밤 과육, 껍질 및 밤나무 잎 추출물에 대한 항산화 및 항염증 활성 비교
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The present study was carried out to evaluate the antioxidant and anti-inflammatory activities of three extracts (hot water, 50% ethanol and mixed solvent;water, ethanol, butylene glycol, propylene glycol) of dried chestnut, chestnut shell, chestnut leaves and dried chestnut leaves obtained from Castanea crenata tree. When conducted DPPH assay, radical scavenging activity of ethanol extract of chestnut shell was the highest with IC50 10.8 ㎍/mL among four extracts from these parts (p < 0.05). In additional results by the xanthine oxidase assay, antioxidant activity showed that water extract of chestnut leaves showed the highest xanthine oxidase inhibitory activity in the tested extracts (p < 0.05). Futhermore, extracts of chestnut shell and leaves exhibited no cytotoxicity in RAW 264.7 cells (p < 0.05). Also, anti-inflammatory activity by NO assay showed LPS-induced NO was significantly inhibited following treatment with extracts of chestnut shell and leaves of 3㎎/mL (p < 0.05). These data suggest that extract of chestnut shell have antioxidant and anti-inflamantory activity including chestnut leaves. Therefore, it is considered that Castanea crenata research range and selection of functional material can broaden chestnut shell to other fractions such as chestnut and chestnut leaves.
Keywords:
Antioxidant, Anti-Inflammatory, Castanea crenata, Xanthine Oxidase, Nitric Oxide서 언
밤나무는 참나무과 (Fagaceae) 낙엽교목으로 아시아, 유럽, 북아메리카, 북부아프리카 등지의 온대지역에 13종이 있으며, 그 중 과실생산을 위해 일본밤/한국밤 (Castanea crenata) 등 이 국내에서 재배되고 있다. 국내 밤 생산량은 1980년 4만톤, 1990년 8만톤, 1997년에는 12만톤으로 증가하다가 밤나무 재 배면적의 감소, 밤나무림의 노령화, 수확인력 부족 등으로 2002년에 6만톤으로 감소한 이후, 현재 생산량은 소폭 상승중 이다 (Kim et al., 2007).
밤의 이화학적 성분은 수분 65.3%, 조단백질 6.6%, 조지방 0.9%, 조섬유 2.3%, 조회분 1.7% 내로 구성되어 있으며 (Nha and Yang, 1996), 그 외 성분으로, 밤의 과육 부분 에서 ferulic acid과 caffeic acid, sinapic acid, p-coumaric aicd, salicylic acid (Yoon, 1991), 밤의 내피 부분에서 11.0 ~ 12.3%의 축합형 탄닌이 보고되어 있다 (Cho, 1993).
밤은 영양이 풍부하여 예로부터 대량식량 및 기호식품으로 널리 이용되고 있으며, 현재 소비 형태는 생과용이 55%, 가공 용이 45% 정도 차지한다. 그러나 깐밤이나 밤 통조림으로 가 공시 발생하는 대부분의 밤 껍질 (율피)은 특별한 활용없이 대 부분 폐기되고 있는 실정이다. 최근 자원순환의 일환으로 부 산물 활용에 관심이 높아지면서, 밤의 주요 부산물인 율피에 관하여 물리적 또는 화학적 접근을 통한 소재연구가 활발히 진행 중에 있다. 기능성 소재 연구에 따르면, 율피는 흡착능을 이용하여 폐수의 중금속 생물흡착제 소재로 사용이 가능하며 (Lee et al., 2012), 미백 활성 및 주름개선 효과를 이용한 화 장품 소재로의 활용도 가능하다고 보고된 바 있다 (Jang et al., 2011). 또한, 밤나무에 관한 약리활성연구로, 율과 율피의 추출물의 항균 효과 (Cha et al., 1998), 항산화 활성 (Rim et al., 2000; Kwon et al., 2001), 항혈전 효과 (Yook et al., 2002), 피부 노화 방지 (Yagi et al., 1986) 등이 보고되 고 있다.
그러나 대부분의 연구가 기능성 연구 전 선행되어야 할 기 초 연구가 미흡하고, 기초연구는 대부분 항산화 활성에 초점 이 맞춰진 형태이다. 또한 일부 제한된 부위에 대해서만 연구 가 보고되어 있어, 밤나무의 다양한 부위 중 적합한 기능성 소재를 선택하기 위한 비교분석이 필요하다. 따라서 본 연구 에서는 부산물을 포함한 건조 과육 (건율), 율피, 율엽, 건조 율엽 (건율엽)과 3 종류의 추출용매를 이용한 추출물간의 항 산화 및 항염증 활성을 비교하였다. 추가적으로 소재의 활용 을 위하여 추출물의 세포 독성효과를 확인하였다.
재료 및 방법
1. 실험재료 및 추출
본 연구에서 사용한 건율과 율피, 율엽, 건율엽은 보민영농 조합법인 (영천)에서 제공받아서 시험에 이용하였다. 각각 3가 지의 방법으로 추출하였으며, 재료와 용매의 비율은 Table 1 과 같다. 추출 방법은 물과 50% 에탄올을 추출용매로 사용하 여 100°C에서 2시간동안 추출하였다. 그리고 혼합용매로 물 :에탄올 :부틸렌글리콜 :프로필렌글리콜 (4 : 4 : 1 : 1)을 water bath (Shaking Water Bath MSB-1511D, MonoTech Eng Co., Daegu, Korea)에서 70°C의 물로 중탕하여 8시간 추출하였다. 여과지 (whatman No.2)를 사용하여 추출물을 여 과한 후 회전진공농축기 (Rotavapor R-114, BUCHI, Flawil, Switzerland)로 농축하였다. 그 후, 농축된 샘플을 1.7 mL Etube에 500 µL씩 나눠담고 원심진공농축기 (Cold Vac 50/ Modulspin 31, Bucheon, Korea)로 완전 농축을 하였다. 농축 된 시료의 무게를 잰 후, 실험에 사용할 5가지 농도 (30, 100, 300, 1000, 3000㎍/mL)를 각 실험에 맞는 용매로 희석 하여 준비하였다. 혼합용매추출물의 경우, 완전 건조가 어려웠 으므로 1시간 농축 후, 이를 100%로 하여 0.03, 0.1, 0.3, 1, 3%로 설정하여 시험에 이용하였다.
2. DPPH radical 소거능 측정
건율과 율피, 율엽, 건율엽추출물의 DPPH radica 소거능을 측정하였다. 4가지 부위의 각각 3가지 추출용매 10 µL을 DPPH (2,2-Diphenyl-1-picrylhydrazyl, 100 µM)의 200 µL를 더하여 96 well plate에 첨가 후 37°C에서 30분 동안 배 양하였다. 흡광도 측정은 VERSA max microplate reader (Molecular Devices Corp., Sunnyvale, CA, USA)를 사용하 여 517㎚에서 측정하였다. 시료의 DPPH radical 소거능 평 가는 아래와 같이 계산하였다.
DPPH radical 소거능 (%) = [(Ab-Aa)/Ab] × 100
Ab: 무처리구의 흡광도
Aa: 시료첨가구의 흡광도
3. Xanthine Oxidase 활성 저해능 평가
건율과 율피, 율엽, 건율엽 추출물의 항산화 효과를 측정하 기 위해 xanthine oxidase 저해 활성을 측정하였으며, Saghal (2009)와 Lee 등 (2009)의 방법을 변형하여 실시하였다. 큐벳에 10 mM의 PBS 1,760 µL와 0.175㎎/mL로 녹인 xanthine (Sigma, St Louis, MO, USA) 용액 100 µL를 첨가 하고, 희석한 시료 100 µL와 10 mM PBS에 녹인 0.15 unit/ mL의 xanthine oxidase (Sigma, St Louis, MO, USA) 40 µL를 첨가하여 3분 동안 반응시킨 후 생성된 uric acid 양을 측정하기 위해 spectrophotometer (Kontron Instrument, Zurich, Switzerland)를 이용하여 295㎚에서 흡광도를 측정하 였다. 시료를 첨가하지 않은 대조군은 시료 대신 PBS 100 µL를 첨가하였다. 양성 대조군으로 사용된 ascorbic acid 는 빛의 노출을 최소화 하여 농도 별로 희석하여 사용하였 고, 추출물 처리군과 대조군의 흡광도 감소율은 아래와 같이 계산 하였다.
Inhibition(%) = [Δabsorbance(control)-Δabsorbance(sample)] /Δabsorb ance(control) × 100
4. 세포 독성 평가
건율과 율피, 율엽, 건율엽추출물에 대한 세포독성을 알아보 기 위해 Begona 등 (2002)의 방법을 변형하여 세포독성 시험 을 하였다. 시험에 이용한 마우스 대식세포인 RAW 264.7 세 포주 (KCLB No. 40071)는 한국세포주 은행에서 분양받았다. RAW 세포주는 각각 100 unit/mL-100㎍/mL의 penicillin-streptomycin과 10% fetal bovine serum (FBS; Sigma, St Louis, MO, USA)이 들어있는 Dulbecco’s Modified Eagle’s Medium (DMEM; Sigma, St Louis, MO, USA)을 배지를 사용하여 37°C, 5% CO2 incubator에서 배양하였다. 세포독성 시험시, RAW 세포주를 각 well당 1× 104개가 되도록 180 µL씩 96 well plate에 접종되었고, 배양 전에 농도 별로 희석된 시료를 20 µL씩 접종하였다. 접종 4일 후에 2㎎/mL로 희석된 3-(4,5-dimethylthiazol-2-yl)-2,5 diphenyl-tetrazolium bromide (MTT; Sigma, St Louis, MO, USA)용 액을 각 well당 50 µL씩 접종하여 4시간 동안 배양한 후, 염색된 세포가 떨어지지 않도록 배지를 제거하였다. 그 후 dimetylsulphoxide를 150 µL씩 가하여 formazan crystal을 녹 여 microplate reader (Molecular Devices Corp., Sunnyvale, CA, USA)를 이용하여 540㎚에서 흡광도를 측정하였다.
5. Nitric Oxide (NO) 생성 억제 활성 측정
NO 측정은 cell의 상층액에서 NO의 양을 Griess reaction (Green et al., 1982)에 기초해 측정하였다. RAW 264.7 cell 을 1.5 × 105 cells/mL로 접종하고, 여러 농도로 희석한 시료로 전 처리한 후, 1시간 뒤에 lipopolysaccharide (LPS; Sigma, St Louis, MO, USA) 1 ㎍/mL을 처리하여 24시간 배양 하였다. 96 well plate에 세포 배양 상층액 50 µL와 Griess 시약 1% (w/v) sulfanilamide 50 µL를 첨가한 다음 차광하여 10분 동안 실온에서 반응시킨 후, 2.5% (v/v) phosphoric acid에 녹인 0.1% (w/v) N-1-napthylethylenediamine을 50 µL 혼합하여 10분 동안 차광하여 반응시키고, 30분 이내에 microplate reader (Molecular Device, CA, USA)를 이용하여 540㎚에서 흡광도를 측정하였다. NO의 생성량 산출은 nitric oxide standard solution을 이용하여 계산하였다.
6. 통계처리
모든 측정은 3회 반복으로 얻어진 결과로 평균과 표준편차 로 나타내었으며, SAS package (Statistical Analysis Program, version 9.3)를 사용하여 ANOVA 분석 후에 유의성이 인정되 면 사후검정으로 Duncan’s Multiple Range Test (DMRT)을 실시하고 p < 0.05값인 경우 통계적으로 유의성이 있는 것으로 인정하였다.
결과 및 고찰
농자원 기능성 소재의 다양성 확보차원에서 부산물에서 얻 어지는 소재는 산업적으로 가격 경쟁력 뿐만 아니라 농가에게 부수적인 수입을 보장하는 중요한 가치이다. 따라서, 본 연구 에서는 이러한 점에 착안하여, 부산물로 버려지는 율피과 율 엽의 항산화 및 항염증 소재를 확보하고자 축적된 추출기법을 통해 추출물을 획득하고 일련의 실험을 실시하여 다음과 같은 결과를 도출하였다.
1. DPPH radical 소거능 측정
DPPH radical법은 항산화 활성을 평가하는 방법 중 하 나로, DPPH의 환원정도를 기준으로 측정물질의 환원력과 항 산화력을 측정한다 (Lee, 2003; Wang, 2003). 건율과, 율피, 율엽, 건율엽 등에 대한 용매별 추출물의 항산화 활성을 비교 하기 위하여 DPPH radical에 대한 소거활성을 비교하였으며 양성 대조군으로 항산화 활성이 있는 ascorbic acid를 사용하 였다 (Table 2). 추출용매별 DPPH radical 소거활성은 추출물 농도 의존적으로 증가하였으며 (p < 0.05), 물추출물, 에탄올추 출물, 혼합용매추출물 순으로 나타났다. 물추출물 및 에탄올추 출물 (3㎎/mL)에서 72.3 ~ 97.4%의 소거활성이 나타난 반면, 혼합용매추출물에서는 율피 (82.3%)를 제외하고 전체적으로 낮은 소거활성 (27.7 ~ 67.9%)을 보였다. 물추출물과 에탄올추 출물 기준으로 부위별 DPPH radical 소거 활성을 비교하였을 때, 율피추출물, 건율추출물, 율엽추출물, 건율엽추출물 순 으로 활성이 높았으며, IC50은 각각 10.8 ~ 19.8, 48.7 ~ 52.5, 62.4 ~ 63.4, 180 ~ 183㎍/mL 수준이었다. 특히, 율피추출물의 경우, 양성대조군으로 사용한 ascorbic acid (IC50, 23㎍/mL) 보다 낮은 수준으로 나타나, DPPH radical 소거능 활성 수준 이 더 높은 것으로 확인되었다. Kim 등 (2007)이 보고한 인 삼의 물추출물과 에탄올추출물 (10㎎/mL)의 DPPH radical 소거능 (46%)과 비교했을 때, 부위별 추출물의 DPPH radical 소거활성이 더 높은 것으로 확인되었다. 또한 주류. 음료 등 기능성 식품으로 많이 이용되고 있는 복분자의 미숙과 에탄올 추출물 (IC50, 24.98㎍/mL) (Kwon et al., 2011)과 비교하여 볼 때, 율피의 에탄올추출물의 IC50값은 50% 정도 낮은 수준 으로 나타나 뛰어난 항산화제 소재로 개발할 수 있을 것으로 생각된다.
2. Xanthine Oxidase 활성 저해능 평가
항산화 활성을 측정하기 하기 위해 추가적으로 xanthine oxidase을 활성 저해능을 평가하였다 (Cho et al., 1993). Table 3과 같이, 건율과 율피, 율엽, 건율엽추출물은 농도의존 적으로 xanthine oxidase 활성을 억제하였으며 DPPH radical 소거능 결과와 유사한 경향을 보였다 (p < 0.05). 물추 출물과 에탄올추출물 기준으로 부위별 xanthine oxidase 억제 활성을 비교하였을 때, 율피추출물, 율엽추출물에서 억제활 성이 높았으며, IC50 값은 각각 590과 492, 339와 855 ㎍/ mL 수준이었다. 특히, 율엽의 물추출물의 경우, 양성대조군으 로 사용한 ascorbic acid (IC50, 236㎍/mL)과 유사한 수준으 로 나타났으며, 이는 구실잣밤나무잎 (Castanopsis cuspidata) 의 물추출물과 에탄올추출물의 IC50값이 1000㎍/mL이상, 371.31㎍/mL인 것과 비교시, 각각 유사하거나 더 높은 억제 수준이었다 (Kim et al., 2011). xanthine oxidase가 산화적 스트레스를 유발하는 키 효소임을 감안한다면, 율피추출물 뿐 만 아니라 율엽추출물 또한 뛰어난 항산화 소재로 이용이 가 능할 것으로 판단된다.
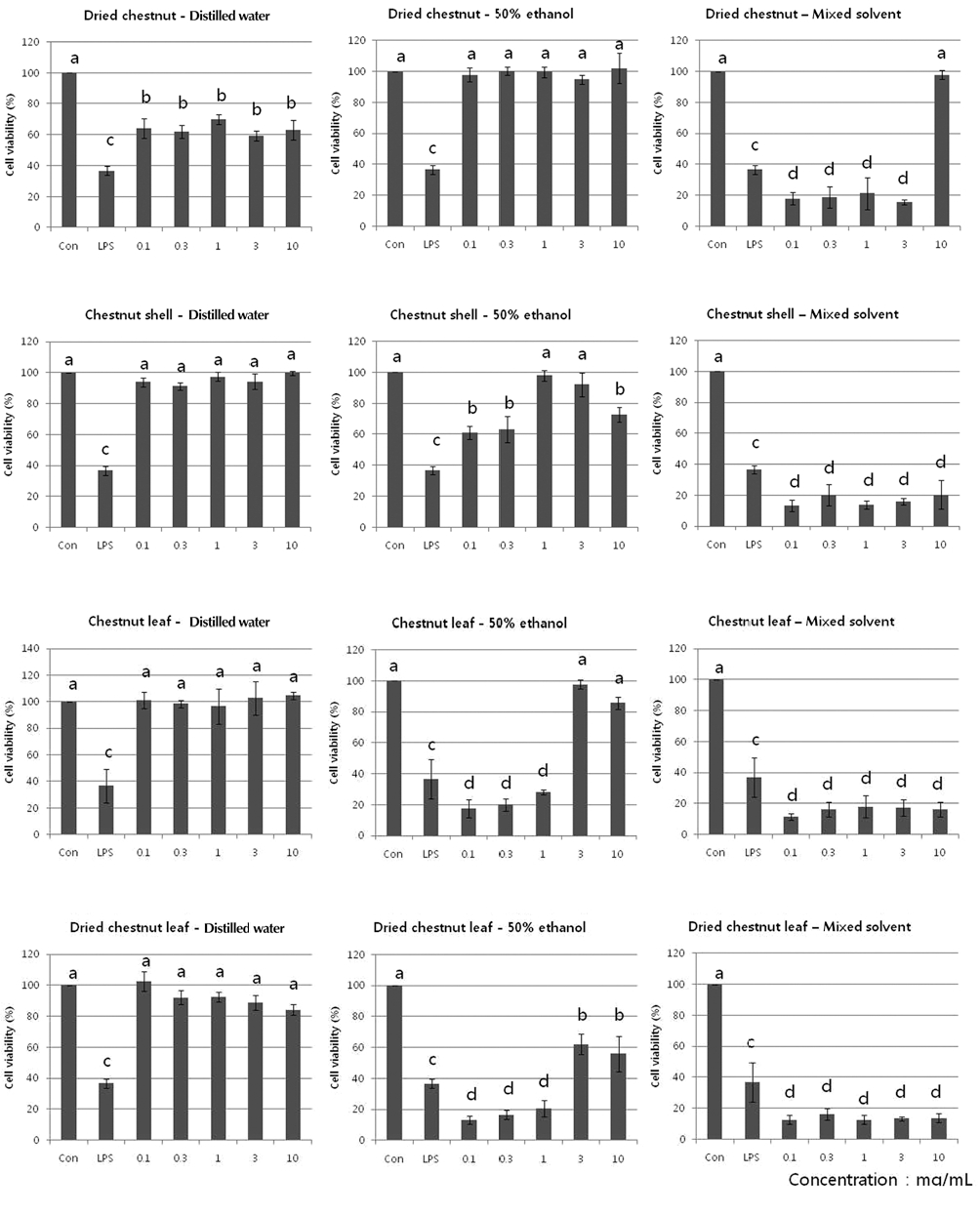
3. 세포 독성 평가
건율과 율피, 율엽, 건율엽추출물의 정상세포 보호 및 독성 의 정도를 확인하기 위해 murine macropharge인 RAW 264.7 세포주 모델을 이용하여 세포의 생존율을 측정하였다 (Fig. 1). 건율과 율피, 율엽, 건율엽의 물추출물 투여군은 세포 독성이 있는 LPS 투여군 (양성대조군)에 비해 세포생존율이 유의적으로 증가하였으며, 건율을 제외한 나머지 물추출물 0.1 ~ 10㎎/mL의 농도 투여시 무처리군 (음성대조군)의 세포 생존율과 동일하게 나타났다 (p < 0.05). 또한, 건율의 에탄올 추출물에서도 동일한 결과를 확인하였으나, 율엽과 율피의 에 탄올추출물의 경우 각각 1 ~ 3, 3 ~ 10㎎/mL 농도에서만 세포 생존율이 90% 이상으로 나타났다. 반면, 혼합용매추출물은 다 른 용매의 추출물과 비교했을 때, 낮은 세포 생존율을 보였으 며 이는 혼합용매추출물 내 부틸렌글리콜과 프로필렌글리콜 자체에 의한 세포독성 효과로 판단된다.
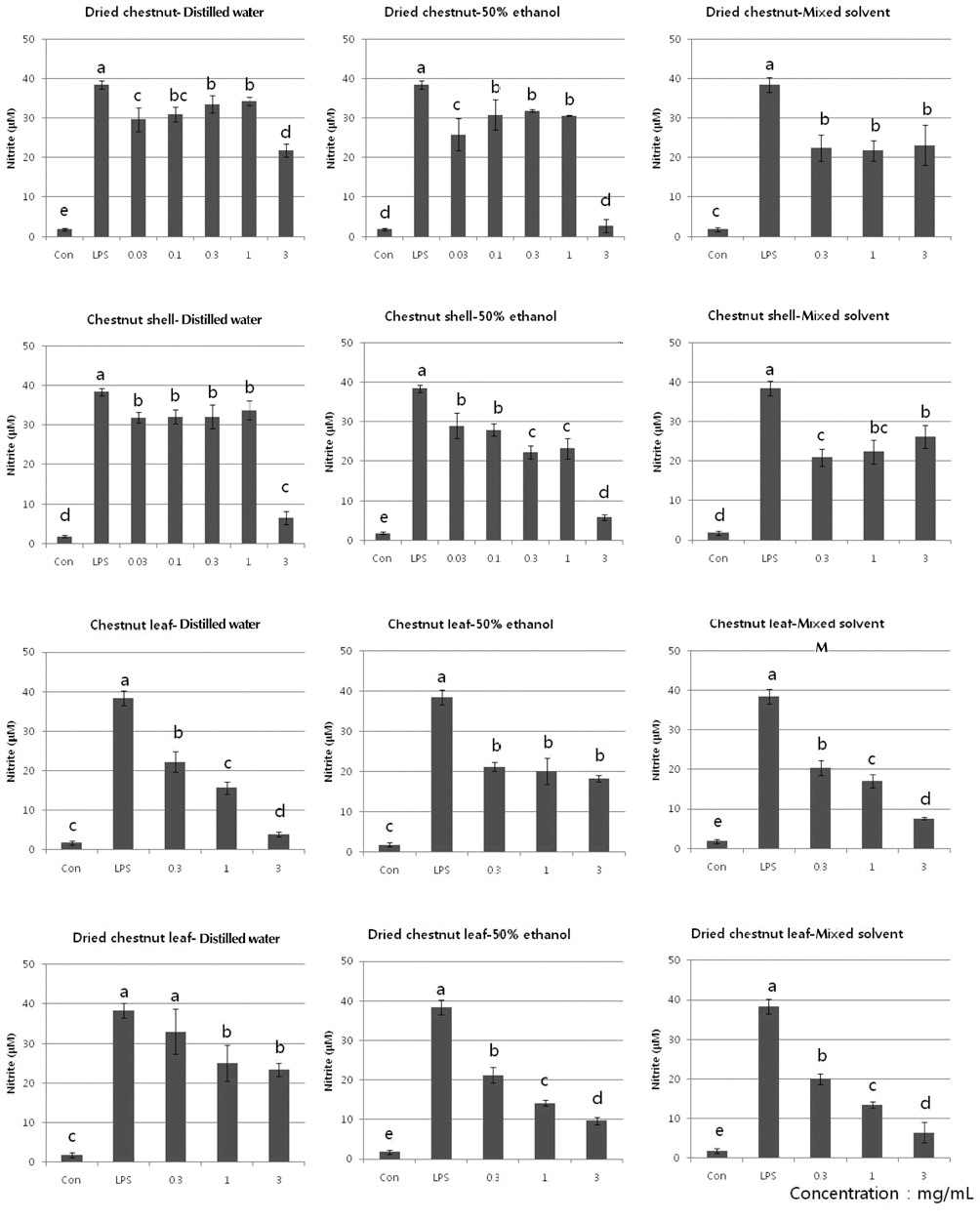
4. Nitric Oxide (NO) 생성 억제 활성 측정
NO는 혈액 응고, 혈압조절 및 암세포 억제 등의 기능이 있 으나, 과량 존재하게 되면 인체에 유해한 영향을 미치게 되어 세포의 손상뿐 아니라 염증을 야기하기도 한다 (Lowenstein et al., 1994; Bak et al., 2011). 본 연구에서 항염증 활성능 을 비교하기 위하여 NO 유도물질인 LPS 처리 후 건율, 율피 그리고 율엽추출물을 농도별 (0.03 ~ 3㎎/mL)로 처리하여 LPS에 의한 NO 생성 억제량을 측정하였다 (Fig. 2). 모든 부 위에서 얻어진 각각의 모든 추출물은 LPS에 의한 NO 생성을 유의수준으로 억제하였다 (p < 0.05). 물추출물에서 건율과 율 피는 최고 농도 (3㎎/mL)에서 43, 83%로 높은 수준으로 나 타난 것에 비해, 율엽의 경우, 농도의존적 감소가 뚜렷하였고 3 ㎎/mL에서 89%의 높은 억제를 나타내었다. 에탄올추출물 최고농도에서 건율이 92%으로 억제 수준이 가장 높았으며, 율 피가 83%, 율엽과 건율엽은 44 ~ 74%로 비교적 높은 억제수 준을 나타냈다. 반면, 혼합추출물에서도 NO 억제 수준이 평균 50%으로 비교적 높은 수준으로 관찰되었는데, 이는 각 부위 별 추출물의 고유활성 작용에 의한 것보다 세포독성에 의한 위양성 효과로 판단된다. 추출물은 추출용매와 추출물의 농도 에 따라 항산화, 항염증 특성이 다양하게 나타난다 (Kim et al., 2010; Yoon et al., 2010). 본 연구를 통해, 율피의 물추 출물과 에탄올추출물 및 율엽의 물추출물에서 항산화, 항염증 의 활성이 높은 것으로 확인되었다. 이는 기존에 율피를 이용 한 생리 활성 연구결과와 일치하며 (Rim et al., 2000; Kwon et al., 2001), 더욱이 건율 및 율엽추출물 또한 항산화 및 항염증 활성을 연구한 것으로 기존에 율피에만 집중되어 있던 기능성 연구의 범위를 넘어서 건율 및 페기 부산물인 율 엽까지 확장이 가능할 것으로 생각된다. 또한, 밤나무의 부위 별 및 추출용매별로 다양한 수준의 활성이 나타나고 있으므로 기능성 소재개발을 위한 적절한 부위 및 추출용매선택, 최적 용량 설정시 추가 응용이 가능할 것으로 사료된다.
결론적으로 본 연구에서는 기능성 소재를 확보하고자 건율 과 율피, 율엽, 건율엽의 용매별 (물, 50% 에탄올, 혼합용매) 추출물에 대한 생리활성 시험을 실시한 결과, 항산화 및 항염 증 활성을 확인하였다. 이중, 율피와 율엽 물추출물은 세포독 성이 낮고 항산화 활성과 NO 생성 억제 활성이 높은 수준으 로 확인되어 기능성 소재 후보로 이용이 가능하며, 향후 추가 적인 연구를 통해 항산화 및 항염증 영역에서 산업적 응용이 가능할 것으로 사료된다.
감사의 글
본 논문은 중소기업청 창업성장 기술개발사업(과제번호: S2013155) 및 농촌진흥청 차세대바이오그린21사업(과제번 호: PJPJ009007)의 지원에 의해 이루어진 결과로 이에 감 사드립니다.
REFERENCES
- Bak, JP, Son, JH, Kim, YM, Jung, JH, Leem, KH, Lee, EY, Kim, EH, Suppression of the inflammatory response in macrophages by Paeoniae Radix Rubra, Korean Journal of Medicinal Crop Science, (2011), 19, p373-379.
-
Begona, CA, Laszlo, GB, Silvia, M, Joan, B, Carles, CM, Josep, JC, Josep, LT, Neus, A, Sara, B, Marta, C, Fermented wheat germ extract inhibits glycolysis/pentose cycle enzymes and induces apoptosis through poly(ADP-ribose) polymerase activation in Jurkat T cell leukemia tumor cells, Journal of Biological Chemistry, (2002), 277, p46408-46414.
[https://doi.org/10.1074/jbc.m206150200]

- Cha, BC, Lee, HW, Choi, MY, Antioxidative and antimicrobial effect of nut species, Korean Journal of Phamacognosy, (1998), 29, p28-34.
- Cho, YJ, Chun, SS, Choi, C, Inhibitory effect of condensed tannins isolated from Korean green tea against xanthine oxidase, Journal of the Korean Society of Food Science and Nutrition, (1993), 22, p418-422.
- Denizot, F, Rita, L, Rapid colorimetric assay for cell growth and survival: Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability, Journal of Immunological Methods, (1986), 89, p271-277.
-
Green, LC, Wagner, DA, Glogowski, J, Skipper, PL, Wishnok, JS, Tannenbaum, SR, Analysis of nitrate, nitrite, and [15N]nitrate in biological fluids, Analytical Biochemistry, (1982), 126, p131-138.
[https://doi.org/10.1016/0003-2697(82)90118-x]

-
Jang, MJ, Cheon, SJ, Kim, HY, Kwoen, DJ, Kim, HY, Kim, SH, Lee, JT, The anti-wrinkle and whitening effect of extracts ofCastanea crenatainner shell, Journal of Life Science, (2011), 21, p734-738.
[https://doi.org/10.5352/jls.2011.21.5.734]

- Kim, JS, Joo, RW, Kim, CS, Choi, SI, Kim, KD, Kang, HM, Choi, JW, Lee, SY, Ji, DH, Kim, SS, Oh, CJ, Oh, DS, Kim, DO, Park, JH, Income analysis of chestnut and pyogo 2006, Korea Forest Research Institute. Seoul. Korea, (2007), p14.
- Kim, JY, Yoon, WJ, Yim, EY, Park, SY, Kim, YJ, Song, GP, Antioxidative and antimicrobial activities ofCastanopsis cuspidatavar.sieboldiiextracts, Korean Journal of Plant Resources, (2011), 24, p200-207.
- Kim, MO, Kim, JS, Sa, YJ, Jeong, HJ, Chun, WJ, Kwon, YS, Kim, TY, Choi, HS, Yu, CY, Kim, MJ, Screening extraction solvent condition of fermentedRhus vernicifluastem bark by antioxidant activities, Korean Journal of Medicinal Crop Science, (2010), 18, p217-223.
-
Kim, YC, Cho, CW, Rhee, YK, Yoo, KM, Rho, JH, Antioxidant activity of ginseng extracts prepared by enzyme and heat treatment, Journal of the Korean Society of Food Science and Nutrition, (2007), 36, p1482-1485.
[https://doi.org/10.3746/jkfn.2007.36.11.1482]

- Kwon, EJ, Kim, YC, Kwon, MS, Kim, CS, Kang, WW, Lee, JB, Chung, SK, Antioxidative activity of solvent fraction and isolation of antioxidative compound from chestnut husk, Journal of the Korean Society of Food Science and Nutrition, (2001), 30, p726-731.
-
Kwon, JW, Lee, HK, Park, HJ, Kwon, TO, Choi, HR, Song, JY, Screening of biological activities to different ethanol extracts ofRubus coreanusMiq, Korean Journal of Medicinal Crop Science, (2011), 19, p325-333.
[https://doi.org/10.7783/kjmcs.2011.19.5.325]

- Nha, YA, Yang, CH, Changes of constituent components in chestnut during storage, Korean Journal of Food Science and Technology, (1996), 28, p1164-1170.
- Lee, HJ, DPPH radical scavenging effect and in vitro lipid peroxidation inhibition byPortulaca oleracea, Korean Journal of Biotechnology and Bioengineering, (2003), 18, p165-169.
- Lee, HY, Lim, JE, Lee, SS, O, YS, Lead bioabsorption by chestnut shell and oak sawdust in aqueous solution using thermodynamic equilibrium model, Journal of the Environment, (2012), 9, p15-26.
- Lee, YS, Ahn, DS, Joo, EY, Kim, NW, Antioxidative activities ofSyneilesis palmataextracts, Journal of the Korean Society of Food Science and Nutrition, (2009), 38, p1471-1477.
- Lowenstrein, CJ, Dinerman, JL, Snyder, SH, Nitric oxide: A physiologic messenger, Annals of Internal Medicine, (1994), 120, p227-237.
- Rhim, TJ, Lim, SC, The hepatotprotective and antioxidative effects of onion(Allium cepa) extracts in rat hepatocyte primary culture, Korean Journal of Plant Resources, (2005), 18, p52-60.
- Rim, YS, Park, YM, Park, MS, Kim, KY, Kim, MJ, Choi, YH, Screening of antioxidants and antimicrobial activity in native plants, Korean Journal of Medicinal Crop Science, (2000), 8, p342-350.
-
Saghal, G, Ramanathan, S, Sasidharan, S, Mordi, MN, Ismail, S, Mansor, SM, In vitro antioxidant and xanthine oxidase inhibitory activities of methanolicSwietenia mahagoniseed extracts, Molecules, (2009), 14, p4476-4485.
[https://doi.org/10.3390/molecules14114476]

-
Wang, LF, A theoretical investigation on DPPH radical- Scavenging mechanism of edaravone, Bioorganic & Medicinal Chemistry Letters, (2003), 13, p3789-3792.
[https://doi.org/10.1016/j.bmcl.2003.07.016]

- Yagi, A, Kanbara, T, Morinobu, N, The effect of tyrosinase inhibition for Aloe, Planta Medica, (1986), 3981, p517-519.
- Yook, GJ, Lee, HJ, Kim, MK, Effect of chestnut and acone on lipid metabolism, antioxidative capacity and antithrombotic capacity in rats, Korean Journal of Nutrition, (2002), 35, p171-182.
- Yoon, KY, Polyphenol compounds and biochemical characteristics of polyphenol oxidase in chinese chestnut, Kyungpook National University Graduate School, (1991), 9, p51-59.
- Yoon, TS, Cheon, MS, Kim, SJ, Lee, AY, Moon, BC, Chun, JM, Choo, BK, Kim, HK, Evalutaion of solvent extraction on the anti-inflammatory efficacy ofGlycyrrhiza uralensis, Korean Journal of Medicinal Crop Science, (2010), 18, p28-33.