LPS로 유도한 RAW 264.7 세포의 염증반응에서 뚝새풀 에탄올 추출물의 억제 효과
†Corresponding Author : (Phone) +82-61-860-2810 (E-mail) johw7@naver.com
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
In the present study, we investigated the anti-inflammatory effects by Alopecurus aequalis Sobol on the lipopolysaccharide (LPS)-induced nitric oxide (NO) production by RAW 264.7 cell line. Consistent with these observations, DS reduced the LPS-induced expression of inducible nitric oxide synthase (iNOS) and cyclooxygenase-2 (COX-2) at the protein levels in a concentration-dependent manner. In addition, the release of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) were also reduced by DS. Moreover, LPS increased expression phosphorylation of IκBα, but DS showed inhibitory effect by reducing LPS-inducible p-IκBα expression level. These results suggest that the down regulation of iNOS, COX-2, TNF-α, and IL-6 expression by DS are achieved by the downregulation of NF-κB activity, a transcription factor necessary for pro-inflammatory mediators, and that is also responsible for its anti-inflammatory effects.
Keywords:
Alopecurus aequalis Sobol, Inflammation, RAW 264.7 Cell Line, Lipopolysaccharide서 언
뚝새풀은 벼과 (Gramineae)에 속하는 일년생 또는 이년생 초본으로 우리나라 전 지역 습지, 논경지에서 흔히 볼 수 있 다. 일반적으로 가을에 추수후 발아하여 지표면에서 유묘 상 태로 월동하며 초여름에 성숙한다 (Hong et al., 1996). 뚝새 풀은 번식력이 왕성하여 봄에 경운 및 써레질로 개체가 절단 되어도 지상의 마디로부터 싹이나 뿌리가 재생하는 잡초이다. 1970년도부터 1990년대까지 쌀 생산량 증대를 위한 뚝새풀 방 제연구가 주로 수행되었으며 (Choi and Lee, 1976; Hong et al., 1996), 2000년대 초반부터 현재까지 뚝새풀의 뛰어난 번 식력과 발생밀도를 활용한 피복자원의 이용연구가 시도되고 있다 (Lee and Lee, 2006; Seong and Park, 2012).
뚝새풀은 둑새풀, 독새풀, 혹은 독쌔기풀이란 이명을 가지고 있으며 한방에서 뚝새풀의 전초를 간맥랑 (看麥娘)이라 한다. 효능은 전신부종과 어린아이의 수두와 복통, 설사에 효능이 있 다고 알려져 있다 (SATC, 1999). 따라서 본 연구는 동절기 우점잡초인 뚝새풀의 신소득 작물화 및 자원의 산업화를 위하 여 항염증 조사를 수행하였다.
염증 반응은 외부 자극에 대한 생체조직의 방어반응의 하나 로서 물리적 작용이나 유해물질, 화학적 자극, 세균감염 등에 의한 손상을 수복 재생하려는 기전이며, 지속적인 염증반응은 오히려 점막손상을 촉진하고, 그 결과 일부에서는 암 발생 등 각종 질환을 유도한다 (Cho et al., 2009; Willoughby, 1975).
그람 음성균의 외막성분인 lipopolysaccharide (LPS)는 국 소 염증, 항체 생산, 폐혈증과 같은 다양한 반응을 일으킨다 (Takeda et al., 2003). 대식세포는 LPS 감염초기에 반응하고 숙주의 방어와 항상성 유지에 중추적인 역할을 한다. 그러나 고농도의 LPS 자극은 대식세포에서 tumor necrosis factor-α (TNF-α), interleukin (IL)-1β 및 IL-6, nitric oxide (NO)와 같은 전 염증성 매개물질을 분비시켜 숙주에 치명적인 결과를 초래할 수 있다 (McDaniel et al., 1996; Kim et al., 2009; Willeaume et al., 1996). 일반적으로 NO는 대식세포가 활성 화되면 inducible NO synthase (iNOS)로부터 생산되며 몇몇 바이러스나 기생충을 억제하는 항균 효과를 가지고 있지만 (Moncada and Higgs, 1991) 과도한 NO의 형성은 염증을 유발시키게 되며 조직의 손상, 유전자 변이 및 신경 손상 등을 유발하는 것으로 알려져 있다 (Kim et al., 2012; McCartney-Francis et al., 1993).
TNF-α, IL-1β 및 IL-6와 같은 전염증성 cytokine의 발 현은 extracellular signal-regulated kinase1/2 (ERK1/2), p38 kinases (p38), c-Jun NH2-terminal kinase (JNK)와 같은 mitogen-activated protein kinases (MARKs)와 nuclear factor kappa B (NF-κB)에 의해 조절 된다 (Feng et al., 1999). NF-κB는 면역과 염증 반응에 관계된 유전자의 발현에 중요한 역할을 한다 (Anest et al., 2003). NF-κB가 활성화되면 NF- κB와 결합해 있던 inhibitory kappa B α (IκBα)가 분해되면 서 NF-κB가 세포 원형질에서 핵으로 들어가게 되며 이후 TNF-α, IL-12, IL-6와 같은 cytokine 발현의 전사 인자로서 작용한다 (Athman and Rhilpott, 2004; Beinke and Ley, 2004).
이에 본 연구는 뚝새풀 추출물이 대식세포주인 RAW 264.7 cell에서 LPS로 유도된 염증반응을 억제할 수 있는지의 여부 를 확인하기 위하여 NO 및 iNOS, COX-2, 전 염증성 cytokine (TNF-α, IL-6)의 발현정도와 IκBα의 분해 억제효과 를 조사하였다.
재료 및 방법
1. 시 약
Dulbecco’s modified eagle’s medium (DMEM)과 fetal bovine serum (FBS), penicillin, streptomycin은 Gibco/BRL (Eggenstein, Germany)에서 구입하였고, 3-(4,5-dimethylthiazol- 2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2Htetrazolium (MTS, CellTiter 96®AQueous One Solution Cell Proliferation Assay), Griess reagent system은 Promega (Madison, USA)에서 구입하였다. Lipopolysaccaride (LPS), dimethyl sulfoxide (DMSO)는 Sigma Chemical Co. (St. Lousi, MO, USA)에서 구입하였고, TNF-α, IL-6의 enzymelinked immunosorbent assay (ELISA) Kit는 R&D systems (DuoSet ELISA Development Systems, MN, USA)에서 구 입하였다. iNOS, COX-2, IκBα, p-IκBα, β-actin antibodies는 Cell Signaling Technology Inc. (MA, USA)에서 구입하였다.
2. 추출물 제조 및 세포 배양
뚝새풀은 전남 강진군 강진읍 (2013년 4월 17일)에서 직접 채취하였다. 음건한 뚝새풀 100 g을 100% 에탄올 (ethanol, w/v) 5 L를 투입하여 3 시간, 두 번 추출한 후, 250 mesh와 whatman 여과지로 여과하였다. 여과액을 45°C에서 감압농축 하여 에탄올을 증발시키고 동결건조 (Ilshin, Korea)하여 6 g의 뚝새풀 시료를 (6% 수율) 얻었다. 한국세포주은행 (KCLB, Seoul, Korea)으로부터 분양받은 마우스 대식세포주인 RAW 264.7 cell은 Penicillin/streptomycin 100 unit/ml과 10% FBS가 함유된 DMEM 배지를 사용하여 37°C, 5% CO2 incubator에서 배양하였다.
3. MTS 분석
뚝새풀 추출물의 RAW 264.7 cell에 대한 세포 독성 효과 를 측정하기 위해 MTS assay를 실시하였다. 96 well plate에 3 × 105 cells/ml로 분주하였고 DMEM FBS 10% 조건에서 뚝 새풀 추출물을 농도별로 24시간 처리하였다. 그 후에 각각 세포 배양액 용량의 1/10 배의 MTS 용해액을 첨가한 후 37°C에서 2 시간 배양한 후 ELISA microplate reader (Infinite 200 pro, TECAN, Austria)를 이용하여 490㎚에서 흡광도를 측정하였다.
4. Nitric Oxide (NO) 농도 측정
LPS로 활성화된 RAW 264.7 cell에서 뚝새풀 추출물의 NO 생성 억제를 측정하기 위해 뚝새풀 추출물을 50, 100, 200µg/ml 농도로 처리한 실험군과 대조군을 24시간 세포 배 양 후 Griess reagent system (G2930, Promega, USA)를 이 용하여 측정하였다. 96 well plate에 세포 배양 상등액과 Griess reagent를 1 : 1로 혼합하여 넣고 10분 동안 반응 시킨 후 ELISA microplate reader (Infinite 200 pro, TECAN, Austria)를 이용하여 540㎚에서 흡광도를 측정하였다.
5. Immunoblot 분석
뚝새풀 추출물의 항염증 효과를 확인하기 위해 Western blot을 이용하여 iNOS와 COX-2, IκBα, p-IκBα 단백질의 발 현 정도를 분석하였다. 뚝새풀 추출물을 농도별로 처리한 실험군과 대조군을 24시간 배양 후 62.5 mM Tris-HCl (pH 6.8), 2% SDS, 5% β-mercaptoethanol, 2 mM phenyl-methylsulfonyl fluoride, protease inhibitors (completeTM, Roche, Manngeim, Germany), 1 mM Na3VO4, 50 mM NaF 과 10 mM EDTA을 함유하는 완충제를 사용하여 세포를 용해 시켰다. 세포 용해액을 15,000 × g로 4°C에서 30 분간 원심 분리하여 단백질만 포함하고 있는 상층액만을 얻었다. 정량 한 단백질 20µg을 10% SDS-PAGE에 전기 영동시킨 후 PVDF (polyvinylidene difluoride) membrane (BIO-RAD, Richmond, CA, USA)으로 옮겼다. 그리고 membrane의 blocking은 5% bovine serum albumin (BSA)이 함유된 TTBS (0.1% Tween 20 + TBS) 용액을 상온에서 2시간 동안 실시한 다음 iNOS, COX-2, IκBα, p-IκBα, β-actin에 대한 1차 항체와 반응시킨 후 2차 항체인 horseradish peroxidaseconjugated anti-rabbit or anti-mouse IgG를 반응시키고 ECL detection reagents (Millipore, MA, USA)를 사용하여 단백질 의 발현정도를 확인하였다.
6. Cytokine (TNF-α, IL-6) 측정
LPS (500 ng/ml)로 RAW 264.7 cell을 자극하기 전 뚝새 풀 추출물을 30분 동안 전처리 하였다. Pro-inflammatory cytokine의 염증매개물질의 생성에 미치는 약물의 효과를 검증 하기 위해서 LPS로 자극한 후 24 시간 뒤 이들 염증매개와 관련된 cytokine을 세포 상층액에서 ELISA kit의 protocol 대 로 ELISA법으로 정량하였다.
7. 통계처리
본 실험에서 얻은 결과에 대해서는 평균치 ±표준편차 (mean ± S.D.)로 나타내었으며, 대조군과 각 실험군과의 평균 의 차이는 Student’s t-test로 분석하여 p-value 값이 0.05 미 만일 때 통계적으로 유의한 차이가 있는 것으로 판정하였다.
결 과
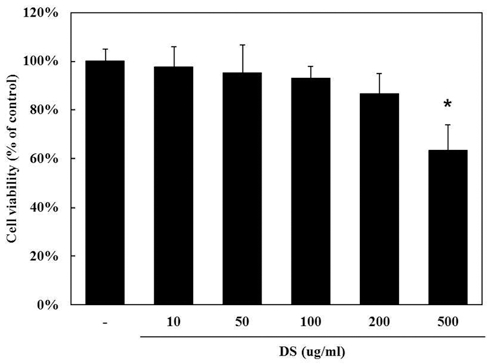
1. 뚝새풀 추출물 (DS)이 RAW 264.7의 세포생존율에 미치 는 영향
DS의 세포독성에 대해 알아보기 위해 MTS 분석법을 이용 하여 세포생존율을 측정하였다 (control군 100.0 ± 4.84%, 10µg/ml DS군 97.7 ± 8.33%, 50µg/ml DS군 95.1 ± 11.73%, 100µg/ml DS군 93.0 ± 4.84%, 200µg/ml DS군 86.6 ± 8.67%, 500µg/ml DS군 63.2 ± 10.68%). DS를 10, 50, 100, 200, 500µg/ml의 농도로 처리하였을 때 500µg/ml 농도에서 세포 독성이 관찰되었다 (Fig. 1).
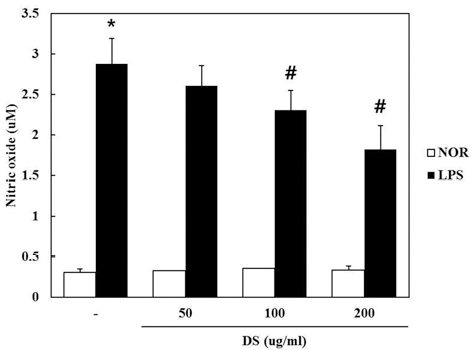
2. 뚝새풀 추출물 (DS)이 RAW 264.7에서 LPS로 유도된 NO 생성에 미치는 영향
DS가 NO 생성에 미치는 영향을 조사하기 위하여 DS를 50, 100, 200µg/ml의 농도로 세포에 처리하여 생성되는 NO 양을 측정하였다. DS를 전 처리하고 LPS로 자극하여 24 시 간 후에 세포 상층액에서 NO의 생성을 측정한 결과 LPS 만 처리한 군에서는 LPS 자극없이 DS 단독 처리군과 비 교하여 NO의 생성량이 현저하게 증가하였으며 (control군 0.31 ± 0.043 uM, 50µg/ml DS군 0.33 uM, 100µg/ml DS군 0.36 ± 0.012 uM, 200 µg/ml DS군 0.34 ± 0.051 uM, LPS 군 2.88 ± 0.311 uM, LPS + 50µg/ml DS군 2.61 ± 0.248 uM, LPS + 100µg/ml DS군 2.31 ± 0.244 uM, LPS + 200µg/ml DS 군 1.82 ± 0.294 uM), DS를 100, 200µg/ml 농도로 전처리하 고 LPS를 처리한 실험군에서는 농도 의존적으로 유의성 있게 NO의 생성을 억제하였다 (Fig. 2).
3. 뚝새풀 추출물 (DS)이 RAW 264.7에서 LPS로 유도된 iNOS 발현에 미치는 영향
NO 생성 억제기작에 관한 iNOS 단백질의 관련성을 조사하 기 위하여 immunoblot 분석을 이용하여 세포질 내에서의 iNOS 단백질 발현량을 조사하였다. LPS 처리시에는 iNOS 단 백질이 발현이 강하게 유도되었으나, LPS에 DS 50µg/ml 이 상 처리한 실험군에서는 LPS에 의한 iNOS의 발현량이 농도 의존적으로 현저히 감소되는 것을 관찰할 수 있었다 (Fig. 3).
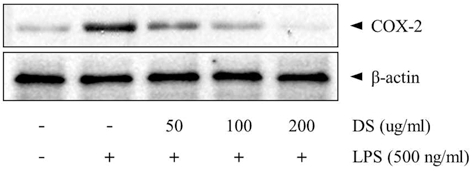
4. 뚝새풀 추출물 (DS)이 RAW 264.7에서 LPS로 유도된 COX-2 발현에 미치는 영향
Pro-oxidant나 pro-inflammatory stimuli에 의해 MEKK-1, NF-κB의 활성화를 경유하여 생성되는 COX-2는 prostaglandin 합성을 증가시켜 염증반응에 있어서 중추적 역할을 한다(Kranzhofer et al., 1999). 본 실험에서 LPS 처리시에는 COX-2 발현량이 강하게 유도되었으나, 50, 100, 200µg/ml DS 전처리로 LPS에 의한 COX-2 발현량이 농도 의존적으로 현저히 감소하였다 (Fig. 4).
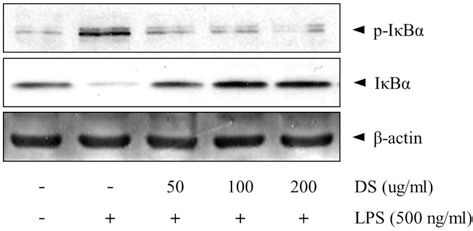
5. 뚝새풀 추출물(DS)이 RAW 264.7에서 LPS로 유도된 p-IκBα 발현에 미치는 영향
바이러스, 박테리아 감염시 유도되는 염증반응에 의해 활성 화 되는 NF-κB는 iNOS나 TNF-α 유전자의 발현에 관련된다 (Willeaume et al., 1996). 정상상태에서 NF-κB는 세포질에서 inhibitory molecule인 IκBα, IκBβ, IκBε, p105, p100 등과 결합하여 비활성형으로 존재하지만, LPS의 자극에 의해 NFκB signaling cascade가 활성화 되면, NFκB가 핵으로 translocation하여 COX-2, iNOS, BclXL, cIAPs 등의 전사를 유도한다 (Willeaume et al., 1996). 본 실험에서는 IκBα의 phosphorylated form을 측정하여 IκBα 활성에 의한 NF-κB 기전을 확인하였다. LPS 처리시에는 p-IκBα 발현이 유도되었 으나, 50, 100, 200µg/ml DS는 LPS에 의한 p-IκBα 발현량 을 억제시켰다 (Fig. 5).
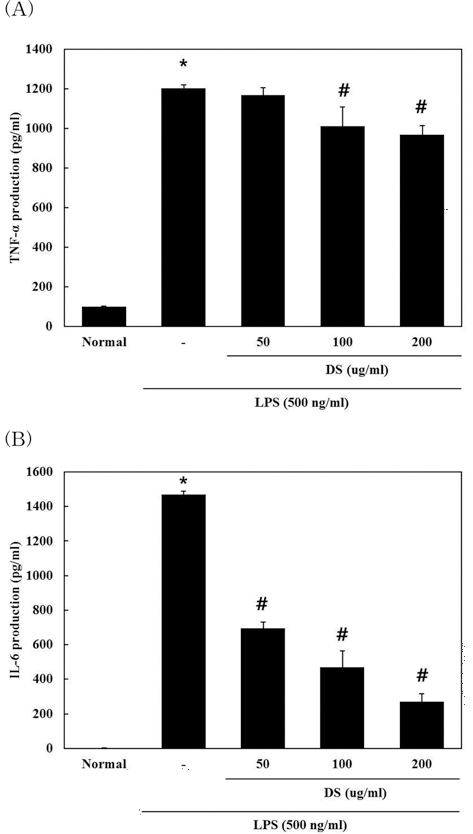
6. 뚝새풀 추출물 (DS)이 TNF-α, IL-6 발현에 미치는 영향
DS가 RAW 264.7 cell에서 LPS로 유도 되는 각종 전염증 성 및 염증성 cytokine들의 발현에 대한 영향을 조사하기 위 하여 전염증성 및 염증성 cytokine의 생성을 조사하였다. DS 를 전처리한 후 LPS로 자극하여 24시간 후에 세포 상층 액을 ELISA 방법으로 측정한 결과 DS의 100, 200 µg/ml 농도에서 TNF-α (normal군 100.0 ± 1.57 pg/ml, LPS군 120 2.2 ± 18.86 pg/ml, LPS + 50µg/ml DS군 116 8.3 ± 36.93 pg/ml, LPS + 100µg/ml DS군 1010.6 ± 96.64 pg/ml, LPS + 200µg/ml DS군 967.8 ± 47.14 pg/ml)를 농도 의존적으로 유의성 있 게 억제하였고, IL-6 (normal군 1.6 ± 0.61 pg/ml, LPS군 14 70.4 ± 21.86 pg/ml, LPS + 50µg/ml DS군 694.8 ± 41.93 pg/ml, LPS + 100µg/ml DS군 468.9 ± 89.64 pg/ml, LPS + 200µg/ml DS군 269.8 ± 47.14 pg/ml)는 50, 100, 200µg/ml의 농도에서 농도 의존적으로 유의성 있게 억제하였다 (Fig. 6).
고 찰
뚝새풀은 벼과 뚝새풀속의 한해살이 또는 두해살이풀로서 한국, 중국, 일본, 시베리아 등지에 분포하고 있다. 털이 없으 며 잎은 편평하며 길이 5 ~ 15㎝, 나비 2 ~ 5㎜로서 백록색 이며 엽설 (葉舌)은 색이 연하며 가장자리가 밋밋하고 반원형 또는 달걀 모양이다. 꽃은 5 ~ 6 월에 피며 꽃이삭은 길이 3 ~ 8㎝, 나비 3 ~ 5㎜로서 연한 녹색이고 가지에 털이 약간 있다. 작은 이삭은 1개의 꽃으로 되며 좌우로 납작하고 짧은 대가 있다. 포영 (苞潁)은 밑부분이 약간 붙으며 좁은 모양이 고 바깥쪽 맥 밑부분에 누운 털이 있다.
대식세포는 능동 및 수동 면역반응에서 매우 중요한 역할 을 하며 NO, prostaglandins (PGs) 그리고 pro-inflammatory cytokines을 포함한 다양한 염증 매개물질을 조절한다 (Iontcheva et al., 2004). 이 중 NO 형성은 박테리아를 죽이 거나 종양을 제거시키는 중요한 역할을 하지만, 병리적인 원 인에 의한 과도한 NO 형성은 염증을 유발시키게 되며 조직의 손상, 유전자 변이 및 신경 손상 등을 유발한다 (Stuehr et al., 1991; McCartney-Francis et al., 1993; Weisz et al., 1996). 이러한 사실에 기초하여 DS가 RAW 264.7 세포에서 LPS에 의해 유도된 NO의 생성을 저해함을 확인하였다. 또한 Western blot으로 분석한 결과 DS에 의한 iNOS의 발현 억제 는 NO 형성 억제와 유사한 경향을 나타냄으로 NO 형성 억 제는 iNOS의 발현저해를 경유한 것임을 알 수 있었다.
다수의 항염증 약물들의 작용기전은 prostaglandin 합성을 억제하며 이는 COX-2의 생성 및 효소 활성저해에 의한 것 이다. COX는 COX-1과 COX-2로 구분되는데, 다양한 세포에 서 각각 다른 발현 경향을 나타낸다. COX-1은 위 및 신장기 능의 유지, 혈소판의 형성에 필요한 prostaglandin을 합성한다 (Masferrer et al., 1994). 상대적으로 COX-2는 동물이나 인간 의 염증반응 부위에서 발현된다 (Masferrer et al., 1994; Seibert et al., 1994). 따라서 COX-2에 의한 prostaglandin의 합성은 염증반응을 매개하는 것으로 여겨지고 있다 (Lee et al., 2011). Western blot을 이용하여 COX-2 단백질의 발현을 확인한 결과 DS는 LPS에 의해 형성되는 COX-2를 유의성 있게 감소시켰다.
염증매개물질인 TNF-α와 IL-6는 in υiυο 및 in υitrο에서 모두 염증반응을 조절하는 물질로 알려져 있다. 이러한 cytokine들은 서로 상호작용이 있는 것으로 알려져 있으며 LPS 등의 염증 자극 물질에 의해 생성이 유도된다고 보고되 었다 (Feldmann et al., 1996). DS는 LPS에 의해 유도된 TNF-α의 생성을 100µg/ml에서부터 유의성 있게 감소 시켰 으며 IL-6의 생성도 농도 의존적으로 유의성 있게 저해하였다.
LPS는 RAW 264.7 세포에서 NF-κB를 활성화시켜 염증성 사이토카인의 분비, COX-2, iNOS의 활성화를 유도한다고 알 려져 있다 (Willeaume et al., 1996; Karin and Ben-Neriah, 2000). 본 연구에서 DS에 의한 TNF-α 분비억제, COX-2, iNOS의 활성 억제에 대한 기전으로 NF-κB 경로를 확인하기 위하여 세포내 NF-κB 억제 단백질인 Iκ-Bα의 활성을 관찰하 였다. DS를 처리 했을 때 농도 의존적으로 Iκ-Bα 인산화 반 응이 억제되었으며 이 결과는 COX-2의 발현억제, NO와 TNF-α의 분비억제 반응 기작에 NF-κB의 translocation이 DS 에 의해 억제됨을 간접적으로 시사하는 것이라 할 수 있다.
본 실험 결과를 요약하면, 뚝새풀 에탄올 추출물은 RAW 264.7 세포에서 NF-κB 전사 활성을 억제함으로써 LPS에 의 해 유도되는 iNOS 그리고 COX-2 단백질과 pro-inflammatory cytokine인 TNF-α 및 IL-6의 발현을 효과적으로 저해한다. 본 실험결과를 토대로 뚝새풀 추출물이 대식세포를 매개로 한 염 증반응의 작용기전 연구에 중요한 기초 자료가 될 수 있고, 향후 염증성 질환의 예방과 치료에 효과적으로 사용할 수 있 을 것으로 기대된다.
REFERENCES
- Anest, V, Hanson, JL, Cogswell, PC, Steinbrecher, KA, Strahl, BD, Balcwin, AS, A nucleosomal function for I kappa B kinase-alpha in NF-kappaB-dependunt gene expression, Nature, (2003), 423, p659-63.
-
Athman, R, Rhilpott, D, Innate immunity via toll-like receptors and Nod proteins, Current Opinion in Microbiology, (2004), 7, p32-25.
[https://doi.org/10.1016/j.mib.2003.12.013]

- Beinke, S, Ley, SC, Functions of NF-kappaB1 and NF-kappaB2 in immume cell biology, Biochemical Journal, (2004), 382, p409-393.
-
Cho, W, Nam, JW, Kang, HJ, Windono, T, Seo, EK, Lee, KT, Zedoarondiol isolated from the rhizoma of Curcuma heyneana is involved in the inhibition of iNOS, COX-2 and pro-inflammatory cytokines via the downregulation of NF-κB pathway in LPS-stimulated murine macrophages, International Immunopharmacology, (2009), 9, p1049-57.
[https://doi.org/10.1016/j.intimp.2009.04.012]

- Choi, SY, Lee, HR, Host preference by the small brown planthopper and green rice leafhopper on barley and water foxtail, Korean Journal of Plant Protection, (1976), 15, p179-181.
- Feldmann, M, Brennan, FM, Maini, RN, Role of cytokines in rheumatoid arthritis, Annual Review of Immunology, (1996), 14, p397-440.
- Feng, GJ, Goodridge, HS, Harnett, MM, Wei, XQ, Nikolaev, AV, Higson, AP, Liew, FY, Extracellular signal-related kinase(ERK) and p38 mitogen-activated protein(MAP) kinases differentially regulate the lipopolysaccharide-mediated induction of inducible nitric oxide synthase and IL-12 in macrophages: Leishmania phosphoglycans subvert macrophage IL-12 production by targeting ERK MAP kinase, Journal of Immunology, (1999), 163, p6403-12.
- Hong, KP, Kim, JY, Kang, DJ, Shin, WG, Occurrence pattern and control method of water-foxtail(Alopecurus aequalisOhwi) in notillage paddy, Korean Journal of Weed Science, (1996), 16, p176-180.
-
Iontcheva, I, Amar, S, Zawawi, KH, Kantarci, A, Van Dyke, TE, Role for moesin in lipopolysaccharidestimulated signal transduction, Infection and Immunity, (2004), 72, p2312-2320.
[https://doi.org/10.1128/iai.72.4.2312-2320.2004]

-
Karin, M, Ben-Neriah, Y, Phosphorylation meets ubiquitination: The control of NF-B activity, Annual Review Journal of Immunology, (2000), 18, p621-663.
[https://doi.org/10.1146/annurev.immunol.18.1.621]

-
Kim, YO, Lee, SW, Sohn, SH, Kim, SY, Oh, MS, Kim, SK, Anti-inflammatory effects of water extract ofEucommia ulmoidesoliver on the LPS-induced RAW 264.7 cells, Korean Journal of Medicinal Crop Science, (2012), 20, p381-386.
[https://doi.org/10.7783/kjmcs.2012.20.5.381]

- Kim, DH, Park, SJ, Jung, JY, Kim, SC, Byun, SH, Antiinflammatory effects of the aqueous extract of Hwangnyenhaedok-tang in LPS-activated macrophage cells, Korean Journal of Herbology, (2009), 24, p47-39.
-
Kranzhofer, R, Schmidt, J, Pfeiffer, CA, Hagl, S, Libby, P, Kubler, W, Angiotensin induces inflammatory activation of human vascular smooth muscle cells, Arteriosclerosis, Thrombosis and Vascular Biology, (1999), 19, p1623-1629.
[https://doi.org/10.1161/01.atv.19.7.1623]

-
Lee, KH, Cho, YL, Joo, CG, Joo, YJ, Kwon, SS, Park, C, Study on the anti-inflammatory effect of kaempferol and kaempferol rhamnosides isolated fromHibiscus cannabinusL, Korean Journal of Medicinal Crop Science, (2011), 19, p426-434.
[https://doi.org/10.7783/kjmcs.2011.19.6.426]

- Lee, JW, Lee, SH, Grass sward system for eco-friendly cultivation in vineyard, Chungnam Agricultural Research Report of CARES, (2006), p346-355.
-
Masferrer, J, Zweifel, BS, Manning, PT, Hauser, SD, Leahy, KM, Smith, WG, Isacson, PC, Seibert, K, Selective inhibition of inducible cyclooxygenase 2 in vivo is anti-inflammatory and nonulcerogenic, (1994), Proceedings of the National Academy of Sciences of the United States of America, 91, p3228-3232.
[https://doi.org/10.1073/pnas.91.8.3228]

-
McCartney-Francis, N, Allen, JB, Mizel, DE, Albina, JE, Xie, QW, Nathan, CF, Wahl, SM, Suppression of arthritis by an inhibitor of nitric oxide synthase, Journal ofExperimental Medicine, (1993), 178, p749-754.
[https://doi.org/10.1084/jem.178.2.749]

-
McDaniel, ML, Kwon, G, Hill, JR, Marshall, CA, Corbett, JA, Cytokines and nitric oxide in islet inflammation and diabetes, (1996), Proceedings of the Society for Experimental Biology and Medicine, 211, p32-24.
[https://doi.org/10.3181/00379727-211-43950d]

- Moncada, S, Higgs, EA, Endogenous nitric oxidephysiology pathology and clinical relevance, European Journal of Clinical Investigation, (1991), 21, p361-74.
-
Seibert, K, Zhang, Y, Leahy, K, Hauser, S, Masferrer, J, Perkins, W, Lee, L, Ksakson, P, Pharmacological and biochemical demonstration of the role of cyclooxygenase 2 in inflammation and pain, (1994), Proceedings of the National Academy of Sciences of the United States of America, 91, p12013-12017.
[https://doi.org/10.1073/pnas.91.25.12013]

-
Seong, KY, Park, TS, Weed occurrence according to the density of water foxtail in no-tillage seeding rice paddy fields, Korean Journal of Weed Science, (2012), 32, p280-284.
[https://doi.org/10.5660/kjws.2012.32.3.280]

- State Administration of Traditional Chinesemedicine(SATC), The encyclopedia of oriental herbal medicine. State Administration of Traditional Chinesemedicine. Shanghai China, (1999), 8, p7393-7394.
- Stuehr, HJ, Kwon, NS, Weise, M, Nathan, C, Purification of the cytokine-induced macrophage nitric oxide synthase An FAD- and FMN- containing flavoprotein, (1991), Proceedings of the National Academy of Sciences of the United States of America, 88, p7773-7777.
- Takeda, K, Kaisho, T, Akira, S, Toll-like receptors, Annual Review of Immunology, (2003), 21, p335-76.
- Weisz, A, Cicatiello, I, Esumi, H, Regulation of the mouse inducible-type nitric oxide synthase gene promoter by interferon-gamma, bacterical lipopolysaccharide and NGmonomethyl- L-arginene, Biochemical Journal, (1996), 316, p209-215.
- Willeaume, V, Kruys, V, Mijatovic, T, Huez, G, Tumor necrosis factor-alpha production induced by viruses and by lipopolysaccharides in macrophages: Similarities and differences, Journal of Inflammation, (1996), 46, p1-12.
- Willoughby, DA, Human arthritis applied to animal models. Towards a better therapy, Annals of the Rheumatic Diseases, (1975), 34, p471-478.