
동물모델을 이용한 짚신나물 물 추출물의 위염 예방효과 및 유전독성 평가
 ; Ji Hun Jang
; Ji Hun Jang ; Hyun Joo Lee
; Hyun Joo Lee ; Beodul Yang
; Beodul Yang ; Kyeong Wan Woo
; Kyeong Wan Woo ; A Hyeon Kim
; A Hyeon Kim ; Jae Wan Seo ; Tae Yeon Hwang
; Jae Wan Seo ; Tae Yeon Hwang ; Hyun Woo Cho ; Ho Kyung Jung†
; Hyun Woo Cho ; Ho Kyung Jung†
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Agrimonia pilosa Ledeb has been used as a traditional medicine for the treatment of hematuresis and uterine bleeding in Korea. It has been reported to have anti-obesity, anti-diabetes and anti-inflammaotry effect by regulating the inflammatory signaling pathway. However, the preventive effect of Agrimonia pilosa Ledeb on gastritis has not been elucidated. Thus, in the present study, we evaluated the effects of the water extract of Agrimonia pilosa Ledeb (APW) using HCl/EtOH-induced gastritis rat models.
Gastritis was induced in rats by HCl/EtOH administration. The rats in each group were orally administered with two doses of APW (100 and 500㎎/㎏). Omeprazole was used as a positive control drug. An enzyme-linked immunosorbent assay (ELISA) was used to measure the prostaglandin E2 (PGE2) levels in stomach. The treatment with 500㎎/㎏ APW reduced the gastric ulcer area. The APW treatment prevented a decreased in PGE2 concentration induced by HCl/EtOH in rats. In the micronucleus test, the ratio of micronucleated polychromatic erythrocytes to polychromatic erythrocytes showed no significant change in the APW-treated group compared with the control group.
These results indicate that APW could be used to prevent the gastritis caused by the HCl/EtOH-induced damage to stomach lining. In addition, the APW treatment showed no significant change in results of the micronucleus test. However, further experiments are required to determine how APW influenced the secretion of mucus and gastric acid using the chromosome aberration test and bacterial reverse mutation assay.
Keywords:
Agrimonia pilosa Ledeb, Gastritis, Micronucleus Test서 언
위염이란 위 내부의 상피 내막에 발생되는 염증반응을 의미하며 외부적 요인이 위에 직접적으로 작용하는 경우와 다른 인접장기의 질병에 의해 발병되는 경우가 존재하고 복부 통증과 메스꺼움, 트림 및 복부팽만을 야기한다 (Glickman and antonioli, 2001). 위염은 크게 만성 위염과 급성 위염으로 나뉘게 되는데, 만성 위염은 스트레스와 Helicobacter pylori 감염과 관련이 있으며 급성 위염은 스테로이드성 항염증제의 장기간 사용 및 과한 알코올 섭취에 의해 유도된다고 알려져 있다 (Srivastava and Lauwers, 2007; Kandulski et al., 2008; Rocco et al., 2014). 위염이 유발된 상태에서 위점막은 주로 히스타민, 펩신, 위산 분비에 의해 손상되며 이에 따라 발적, 출혈, 부종등의 증상이 나타난다 (Lee et al., 2015).
Prostaglandin은 phospholipase A2에 의해 membrane phospholipid (막 인지질)로부터 arachidonic acid가 만들어짐에 따라 합성이 시작되며, 이러한 대사 경로에 cyclooxygenase에 속하는 cyclooxygenase-1과 cyclooxygenase-2가 참여하고 합성된 prostaglandin은 혈소판 응집, 위 점막 보호, 신장기능 조절 또는 염증반응에 관여한다고 알려져 있다 (Turini and Dubois, 2002). Prostaglandin E2 (PGE2)는 염증반응과 밀접한 관련이 있어 질병을 포함한 염증과 관계된 여러 상태에서 효능을 평가하는데 흔히 사용된다 (Kim et al., 2012; Im and Lee, 2014; Kim et al., 2014; Nho et al., 2018). 위에서 분비되는 PGE2는 prostaglandin E2 receptor 2 (EP2) 또는 prostaglandin E2 receptor 4 (EP4)를 통해 점액 분비를 촉진시키며 외부 자극에 의한 점막 손상을 억제하는 것으로 알려져 있다 (Hoshino et al., 2003; Kim, 2009).
짚신나물 (Agrimonia pilosa Ledeb)은 장미과에 속하는 식물로 용아초 또는 선학초라 부르기도 하며, 예로부터 혈뇨 및 자궁출혈에 사용되었다 (Bae and Sohn, 2005; Lee et al., 2009). 여러 연구에 따르면, 짚신나물은 항노화, 항산화 및 항알러지 효과를 가질 뿐만 아니라 함유된 유효성분의 추출조건을 개선하는 연구방법에 대해 알려져 있고 (Min et al., 2008; Kim, 2010; Yoon et al., 2012; Park and Lee, 2016), 염증반응에 관련된 inducible nitric oxide synthase 및 reactive oxygen species 를 억제하여 항염증 효과를 나타낸다 (Jung et al., 2010). 짚신나물은 tiliroside, quercetin, luteolin, apigenin, pinocembrin 및 kaempferol을 포함한 여러 플라보노이드 성분을 포함한 것으로 알려져 있다 (Liu et al., 2016). 여러 연구에 따르면 다양한 플라보노이드는 섭취 시 체내에 5% 정도 내지 흡수되며 염증반응에 관련된 여러 유전자의 발현 및 활성에 영향을 미치는 것으로 알려져 있다 (Serafini et al., 2010). 특히 짚신나물의 주요성분인 tiliroside는 MAPK/JNK/p38 신호전달경로에 관여하여 과도한 염증반응을 억제시키는 것으로 얼려져있을 뿐만 아니라, smooth muscle cell에서 Ca2+의 유입을 감소시키는 것으로 알려져 있는데 이러한 작용은 세포 내 Ca2+ 농도 증가에 따른 위산 과분비 작용에 영향을 미칠 수 있다고 사료되지만 실제로 짚신나무 물 추출물이 위염을 예방 또는 개선시킬 수 있는지에 대한 효능은 보고되지 않았다 (Chew, 1993; Silva et al., 2013; Jin et al., 2016).
최근 짚신나물을 포함한 여러 식물은 민간요법으로 자주 이용되고 있다. 하지만 일부 식물들은 잠재적인 독성을 가지고 있어 높은 농도로 복용할 경우 인체에 영향을 미칠 수 있지만 이에 대한 독성 및 안전성에 대한 연구는 미흡한 실정이다 (Kim et al., 2008).
이러한 이유에 따라 본 연구는 짚신나무 물 추출물을 이용하여 소핵시험을 통해 유전독성을 평가하였고, HCl/EtOH로 유도된 위염 동물모델에서 조직학적 및 형태학적 분석과 점액질 분비 물질을 분석하여 위염의 병변을 억제할 수 있는지 알아보고자 하였다.
재료 및 방법
1. 실험재료와 추출물의 제조
본 연구에 사용한 짚신나물 (Agrimonia pilosa Ledeb)은 2015년 4월 21일경에 경북 봉화 (위도 36 o90’08”N, 경도 128 o80’91”E, 고도 268 m)에서 채취하였으며 동신대학교 한의학과 정종길교수의 동정을 거쳤다. 실험에 사용된 시료의 확증표본은 한약진흥재단 한약자원본부에 보관하고 있다. 짚신 나물의 전초를 세척한 뒤 50℃ 조건으로 열풍건조기에서 일주일간 건조하였다.
건조된 시료 2,160 g을 분쇄한 뒤 시료 무게의 10 배에 해당하는 물을 넣고 환류 냉각추출방법을 이용하여 105℃에서 5시간, 2 회 반복하여 추출하였다. 추출된 시료는 대형 회전감압농축기 (NVC-2200, Eyela, Tokyo, Japan)를 이용해 55℃에서 농축한 뒤 filter paper (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 사용하여 여과하였고, 여과된 추출물은 동결건조기를 이용해 건조하였다.
실험재료는 331 g을 수득하여 약 15.3%의 수율을 확인하였고, 건조된 파우더는 0.5% carboxymethyl cellulose (CMC, Sigma-Aldrich Co., St. Louis, MO, USA)에 녹인 뒤 사용하였다.
2. 실험 동물 및 처치
본 실험은 동물보호법 (제정 1991년 5월 31일 법률 제 4379호, 일부개정 2015년 1월 20일 법률 제 13023호)에 근거한 한약진흥재단 한약자원본부의 동물실험윤리위원회에 의해 승인되었다 (승인번호: NIKOM-2017-007).
위염 예방효과 측정은 수컷 6 주령 Sprague-dawley (SD) rat를 오리엔트 바이오 (Jeongeup, Korea)에서 구입하였으며, 다섯 그룹으로 분리하였고 마릿수는 다음과 같다 (정상대조군 n = 7, 음성대조군 n = 7, 양성대조군 n = 7,100㎎/㎏ 짚신나물 물 추출물 투여군 n = 7,500㎎/㎏ 짚신나물 물 추출물 투여군 n = 7).
소핵실험을 통한 유전독성평가는 6 주령 ICR 마우스를 오리엔트 바이오 (Jeongeup, Korea)에서 구입하였으며, 다섯 그룹으로 분리하였고 마릿수는 다음과 같다 (정상대조군 n = 7, 음성대조군 n = 7, 500㎎/㎏ 짚신나물 물 추출물 투여군 n= 7, 1,000㎎/㎏ 짚신나물 물 추출물 투여군 n = 7, 2,000㎎/㎏ 짚신나물 물 추출물 투여군 n = 7).
동물실험에 사용된 추출물의 농도는 짚신나물 추출물을 이용한 여러 실험결과를 참고하여 적용하였고 (Hsu et al., 1987; Kim et al., 2012; Park et al., 2012; Jang et al., 2017), 농도설정 시험에서 짚신나무 추출물을 최대 500㎎/㎏의 농도로 투여했을 때 신장 및 간 기능평가 마커인 alanine aminotransferase, aspartate aminotransferase, blood urine nitrogen 및 creatinine 수치가 정상대조군과 차이가 없어 시험농도로 사용하였다.
음성대조군 그룹은 물을 1㎖씩 3 일간 경구투여 하였다. 양성대조군 그룹은 omeprazole을 20㎎/㎏ 농도로 3 일 동안 경구투여 하였고, 짚신나물 물 추출물 투여군은 각각 100 또는 500 ㎎/㎏ 농도로 3 일 동안 경구투여 하였다. 실험 마지막 날 경구투여 30 분 뒤 실험동물 한마리당 150 mM HCl (in 60% EtOH, 1㎖)을 경구투여 하여 위염을 30 분 동안 유도하였고, 위염 유도 농도는 여러 실험을 참고하여 선정하였다 (Choi et al., 2012; Lee et al., 2016; Hwang et al., 2017), 실험이 끝난 뒤 모든 실험동물은 Institutional Animal Care and Use Committee (IACUC)의 실험동물 관리 기준에 따라 CO2를 과호흡시켜 안락사를 유도하였다.
3. 위염 병변 및 억제율 측정
위염 병변 및 추출물 투여에 따른 억제 정도를 측정하기 위해 적출된 위를 절개하여 고정하고 위벽에 발생한 손상 길이를 현미경을 통해 측정하여 병변의 면적과 억제율을 구하였다.
4. Hematoxylin과 eosin 염색
적출된 위는 10% neutral buffered formalin (NBF)에 고정한 뒤, 조직처리 과정을 통해 파라핀으로 포매하였다. 포매가 끝난 위 조직은 위벽의 점막층을 확인할 수 있도록 5㎛ 두께로 절편을 제작하였으며, Dako Mayer’s Hematoxylin (Agilent Technologies Inc., Santa Clara, CA, USA)과 Eosin Y (Sigma-Aldrich Co., St. Louis, MO, USA)를 이용해 염색한 뒤 현미경하에 관찰하였다.
5. PGE2 측정
PGE2 ELISA kit (Enzo, Farmingdale, NY, USA)을 사용하여 실험을 진행하였다. 적출된 위의 일부는 일정한 무게로 잘라 RIPA buffer (Cell Signaling Technology, Danvers, MA, USA)에 녹여 단백질을 분리한 뒤 원심분리기로 4℃, 13,000 × g 조건에서 10 분간 원심분리 하였고, 일정한 양의 단백질 용해액을 이용해 제조사가 제시한 protocol에 따라 실험을 수행하였다. 또한 위 조직 무게당 PGE2 농도를 그래프로 표기하였다.
6. 소핵시험
소핵시험에 사용된 농도는 용량설정시험 결과를 토대로 짚신나무 물 추출물을 2,000㎎/㎏ 농도로 경구투여 시 독성이 나타나지 않았기 때문에 이를 최고농도로 설정하였다.
실험동물은 2 일간 짚신나물 물 추출물을 각각 500, 1,000 및 2,000㎎/㎏의 농도로 경구투여 하였으며, 대조군 물질로 사용된 cyclophosphamide (CPA, Sigma-Aldrich Co., St. Louis, MO, USA)는 70㎎/㎏의 농도로 단회 복강투여 하였다. 시험이 끝난 뒤 마우스 대퇴골에서 fetal bovine serum을 사용해 골수세포를 수거하고, 채취한 골수를 4℃, 1,000 rpm 조건에서 5 분간 원심분리 하였다. 상층액을 버린 후 골수세포를 부유시켜 slide glass에 도말한 뒤 건조하여 검체를 만들었다. 검체는 메탄올로 고정한 뒤 5% giemsa (Sigma-Aldrich Co., St. Louis, MO, USA) 염색액으로 염색하여 분석하였다. 약 4,000 개의 다염성 적혈구 (PCE, polychromatic erythrocyte)를 관찰하고, 이중 소핵 다염성 적혈구 (MNPCE, micronucleated polychromatic erythrocyte) 의 빈도를 측정한 동시에 정상체 적혈구 (NCE, normochromatic erythrocyte)와 다염성 적혈구를 더한 전적혈구 (PCE + NCE)에 대한 다염성 적혈구 빈도를 측정하였다.
7. 통계처리
통계처리는 IBM SPSS (Statistics Version 19.0 Statistic Software, SPSS Inc., IBM, Chicago, IL, USA)을 이용하여 통계처리 하였고, 평균값과 표준편차를 구하였다. 실험군 간의 평균 차이를 검증하기 위해 일원배치 분산분석 (One-way ANOVA)을 한 뒤, Tukey-Kramer Multiple Comparison Test를 사용하여 유의수준 p < 0.05 수준에서 통계적인 차이를 검증하였다.
결과 및 고찰
1. 염산/에탄올에 의해 유도된 위염 동물모델에서 짚신나물 물 추출물의 예방효능 평가
일정 농도의 HCl/EtOH 경구투여는 위점막 체계를 손상시켜 점막 세포를 사멸시킴에 따라 위산 과분비와 알콜섭취에 따른 급성 위염의 특징을 잘 나타내기 때문에 실험모델로 사용되며, HCl 또는 EtOH의 단독투여는 병변이 잘 유발되지 않고 재현성이 낮은 단점이 존재하기 때문에 위산과 비슷한 농도를 가지는 HCl과 EtOH 동시 투여에 따른 급성 위염 동물모델이 흔히 사용된다 (Mizui and Doteuchi, 1983; Hsu et al., 2009; Hwang et al., 2017). 위염 동물 모델에서 짚신나물 (Agrimonia pilosa Ledeb) 물 추출물 (APW)이 병변을 예방할 수 있는지 알아보기 위해 실험을 진행하였다. 정상대조군과 비교하였을 때 위염 유도군의 병변은 134.5 ± 13.3㎜2로 나타났다. 양성대조군 (20 ㎎/㎏ omepazole) 그룹은 병변이 2.9 ± 1.6㎜2 (억제율, 98.9 ± 1.4)로 위염 유도군 대비 크게 감소하였으며, 100 또는 500㎎/㎏ 짚신나물 물 추출물 투여군은 각각 57.2 ± 9.4㎜2 (억제율, 60.8 ± 7.0)와 37.3 ± 3.5㎜2 (억제율, 72.2 ± 9.3)로 위염 유도군 대비 감소된 병변을 나타내었다 (Table 1 and Fig. 1A). H&E 염색을 통해 위점막조직을 확인한 결과 위염 유도군은 점막부분이 대부분 소실된 상태였으며, 이와 비교하여 양성대조군 그룹은 정상대조군과 비슷하게 HCl/EtOH에 의한 점막 손상이 차단되었다. 저농도 짚신나물 물 추출물 투여군은 고농도 투여군에 비해 점막 보호효과가 낮게 나타났다 (Fig. 1B).
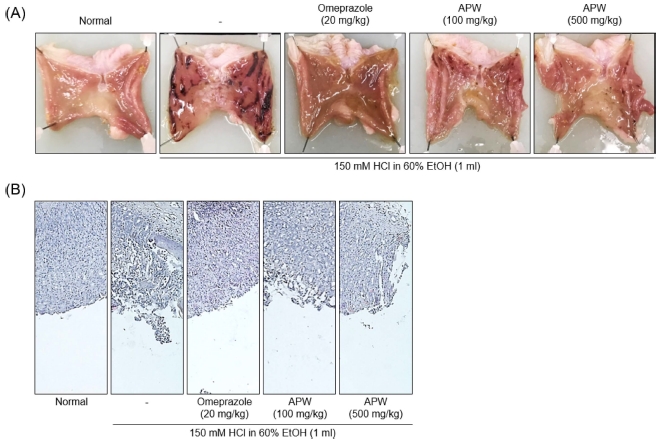
Prevention effect of APW on HCl/EtOH-induced gastritis. Rats were separated in five groups of 7 rat each: Normal, HCl/EtOH (negative control), Omeprazole (positive control, 20㎎/㎏ Omeprazole + HCl/EtOH), 100㎎/㎏ APW + HCl/EtOH, 500㎎/㎏ APW + HCl/EtOH. (A) Morphological analysis was carried out on stomach, (B) Representative images were stained by hematoxylin and eosin (H&E) staining. APW, water extracts of Agrimonia pilosa Ledeb.
위와 같은 실험조건하에 위염 예방효과가 있다고 알려진 추출물과 비교하였을 때 짚신나무 물 추출물은 소초, 대황, 소리쟁이 및 장엽대황 물 추출물과 비교하여 농도 대비 위염 예방 효과가 뛰어난 것으로 나타났다 (Hwang and Jeong, 2013; Hwang et al., 2017).
위 내부에서 분비되는 PGE2는 점액 분비를 촉진시킬뿐만 아니라 외부 자극에 의한 점막의 손상을 차단하는 것으로 알려져 있다 (Hoshino et al., 2003; Kim, 2009). 이에 따라 위 조직 내부에 존재하는 PGE2의 농도를 확인한 결과, 위염 유도군은 23 ± 2 ng/㎎으로 정상대조군 (60 ± 5 ng/㎎)에 비해 크게 감소되었다. 양성대조군 그룹은 47 ± 4 ng/㎎으로 위염 유도군과 비교하여 유의적으로 감소하지 않았으며, 100 또는 500㎎/㎏ 짚신나물 물 추출물 투여군은 각각 30 ± 2 ng/㎎과 35 ± 3 ng/㎎으로 위염 유도군과 비교하여 PGE2의 농도가 유의적으로 높았다 (Fig. 2).
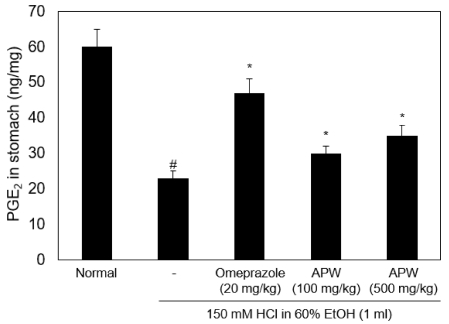
Effect of APW on PGE2 level in stomach. Rats were separated 5 group (Normal, -; HCl/EtOH + water 1 ㎖, Omeprazole; HCl/EtOH+ 20㎎/㎏ Omeprazole, HCl/EtOH + 100㎎/㎏ APW, HCl/EtOH + 500㎎/㎏ APW, n = 7). PGE2 in stomach was analyzed by ELISA. #p < 0.05, versus normal group; *p < 0.05, versus HCl/EtOH group. Between groups comparisons were conducted using one-way ANOVA with Tukey-Kramer Multiple Comparison Test. APW, water extracts of Agrimonia pilosa Ledeb.
양성대조군으로 사용된 omeprazole은 프로톤펌프억제제로써 위 내부의 H+K+-ATPase 저해를 통해 위산 분비를 감소시키지만 D세포의 somatostatin 분비를 억제시키고 G세포의 가스트린 분비를 촉진하여 가스트린혈증을 유발시키는 부작용을 나타낸다 (Park and Kim, 2011). 500㎎/㎏ 짚신나물 물 추출물 투여군은 20㎎/㎏ omeprazole 투여군에 비해 위염 병변 억제율이 낮았지만 위 내부 출혈을 억제하는 것으로 나타났을 뿐만 아니라 (Table 1 and Fig. 1A), HCl/EtOH에 의한 위점막 부분의 소실을 억제하는 것으로 나타났다 (Fig. 1B). 이는 항염증 효과를 나타내는 플라보노이드 성분인 tiliroside를 포함한 짚신나물 물 추출물의 투여가 HCl/EtOH 처리에 의한 위 점막 손상을 예방하는 것으로 사료되지만, omeprazole과 같이 H+K+-ATPase의 활성을 저해하거나 추출물에 포함된 유효성분이 직접적으로 다른 염증 반응 신호전달 경로를 통해 HCl/EtOH에 의한 점막세포의 사멸 억제에 관여하는지 알지 못하기 때문에 이러한 경로를 측정할 수 있는 추가적인 연구와 짚신나물에서 분리되는 특정 분리성분을 이용해 위염예방효과를 평가하는 실험이 필요하다고 생각된다.
2. 짚신나물 물 추출물의 소핵시험평가
수컷 6 주령 ICR 마우스를 이용해 설치류의 조혈모세포에 대한 짚신나물 물 추출물이 소핵을 유발하는지 평가하였다. 시험결과 추출물 및 음성대조군 투여에 따른 사망동물은 확인되지 않았고, 소핵을 가지는 다염성 적혈구의 출현 빈도를 측정하였다. 500, 1,000, 2,000㎎/㎏ 짚신나물 물 추출물 투여군은 정상대조군과 비교하여 소핵을 가진 다염성 적혈구의 유의적인 증가를 확인할 수 없었다. 마찬가지로, 세포독성 지표인 PCE/ (PCE +NCE) 비율도 정상대조군과 짚신나물 물 추출물 투여군의 차이가 나타나지 않았다 (Table 2).
이 결과로 볼 때 짚신나물 물 추출물은 본 시험조건에서 마우스 골수세포에 소핵을 유발하지 않는 것으로 사료된다. 이러한 결과는 짚신나물 물 추출물의 소핵유발능에 대한 안전성을 입증하는 자료를 마련하게 된 것으로 추후 이루어질 추가적인 실험에 있어 추출물의 안전성을 확보하게 되는 기초자료가 될 수 있을 것으로 예상되지만 세균을 이용한 돌연변이시험 및 염색체이상시험과 같은 추가적인 유전독성 시험이 필요할 것으로 생각된다.
본 연구를 통해 짚신나물 물 추출물의 위염 예방 소재로 이용될 수 있는 잠재성과 안전성을 확인하였으며, 유통시장에서 다양한 기원식물들이 혼재되어 사용되고 있는 실정에 형태학적으로 분류되어진 짚신나물의 효능을 과학적인 방법을 통해 분석함에 따라 한약재로 사용되는 식물의 과학화 및 표준화에 기여할 수 있는 것으로 사료된다.
Acknowledgments
본 연구는 보건복지부 한국 토종자원의 한약재기반구축사업 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFERENCE
- Bae, JH, and Sohn, MA., (2005), Effect of Agrimonia Pilosa Ledeb. extract on the growth of food-borne pathogens, Korean Journal of Nutrition, 38, p112-116.
- Chew, CS., (1993), Intracellular mechanisms in control of acid secretion, Current Opinion in Gastroenterology, 7, p856-862.
-
Choi, WS, Jang, DY, Lee, GR, and Kim, SH., (2012), Protective effect of HEAC and its primary active compound on HCl-ethanol induced gastritis in rats, Journal of the Korea Academia-industrial Cooperation Society, 13, p1769-1776.
[https://doi.org/10.5762/kais.2012.13.4.1769]

- Glickman, JN, and Antonioli, DA., (2001), Gastritis, Gastrointestinal Endoscopy Clinics of North America, 11, p717-740.
- Hoshino, T, Tsutsumi, S, Tomisato, W, Hwang, HJ, Tsuchiya, T, and Mizushima, T., (2003), Prostaglandin E2 protects gastric mucosal cells from apoptosis via EP2 and EP4 receptor activation, Journal of Biological Chemistry, 278, p12752-12758.
-
Hsu, DZ, Chu, PY, and Liu, MY., (2009), Effect of sesame oil on acidified ethanol-induced gastric mucosal injury in rats, Journal of Parenteral and Enteral Nutrition, 33, p423-427.
[https://doi.org/10.1177/0148607108327046]

-
Hsu, MF, Young, JH, Wang, JP, and Teng, CM., (1987), Effect of hsien-ho-t’sao(Agrimonia pilosa) on experimental thrombosis in mice, American Journal of Chinese Medicine, 15, p43-51.
[https://doi.org/10.1142/s0192415x87000060]

-
Hwang, IY, and Jeong, CS., (2013), A study on the antigastritic effect of Rheum species extracts and their active components, Journal of Food Hygiene and Safety, 28, p330-336.
[https://doi.org/10.13103/jfhs.2013.28.4.330]

- Hwang, IY, Lee, SY, Kyung, SY, and Jeong, CS., (2017), Inhibitory effects of Polygala tenuifolia Willd., Polygala japonica and Polygala tenuifolia on HCl·ethanol-induced gastritis in rats, Yakhak Hoeji, 61, p24-29.
-
Im, DY, and Lee, KI., (2014), Prostaglandin E2 up-regulation and wound healing effect of the ethanol extract of Eriobotryae Folium in human keratinocyte, Korean Journal of Medicinal Crop Science, 22, p457-462.
[https://doi.org/10.7783/kjmcs.2014.22.6.457]

-
Jang, HH, Nam, SY, Kim, MJ, Kim, JB, Choi, JS, Kim, HR, and Lee, YM., (2017), Agrimonia pilosa Ledeb. aqueous extract improves impaired glucose tolerance in high-fat diet-fed rats by decreasing the inflammatory response, BMC Complementary and Alternative Medicine, 17, p442, (cited by 2019 March 3).
[https://doi.org/10.1186/s12906-017-1949-z]

-
Jin, X, Song, S, Wang, J, Zhang, Q, Qiu, F, and Zhao, F., (2016), Tiliroside, the major component of Agrimonia pilosa Ledeb ethanol extract, inhibits MAPK/JNK/p38-mediated inflammation in lipopolysaccharide-activated RAW 264.7 macrophages, Experimental and Therapeutic Medicine, 12, p499-505.
[https://doi.org/10.3892/etm.2016.3305]

-
Jung, CH, Kim, JH, Park, SJ, Kweon, DH, Kim, SH, and Ko, SG., (2010), Inhibitory effect of Agrimonia pilosa Ledeb. on inflammation by suppression of iNOS and ROS production, Immunological Investigations, 39, p159-170.
[https://doi.org/10.3109/08820130903501790]

- Kandulski, A, Selgrad, M, and Malfertheiner, P., (2008), Helicobacter pylori infection: A clinical overview, Digestive and Liver Disease, 40, p619-626.
-
Kim, JJ, Jiang, J, Shim, DW, Kwon, SC, Kim, TJ, Ye, SK, Kim, MK, Shin, YK, Koppula, S, Kang, TB, Choi, DK, and Lee, KH., (2012), Anti-inflammatory and anti-allergic effects of Agrimonia pilosa Ledeb extract on murine cell lines and OVA-induced airway inflammation, Journal of Ethnophamacology, 140, p213-221.
[https://doi.org/10.1016/j.jep.2011.12.035]

- Kim, JK., (2009), Prostaglandin E2 receptors on upper respiratory tract, Korean Journal of Otorhinolaryngology-Head and Neck Surgery, 52, p553-559.
-
Kim, NY, Lee, YD, Cho, SC, Shin, YC, and Lee, HY., (2014), Enhancement of anti-inflammation effect by fermentation process in Aronia melanocarpa(Michx.) Elliott extract, Korean Journal of Medicinal Crop Science, 22, p475-482.
[https://doi.org/10.7783/kjmcs.2014.22.6.475]

- Kim, SH, Choi, EJ, Kim, DH, Lee, KY, Lee, M, Baek, SW, Kwak, SJ, Kang, TS, Kim, YC, and Sung, SH., (2008), Stability test of the extracts of Cimicifugae Rhizoma, Achyranthis Radix, Artemisia Capillaris Herba, Moutan Cortex Radicis and Arecae Semen for toxicity study, Korean Journal of Phamacognosy, 39, p241-245.
- Kim, YM., (2010), The inhibitory effect of Agrimonia pilosa Ledeb extract on allergic reaction, Korean Journal of Medicinal Crop Science, 18, p398-404.
-
Kim, YO, Lee, SW, Sohn, SH, Kim, SY, Oh, MS, and Kim, SK., (2012), Anti-inflammatory effects of water extract of Eucommina ulmoides on the LPS-induced RAW 264.7 cells, Korean Journal of Medicinal Crop Science, 20, p381-386.
[https://doi.org/10.7783/kjmcs.2012.20.5.381]

-
Lee, AR, Lee, JY, Kim, MY, Shin, MR, Shin, SH, Seo, BI, Kwon, OJ, and Roh, SS., (2015), Protective effect of a Lycium chinense ethanol extract through anti-oxidative stress on acute gastric lesion mice, Korea Journal of Herbology, 30, p63-68.
[https://doi.org/10.6116/kjh.2015.30.6.63.]

-
Lee, JY, Kwon, OJ, Noh, JS, and Roh, SS., (2016), Protective effect of red ginseng according to steaming time on HCI/ethanol-induced acute gastritis, Journal of Applied Biological Chemistry, 59, p365-372.
[https://doi.org/10.3839/jabc.2016.062]

- Lee, SH, Jung, H, Lee, JA, Go, HY, Choi, YK, Park, JH, Kim, JH, Ko, SK, and Jun, CY., (2009), The anticancer effects and drug metabolic enzyme change by oral intake of Agrimonia Pilosa Ledeb, Korean Journal of Oriental Preventive Medical Society, 13, p51-64.
- Liu, WJ, Hou, XQ, Chen, H, Liang, JY, and Sun, JB., (2016), Chemical constituents from Agrimonia pilosa Ledeb. and their chemotaxonomic significance, Natural Product Research, 30, p2495-2499.
- Min, KJ, Song, JW, and Cha, CG., (2008), The antioxidative and antitumor activity of extracts of Agrimonia pilosa, Journal of Food Hygiene and Safety, 23, p149-156.
-
Mizui, T, and Doteuchi, M., (1983), Effect of polyamines on acidified ethanol-induced gastric lesions in rats, Japanese Journal of Pharmacology, 33, p939-945.
[https://doi.org/10.1254/jjp.33.939]

- Nho, JH, Kang, BM, and Jung, SW., (2018), Anti-inflammatory activity of high temperature extract from the central part including heartwood, sapwood, cambiun, and phloem in Morus alba L, Korean Journal of Medicinal Crop Science, 26, p233-239.
- Park, HJ, and Kim, HS., (2011), Effects of proton pump inhibitors on atrophic gastritis and gastric cancer: Safe perspective, Korean Journal of Medicine, 81, p1-5.
-
Park, JJ, and Lee, WY., (2016), Prediction of optimal microwave extraction conditions for functional compounds from Agrimonia pilosa Ledeb using response surface methodology, Korean Journal of Otorhinolaryngology-Head and Neck Surgery, 24, p263-270.
[https://doi.org/10.7783/kjmcs.2016.24.4.263]

- Park, SH, Sim, YB, Kang, YJ, Lee, JK, Lim, SS, and Suh, HW., (2012), Effect of Agrimonia pilosa Ledeb extract on the antinociception and mechanisms in mouse, Korean Journal of Physiology and Pharmacology, 16, p119-123.
-
Rocco, A, Compare, D, Angrisani, D, Sanduzzi, ZM, and Nardone, G., (2014), Alcoholic disease: Liver and beyond, World Journal of Gastroenterology, 20, p14652-14659.
[https://doi.org/10.3748/wjg.v20.i40.14652]

- Serafini, M, Peluso, I, and Raguzzini, A., (2010), Flavonoids as anti-inflammatory agents, Proceedings of the Nutrition Society, 69, p273-278.
-
Silva, GC, Pereira, AC, Rezende, BA, da Silva, JFP, de Souza, MF, Gomes, RA, Teles, YCF, Cortes, SF, and Lemos, VS., (2013), Mechanism of the antihypertensive and vasorelaxant effects of the flavonoid tiliroside in resistance arteries, Biological and Pharmacological Activity, 79, p1003-1008.
[https://doi.org/10.1055/s-0032-1328765]

-
Srivastava, A, and Lauwers, GY., (2007), Pathology of non-infective gastritis, Histopathology, 50, p15-29.
[https://doi.org/10.1111/j.1365-2559.2006.02553.x]

- Turini, ME, and Duboid, RN., (2002), Cyclooxgenase-2: A therapeutic target, Annual Review of Medicine, 53, p35-57.
-
Yoon, JY, Lee, SY, Jun, HJ, and Lee, JY., (2012), Anti-aging effects of solvent fraction from Agrimonia pilosa L. extracts, Journal of Applied Biological Chemistry, 55, p35-39.
[https://doi.org/10.3839/jabc.2011.056]

