섬개야광나무 잎 추출물 및 분획물의 생리활성 평가 및 활성 물질 분리
 ; Hee Kyu Kim2
; Hee Kyu Kim2 ; Jae Mo Song3
; Jae Mo Song3 ; Chan Ok Lee4
; Chan Ok Lee4 ; Ju Hee Park5
; Ju Hee Park5 ; Byung Jun Park6
; Byung Jun Park6 ; Yeong Bin Choi7
; Yeong Bin Choi7 ; Young Sun Baek8
; Young Sun Baek8 ; Yeon Ji Hwang9
; Yeon Ji Hwang9 ; Myong Jo Kim10, †
; Myong Jo Kim10, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Previously, studies have observed that the leaf extract of Cotoneaster wilsonii Nakai has potent antioxidant and anti-inflammatory activites. Therefore, further research was conducted to separate the active antioxidant and anti-inflammatory compounds in the leaf of the C. wilsonii.
The anti-oxidant effects were evaluated by analyzing the 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity, estimating the totla phenolic content (TPC) and total flavonoid content (TFC), and using reducing power assay method. The ethyl acetate (EtOAc) fraction demonstrated the highest DPPH radical scavenging activity (IC50; 9.69 ㎍/㎖), and the highest TPC and TFC (345.98 ㎎·GAE/g, and 74.23 ㎎·QE/g). Moreover, it indicated the highest effects on nitric oxide production. Therefore, the active compound was separated using the EtOAc fraction, determined on the basis of spectral data, and identified as (+)-catechin.
The first compound separated was made from the leaf of C. wilsonii was (+)-catechin, which produced potent anti-oxidant and anti-inflammatory effects.
Keywords:
Cotoneaster wilsonii Nakai, Anti-oxidant, Anti-inflammatory, Catechin서 언
산소를 이용하여 호흡하는 생물체들은 활성 산소에 의해 자유라디칼 반응이 일어남에 따라 생체 내에서 암, 각종 성인병 및 노화가 발생된다 (Halliwell and Gutteridge, 1990). 이러한 자유라디칼 반응을 방지하기 위해서 항산화물질을 섭취함으로 질병 예방 및 노화억제를 예방한다 (Ramarathnam et al., 1995). 하지만 합성의약품인 BHA와 BHT 등은 안정성 여부에 대해서 이슈화 되며 소비자들의 기피현상이 발생하였다 (Branen, 1975). 이에 따라 천연물을 이용한 항산화제에 대한 관심이 급증하였고 항산화력이 우수한 물질의 개발과 연구가 활발하게 진행되고 있다.
섬개야광나무는 장미과 (Rosaceae)에 속한 식물로 울릉도의 해안가 절벽과 바위 지대에서 자생하는 한국 고유종으로 환경부 멸종위기 2급 식물이다. 학자들은 섬개야광나무 (C. multiflorus) 씨앗이 바닷물에 떠서 혹은 새나 바람에 옮겨와서 울릉도 환경 조건에 적응해 섬개야광나무로 분화했을 것으로 추측한다. 섬개야광나무의 높이는 1 m - 4 m이며, 잎은 어긋나며 2 ㎝ - 4 ㎝ 정도의 길이를 가지며 타원형, 달걀형 또는 거꾸로 선 달걀형의 모양이다. 잎자루는 길이가 2.5 ㎜ 정도이며 털이 있다 (Kim et al., 2002).
선행 연구에서 섬개야광나무의 잎, 열매, 줄기 메탄올 추출물의 항산화 및 항염 활성 비교 (Yoo et al., 2019) 를 통해 잎이 항산화 및 항염에 효과가 높은 것을 확인하였다. 따라서 섬개야광나무의 잎을 천연 항산화제 및 항염 물질로 사용 가능한 근거를 마련하고, 항산화 및 항염에 관련된 물질을 분리하고자 추가적인 연구를 진행하였다.
재료 및 방법
1. 섬개야광나무 잎 추출 및 분획
실험에 사용한 섬개야광나무 (C. multiflorus)잎은 강원도 자연환경연구원 (Hongcheon, Korea)에서 MeOH 조추출물을 제공받아 실험에 사용하였다. n-hexane, ethyl acetate (EtOAc), n-butanol, aqueous 순으로 극성 차이를 두고 분획하였다. MeOH 조 추출물 43.5 g을 증류수에 희석한 후, n-hexane로 분획하여 7.7 g을 얻었다. 남은 물 층에 ethyl acetate (EtOAc)로 분획하여 9.4 g을 얻었으며, 다시 남은 물 층에 n-butanol로 분획하여 8.6 g을 얻었다. 최종적으로 남은 aqueous 층은 17.4 g이였다. 각 분획 물은 감압농축기(N-1200A. Eyela Co., Ltd., Tokyo, Japan)를 이용하여 40℃에서 농축하였다.
2. 시약 및 기기
1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,6-di-tert-butyl-4-methylphenol (BHT), 3-tert-butyl-4-hydroxyanisole (BHA), α-tocopherol, ascorbic acid, gallic acid, sodium carbonate, quercetin, aluminium chloride, potassium acetate, trichloroacetic acid, 1-(4,5-dimethylthiazol-2-yl)-3,5-diphenyl-formazan (MTT), methanol-d6는 Sigma-Aldrich (St. Louis, MO, USA)사 제품을 사용하였다. 그 외에 항산화 및 물질분리에 사용된 시약은 Deajung (Siheung, Korea)사 및 Junsei (Tokyo, Japan)사의 프리미엄 급 제품을 사용하였다. HPLC-MS/MS 분석에서는 HPLC grade 물과 acetonitrile을 Avantor (Delaware, PA, USA)사 에서 구매하여 사용하였다.
실험에 사용된 기기는 UV/VIS spectrophotometer (V530, Jasco Co., Tokyo, Japan), ELISA (Model 680, Bio-Rad Inc., Hercules, CA, USA) 등을 사용하였으며, 1H-NMR 및 13C-NMR은 FT-NMR 600 MHz Spectrometer (Bruker Avance Neo 600, Bruker Co., Ltd., Billerica, MA, USA)를 사용하여 측정하였다. LC-MS/MS는 SCLEX (Cunningham, MA, USA)사의 QTRAP 4500로 분석하였다.
3. 항산화력 평가
DPPH free radical 소거 활성은 Blois (1958)의 방법을 변형하여 실험하였다. 양성대조군으로는 ascorbic acid, BHT, BHA, α-tocopherol를 사용하였으며, 0.1 ㎖의 서로 다른 농도의 시료에 0.15 mM 농도의 DPPH 용액 0.1 ㎖를 혼합 한 후 실온에서 30 분간 암반응 시켰다. 이 반응 액을 ELISA (Model 680, Bio-Rad, Hercules, CA, USA)를 이용하여 517 ㎚로 흡광도를 측정하였다. 실험 결과는 농도에 따른 소거능이 50%가 되는 시료농도를 구하여 IC50 값으로 나타내었다.
섬개야광나무 잎의 환원력 측정은 Oyaizu (1986)의 방법을 변형하여 측정하였다. 0.1 ㎖의 시료와 0.1 ㎖의 0.2 M sodium phosphate buffer (pH 6.6), 0.1 ㎖의 1% potassium ferricyanide, 0.1 ㎖의 10% trichloroacetic acid와 0.4 ㎖의 증류수를 섞어 준 후, 0.05 ㎖ ferric chloride를 넣은 즉시 UV/VIS spectrophotometer (V530, Jasco Co., Tokyo, Japan)로 700 ㎚에 흡광도를 측정하였다.
4. 총 페놀 및 총 플라보노이드 함량 측정
섬개야광나무 잎의 총 페놀 함량은 Singleton와 Rossi (1965)의 Folin-Ciocalteau 방법을 변형하여 실험하였다. 시료 0.1 ㎖를 Folin-Ciocalteu 시약 0.05 ㎖와 혼합 후 상온에서 3분간 안정화를 시킨 후에, 20% sodium carbonate를 0.3 ㎖ 넣어주었다. 15 분 반응 후에 증류수 1 ㎖를 혼합하여 UV/VIS spectrophotometer (V530, Jasco Co., Tokyo, Japan)로 725 ㎚에서 흡광도를 측정하였다. 시료의 총 페놀 함량은 다양한 농도의 gallic acid를 측정한 표준 검량 곡선으로부터 페놀화합물을 정량하여 추출물 g 당 gallic acid equivalence (㎎·GAE/g)로 나타내었다.
총 플라보노이드 함량은 Nieva Moreno 등 (2000)의 방법을 변형하여 측정하였다. 시료 0.1 ㎖, 10% aluminum nitrate 0.02 ㎖ 와 1 M potassium acetate 0.02 ㎖를 순차적으로 넣은 후, 80% ethanol 0.86 ㎖를 첨가하여 상온에서 40 분간 반응시킨 후 UV/VIS spectrophotometer (V530, Jasco Co., Tokyo, Japan)로 415 ㎚에서 흡광도를 측정하였다. 시료의 총 플라보노이드 함량은 다양한 농도의 quercetin을 측정한 표준검량 곡선으로부터 플라보노이드 화합물을 정량하여 추출물 g 당 quercetin equivalence (㎎·QE/g)로 나타내었다.
5. MTT assay
섬개야광나무 잎 추출물 및 분획 물에 대한 세포 독성은 Mosmann (1983)의 MTT 방법을 변형하여 측정하였다. 세포독성은 RAW264.7 세포로 평가 하였다. 세포는 96 well plate에 1 × 104 cells/well로 분주한 후 24 시간 동안 37℃, 5% CO2 incubator에서 배양하고 상층 액을 제거한 후에 농도별 (10, 50, 100, 200 ㎍/㎖)로 0.1 ㎖ 처리하였다. 24 시간배양 후 배지를 제거하고 phosphate-buffered saline (PBS)에 MTT를 500 ㎍/㎖의 농도로 처리하여 4 시간 후에 상층 액을 제거하고 DMSO 0.1 ㎖을 처리하였다. 10 분 후에 ELISA (Model 680, Bio-Rad Inc., Hercules, CA, USA)를 이용하여 540 ㎚에서 측정하였다.
6. Nitrite oxide (NO) 생성율 측정
섬개야광나무 잎 추출물 및 분획 물에 대한 NO 생성은 Green 등 (1982)의 griess reagent system을 변형하여 측정하였다. RAW264.7 세포를 1 × 105 cells/well로 96 well plate에 분주한 후 24 시간 동안 37℃, 5% CO2 incubator에서 배양하고 상층 액을 제거한 후에 LPS가 첨가된 농도 (10, 50, 100, 200 ㎍/㎖)로 0.1 ㎖ 처리하였다. 24 시간 배양 후 상등액 0.05 ㎖와 griess reagent [A reagent: 5% phosphoric acid에 녹인 1% sulfanilamide + B reagent: 물에 녹인 0.1% n-(1-naphthyl)-ethylenediamine dihydrochloride] 0.05 ㎖를 혼합하여 반응 시킨 후 ELISA (Model 680, Bio-Rad, Hercules, CA, USA)를 이용하여 540 ㎚에서 측정하였다.
7. 화합물 분리
가장 높은 항산화 활성을 가지는 EtOAc 층을 대상으로 화합물의 분리를 하였다. Silica gel (Merck Co., Darmstadt, Germany, 0.2 ㎜ - 0.5 ㎜) column으로 용매를 CHCl3 : MeOH = 8 : 2로 용출시켜서 11 개의 소분획 (CW-1 - CW-11)으로 나누었다. 이 중 CW-2 그룹을 다시 silica gel (Merck, Darmstadt, Germany, 0.2 ㎜ - 0.5 ㎜) column으로 용매를 CHCl3 : MeOH = 8 : 2로 용출시켜서 4 개의 소분획 (CW-2-1 - CW-2-4)을 얻었다. CW-2-2 그룹을 다시 ODS (YMC gel, Yawata, Japan, ODS-A, 75 ㎛) column으로 용매를 MeOH : H2O = 4 : 6으로 용출시켜서 4 개의 소분획 (CW-2-2-1 - CW-2-2-4)을 얻었다. 이 중 CW-2-2-2에서 화합물 1 (20 ㎎)을 얻었다.
8. Statistical analysis method
각각의 측정값은 3 회 이상 분석하여 평균 ±표준편차로 나타내었고, 실험결과 간의 유의차 분석은 IBM SPSS Statistic 24 Software (Armonk, NY, USA)를 이용하여 One-way ANOVA와 Duncan's LSR test를 실시하여 p < 0.05의 유의수준에서 검정하였다.
결과 및 고찰
1. 섬개야광나무 잎 추출물 및 분획물의 항산화 활성
섬개야광나무 (C. multiflorus) 잎 추출물 및 분획 물에 대한 DPPH radical 소거 활성을 측정한 결과는 잎 메탄올 조추출물 22.74 ± 0.16 ㎍/㎖, n-hexane 분획 물 38.46 ± 0.69 ㎍/㎖, EtOAc 분획 물 9.69 ± 0.45 ㎍/㎖, n-BuOH 분획물 14.60 ± 0.20 ㎍/㎖, aqueous 층 32.35 ± 0.35 ㎍/㎖의 IC50 값을 나타내었다 (Table 1). 이 중 EtOAc 분획 물이 가장 높은 항산화 효과를 보였으며, 항산화제로 쓰이는 BHT (127.46 ㎍/㎖), BHA (16.09 ㎍/㎖), α-tocopherol (12.33 ㎍/㎖)보다 높은 활성을 나타내었다. 이에 따라 항산화제로의 이용 가능성을 확인할 수 있었다.
Kicel 등 (2019)가 보고한 섬개야광나무 (C. integerrimus) 잎 추출물의 EC50값이 23.8 ± 1.20 ㎍/㎖을 갖는다는 보고와 비교하여 볼 때, 비슷한 활성을 가짐을 확인할 수 있었다.
섬개야광나무의 잎 추출물 및 분획 물은 각각 100, 500, 1,000 ㎍/㎖ 로 처리하였다. EtOAc 분획 물에서 가장 높은 환원력을 나타냈고, 다음으로는 n-BuOH 분획 물이 높은 환원력을 나타내었다. EtOAc 분획 물의 경우 500, 1,000 ㎍/㎖ 농도로 처리하였을 때는 positive control인 ascorbic acid와 비슷한 활성을 나타내었다 (Fig. 1). 이는 앞서 실험한 DPPH radical 소거 활성 실험과 유사한 결과로써 항산화 활성이 높으면 환원력도 높은 흡광도를 가진다는 Kim 등 (2005)의 연구결과와 유사하다.
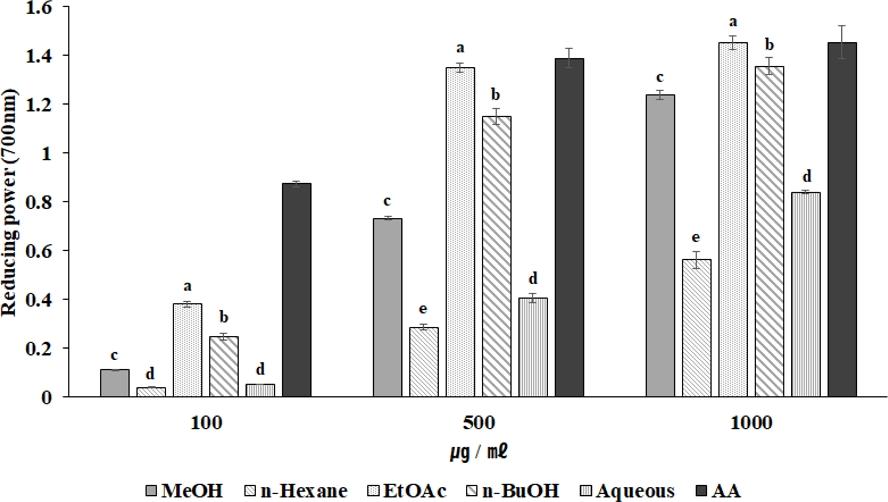
Reducing power of extraction and fractions from C. wilsonii Nakai leaf. AA; ascorbic acid. Each data value is means ± standard deviation of three replicate experiments. *The all data were analyzed statistically through Duncan's LSR test. And significant differences were evaluated at 5% level of probability (p < 0.05).
2. 섬개야광나무 잎 추출물 및 분획물의 총 페놀 및 플라보노이드 함량
섬개야광나무의 추출물 및 분획물의 total phenol 함량은 EtOAc 분획 물 (345.98 ± 1.98 ㎎·GAE/g) > n-BuOH 분획물 (258.07 ± 4.03 ㎎·GAE/g) >MeOH 추출물 (170.47 ± 0.46 ㎎·GAE/g) > aqueous 분획 물 (130.43 ± 2.47 ㎎·GAE/g) > n-hexane 분획 물 (81.48 ± 4.94 ㎎·GAE/g)순으로 높게 나타났으며, total flavonoid 함량 또한 EtOAc 분획 물에서 74.23 ± 2.67 ㎎·QE/g로 가장 높게 나타났다 (Table 2). 이러한 결과는 페놀 및 플라보노이드 성분은 높은 항산화 활성을 가진다는 연구결과 (Shahidi et al., 1992)를 보았을 때, 섬개야광나무 잎의 높은 항산화 활성은 많은 페놀과 플라보노이드의 함량으로 인한 결과라도 판단되어 진다.
3. Nitric oxide (NO) 생성율 측정을 통한 섬개야광나무 잎 추출물 및 분획물의 항염 활성
활성 산소종이 과다하게 발생하게 되면 세포 조직, DNA 등에 손상을 입히게 되면서 염증이 유발 혹은 악화 시킬 수 있다. 따라서 항산화 물질을 이용하여 활성 산소종을 조절해야 한다 (Wiseman, 1996).
섬개야광나무 잎 추출물 및 분획물의 항염 활성을 확인하기 위하여 대식세포인 RAW264.7을 사용하여 실험하였다. 세포독성을 측정하기 위하여 부위별 추출물을 다양한 농도별 (10, 50, 100, 200 ㎍/㎖)로 처리하였다. 잎 메탄올 조추출물은 200 ㎍/㎖에서 74%의 세포생존율, n-hexane 분획 물에서 56%의 생존율을 보였으며, 다른 분획 물에서는 87% 이상의 생존율을 보였다 (Fig. 2).
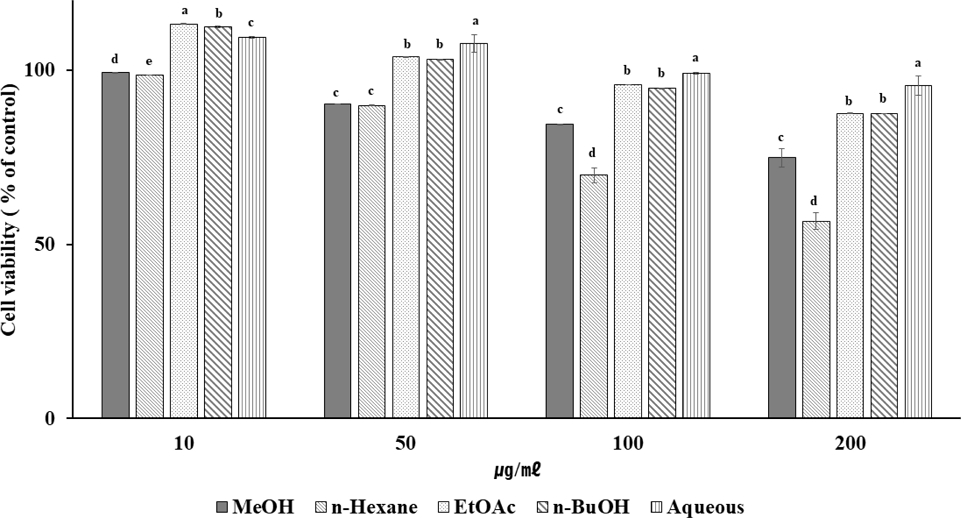
Inhibitory effect of extraction and fractions from C. wilsonii Nakai on cytotoxicity of RAW264.7 cell. Each data value is means ± standard deviation of three replicate experiments. *The all data were analyzed statistically through Duncan's LSR test. And significant differences were evaluated at 5% level of probability (p < 0.05).
RAW264.7 세포에 추출물 및 분획 물을 다양한 농도 (10, 50, 100, 200 ㎍/㎖)로 처리하고, 염증유발 물질인 LPS 자극을 주어 NO 생성량을 측정하였다. 그 결과, 모든 층에서 농도와 비례해서 NO 생성이 줄어드는 것을 확인할 수 있었으며, 항산화가 가장 높았던 EtOAc 층에서 가장 높은 억제 효과를 가짐을 확인하였다 (Fig. 3). 섬개야광나무 잎 추출물이 RAW264.7 세포내에서 NO 생성을 억제하는 것을 확인하였고, 염증을 억제 및 조절할 수있는 천연물질로써 이용 가능성을 확인하였다.
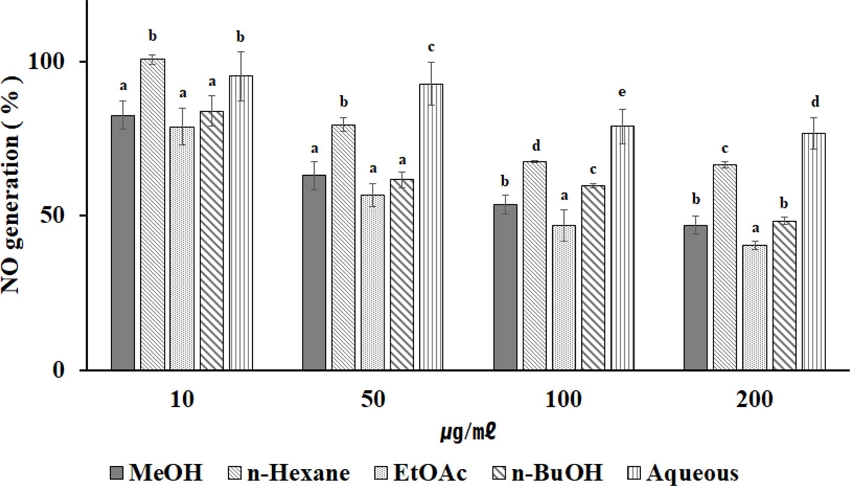
The effect of C. wilsonii Nakai leaf extraction and fractions on LPS-induced NO production in RAW264.7 cell. Each data value is means ± standard deviation of three replicate experiments. *The all data were analyzed statistically through Duncan's LSR test. And significant differences were evaluated at 5% level of probability (p < 0.05).
4. 분리된 항산화 물질의 구조 동정
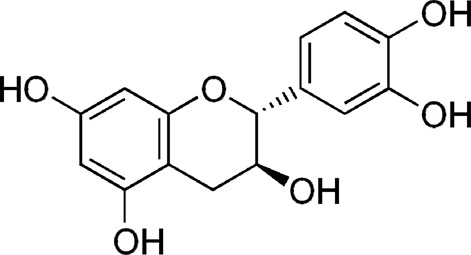
Open column을 통해 분리된 화합물 1의 구조 해석을 위해 1H-NMR, 13C-NMR, LC-MS/MS를 분석하였다. LC-MS/MS (negative mode) m/z 289 [M−H]−, 1H NMR (600 MHs, Methanol-d6) δ: 6.85 (1 H, d, J=1.8 Hz, H-2'), 6.78 (1 H, d, J=8.1 Hz, H-5'), 6.73 (1 H, dd, J=6.3 and 1.8 Hz, H-6'), 5.94 (1 H, d, J=2.2 Hz, H-8), 5.87 (1 H, d, J=2.2 Hz, H-6), 4.58 (1 H, d, J=7.5 Hz, H-2), 3.99 (1 H, m, H-3), 2.86 (1 H, dd, J=10.6 and 5.4 Hz, H-4b), 2.52 (1 H, dd, J=8.2 and 7.9 Hz, H-4a) 13C NMR (600 MHz, methanol-d6) δ: 156.45 (C-8), 156.18 (C-6), 155.52 (C-10), 144.85 (C-4'), 144.83 (C-3'), 130.83 (C-1'), 118.63 (C-6'), 114.67 (C-2'), 113.86 (C-5'), 99.41 (C-5), 94.88 (C-7), 94.10 (C-9), 81.46 (C-2), 67.42 (C-3), 27.12 (C-4). 그 결과, 화합물 1은 (+)-catechin으로 동정되었다 (Fig. 4).
고 찰
섬개야광나무 잎에 대한 항산화 활성 검정 및 항염 활성 검정을 통해 항산화 및 항염에 이용 가능한 천연 물질로서 확인하기 위해 DPPH free radical 소거 활성 검정, 환원력 측정, 총 phenol 및 flavonoid 함량 측정을 실시하였으며, 물질 분리를 진행하였다. 그 결과 모든 실험에서 EtOAc 분획 물에서 가장 높은 항산화 활성을 보였다. DPPH free radical 소거활성에서 9.69 ± 0.69 ㎍/㎖의 IC50 값으로 항산화제로 이용되는 BHT, BHA 보다 높은 활성을 보였으며, α-tocopherol보다 높은 활성을 보였다. 총 phenol과 flavonoid는 각각 345.98 ± 1.98 ㎎·GAE/g, 74.23 ± 2.67 ㎎·QE/g이며, 환원력 측정에서도 ascrobic acid와 비슷한 효과를 보였다.
LPS로 산화적 스트레스를 유발시킨 RAW264.7 세포에 염증유발 물질인 NO 생성량을 측정한 결과 잎 추출물 및 분획물에서 모두 negative control에 비해 농도 의존적으로 NO의 생성량이 감소하는 것을 확인할 수 있었다. 특히 EtOAc 분획물에서는 200 ㎍/㎖에서 NO 생성이 40%까지 감소하였다 (Fig. 4). 이는 Lee 와 Cho (2015)가 보고한 활성 산소종으로 인해 발생한 산화적 스트레스가 항산화제에 의해 차단되면 염증반응이 억제된다는 결과와 일치한다. 따라서 섬개야광나무잎의 추출물 및 분획물의 항염 효과는 앞서 보고한 섬개야광나무의 강력한 항산화력에 기인한다고 생각되어 진다.
항산화 활성이 가장 높은 EtOAc 분획 물을 통해 1 개의 화합물을 분리해내었으며 (+)-catechin으로 동정하였다 (Fig. 5). (+)-Catechin은 항염 (Serafini et al., 2010) 및 항산화 (Yang et al., 2001)에 효과가 있다고 알려진 플라보노이드 계열의 물질이다. 이에 따라 (+)-catechin의 항산화력을 평가하기 위해 DPPH radical 소거 활성을 진행한 결과, IC50 값이 16.05 ± 0.20 μmol로 확인 되었으며 19.98 ± 0.07 μmol의 IC50 값을 가지는 α-tocopherol보다 높은 항산화력을 갖는 것을 확인하였다. 또한 RAW264.7 세포를 이용하여 세포 독성 및 NO 생성율을 확인한 결과, 200 μmol을 처리하였을 때 83.62 ± 3.11%의 세포생존율을 보였으며 NO 생성율은 45.08 ± 3.59% 였다 (data not shown). 이는 섬개야광나무의 높은 항산화 및 항염 효과를 뒷받침 해준다.
본 연구결과는 섬개야광나무 잎의 유효성분 분리를 통해 섬개야광나무 잎의 높은 항산화 및 항염의 근거를 확인하였으며, (+)-catechin을 분리하였다. 따라서, 섬개야광나무 잎 추출물이 천연 항산화제 및 항염증제로 이용하기 위한 기초자료를 제시하였다.
Acknowledgments
본 연구는 2019년 대학혁신지원사업 도전연구비지원 프로그램의 지원에 의해 수행되었으며 이에 감사드립니다.
References
-
Blois MS. (1958). Antioxidant determinations by the use of a stable free radical. Nature. 181: 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Branen AL. (1975). Toxicology and biochemistry of butylated hydroxyanisole and butylated hydroxytoluene. Journal of the American Oil Chemists’ Society. 52:59-63.
[https://doi.org/10.1007/BF02901825]

-
Green DR and Kroemer G. (2005). Pharmacological manipulation of cell death: Clinical applications in sight? Journal of Clinical Investigation. 115:2610-2617.
[https://doi.org/10.1172/JCI26321]

-
Halliwell B and Gutteridge JMC. (1990). The importance of free radicals and catalytic metal ions in human diseases. Molecular Aspects of Medicine. 8:89-193.
[https://doi.org/10.1016/0098-2997(85)90001-9]

-
Kicel A, Owczarek A, Gralak P, Ciszewski P and Olszewska MA. (2019). Polyphenolic profile, antioxidant activity, and pro-inflammatory enzymes inhibition of leaves, flowers, bark and fruits of Cotoneaster integerrimus: A comparative study. Phytochemisty Letters. 30:349-355.
[https://doi.org/10.1016/j.phytol.2019.02.027]

- Kim TC, Bae KS, Kim IK and Chun HJ. (2005). Antioxidative activities of solvent extracts from blueberry. Korean Journal of Oriental Physiology and in Korean Pathology. 19:179-183.
-
Kim YS, Chang CS, Shin HT, Kim H and Choi DY. (2002). Conservational status of Cotoneaster wilsonii on island Ulleung-do. Korean Journal of Plant Taxonomy. 32:159-175.
[https://doi.org/10.11110/kjpt.2002.32.2.159]

-
Lee SE and Cho SI. (2015). Anti-inflammatory effects of Salviae Miltiorrhizae Radix extract on RAW264.7 cell. via anti-oxidative activities. Korea Journal of Herbology. 30:89-94.
[https://doi.org/10.6116/kjh.2015.30.4.89.]

-
Mosmann T. (1983). Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65:55-63.
[https://doi.org/10.1016/0022-1759(83)90303-4]

-
Nieva Moreno MI, Isla MI, Sampietro AR and Vattuone MA. (2000). Comparison of the free radical-scavenging activity of propolis from several regions of Argentine. Journal of Ethnopharmacology. 71:109-114.
[https://doi.org/10.1016/S0378-8741(99)00189-0]

-
Oyaizu M. (1986). Studies on products of browning reactions: Antioxidative activities of products of browning reaction prepared from glucosamine. Japanese Journal of Nutrition. 44:307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Ramarathnam N, Osawa T, Ochi H and Kawakishi S. (1995). The contribution of plant food antioxidants to human health. Trends in Food Science and Technology. 6:75-82.
[https://doi.org/10.1016/S0924-2244(00)88967-0]

-
Serafini M, Peluso I and Raguzzini A. (2010). Flavonoids as anti-inflammatory agents. Proceedings of the Nutrition Society. 69:273-278.
[https://doi.org/10.1017/S002966511000162X]

-
Shahidi F, Janitha PK and Wanasundara PD. (1992). Phenolic antioxidants. Critical Reviews in Food Science and Nutrition. 32:67-103.
[https://doi.org/10.1080/10408399209527581]

- Singleton VL and Rossi JA. (1965). Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16:144-158.
-
Wiseman H. (1996). Dietary influences on membrane function: Impotent in protection against oxidative damage and disease. Journal of Nutritional Biochemistry. 7:2-15.
[https://doi.org/10.1016/0955-2863(95)00152-2]

-
Yang B, Kotani A, Arai K and Kusu F. (2001). Relationship of electrochemical oxidation of catechins on their antioxidant activity in microsomal lipid peroxidation. Chemical and Pharmaceutical Bulletin. 49:747-751
[https://doi.org/10.1248/cpb.49.747]

- Yoo NH, Kim HK, Lee CO, Park JH and Kim MJ. (2019). Comparison of anti-oxidant and anti-inflammatory activities of methanolic extracts obtained from different parts of Cotoneaster wilsonii Nakai. Korean Journal of Medicinal Crop Science. 27:194-201.