식물정유 10 종의 라디칼 소거 활성과 주요 활성 성분의 탐색
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
A growing interest in health has increased the need for the development of potent antioxidant materials known to play a role in various physiological activities. Currently research and development of non-toxic natural antioxidants with high activity is ongoing.
In this study, we measured 2,2′-azinobis- (3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) and 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical scavenging ability of 10 plant essential oils, selecting samples of Dendranthema indicum, Dendranthema zawadskii, and Citrus sunki essential oils. The samples were analyzed using liquid chromatography (LC) and the radical scavenging activity on LC-based systems with the same conditions. In the LC-mass spectroscopy (MS)/MS analysis of the active compound peak, 2-methoxy-4-vinylphenol with a molecular weight of 150.1 g/㏖ was identified in C. sunki essential oils. Eugenol or isoeugenol with a molecular weight of 164.1 g/㏖ as identified in D. indicum and D. zawadskii essential oils as radical scavenging active compounds.
In the LC-based measurement system, the active ingredient can be identified by simultaneously conducting profile analysis and the radical scavenging activity of essential oil samples. In addition, LC-MS/MS analysis of the active compound peaks can be performed under the same separation conditions to obtain data that can identify the active compounds in the sample.
Keywords:
Essential Oil, ABTS Radical, DPPH Radical, Antioxidant, LC, Mass Spectroscopy서 언
건강한 삶에 대한 관심이 높아지면서 다양한 생리활성에 관여하는 것으로 알려진 항산화 활성 소재의 개발에 대한 요구가 증가되고 있다. 다양한 연구들에서 항산화 활성의 대상이 되고 있는 활성산소 (reactive oxygen species, ROS)는 hydroxyl radical (·OH), peroxyl radical (ROO·), superoxide anion (·O2−) 등의 free radical들이다. 이는 체내 호흡을 통한 에너지 생성 과정에서 필연적으로 발생되며, 활성산소가 순간적으로 과량 생성되거나 만성적인 영향을 끼치게 되면 세포조직에 손상을 주게 된다 (Devasagayam et al., 2004). 활성산소에 의한 세포손상의 예로는 DNA 변성, 세포막 손상, 단백질 변성 등이 있으며 (Valko et al., 2007), 피부노화나 염증반응, 암 등 각종 질환을 일으키는 요소로 작용한다 (Wickens, 2001; Lee et al., 2015).
생체 내에는 활성산소로부터 세포를 보호하기 위하여 superoxide dismutase, glutathione peroxidase 등의 항산화 효소를 분비하여 대처하는 체계를 가지고 있다. 이와 함께 외부적으로 공급할 수 있는 비효소적 항산화 물질로서 butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT)와 같은 고활성의 합성 항산화제를 활용할 수도 있으나 간손상이나 발암 등의 독성 문제로 인해 ascorbic acid, tocopherol과 같은 천연 항산화 성분의 사용이 바람직한 것으로 알려져 있다 (Gaunt et al., 1965; Devasagayam et al., 2004). 이에 따라 식물 추출물과 같은 천연물로부터 독성이 없으면서 일정 수준의 항산화 활성을 가지는 천연 항산화 소재에 대한 연구와 개발이 지속적으로 이루어지고 있다 (Kim et al., 2018; Yoo et al., 2019).
다양한 약용작물의 연구 및 이용에 있어서 그 활용도가 높아지고 있으며, 각종 식물에 함유되어 있는 방향성이 강한 물질인 정유 (essential oil)는 저비점의 기름성 물질로 공기 중에 쉽게 휘산되며, 식물의 생명유지에 있어서 필수적인 2차 대사산물이다 (Bakkali et al., 2008). 일반적으로 모노테르펜 (monoterpene)류를 중심으로 하는 테르펜 화합물이 주성분으로 알려져 있으나 정유의 원료 식물에 따라 성분조성이나 함량이 다르며, 이로 인해 각 정유가 가지는 생리활성도 달라진다. 정유에 따라 피부에 관련된 활성으로서 여드름을 원인균의 성장을 억제시키는 항균활성 및 피부와 모공 개선 효과를 가지거나 (Kim et al., 2013), 스트레스 저감 및 심신 안정효과가 있는 것으로 알려져 있다 (Holmes and Ballard, 2004). 또한 정유가 가지는 항산화 활성 등에 대한 관심이 높아지면서, 다양한 식물 정유들이 식품이나 화장품 등의 제품에 천연 향신료나 산화방지제 등으로 이용되고 있다 (Holmes and Ballard, 2004; Lin et al., 2007; Kim, 2011; Kim et al., 2013).
식물 추출물과 같은 천연물 분석 분야에서 활용되는 profile 분석은 일반적으로 자외선 검출기와 결합된 액체크로마토그래피 (liquid chromatography; LC) 장비를 사용한다. 이러한 profile 분석은 지표성분이나 유효성분을 특정하지 못한 시료의 분석이나 물질 분리 조건 설정 등을 위한 단계에서 유용하게 활용되고 있다. Profile 분석과 동일한 조건에서 분리를 실시한 후 항산화 활성을 측정하기 위한 radical 용액과 반응시킬 수 있다면 분리된 물질의 개별적인 radical 소거 활성을 측정할 수 있게 된다. 최근 들어 LC 분석 장비를 기반으로 한 시스템을 실시간 물질 분리 및 항산화 활성 연구가 다양한 시료를 대상으로 국내외에서 진행되고 있다 (Inoue et al., 2012; Im et al., 2017). 한편, LC의 검출기 중 하나로 활용될 수 있는 질량분석기 (mass spectroscopy; MS)는 각종 성분의 정성이나 정량분석에서 활용도가 높아지고 있다. 특히 구성 성분이 다양하여 일반적인 크로마토그래피 조건에서 완벽한 분리가 쉽지 않고 모든 성분에 대한 표준품 확보가 어려운 천연물 유래의 소재 연구에서 기초적이며, 예비적인 정성분석의 도구로서 유용하게 활용될 수 있다.
본 연구에서는 10 종의 식물 정유를 대상으로 2,2-diphenyl-1-picrylhydrazyl (DPPH)와 2,2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid) (ABTS) radical 소거능을 측정하여 상대적으로 우수한 소거능을 가지는 정유 시료를 선별한 후 LC profile 분석과 radical 소거 활성, 그리고 질량분석을 동일한 분리 조건에서 수행하는 스크리닝 분석시스템에서 분석을 실시하여 정유 시료 중의 개별 항산화 활성 성분을 탐색하였다.
재료 및 방법
1. 정유 시료의 조제
정유 (essential oil) 추출은 수증기증류법 (hydrodistillation)으로 추출하였다. 10 ℓ 둥근 플라스크에 약 1 ㎏의 시료를 넣고 시료가 잠길 정도의 증류수를 첨가하였다. 시료가 담긴 둥근 플라스크는 102 ± 1℃에서 가열용 맨틀 (MS-DM608 heating mantle, MTOPS®, Yangju, Korea)을 이용하여 가열되었다. 열에 의해 증발된 증기는 냉각관에서 응축된 후 dean stark trap에서 수집되었다.
정유의 양이 더 이상 늘어나지 않을 때까지 추출하였으며, 물과 정유가 응축되어 있는 트랩에서 물을 제거한 후 정유를 얻었다. 정유에 남아 있는 수분을 anhydrous sodium sulfate (Samchun Co., Ltd., Pyeoungtaek, Korea, 98.5%)를 사용하여 최종적으로 제거한 후 4℃에서 냉장 보관하였다. 추출된 정유의 수율은 다음의 공식에 의하여 계산하였다.
2. ABTS radical 소거능 측정
정유 시료의 항산화 활성을 확인하기 위해 2,2'-azino-bis(3-ethylbenzthiazoline -6-sulfonic acid) (ABTS) radical 소거능을 측정하였다 (Re et al., 1999). 시료는 methanol에 희석하여 0.005 - 1% 농도로 준비하였다. 7.4 mM ABTS와 2.6 mM potassium persulfate를 혼합 후 상온, 암소에서 4 시간 동안 방치하여 radical을 형성하고, 실험 직전 735 ㎚에서 흡광도가 0.700 ± 0.050가 되도록 증류수로 희석하였다.
시료액 20 ㎕와 ABTS용액 180 ㎕를 혼합하여 30 분간 암실에서 방치한 후 735 ㎚에서 흡광도를 측정하였다. 측정된 흡광도를 바탕으로 50%의 ABTS radical을 소거하는데 필요한 농도 (SC50)를 계산하였다. Positive control로 ascorbic acid와 BHA를 사용하였다.
3. DPPH radical 소거능 측정
정유 시료의 항산화 활성을 확인하기 위해 2,2-diphenyl-1-picrylhydrazyl (DPPH)을 이용하여 radical 소거능을 측정하였다 (Blois, 1958). 시료는 methanol에 희석하여 0.005 - 1% 농도로 준비하였다. Methanol을 이용해 100 μM로 용해시킨 DPPH 용액 180 ㎕와 시료액 20 ㎕를 혼합한 후 암실에서 20 분간 반응시켜 517 ㎚에서 흡광도를 측정하였다.
측정된 흡광도를 바탕으로 50%의 DPPH radical을 소거하는데 필요한 농도 (SC50)를 계산하였다. Positive control로 ascorbic acid와 BHA를 사용하였다.
4. 정유성분의 LC profile과 radical 소거 활성 동시 측정
정유 시료의 LC profile 확인과 radical 소거능 동시 측정을 위해 LC-30A (Shimadzu Co., Kyoto, Japan) 액체크로마토그래피와 column으로서 Kinetex C18 (2.1 ㎜ × 150 ㎜, 2.6 ㎛, Phenomenex, Torrance, CA, USA)을 기본 장비 구성으로 하여 분석을 실시하였다. 1% 농도로 methanol에 희석시킨 정유를 측정에 사용하였으며, 시료 주입량은 1 ㎕, column oven은 40℃를 유지하였다. 이동상으로 water (A)와 methanol (B)을 사용하여 초기 2% B에서 시작하여 100% B까지 순차적으로 변화시킨 후 다시 0% B로 낮춰서 90 분간 분석을 실시하였으며, 유속은 0.3 ㎖/min으로 유지하였다.
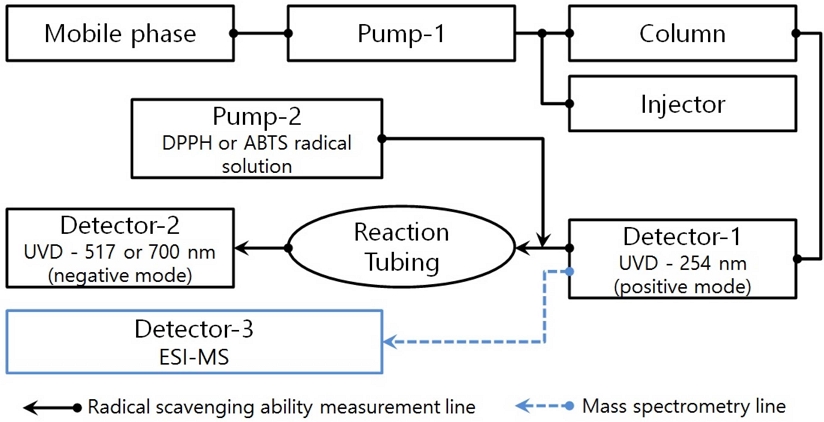
전체적인 시스템의 구성은 Fig. 1과 같이 구성하였으며, radical 용액을 공급하기 위해 추가로 LC-20AD pump (Shimadzu Co., Kyoto, Japan)를 설치하였다. Column에서 분리된 시료액과 radical 용액이 혼합된 이후 radical 소거 반응을 위해 길이 1 m의 reaction tubing을 설치하였다. DPPH radical 소거 활성 측정에는 methanol에 50 μM로 용해시킨 DPPH 용액을 사용하였으며, 유속은 0.2 ㎖/min으로 유지하면서 negative mode의 517 ㎚에서 검출을 수행하였다.
ABTS radical 소거 활성 측정에는 7.4 mM ABTS와 2.6 mM potassium persulfate를 혼합 후 상온, 암소에서 4 시간 동안 방치하여 형성된 radical을 측정 직전에 700 ㎚에서 흡광도가 0.700 ± 0.050가 되도록 증류수로 희석한 용액을 사용하였으며, 유속은 0.2 ㎖/min으로 유지하면서 negative mode의 700 ㎚에서 검출을 수행하였다.
5. Radical 소거 활성 성분의 LC-MS/MS 분석
Radical 소거 활성 성분에 대한 질량분석에는 LC-30A (Shimadzu Co., Kyoto, Japan) 액체크로마토그래피와 연동된 LCMS-8050 (Shimadzu Co., Kyoto, Japan) 삼중사중극자 질량분석기 (triple quadrupole mass spectroscopy; MS/MS)를 사용하였으며, Fig. 1의 LC profile과 radical 소거 활성 동시측정 조건과 동일한 분리 조건을 적용하여 electro-spray ionization (ESI) 장치로 시료를 이온화시킨 후 분석을 실시하였다.
결과 및 고찰
1. 정유 시료의 ABTS 및 DPPH radical 소거능
항산화 활성 관련 연구에서 빈번하게 이용되는 DPPH radical과 ABTS radical 소거능 측정은 각각의 radical 물질과 소거 활성 물질이 결합함으로써 색상이 변하는 정도를 분광학적으로 측정하는 원리를 활용하게 된다. 안정한 radical 형태인 DPPH의 경우 활성 물질에서 전자를 받아 비 radical 형태로 변하게 된다는 것과 유리기들이 반응하여 만들어진 양이온 형태의 ABTS가 활성 물질에 의해 환원된다는 것이 두 가지 측정의 차이로 알려져 있다 (Yu et al., 2002). 또한 ABTS는 양이온 radical을, DPPH는 음이온 radical을 생성하는 차이가 있으며, 이 두 가지 방법은 기질과 반응물질의 결합 정도가 서로 달라 측정 결과가 상이할 수도 있다고 알려져 있다 (Lee et al., 2012).
ABTS radical 소거능에서 감국 [Dendranthema indicum (L.) DesMoul.] 정유가 0.00684%의 SC50 값으로 가장 높은 소거능을 나타내었다. 구절초 [Dendranthema zawadskii var. latilobum (Maxim.) Kitam.] 정유가 0.00857%의 SC50 값으로 감국 정유 다음으로 높은 소거능을 보였으며, 나머지 정유들의 소거능은 감국과 구절초에 비해 낮은 소거능을 가지는 것으로 나타났다. 특히 실화백 [Chaemaecyparis pisifera (Sieb. & Zucc.) Endl.]과 갯기름나물 (Peucedanum japonicum Thunb.) 정유는 0.2% 이상의 SC50 값을 가지는 것으로 나타나 현저히 낮은 ABTS radical 소거능을 가지는 것으로 확인되었다.
DPPH radical 소거능에서도 감국 정유가 0.3300%의 SC50 값으로 가장 높은 활성을 나타냈으며, 진귤 (Citrus sunki Hort. ex Tanaka)과 순비기열매 (Vitex rotundifolia L.f.) 정유가 0.3450%와 0.4300%의 SC50 값으로 감국 정유 다음으로 높은 소거능을 보였다. 실화백과 갯기름나물, 그리고 리기다소나무 (Pinus rigida Mill.) 정유는 2% 이상의 SC50 값을 가지는 것으로 나타나 다른 정유 시료에 비해 현저히 낮은 DPPH radical 소거능을 가지는 것으로 확인되었다.
ABTS radical 소거능에서 보여준 감국과 구절초 정유의 활성은 수목 방향유 15 종에 대한 항산화 활성 관련 연구에서 밝히고 있는 고활성 소재인 clove bud 정유보다는 다소 낮았으나 두 번째로 높은 활성을 가진 것으로 보고한 붓순나무 (Illicium anisatum) 정유보다는 높은 소거능이었다. 또한 감국과 진귤 정유의 DPPH radical 소거능은 동일한 기존 연구에서 확인된 clove bud와 붓순나무 정유의 활성보다 낮았으며, 왕초피나무 (Zanthoxylum coreanum)와 곰취 (Ligularia fischeri) 정유의 활성과 유사한 radical 소거능임을 알 수 있었다 (Jo et al., 2018).
2. 정유 시료의 LC profile 분석 및 radical 소거 활성
정유 시료를 대상으로 측정한 radical 소거능 결과를 바탕으로 상대적으로 활성이 높은 시료를 선별하여 액체크로마토그래피 (LC) 기반의 시스템에서 profile 분석과 radical 소거 활성을 동시에 측정하는 추가적인 분석을 실시하였다. 즉, ABTS radical 소거능에서 높은 활성을 나타낸 감국과 구절초 정유와 DPPH radical 소거능에서 감국 정유 다음으로 높은 소거능이 확인된 진귤 정유 등 총 3 종의 분석 대상 정유를 선별하였다. 앞선 연구들에서 profile 분석과 동일한 조건에서 분리를 실시한 후 항산화 활성을 측정하기 위한 radical 용액과 반응시켜 LC에서 분리된 물질의 개별적인 radical 소거 활성을 측정할 수 있음을 보고하고 있다 (Inoue et al., 2012; Im et al., 2017). 본 연구에서도 Fig. 1과 같은 측정 시스템을 사용하여 ABTS와 DPPH radical 소거 활성을 측정하였으며, Fig. 2에 그 결과를 제시하였다.
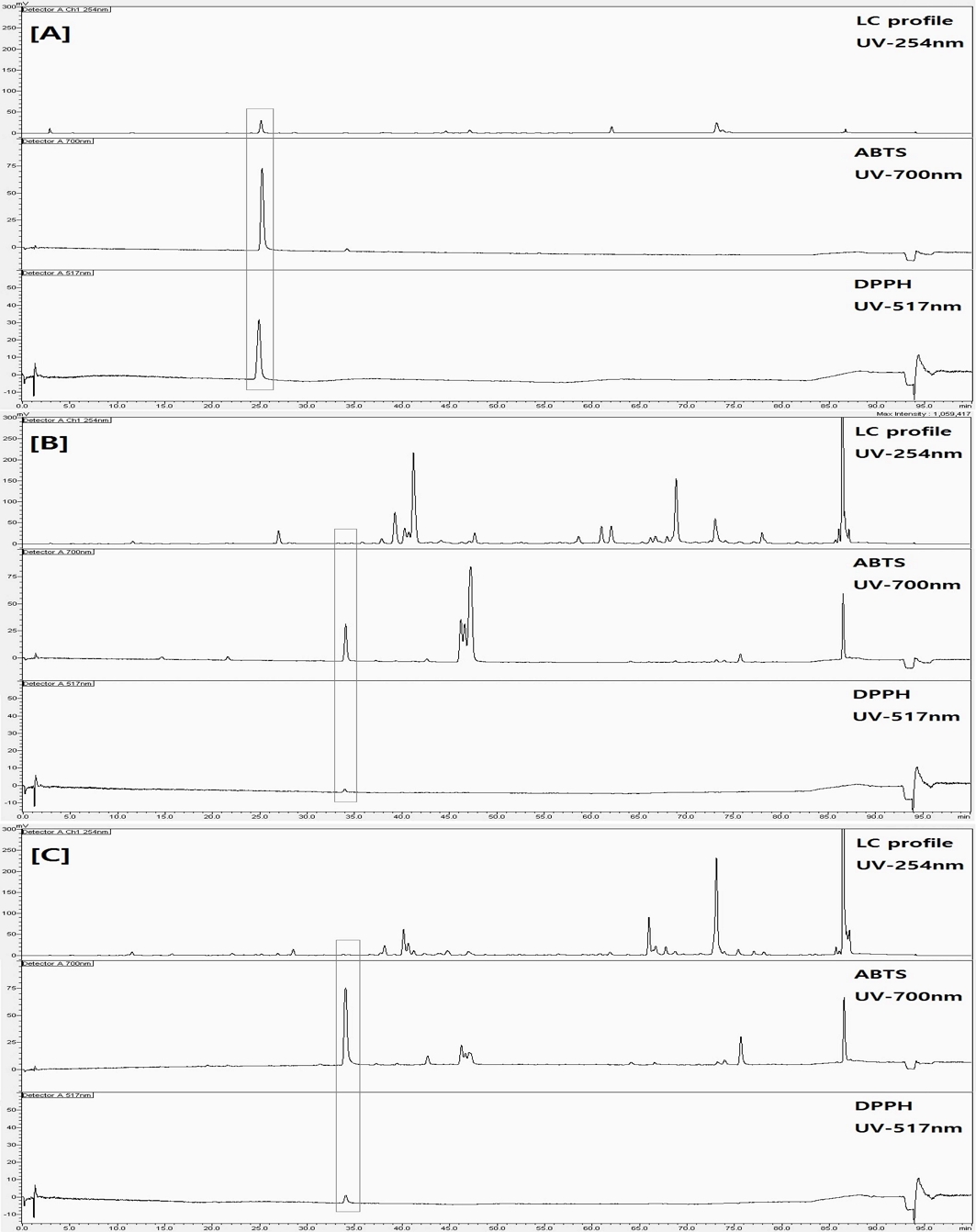
LC-UV detector profiles and radical scavenging effects of essential oils.[A]; chromatograms of Citrus sunki. [B]; chromatograms of Dendranthema zawadskii. [C]; chromatograms of Dendranthema indicum. Peak of the same retention time in the square is the radical scavenging active compound.
Fig. 2 [A]와 같이 진귤 정유의 분석 결과에서 retention time 25 분 위치의 성분이 ABTS와 DPPH radical 소거 활성을 가지는 것으로 확인되었다. 구절초 정유의 경우 Fig. 2 [B]와 같이 ABTS radical을 소거하는 성분이 retention time 34 분과 46 - 47 분, 75 분, 그리고 86 분 부근에서 확인되었으며, DPPH radical을 소거하는 성분은 retention time 34 분에서만 나타났다. 감국 정유의 경우 Fig. 2의 [C]에 나타난바와 같이 구절초 정유와 유사한 retention time에서 ABTS radical을 소거하는 성분과 DPPH radical을 소거하는 성분이 확인되었다. 감국과 구절초 정유에서 유사한 결과를 보인 것은 두 정유 식물이 국화과 (Compositae)의 동일한 산국속 (Dendranthema)에 속하는 특성이 반영된 것으로 판단된다.
3. Radical 소거 활성 성분의 LC-MS/MS 분석
감국과 구절초, 진귤 정유 시료 분석 결과에서 확인된 주요 radical 소거 활성 peak에 대한 질량분석을 Fig. 1과 같이 LC profile과 radical 소거 활성 동시 측정 조건과 동일한 분리 조건을 적용하여 실시하였다.
Fig. 3의 [A]에 제시한 것과 같이 진귤 정유 분석 결과에서 retention time 25 분에 활성 성분으로 확인된 peak는 negative mode의 1차 scan 분석에서 [M-H]− 형태로 보이는 149.1 m/z를 특징적으로 나타냄에 따라 모분자량이 150.1인 화합물로 추정되었다. Fig. 3의 [B]와 [C]에 제시한 것과 같이 감국과 구절초 정유 분석에서 ABTS와 DPPH radical 소거활성 결과에서 동일하게 retention time 34 분에 활성 성분으로 확인된 peak는 negative mode의 1차 scan 분석에서 [M-H]−형태인 163.1 m/z를 특징적으로 나타냄에 따라 모분자량이 164.1인 화합물로 추정되었다.
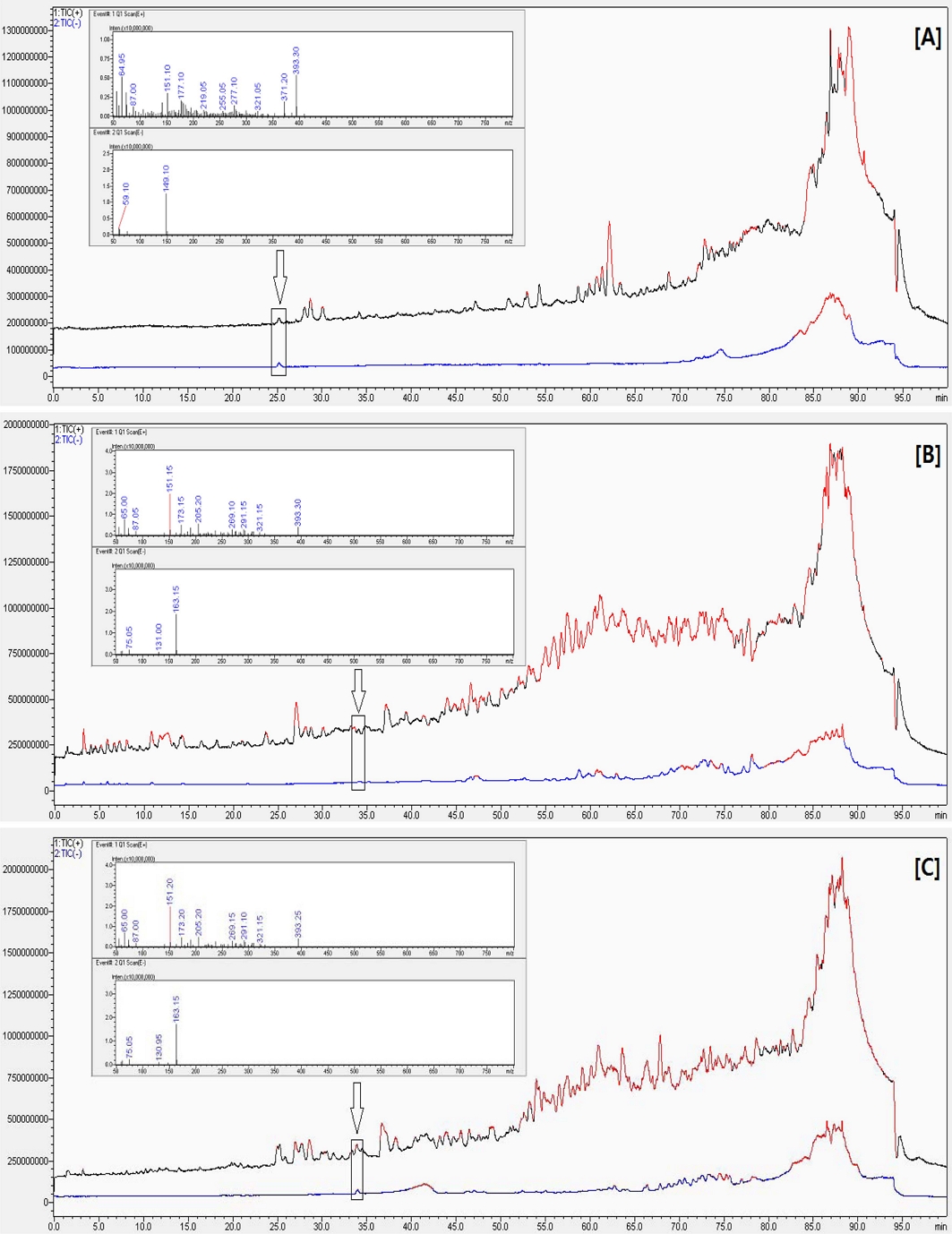
Total ion chromatogram and scan data of major active peaks.[A]; total ion chromatogram and scan data of Citrus sunki, [B]; total ion chromatogram and scan data of Dendranthema zawadskii, [C]; total ion chromatogram and scan data of Dendranthema indicum.
진귤 정유의 1차 scan mode 분석 결과를 바탕으로 precursor ion을 149.1 m/z로 설정한 후 negative mode에서 product ion scan을 실시한 결과 Fig. 4의 [A]와 같이 149.1 m/z와 함께 CH3 group이 떨어져 나간 형태로 볼 수 있는 134.0 m/z가 확인되었다. 이는 분자구조에서 하나의 CH3 group이 쉽게 이온화 과정 중 떨어져 나가고 나머지는 비교적 안정한 구조를 가지는 분자량 150.1의 화합물로 추정할 수 있는 결과이다.
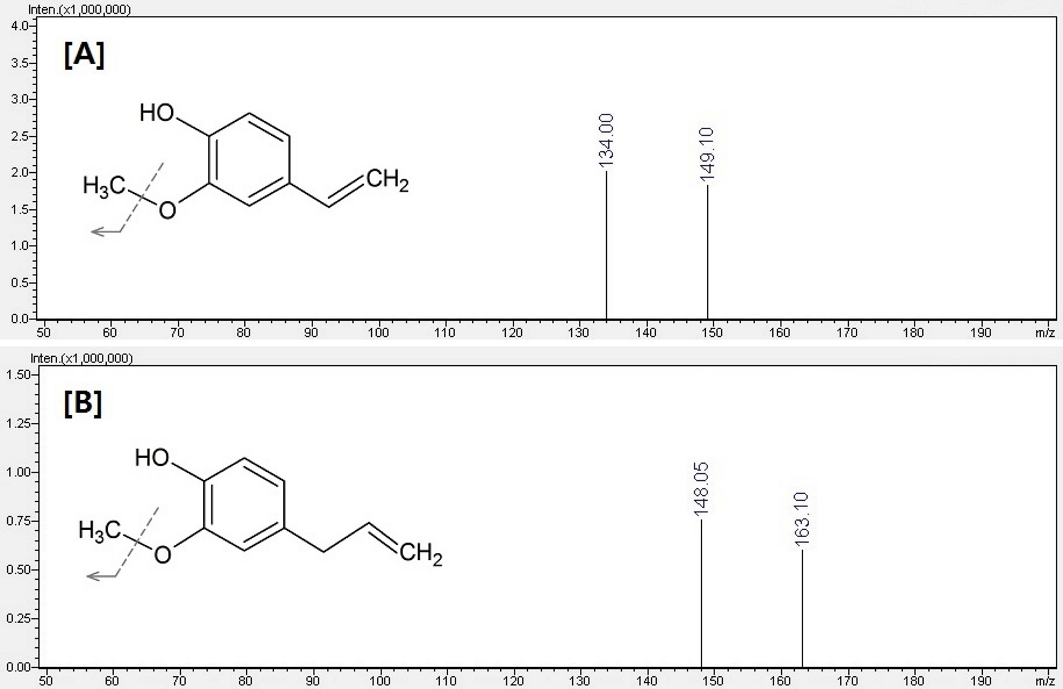
Product ion scan data by negative electrospray ionization mode LC-MS/MS of major active peaks.[A]; product ion scan data of Citrus sunki., [B]; product ion scan data of Dendranthema zawadskii and Dendranthema indicum.
감국과 구절초 정유의 1차 scan mode 분석 결과를 바탕으로 precursor ion을 163.1 m/z로 설정한 후 negative mode에서 product ion scan을 실시한 결과 Fig. 4의 [B]와 같이 163.1 m/z와 함께 CH3 group이 떨어져 나간 형태로 볼 수 있는 148.0 m/z가 확인되었다. 진귤 정유에서 확인된 것과 마찬가지로 분자구조에서 CH3 group이 쉽게 이온화 과정 중 떨어져 나갈 수 있는 화합물로 분자량 164.1의 화합물로 추정되는 결과이다.
본 연구에서 나타난 radical 소거 활성과 기존의 연구보고 등을 검토하여 진귤 정유의 retention time 25 분 peak는 Fig. 4의 [A]의 화학구조를 가지는 2-methoxy-4-vinylphenol로 추정하였다. 2-Methoxy-4-vinylphenol은 4-vinylguaiacol이라 불리기도 하며, Citrus속 식물을 포함하여 다양한 식물에서 발견되는 성분이다 (Hillebrand et al., 2004; Averbeck and Schieberle, 2011; González-Mas et al., 2019). 감국과 구절초 정유의 retention time 34 분 peak는 Fig. 4 [B]의 화학구조를 가지는 eugenol 또는 isoeugenol로 추정하였다. Eugenol이나 isoeugenol은 국화과 산국속의 식물에 존재하는 성분으로 항산화 활성이나 항균 활성 등을 가지는 것으로 알려져 있다 (Gülçin, 2011; Bidarigh, 2015; Fan et al., 2018).
본 연구에서는 10 종의 식물 정유를 대상으로 ABTS와 DPPH radical 소거능을 측정하여 상대적으로 우수한 소거능을 가지는 감국과 구절초, 그리고 진귤 정유 시료를 선별한 후 LC profile 분석과 radical 소거 활성, 그리고 질량분석을 동일한 분리 조건에서 수행하는 스크리닝 분석을 실시하여 정유 시료 중의 개별 항산화 활성 성분을 탐색하였다. Radical 소거활성과 분석 결과를 종합하여 진귤 정유에서 2-methoxy-4-vinylphenol, 감국과 구절초 정유에서 eugenol 또는 isoeugenol을 radical 소거 활성 성분으로 추정하였다.
이와 같은 결과는 정유 시료의 profile 분석과 radical 소거활성 측정을 LC 기반의 분석장비에서 동시에 수행하고 활성이 확인된 성분 peak에 대한 LC-MS/MS 분석을 동일한 분리조건에서 수행한다면 정유와 같은 추출물 수준에서 활성 성분을 특정할 수 있는 data를 얻을 수 있으며, 추가적으로 수행되는 연구에서 활성 성분 동정의 가능성과 정확성을 높이는데 기여할 수 있음을 보여주는 것으로 판단된다. 또한 감국과 구절초, 그리고 진귤 정유 시료 다음으로 높은 radical 소거 활성을 보였거나 각각의 radical 소거능에서 특이하게 다른 양상을 나타낸 것으로 판단할 수 있는 스트로브잣나무 (Pinus strobus L.)나 순비기열매 (Vitex rotundifolia L.f.) 정유 등의 활성 성분 연구에도 활용될 수 있을 것이다.
Acknowledgments
본 연구는 국립산림과학원 산림과학기술개발사업(과제번호: FP0900-2016-01)의 지원에 의해 이루진 결과로 이에 감사드립니다.
References
-
Averbeck M and Schieberle P. (2011). Influence of different storage conditions on changes in the key aroma compounds of orange juice reconstituted from concentrate. European Food Research and Technology. 232:129-142.
[https://doi.org/10.1007/s00217-010-1366-8]

-
Bakkali F, Averbeck S, Averbeck D and Idaomar M. (2008). Biological effects of essential oils-a review. Food and Chemical Toxicology. 46:446-475.
[https://doi.org/10.1016/j.fct.2007.09.106]

- Bidarigh S. (2015). Improvement vase life of Chrysanthemum (Dendranthema grandiflorum L.) cut flowers using essential oils of geranium, eucalyptus and myrtus. Journal of Ornamental Plants. 5:213-221.
-
Blois MS. (1958). Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200.
[https://doi.org/10.1038/1811199a0]

- Devasagayam TPA, Tilak JC, Boloor KK, Sane KS, Ghaskadbi SS and Lele RD. (2004). Free radicals and antioxidants in human health: Current status and future prospects. Journal of Association of Physicians of India. 52:794-804.
-
Fan S, Chang J, Zong Y, Hu G and Jia J. (2018). GC-MS analysis of the composition of the essential oil from Dendranthema indicum var. Aromaticum using three extraction methods and two columns. Molecules. 23:576. (cited by March 4).
[https://doi.org/10.3390/molecules23030576]

-
Gaunt IF, Feuer G, Fairweather FA and Gilbert D. (1965). Liver response tests. IV. Application to short-term feeding studies with butylated hydroxytoluene(BHT) and butylated hydroxyanisole(BHA). Food and Cosmetics Toxicology. 3:433-443.
[https://doi.org/10.1016/S0015-6264(65)80130-4]

-
González-Mas MC, Rambla JL, López-Gresa MP, Blázquez MA and Granell A. (2019). Volatile compounds in citrus essential oils: A comprehensive review. Frontiers in Plant Science. 10:12. (cited by September 5).
[https://doi.org/10.3389/fpls.2019.00012]

-
Gülçin I. (2011). Antioxidant activity of eugenol: A structure-activity relationship study. Journal of Medicinal Food 14:975-985.
[https://doi.org/10.1089/jmf.2010.0197]

-
Hillebrand S, Schwarz M and Winterhalter P. (2004). Characterization of anthocyanins and pyranoanthocyanins from blood orange[Citrus sinensis(L.) Osbeck] juice. Journal of Agricultural and Food Chemistry. 52:7331-7338.
[https://doi.org/10.1021/jf0487957]

-
Holmes C and Ballard C. (2004). Aromatherapy in dementia. Advanced in Psychiatric Treatment. 10:296-300.
[https://doi.org/10.1192/apt.10.4.296]

-
Im DY, Pyo BS, Kim SM and Lee KI. (2017). Measurement of the anti-oxidative properties of extract from medicinal plants using an on-line HPLC-DPPH assay. Journal of Life Science. 27:44-49.
[https://doi.org/10.5352/JLS.2017.27.1.44]

-
Inoue K, Baba E, Hino T and Oka H. (2012). A strategy for high-speed countercurrent chromatography purification of specific antioxidants from natural products based on on-line HPLC method with radical scavenging assay. Food Chemistry. 134:2276-2282.
[https://doi.org/10.1016/j.foodchem.2012.02.219]

- Jo SJ, Park MJ, Guo RH, Park JU, Yang JY, Kim JW, Lee SS and Kim YR. (2018). Antioxidant, antibacterial, antifungal, and anti-inflammatory effects of 15 tree essential oils. Korean Journal of Food Science and Technology. 50:535-542.
- Kim HG, Kang SM, Park DJ, Yong SH, Yang WH, Park JH, Yu CY, Solomon T and Choi MS. (2018). Effects of blending oil and antioxidants to prevent rancidity of sancho oil. Korean Journal of Medicinal Crop Science. 26:455-463.
-
Kim SS, Hyun CG, Choi YH and Lee NH. (2013). Tyrosinase inhibitory activities of the compounds isolated from Neolitsea aciculata(Blume) Koidz. Journal of Enzyme Inhibition and Medicinal Chemistry. 28:685-689.
[https://doi.org/10.3109/14756366.2012.670806]

-
Lee KW, Kim DY and Lee MY. (2015). Quality characteristics of Gastrodia elata extract glutinous rice porridge jochung and principal component analysis of antioxidant activity. Journal of the East Asian Society of Dietary Life. 25:1018-1028.
[https://doi.org/10.17495/easdl.2015.12.25.6.1018]

-
Lee SM, You YH, Kim KM, Park JJ, Jeong CS, Jhon DY and Jun WJ. (2012). Antioxidant activities of native Gwangyang Rubus coreanus Muq. Journal of the Korean Society of Food Science and Nutrition. 41:327-332.
[https://doi.org/10.3746/jkfn.2012.41.3.327]

-
Lin PW, Chan WC, Ng BF and Lam LC. (2007). Efficacy of aromatherapy(Lavandula angustifolia) as an intervention for agitated behaviors in Chinese older persons with dementia: Across-over randomised trial. International Journal of Geriatric Psychiatry. 22:405-410.
[https://doi.org/10.1002/gps.1688]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M and Rice-Evans C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine. 26:1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Valko M, Leibfritz D, Moncol J, Cronin MTD, Mazur M and Telser J. (2007). Free radicals and antioxidants in normal physiological functions and human disease. International Journal of Biochemistry and Cell Biology. 39:44-84.
[https://doi.org/10.1016/j.biocel.2006.07.001]

-
Wickens AP. (2001). Ageing and the free radical theory. Respiration Physiology. 128:379-391.
[https://doi.org/10.1016/S0034-5687(01)00313-9]

- Yoo NH, Kim HK, Lee CO, Park JH and Kim MJ. (2019). Comparison of anti-oxidant and anti-inflammatory activities of methanolic extracts obtained from different parts of Cononeaster wilsonii Nakai. Korean Journal of Medicinal Crop Science. 27:194-201.
-
Yu L, Haley S, Perret J, Harris M, Wilson J and Qian M. (2002). Free radical scavenging properties of wheat extracts. Journal of Agricultural and Food Chemistry. 50:1619-1624.
[https://doi.org/10.1021/jf010964p]