
NaCl 처리가 고들빼기의 생장과 생리적 특성에 미치는 영향
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was conducted to investigate the effects of NaCl concentration on the photosynthetic parameters, chlorophyll fluorescence and growth characteristics of Crepidiastrum sonchifolium.
As treatments, we subjected C. sonchifolium plants to four different concentrations of NaCl (0, 50, 100 and 200 mM). We found that the photosynthetic parameters maximum photosynthesis rate (PN max), net apparent quantum yield (Φ), maximum carboxylation rate (Vcmax), and maximum electron transport rate (Jmax) were significantly reduced at an NaCl concentration greater than 100 mM. In contrast, there was an increase in water-use efficiency with increasing NaCl concentration, although in terms of growth performances, leaf dry weight, root dry weight, stem length, and total dry weight all decreased with increasing NaCl concentration. Furthermore, leakage of electrolytes, as a consequence of cell membrane damage, clearly increased in response to an increase in NaCl concentration. Analysis of the polyphasic elevation of chlorophyll a fluorescence transients (OKJIP) revealed marked decrease in flux ratios (ΦPO, ΨO and ΦEO) and the PIabs, performance index in response to treatment with 200 mM NaCl, thereby reflectings the relatively reduced state of photosystem II. This increase in fluorescence could be due to a reduction in electron transport beyond . We thus found that the photosynthetic parameters, chlorophyll fluorescence and growth characteristics of C. sonchifolium significantly increased in response to treatment with 200 mM NaCl.
Collectively, the findings of this study indicate that C. sonchifolium shows relatively low sensitivity to NaCl stress, although photosynthetic activity was markedly reduced in plants exposed to 200 mM NaCl.
Keywords:
Crepidiastrum sonchifolium, NaCl Stress, Performance Index, Photosynthetic Activities, Polyphasic Rise of Chlorophyll a Fluorescence Transients서 언
식물의 성장에 대한 염의 부정적인 영향으로는 토양 공극의 감소를 비롯한 토양 구조의 변화로 토양 내 공기 유통과 수리 전도도 (hydraulic conductance)가 제한되고, 토양 용액의 낮은 삼투포텐셜에 따른 생리적 가뭄 (physiological drought)을 초래하면서 정상적인 수분흡수를 어렵게 만드는 것을 들 수 있다 (Parida and Das, 2005; Hopkins and Hüner, 2008). 또한 Na+와 Cl-과 같은 특정 이온의 유입으로 인한 이온독성 및 영양의 불균형으로 효소활성 저해, 세포막의 손상 및 광합성 능력의 감소와 같은 피해가 나타나게 되어 식물의 생장과 생산성을 크게 감소시키게 된다 (Parida and Das, 2005; Hopkins and Hüner, 2008; Park et al., 2010; Kalaji et al., 2011).
염 스트레스에 대한 식물 반응은 많은 요인에 의해 차이를 나타내는데, 특히 삼투조절제의 생산과 염의 엽록체 축적을 통한 광합성 기구의 보호가 식물 종간에 치사농도의 염에 대한 생장반응 및 내성을 결정하는 데 중요한 요소이다 (Hopkins and Hüner, 2008; Kalaji et al., 2011).
고들빼기 (Crepidiastrum sonchifolium)는 국화과에 속하는 산채류로서 쓴맛이 강해 우리나라에서는 예로부터 봄철에는 나물로 먹고, 가을철에는 데친 후 김치로 만들어 먹고 있으며, 한방에서는 건위, 진통, 해열, 간염, 종기 등을 위한 약용으로 이용되어 왔다 (Kim et al., 2010; Chon and Kang, 2013).
고들빼기의 약리적 효능에 관한 연구결과를 살펴보면, Young 등 (1992)은 고들빼기의 플라보노이드 성분 중에서 cynaroside가 총 콜레스테롤 농도 감소효과를 나타낸다고 하였고, Yin 등 (2007)은 HPLC 분석을 통해 고들빼기의 주요한 5 가지 화합물인 chlorogenic acid, caffeic acid, luteolin-7-O-β-D-glucuronide, luteolin-7-O-β-D-glucoside, luteolin를 분리한 바 있으며 이들 물질은 항균 등 다양한 생리활성을 지닌 것으로 보고되었다 (Chon, 2010). 또한 혈청의 지질 농도를 낮추고 (Kim et al., 1998), 고지혈증과 관련한 지질대사 개선 및 지방간으로 인한 간세포의 손상을 지연시키며 (Bae et al., 1997; Lim et al., 1997), 항염, 항산화 (Kim et al., 2010; Chon and Kang, 2013) 효과와 더불어 위암세포의 생존을 억제하는 (Shin et al., 2016) 등 기능성 식품으로서의 가치가 높은 것으로 평가되고 있다.
그러나 고들빼기의 기능성에 관한 연구에 비해 재배조건이나 비생물적 스트레스 반응에 대한 연구는 거의 없는 실정으로 다양한 환경조건에서 나타나는 생장 및 생리적 반응을 조사하고 이를 활용할 수 있는 기초 연구가 필요한 실정이다.
최근에 산채의 생산량 증대를 위한 시설재배나 해안지역 등 재배지 확대와 재배적지의 기준 설정을 위해 다양한 노력이 진행되고 있으며 (Hyun et al., 2010; Lee and Lee, 2018), 식물의 염류에 대한 내성을 비교하기 위해 주로 NaCl 처리를 통한 내염성 검정이 많이 이루어져 왔다 (Shim et al., 2012; Choi et al., 2013; Heo et al., 2016; Lee and Lee, 2018). 고들빼기의 경우 전광조건에서 생육이 우수한 양지성 식물로서 전국의 산야, 밭뚝에서도 쉽게 찾아볼 수 있으며, 척박한 땅에서도 잘 자라지만 (Chon, 2010) 간척지나 염해 매립지와 같은 토양 염이 높은 환경에서 생육의 가능성을 조사한 연구 결과가 보고된 바는 없다. 본 연구는 산채의 일종으로 다양한 기능성을 가지고 있으며, 척박한 환경조건에서도 생육할 수 있는 고들빼기를 대상으로 염 스트레스에 대한 생리 및 생장반응을 조사하여 염이 높은 토양환경에 대한 재배 가능성을 알아보고자 수행하였다.
재료 및 방법
1. 연구재료 및 NaCl 처리
실험에 사용된 고들빼기 (Crepidiastrum sonchifolium)는 한국농수산대학 구내 온실에서 2019년 4월 1일에 파종하여 같은 해 4월 27일 원예용 상토 (Horticulture nursery media, Punong Co., Gyeongju, Korea)를 이용한 높이 15㎝, 직경 10㎝ 포트의 중심에 1 본씩 이식시킨 개체를 사용하였다. 염 스트레스를 유발하기 위해 NaCl 농도를 무처리구 (0 mM), 50 mM, 100 mM, 200 mM의 4 단계로 조절하여 6월 3일부터 7월 13일까지 6 주간 주 3 회 100㎖/pot씩 오후 5 시경 관수하였다.
NaCl 처리에 따른 토양 pH1:5와 EC1:5의 차이를 조사하기 위해 생장조사를 완료한 후 토양을 채취하여 풍건시켰으며, 50㎖ 비커에 처리구당 각각 5 g 씩을 취하여 증류수 25㎖를 가해 유리막대로 1 시간 동안 충분히 저은 후 pH & EC meter (portable pH · conductivity, orion 4 star, Thermo Fisher Science Inc., Waltham, MA, USA)로 분석하였다.
2. 광합성 특성
NaCl 처리에 따른 광합성 반응은 7월 16일 휴대용 광합성 측정기 (Portable Photosynthesis system, Li-6800, Li-Cor Inc., Lincoln, NE, USA)를 이용하여 측정하였으며, 광도 변화 (0 μ㏖ · m-2· s-1 - 1400 μ㏖ · m-2· s-1)에 의한 광반응 곡선 (PN-PPFD)과 CO2 농도 (0 μ㏖ · m-2· s-1 - 1400 μ㏖ ·㏖-1)에 의한 엽육세포내 CO2 반응 곡선 (PN-Ci)을 작성하고 광보상점 (light compensation point, LCP), 순양자수율 (net apparent quantum yield, Φ), 최대광합성속도 (maximum photosynthesis rate, PN max), 최대 카르복실화 속도 (maximum carboxylation rate, Vcmax), 최대 전자전달 속도 (maximum electron transport rate, Jmax), 삼인산화율 (triose-phosphate utilization, TPU), 호흡율 (dark respiration rate, RD), 수분이용효율 (water use efficiency, WUE), 엽육세포간극의 CO2 이용효율 (intercellular CO2 concentration/ambient CO2 concentration, Ci · Ca-1) 등을 구하였다 (Kume and Ino, 1993; Kim and Lee, 2001; Sharkey et al., 2007).
이때 공통된 측정 조건은 챔버로의 유입 공기유량을 600 μ㏖ · s-1, 온도는 25℃, 상대습도는 60% - 70%를 유지하였으며, 광도 변화에 의한 광합성 측정 시 CO2 농도는 400 μ㏖ ·㏖-1, 측정시간은 광도의 적응반응을 관찰 후 광도 레벨에 따라 10 - 20 분 간격으로 조사하였고, CO2 농도에 의한 광합성 측정시 광도는 1,000 μ㏖ · m-2· s-1로 고정한 후 측정 시간은 처리구당 10 분 이내에 완료하였다.
3. 엽록소 함량 및 엽록소 형광반응 분석
엽록소 함량은 SPAD 측정기 (CCM-200, Opti-Sciences Inc., Tyngsboro, MA, USA)를 이용하여 조사하였으며, OKJIP 분석 (polyphasic rise of chlorophyll a fluorescence transients)은 엽록소 형광반응 측정기 (Plant Efficiency Analyzer, Hansatech Instrument Ltd., King’s Lynn, England)를 이용하여 20 분간 암적응 시킨 엽에 3,500 μ㏖ · m-2· s-1의 광량을 1 초간 조사하고, 50 ㎲ (O 단계), 300 ㎲ (K 단계), 2 ㎳ (J 단계), 30 ㎳ (I 단계), 500 ㎳ (P 단계)의 엽록소 형광밀도를 조사한 후 다양한 형광변수들을 산출하였다 (Strasser et al., 2000; Wang et al., 2012).
4. 세포막의 이온 유출량 측정
NaCl 처리에 따른 세포막의 피해정도를 조사하기 위해 이온 유출량을 측정하였으며, 잎맥을 제외한 5㎠의 잎 절편을 15 ㎖의 증류수에 넣어 25℃ 상온에 24 시간이 지난 후 EC meter (portable pH · conductivity, orion 4 star, Thermo Fisher Science Inc., Waltham, MA, USA)를 이용하여 이온 유출량을 측정하고 (C1), 진탕배양기 90℃에서 1 시간 30 분 동안 삶은 후, 상온 25℃에서 용액의 온도가 안정화가 되면 다시 이온 유출량을 측정하였다 (C2). 각 측정한 값들은 다음의 식에 의해 계산하였다 (Blum and Ebercon, 1981).
Leakage of electrolytes (%) = (C1/C2) × 100
5. 생장특성 조사
NaCl 처리에 따른 생장특성을 알아보기 위해 광합성 실험이 끝난 후 시료의 잎, 줄기, 뿌리를 구분하고 줄기 길이, 부위별 건조 중량 등을 측정하였다. 부위별 건조 중량은 건조기 (DS-80-5, Dasol Scientific Co., Ltd., Hwaseong, Korea)에 48 시간 동안 80℃로 건조하여 조사하였고, 측정 결과에 따라 T/R률 (지상부 건중량/지하부 건중량)과 엽중비 (leaf weight ratio; LWR = 엽 건중량/총 건중량)를 계산하였다.
본 실험의 시험구배치는 완전임의배치 10 반복으로 하였으며, SPSS Statistics program 19.0 (SPSS Inc., Chicago, IL, USA)을 이용하여 일원분산분석 (One-way ANOVA)을 실시하였다. 각 처리간의 유의성은 DMRT (Duncan's Multiple Range Test) 5% 수준에서 실시하였다 (p < 0.05).
결과 및 고찰
1. 토양 pH1:5, EC1:5 및 이온 유출량 변화
NaCl 처리에 따른 토양 pH1:5와 EC1:5를 각각 살펴보면, 무처리와 처리간 차이는 확산이중층 내 존재하는 수소이온이 NaCl 첨가에 따라 이온교환반응에 의해 수소가 치환되어 pH가 낮아졌으며, NaCl 농도가 증가하여도 차이는 없는 것으로 나타났다. 이와 달리 토양 EC1:5는 NaCl 처리 농도가 증가할수록 급격하게 증가하여 200 mM의 고농도를 처리한 시험구는 토양의 적정 EC 범위 2.0 ds · m-1 (Sohn et al., 2010)보다 높은 약 2.7 ds · m-1의 값을 나타냈다 (Fig 2).

Comparison of C. sonchifolius grown under different NaCl concentration after 6 weeks cultivation.(A); 0 mM, (B); 50 mM, (C); 100 mM, (D); 200 mM.
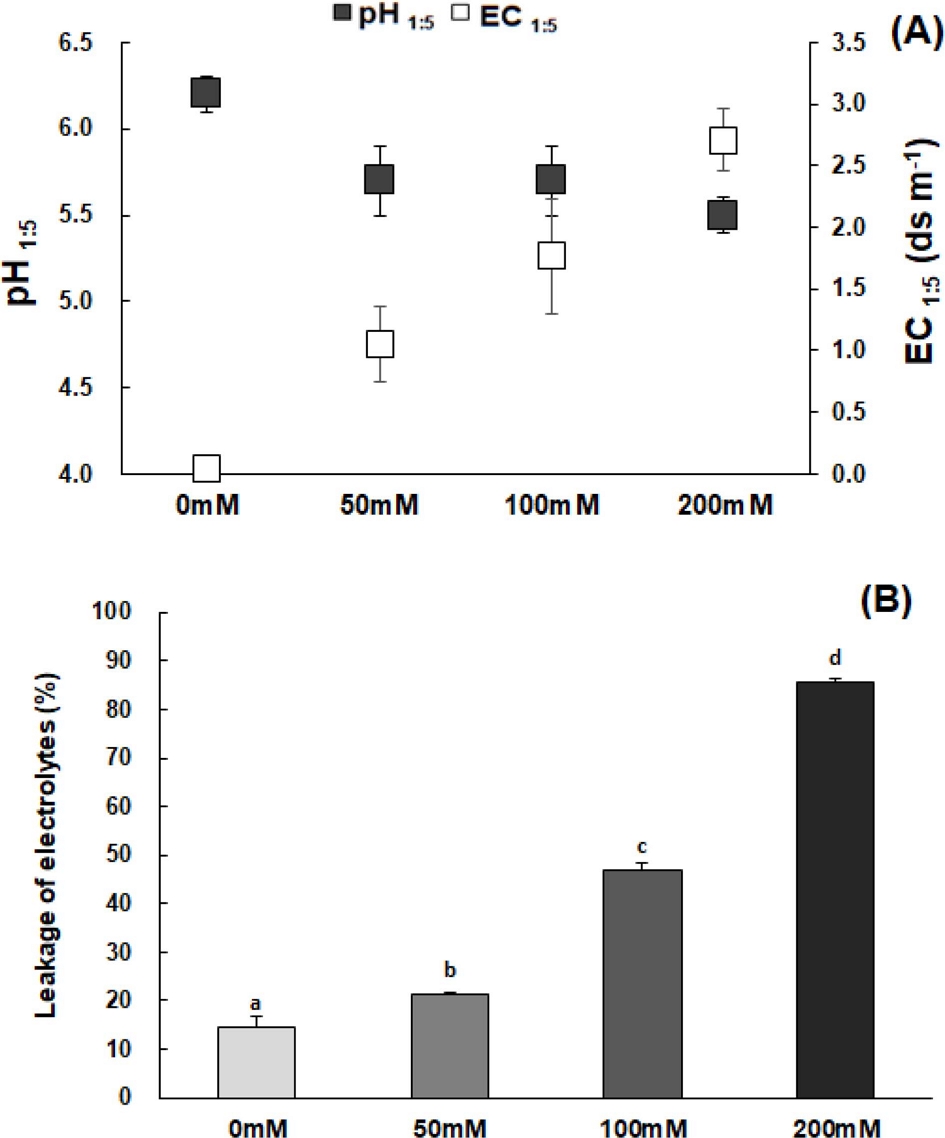
Effects of different NaCl concentration on pH1:5, EC1:5 of soil (A) and leakage of electrolytes in the leaves of C. sonchifolium (B).Each value is expressed as the means ± SD (n = 3). *Means with difference letters are significantly different by DMRT (Duncan's Multiple Range Test) at 5% level (p < 0.05).
세포막의 손상을 통한 물질의 이동능력 정도를 나타내는 이온 유출량은 다양한 환경 스트레스 조건에서 식물체의 내성 정도에 대한 유용한 생리적 지표로 활용되고 있다 (Yao and Liu, 2006; Heo et al., 2016). 고들빼기 (Crepidiastrum sonchifolium)의 경우 NaCl 처리농도가 증가함에 따라 무처리구에 비해 50 mM 처리구는 1.1 배, 100 mM 처리구는 2.4 배, 200 mM 처리구는 4.5 배로 급격하게 이온 유출량이 증가하여 염 스트레스에 따른 세포막의 피해가 커짐을 알 수 있었다 (Fig 2).
2. 광합성 반응
NaCl 처리에 따른 광합성 특성의 변화를 Table 2에 나타냈다 LCP의 경우 유의한 결과가 나타나지 않았지만, PN max, Φ, Vcmax, Jmax, TPU 등의 전반적인 광합성 지표는 NaCl 200 mM 처리시 급격한 감소를 보이는 것으로 나타났다. 특히 최대광합성속도의 경우 50 mM에서 11.34 μ㏖·m-2· s-1로 가장 높은 값을 나타내는데 비해 200 mM 처리구의 경우 50 mM보다 약 5.4 배 낮은 2.11 μ㏖ · m-2· s-1에 불과한 것으로 나타났다. 고들빼기와 같은 산채의 일종인 수리취의 경우 NaCl 50 mM 처리 시 즉각적인 최대광합성속도 및 기공전도도의 감소가 나타난다고 보고된 바 있다 (Lee and Lee, 2018).
The photosynthetic parameters of C. sonchifolium grown under different NaCl concentration treatments.
식물의 광합성 능력은 루비스코 (rubisco)의 활성에 따른 카르복실화율 및 리불로오스 이인산 (ribulose-1, 5-bisphosphate, RuBP)의 재생 속도간 균형에 의해 결정되는데 (Hopkins and Hüner, 2008), RuBP의 재생 속도는 전자전달 효율에 의해 제한된다 (Hopkins and Hüner, 2008; Ryu et al., 2014). 고들빼기의 경우 Vcmax, Jmax 및 TPU 모두 NaCl 농도가 증가할수록 감소하는 경향을 보였는데 특히 200 mM 처리구에서 급격히 감소하여 광합성 능력의 현저한 저하가 나타남을 알 수 있다 이러한 결과는 200 mM 처리구에 용해된 이온의 총 합계량인 EC1:5 값이 2.7 ds · m-1로 매우 높은 것과도 관계가 있지만 총 염에 대한 Na의 비율이 증가가 더욱 큰 영향을 미쳤을 것으로 여겨진다 (Seo et al., 2008).
세포내의 CO2 농도는 부분적으로 기공전도도에 의해 결정되고, 기공전도도의 감소는 CO2의 흡수 제한과 증산속도의 감소를 가져온다. Cho와 Kim (1999)은 염 스트레스가 유발되면 엽내 수분포텐셜의 감소로 기공이 폐쇄되고 광합성 능력을 감소시키는 결과를 가져온다고 하였는데, 고들빼기의 경우에도 NaCl 처리 농도가 높아짐에 따라 기공전도도와 기공증산속도가 뚜렷한 감소를 보이고 있으며, 이로 인해 엽육세포간극의 CO2 이용효율인 Ci·Ca-1은 낮아지고, 수분이용효율은 상대적으로 증가하는 경향을 나타내고 있다 (Fig. 3). 이러한 결과를 통해 고들빼기는 NaCl 200 mM의 높은 염 스트레스에서 기공반응의 감소로 인한 엽육내 CO2 농도의 저하와 Vcmax와 Jmax의 급격한 감소가 광합성 능력을 현저히 떨어뜨리게 됨을 알 수 있다 (Fig. 3).
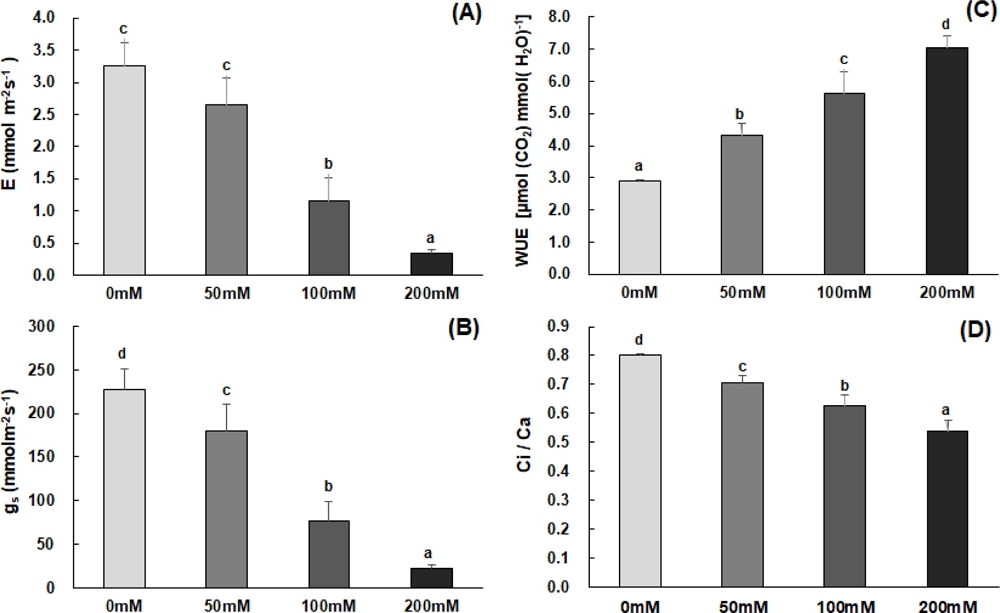
Effects of different NaCl concentration on stomatal transpiration rate (A), stomatal conductance (B), water use efficiency (C) and Ci·Ca-1 (D) in the leaves of C. sonchifolium (on PPFD 1,000 μ㏖·m-2·s-1).Each value is expressed as the means ± SD (n = 3). *Means with difference letters are significantly different by DMRT (Duncan's Multiple Range Test) at 5% level (p < 0.05).
3. 엽록소 형광반응 분석
엽록소 형광분석은 광화학반응으로 흡수되는 에너지와 전자 전달 반응에 사용되는 에너지의 불균형을 분석하여, 광합성 기구의 기능을 정량적으로 보여주며 (Hopkins and Hüner, 2008), 특히 OKJIP 곡선은 광계 II에서의 에너지 흐름의 변화와 전자수용체의 환원 등 다양한 정보를 제공하여 다양한 스트레스에 따른 생리적 반응을 나타내는 대표적인 엽록소 형광 유도 분석법이다 (Oh and Koh, 2004; Kang et al, 2016; Lee, 2018; Lee and Lee, 2018; Lee et al., 2019).
OKJIP 곡선을 통해 산출한 형광변수를 살펴보면, 전반적으로 NaCl 200 mM 처리구에서 가장 큰 변화를 보였는데, 최대형광수율 FM과 잠재적 광합성 능력을 나타내는 FV/FO는 크게 감소하였고, FO/FM, VJ 및 FK는 유의적으로 (p < 0.05) 증가하는 경향을 보였다 (Fig. 4, Table 3). 특히 FV/FO의 감소는 불활성 상태의 반응중심이 증가하고 있음을 암시하고, VJ와 FK의 증가는 산소발생복합체 (oxygen-evolving complex)의 비활성화로 인해 광계 II에서 초기 전자수용체 퀴논 QA- 이후 전자전달이 저해됨을 의미하는데 (Wang et al., 2012; Oh et al, 2014; Lee, 2018), NaCl 처리 농도가 높아짐에 따라 FV/FO는 감소하고 VJ가 증가하는 경향은 유채에서도 관찰된 바 있다 (Jafarinia and Shariati, 2012).

The chlorophyll fluorescence parameters of C. sonchifolium grown under different NaCl concentration treatments.
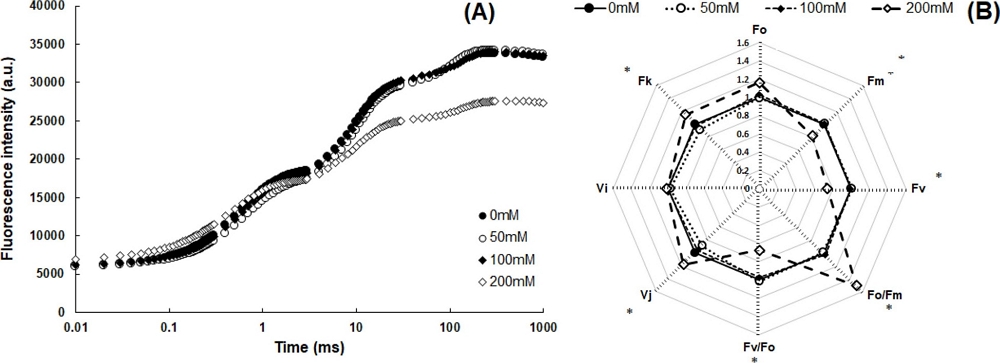
Effects of different NaCl concentration on Changes of OKJIP fluorescence curve (A) and radar plots of fluorescence parameters (B, each parameter is expressed by mean of the ratio “NaCl concentration/0 mM”) grown under different NaCl concentration treatments.The asterisk symbols indicated significantly different from 0 mM 1 and P values were calculated by DMRT (Duncan's Multiple Range Test) at 5% level (p < 0.05).
ΦPO는 초기광화학반응에서 최대양자수율을 의미하며, ΦEO 및 ΨO는 QA- 이후 전자전달을 나타낸다. 또한 PIabs는 매우 민감한 환경스트레스 지표로 전반적인 과정에서 에너지 보존 효율을 의미한다. 이러한 지표를 통해 광화학반응의 각 단계에 대한 에너지전이 비율 및 형광수율 등을 알 수 있으며 (Strasser et al., 2000; Holland et al., 2014), 고들빼기의 경우 NaCl 200 mM 처리구에서 ΦPO, ΦEO, ΨO 및 PIabs가 크게 감소하는 것으로 나타나 광합성 기구에 심각한 악영향이 야기됨을 알 수 있다 (Table 3).
이와 반대로 반응중심 당 흡수되는 빛에너지 양과 광계 II에서 포획되는 에너지, 열로 소산되는 에너지, 전자전달로 전해지는 에너지의 변화를 나타내는 ABS/RC, DIo/RC, TRo/RC 및 ETo/RC는 NaCl 200 mM 처리구에서 유의적으로 (p < 0.05) 증가하였는데, 이러한 결과는 불활성상태의 반응중심이 많아지게 되어 나타나는 결과로 생각할 수 있다 (Table 3).
4. 엽록소 함량과 생육특성
식물은 고농도의 염 스트레스 환경에 놓이게 되면 K+와 Ca2+의 흡수가 저해되는 동시에 과도한 Na+의 유입으로 인한 이온 독성과 영양의 불균형, 염 스트레스 극복을 위한 에너지 소비의 증가 등으로 생장과 발달이 크게 저하된다 (Ashraf et al., 1994; Bea et al., 2003). 고들빼기는 NaCl 농도가 증가할수록 줄기의 길이가 짧아지는 것으로 나타났으나, 엽 건중량, 줄기 건중량은 50 mM에서 가장 높고, 총 건중량은 무처리구와 50 mM 처리구가 각각 4.68, 4.69 g으로 차이가 없는 것으로 나타났다. 염 스트레스는 뿌리의 세포분열과 신장억제의 직접적인 원인이 되어 지상부 생장에 필요한 영양분의 흡수를 저해시켜 식물의 엽 생장을 억제시키는데 (Bea et al., 2003), 고들빼기의 경우 무처리구 및 50 mM 처리구와 비교해 100 mM 처리구에서 줄기와 뿌리 건중은 큰 차이가 없었으나 상대적으로 엽 건중이 감소하여 총 건중량과 잎의 생산에 투입된 건물량을 나타내는 엽중비 (LWR)의 감소를 가져온 것으로 나타났다 (Table 4).

The growth characteristics and SPAD of C. sonchifolium grown under different NaCl concentration treatments.
염 스트레스에 대한 식물의 내염성 정도는 수종에 따라 큰 차이를 보이는데, 목본류인 다정큼나무는 NaCl 50 mM 처리 시 수고와 근원경의 감소가 시작되었고 (Choi et al., 2013), 모감주나무는 50 mM 처리 시 대조구에 비해 생체중이 40.7% 감소되는 경향을 보였다 (Park et al., 2010). 초본류에서는 토마토와 가지의 경우 NaCl 40 mM 농도에서 30 일 이상 생육시킨 결과 작물의 생장이 크게 억제된다고 하였고 (Rhee et al., 2002), 줄사초, 왕밀사초, 여우꼬리사초, 노랑꽃창포 등의 일부 자생 식물은 NaCl 200 mM의 고농도에서도 잘 견디는 초종으로 보고된 바 있다 (Shim et al., 2012). 또한 고들빼기와 같은 산채의 일종인 눈개승마와 수리취의 경우 눈개승마는 NaCl 100 mM 처리 시 엽폭, 엽장, 식물체 길이가 뚜렷한 감소를 보인다고 하였으나, 50 mM 처리에 대한 조사는 진행되지 않은 결과이며 (Nam et al., 2017), 수리취는 NaCl 50 mM 처리구부터 엽면적, 엽중, 줄기 길이 등 전반적인 생육 지표의 감소가 시작되는 것으로 보고된 바 있다 (Lee and Lee, 2018).
고들빼기의 경우 NaCl 50 mM에서는 무처리구와 생장 지표의 변화가 나타나지 않았으며, 100 mM 처리구에서 전반적인 생장의 감소가 시작되었고, NaCl 200 mM의 고농도 처리 시에는 줄기 길이, 부위별 건중량 모두 크게 감소하여 100 mM 처리구에 비해 총 건중량이 약 2.1 배 수준으로 뚜렷한 생육 저해를 보였다 (Table 4).
고염도에서 과량의 Na+, Cl- 흡수는 염록소의 구성분인 Mg의 흡수를 제한하여 엽록소 합성을 저해할 수 있는데 (Kim et al., 2002), 고들빼기의 경우에도 200 mM의 고농도에서 엽록소 함량을 보여주는 SPAD 값의 유의적인 감소가 관찰되었다 (Table 4). 이를 통해 고들빼기는 NaCl 100 mM 농도 처리에서 엽에 투자하는 물질배분이 현저히 줄어들기 시작하며, 200 mM 수준의 심한 염 스트레스 환경에서는 엽록소 함량뿐만 아니라 전반적인 생장 지표가 크게 감소하는 종임을 알 수 있다.
위의 결과를 통해 고들빼기는 NaCl 처리 농도가 높아짐에 따라 기공 닫힘으로 인해 기공전도도와 기공증산속도 및 엽육 내 CO2 농도가 감소하는 반응을 보였으나 PN max, Φ, Vcmax, Jmax, TPU, ΦPO, ΦEO, ΨO 및 PIabs와 같은 광합성 활성에 관련된 지표를 비롯하여 엽건중 및 총건중량 등 전반적인 생장은 NaCl 50 mM 처리시 (EC1:5 1.06 ds · m-1)까지 비교적 높게 유지하는 식물임을 알 수 있었다.
그러나 NaCl 200 mM (EC1:5 2.71 ds · m-1)의 고농도 처리 시 불활성상태의 반응중심이 많아지면서 에너지 전이 및 형광 수율이 크게 감소하였고, 엽록소 함량도 유의적으로 감소하는 등 광합성 기구의 손상을 보였다. 결과적으로 NaCl 200 mM (EC1:5 2.71 ds · m-1) 처리시 무처리구에 비해 최대광합성 속도는 약 22.4%, 줄기의 길이와 총 건중량은 각각 37.4%, 41% 수준으로 현저한 감소를 보여 생육에 매우 부적합한 조건임을 알 수 있었고, 50 mM 수준의 염 스트레스 조건에서는 비교적 양호한 생육을 유지하는 식물임을 알 수 있었다.
References
-
Ashraf M, Noor R, Zafar ZU and Mujahid M. (1994). Growth and ion distribution in salt stressed Melilotus indica(L.) ALL. and Medicago sativa L. Flora. 189:207-213.
[https://doi.org/10.1016/S0367-2530(17)30595-9]

- Bae SJ, Kim NH, Koh JB, Roh SB and Jung BM. (1997). Effects of Godulbaegi(Ixeris sonchifolia H.) diet on enzyme activities of CCl4 induced hepatotoxicity in rats. Korean Journal of Nutrition. 30:19-24.
-
Bea JJ, Choo YS, Kim JA, Roh KS, Song JS and Song SD. (2003). Effects of nitrogen application on the patterns of amino acids, nitrogen contents and growth response of four legume plants under saline conditions. Journal of Ecology. 26:135-142.
[https://doi.org/10.5141/JEFB.2003.26.3.135]

-
Blum A and Ebercon A. (1981). Cell membrane stability as a measure of drought and heat tolerance in wheat. Crop Science. 21:43-47.
[https://doi.org/10.2135/cropsci1981.0011183X002100010013x]

- Cho JW and Kim CS. (1999). Growth characteristics and photosynthesis of soybean seedling to NaCl stress in sand culture. Korean Journal of Environmental Agriculture. 18:361-365.
-
Choi SM, Shin HC, Kim IH, Huh KY and Kim DI. (2013). Salt tolerance assessment with NaCl of Stauntonia hexaphylla(Thunb.) Decene. and Raphiolepis indica var. umbellata(Thunb.) Ohashi. Korean Journal of Horticultural Science and Technology. 31:617-625.
[https://doi.org/10.7235/hort.2013.13029]

-
Chon SU and Kang JG. (2013). Phenolics level and antioxidant activity of methanol extracts from different plant parts in Youngia sonchifolia. Korean Journal of Crop Science. 58:20-27.
[https://doi.org/10.7740/kjcs.2013.58.1.020]

-
Chon SU. (2010). Shading effect on plant growth and physiological activity of Youngia sonchifolia grown in plastic house. Korean Journal of Weed Science. 30:215-224.
[https://doi.org/10.5660/KJWS.2010.30.3.215]

-
Heo JY, Lee CH, Jeong SH, Choi HR, Lee SE and Park SM. (2016). Evaluation of salt tolerance in lettuce landraces from Korea. Korean Journal of Breeding Science. 48:199-205.
[https://doi.org/10.9787/KJBS.2016.48.3.199]

-
Holland V, Koller S and Brüggemann W. (2014). Insight into the photosynthetic apparatus in evergreen and deciduous European oaks during autumn senescence using OJIP fluorescence transient analysis. Plant Biology. 16:801-808.
[https://doi.org/10.1111/plb.12105]

- Hopkins WG and Hüner NPA. (2008). Introduction to plant physiology. (4nd ed.). John Wiley and Sons Inc. New York. NY, USA. p.223-230.
- Hyun BK, Jung SJ, Sonn YK, Park CW, Zhang YS, Song KC, Kim LH, Choi EY, Hong SY, Kwon SI and Jang BC. (2010). Comparison between methods for suitability classification of wild edible greens. Korean Journal of Soil Science and Fertilizer. 43:696-704.
- Jafarinia M and Shariati M. (2012). Effects of salt stress on photosystem II of canola plant(Barassica napus, L.) probing by chlorophyll a fluorescence measurements. Iranian Journal of Science and Technology. 36:71-76.
-
Kalaji HM, Govindjee, Bosa K, Kościelniak J and Żuk-Gołaszewska K. (2011). Effects of salt stress on photosystem II efficiency and CO2 assimilation of two syrian barley landraces. Environmental and Experimental Botany. 73:64-72.
[https://doi.org/10.1016/j.envexpbot.2010.10.009]

-
Kang HG, Kim TS, Park SH, Kim TW and Yoo SY. (2016). Photochemical index analysis on different shading level of garden plants. Korean Journal of Environmental Biology. 34:264-271.
[https://doi.org/10.11626/KJEB.2016.34.4.264]

- Kim JY, Oh SW and Koh JB. (1998). Effect of godulbaegi(Ixeris sonchifolia H.) powder on growth, protein and lipid concentration in rats. Journal of the Korean Society of Food Science and Nutrition. 27:525-530.
- Kim MJ, Park HS, Lee CI, Kim SH, Kim PN, Huh W, Lee DY and Son JC. (2010). Component analysis and antioxidant effects of Youngia sonchifola Max. Journal of Food Hygiene and Safety. 25:354-359.
- Kim PG and Lee EJ. (2001). Ecophysiology of photosynthesis 1: Effects of light intensity and intercellular CO2 pressure on photosynthesis. Korean Journal of Agricultural and Forest Meteorology. 3:126-133.
- Kim YS, Jeong YO, Park JC and Huh MR. (2002). Growth characteristics and mineral concentrations in glasswort(Salicornia herbacea) as affected by NaCl concentration. Journal of Korean Society for People, Plants, and Environment. 5:15-24.
-
Kume A and Ino Y. (1993). Comparison of ecophysiological responses to heavy snow in two varieties of Acuba japonicawith different areas of distribution. Ecological Reserch. 8:111-121.
[https://doi.org/10.1007/BF02348523]

-
Lee KC and Lee HB. (2018). Effects of NaCl on growth and physiological characteristics of Synurus deltoides(Aiton) Nakai. Journal of Agriculture and Life Science. 52:55-72.
[https://doi.org/10.14397/jals.2018.52.2.55]

- Lee KC, Han SK, Kwon YH, Jeon SR, Lee CW, Seo DJ and Park WG. (2019). Effects of shading treatments on growth and physiological characteristics of Aruncus dioicus var. kamtschaticus (Maxim.) H. Hara seedling. Korean Journal of Medicinal Crop Science. 27:30-37.
- Lee KC. (2018). Changes in photosynthetic performance and water relation parameters in the sedlings of Korean dendropanax subjected to drought stress. Korean Journal of Medicinal Crop Science. 26:181-187.
- Lim SS, Jung HO and Jung BM. (1997). Effect of Ixeris Sonchifolia H. on serum lipid metabolism in hyperlipidemic rats. Korean Journal of Nutrition. 30:889-894.
-
Nam HH, Lee JH and Choo BK. (2017). Effect of NaCl treatment on growth and physiologycal activity of Aruncus dioicus var. kamtschaticus(Maxim.) H. Hara. Korean Journal of Organic Agriculture. 25:789-804.
[https://doi.org/10.11625/KJOA.2017.25.4.789]

- Oh SJ and Koh SC. (2004). Chlorophyll fluorescence and antioxidative enzyme activity of Crinum leaves exposed to natural environmental stress in winter. Korean Journal of Environmental Biology. 22:233-241.
-
Oh SJ, Moon KH, Son IC, Song EY, Moon YE and Koh SC. (2014). Growth, photosynthesis and chlorophyll fluorescence of Chinese cabbage in response to high temperature. Korean Journal of Horticultural Science and Technology. 32:318-329.
[https://doi.org/10.7235/hort.2014.13174]

-
Parida AK and Das AB. (2005). Salt tolerance and salinity effects on plants: A review. Ecotoxicology and Environmental Safety. 60:324-349.
[https://doi.org/10.1016/j.ecoenv.2004.06.010]

- Park WJ, Seo BS, Park CM, Choi CH and Choi SM. (2010). Growth responses of 4 species to NaCl concentration in artificial soil. Korean Journal of Environment and Ecology. 24:735-743.
- Rhee HC, Kang KH, Kweon KB, Choi YH and Kim HT. (2002). Effect of NaCl stress on the growth, photosynthetic rate and mineral uptake of tomato, red pepper, and egg plant in pot culture. Journal of Bio-Environment Control. 11:133-138.
-
Ryu D, Bae JH, Park JH, Cho SS, Moon MK, Oh CY and Kim HS. (2014). Responses of native trees species in Korea under elevated carbon dioxide condition-open top chamber experiment. Korean Journal of Agricultural and Forest Meteorology. 16:199-212.
[https://doi.org/10.5532/KJAFM.2014.16.3.199]

- Seo YJ, Kim JS, Kim CY, Park SD and Park M. (2008). Effect of sodium in artificial substrate on the growth, gas exchange and leaf water status of cucumber(Cucumis sativa L.) and Korea Melon(Cucumis melo L.). Korean Journal of Soil Science and Fertilizer. 41:177-183.
-
Sharkey TD, Bemacchi CJ, Farquhar GD and Singsaas EL. (2007). Fitting photosynthetic carbon dioxide response curves for C3 leaves. Plant, Cell and Environment. 30:1035-1040.
[https://doi.org/10.1111/j.1365-3040.2007.01710.x]

-
Shim MS, Kim YJ, Lee CH and Shin CH. (2012). Salt tolerance of various native plants under salt stress. Journal of Bio-Environment Control. 21:478-484.
[https://doi.org/10.12791/KSBEC.2012.21.4.478]

-
Shin SA, Lee HN, Choo GS, Kim HJ, Park BK, Kim BS and Jung JY. (2016). Induction of apoptosis in human cancer cells with extracts of Taraxacum coreanum, Youngia sonchifolia and Ixeris dentate. Journal of Food Hygiene and Safety. 31:51-58.
[https://doi.org/10.13103/JFHS.2016.31.1.51]

- Sohn YM, Song JD, Jeon GY, Kim DH and Park ME. (2010). Effect of soil salinity and culturing condition on the maintenance of ridge and the growth of upland crops in the saemangeum reclaimed tidal land. Korean Journal of Soil Science and Fertilizer. 43:529-539.
- Strasser RJ, Srivastava A and Tsimilli-Michael M. (2000). The fluorescence transient as a tool to characterize and screen photosynthetic samples. In Yunus M, Pathre U and Mohanty P. (eds.). Probing photosynthesis: Mechanism, regulation and adaptation. Taylor and Francis. London, England. p.445-483.
-
Wang ZX, Chen L, Ai J, Qin HY, Liu YX, Xu PL, Jiao ZQ, Zhao Y and Zhang Q. (2012). Photosynthesis and activity of photosystem II in response to drought stress in amur grape(Vitis amurensis Rupr.). Photosynthetica. 50:189-196.
[https://doi.org/10.1007/s11099-012-0023-9]

-
Yao XQ and Liu Q. (2006). Changes in morphological, photosynthetic and physiological responses of Mono Maple seedlings to enhanced UV-B and to nitrogen addition. Plant Growth Regulation. 50:165-177.
[https://doi.org/10.1007/s10725-006-9116-4]

-
Yin R, Deng XX, Han F, Song Z, Cheng WM, Chen XH and Bi KS. (2007). Determination of five components in Ixeris sonchifolia by high performance liquid chromatography. Journal of Pharmaceutical and Biomedical Analysis. 43:1364-1369.
[https://doi.org/10.1016/j.jpba.2006.11.014]

- Young HS, Choi JS and Lee JH. (1992). Further study on the anti-hypercholesterolemic effect of Ixeris sonchifolia. Korean Journal of Pharmacognosy. 23:73-76.
