배초향 에센셜오일의 화학적 조성과 생리활성 특성
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In Korea, Agastache rugosa (Fisch. & C. A. Mey.) O. Kuntze is one of the well-known perennial plants belonging to Lamiaceae. This mint-fragranced plant has long been used for the treatment of abdominal pain, congestion, chills, and diarrhea since the Goryeo Dynasty. Although this plant has various medicinal properties, it is only used as a spice and for landscape purposes.
The objective of this paper was to review the chemical composition and biological properties of the essential oil of A. rugosa. Several studies reported that the essential oil contains more than 60 different chemical components of monoterpene and sesquiterpene hydrocarbons and oxygenated hydrocarbons. The major component is methyl chavicol (estragole), accounting for 64% - 88% of the oil. The chemical composition of this essential oil vaired widely according to the planting time, environmental conditions, planting distance, fertilizer application, and harvesting time.
The essential oil of A. rugosa possesses various pharmacological properties such as antioxidant, antibacterial, anticancer, antiviral, nematicidal, antifungal, insecticidal, wrinkle improver, stress reliever, and Alzheimer's disease alleviator. Hence, the essential oil from A. rugosa could be used for the development of high value-added industrial products in the near future.
Keywords:
Agastache rugosa (Fisch. & C. A. Mey.) O. Kuntze, Biological Activity, Essential Oil, Korean Mint서 언
국내에 서식하고 있는 자생식물은 197 과 (科) 4,157 종 (種)에 달하며 (Lee, 2006) 그 중 식물체에서 향기가 나는 대표적인 방향식물 (芳香植物)은 소나무과 (pinaceae), 녹나무과 (lauraceae), 운향과 (rutaceae), 정향과 (myrtaceae), 산형과 (umbelliferae), 꿀풀과 (labiatae), 국화과 (compositae), 매자나무과 (berberidaceae), 물푸레나무과 (oleaceae), 인동과 (caprifoliaceae) 등이다 (Lee et al., 2005).
고려시대 이후로 우리 선조들은 방향식물을 실생활에서 적극적으로 이용하기 시작하였는데 행향 (行香), 향의 (香儀), 장례 (葬禮), 향약 (香藥)은 물론 일상생활에서도 음식, 치료, 목욕, 해충기피, 향장의 목적으로 이용하였다. 방향식물의 이용 방법에 대해서는 동의보감 (東醫寶鑑), 규각총서 (閨閣叢書), 해동농서 (海東農書), 산림경제 (山林經濟), 농정회요 (農政會 要) 등에 자세하게 기록되어 있으며 한의학에서 사용된 향기 요법만 해도 훈법 (熏法), 훈세법 (熏洗法), 향대법 (香袋法), 향침법 (香枕法), 향의법 (香衣法), 향병법 (香甁法), 향지법 (香脂法), 향즙법 (香汁法), 향두법 (香豆法), 향봉법 (香法), 향마법 (香摩法)처럼 다양해서 서양의 아로마테라피와 비교해도 뒤지지 않았다고 평가된다 (Song, 2016). 우리 선조들이 발전시켜 놓았던 방향식물의 이용방법은 현대에 들어와 거의 소멸되었으며, 일반인들은 방향식물의 이용을 주로 에센셜오일 (essential oil)을 이용하는 아로마테라피 (aromatheraphy)로 인식하고 있다.
방향식물을 다양한 추출방법-수증기증류 추출법 (steam distillation extraction, SDE), 초임계 이산화탄소 유체 추출법 (supercritical fluid carbon dioxide extraction, SFE), 유기용매 추출법 (organic solvent extraction, OSE)으로 추출하면 에센셜오일이 얻어진다. 에센셜오일에는 monoterpenoids, sesquiterpenoids, diterpenoids 류의 휘발성 화합물이 함유되어 있고 이들이 가지고 있는 물리화학적 특성과 향취 특성 때문에 향장품 (fragrance), 향신료 (flavor), 가정용품, 생물용품, 보안용품, 환경용품, 공업용품, 농업용품 등의 산업제품 개발에 이용되고 있다 (Kim et al., 2018a).
에센셜오일로부터 고부가가치 산업제품이 개발된 대표적인 예로는 쑥 (sweet wormwood, Artemisia annua L.)에 함유된 artemisinine으로부터 말라리아 치료제를 개발한 것 (Krishna et al., 2008)과 정향과 식물인 manuka tree (Leptospermum scoparium)나 bottlebrush plant (Callistemon citrinus)에 함유되어 있는 leptospermone의 제초활성 연구로부터 sulcotrione, mesotrione, tembotrione과 같은 β-triketone 제초제 개발을 들 수 있다 (Hellyer, 1968; Mitchell et al., 2001; Dayan et al., 2011). 이러한 결과들은 에센셜오일에 함유된 생리활성물질에 대한 연구를 통해 부가가치가 높은 산업제품으로 개발될 수 있다는 점을 시사하여 준다. 그럼에도 불구하고 국내의 많은 방향식물들은 주로 한의약적 관점에서만 연구가 되고 있을 뿐이고, 그 재배면적이나 생산량도 매우 제한적인데 그 이유로는 외국산과 비교하여 가격경쟁력이 낮다는 점을 들 수 있다. 그럼에도 불구하고 향후에는 나고야의정서의 발효에 따라 국내 방향식물의 수요가 급증될 것이라고 예상 된다 (Kim et al., 2016).
본 연구에서 저자들은 역사적으로 고려시대 이후부터 한의학적으로 이용되었고 또 재배기록이 남아 있는 방향식물인 배초향 [Agastache rugosa (Fisch. & C. A. Mey.) O. Kuntze]의 에센셜오일을 대상으로 생리활성물질에 대한 자료를 수집 정리하였다. 꿀풀과 (Labiatae)의 다년생 식물인 배초향은 대표적인 한국의 방향식물로 한의학에서는 지상부를 곽향 (Agastachis Herba)이라 불리었으며 음식으로 인한 체증, 오한, 설사를 동반한 복통 증세에 곽향정기탕으로 널리 사용하였다. 그러나 현재는 향신료와 경관 조성용도로만 제한적으로 활용되고 있을 뿐이고 함유되어 있는 생리활성물질을 이용하여 고부가가치가 산업제품으로는 개발되지 못하고 있다.
결과 및 고찰
1. 배초향의 식물학적 특징
배초향은 Labiatae (순형과 혹은 꿀풀과)에 속하는 다년생 식물로 학명은 Agastache rugosa (Fisch. & C. A. Mey.) O. Kuntze이고 일반명으로는 Korean mint, purple giant hyssop, Indian mint, wrinkled giant hyssop으로 알려져 있다 (Gong et al., 2017). 배초향은 동아시아 중국, 일본과 한국에서 중요한 전통 민간약재로 이용되었지만 전통중의약에서는 곽향 (Agastachis herba)으로 모호하게 기재하고 있어 곽향이 배초향만을 의미하는지는 명확하지 않다. 일반적으로 곽향은 Agastache rugosa 또는 Pogostemon cablin (Blanco) Benth. 인데 후자는 말레이시아나 인도네시아에서는 패출리 (patchouli)로 알려져 있다. 물론 두 식물은 화학적 조성이나 향이 매우 다르다고 알려져 있다 (Holmes, 1997; Hu et al., 2006; Wu et al., 2013).
배초향은 40 ㎝ - 100 ㎝까지 높이 자라고 가지는 갈라지며 줄기는 네모지다. 잎은 대생 (對生)하고 모양은 난상 심장형이며 끝은 뾰족하고 밑 부분은 원저 (圓低) 또는 아심장저 (亞心臟底)로 길이는 5 ㎝ - 15 ㎝, 너비는 3 ㎝ - 7 ㎝이다. 잎의 표면에는 털이 없고 뒷면에만 약간 있으며 잎의 가장자리에는 둔한 톱니가 있고 잎과 줄기를 이어주는 엽병 (葉柄)의 길이는 1 ㎝ - 4 ㎝이다. 꽃은 7월 - 9월에 피는데 자주색이고 가지 끝과 원줄기 끝에 윤산화서로 달리며 화서 길이는 5 ㎝ - 15 ㎝이고 너비는 2 ㎝이다 (Fig. 1). 화관은 입술모양으로 길이는 8 ㎜ - 10 ㎜이다 (Park and Lee, 2000; Lee, 2003; Lee, 2006).
배초향은 Labiatae에 속하는 다른 식물들인 박하 (Mentha arvensis var. piperascens Malinvaud), 차즈기 (Perilla frutescens Britton var. acuta Kudo), 산박하 [Rabdosia inflexa (Thunb.) Hara]와 형태학적으로 매우 유사하지만 식물분류학적으로는 명확하게 다른데 이들의 형태학적 차이점은 Table 1에 나타내었다.
2. 배초향의 역사적 기록과 민간 이용
국내에서 곽향 (藿香)이 민간에서 사용되었다는 기록은 고려시대로까지 거슬러 올라간다. 고려시대에 곽향은 송과 대식국 등과 공사무역을 하면서 도입되었는데 한반도에서 직접서식, 수집, 재배에 대한 기록은 조선시대에나 발견된다 (Kwon, 2013). 고려시대에 곽향의 기록은 조공 사행에서 발견된다. 고려사 권9 세가 (世家) 권제9 [문종 (文宗) 33년 (1079년, 7월)]에 “송 황제가 의원과 약재를 보냈다”라는 기록이 나온다 (NIKH, 2020a). 문종이 혼란스럽고 통증은 없으나 손발을 잘 쓰지 못하는 풍비증 (風痺症)에 걸려 낫지를 않자송 황제에게 이의 치료를 부탁하는 조서 (詔書)를 보냈고 이에 송 황제가 100 가지 약재를 보내주었는데 중국 광주지역에서 생산된 곽향 (廣州 藿香)이 포함되어 있었다. 역사적으로 고려시대에는 송나라와의 공무역뿐만 아니라 사무역도 활발했는데 송나라는 해로를 통해 약 60 여 국가와 교역을 하고 있었기에 다양한 향료가 고려로도 유입되었을 것이라 추측된다.
조선시대 곽향의 기록은 조선왕조실록에 잘 나와 있다. 조선왕조실록에는 태종시대로부터 고종시대까지 총 35 회에 걸쳐 곽향과 관련된 기록이 검색된다. 조선왕조실록에는 주로 명, 청, 일본과의 외교를 통해 곽향이 주로 의약용 약재로 도입되었음을 알 수 있다. 태종실록 12 권 (태종 6년 12월 22 일)에는 “명나라 황제가 통감강목 (通鑑綱目) 등의 서적과 곽향 등 약재 18 종을 하사하였다”라 기록되어 있고, 세종실록 1 권 (세종 1년 8월 14일)에는 “유구 (현재 일본국 오키나와) 국왕의 아들이 곽향 50 근을 바쳤다”는 기록이 있다 (NIKH, 2020b). 조선왕조실록에 곽향과 관련된 기록은 세종실록 이외에도 경종실록, 단종실록, 세조실록, 효종실록, 경종실록, 영조실록, 정조실록과 고종실록에서도 검색되는 것으로 보아 조선시대에는 민간에서도 활발하게 이용하였을 것이라 추측된다.
곽향이 의료용으로 고려시대부터 도입되었기에 고려시대부터 재배가 이루어졌을 것이라 미루어 짐작할 수 있지만 문헌기록상으로는 세종대에 처음 발견된다. 조선왕조실록 세종실록 151 권 지리지에 곽향이 전라도의 공물이라는 기록이 있는 것으로 보아 (NIKH, 2020c) 이미 조선시대에는 민간에서 재배되고 있었을 것이다.
곽향은 궁중에서뿐만 아니라 민간에서도 두통 및 발열 등의 상한 (傷寒) 증세와 토사곽란 치료에 사용되었는데 대표적인 것이 곽향정기산 (藿香正氣散)이다. 곽향정기산은 곽향에 창출, 후박, 진피, 반하, 복령, 백지, 길경, 백복피, 자소엽, 감초를 혼합한 약재로 조선왕조실록 경종수정실록 5 권 (경종 4년 8월 20일)에 “경종이 밤에 가슴과 배가 비틀리듯이 아팠기에 곽향정기탕을 청하였다”라고 기록되어 있어 곽향의 용도를 잘 알 수 있다 (NIKH, 2020d). 민간에서도 음식으로 인한 체증, 오한, 설사를 동반한 복통 증세에 곽향정기산이 널리 활용되었는데 15 세기의 구급간이방언해 (救急簡易方諺解), 동의보감 (東醫寶鑑), 군중의약 (軍中醫藥), 급유방 (及幼方), 광제비급 (廣濟秘) 등의 서적에도 기록이 남아 있다 (NIKH, 2019).
3. 배초향의 재배기술이 생육과 에센셜오일 생산에 미치는 영향
배초향의 품질을 감각을 통해 쉽게 알 수 있는 것은 강한 향이라고 할 수 있다. 에센셜오일의 품질이 바로 강한 향취와 밀접한 관련이 있기 때문에 고함량의 에센셜오일을 함유하는 배초향을 재배하기 위해서 종자발아, 파종시기, 생육온도, 재식거리 및 밀도, 차광, 재배지역, 수확기에 관한 연구가 연구자들에 의해 수행되었기에 이를 소개한다.
Ryu 등 (1988)은 배초향의 종자 발아는 15℃에서는 6% 밖에는 발아가 되지 않지만 15℃ - 25℃에서는 100% 발아되는 것으로 보고하였다. 이 보고에 의하면 종자발아는 저온보다는 약간 높은 온도에서 더 잘 이루어지는 것을 알 수 있다. 일반적으로 야생종 식물종자의 경우에는 발아율이 매우 낮은데 배초향 종자의 발아율이 15℃ - 25℃에서 100%에 달한다는 것은 야생종 배초향 종자가 거의 품종 상태가 되었다는 것을 시사하여 준다.
파종 시기는 식물의 영양생장, 생식생장 및 수확시기에도 영향을 주기에 에센셜오일의 품질과도 밀접한 관련이 있다. Lee 등 (1999)은 배초향의 수확시기별 생육특성 연구를 통해 우리 나라에서 배초향의 최적 파종기는 춘파의 경우 3월 23일이 적기이고 추파의 경우에는 10월 11일이 적기라고 하였다. 그러나 이러한 파종 적기는 배초향 재배가 주로 이루어지는 남부 지방에만 적용될 것이라 판단되는데 중부 산간지대에서의 파종적기는 3월 중·하순보다는 더 늦어질 것이 예상된다.
배초향의 파종은 춘파와 추파가 가능하며 춘파의 경우에는 당해년도의 수확을 그리고 추파의 경우에는 월동 후 차년도의 수확을 목표로 한다. 이에 대한 연구로 Ryu 등 (1988)은 추파하여 월동한 배초향이 향이 진하고 독특하지만 늦은 봄이나 여름에 잎을 채소로 이용할 때에는 가을에 파종하는 것이 좋다고 보고하였다. 이러한 결과로부터 농가에서는 배초향의 재배 목적에 따라 파종시기를 달리할 수 있을 것이다.
다년생 식물인 배초향은 파종 당해연도와 차년도에 생육에 차이가 있어서 개화 시기에 차이를 나타낸다. 배초향은 1 년차와 2 년차에 출현하는 시기에는 큰 차이가 없는 것으로 나타났는데 Choi와 Lee (1994)의 연구에 의하면 파종 2 년째에는 4월 상순 경 90% 이상이 출현되며 개화기는 7월 상순으로 빨라졌다고 하였다. 저자들은 그 이유로 2 년차에는 배초향의 뿌리가 토양에 이미 활착되어 생육이 왕성하였기 때문이라고 추론하였다.
Ryu 등 (1988)은 배초향을 비닐하우스에서 재배 시에 유묘의 이식 시기를 15 일 정도 앞당길 수 있기 때문에 조기에 배초향을 생장시켜 엽채소로 이용할 수 있다고 하였는데 이는 노지에 비해서 비닐하우스 재배의 장점이라고 할 수 있다.
배초향은 고온과 저온보다는 약간 서늘한 기온에서 재배될 때 생장이 왕성한 것으로 나타났다. Choi 등 (2010a)에 의하면 25℃에서 재배된 배초향의 초장은 15℃와 30℃에서 재배된 것보다 더 길었고 시기별로는 5월 16일부터 6월 16일 사이에 생육이 급격하게 증가하였다고 보고하였다. 재배지역은 에센셜오일의 함량에 영향을 미쳤는데 배초향 수확기인 10월 15일에 준고냉지에서 재배된 배초향 에센셜오일 함량은 4.04 ㎖·㎏-1이었던 반면, 평야부에서 재배된 배초향의 에센셜오일 함량은 3.75 ㎖·㎏-1으로 낮았다 (Choi et al., 2010a). 또한 Choi 등 (2010c)은 배초향의 생육이 서늘한 기후에서 더 잘 이루어진다는 선행 연구를 뒷받침하는 결과를 보고하였다.
배초향 재배 중 차광은 서늘한 온도를 제공하여 생육에 도움을 준다. Choi 등 (2010c)은 배초향 재배에 있어서 30% 차광시 초장과 경경이 유의미하게 증가되었고, 수확기에 생체중 및 건물중도 높았다고 보고하였다. 또한 Ryu 등 (1988)은 차광막 재배시 습하고, 그늘지며, 노지보다 높은 온도가 유지되어 초기의 활착에 유리하다고 보고하였다. 저자들의 연구결과는 배초향 재배시 차광이 서늘한 조건을 유지함과 동시에 생육을 촉진하기에 생산성 향상을 위해서는 차광재배가 유리하다는 것을 보여준다.
배초향의 생육은 재식거리와 밀도에 따라 달라지는데 Choi 등 (2010a)은 재식밀도가 낮을수록 초장, 분지수, 절수와 생체중이 증가되는 경향을 보인다고 하였으며 재식거리가 길수록 초장, 분지수 등이 증가되었으며 짧을수록 분지수는 감소되지만 수량은 높았다고 보고하였다. 배초향을 15 ㎝ × 15 ㎝, 30 ㎝ × 30 ㎝, 50 ㎝ × 50 ㎝별로 재식하였을 때 주당 건물중은 각각 78.9, 119.0, 243.8 g·plant-1이었고, 생산량은 2,099, 785, 975 ㎏·10a-1이었는데, 이러한 결과는 배초향이 양분의 경합 및 광합성의 간섭 등 환경조건의 영향을 적게 받은 것이라 추론된다.
Kim 등 (2018b)은 상이한 파장의 광 조건이 배초향 생장에 미치는 영향을 연구하였는 바 LED 조건하에서 배초향을 재배하면서 생장을 측정한 결과, 적색광만을 처리했을 경우에는 지상부 생육이 현저하게 낮았고, 백색광과 녹색광 혼합 처리구에서는 생육이 증가된 것으로 나타났다. 이러한 결과는 적색광의 파장이 배초향에 있는 광계 I에만 작용하여 전체적으로 광합성 효율을 낮춤으로써 일어난 결과라고 해석할 수 있지만 이에 대해서는 좀 더 면밀한 연구가 요구된다.
배초향의 에센셜오일 함량은 질소비료 시용에 따라 달라진다. Omidbaigi 등 (2008)은 질소비료 100 ㎏·ha-1을 배초향에 처리하면 에센셜오일 함량은 2.88%까지 도달한다고 보고하였다. 질소비료 시용은 배초향의 엽면적을 증가시키고 그 결과로 태양광 포집이 증가하여 광합성 효율이 증가하고 이로 인하여 에센셜오일의 함량 역시 증가한다고 추론된다. 그러나 질소비료-광합성 효율-에센셜오일 생합성 과정인 메발론산 경로 (mevalonic acid pathway) 간의 상관관계에 대한 연구는 보고된 바가 없다.
많은 연구자들은 에센셜오일의 함량은 배초향 생육시기별로 달라진다고 보고하였는데 Lee 등 (1999)은 개화 중기인 9월 20일 경 배초향의 식물부위별 건물수량이 가장 높았다고 보고하였고 Park 등 (1991)은 역시 Lee 등 (1999)의 결과를 뒷받침하는 결과를 보고하였다. Park 등 (1991)은 개화기에 10 a 당 건물수량은 줄기 (421 ㎏ - 932 ㎏) > 뿌리 (172 ㎏ - 394 ㎏) > 잎 (135 ㎏ - 252 ㎏) > 꽃 (109 ㎏ - 156 ㎏)의 순이었으며 로즈마린산 (rosmarinic acid)의 함량은 뿌리 (0.91% - 6.56%) > 꽃 (0.32% - 2.34%) > 잎 (0.97% - 1.64%) > 줄기 (0.03% - 0.21%)의 순서로 많이 함유되어 있다고 보고하였다. 이러한 결과는 건물수량이 많은 부위가 반드시 특정 성분도 많이 함유하지는 않는다는 것을 보여준다.
배초향은 시기별로 식물부위에 따라 성분 함량은 변화한다. Lee 등 (1999)은 배초향 잎의 에센셜오일 함량은 개화기이전에는 5.78%이었지만 개화기 이후에는 4.40%로 낮아진다고 보고하였고, 꽃의 에센셜오일 함량은 개화기 이전에는 3.84%이었던 것이, 개화기 후에는 4.40%로 높아진다고 하였다. 그리고 Ok과 Chae (1999)는 우리나라에서 수집된 배초향 지역종의 생육시기별 에센셜오일 함량과 에센셜오일 주성분인 estragol [1-methyl-4-(propenyl)-benzene], p-allylanisole, methyl chavicol, isoanethole, 4-allylanisole의 함량을 조사하여 개화기에 에센셜오일이 가장 많았다고 보고하였다. 이러한 결과로부터 에센셜오일의 함량은 부위별로 개화기 전후에 달라진다는 것을 알 수 있다. 이러한 연구결과들은 배초향 식물의 수확 부위에 따라 수확시기를 달리 할 수 있다는 것을 보여준다.
4. 배초향의 일반 성분
배초향에 함유되어 있는 일반성분들은 꽃, 잎, 줄기에 차이가 있었는데 꽃에는 탄수화물, 지방, 단백질, 회분 함량이 각각 70.75%, 3.06%, 16.08%, 10.11%, 잎에는 66.84%, 9.54%, 11.61%, 12.01%, 그리고 줄기에는 93.37%, 0.01%, 2.64%, 3.98% 함유되어 있었다 (Lee and Hwang, 2000). 휘발성 유기화합물로 구성되는 에센셜오일은 지방 성분으로 분류될 수 있는데 (수증기증류법으로 추출 시 에센셜오일은 물과 분리됨) 배초향의 식물부위별로 지방 함량만을 놓고 평가한다면 잎에 가장 많이 함유되어 있다고 판단된다. 이러한 이유로 Lee와 Hwang (2000)은 배초향의 잎을 국내에서 다양한 음식을 만드는 향신료로 사용한 것은 근거가 있는 것이라 추론하였다.
5. 배초향 에센셜오일의 함량
배초향을 포함하여 꿀풀과 식물들은 아름다운 꽃뿐만 아니라 향기를 함유하고 있어서 관상용, 밀원용, 식품, 향신료, 한약재 및 다양한 산업제품의 원료로 사용되고 있다 (Lee et al., 2000). 배초향에 함유된 휘발성의 향기성분들은 수증기 증류 추출법 (steam distillation extraction, SDE), 초임계 이산화탄소 유체 추출법 (supercritical fluid carbon dioxide extraction, SFE), 유기용매 추출법 (organic solvent extraction, OSE)으로 얻을 수 있다. Fragrance와 flavor 산업계에서는 SDE로 추출한 것을 특정하게 에센셜오일 (essential oil)이라 하고 SFE나 OSE로 추출된 것은 추출물 (extracts)이라 분류하고 있다. 그러나 본 리뷰에서는 편의상 배초향으로부터 추출 방법과 관계없이 추출된 모든 추출물을 에센셜오일이라 정의하고자 한다. 그렇지 않으면 많은 저자들이 배초향으로부터 추출한 에센셜오일 혹은 추출물에 대한 비교 분석이 어렵기 때문이다.
배초향에 함유된 에센셜오일의 함량은 연구자들마다 상이하였는데 이러한 차이점은 재배지역, 재배시기, 재배법, 채취부위와 추출방법에 기인된다고 보여진다 (Charles et al., 1991; Svoboda et al., 1995; Dũng et al., 1996; Wang, 2010; Gong et al., 2012; Li et al., 2013). 여러 연구자들이 보고한 바에 따르면 배초향 잎에 함유된 에센셜오일의 함량은 유전적, 재배 환경적 차이에도 불구하고 0.29% - 6.92% 수준이었다 (Table 2). 전 세계 어느 지역에서 재배가 이루어지더라도 배초향 에센셜오일의 함량은 이 범위를 넘지 않았는데 예를 들어 중국 Xinjiang 지역에서 재배된 배초향 잎에 함유된 에센셜오일의 함량이 0.57%이었다 (Gong et al., 2017).
Yields of essential oil in different plant parts of Korean mint [Agastache rugosa (Fisch. & C. A. Mey.)] O. Kuntze) by various authors.
배초향 에센셜오일의 추출효율은 SDE보다는 SFE가 높았는데 Lee 등 (2005)은 배초향 잎을 SDE로 추출했을 때 에센셜오일의 함량은 5.04%이었던 반면, SFE로 추출했을 때의 함량은 6.92%이라 보고하였고, Kim 등 (2001a)은 배초향 지상부위를 SDE로 추출했을 때의 함량은 0.49%이었던 반면 SFE로 추출하였을 경우에는 3.21%로 3.5 배나 증가하였다고 보고하였다. SDE는 고온의 수증기를 이용하여 식물시료의 표면에 있는 휘발성의 향기성분을 추출하는 방법으로 열에 불안정한 휘발성 유기화합물은 추출 중에 변성되거나 파괴되기도 한다. SFE는 액상과 기상이 구분되지 않는 임계점보다 높은 영역에서 이산화탄소를 이용하여 에센셜오일을 추출하는 방법으로 비휘발성이고 열에 불안정한 유기화합물도 추출하기 때문에 SDE와 비교하여 추출효율이 높은 것으로 알려져 있다.
배초향 잎에 함유된 에센셜오일의 함량은 섬백리향 (Thymus quinquecostatus var. japonica HARA) 지상부의 SFE 결과 (0.20% - 0.27%; Lee et al., 2014), 곰취 (Ligularia fischeri) 지상부의 SDE 결과 (0.12%; Yeon et al., 2012), 한대리곰취 (Ligularia fischeri var. spicifoprmis) 지상부의 SDE 결과 (0.04%; Yeon et al., 2012), 그리고 우리나라 산에 많이 식재되어 있는 침엽수종인 소나무 (Pinus densiflora, 0.12%), 잣나무 (Pinus koraiensis, 0.20%), 낙엽송 (Larix kaempfeir, 0.06%), 분비나무 (Abies nephrolepsis, 0.17%) 잎의 함량 (Yun et al., 2013)보다도 훨씬 높았는데 이러한 결과는 향후 배초향의 에센셜오일을 산업화하는데 장점으로 작용할 것이라 판단된다.
배초향은 잎에서 뿐만 아니라 꽃에도 에센셜오일이 함유되어 있는데 꽃에 함유된 함량은 0.29% - 3.99%이었다 (Table 2). Lee 등 (1994b)은 한국인삼연초연구원 시험포에서 재배한 배초향의 꽃을 개화기인 8월 경 수확하여 추출한 에센셜오일 함량이 0.38%라 보고하였고, Gong 등 (2017)은 중국 Xinjiang 지역에서 재배된 배초향 꽃에 에센셜오일 함량은 0.29%라 보고하였다. 그리고 Lee 등 (2005)는 한국 자생 허브식물에 함유된 에센셜오일을 추출한 실험을 통해 배초향 꽃부위를 SDE와 SFE로 추출했을 때 각각 3.99%와 2.66%의 에센셜오일이 함유되어 있다고 보고한 바 있다. 배초향 꽃에 함유된 에센셜오일 함량은 연구자마다 달랐는데 이와 같은 결과는 앞서 설명한 바와 같이 재배이력, 수확시기, 그리고 추출방법에 따라 달랐다고 추론된다.
배초향 지상부위 (줄기 + 잎 + 꽃)를 SDE로 추출했을 경우 에센셜오일의 함량은 약 0.15% - 0.40%인 것으로 여러 연구자들은 보고하고 있다 (Table 2). 고산지대인 가리왕산 정상부근에서 채집된 야생종에는 0.46%의 에센셜오일이 함유되어 있었는데 (Park et al., 2000) 이러한 결과는 배초향의 생장이 서늘한 곳에서 더 잘 이루어진다는 Choi 등 (2010a)의 연구 결과와도 일맥상통하는 것이라 할 수 있다.
배초향을 노지에서 재배할 경우 기후 영향을 많이 받기 때문에 일정한 품질의 에센셜오일을 얻는 것이 불가능하다. Shin 등 (1991)은 이러한 문제를 해결하기 위하여 식물조직 배양을 통해 캘러스를 생산하면서 에센셜오일 함량을 조사하였는데 노지에서 재배했을 때보다 훨씬 적은 0.03%라 보고하였다. 그러나 캘러스에 에센셜오일의 전구물질인 pyruvic acid 첨가시에는 0.08%, phenyl alanine 첨가시에는 0.07%, cinnamic acid 첨가시에는 0.06%로 증가하였고, mevalonic acid lactone을 첨가시에는 에센셜오일 함량이 6.00%까지 증가하였다. Shin 등 (1991)의 연구 결과는 식물조직 배양을 이용한 에센셜오일 대량생산이 가능하다는 것으로 보여주었으며 향후 기후변화로 인한 에센셜오일 공급 부족을 타개할 수 있는 방안 중 하나라고 판단된다.
지금까지 보고된 배초향에 함유된 에센셜오일의 함량은 재배지역과 수확시기 등에 따라 매우 달랐다는 것을 알 수 있다. 몇몇 연구자들의 연구결과는 국내의 다른 식물보다도 배초향에 많은 에센셜오일이 함유되어 있다는 것을 보여주었다. 향기식물의 이용에 있어서 중요한 것이 에센셜오일의 함량과 향기의 질 (fragrance quality)이라 할 수 있는데 이러한 것을 고려하였을 때 배초향의 이용에 대한 전망은 높다고 할 수 있다.
6. 배초향 에센셜오일의 화학조성
많은 연구자들은 배초향 에센셜오일을 분석하여 다양한 휘발성 유기화합물이 존재한다고 보고하였다. 배초향 에센셜오일에 함유된 유기화합물은 Table 3에 그리고 화학구조는 Fig. 2에 정리하였다.

Chemical composition in different plant parts of Korean mint [Agastache rugosa (Fisch. & C. A. Mey.) O. Kuntze].
Park 등 (2000)은 배초향 에센셜오일을 gas chromatography-mass spectrometry (GC-MS) 분석 시 표준품 분석을 수행하여 9 종 화합물-menthone, isomenthone, dihydrocarvone, anethole, vanillin, eugenol, methyl eugenol, β-caryophyllene, β-caryophyllene oxide가 함유되어 있다고 보고하였는데 실제 배초향 에센셜오일에는 이보다는 훨씬 많은 화학성분이 함유되어 있다는 것을 많은 연구자들은 보고하고 있다 (Table 3).
배초향 에센셜오일의 주성분으로는 methyl chavicol로 알려져 있는 estragole을 들 수 있다. Lee 등 (1994b)은 배초향 잎으로부터 추출된 에센셜오일을 분석하여 estragole 함량이 64.4%로 가장 높았고 꽃에는 78.4%가 함유되어 있다고 보고하였는데 이러한 연구결과는 배초향 에센셜오일에 estragole이가장 높은 함량의 화학성분이라는 것을 나타낸다. 그리고 Charles 등 (1991)은 배초향 에센셜오일에 estragole이 46.7% - 94.6% 함유되어 있다는 것을, Shin 등 (1991)은 역시 estragole이 80% 함유되어 있다고 보고하여 Lee 등 (1994b)가 보고한 것과 동일한 결과를 보고하였다. 이외에도 많은 연구자들이 배초향 에센셜오일의 주성분은 estragole이라 보고하였다 (Fujita and Fujita, 1973; Kang, 2002; Lee et al., 2002b; Song et al., 2002; Moon et al., 2012; Li et al., 2013; Baik, 2016).
Baik (2016)은 배초향 에센셜오일의 성분 분석을 통해 estragole이 전체 함량의 88.2%를 차지하며 그 뒤를 이어 limonene과 trans-caryophyllene이 각각 4.5%와 2.4%를 차지한다고 보고하여 estragole이 주성분임을 보고하였다. Lee 등 (2002b) 역시 배초향 에센셜오일에는 estragole (79.83%) > limonene (4.13%) > trans-isopulegone (3.45%) > β-caryophyllene (1.82%)의 순으로 화학성분이 함유되어 있다고 하였고, Kang (2002) 또한 methyl chavicol (estragole) (49.42%) > limonene (12.52%) > β-caryophyllene (6.49%)의 화학성분이 함유되어 있다고 보고하여 배초향 에센셜오일의 주성분은 estragole이라는 많은 연구자들의 결과를 뒷받침해 주었다.
배초향의 주성분인 estragole은 부위별로 다르게 함유되어 있었는데 어린잎보다는 성숙잎에, 잎보다는 꽃대에 더 많이 함유되어 있다고 Ahn과 Yang (1991)은 보고하였다. 배초향에 함유되어 있는 화학성분들로 인하여 전체적인 향취는 박하향, 풀향, 한약향이 섞인 관능적인 향기라고 알려져 있다 (Lee et al., 2000).
Lee 등 (1994b)는 배초향 잎과 꽃에 함유된 에센셜오일을 SDE로 추출하고 탄화수소 분획과 함산소화합물 분획으로 분리한 다음 GC-MS 분석을 통해 총 60 종의 화학성분이 함유되어 있다고 보고하였다. 저자들은 화학성분을 탄화수소와 함산소화합물로 구분하여 탄화수소 분획에는 13 종의 화학성분이 함유되어 있었는데 이들의 성분명 (함량)은 α-pinene (<0.1%), camphene (<0.1%), β-pinene (<0.1%), limonene (13.1%), α-phellandrene (<0.1%), p-cymene (<0.1%), α-copaene (3.6%), β-ylangene (0.7%), β-caryophyllene (59.3%), sesquiterpene (2.1%), δ-cadinene (10.7%), β-bisabolene (4.1%), α-cadinene (3.5%)이라 보고하였다. 그리고 함산소화합물 분획에는 methyl chavicol 등 총 44 종의 화학성분이 검출되었는데 methyl chavicol이 79.1%로 가장 많았으며 강한 꽃향기를 내는 β-damascenone, α-ionone, dihydroactinidiolide, edulan 등도 함유되어 있다고 보고한 바 있다.
그러나 많은 연구자들이 배초향의 주성분은 estragole이라 보고한 것과는 달리 Li 등 (2013)은 주성분이 methyl eugenol (50.5%)이라 하였고, Wang (2010)은 중국 서부에서 재배된 배초향 에센셜오일의 주성분은 p-menthan-3-one이라 하였다. 배초향 에센셜오일의 주성분이 이렇게 다른 이유로는 지역종의 유전형질, 서식지 환경의 상이함을 들 수 있다. 서로 상이한 지역에서 재배되는 배초향이 비록 형태학적으로는 유사하더라도 특정 화학성분에 대한 유전발현이 다를 경우 얼마든지 상이한 화학종이 발현될 수 있으며 또 재배되는 토양의 화학성분이 상이할 경우에도 상이한 화학종이 발현될 수 있다고 추론된다. 현재까지 보고된 배초향 주성분에 따른 화학종은 estragole 타입, methyl eugenol 타입, p-menthan-3-one 타입이지만 전 세계적으로 더 많은 화학종이 보고될 것으로 예상된다.
국내에서 배초향 에센셜오일의 성분은 지역종마다 차이가 있다고 발표되었는데 Moon 등 (2012)은 제주산, 전남산, 경북산 배초향의 에센셜오일 성분을 비교 분석하여 차이가 있음을 보고하였다. 제주산에는 pulegone (48.12%) > L-menthone (19.47%) > D/L-limonene (10.34%) > β-caryophyllene (2.98%) > estragole (0.59%)으로 pulegone이 주성분이었고, 전남산은 estragole (67.25%) > L-menthone (10.53%) > β-caryophyllene (4.29%) > L-menthone (3.6%) > pulegone (2.25%)으로 estragole이 주성분이었으며, 경북산은 eugenol methyl ester (37.04%) > estragole (26.99%) > D/L-limonene (10.04%) > L-menthone (3.48%) > β-caryophyllene (3.41%) > pulegone (1.18%)로 eugenol methyl이 주성분이었다. 이러한 결과는 배초향 에센셜오일의 화학종이 estragole 타입, methyl eugenol 타입, p-menthan-3-one 타입이라는 결과와 동일한 것이다. 여기서 제주산의 pulegone의 이명이 p-menthan-3-one이며, eugenol methyl은 methyl eugenol이다. 그런데 Lee 등 (2001)은 배초향 에센셜오일 주성분에 따라 화학종을 limonene 타입, estragole 타입, trans-β-ocimene 타입으로 분류하였는데 이는 앞서 기술한 타입 (Moon et al., 2012)과는 다른 것이다.
그리고 Charles 등 (1991)과 Li 등 (2013)은 미국산 배초향 (USDA 4721)과 중국산 배초향 에센셜오일의 주성분이 각각 methyl chavicol (estragole, 92.3%)과 methyl chavicol (50.51%)이라 보고하여 화학성분은 같지만 함량이 다르다고 보고하였다. Skakovskii 등 (2010)은 주성분이 isomenthone (개화기 43.6%)이라 발표하였는데 이는 (2S,5S)-5-methyl-2-propan-2-ylcyclohexan-1-one으로 앞서 언급한 타입과는 전혀 다른 것임을 알 수 있다. 이러한 결과를 종합해 보면 배초향 에센셜오일 주성분에 따른 화학종은 estragole 타입, methyl eugenol 타입, p-menthan-3-one 타입, trans-β-ocimene 타입, isomenthone 타입으로 분류할 수 있을 것이다.
배초향 에센셜오일에 함유된 화학성분은 추출방법에 따라 달라진다고 연구자들은 보고하였다. SDE는 배초향 시료에 수증기를 쐬어서 식물체에 있는 휘발성 화학성분들을 추출하고, SFE는 배초향 시료를 가스-액체의 초임계점에 이른 CO2 가스를 이용하여 화학성분을 추출하며, OSE는 배초향 시료를 유기용매를 이용하여 추출하기 때문에 추출되는 화학성분에 차이가 있을 수 밖에 없다. 이러한 추출방식의 차이로 인해서 화학성분은 달라지며 비록 배초향에 많이 함유된 화학성분이라도 추출하게 되면 함량에 있어서도 차이가 나기도 한다.
Kim 등 (2001a)은 배초향 시료를 SDE와 SFE로 추출하고 화학성분을 비교분석하였는데 SDE로 추출한 에센셜오일의 함량은 methyl chavicol (27.17%) > isomenthone (24.63%) > hexadecanoic acid (12.97%) > menthone (5.54%) > anethole (2.67%) > piperitone (2.55%)의 순이었으나, SFE로 추출한 에센셜오일의 함량은 isomenthone (15.27%) > hexadecanoic acid (13.71%) > methyl chavicol (12.61%) > benzoic acid (3.82%) > 3-(1-propenyl)phenol (3.29%)의 순이었다. 이러한 결과들은 두 추출방법에 따라 주성분과 함량에서 차이가 났다는 보여주고 있다. 그리고 Song 등 (2002)은 SDE로 추출한 배초향 에센셜오일에는 총 13 종의 화합물이 검출된 반면, 또다른 추출방법인 solid phase microextraction (SPME) 추출법으로 추출한 에센셜오일에는 총 16 종의 화합물이 검출되었다고 보고하였다. SPME는 식물체 시료를 저온으로 가열하고 이때 휘발되는 휘발성 유기화합물을 흡·탈착시키는 방법으로 분석하기에 검출되는 화학성분은 차이가 날 수 밖에 없었다고 사료된다. 그러나 추출방법간의 차이에도 불구하고 주성분은 estragole과 isopulegone이 50% 이상 차지하는 것으로 나타났는데 이러한 결과는 배초향에 두 화학성분이 많이 함유되어있기 때문이라고 판단된다.
배초향 시료의 건조 유무는 화학성분의 변화에 있어서 매우 중요하다고 할 수 있다 (Kim, 1998).
잎이 건조되지 않은 생초잎에 함유된 에센셜오일에는 estragole (92.11%) > limonene (2.19%) > cis-3-hexenol (1.06%) > β-caryophyllene (1.02%)의 순으로 총 45 개의 화학성분이 검출되었던 반면, 건조된 상태의 건초잎에 함유된 에센셜오일에는 estragole (92.05%) > limonene (2.30%) > β-caryophyllene (1.48%)의 순으로 38 개의 화학성분이 함유되어 있었다. 생초잎에는 건초잎과는 달리 cis-3-hexenol이 발견되었는데 이 화학성분은 풀 향기의 주성분으로 잘 알려져 있기에 건조과정 중 다른 화학성분으로 변환되었을 것이라 추론된다.
7. 배초향 에센셜오일의 생리활성
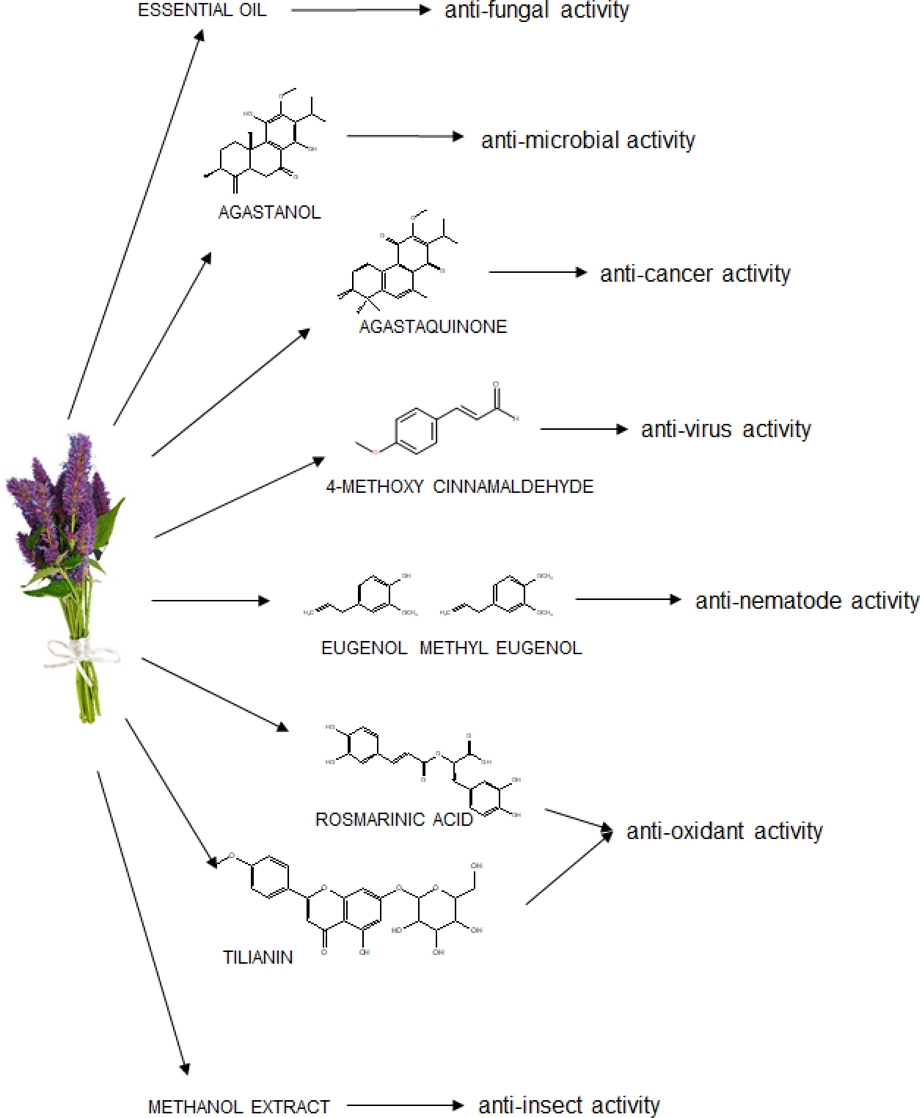
식품의약품안전처 식품의약품안전평가원에서 발행한『곽향 (Agastachis Herba)』에는 배초향 추출물의 생리활성으로 항염증과 항산화 효능, 기억력 개선과 항불안 효능, 간 보호 효능, 기관지 천식 및 알러지 비염에 대한 효능, 호흡기 점액생성과 분비 조절 효능이 기재되어 있다 (NIFDSE, 2018). 그러나 이러한 생리활성은 곽향 시료를 70% 에탄올 혹은 물로 추출한 결과여서 에센셜오일과는 물리화학적 성질이 다르다고 할 수 있다. 배초향 에센셜오일과 생리활성물질들이 나타내는 생리활성으로는 항균, 항진균, 항바이러스, 항돌연변이 및 항암, 살선충, 살충, 항산화와 알츠하이머 완화 활성을 들 수 있으며 Table 4에 정리해 놓았다.

Overview of biological activities of Korean mint [Agastache rugosa (Fisch. & C. A. Mey.) O. Kuntze].
배초향 에센셜오일 원액은 포도상구균에 대해 강한 항균력을 나타내었지만 항균성은 비특이적으로 광범위하게 나타났다 (Park et al., 2000). 저자들은 소화기계의 식중독에 배초향이 유효하게 사용되었다는 점은 항균활성 때문이라 추론하였다.
Lee 등 (2002b)은 배초향 에센셜오일은 포도상구균 뿐만 아니라 장의 염증이나 질병을 일으키는 병원균에 효과를 보였는 데 식중독을 일으키며 감염 시 출혈성 신증후군 및 장염을 일으키는 Escherichia coli O157:H7 ATCC 43895와 인간에게 장티푸스 등 장내 질병을 유발하는 Salmonella typhymurium ATCC 7988에 대해서 농도 의존적으로 억제하였다고 보고하였는데 이러한 배초향의 항균작용의 기작 (mechanism of action)으로 미생물 세포의 내부 구조를 관찰한 결과, 배초향 에센셜오일에 처리된 미생물의 외부와 내부구조에 큰 변형이 일어난 것을 관찰하였다. 이러한 세포구조적 변화는 에센셜오일이 세포에 있는 원형질막 등 막 구조를 붕괴시켜 원형질 등 내용물의 유출을 통해 세포를 사멸시킨다고 사료된다.
배초향에 함유된 항균활성물질을 탐색하고자 Son (2003)은 배초향을 열수로 추출하고 추출물을 chloroform, ethylacetate, butanol, water로 분획한 다음 그람 양성균 9 종과 그람 음성균 7 종을 대상으로 항균활성을 검정하였다. Ethylacetate 분획물은 그람 양성균과 그람 음성균 17 종에 대해 강한 항균활성을 나타내었는데 이에는 chavicol (30.43%) > 1-bromomethyl-3-nitro-benzene (21.39%) > coumarin (12.67%) > eugenol (8.19%) > 1-(3-methyl-2-butenoxy)-4-(1-propenyl) benzene (5.68%) > benzoic acid (3.40%)이 함유되어 있었다.
배초향 생초와 건초에 함유된 화학성분의 항균활성 비교를 위하여 Kim (1998)은 에센셜오일을 추출하고 14 종 미생물 (그람 양성균 6 종, 그람 음성균 6 종, yeast 2 종)을 대상으로 항균활성을 검정한 결과 14 종 모두 강한 항균활성을 보였다고 보고하였다. 특히 배초향 에센셜오일은 Candida utilis와 Saccharomyces cerevisiae에 대하여 높은 항균활성을 나타내었는데 생초 에센셜오일에는 estragole, limonene, cis-3-hexenol, β-caryophyllene 등 총 45 종의 화합물이, 그리고 건초 에센셜오일에는 estragole, limonene, β-caryophyllene 등 총 38 종의 화합물이 함유되어 있다고 보고하였다. Gong 등 (2017)은 배초향의 항균활성은 중국에서도 입증되었는데 중국 진장에서 재배된 배초향 화서의 에센셜오일은 Staphylococcus aureus와 Escherichia coli를 강하게 억제하였고, 잎의 에센셜오일은 Candida albicans를 강하게 억제하였다고 보고하였다.
많은 연구자들은 배초향 에센셜오일이 항균활성을 나타낸다고 보고하였지만 항균활성에 직접 관여하는 화학성분에 대한 연구결과는 보고된 바가 없으며 어떻게 균을 사멸시키는지에 대한 구체적인 작용기작에 대해서도 밝혀진 바가 없다. 향후 이에 대한 연구 결과는 배초향의 의료제품 개발에 도움이 될 것이다.
Lee 등 (1994a)은 배초향 뿌리로부터 추출된 밝은 담황색의 침상 결정형 diterpene 화합물인 agastanol [18(4→3)-abeo-11,14-dihydroxy-12-methoxy abieta-4(19),8,11,13-tetraen-7-one]은 7 종의 피부진균에 대하여 약하나마 항진균활성을 나타내는 것으로 보고하였지만 이 결과는 에센셜오일의 형태는 아니었다.
에센셜오일이 항진균활성을 보인다는 보고는 Kang (2002)에 의해 이루어졌는데 배초향 에센셜오일에 함유된 estragole은 Aspergillus niger, A. flavus, Trichoderma viride, Candida albicans, C. utilis, C. tripicalis, Cryptococcus neoformans, Trichosporon mucoides, Trichophyton tonsurans, Blastoschizo myces capitatus 등 10 종의 진균에 대해 강한 활성을 나타낸다고 보고하였고, estragole의 최소저해농도 (minimum inhibitory concentration)는 5 ㎎·㎖-1 - 20 ㎎·㎖-1이었다.
배초향에 함유되어 있는 4-methoxy cinnamaldehyde는 인간호흡기 세포융합 바이러스에 대하여 항바이러스 효과를 나타냈는데 (Wang et al., 2009) 이 화학성분은 바이러스 부착을 방해하여 바이러스가 침입하는 것을 저해한다고 알려져 있다 (Fig. 3). 항바이러스 활성은 4-methoxy cinnamaldehyde 이외에도 pachypodol (4‘5-dihydroxy-3,3’,7-trimethoxyflavone)도 일으키는 것으로 보고되었는데 (Ishitsuka et al., 1982) 배초향 잎에서 분리한 pachypodol은 매우 지용성인 플라보놀 (flavonol)로 rhinovirus, coxsackievirus, poliovirus와 같은 RNA virus를 매우 선택적으로 제어한다고 하였다.
배초향 에센셜오일은 Chinese hamster ovary AS52 cell에 대하여 농도의존적으로 항돌연변이 활성을 나타내었다 (Kim et al., 2001b). 이에 함유된 estragole과 limonine보다는 에센셜오일 그 자체가 높은 활성을 나타내었는데 배초향 에센셜오일 0.2 g·ℓ-1, 0.6 g·ℓ-1, 1.0 g·ℓ-1 처리 시 항돌연변이 활성은 각각 14%, 68%, 75%의 저해율을 나타내어 농도의존적인 저해활성을 나타내었다.
Lee 등 (2002a)은 배초향에 함유된 diterpene인 agastaquinone이 폐, 난소, 흑색종, CNS와 대장암과 같은 여러 암세포에 대해 세포독성 효과를 보였지만 agastinol과 agastenol은 백혈병세포 U937에 대해 보호효과를 나타낸다고 보고하였다 (Fig. 3).
Li 등 (2013)은 배초향 에센셜오일은 Meloidogyne incognita에 대하여 강한 살선충활성을 나타내었으며 LC50값은 47.3 ㎍·㎖-1이었으며 에센셜오일에 함유된 eugenol과 methyl eugenol 이 살선충 활성을 나타내는 주성분이라 보고하였는바 (Fig. 3) 배초향은 뿌리혹선충 (root-knot nematode)을 방제하는데 아주 좋은 천연 살선충제로 개발 가능할 것이라 판단된다.
배초향 메탄올 추출물은 담배의 생산과 품질에 영향을 미치는 저장해충인 Lasioderma serricorne에 대하여 살충 효과를 나타낸다고 보고하였고 (Kim et al., 2003a), Kim 등 (2003b)은 쌀 바구미 (rice weevile)인 Sitophilus oryzae와 콩바구미 (bean weevile)인 Callosobruchus chinensis에 대하여 살충 효과가 있다고 보고한 바 있다.
Kim 등 (2007) 또한 배초향은 산란계 가금류에 손실을 입히는 주요 흡혈 기생충인 Dermanyssus gallinae De Geer에 대해서도 효과가 있어 현재 사용 중인 훈증제의 대체제가 될 것이라 제안하였고, Andrés 등 (2012)은 배초향 에센셜오일이 소나무재선충인 Bursaphelenchus xylophilus를 고사시키는 효과가 있다고 보고하였다. 이러한 결과들은 모두 배초향에 살충활성을 나타내는 화학성분이 존재한다는 것을 시사하지만 에센셜오일에 함유된 어떤 화학성분이 살충 효과를 나타내는지에 대해서는 보고된 바가 없다.
Sa 등 (2013)은 국내 자생식물인 구절초, 미역취, 고본, 산부추, 좀개미취, 꿩의비름, 고려엉겅퀴, 벌개미취, 배초향의 DPPH 소거능 측정, 환원력 측정, 총 페놀함량, 총 플라보노이드 함량 측정을 통해 항산화 활성을 검정한 결과, 배초향의 DPPH 소거능인 SC50이 74.6 ㎍·㎖-1, 환원력은 50 ㎍·㎖-1, 그리고 총 페놀함량은 134.6 ㎎·GAE·㎖-1로 대상 식물들 중가장 높은 항산화능을 보유하고 있다고 보고하였다. Sa 등 (2013)의 연구에서 배초향 꽃을 분획한 결과 페놀화합물은 주로 ethyl acetate 층에 다량 존재한다는 것을 확인하였으나 ethyl acetate 층에서 항산화 효과가 있는 화합물을 단리하지는 못하였으며 Lee 등 (2007)은 배초향 메탄올 추출물로부터 항산화물질로 알려진 tilianin을 분리 동정하였지만 ethyl acetate 층으로부터 분리된 것인지는 명확하지 않다.
배초향 식물부위 중에서는 줄기의 항산화능이 가장 높게 나타났는데 Desta 등 (2015)은 진주산 배초향의 줄기, 잎, 꽃, 뿌리 추출물의 항산화능을 검정한 결과 줄기 > 잎 > 꽃 > 뿌리 순으로 효과가 높았다고 보고하였다.
Oh 등 (2006)은 배초향에 함유된 페놀화합물의 항산화 효과를 조사하여 배초향 물 추출물에 함유된 caffeic acid derivatives와 같은 페놀 화합물들은 직접 항산화와 heme oxygenase-activating mechanism에 관여한다고 보고하였다.
배초향이 항산화 활성이 있다는 보고로부터 활성물질을 탐색하는 연구가 이루어져 현재는 rosmarinic acid와 tilianine이 활성물질임이 밝혀졌는데 (Fig. 3), Kim 등 (1999)은 배초향으로부터 rosmarinic acid를 분리하고 free radical 소거능을 측정한 결과 항산화능력이 천연 항산화물질인 α-tocopherol이나 BHT보다도 훨씬 높았다고 보고하여 rosmarinic acid가 항산화물질임을 밝혔으며 rosemarinic acid는 페닐알라닌과 티로 신의 두 방향족 아미노산의 결합체로 병원균 및 초식동물에 대한 식물방어 물질로 역할을 하며, 또한 항바이러스, 항염, 항균성을 가지고 있어서 불안이나 우울증 예방에도 도움이 되는 것으로 알려져 있다 (Cuvelier et al., 1996; Chen and Ho, 1997; Takeda et al., 2002).
배초향 메탄올 추출물의 DPPH에 의한 항산화효과를 검정한 결과 60% 메탄올과 30% 메탄올이 대조약물인 vitamin A의 IC50 값과 비교하여 우수한 활성을 보였고 (Lee et al., 2007), 에탄올 추출물 (70%)의 DPPH 항산화능은 78.7%로 감국 (Chrysanthemum indicum), 구절초 (Chrysanthemum zawadskii var. latilobum), 삼백초 (Saururus chinensis), 배암차즈기 (Salvia plebeia), 울릉미역취 (Solidago virga-aurea var. gigantea), 백리향 (Thymus quinquecostatus), 케모마일 (Chamaemelum nobile), 라벤더 (Lavandula stoechas), 페퍼민트 (Mentha piperita), 로즈마리 (Rosmarinus officinalis)의 항산화능보다도 높았다고 보고되었다 (Choi et al., 2010b).
Lee 등 (2007)은 메탄올 추출물로부터 분자식 C22H22O10의 tilianin으로 알려져 있는 acacetin-7-O-β-D-glucopyranoside을 분리동정하였는데 이 화합물은 피부점막의 노화를 방지하는 천연 항산화물질로 의약품이나 기능성 화장품 원료로서 개발가능성이 높기에 배초향의 활용범위는 식물뿐만 아니라 기능성 화장품과 의약품으로까지 확대될 수 있다고 사료된다.
Kim 등 (2015)은 배초향이 항산화효과가 탁월하다는 점에 착안하여 배초향 발효추출물의 주름개선 효과를 검정하였다. 배초향 에탄올 추출물 (1.0 ㎎·㎖-1) 처리 시에는 77.4 ng·㎖-1의 collagen이 생성되었던 반면 유산균 발효 에탄올 추출물처리 시에는 113.1 ng·㎖-1의 collagen이 생성되어 46%의 collagen이 더 많이 생성된다고 보고하였다. 이러한 결과는 발효공정이 collagen 생성을 증진시켰다는 증거라고 판단하여 배초향 발효 추출물은 주름개선에 효과가 있을 것이라 제안하였다.
Guo 등 (2011)은 배초향 에센셜오일은 40℃에 놓인 돼지의 열 스트레스 (heat stress)를 경감시키며, 에센셜오일 처리 시 malondialdehyde 수준이 낮아졌고, SOD와 GPx 활성은 대조구 수준으로 회복되었다고 보고하였다.
배초향 에센셜오일의 acetylcholinesterase (AChE)에 대한 IC50은 69.06 ㎍·㎖-1이었고 butylcholinesterase에 대한 IC50은 76.71 ㎍·㎖-1이었고 이는 양성 대조군이었던 berberine의 값과 비교하였을 때 매우 높았는데, 이것은 배초향 에센셜오일이 cholineseterase 작용을 억제함에 따라 뇌내에서 acetylcholine의 분해를 막아 그 농도가 증가할 것이라 추론하였다 (Choi et al., 2016). 배초향 에센셜오일의 cholinesterase에 대한 저해활성과 중추신경계에 대한 활성은 보고된 적이 없어서 향후 배초향 에센셜오일은 알츠하이머 질환치료에 활용될 수 있을 것이다.
현재까지 보고된 배초향 에센셜오일의 생리활성은 항균 활성, 항진균 활성, 항바이러스 활성, 항돌연변이 및 항암활성, 살선충 활성, 살충 활성, 항산화 활성, 주름개선 활성과 스트레스 및 알츠하이머 완화 활성을 들 수 있다. 배초향이 나타내는 항균, 항진균, 항바이러스, 항돌연변이 및 항암 활성, 스트레스 및 알츠하이머 완화 활성은 의약품 산업에 응용될 수 있을 것이고, 주름개선과 항산화 활성은 뷰티 산업에 응용될 수 있다. 그리고 항산화 활성은 식품 산업, 뷰티 산업과 의약품 산업 등에 응용될 수 있으므로 배초향에 대한 지속적인 연구개발은 재배농가뿐만 아니라 고부가가치 산업제품을 개발하는 산업체에도 큰 도움이 될 수 있을 것이다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ01450601)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
- Ahn B and Yang CB. (1991). Voltile flavor components of Bangah(Agastache rugosa O. Kuntze) herb. Korean Journal of Food Science and Technology. 23:582-586.
-
Andrés MF, González-Coloma A, Sanz J, Burillo J and Sainz P. (2012). Nematicidal activity of essential oils: A review. Phytochemistry Review. 11:371-390.
[https://doi.org/10.1007/s11101-012-9263-3]

-
Baik JA. (2016). Analysis, antibacterial, and insecticide effects on domestic native fragrant plants Elsholtzia ciliata and Agastache rugosa. Journal of People, Plants, and Environment. 19:79-83.
[https://doi.org/10.11628/ksppe.2016.19.2.79]

-
Charles DJ, Simon JE and Widrlechner MP. (1991). Characterization of the essential oil of Agastache species. Journal of Agricultural and Food Chemistry. 39:1946-1949.
[https://doi.org/10.1021/jf00011a011]

-
Chen JH and Ho CT. (1997). Antioxidant activities of caffeic acid and its related hydroxycinnamic acid compounds. Journal of Agricultural and Food Chemistry. 45:2374-2378.
[https://doi.org/10.1021/jf970055t]

- Choi IY, Moon JS, Cho CH and Song YJ. (2010a). Cultivation technique of Agastache rugosa O. Kuntze for high quality herb production. Journal of Agriculture and Life Sciences. 41:1-7.
- Choi IY, Song YJ and Lee WH. (2010b). DPPH radical scavenging effect and antimicrobial activities of some herbal extracts. Korean Journal of Horticultural Science and Technology. 28:871-876.
- Choi IY, Song YJ, Choi DC and Lee WH. (2010c). A comparative study for obtaining maximum essential oil from six herbs on the basis of harvesting time, cultivation regions and type, and drying methods. Korean Journal of Horticultural Science and Technology. 28:492-496.
- Choi JS, Song BM and Park HJ. (2016). Gas chromatographic analysis and cholinesterase activity of the essential oil from Korean Agastache rugosa. Korean Journal of Pharmacognosy. 47:192-196.
- Choi SK and Lee JI. (1994). Effects of planting dates and density on agronomic characteristics and yield of Agastach rugosa Kuntze. Korean Journal of Plant Resources. 7:143-147.
-
Cuvelier ME, Richard H and Berset C. (1996). Antioxidative activity and phenolic composition of pilot plant and commercial extracts of sage and rosemary. Journal of the American Oil Chemists Society. 73:645-652.
[https://doi.org/10.1007/BF02518121]

-
Dayan FE, Howell JL, Marais JP, Ferreira D and Koivunen M. (2011). Manuka oil, a natural herbicide with preemergence activity. Weed Science. 59:464-469.
[https://doi.org/10.1614/WS-D-11-00043.1]

-
Dũng NX, Cu LD, Thái NH, Mõi Ld, Hac LV and Leclercq PA. (1996). Constituents of the leaf and flower oils of Agastache rugosa(Fisch. et Mey) O. Kuntze from Vietnam. Journal of Essential Oil Research. 8:135-138.
[https://doi.org/10.1080/10412905.1996.9700580]

-
Fujita S and Fujita Y. (1973). Miscellaneous contributions to the essential oils of plants from various territories XXXIII essential oil of Agastache rugosa O. Kuntze. Yakugaku Zasshi. 93:1679-1681.
[https://doi.org/10.1248/yakushi1947.93.12_1679]

-
Gong H, Li S, He L and Kasimu R. (2017). Microscopic identification and in vitro activity of Agastache rugosa(Fisch. et Mey.) from Xinjiang, China. BMC Complementary and Alternative Medicine. 17:95. https://bmccomplementmedtherapies.biomedcentral.com/articles/10.1186/s12906-017-1605-7, (cited by 2020 Jan 13).
[https://doi.org/10.1186/s12906-017-1605-7]

-
Gong H, Zhou X, Zhu M, Ma X, Zhang X and Tian S. (2012). Constituents of essential oil isolated from the dried flower and leaf of Agastache rugosa(Fisch. et Mey) from Xinjiang, in China. Journal of Essential Oil Bearing Plants. 15:534-538.
[https://doi.org/10.1080/0972060X.2012.10644084]

-
Guo KJ, Xu SF, Yin P, Wang W, Song XZ, Liu FH, Xu JQ and Zoccarato I. (2011). Active components of common traditional Chinese medicine decoctions have antioxidant functions. Journal of Animal Science. 89:3107-3115.
[https://doi.org/10.2527/jas.2010-3831]

-
Hellyer RO. (1968). The occurrence of β-triketones in the steam-volatile oils of some myrtaceous Australian plants. Australian Journal of Chemistry. 21:2825-2828.
[https://doi.org/10.1071/CH9682825]

-
Holmes P. (1997). Patchouli: The colours within the darkness. International Journal of Aromatherapy. 8:18-22.
[https://doi.org/10.1016/S0962-4562(97)80040-9]

-
Hong JJ, Choi JH, Oh SR, Lee HK, Park JH, Lee KY, Kim JJ, Jeong TS and Oh GT. (2001). Inhibition of cytokine-induced vascular cell adhesion molecule-1 expression: Possible mechanism for anti-atherogenic effect of Agastache rugosa. FEBS Letters. 495:142-147.
[https://doi.org/10.1016/S0014-5793(01)02379-1]

-
Hu LF, Li SP, Cao H, Liu JJ, Gao JL, Yang FQ and Wang YT. (2006). GC–MS fingerprint of Pogostemon cablin in China. Journal of Pharmaceutical and Biomedical Analysis. 42:200-206.
[https://doi.org/10.1016/j.jpba.2005.09.015]

-
Ishitsuka H, Ohsawa C, Ohiwa T, Umeda I and Suhara Y. (1982). Antipicornavirus flavone Ro 09-0179. Antimicrobial Agents and Chemotherapy. 22:611-616.
[https://doi.org/10.1128/AAC.22.4.611]

- Kang CA. (2002). Antifungal activity of essential oil from Agastache rugosa O. Kuntze. Mater thesis. Duksung Women’s University. Seoul, Korea. p.1-67.
- Kim JB, Kim JB, Cho KJ, Hwang YS and Park RD. (1999). Isolation, identification, and activity of rosmarinic acid, a potent antioxidant extracted from Korean Agastache rugosa. Journal of the Korean society of Agricultural Chemistry and Biotechnology. 42:262-266.
- Kim KS, Kim SK, Kim YH, Kim YH and Lee JC. (2001a). Comparison of essential oil composition extracted from Agastache rugosa by steam distillation and supercritical fluid extraction. Journal of the Korean Society of Tobacco Science. 23:65-70.
-
Kim MH, Chung WT, Kim YK, Lee JH, Lee HY, Hwang B, Park YS, Hwang SJ and Kim JH. (2001b). The effect of the oil of Agastache rugosa O. Kuntze and three of its components on human cancer cell lines. Journal of Essential Oil Research. 13:214-218.
[https://doi.org/10.1080/10412905.2001.9699669]

- Kim MJ, Yang BH and Kim SM. (2018a). Effect of fragrance of weeds on the behavior of consumers. Weed and Turfgrass Science. 7:98-110.
- Kim MJ. (1998). Antimicrobial activity and components of volatile flavor from Agastache rugosa during storage period and condition. Mater Thesis. Dong-A University. Busan, Korea. p.1-78.
-
Kim NY, Park DS and Lee HY. (2015). Effect of anti-skin wrinkle and antioxidant of Agastache rugosa Kentz through fermentation process of the lactic acid. Korean Journal of Medicinal Crop Science. 23:37-42.
[https://doi.org/10.7783/KJMCS.2015.23.1.37]

-
Kim S, Bok G and Park J. (2018b). Analysis of antioxidant content and growth of Agastache rugosa as affected by LED light qualties. Protected Horticulture and Plant Factory. 27:260-268.
[https://doi.org/10.12791/KSBEC.2018.27.3.260]

-
Kim SI, Na YE, Yi JH, Kim BS and Ahn YJ. (2007). Contact and fumigant toxicity of oriental medicinal plant extracts against Dermanyssus gallinae(Acari: Dermanyssidae). Veterinary Parasitology. 145:377-382.
[https://doi.org/10.1016/j.vetpar.2006.12.021]

-
Kim SI, Park C, Ohh MH, Cho HC and Ahn YJ. (2003a). Contact and fumigant activities of aromatic plant extracts and essential oils against Lasioderma serricorne(Coleoptera: Anobiidae). Journal of Stored Products Research. 39:11-19.
[https://doi.org/10.1016/S0022-474X(02)00013-9]

-
Kim SI, Roh JY, Kim DH, Lee HS and Ahn YJ. (2003b). Insecticidal activities of aromatic plant extracts and essential oils against Sitophilus oryzae and Callosobruchus chinensis. Journal of Stored Products Research. 39:293-303.
[https://doi.org/10.1016/S0022-474X(02)00017-6]

- Kim SS, Heo JH and Lee HJ. (2016). A study on conservation and utilization of agriculture and forest genetic resources in response to the Nagoya protocol. Korea Rural Economic Institute. Naju, Korea. p.139.
-
Krishna S, Bustamante L, Haynes RK and Staines HM. (2008). Artemisinins: Their growing importance in medicine. Trends in Pharmacological Sciences. 29:520-527.
[https://doi.org/10.1016/j.tips.2008.07.004]

-
Kwon SH. (2013). Incense and cultural life in the early and mid-period of Koryo dynasty. Korean Culture Studies. 25:7-35.
[https://doi.org/10.17792/kcs.2013.25..7]

- Lee BK, Bang JK, Kim JK, Park CB and Lee BH. (2001). Chemotaxonomy of essential oils in Elsholtzia ciliata and Agastache rugosa. Korean Journal of International Agriculture. 13:71-77.
- Lee BY and Hwang JB. (2000). Physicochemical characteristics of Agastache rugosa O. Kuntze extracts by extraction conditions. Korean Journal of Food Science and Technology. 32:1-8.
- Lee BY, Yuk JS, Oh SR and Lee HK. (2000). Aroma pattern analysis of various extracts of Agastache rugosa O. Kuntze by electronic nose. Korean Journal of Food Science and Technology. 32:9-16.
-
Lee CH, Kim HA and Kho YE. (2002a). Agastinol and agastenol, novel lignans from Agastache rugosa and their evaluation in an apoptosis inhibition assay. Journal of Natural Products. 65:414-416.
[https://doi.org/10.1021/np010425e]

- Lee HK, Byon SJ, Oh SR, Kim JI, Kim YH and Lee CO. (1994a). Diterpenoids from the roots of Agastache rugosa and their cytotoxic activities. Korean Jouranl of Pharmacognosy. 25:319-327.
-
Lee HK, Oh SR, Kim JI, Kim JW and Lee CO. (1995). Agastaquinone, a new cytotoxic diterpenoid quinone from Agastache rugosa. Journal of Natural Products. 58:1718-1721.
[https://doi.org/10.1021/np50125a011]

- Lee JC, Choi YH and Kim YH. (1994b). Essential oils in aerial parts of Agastache rugosa O. Kuntze. Korean Journal of Medicinal Crop Science. 2:168-173.
- Lee JY, Kang JR and Whang WK. (2007). Antioxidant activity of MeOH extract of aerial part from Agastache rugosa O. Kuntze. Jounal of The Korean Society of cosmetology. 13:1396-1403.
-
Lee SE, Kim SM, Lim WC, Kang KC and Pyo HB. (2014). Comparison of volatile compounds from Thymus magnus Nakai by three different extraction methods. Journal of the Society of Cosmetic Scientists of Korea. 40:171-178.
[https://doi.org/10.15230/SCSK.2014.40.2.171]

- Lee SE, Park CK, Cha MS, Kim JK, Seong NS, Bang KH and Bang JK. (2002b). Antimicrobial activity of essential oils from Mentha arvensis L. var. piperascens Malivaud and Agastache rugosa O. Kuntze on Escherichia coil and Salmonella typhimurium. Korean Journal of Medicinal Crop Science. 10:206-211.
- Lee SH, Kim JK, Kim SW, Kim YW, Choi YH and Kwon JH. (2005). Evaluation of functional properties of the traditional herbs in Korea. Food Engineering Progress. 9:249-261.
- Lee SW, Kim JB, Kim KS and Kim MS. (1999). Changes of growth characteristics, rosmarinic acid and essential oil contents according to harvest time in Agastache rugosa O. Kuntze. Korean Journal of Medicinal Crop Science. 7:83-88.
- Lee TB. (2003). Coloured flora of Korea. Hyangmunsa. Seoul, Korea. p.120.
-
Lee TH, Park SJ, Yoo GJ, Jang CY, Kim MH, Kim SH and Kim SY. (2016). Demethyleugenol β-glucopyranoside isolated from Agastache rugosa decreases melanin synthesis via down-regulation of MITF and SOX9. Journal of Agricultural and Food Chemistry. 64:7733-7742.
[https://doi.org/10.1021/acs.jafc.6b03256]

- Lee YN. (2006). New flora of Korea. Kyo-Hak Publishing Co., Ltd., Seoul, Korea. p.141.
-
Li HQ, Liu QZ, Lie ZL, Du SS and Deng ZW. (2013). Chemical composition and nematicidal activity of essential oil of Agastache rugosa against Meloidogyne incognita. Molecules. 18:4170-4180.
[https://doi.org/10.3390/molecules18044170]

-
Mitchell G, Bartlett DW, Fraser TEM, Hawkes TR, Holt DC, Townson JK and Wichert RA. (2001). Mesotrione: A new selective herbicide for use in maize. Pest Management Science. 57:120-128.
[https://doi.org/10.1002/1526-4998(200102)57:2<120::AID-PS254>3.0.CO;2-E]

-
Moon YG, Hong JS and Song MH. (2012). DPPH radical scavenging activity and composition of essential oil from the herbs of Jeju Agastache rugosa. Journal of Life Science. 22:156-160.
[https://doi.org/10.5352/JLS.2012.22.2.156]

- National Insititute of Korean History(NIKH). (2019). Annals of the Joseon dynasty. National Insititute of Korean History. http://sillok.history.go.kr/search/searchResultList.do, (cited by 2020 Jan 13).
- National Institute of Food and Drug Safety Evaluation (NIFDSE). (2018). Agastachis Herba. National Insititute of Food and Drug Safety Evaluation. Korean History. https://www.nifds.go.kr/brd/m_184/view.do?seq=5, (cited by 2020 Jan 18).
- National Institute of Korean History(NIKH). (2020a). Database of Goryeo dynasty. National Insititute of Korean History. http://db.history.go.kr/KOREA/search/searchResult.do?sort=levelId&dir=ASC&limit=20&page=1&pre_page=1&codeIds=PERIOD-0-3&searchTermImages=%EA%B3%BD%ED%96%A5&searchKeywordType=BI&searchKeywordMethod=EQ&searchKeyword=%EA%B3%BD%ED%96%A5&searchKeywordConjunction=AND#searchDetail/kr/kr_009_0080_0060_0010/1/0/1/o, (cited by 2020 Jan 31).
- National Institute of Korean(NIKH). (2020b). The annals of the Joseon dynasty. National Insititute of Korean History. http://sillok.history.go.kr/id/kda_10008014_003, (cited by 2020 Jan 31).
- National Institute of Korean(NIKH). (2020c). The annals of the Joseon dynasty. National Insititute of Korean History. http://sillok.history.go.kr/id/kda_400070, (cited by 2020 Jan 31).
- National Institute of Korean(NIKH). (2020d). The annals of the Joseon dynasty. National Insititute of Korean History. http://sillok.history.go.kr/id/kta_10408021_001, (cited by 2020 Jan 31).
-
Oh HM, Kang YJ, Kim SH, Lee YS, Park MK, Heo JM, Sun JJ, Kim HJ, Kang ES, Kim HJ, Seo HG, Lee JH, Choi HS and Chang KC. (2005). Agastache rugosa leaf extract inhibits the iNOS expression in ROS 17/2.8 cells activated with TNF-α and IL-1β. Archives of Pharmaceutical Research. 28:305-310.
[https://doi.org/10.1007/BF02977797]

-
Oh HM, Kang YJ, Lee YS, Park MK, Kim SH, Kim HJ, Seo HG, Lee JH and Chang KC. (2006). Protein kinase G-dependent heme oxygenase-1 induction by Agastache rugosa leaf extract protects RAW264.7 cells from hydrogen peroxide-induced injury. Journal of Ethnopharmacology. 103:229-235.
[https://doi.org/10.1016/j.jep.2005.08.030]

- Ok HC, Song JS and Chae YA. (1999). Analysis of essential oil and variation of estragol content in different growth stages of Agastache rugosa Kuntze. Korean Journal of Medicinal Crop Science. 7:115-120.
-
Omidbaigi R, Kabudani M and Khoorang M. (2008). Nitrogen fertilizer affecting herb yield, essential oil content and compositions of Agastache foeniculum Purch. Journal of Essential Oil Bearing Plants. 11:261-266.
[https://doi.org/10.1080/0972060X.2008.10643628]

- Park HC, Kim SK, Park KH and Choi KG. (1991). Establishment of cultivation method of Agastache rugosa(Fisher & C.A.Meyer) O. Kuntze. Jeollabuk-Do Agricultural Research and Extension Services. Iksan, Korea. p.129-141.
- Park HJ, Kwon SH, Lee MS, Kim GT, Choi MY and Jung WT. (2000). Antimicrobial activity of the essential oil of the herbs of Agastache rugosa and its composition. Journal of the Korean Society of Food Science and Nutrition. 29:1123-1126.
- Park JH and Lee JK. (2000). Medicinal plant. Shinilsangsa. Seoul, Korea. p.162-163.
- Ryu JH, Baek WJ, Choi SY and Lee KS. (1988). Studies on the cultivation and use of Agastache rugosa Kuntze. Bulletin Agricultural College, Chonbuk National University. 29:70-79.
-
Sa YJ, Park JH, Kim DH, Yeom DH, Cho JC, Kwon YS and Kim MJ. (2013). Comparative study of native flowers for anti-oxidative effects in Korea. Korean Journal of Plant Resources. 26:433-440.
[https://doi.org/10.7732/kjpr.2013.26.4.433]

-
Sandoval IV and Carrasco L. (1997). Poliovirus infection and expression of the poliovirus protein 2B provoke the disassembly of the Golgi complex, the organelle target for the antipoliovirus drug Ro-090179. Journal of Virology. 71:4679-4693.
[https://doi.org/10.1128/JVI.71.6.4679-4693.1997]

-
Shin S and Kang CA. (2003). Antifungal activity of the essential oil of Agastache rugosa Kuntze and its synergism with ketoconazole. Letters in Applied Microbiology. 36:111-115.
[https://doi.org/10.1046/j.1472-765X.2003.01271.x]

-
Shin S. (2004). Essential oil compounds from Agastache rugosa as antifungal agents against Trichophyton species. Archives of Pharmacal Research. 27:295-299.
[https://doi.org/10.1007/BF02980063]

- Shin SH, Kim HK and Chi HJ. (1991). Production of giant hyssop oil by plant tissue culture. Korean Journal of Pharmacognosy. 22:91-94.
-
Skakovskii ED, Kiselev WP, Tychinskaya LY, Schutova AG, Gonsharova LW, Spiridowish EW, Bovdey NA, Kiselev PA and Gaidukevich OA. (2010). Characterization of the essential oil of Agastache rugosa by NMR spectroscopy. Journal of Applied Spectroscopy. 77:329-334.
[https://doi.org/10.1007/s10812-010-9335-3]

- Son JE. (2003). Antimicrobial activity and components of extracts from Agastach rugosa. Master Thesis. Dong-A University. Busan, Korea. p.1-50.
- Song YA. (2016). Literature study on Korean traditional aromatheraphy. Ph.D. Thesis. Sungshin University. Seoul, Korea. p.1-226.
- Song YE, Ku CS, Mun SP, Ryu JS, Kim DH, Choi JS and Choi YG. (2002). Volatile aroma compounds and their characteristics of Labiatae by solid-phase microextraction(SPME). Korean Journal of Medicinal Crop Science. 10:120-125.
-
Svoboda KP, Gough J, Hampson J and Galambosi B. (1995). Analysis of the essential oils of some Agastache species grown in Scotland from various seed sources. Flavour and Fragrance Journal. 10:139-145.
[https://doi.org/10.1002/ffj.2730100305]

-
Takeda H, Tsuji M, Miyamoto J and Matsumiya T. (2002). Rosmarinic acid and caffeic acid reduce the defensive freezing behavior of mice exposed to conditioned fear stress. Psychopharmacology. 164:233-235.
[https://doi.org/10.1007/s00213-002-1253-5]

- Wang JG. (2010). GC-MS Analysis of chemical composition of volatile oil from Agastache rugosa. Food Science. 31:223-225.
-
Wang KC, Chang JS, Chiang LC and Lin CC. (2009). 4-Methoxycinnamaldehyde inhibited human respiratory syncytial virus in a human larynx carcinoma cell line. Phytomedicine. 16:882-886.
[https://doi.org/10.1016/j.phymed.2009.02.016]

-
Wu Y, Li C, Li X, Yuan M and Hu X. (2013). Comparison of the essential oil compositions between Pogostemon cablin and Agatache rugosa used as herbs. Journal of Essential Oil Bearing Plants. 16:705-713.
[https://doi.org/10.1080/0972060X.2013.862077]

-
Yeon BR, Cho HM, Yun MS, Jhoo JW, Jung JW, Park YH and Kim SM. (2012). Comparison of fragrance and chemical composition of essential oils in Gom-chew(Ligularia fischeri) and Handaeri Gom-chew(Ligularia fischeri var. spicifoprmis). Journal of the Korean Society of Food Science and Nutrition. 41:1758-1763.
[https://doi.org/10.3746/jkfn.2012.41.12.1758]

-
Yun MS, Cho HM, Yeon BR, Choi JS and Kim SM. (2013). Herbicidal activities of essential oils from pine, nut pine, larch and khingan fir in Korea. Weed and Turfgrass Science. 2:30-37.
[https://doi.org/10.5660/WTS.2013.2.1.030]