
Aspergillus awamori로 발효한 황기 열수 추출물의 이화학적 특성과 항염증 효과
 ; Da Bin Lee2
; Da Bin Lee2 ; Bit Na Song3
; Bit Na Song3 ; Bo Ram Park4 ; Sung Hyen Lee5
; Bo Ram Park4 ; Sung Hyen Lee5 ; Ji Ho Choi6 ; Shin Young Park7, †
; Ji Ho Choi6 ; Shin Young Park7, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Fermentation of medicinal plants increases their absorption rate and bioavailability in the body. Astragalus membranaceus has been used as a raw material, but research in its use as a food ingredient is lacking. Therefore, the purpose of this study was to identify the physicochemical characteristics and anti-inflammatory effect of fermented Astragalus membranaceus.
Astragalus roots were fermented using Aspergillus awamori for 4 days and their extracts prepared using hot water. The pH, total acidity (%), and reducing sugar (%) of the extracts were then investigated. The pH and total acidity decreased during fermentation. After fermentation, the pH and total acidity decreased, whereas the reducing sugar level increased. The active ingredients in fermented Astragalus were calycosin-7-O-ßd-glucoside, ononin, calycosin and formononetin. The calycosin contents was highest in the hot-water extracted samples fermented for 4 days. The other components were similar to those in control. Nitric oxide level was lower in the hot-water extracted samples fermented for 4 days than in lipopolysaccharide control group. The sample fermented for 4 days was confirmed to inhibit the production of tumor necrosis factor-α and interleukin-1β.
Our results showed the physicochemical properties and anti-inflammatory effects of A. membranaceus after fermentation using Aspergillus awamori. These results indicated that fermented Astragalus membranaceus can be used as a functional food.
Keywords:
Astragalus membranaceus (Fisch.) Bunge, Aspergillus awamori, Anti-inflammatory, Cytokine, Fermentation서 언
황기 [Astragali Radix; Astragalus membranaceus (Fisch.) Bunge]는 콩과 (Leguminosae)에 속하는 다년생 초본식물이다. 뿌리 그대로 혹은 주피를 제거하여 건조시켜 사용한다 (Lee et al., 2011). 아시아, 중국, 유럽, 아프리카 지역에 분포하고 있으며 한국에서는 충북, 강원도 등지에서 재배하며 한약재로 주로 사용한다. 황기는 골다공증 개선, 세포성장 작용, 항종양작용, 항산화 작용, 항암효과, 이뇨작용, 강장, 혈압강하 작용, 항염증, 항관절 및 항고혈압 등의 효능이 보고된 바 있다. 또한 독성이 없어 안전하기 때문에 식용과 약용으로 사용하는 약초이다 (Kim et al., 2013; Su et al., 2016; Choi et al., 2019). 한방에서는 황기건중탕, 십전대보탕, 방기황기탕 등으로 처방하고 있다 (Im et al., 2010).
황기의 주요 성분은 polysaccharide, saponin, isoflavoniod, 아미노산과 미량원소로 이루어져 있으며 isoflavoniod 계열에는 calycosin-7-σ-β-D-glucoside, ononin, formononetin, calycosin 등의 성분이 있다. 이러한 성분들은 약리작용을 하여 면역증강과 함염증작용 등의 효과가 있다 (Choi et al., 2019). 황기의 calycosin-7-σ-β-D-glucoside 성분은 토끼 골관절염 모델에서 토끼 무릎관절의 병리적 변형을 경감시키는 효과를 확인하여 골관절염 후보 치료제 소재로서 효능을 보고하였다 (Su et al., 2016). Calycosin과 formononetin은 항관절 효과, 항노화 효과 및 보습효과가 있다 (Im et al., 2010; Kim et al., 2013).
Aspergillus awamori가 생육하면서 만들어내는 β-glucosidase와 같은 당분해 효소가 황기에 비배당체 형태로 존재하고 있는 isoflavonoids를 배당체 형태로 전환한다 (Jang et al., 2016a). 미생물에 의해 고분자 구조의 물질이 다당체, 올리고당, 아미노산 펩타이드 등의 저분자 구조로 분해되어 체내 흡수율이 높아지고, 발효 과정에서 생리활성물질이 풍부하게 생성되어 생체이용률이 증대시켜 신기능 소재로서의 활용 가치가 있다 (Song et al., 2018; Yang et al., 2007).
Nitric oxide (NO)는 L-arginine을 전구물질로 nitric oxide synthase (NOS)에 의해 생성되며, 합성효소에는 endothelial (eNOS), neuronal (nNOS), cytokine inducible (iNOS)로 세가지 형태가 있다 (Kradin et al., 2005). NO는 혈압을 조절하는 역할을 하며 염증반응과 면역반응에서 항원이나 세균과 같은 외부로부터의 자극으로 인하여 다량 생산된다. 그리고 신체 내의 암세포에 대하여 독성을 가져 신체를 보호한다 (Yang et al., 2007).
Cytokine은 면역세포들이 생산하는 매개물질 중의 하나로 염증반응과 면역반응을 조절한다 (Jin et al., 2017). 대표적으로 tumor necrosis factor (TNF)-α, interleukin (IL)-1β와 IL-6이다. 이 중 TNF-α 는 활성화된 대식세포에서 주로 대량 생산되며 lipopolysaccharide (LPS)로 자극할 경우 생산량이 더 많아진다. TNF-α의 증가는 열, 부종, 통증 등을 일으키고 더 나아가 미세혈관의 혈전, 심장 박출량 억제와 다른 염증세포를 활성화시켜 조직 손상을 촉진시킨다 (Tak et al., 2014). 또 IL-6, IL-10 과 같은 사이토카인의 생성으로 B 림프구를 활성화시킨다는 보고가 있다 (Seo et al., 2013; Tak et al., 2014). IL-1β는 체내에서 매우 낮은 농도로 세포 성장이나 항상성을 유지하는 역할을 하지만 염증반응에 의해서는 대량 생산되어 증상을 악화시킨다 (Tak et al., 2014).
따라서 본 연구에서 Aspergillus awamori로 황기를 발효하여 비배당체 형태인 calycosin-7-β-glucopyranoside를 배당체형태인 calycosin, formononetin으로 전환하여 함량을 증가시켜 체내 흡수율을 높이고 항염증 실험을 통해 발효 황기가 기능성 식품으로 쓰일 수 있는 기초자료를 제공하고자 한다.
재료 및 방법
1. 실험재료
누룩균은 국립농업과학원 발효식품과에서 분리한 Aspergillis awamori N60247 를 분양받아 사용하였다. 균의 보존용 배지로는 potato dextrose agar (PDA, Difco Laboratories Inc., Detroit, MI, USA) 배지를 사용하여, 30℃에서 5 일간 평판 배양한 다음 접종원으로 사용하였다. 황기 [Astragalus membranaceus (Fisch) Bunge]는 충북 제천산 3년근으로 경동시장에서 구입하여 농촌진흥청 원예특작과학원 약용작물과에서 확인 후 사용하였다.
2. 누룩 제조
누룩 제조과정은 다음과 같다. 쌀을 물로 2 회 - 3 회 씻어 물에 2 시간 불린 후 물 빼기를 1 시간 하고 고두밥을 만들었다. 고두밥을 35℃ - 40℃로 식힌 후 Aspergillis awamori를 접종하였다. 30℃ 온도의 배양기 (VS-1203PFHLN, Vision Scientific Co., Ltd., Daejeon, Korea)에 배양하였다.
배양 20 시간 후 1 차 뒤집기를 하고 다시 5 시간 배양 후 2 차 뒤집기를 하고 다시 15 시간 배양하였다. Aspergillis awamori를 접종하여 제조한 누룩을 건조기에 50℃로 24 시간 건조한 후 분쇄기로 분쇄하였다.
3. 균주 배양 및 발효 황기 제조
황기 뿌리를 파쇄하여 멸균 팩에 담아 고압멸균기 (Vision Scientific Co., Ltd., Daejeon, Korea)에서 121℃, 15 분 멸균시킨 다음, Aspergillis awamori를 접종한 누룩을 1% 혼합한 후 30℃ 온도의 배양기 (VS-1203PFHLN, Vision Scientific Co., Ltd., Daejeon, Korea)에서 4 일 발효시켰다. 4 일 동안 발효된 황기뿌리는 -80℃ 초저온냉동기 (deep freezer, ilsin BioBase Co., Ltd., Yangju, Korea)에서 24 시간 동결시킨 후 동결건조기 (freeze dryer, ilsin BioBase Co., Ltd., Yangju, Korea)에서 72 시간 동결건조시킨 것을 추출물의 시료로 사용하였다.
4. 추출물 제조
동결 건조한 발효 황기를 이용하여 열수 추출물을 제조하였다. 열수 추출물의 제조는 다음과 같이 실시하였다. 각 시료 5 g에 85℃ 열수 100㎖을 혼합 후 ultrasonication (Power Sonic 420, 50/60 HZ, 700W Hwashin Co., Ltd., Seoul, Korea) 로 1 시간 씩 2 회 반복 추출한 후 Whatman No. 2 여과지를 이용하여 여과시킨 후, 여과액을 200 ㎖로 정용하여 rotary vacuum evaporator (BUCHI Labortehnik AG, Flawil, Switzerland)를 이용하여 50℃ 이하에서 감압·농축한 뒤, 이를 같은 추출 용매로 용해하여 본 실험의 분석용 시료로 사용하였다.
5. β-glucosidase 활성 측정
베타글루코시다아제 (β-glucosidase) 활성을 측정하기 위하여 1 mM p-nitrophenol-β-D-glucoside (PNPG) 0.5 ㎖를 37℃에서 5 분간 예열한 후 효소액 50 uL를 첨가하였다. 37℃에서 10 분간 반응시킨 다음 200 mM Na2CO3 용액 1 ㎖를 가하여 반응을 정지시킨 후 410 nm에서 흡광도를 측정하여 유리 된 p-nitrophenol을 정량하였다. β-glucosidase 활성은 PNPG에서 37℃, 1 분 동안 1 nmol의 p-nitrophenol을 만드는 역가를 1 unit으로 하였으며 다음 식에 의해서 효소활성을 구하였다.
6. pH 및 산도 측정
6. pH 및 산도 측정 발효 황기의 pH는 시료 2 g을 칭량하여 8 ㎖의 증류수를 가하여 균질화한 후 3,000 rpm에서 15 분간 원심분리 하여 상등액을 취한 후 pH meter (HM-30P, DKK-TOA, Tokyo, Japan)로 측정하였다.
총 산도는 pH 측정의 시료와 동일한 시료를 3,000 rpm에서 15 분간 원심분리한 후 시료액 0.1 ㎖에 0.9 ㎖의 증류수를 가하여 1 ㎖로 정용한 후, 0.1 N NaOH로 pH 8.3에 도달 할 때까지 적정하였다. 적정에 소비된 NaOH 소비량을 이용하여 acetic acid 함량 (%)으로 환산하여 총산 함량을 표시하였다. 실험은 3 회 반복하여 그 평균값으로 나타내었다.
7. 환원당 측정
환원당은 DNS (dinitrosalicylic acid)법 (Lee et al., 2009)에 따라 시료 2 g을 칭량하여 8 ㎖의 증류수를 가하여 균질화한 후 3,000 rpm에서 15 분간 원심분리 하여 상등액을 취한 후 DNS reagent 1 ㎖을 가하여 15 분간 끓인 다음, 냉각한 후 증류수 3 ㎖을 첨가하여 microplate reader (Biotek Syergy Mx, Biotek Instruments, Winooski, VT, USA)를 이용하여 546 ㎚의 파장에서 흡광도를 측정하였다.
당의 정량은 glucose를 표준물질로 사용하였으며, 표준곡선으로부터 환산하여 함량을 산출하였다.
8. Calycosin-7-β-glucopyranoside, calycosin, formononetin, ononin 함량
발효 황기 추출물의 성분분석은 HPLC (Waters 2998, Waters, Miliford, MA, USA)를 이용하여 분석하였다. 추출물 시료의 성분분석을 위하여 0.2 ㎛ PVDF membrane filter (Waters, Miliford, MA, USA)를 통과시킨 후 분석시료를 제조하였으며 발효 황기의 성분분석을 위한 HPLC 분석조건으로 column은 ACQUITY HPLC BEH C18 (1.7 ㎛, 2.1 ㎜ × 50 ㎜), 검출기는 PDA (photodiode array) detector를 이용하였으며 파장은 250 ㎚로 고정하여 사용하였다. 유속은 0.5 ㎖/min이며, 이동상은 용매 A (0.2% acetic acid를 함유한 water)와 용매 B (100% acetonitril)을 기울기 용리로 하여 실시하였다.
지표성분의 정량은 표준물질을 ㎎/㎖로 제조하고 HPLC에서 나타난 peak area의 3 회 반복 평균값을 취한 후 표준품의 양과 peak area 사이의 상관관계를 도출하여 검량선을 작성하여 계산하였다.
9. 세포 배양
RAW264.7 (mouse macrophage cell line) 세포는 한국세포주은행 (Korean Cell Line Bank, Seoul, Korea)에서 구입하여 사용하였고, 10% heat inactivated fetal bovine serum (FBS, GIBCO, Grand Island, NY, USA)과 1% penicillin-streptomycin solution (Welgene, Gyeongsan, Korea)이 포함된 Dulbecco’s modified Eagle’s media (DMEM, Gibco, Thermo Fisher Inc., Waltham, MA, USA) 배지를 사용하여 37℃, CO₂5% 조건의 Incubator에서 배양하였다. RAW264.7 세포는 배양용 플라스크 (T75 ㎠)에서 세포를 배양하고, 약 80% 이상 밀집하면 부착된 세포를 떼어 낸 후 실험에 사용하였다.
10. 세포 생존율
세포독성 측정은 RAW264.7 세포주 (mouse macrophage cell line)를 이용하여 3-(4,5-dimethylthiazol-2-yl)-5(3-carboxymethonyphenol)-2-(4-sulfophenyl)-2H-tetrazolium (MTS) assay를 수행하였다.
RAW264.7 세포를 2 × 104 cells/㎖의 농도로 96 well plate에 분주하여 24 시간 배양한 후에 추출물을 농도별로 처리한 다음, tetrazolium을 첨가하여 3 시간 배양 후 490 ㎚에서 흡광도를 측정하였다. 세포 독성 정도는 시료를 처리하지 않은 대조군 과 발효황기추출물 처리 군의 비율로 계산하였다(Choi et al., 2014).
11. 산화질소 측정
Nitric oxide (NO) 생성능은 Griess assay 방법으로 NO의 농도를 측정하였다. Cell counter (Luna automated cell counter, Logos Biosystems, Anyang, Korea)를 이용하여, RAW264.7 세포수를 측정하고, 96 well plate에 2 × 104 cells/㎖의 농도로 분주하여 24 시간 배양한 후에 추출물을 농도별로 처리한 다음, Lipopolysaccharide (2 ㎍/㎖)를 처리하여 20 시간 배양하였다. 세포 배양액 100 ㎕와 Griess 시약 100 ㎕를 혼합하여 상온에서 10 분 동안 반응시킨 후, 520 ㎚에서 흡광도를 측정하였고 sodium nitrate로 표준곡선을 작성하여 NO 함량을 산출하였다 (Choi et al., 2014).
12. 염증성 cytokine 분석
Cytokine의 생성량 RAW264.7 세포주를 이용하였다. RAW264.7 세포를 2 × 104 cells/㎖의 농도로 96 well plate에 분주하여 24 시간 배양한 후에 추출물을 농도별로 처리한 다음, LPS 2 ㎍/㎖를 처리하여 24 시간 배양하였다. 이때 얻은 상층액을 시료로 하여 분석 kit로는 IL-1β (ab100747, Abcam, Cambridge, Engalnd), TNF-α (ab100705, Abcam, Cambridge, Engalnd)의 수준을 제조사의 분석 메뉴얼에 따라 분석하였다.
13. 통계처리
본 실험의 결과는 3 회 반복 실험을 실시한 뒤 평균과 표준편차 (means ± SD) 로 나타내었다. 각 실험결과에 대한 통계분석은 SPSS 25.0 program (Statistical Package for Social Sciences, SPSS Inc., Chicago, IL, USA)을 이용하여 ANOVA를 실시한 후 Duncan’s Multiple Range Test (DMRT)방법을 사용하여 각 처리구간의 유의적 차이를 검증하였다 (p < 0.05).
결과 및 고찰
1. 황기 발효 균주 선발
황기에 배당체 형태로 존재하고 있는 isoflavonoids는 당분해 효소에 의해 비배당체 형태로 전환한다 (Jang et al., 2016a). 비배당체 형태인 calycosin-7-β-glucopyranoside를 비배당체형태인 calycosin, formononetin으로 전환하여 유효성분의 함량을 증가시키고자 하였다.
본 연구에서는 당 분해 효소 중 β-glucosidase의 활성이 높은 균주를 선발하기 위해 농촌진흥청에서 분양받은 Aspergillus niger, Aspergillus awamori, Aspergillus luchensis 3 주의 효소활성을 평가하였고 Table 1에 나타내었다. 실험 결과 Aspergillus awamori가 117.5 U/g로 가장 높은 활성을 나타내었으며 Aspergillus niger는 103.82 U/g, Aspergillus luchensis는 88.08 U/g의 활성을 보였다. 이 후의 실험에서는 Aspergillus awamori로 황기를 발효하여 진행하였다.
2. 발효 황기의 이화학적 특성 변화
Aspergillus awamori로 0, 4 일간 발효한 황기 (AF0, AF4)의 pH, 산도, 환원당의 측정 결과는 Table 2과 같다. 발효 황기의 pH는 AF0와 비슷한 pH 5 수준으로 변화가 거의 없는 것으로 나타났다. Aspergillus sp. 균주의 생장은 알칼리보다는 pH 4 - 5 범위에서 잘되며 β-glucosidase 활성도 이와 같은 조건에서 가장 높게 이루어진다 (Jager et al., 2001; Jang and Kim. 2010). 산도는 발효가 되면서 감소하는 경향을 보인다. AF0의 산도가 4.27%로 가장 높았으며 이후 발효가 진행되면서 3.04%로 감소하였다. 이는 발효가 진행되면서 유기산의 일부가 소모되어 발효물의 산도를 감소시키는 것으로 판단된다 (Jang et al., 2016b).
발효 황기의 환원당 함량을 측정한 결과 발효 기간이 증가함에 따라 함량 차이를 보였다. AF4에서 환원당 함량은 910 ㎎/100g으로 가장 높게 나타났으며 이는 Aspergullus awamori 균이 배양기간 동안 α-amylase를 생성하여 황기 내 전분질 원료를 당화하여 환원당 함량이 증가한 것으로 사료된다 (Park et al,. 2009).
3. 발효 황기의 Flavonid 함량 변화
황기 발효에 따른 calycosin-7-β-glucopyranoside, ononin, calycosin, formononetin 4 가지 성분에 대한 함량변화를 분석하였으며, 그 결과를 Table 3에 나타내었다.
Calycosin-7-β-glucopyranoside은 AF0에서 45.79 ㎎/㎖ 검출되었고 AF4에서는 2.93 ㎎/㎖으로 감소하였으나 calycosin에서 AF0은 7.62 ㎎/㎖, AF4에서는 12.39 ㎎/㎖로 함량이 증가하였으며 ononin과 formononetin은 발효 전후 함량변화에 유의적인 차가 없었다.
이러한 결과는 황기에 많이 함유된 배당체 형태인 calycosin-7-β-glucopyranoside가 당 분해 효소에 의해 분해되면서 비 배당체인 calycosin으로 전환되면서 함량이 증가하였기 때문으로 판단되며 (Jang et al., 2016a), 배당체 형태로는 체내 흡수와 이용률이 저하되어 항산화, 항염증, 면역증진 등의 다양한 생리활성효과를 기대하기 어렵기 때문에 발효를 통해 배당체를 비배당체로 전환하여 체내 흡수율을 높이고 생체 이용률을 증진시킬 수 있다는 보고 (Jang et al., 2016a)에 근거하여 볼 때 발효 황기는 배당체 형태의 성분을 비배당체 성분으로 전환이 이루어져 발효하지 않은 황기보다 더 높은 생리활성을 나타낼 수 있을 것으로 판단된다.
4. 세포 생존율에 대한 영향
RAW264.7 세포에 대한 세포 독성을 평가하기 위해 황기 열수 추출물을 농도별로 처리 한 후, 시료 처리를 하지 않은 대조구과 비교하여 세포 생존율 (%)을 측정하였다.
AF4에 비해 AF0은 250 μg/㎖에서 세포독성이 관찰되었으며 125 μg/㎖ 이하의 농도에서는 93% 이상의 생존율을 나타내었으며, AF4는 250 μg/㎖에서 100% 이상의 생존율을 보였다 (Fig. 1).
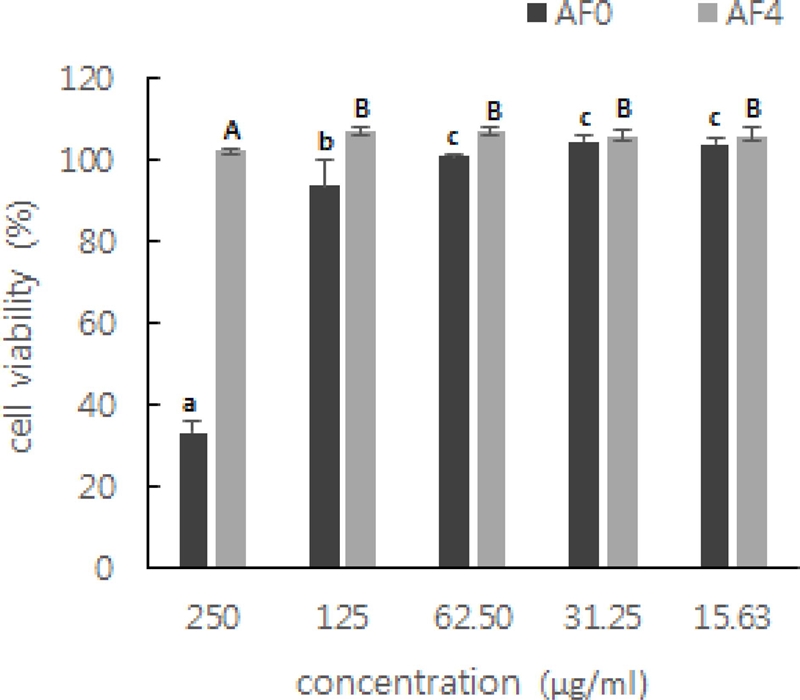
Effects of water extracts from Astragalus membranaceus fermented Aspergillus awamori on the cell viability of RAW264.7 cells.Results of three independent experiments were averaged mean value of three independent experiments (SD = bars), and are shown as percentage cell viability compared with the viability of untreated control cells. Values are means ± SD (n = 3). *Means with different superscript in the same column are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT). AF0, Astragalus membranaceus of hot water extracts treated RAW264.7 cell; AF4, Astragalus membranaceus fermented Aspergillus awamori treated RAW264.7 cell.
5. 산화질소 생성능에 대한 영향
Nitric oxide (NO)는 LPS에 의해 활성화된 대식세포에서 분비되는 물질로 과다생성 시 산화반응물은 DNA, 단백질 등의 물질을 손상시켜 암, 심혈관질환 같은 만성질환을 유발시킨다. 하지만 NO의 정상적인 상태에서는 신호전달, 혈관확장 등 생체 내에서 다양한 면역반응을 매개한다고 알려져 있다 (Lee et al., 2011; Kim et al., 2014).
RAW264.7 세포에서 발효 황기 열수 추출물에 대한 농도별 NO 생성능을 평가 한 결과 황기 추출물을 RAW264.7 세포에 처리한 후 LPS로 염증을 유발한 결과 LPS 처리군과 비교하였을 때 시료의 농도가 높을수록 NO 생성량이 현저하게 감소하였고 농도 의존적으로 함량이 변화하는 것을 확인하였다. 발효 황기추출물 또한 농도가 높아질수록 NO 생성량이 감소하였다 (Fig. 2). 이러한 본 연구결과로 볼 때 황기 및 발효 황기 추출물 모두 산화질소 억제 효과가 우수한 것으로 확인되었다.
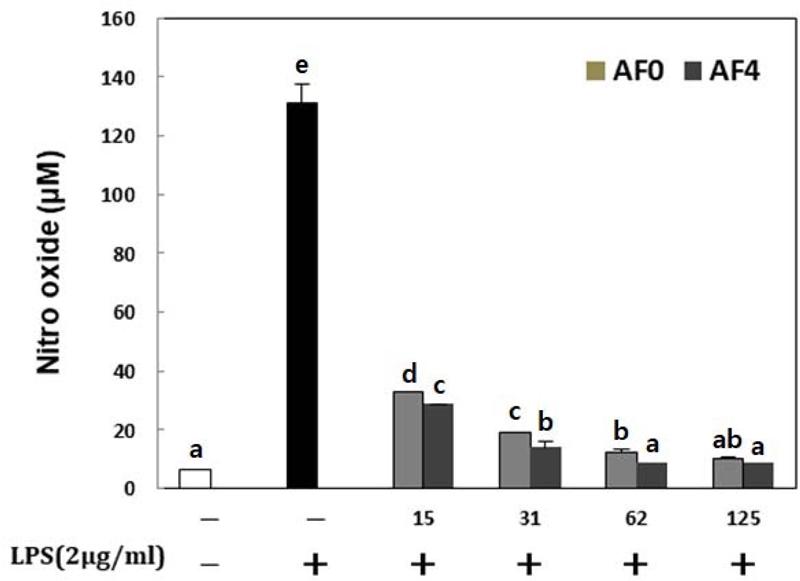
Nitric acid production of water extracts from Astragalus membranaceus fermented Aspergillus awamori.Values are means ± SD (n = 3). *Means with different superscript in the same column are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT). LPS; lipopolysaccharide (LPS, 2 ㎍/㎖) treated RAW264.7 cell; A; AF0, Astragalus membranaceus of hot water extracts treated RAW264.7 cell; B; AF4, Astragalus membranaceus fermented Aspergillus awamori treated RAW264.7 cell; sample concentration was 15, 31, 62 and 125 ㎍/㎖.
6. 염증성 사이토카인에 대한 영향
RAW264.7 세포에 LPS를 처리하여 pro-inflammatory cytokine을 분비하게 하여 염증 반응의 정도를 확인하였다. 염증과 관련된 IL-1β, TNF-α의 억제 정도를 확인하기 위하여 각 물질의 생성량을 확인하였다.
RAW264.7 세포에 황기 열수 추출물을 농도별로 처리하였을 때 cytokine 생성능을 관찰한 결과 cytokine은 IL-1β, TNF-α를 확인하였다. AF0에서 IL-1β는 시료의 농도가 낮을수록 억제되었으며, AF4에서는 15 μg/㎖에서 가장 우수한 결과를 보였다. 전반적인 경향을 보았을 때 LPS를 단독처리한 대조구보다 AF0과 AF4가 IL-1β 생성을 억제하였고 AF0보다 AF4에서 더 억제됨을 확인하였다. TNF-α 생성능을 보았을 때 AF0과 AF4 모두 125 μg/㎖에서 TNF-α의 생성이 가장 억제된 것을 확인하였다 (Fig. 3).
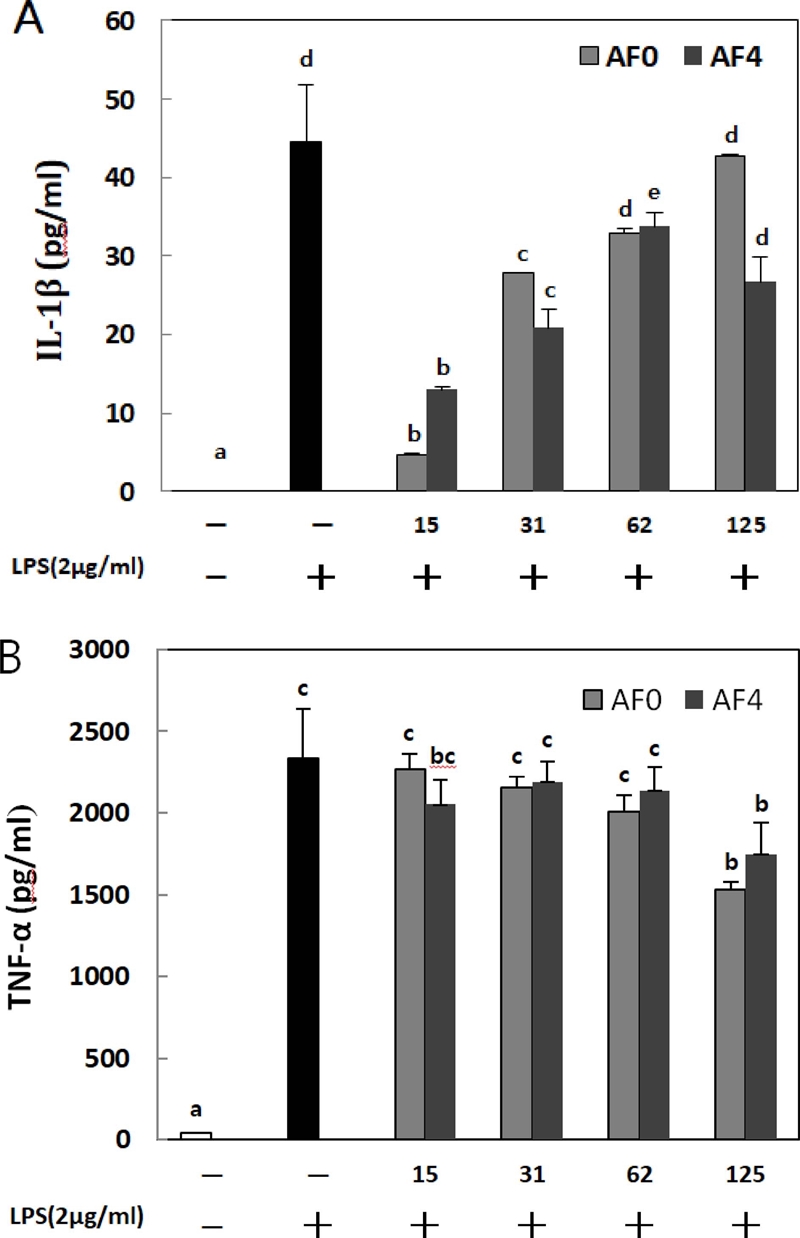
Anti inflammatory of water extracts from Astragalus membranaceus fermented Aspergillus awamori.Values are mean ± SD (n = 3). *Means with different superscript in the same column are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT). LPS; lipopolysaccharide (LPS, 2 ㎍/㎖) treated RAW264.7 cell; AF0, Astragalus membranaceus of hot water extracts treated RAW264.7 cell; AF4, Astragalus membranaceus fermented Aspergillus awamori treated RAW264.7 cell; A, IL-1β; B, TNF-α; sample concentration was 15, 31, 62 and 125 ㎍/㎖.
이러한 결과를 통하여 황기를 대상으로 하는 발효과정은 발효하지 않은 것에 비하여 TNF-α와 IL-1β의 생성을 억제하는 것을 확인할 수 있었으며 이러한 이유는 황기를 대상으로 하는 발효과정이 황기의 지표성분인 calycosin의 생성량에 영향을 미치며 생성된 calycosin에 의해 사이토카인 분비를 억제하는 효과를 나타내었다고 사료된다.
본 연구를 통해서 Aspergillus awamori로 발효한 황기의 이화학적 특성과 지표성분인 calycosin-7-β-glucopyranoside, calycosin, formononetin, ononin, Isomucronulatol7-βd-glucoside의 함량 변화를 보았다.
Aspergillus awamori로 발효에 의한 황기에서 환원당과 calycosin의 함량이 증가하는 것을 확인하였고 RAW264.7 대식세포에서 황기발효추출물 (AF4)에 의한 세포독성, NO생성량 및 cytokine을 측정하였다. 측정 결과 RAW264.7 세포에서 AF4은 AF0에 비하여 NO생성량과 TNF-α, IL-1β에서 전반적으로 생성이 억제됨을 보였으며 항염증 효과를 가지는 것을 확인하였다. 이러한 결과로 발효황기 추출물의 천연 발효 소재로써 산업적 활용이 가능할 것으로 생각되며 기초 자료로서 활용 가치가 높을 것으로 기대된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구사업(과제번호: PJ01357001)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Choi DJ, Choi BR, Lee DY, Choi SI, Lee YS and Kim GS. (2019). Inhibitory effect of mixed extracts obtained from Astragali radix and Lithospermi radix on matrix metalloproteinases in IL-1β-induced SW1353 cells and quantitative analysis of active compounds. Korean Journal of Medicinal Crop Science. 27:247-258.
[https://doi.org/10.7783/KJMCS.2019.27.4.247]

-
Choi HM, Kim HH and Lee HD. (2014). Comparative study of Bojungikgitang in Korea, Japan and China on the anti-Inflammatory and anti-oxidative effects. Korean Journal of Herbology. 29:53-60.
[https://doi.org/10.6116/kjh.2014.29.1.53]

- Im KR, Kim MJ, Jung TK and Yoon KS. (2010). Analysis of Isoflavonoid contents in Astragalus membranaceus bunge cultivated in different areas and at various ages. Korean Society for Biotechnology and Bioengineering Journal. 25:271-276.
-
Jäger S, Brumbauer A, Fehér E, Réczey K and Kiss L. (2001). Production and characterization of β-glucosidases from different Aspergillus strains. World Journal of Microbiology and Biotechnology. 17:455-461.
[https://doi.org/10.1023/A:1011948405581]

- Jang MH and Kim MD. (2010). Exploration of β-glucosidase activity of lactic acid bacteria isolated from Kimchi. Food Engineering Progress. 14:243-248.
-
Jang YJ, Kim EJ, Kim SY, Lee YH and Park SY. (2016a). Changes in physicochemical components of Astragalus membranaceus fermented with Phellinus linteus. Korean Journal of Food Preservation. 23:680-688.
[https://doi.org/10.11002/kjfp.2016.23.5.680]

-
Jang YJ, Lee YH, Lee CJ, Kim JH, Kim EJ, Ji SJ and Park SY. (2016b). Physicochemical components of Astragalus membranaceus fermented with mushroom mycelia. Korean Journal of Food Preservation. 23:49-56.
[https://doi.org/10.11002/kjfp.2016.23.1.49]

- Jin JH, Kwon HO, Ha YJ, Heo SH and Lee JM. (2017). Anti-inflammatory and anti-oxidative effect of Pinus koraiensis Cone shell extracts. Journal of the Korean Society of Food Science and Nutrition. 46:1053-1060.
-
Kim DM, Jin BR and Kim JY. (2014). Comparative radical scavenging and nitric oxide production capacity of water extracts of Acanthopanax divaricatus var, Albeofructus and Eleutherococcus divaricatus var. Chiisanensis. Journal of Applied Biological Chemistry. 57:337-340.
[https://doi.org/10.3839/jabc.2014.053]

-
Kim GS, Lee DY, Lee SE, Noh HJ, Choi JH, Park CG, Choi SI, Hong SJ and Kim SY. (2013). Evaluation on extraction conditions and HPLC analysis method for bioactive compounds of Astragali radix. Korean Journal of Medicinal Crop Science. 21:486-492.
[https://doi.org/10.7783/KJMCS.2013.21.6.486]

-
Kradin R, Matsubara O and Mark EJ. (2005). Endothelial nitric oxide synthase expression in pulmonary capillary hemangiomatosis. Experimental and Molecular Pathology. 79:194-197.
[https://doi.org/10.1016/j.yexmp.2005.08.010]

- Lee HS, Kwon KH, Kim BS and Kim JH. (2009). Quality characteristics of instant Nuroong-gi to which Dioscorea japonica powder was added. Korean Journal of Food Preservation. 16:608-685.
-
Lee KJ, Park MH, Park YH, Lim SH, Kim KH, Kim YG, Ahn YS and Kim HY. (2011). Antioxidant activity and nitric oxide production of ethanol extracts from Astragali membranaceus bunge and A. membranaceus bunge var mongholicus hisiao. Journal of the Korean Society of Food Science and Nutrition. 40:1793-1796.
[https://doi.org/10.3746/jkfn.2011.40.12.1793]

- Park JH, Baek MR, Lee BH, Yon GH, Ryu SY, Kim YS, Park SU and Hong KS. (2009). α-Glucosidase and α-amylase inhibitory activity of compounds from root extract of Pueraria thunbergiana. Korean Journal of Medicinal Crop Science. 17:357-362.
-
Seo MJ, Kang BW, Park JU, Kim MJ, Lee HH, Ryu EJ, Joo WH, Kim KH and Jeong YK. (2013). Effect of black garlic extract on cytokine generation of mouse spleen cells. Journal Life Science. 23:63-68.
[https://doi.org/10.5352/JLS.2013.23.1.63]

- Song BN, Lee DB, Park BR, Hwang H, Kim SY and Park SY. (2018). Physicochemical components of Rehmannia glutinosa fermented with Rhizopus delemar. Korean Journal of Medicinal Crop Science. 26:482-489.
-
Su X, Huang Q, Chen J, Wang M, Pan H, Wang R, Zhou H, Zhou Z, Liu J, Yang F, Li T and Liu L. (2016). Calycosin suppresses expression of pro-inflammatory cytokines via the activation of p62/Nrf2-linked heme oxygenase 1 in rheumatoid arthritis synovial fibroblasts. Pharmacological Research. 113: 695-704.
[https://doi.org/10.1016/j.phrs.2016.09.031]

-
Tak HM, Kang MJ, Kim KM, Kang DW, Han SK and Shin JH. (2014). Anti-inflammatory activities of fermented black garlic. Journal of the Korean Society of Food Science and Nutrition. 43:1527-1534.
[https://doi.org/10.3746/jkfn.2014.43.10.1527]

- Yang HM, Lim SS, Lee YS, Shin HK, Oh YS and Kim JK. (2007). Comparison of the anti-inflammatory effects of the extracts from Rubus coreanus and Rubus occidentalis. Korean of Journal Food Science Technology. 39:342-347.
