
뽕잎 추출물 기원 Flavonoid Rich Fraction의 항비만효과
 ; Byung Ryeol Ryu2
; Byung Ryeol Ryu2 ; Su Jin Yang3 ; Jong Suep Baek4 ; Su Ji Ryu5 ; Hyun Bok Kim6
; Su Jin Yang3 ; Jong Suep Baek4 ; Su Ji Ryu5 ; Hyun Bok Kim6 ; Jung Dae Lim7, †
; Jung Dae Lim7, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study investigated the anti-obesity effect of the flavonoid rich fraction (FRF) and its constituent, rutin obtained from the leaf of Morus alba L., on the lipid accumulation mechanism in 3T3-L1 adipocyte and C57BL/6 mouse models.
In Oil Red O staining, FRF (1,000 ㎍/㎖) treatments showed inhibition rate of 35.39% in lipid accumulation compared to that in the control. AdipoRedTM assay indicated that the triglyceride content in 3T3-L1 adipocytes treated with FRF (1,000 ㎍/㎖) was reduced to 23.22%, and free glycerol content was increased to 106.04% that of the control. FRF and its major constituent, rutin affected mRNA gene expression. Rutin contributed to the inhibition of Sterol regulatory element binding protein-1c (SREBP-1c) gene expression, and inhibited the transcription factors SREBP-1c, peroxisome proliferator-activated receptor gamma (PPAR-γ), CCAAT/enhancer binding protein α (C/EBPα), fatty acid synthase (FAS) and acetyl-CoA carboxylase (ACC). In addition, the effect of FRF administration on obesity development in C57BL/6 mice fed high-fat diet (HFD) was investigated. FRF suppressed weight gain, and reduced liver triglyceride and leptin secretion. FRF exerted potential anti-inflammatory effects by improving insulin resistance and adiponectin levels, and could thus be used to help counteract obesity. The mRNA expressions of PPAR-γ, FAS, ACC, and CPT-1 were determined in liver tissue. Quantitative real-time PCR analysis was also performed to evaluate the expression of IL-1β, IL-6, and TNF-α in epididymal adipose tissue. Compared to the control group, mice fed the HFD showed the up-regulation in PPAR-γ, FAS, IL-6, and TNF-α genes, and down-regulation in CPT1 gene expression. FRF treatement markedly reduced the expression of PPAR-γ, FAS, IL-6, and TNF-α compared to those in HFD control, whereas increased the expression level of CPT1.
These results suggest that the FRF and its major active constituent, rutin, can be used as effective anti-obesity agents.
Keywords:
Morus alba, Anti-obesity, C57BL/6 Mice, Expression, Flavonoid, Gene, Mulberry Leaf, Rutin, 3T3-L1 Cell서 언
비만은 에너지의 섭취량과 소비량 사이의 불균형으로 인하여 체내에 지방이 과도하게 축적되어있는 상태를 말하며, 축적과 에너지 저장을 위한 조절과정에서 발생된다 (Spiegelman and Flier, 1996). 과도한 지방세포의 증가는 분화, 비대와 과형성으로 초래되고, 그 외에도 환경의 변화, 신체 활동량의 감소뿐만 아니라 유전적인 요인 등으로 인하여 발생되는 대사성 질환이다 (Hwang et al., 2014). 최근 약용작물과 그 생리활성물질에 기인하여 다양한 소재의 항비만 활성이 평가되고 있으나 효능평가의 방법이 일반적으로 3T3-L1 지방전구세포를 대상으로 추출물이나 분리된 활성물질의 처리와 처리에 따라 축적되어지는 지방구 (lipid droplet)의 감소 정도를 측정하는 단편적인 활성 평가가 이루어지고 있다 (Kim and Chen, 2004).
지방이 생성된다는 것은 세포 분화과정의 한 부분으로, 지방전구세포의 지방구 축적, 세포형태, 유전자 발현 및 다양한 전사인자에 의해 지방세포로 분화하며 이러한 과정을 지방세포 형성과정 (adipogenesis)이라고 한다 (Ali et al., 2013). 지방전구세포의 지방구가 축적이 되면 insulin 반응을 일으켜 분화하게 되고 (Lefterova and Lazar, 2009), 지방세포의 분화과정이 진행됨에 따라 acyl-CoA carboxylase (ACC), fatty acid synthase (FAS)의 유전자 발현이 증가하게 된다 (Fu et al., 2005; Skurk et al., 2007).
Adipogenesis 과정에 관여하는 중요한 인자로는 분화 초기에 발현되는 CCAAT-enhancer-binding protein α (C/EBPα)와 C/EBPα에 의해 유도되는 peroxisome proliferator activated receptor γ (PPARγ), sterol regulatory element-binding transcription factor-1 (SPEBP-1)가 대표적이며 (Lefterova et al., 2008; Lefterova and Lazar, 2009), C/EBPα는 과발현시 지방구의 크기 및 수를 증가시키고 PPAR-γ은 지질 단백질 경로를 조절하고, SPEBP-1는 지방전구세포의 분화를 촉진시켜 다른 지방 생성 유전자의 발현을 증가시킨다 (Han et al., 2018; Khalilpourfarshbafi et al., 2019).
비만 인구가 증가추세에 있어 뽕나무로부터 식품에 적용 가능한 항비만 활성물질을 대량 추출하여 활성물질을 갖는 항비만 식품개발이 요구되고 있다.
뽕잎은 다양한 생리활성 성분을 함유하고 있으며 무기성분, 아미노산 그리고 rutin (quercetin-3-O-rutinoside), quercetin, quercitrin, isoquercitrin, kaempferol과 alkaloid계 성분을 함유하고 있다 (Kim et al., 2001). 뽕잎 추출물은 지방세포에서 glucose의 소비를 증가시킴으로써 항당뇨 소재로써 가능성이 있음이 보고되어있다 (Attila et al., 2013). 뽕잎의 rutin, quercetin 등의 flavan 유도체들이 3T3-L1 전지방세포에 있어 지방세포로의 분화와 증식을 억제하며, 뽕잎의 1-deoxynojirimycin (DNJ)는 알카로이드계 화합물로써 α-glucosidase를 저해시키는 생리활성을 갖고있어 (Kim et al., 2013), 혈당상승을 억제하여 항비만 활성을 나타내는 것으로 보고되어 있다.
본 연구에서는 뽕잎으로부터 획득한 flavonoid rich fraction (FRF)이 3T3-L1 지방세포의 분화에 미치는 영향과 전사인자 및 신호전달 pathway에 미치는 영향을 조사하고 식이를 통한 뽕잎 기원 flavonoid rich fraction의 항비만 효과를 동물모델에서 검정함으로써 이들이 항비만 소재로 활용되기 위한 자료를 제공하고자 하였다.
재료 및 방법
1. 실험재료
농촌진흥청 농업생물부에서 재배한 뽕나무 (Morus alba L.) “청올품종”의 뽕잎을 사용하였다. 뽕잎은 동결건조 후 사용하였다. 뽕잎 분말 25 g, 50% ethanol 500 ㎖로 30 분간 초음파 추출하였으며, 추출액은 38℃에서 감압농축하여 증류수로 용해시켜 동량의 n-hexane, ethyl acetate, water 층으로 분획하였다. 그 후 각 분획층을 38℃에서 감압농축하였다.
2. HPLC를 이용하여 뽕잎의 rutin, quercetin 함량 측정
뽕잎 추출 분획층을 1,000 ㎍/㎖으로 제조하여 분석하였다. 분석시 rutin (> 95%, Sigma-Aldrich Co., St. Louis, CA, USA), quercetin (> 95%, Sigma-Aldrich Co., St. Louis, CA, USA)으로 검량선을 작성하였으며, 각 분획층에 존재하는 rutin, quercetin ㎎으로 산출하여 나타내었다. 분석조건은 Table 1과 같다. 이후 3T3-L1 adipocyte 세포분화 및 지방축적에 관한 실험에서는 분획물 중 rutin 및 quercetin 함량이 상대적으로 높은 ethyl acetate (EtOAc)분획층과 물 (water)분획층을 대상으로 선정하여 실험하였다.
3. 뽕잎추출물 용매분획물의 3T3-L1 adipocyte 세포분화 및 지방축적
3T3-L1 세포의 배양은 DMEM (Gibco BRL Co., Gaithersburg, MD, USA)에 10% BCS와 1% penicilin/streptomycin (Gibco BRL Co., Gaithersburg, MD, USA)을 첨가하여 사용하였으며, 37℃, 5% CO2의 조건에서 배양하였다.
3T3-L1 전지방세포를 지방세포로의 분화를 유도하기 위하여 세포가 80 - 90% confluence하게 되면 0.25% trypsin-EDTA (Gibco BRL Co., Gaithersburg, MD, USA)를 처리하여 1 분간 배양한 후 배지와 혼합하여 세포를 분리한 후 well에 배양하였다. 세포가 완전히 post-confluent하게 될 때까지 배양한 후 10% FBS가 첨가된 DMEM 배양액에 0.5 mM IBMX, 1 μM dexamethasone, 10 ㎍/㎖ insulin이 첨가된 분화유도 배지를 처리하여 분화를 유도시켰다.
분화 시작일 이후 5 ㎍/㎖의 insulin이 함유된 10% FBS DMEM 배지를 사용하여 이틀 간격으로 배지를 교체하면서 지방세포 분화를 유도하였다. 시료의 처리는 분화유도 시작일을 포함하여 이틀 간격으로 배지와 함께 시료를 처리하였다.
3T3-L1 preadipocyte 분화유도할 때 뽕잎 추출물의 EtOAc 분획층과 water 분획층의 시료를 농도별로 처리하여 분화를 끝마친 후에 Oil Red O staining을 시행하였다. 배지 제거 후, PBS를 이용하여 세척을 해주고, 10% formaldehyde를 첨가하여 상온에서 30 분 동안 세포를 고정시켰다. Formaldehyde를 제거하고 PBS를 이용하여 세척을 해준 후 Oil Red O staining을 처리하여 상온에서 1 시간 동안 염색시킨 후 PBS로 세척하였다. 세척 후 염색된 세포는 현미경을 통해 관찰하였다. 염색된 세포를 100% isopropanol을 첨가하여 세포에 lipid를 용출시킨 후 multilabel reader (VICROPTM X3, PerkinElmer, Waltham, MA, USA)로 510 ㎚에서 흡광도를 측정하였다. 측정된 흡광도를 대조군에 대한 백분율로 산출하였다.
Intracellular 중성지방 함량 측정은 AdipoRedTM kit를 사용하였다. 3T3-L1 preadipocyte의 분화유도배지를 첨가할 떼 100 ㎍/㎖, 500 ㎍/㎖, 1,000 ㎍/㎖ 농도의 시료를 처리하였고, 분화가 끝난 시점에 중성지방 함량을 측정하였다. 배지 제거 후 PBS를 이용하여 세척 후 AdipoRedTM reagent를 처리하여 CO2 incubator에서 10 분 배양시킨 후 PBS를 이용하여 세척하였다. 세척 후에 excitation 485 ㎚, emission 572 ㎚에서 흡광도를 측정하였다. 측정된 흡광도를 대조군에 대한 백분율로 산출하였다.
뽕잎 추출물로 얻은 분획층 중에 rutin 함량이 높은 EtOAc 분획층을 flavonoid rich fraction (FRF)으로 명명하였다. 각 FRF의 농도별 시료 (100 ㎍/㎖, 500 ㎍/㎖, 1,000 ㎍/㎖)와 FRF의 실제 포함된 rutin의 함량을 계산하여 rutin을 (3.24 ㎍/㎖, 16.2 ㎍/㎖, 32.4 ㎍/㎖)의 농도로 처리하였다.
FRF와 rutin을 첨가하여 분화시킨 세포에 배지를 제거하여 PBS를 이용하여 세척시킨 후 trizol reagent를 처리하여 세포 내의 total RNA를 분리하였다. 분리된 RNA에 각각의 primer (Genotech, Daejeon, Korea)와 One step SYBR PrimeScriptTM RT-PCR kit (Takara Inc., Otsu, Japan)를 넣고 Real-time PCR Detection System (ECOTM, Illumina Inc., San Diago, CA, USA)을 이용하여 증폭하였다. 유전자 발현 분석을 사용하는데 필요한 primer의 서열을 Table 2와 같이 나타내었다.

Sequence of primers used in quantitative real-time PCR for mRNA expression of transcription factor on adipogenesis of 3T3-L1 cell line.
PCR의 조건은 초기변성 (95℃, 30 sec), 변성 (95℃, 5 sec), 결합 (57℃, 15 sec), 신장반응 (72℃, 10 sec)의 순서로 40 cycle 반응시켰다. 용해 곡선은 55℃ - 95℃를 0.5℃씩 증가시켜 80 번 반응 후 원하는 형광값을 나타내었다. mRNA의 상대적 발현량은 대조군에 대한 시료의 상대적인 유전자 발현값을 나타내었다.
FRF 처리에 따른 지방대사 관련 단백질인 SREBP-1c, PPAR-γ, CEBP/α, FAS, ACC의 발현양상을 Western blot을 통해 분석하였다. 지방분화가 완료된 세포를 PBS로 세척 후 RIPA buffer를 사용하여 단백질을 추출하였다. 추출된 단백질은 10% SDS-polyacrylamide gel에 전기영동 시킨 후 polyvinylidene fluoride (PVDF) transfer membrane (BIO-RAD Inc., Hercules, CA, USA)으로 400 mA로 100 분간 transfer 시켰다.
Transfer가 완료된 membrane을 5% bovine serum albumin (BSA)이 함유된 TTBS (0.1% Tween 20 + TBS) 용액을 상온에서 2 시간 반응시킨 후 1 : 200 비율의 용액에 1 차 항체 SREBP-1c, PPAR-γ, CEBP/α, FAS, ACO를 첨가시킨 후 저온 환경에서 overnight하여 반응시켰다. TBST를 이용하여 5 분마다 3 번 세척을 진행하였다. 1 : 1,000의 비율의 희석액을 2 차 항체 horseradish peroxidase-conjugated anti-rabbit or anti-mouse IgG를 가한 후 1 시간 상온에서 반응시켰다. 반응 후 TBST를 이용하여 10 분 마다 3 번 세척한 다음 ECL detection reagents (Merck Millipore, Billerica, MA, USA)를 이용하여 해당 시료의 단백질 발현정도를 확인하였다.
4. 실험동물 (C57BL/6 mice) 식이를 통한 항비만 효과의 확인
실험동물은 강원대학교 동물실험윤리위원회의 승인을 받았으며 (KIACUC-1700114), 윤리적이고 과학적인 절차에 따라서 실험을 수행하였다. C57BL/6 마우스 수컷 4 주령 53 마리를 대한 바이오 링크 (Eumsung, Korea)로부터 구입하였다. 마우스는 일주일 동안 사육환경에 적응시킨 후 12 마리씩 일반식이군 (chow, 3.90 kcal/g with 11.5% fat, 20.8% proteins and 677.7% carbohydrates), 고지방식이군 (HFD, 4.73 kcal/g with 45% fat, 20% proteins and 35% carbohydrates), 고지방식이-뽕잎 기원 flavonoid rich fraction 투여군 (HFD-FRF)으로 총 3 가지 처리군으로 분류하였다.
각 3 가지 처리군을 3 반복함으로서 케이지 당 4 마리씩 완전임의 배치하였으며 FRF 분획물 500 ㎎/㎖을 다음 투여액량 10 ㎖/㎏을 매일 경구투여 진행하였다 (5 g/㎏). 12 주간 식이 후 실험동물을 희생시켜 혈액시료 채취, 장기시료 채취 하여 무게를 측정하였다. 실험동물 사육실 온도 22 ± 2℃, 상대습도 55 ± 5%, 12 주간 조명주기로 조절하였으며 물과 실험식이는 자유롭게 섭취할 수 있도록 하였다.
실험동물의 생체중, 실험식이 섭취량, 식이효율은 실험시작 첫 주 (5 주령)부터 각 개체마다 측정하였으며, 식이섭취량은 매주 첫 날 시점부터 공급된 식이량을 측정한 후 매주 마지막 날에 남은 식이량을 뺀 값으로 산정하였고, 마우스당 평균 섭취량은 각 군의 전체 소비량을 개체수로 나누어 계산하였다. 식이효율은 FER = [(total weight gain/total food intake) × 100] 의 공식에 따라 산출하였다.
혈액 중 glucose 농도는 ACCU-CHEK Go (Roche Diagnostics Inc., Basel, Switzerland)를 사용하여 실온 환경에서 5 분 동안 방치시킨 후 96-well plate 에 옮겨 담아 standard 시약을 대조로 하여 600 ㎚에서 흡광도를 측정하였다.
Insulin, leptin, adiponectin은 Matthews 등 (1985)의 방법과 같이 ELISA kit (R&D systems Inc., Minneapolis, MN, USA)를 사용하여 측정하였으며 insulin과 glucose의 농도를 통하여 insulin resistance (HOMA-IR)를 측정하였다.
간은 부검 시 절제하여 formaldehyde에 24 시간 반응시켜 지방과립 관찰을 위해 cryostat을 이용하여 5 ㎛ 두께로 냉동 박절하였다. 함수-탈수 처리 후 파라핀 블록을 이용하여 4 ㎛ 두께의 미세절편을 슬라이드글라스에 부착시켰다.
제작된 슬라이드는 Emamat 등 (2016)의 방법과 같이 hematoxylin and eosin (H&E) 염색을 시행하여 광학현미경으로 관찰하였다. 백색조직 (white adipose tissue)은 지방조직 절취 후 하루 동안 10% neutral buffered formalin과 graded alcohol을 이용하여 고정, 탈수시킨 후 파라핀 block을 4 ㎛ 두께의 조직절편으로 제작하여 Oil Red O staining, xylene clearing, permount의 과정을 거쳐 광학현미경을 통해 관찰하였다.
간지질 분석은 간 시료를 대상으로 PBS를 넣어 균질화 시킨 후 total lipid를 추출하여 AceChem TG Kit (YD Diagnostics Co., Yongin, Korea), total cholesterol kit (YD Diagnostics Co., Yongin, Korea)를 사용하여 혈액분석을 하였다.
5. Quantitative real-time PCR을 통한 뽕잎 기원 flavonoid rich fraction이 실험동물에서의 비만 유전자, 전사인자 및 cytokine 발현에 미치는 효과
간조직, 백색지방조직내의 RNA 추출은 trizol (Invitrogen Technologies Co., Carlsbad, CA, USA)을 이용하여 용출시켰으며, 용출된 RNA는 Transcriptor First Strand cDNA Synthesis Kit (Roche Applied Science, Penzbeng, Germany)를 이용해 cDNA 합성하여 유전자 발현 정도를 확인하기 위해 real-time PCR용 template로서 사용하였다.
NCBI GenBank에서 염기서열을 얻어 primer를 제작하였으며 (Table 3), housekeeping gene으로는 β-actin을 사용하였다. Real-time PCR은 SYBR Premic Ex Taq (Takara Inc., Shiga, Japan)을 이용해 수행하였다. PCR intracellular 중성지방 함량 측정은 AdipoRedTM Kit를 사용하였다. 3T3-L1 preadipocyte의 분화유도배지를 첨가할 때 100 ㎍/㎖, 500 ㎍/㎖, 1,000 ㎍/㎖ 농도의 시료를 처리하였고, 분화가 끝난 시점에 중성지방 함량을 측정하였다. 배지 제거 후 PBS를 이용하여 세척 후 AdipoRedTM reagent를 처리하여 CO2 incubator에서 10 분 배양시킨 후 PBS를 이용하여 세척하였다. 세척 후에 excitation 485 ㎚, emission 572 ㎚에서 흡광도를 측정하였으며, 측정된 흡광도를 대조군에 대한 백분율로 산출하였다.

Sequence of primers used in quantitative real-time PCR for mRNA expression of transcription factor on HFD-fed mice.
Quantitative real-time PCR 분석을 통해 간조직으로부터 PPAR-γ, FAS, ACC, carnitine palmitoyltransferase 1 (CPT-1), 부고환의 백색지방조직으로부터 interleukin-1β (IL-1β), interleukin-6 (IL-6) 및 tumor necrosis factor-alpha (TNF-α)의 발현 검정을 실시하였다.
6. 통계처리
각 처리구에 대한 결과를 평균 ±오차로 표기하였으며 SPSS (Statistical Package for the Social Sciences, ver. 19.0, SPSS Inc., Chicago, IL, USA) 통계프로그램을 이용하였으며, Duncan’s Multiple Range Tests (DMRT, p < 0.05)를 통해 각 처리구의 유의수준을 검정하였다.
결과 및 고찰
1. 뽕잎 추출물로부터 분획의 제조 및 활성물질 분석
뽕잎 추출물을 동량의 n-hexane, ethyl acetate (EtOAc), water 층으로 분리하여 각 분획층에서의 항비만 활성을 나타낼 것으로 예측되는 quercetin과 rutin의 함량을 검정하였다 (Table 4, Fig. 1).

The content of rutin and quercetin of different fractions and 50% ethanol leaf extracts from Morus alba L.
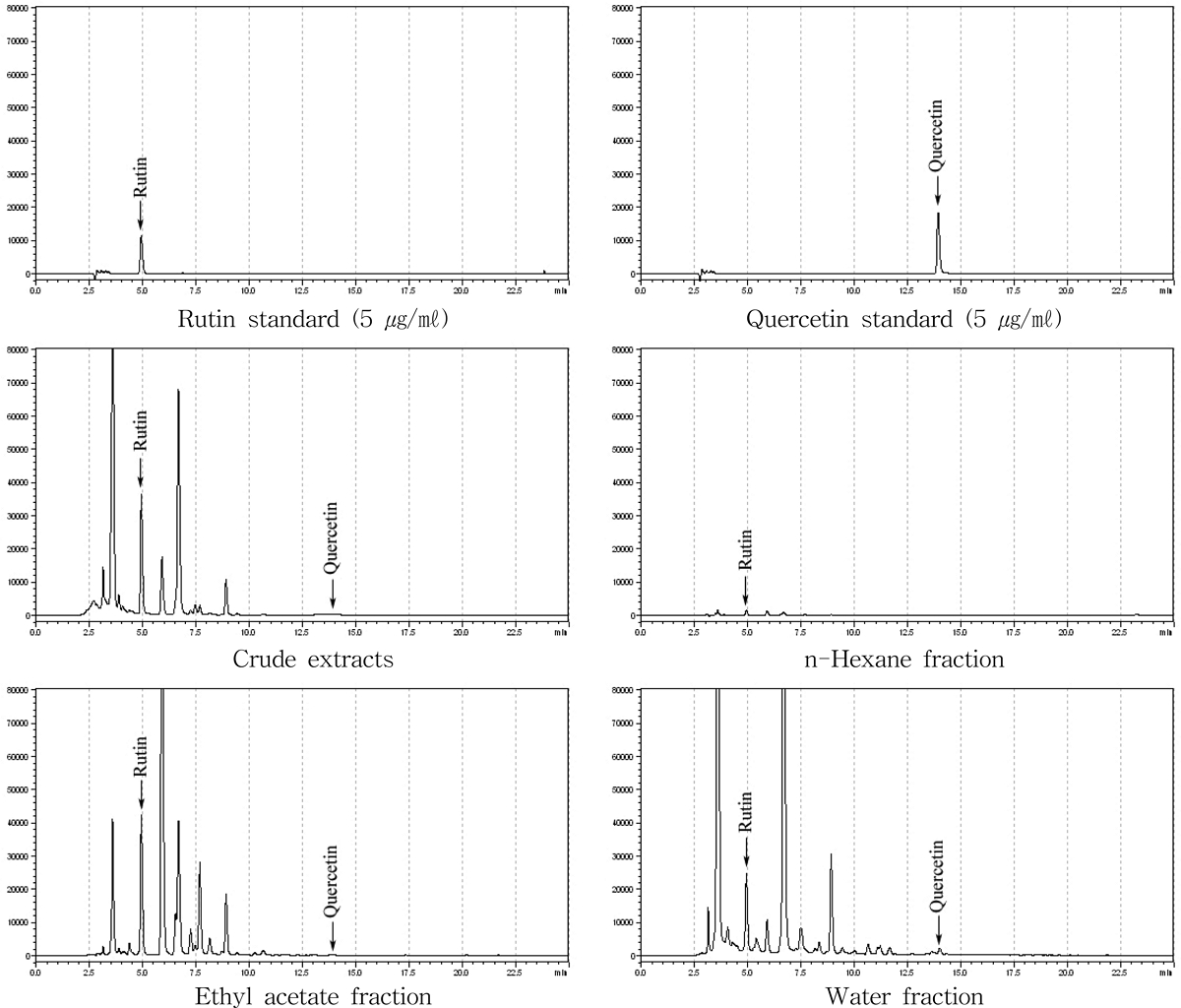
HPLC chromatogram of rutin and quercetin of different fractions and 50% ethanol leaf extracts from Morus alba L.
뽕잎 추출물에서 quercetin과 rutin 함량을 분석한 결과 초기 추출물에서는 quercetin이 0.80 ± 0.10 ㎎/g, rutin이 28.72 ± 3.60 ㎎/g의 수준을 나타내었고, 용매분획 후 n-hexane 분획층에서 quercetin의 함량은 검출되지 않았고, rutin은 2.29 ± 0.50㎎/g을 나타내었으며 EtOAc 분획층에서는 quercetin이 0.83 ± 0.10 ㎎/g, rutin이 32.16 ± 1.20 ㎎/g, water 분획층에서는 quercetin이 3.52 ± 0.80 ㎎/g, rutin이 26.86 ± 1.50 ㎎/g의 함량을 확인하였다.
Quercetin은 water 층에서 3.52 ± 0.80 ㎎/g으로 가장 높은 수준을 나타내었고 EtOAc 분획층에서 0.83 ± 0.10 ㎎/g으로 water 분획층 다음으로 높은 함량을 나타내는 것을 확인하였다. Rutin의 경우, EtOAc 분획층에 32.16 ± 1.20 ㎎/g으로 가장 높은 수준으로 함유되어 있는 것을 확인하였고, water 분획층에서 26.86 ± 1.50 ㎎/g의 함량을 나타내어 뽕잎 추출물에서 유용성분을 함유한 분획층이 water 분획층, EtOAc 분획층임을 확인하였다.
2. 뽕잎 추출물의 용매분획층의 3T3-L1 adipocyte 세포분화 및 지방축적에 대한 영향
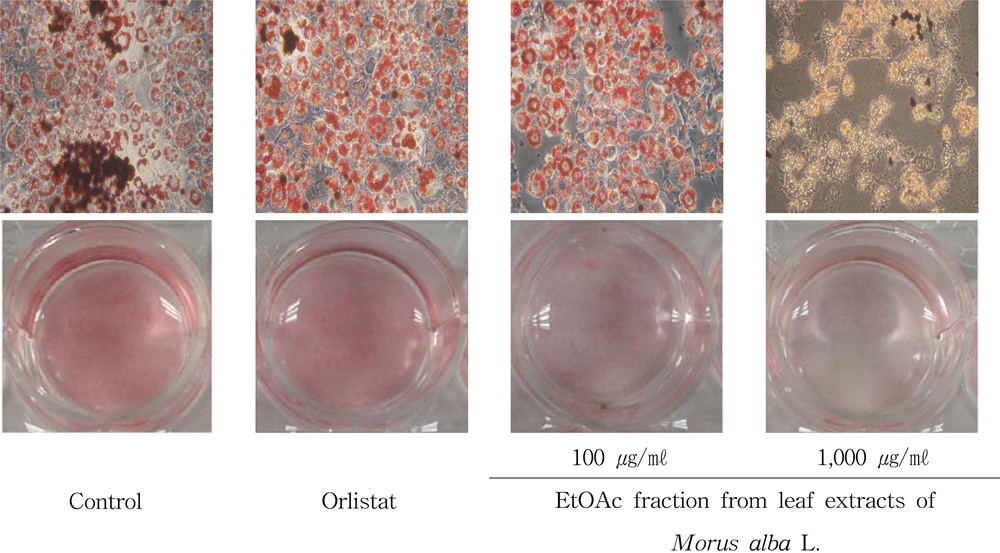
뽕잎 추출물에 대한 용매 분획층의 지방세포분화 및 lipid 함량 축적 저해효과를 검정하기 위하여 뽕잎 기원 EtOAc 분획층과 water 분획층 그리고 orlistat를 지방전구세포에 처리하고 지방세포의 분화와 지질 축적 정도를 비교하였다.
Orlistat는 가역적인 위장 lipase 억제제로 췌장 및 위 lipase를 억제하여 식이지방흡수를 30%까지 억제한다고 알려져 있지만 (Torgerson et al., 2004), 위장, 설사, 변실금, 헛배부름, 팽만감, 소화불량 등의 부작용을 나타낸다 (Rucker et al., 2007).
뽕잎 기원 EtOAc 분획층과 water 분획층 그리고 orlistat를 Oil Red O staining을 실시한 결과 뽕잎 기원의 EtOAc 분획층 500 ㎍/㎖ 농도에서 58.19%, 1,000 ㎍/㎖ 농도의 처리구에서 35.59%의 저해활성을 나타내는 것을 확인한 반면 orlistat를 20 μ㏖ 수준으로 처리한 경우와 water 분획층의 경우 지방세포 분화 억제 및 지질 축적율을 감소시키지 않는 것을 확인하였다 (Table 5).

Inhibitory effect of ethyl acetate and water fractions from 50% ethanol leaf extracts from Morus alba L. on the lipid accumulation in 3T3-L1 adipocyte cells.
중성지방 측정 결과 orlistat를 20 μ㏖ 수준으로 처리한 경우 오히려 중성지방 축적량이 증가하였고 뽕잎 추출물의 EtOAc 분획층은 500㎍/㎖의 농도에서 대조구의 37.63 ± 1.15%의 수준으로, 1,000 ㎍/㎖의 농도에서는 대조구의 23.22 ± 0.38%의 수준으로 중성지방의 함량이 감소하여 뽕잎 추출물의 EtOAc 분획층이 중성지방 함량을 감소시키는 것이 효과가 확인되었다. Water 분획층에서는 1,000 ㎍/㎖의 농도에서 57.71 ± 5.16%로 중성 지방을 감소시켜 효과를 나타내었으나, 현미경 하에서 전구지방세포가 분화되는 과정에서 세포의 물리적인 손상이 관찰되었다 (자료 미제시).
이러한 결과는 뽕잎 추출물이 지방전구세포의 세포자살을 유도하여 지방전구세포 수를 감소시킨다는 결과와 일치하였고 (Ann et al., 2015), quercetin 성분이 세포 증식, 성장, 운동, 생존 등의 세포반응을 일으키는 mitogen activated protein kinase (MAPK) 경로를 조절함으로서 세포자살을 유도한다는 보고와 일치하였다 (Ahn et al., 2008) (Table 6).

Inhibitory triglyceride content of ethyl acetate and water fractions from 50% ethanol leaf extracts of Morus alba L. on the lipid accumulation in 3T3-L1 adipocyte cells.
Water 분획층을 처리하여 중성지방 함량이 낮은 수준으로 나타난 것은 water 분획층에 높은 수준으로 포함되어진 quercetin이 지방전구세포의 지방세포로의 분화나 중성지방 축적에 영향을 미치는 것이 아니라 전구지방세포의 세포자살을 유도하여 지방전구세포의 수 자체를 감소시켰기 때문으로 생각된다.
3. Adipocyte 세포 분화에 있어 뽕잎 기원 flavonoid rich fraction 처리에 따른 지방대사 관련 유전자 발현양상분석
FRF 처리는 전구지방세포의 세포 분화와 지방축적을 감소시키는 것이 확인된 바 FRF 처리가 지방생성 및 축적 자체를 억제시키는 것인지, 지방생성과 관련된 mRNA 유전자발현을 조절하기 때문인지 확인할 필요가 있다.
지방전구세포의 분화는 insulin, dexamethasone, 3-isobutyl-1-methylxanthine (IBMX) 등의 유도인자를 필요로 하며 (Alihaid et al., 1992; Boney et al., 1994), 이때 발현되는 peroxisome proliferator activated receptor-γ (PPAR-γ)와 CCAAT-enhancer-binding protein/α (CEBP/α)는 지방전구세포가 지방세포로 분화하는데 가장 핵심적인 기능을 담당하며 이들이 전자인자로 발현 시 지방전구세포를 자극하여 지방세포로 분화한다 (Lehrke and Lazar, 2005; Lefterova et al., 2008). 또한 SREBP-1c는 지방과 간조직의 지방산과 콜레스테롤대사에 매우 중요한 역할을 가지는 전사인자로서 지방세포에서 PPARγ와 CEBP/α의 발현을 유도하여 지방조직 생성을 촉진시키고 fatty acid synthase (FAS), acetyl-CoA carboxylase (ACC) 등의 발현을 조절하여 지방산과 중성지방의 합성을 담당한다 (Lefterova and Lazar, 2009).
FRF과 FRF에 각 농도별로 함유된 rutin의 함량을 기준으로 3 가지의 농도 수준 (3.24 ㎍/㎖, 16.20 ㎍/㎖, 32.40 ㎍/㎖)으로 처리한 후 지방생성과 관련된 mRNA 유전자발현을 확인하였다 (Fig. 3).
Inhibitory effect of different concentrations of EtOAc fraction from leaf extracts of Morus alba L. on the lipid accumulation in 3T3-L1 adipocyte cell.
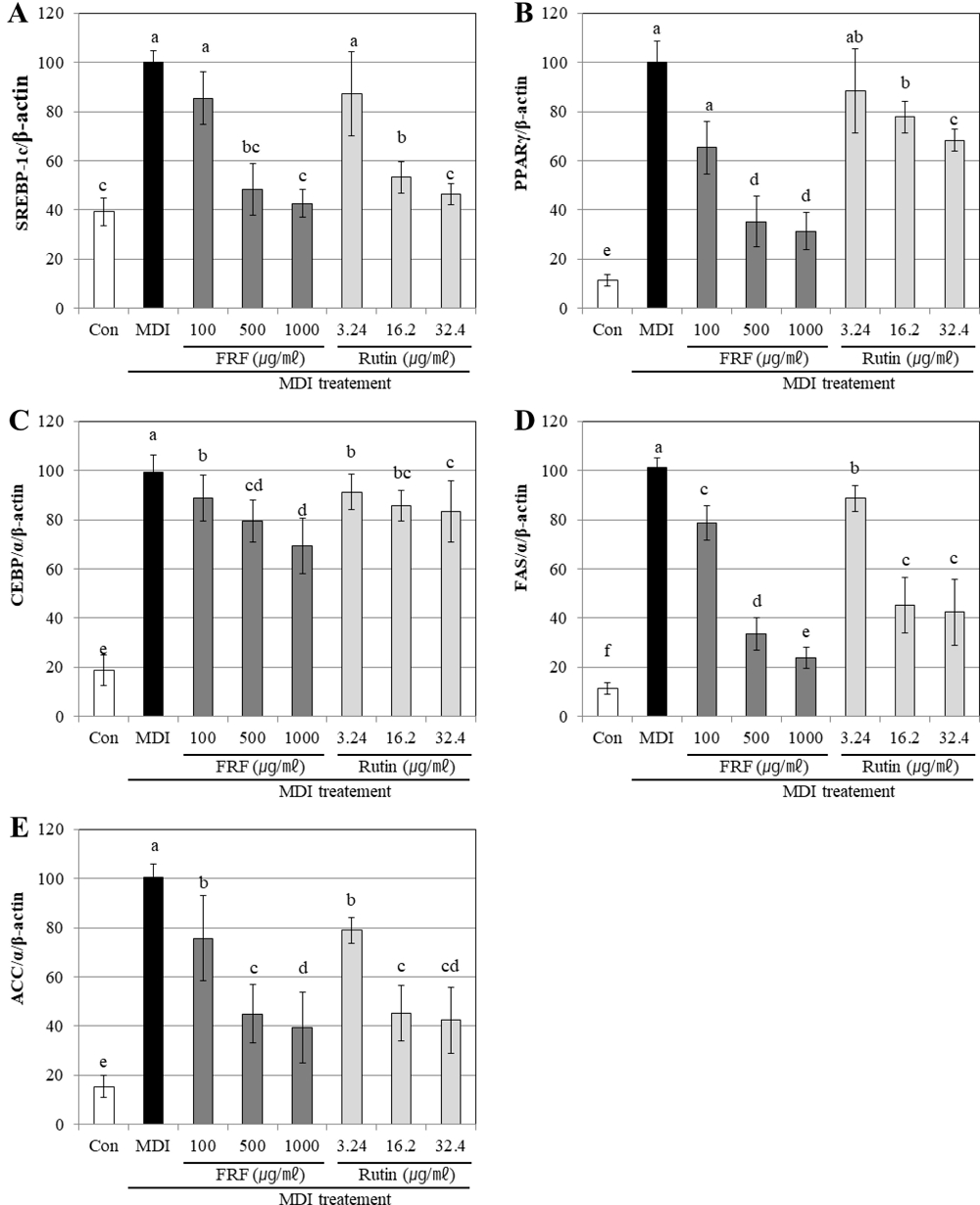
Gene expression effects of flavonoid rich fraction (FRF) of Morus alba L. on adipocyte differentiation in 3T3-L1 cells confirmed RT-PCR.A; SREBP-1c, B; PRAP-γ, C; CEBP/α, D; fatty acid synthase, E; acetyl-CoA carboxylase. Differentiation of confluent 3T3-L1 cells was initiated in DMEM containing differentiating culture mixture (MDI treatment: 0.5 mM 3-isobutyl-1-methylxanthine, 1 μM dexamethasone and 1 ㎍/㎖ insulin). Total RNA was extracted and cDNA was prepared from preadipocyte cell treated by FRF. Equivalent amounts of cDNA were amplified using primers specific for SREBP-1c and β-actin. Each value is expressed as the means ± SD of three independent expriments. Values with the same superscript letters are not significantly different from each other at p < 0.05.
대조군의 분화유도 처리에 따라 지방생성과 관련된 유전자 발현량 증가를 나타내었지만, FRF를 농도별로 처리하였을 경우 유전자의 발현량이 감소되는 것을 확인하였다. SREBP-1c의 경우 FRF 처리에 따라 모든 농도에서 SREBP-1c의 유전자 발현이 감소하였으며 1,000 ㎍/㎖의 농도로 처리한 경우 분화 유도 전의 대조군 수준으로 그 발현이 감소하였다. 또한 각 농도별 FRF에 함유되어질 것으로 예상되는 함량의 rutin을 처리한 경우에서도 동일한 수준으로 유전자 발현량이 감소하는 것이 확인되었으며 FRF의 처리에 따라 SREBP-1c 유전자 발현이 감소하는 것이 뽕잎에 포함되어진 rutin에 기인하는 것이라는 것을 확인할 수 있었다.
PPAR-γ의 경우 FRF를 100 ㎍/㎖의 수준으로 처리한 경우 약 65.36%, 500 ㎍/㎖은 35.23%, 1,000 ㎍/㎖으로 농도가 증가하는 경우 31.36%로 발현양이 감소를 나타내어 500 ㎍/㎖ 이상의 농도에서는 유전자 발현을 억제하는 효과가 크게 증가하지 않았다. 반면 FRF는 FRF에 포함되어져 있을 것으로 예측되는 양의 rutin을 단독으로 처리한 경우 3.24 ㎍/㎖를 처리한 경우 92.63%, 16.20㎍/㎖를 처리한 경우 81.66%, 32.40 ㎍/㎖를 처리한 경우 72.36%를 나타내어 FRF보다 단일성분인 rutin이 PPAR-γ의 유전자 발현을 억제하는 효과가 더 높은 것으로 확인되었다.
이러한 결과는 뽕잎의 FRF rutin 이외의 PPAR-γ 유전자 발현 억제 메카니즘을 가지는 지방세포 분화 억제물질이 포함되어져 있거나 여러 가지 복합적인 flavonoid 성분의 시너지 효과를 통해 지방세포분화를 억제하였기 때문으로 생각되며 추후 뽕잎의 FRF에서 이러한 PPAR-γ 유전자 발현 억제와 무관한 지방세포 분화 억제 성분에 대한 분리정제와 활성검정이 필요할 것으로 판단된다.
CEBP/α 유전자의 발현은 FRF를 처리하는 경우 유전자의 발현이 농도 의존적으로 감소하기는 하였으나 유전자 발현 억제 정도가 100 ㎍/㎖를 처리한 경우 약 88.63%, 500 ㎍/㎖은 79.36%, 1,000 ㎍/㎖에서 83.36%로 발현양이 감소를 나타내어 발현 억제 효과가 크지 않았다. 따라서 뽕잎의 FRF와 그들의 활성성분인 rutin을 처리하는 경우 PPAR-γ, SREBP-1c의 유전자 발현에 더욱 의존적으로 억제효과를 나타내어 지방세포의 생성 및 지질축적을 감소시키는 것을 확인하였다.
이러한 결과는 뽕잎 추출물이 PPAR-γ, CEBP/α, SREBP-1c의 발현을 억제시킨다는 보고와 유사하며 (Kim et al., 2012; Song et al., 2013), rutin 처리가 PPAR-γ, CEBP/α, SREBP-1c의 유전자 발현을 하향 조절하여 세포분화를 억제시킨다는 보고와 같았다 (Wongs-Aree et al., 2006).
지방산 생성에 관여하는 효소인 fatty acid (FAS), acyl-CoA carboylase (ACC) 등은 유전자 발현을 조절하고 지방 생성과 관련된 단백질 발현에도 영향을 끼침으로써 인슐린 의존적인 지방 합성을 유도한다 (Fu et al., 2005; Skurk et al., 2007). FAS는 지방 생성의 주요 효소이며 주로 지방 조직, 간 및 유선에서 발현되는데, 감소된 FAS 발현은 지방전구세포 분화 및 지질 축적을 억제한다 (Schmid et al., 2005).
FAS, ACC의 유전자 발현에 있어서도 FRF를 처리한 경우가 FRF에 포함되어져 있을 것으로 예측되는 양의 rutin을 처리한 경우보다 더 높은 수준으로 FAS, ACC의 유전자 발현 억제하였다. SREBP-1c는 유전자 발현의 전이를 촉진하여 FAS를 조절하고 (Han et al., 2018), SREBP-1c, PPAR-γ, CEBP/α의 발현량이 줄어 ACC의 지방산 합성 및 신장을 억제한다는 보고와 같이 (Kim, 1997), 뽕잎의 FRF은 상위 발현 유전자인 SREBP-1c, PPAR-γ, CEBP/α의 mRNA 발현량을 감소시킴으로써 하위 인자인 FAS와 ACC mRNA의 발현을 감소시킬 수 있다는 것을 확인하였다.
따라서, FRF는 3T3-L1 지방전구세포에서의 지방세포화 인자인 (adipogenic factor) 유전자를 발현억제시킴으로서 지질합성 수송, FAS, ACC 유전자의 발현에 영향을 미쳐 지방세포 분화를 억제시킨 것으로 확인되었다.
4. Adipocyte 세포분화에 있어 뽕잎 기원 flavonoid rich fraction 처리에 따른 지방대사 관련 단백질 발현양상분석
FRF의 농도별 시료 (100 ㎍/㎖, 500 ㎍/㎖, 1,000 ㎍/㎖) 처리에 따른 3T3-L1 cell에서의 지방생성 및 지방분해와 관련된 SREBP-1c, PPAR-γ, CEBP/α, FAS, ACC 단백질 발현양상변화를 western blot을 이용하여 확인하였다 (Fig. 4)
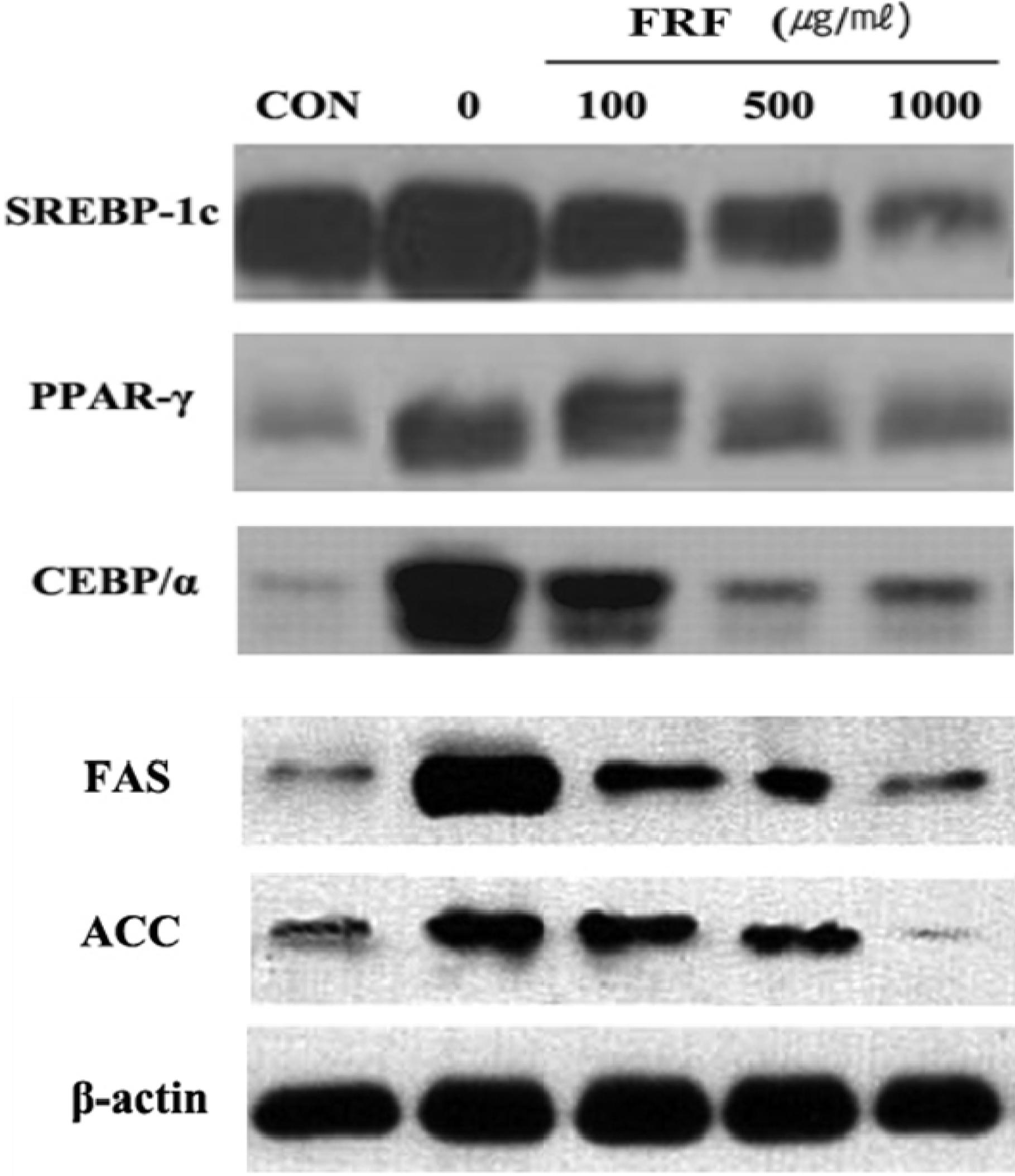
Protein expression effects of flavonoid rich fraction (FRF) of Morus alba L. on adipocyte differentiation in 3T3-L1 cells confirmed western blotting.Differentiation of confluent 3T3-L1 cells was initiated in DMEM containing differentiating culture mixture [MDI treatment: 0.5 mM 3-isobutyl-1-methylxanthine, 1μM dexamethasone and 1 ㎍/㎖ insulin]. Western blotting was perfomed using 30 ㎍ of each sample. The loading control was assessed using β-actin antibody. The relative intensities SREBP-1c, PPAR-γ, CEBP/α, FAS, ACC expression compared with the β-actin expression.
뽕잎의 FRF를 처리하지 않은 대조군은 SREBP-1c, PPAR-γ, CEBP/α, FAS, ACC의 발현이 증가하는 것으로 나타내었고, FRF를 농도별로 처리하였을 경우 유의성 있게 감소하는 것을 확인하였다. 특히 뽕잎의 FRF의 처리에 따른 CEBP/α의 단백질 발현을 확인한 결과 FRF가 CEBP/α의 단백질 발현을 효과적으로 억제하고 있음이 확인되었는데 이는 뽕잎의 FRF 처리 후 지방생성과 축적에 관련된 전사인자를 mRNA 수준에서 검정한 결과, 뽕잎의 FRF는 SREBP-1c, PPAR-γ의 mRNA 발현은 효과적으로 억제하나, CEBP/α의 mRNA 발현억제 효과가 크지 않은 결과 (Fig. 3)와 상이하였다. 이러한 결과는 뽕잎의 flavonoid 성분 중에는 억제효과가 크지 않지만 CEBP/α의 mRNA의 발현을 억제하는 성분도 존재하며 단백질로 번역 후 과정에도 영향을 미쳐 해당 유전자의 단백질 발현을 억제하는 성분도 존재할 것이라는 예측을 할 수 있으며 향후 뽕잎의 flavonoid 성분 중 어떠한 성분이 전사단계와 번역 후 단계에서 CEBP/α의 유전자의 발현을 억제하는 것인지에 대한 검토가 필요할 것으로 보인다.
SREBP-1c는 지방조직에서 발현하여 PPAR-γ의 프로모터에 결합하여 PPAR-γ의 발현을 조절하며, 지방산 대사물을 생성함으로써 지방세포 분화를 유도하는 것으로 알려져 있다 (Tsuda et al., 2004). 또한, CEBP/α는 PPAR-γ의 활성화 및 지속적인 유지를 도와줌으로써 성숙한 지방세포의 생성을 위해 인슐린 감수성에 중요한 역할을 담당하는 것으로 알려져 있는데 (Wu et al., 1999), 뽕잎의 FRF은 SREBP-1c 유전자 발현 억제를 유도함으로써 하위인자인 PPAR-γ, CEBP/α 유전자 발현에 영향을 주는 것으로 생각된다.
이상의 결과를 통하여 뽕잎의 FRF는 비만 관련 인자의 전사단계에서 발현을 제어할 뿐만 아니라 번역 후 과정에도 영향을 미쳐 관련 단백질의 발현량을 감소시키는 것을 확인하였고, 이에 따라 전지방세포의 지방분화 억제 및 지질함량이 감소된다는 것을 확인하였다.
5. 실험동물 (C57BL/6 mice)에서 뽕잎의 flavonoid rich fraction 식이에 따른 항비만 효과
일반식이군 (chow), 고지방식이군 (HFD), 고지방식이-뽕잎 기원 플라보노이드 분획 투여군 (HFD-FRF)에 대해 12 주간 경구 투여 후 식이섭취량, 식이효율 체중변화를 확인하였다.
실험이 실시되는 12 주 동안에 HFD-FRF에서 각 개체의 건강상태는 양호하였다. 실험동물의 초기 체중은 평균 18.24 g이었고 3 군 간에 유의한 차이를 확인할 수 없었다. 12 주 후에 HFD의 체중을 chow과 비교하였을 때 더 큰 체중 증가를 나타내었으며, HFD-FRF은 HFD의 실험동물의 체중을 54.36% 수준으로 감소시켰지만, chow의 마우스보다 여전히 높은 수준이었다 (Table 7). 또한, 마우스의 신장은 각 식이군 사이에서 유의한 차이가 없는 것을 확인하였다 (Fig 5A, Table 7).

Tissue weight and serum parameters and hepatic lipids for the male C57BL/6 mice in Chow, HFD, HFD-FRF group at the end of experiment.
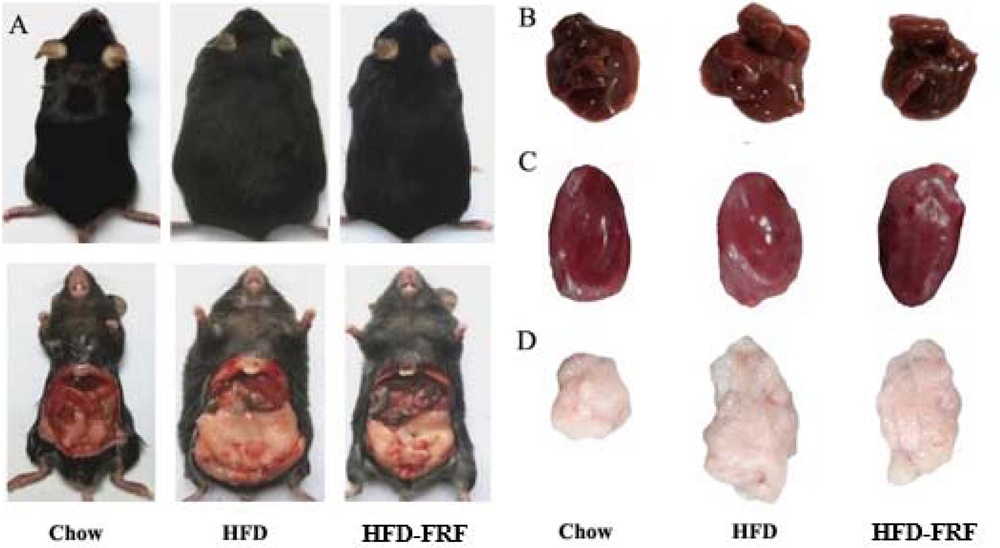
Representative macroscopic pictures of male C57BL/6 mice from different groups at the end of experiment.A; C57BL/6 mice, B; liver, C; heart, D; epididymal white adipose tissue. First pannel; reference chow (RC) diet, second pannel; HFD (high fat/cholesterol diet), third pannel; HFD-FRF [HFD plus 5 g/㎏ flavonoid rich fraction (FRF) of Morus alba L. diet].
일반식이군 (chow)의 식이섭취량은 매주 평균 19.95 g이었고, HFD의 식이섭취량은 19.74 g, HFD-FRF은 19.52 g 이었다. 식이 효율은 HFD이 chow보다 유의적으로 증가하였고 (p < 0.01), HFD-FRF의 식이 효율은 HFD보다 유의적으로 낮게 나타났다 (p < 0.01).
고지방식이군에 rutin 처리는 체중 감소, 복부지방 감소, 식욕억제를 유발시킨다고 보고되어왔다 (Choi et al., 2006; Kamalakkannan and Prince, 2006). 따라서 뽕잎 처리가 고지방식이군의 체중감소, 식이 효율을 감소시킨 것은 뽕잎에 함유된 rutin의 약리적 작용에 기인한 것으로 판단된다.
일반식이군 (chow), 고지방식이군 (HFD), 고지방식이-뽕잎 기원 플라보노이드 분획 투여군 (HFD-FRF)에 대해 12 주간 경구 투여 후 간 조직과 부고환의 지방조직을 분리하고 section 하여 조직 형태를 관찰한 결과 chow과 다르게 고지방 식이를 먹인 마우스는 간에서 많은 지질 축적이 이루어지는 것이 확인된 반면 (Fig. 6B), HFD-FRF에서는 HFD의 마우스에서 관찰되는 지질 축적을 유의하게 완화시키는 것을 확인하였다 (Fig. 6C).
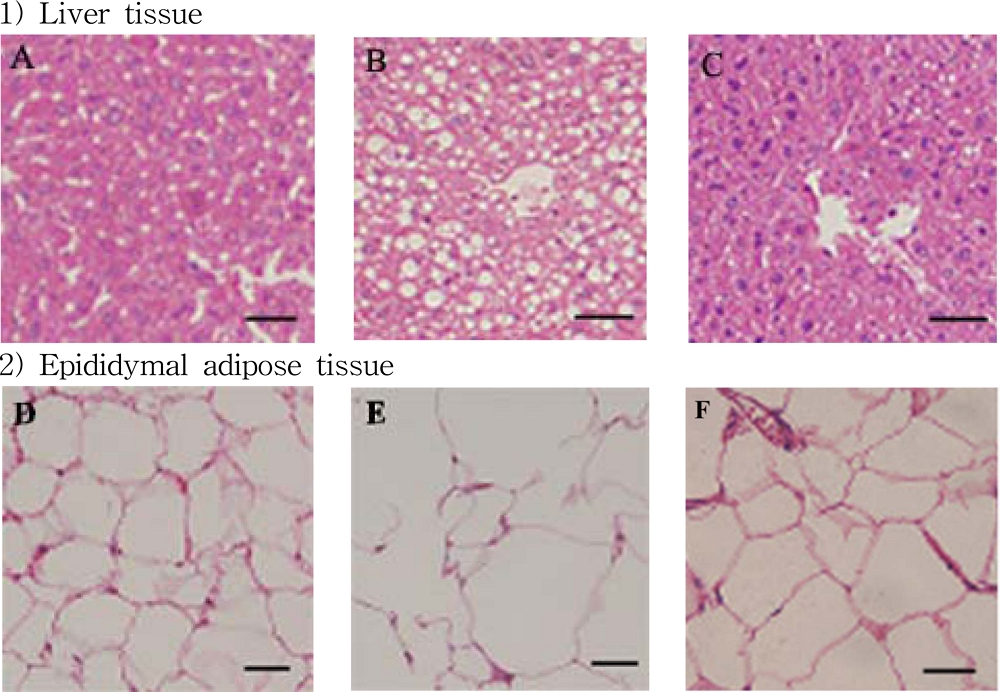
Morpholoogy changes in liver (A - C) and epididymal adipose tissue (D - F) for the male C57BL/6 mice.A - C; Oil Red O was used to stain livers sections of mice, D - F; H&E stained epididymal adipose tissue. Representative sections are from three mice from dietary group of mice. A and D; chow (reference chow diet), B and E; HFD (high fat/cholesterol diet), C and F; HFD-FRF [HFD plus 5 g/㎏ flavonoid rich fraction (FRF) of Morus alba L. diet].
또한 마우스의 부고환 백색 지방 조직을 관찰한 결과 HFD의 마우스는 지방 조직에서 지방 세포의 비대가 관찰되는 반면 (Fig. 6E) HFD-FRF에서는 약화되는 것을 확인하였다 (Fig. 6F). 또한 chow, HFD, HFD-FRF의 마우스 개체의 간 시료를 대상으로 간 지질을 분석한 결과 HFD이 chow에 비하여 총 지질, triglyceride 및 cholesterol 함량이 증가한 반면 HFD-FRF의 경우 콜레스테롤 함량에는 영향을 미치지 못하였으나 간의 총 지질 및 triglyceride 함량은 유의한 수준으로 감소시킴을 확인하였다 (Fig. 7).
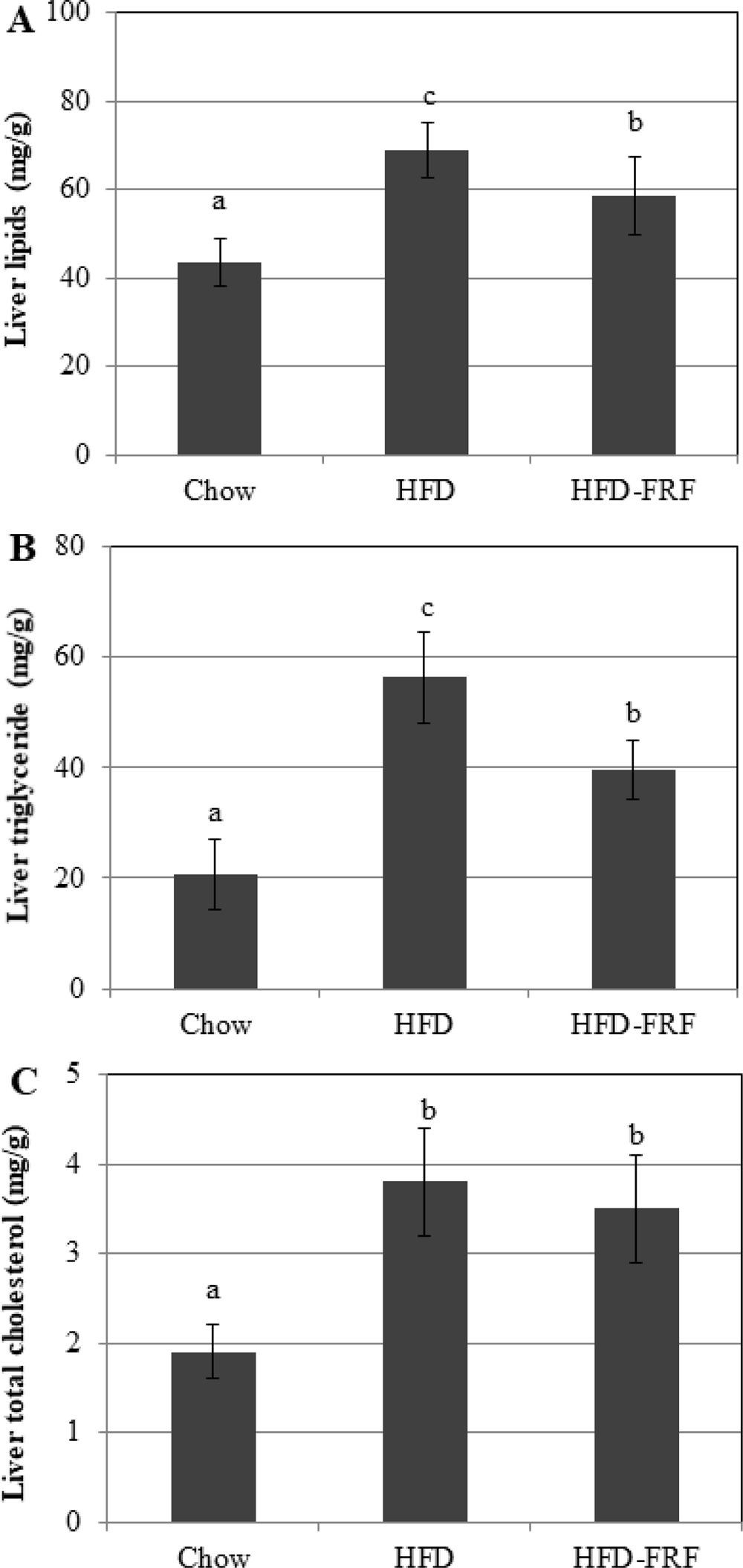
Hepatic contents of total lipid, triacylglycerol and cholesterol.A; liver lipid, B; liver triglyceride, C; liver cholesterol, Chow; reference chow diet group, HFD; high-fat/cholesterol diet group, HFD-FRF; HFD plus 5 g/㎏ flavonoid rich fraction (FRF) of Morus alba L. diet group. Values are mean ± SEM. The means marked with superscript letters are significantly different relative to others group (p < 0.01).
심장, 간, 신장 및 interscapular brown adipose tissue의 무게는 각 처리군에서 크게 변화하지 않았으나 체중의 백분율로 표현했을 때 심장, 간, 신장 및 interscapular brown adipose tissue는 chow에 비해 HFD에서 더 적게 나타났다 (Table 7). Epidermal white adipose tissue의 무게는 일반식이군 (chow)과 비교하여 HFD에서 높게 나타났지만 HFD-FRF에서 그 무게는 유의적으로 감소하였다.
에너지 섭취가 triglycerides (TG)의 형태로 white adipose tissue (WAT)에 저장되며 비만이 발생하게 되는데 (Lowell and Spiegelman, 2000), WAT와 구별되는 brown adipose tissue (BAT)는 다분자 지방구와 non-shivering thermogenesis라는 과정을 통해 체온을 유지하기 위해 열을 발생시키는 다수의 미토콘드리아로 구성된다 (Cannon and Nedergaard, 2004). BAT는 비만과 관련된 질병으로부터 잠재적으로 보호하여 비만 예방효과를 나타내며 (Kajimura et al., 2015), 뽕나무 추출물은 BAT 생성을 증가시킨다는 보고에 근거하여 (You et al., 2015) 뽕나무 잎에 포함되어진 flavonoid 성분이 non-shivering thermogenesis 과정을 촉진하여 BAT 생성을 증가시키며 이에 따라 WAT 생성을 억제하고 TG의 축적을 억제시키는 것이라 생각된다.
HFD는 chow와 비교하여 혈청 포도당, 중성 지방 및 콜레스테롤 수치가 상승하였으나 HFD-FRF의 경우 중성지방함량, 콜레스테롤 함량을 감소시켰고 특히 혈액 내 글로코스 함량을 크게 감소시켰다.
Tao와 Zhang (2013)은 뽕잎의 플라보노이드 성분이 혈당 수준을 억제한다고 하였으며 Choi 등 (2016)은 고지방식이군에서 rutin의 경구투여는 체중, 간 무게, 및 콜레스테롤 농도를 감소시키고, 또한 ALT, AST, LDL, HDL의 혈장 활성을 감소시킨다고 보고하였다 (Prince and Kamalakkannan, 2006). 본 연구에서도 HFD-FRF는 고지방식이에 의해 증가된 aspartate aminotransferase 및 alanine aminotransferase, HDL-cholesterol과 LDL-cholesterol을 낮춤으로서 뽕잎 기원 플라보노이드 분획 투여가 비만 생쥐 모델 혈액에서의 지질 개선효과를 가져올 수 있다는 것을 확인할 수 있었다 (Table 7).
일반식이군 (chow), 고지방식이군 (HFD), 고지방식이-뽕잎 기원 플라보노이드 분획 투여군 (HFD-FRF)에 대해 12 주간 경구 투여 후 혈액 내 leptin과 insulin 수치를 조사한 결과 (Fig. 8), HFD에서 혈청 leptin과 insulin 수치가 일반식이군 (chow)에 비하여 상승한 반면 HFD-FRF에서는 고지방식이에 의해 증가된 leptin의 수치를 일반식이군 (chow) 수준까지 감소시키는 효과를 나타내었으며 adiponectin은 HFD에서 고지방식이로 인해 급격하게 감소하였으나, HFD-FRF 투여로 인해 그 수치가 증가하여 일반식이군 (chow) 수준까지 회복되는 것을 확인하였다. Insulin의 경우도 고지방식이에 의하여 HFD에서 증가된 수치를 나타낸 반면 HFD-FRF에서 다소 감소하는 경향을 나타내었으나 통계적으로 유의한 수준은 아니었다 (Fig. 8).
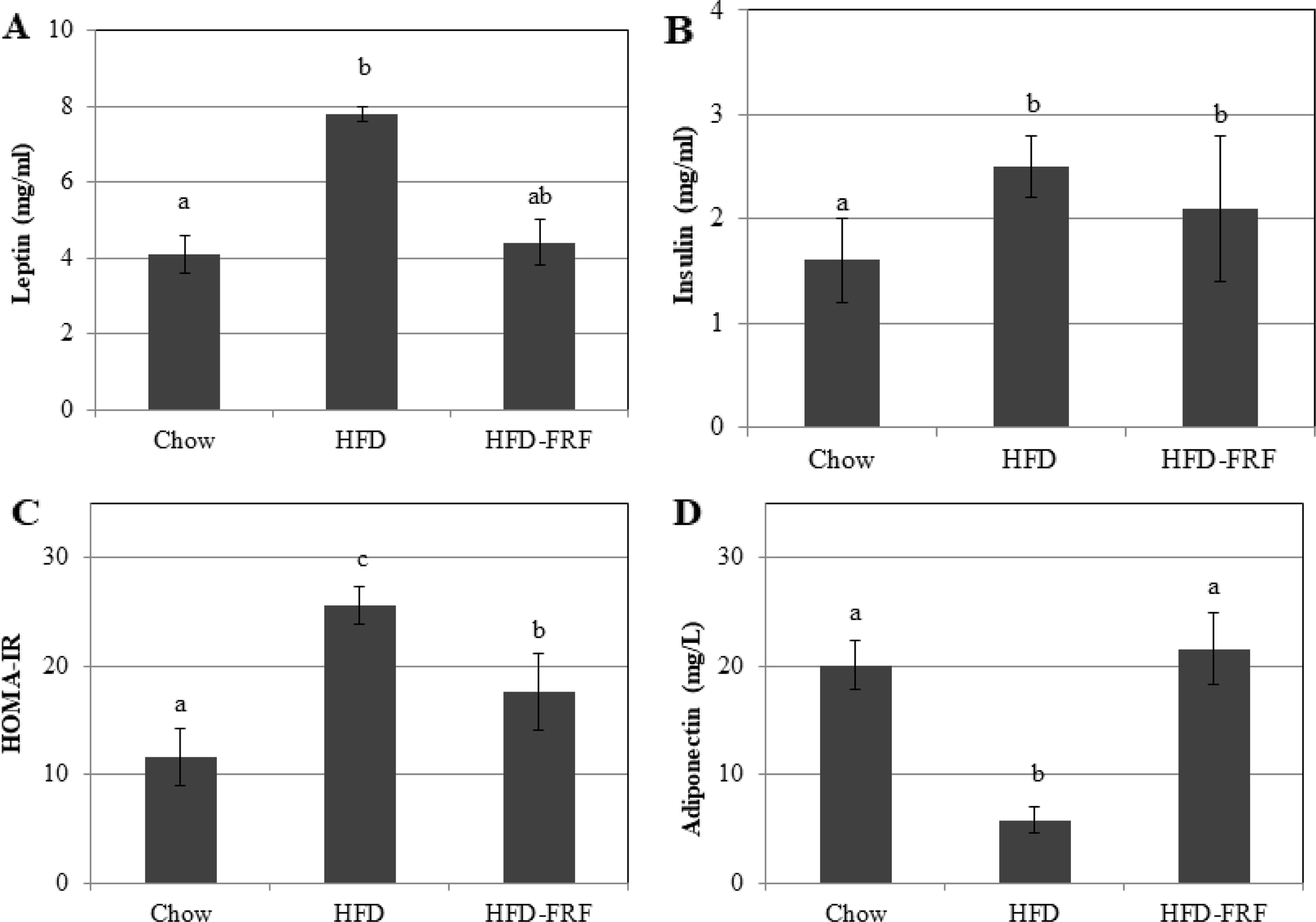
Serum insulin levels, leptin levels, HOMA-IR and adiponectin in mice.Chow; reference chow diet group, HFD; high-fat/cholesterol diet group, HFD-FRF; HFD plus 5 g/㎏ flavonoid rich fraction (FRF) of Morus alba L. Values are mean ± SE. The means marked with superscript letters are significantly different relative to other groups (p < 0.01).
Leptin은 지방조직에 의해 분비되는 비만관련 유전자의 산물이며 지질대사에 중요한 역할을 하고 (Maratos-Flier, 2008), 에너지 항상성, 대사속도, 인슐린감수성을 조절하는 지방의 양과 상관관계가 있다고 보고되고 있다 (Rosenbaum and Leibel, 1999).
Adiponectin은 지방산 산화와 포도당 조절과 같은 대사 과정을 조절하는 지방세포 단백질 호르몬으로서 보통 비만 환자에서는 adiponectin의 생성 수준이 감소한다고 보고되고 있다 (Arcri et al., 2009). 또한 고지방식이가 인슐린 저항성을 높이고 증가된 인슐린 저항성은 지방조직에서 지방 분해를 유도하여 간으로 유리지방산을 방출시켜 간에서 염증을 유발시킨다고 보고되고 있다 (Van der Wier et al., 2015).
이상의 결과를 통해 뽕잎의 flavonoid rich fraction 투여는 adiponectin 농도의 증가와 함께 leptin 분비의 감소, 인슐린저항성의 감소, 염증, 지방생성을 예방할 수 있는 잠재력을 가지는 소재인 것으로 판단된다.
일반식이군 (chow), 고지방식이군 (HFD), 고지방식이-뽕잎 기원 플라보노이드 분획 투여군 (HFD-FRF)에 대해 12 주간 경구 투여 후 간조직에서의 PPAR-γ, FAS, ACO 및 CPT 1의 mRNA 발현 수준을 부고환 조직의 백색지방세포에서 IL-1β, IL-6 및 TNF-α의 발현을 quantitative real-time PCR를 이용하여 측정하였다 (Fig. 9).
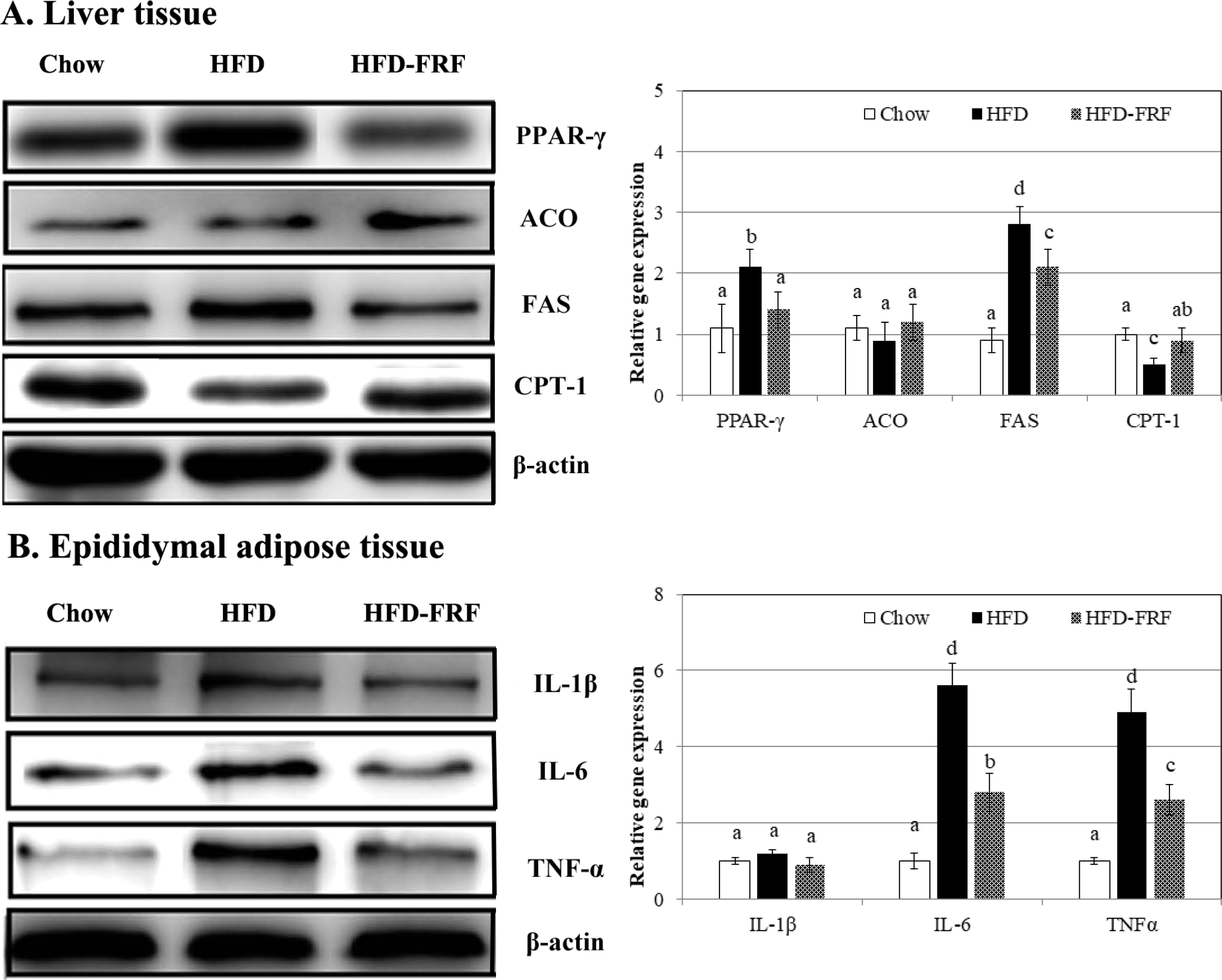
Effects of flavonoid rich fraction (FRF) of Morus alba L. on protein expressions of PPAR-γ, FAS, ACO, CPT-1, IL-1β, IL-6 and TNFα in C57BL/6J mice fed a high fat/cholesterol diet for 12 weeks.The intensity of the bands was quantified by densitometric analysis and normalized with corresponding β-actin. Results are calculated as the mean ± SD of three mice. Chow; reference chow diet group, HFD; high-fat/cholesterol diet group, HFD-FRF; HFD plus 5 g/㎏ flavonoid rich fraction (FRF) of Morus alba L. diet group. PPAR-γ; peroxisome proliferator-activated receptor, FAS; fatty acid synthase, ACO; acyl-CoA oxidase, CP- 1; carnitine palmitoyl transferase, IL-1β; iterleukin-1β, IL-6; iterleukin-6, TNF-α; tumor necrosis factor α. The means marked with superscript letters are significantly different relative to others (p < 0.01).
HFD에서 지질대사 관련 유전자의 발현은 chow과 비교하여 PPAR-γ, FAS, IL-6 및 TNF-α 유전자의 과도발현 시켰으며 CPT1 유전자의 발현을 억제하였다. 반면 HFD-FRF에서는 HFD에서 증가된 PPAR-γ, FAS, IL-6 및 TNF-α의 발현 수준을 현저하게 감소시키고 CPT1 발현 수준은 증가시키는 것을 확인하였다 (Fig. 9).
이러한 결과는 adipocyte 세포 분화에 있어 뽕잎 기원 flavonoid rich fraction 처리에 따른 지방대사 관련 유전자 발현양상과 유사하여 뽕잎 기원 flavonoid rich fraction 처리에 의하여 지방산 합성 관련 유전자 (PPAR-γ와 FAS)를 억제하여 지방산 생성 자체를 억제할 뿐 아니라 CPT1 발현을 증가시켜 생성된 지방산의 산화를 유도함으로써 지질대사를 조절한다는 것을 in vivo 상에서 확인할 수 있었다.
지방조직은 전염증 및 항염증성 adipokine을 분비하는데, 항염증성 adipokine에는 IL-10, adiponectin이 포함되며, 전염증성 adipokine에는 IL-1, IL-6, MCP-1 및 TNF-α가 포함된다 (Jayarathne et al., 2017). 비만은 IL-1β, IL-6 및 TNF-α와 같은 비만 관련 염증성 adipokine의 생산을 증가시키고 adiponectin과 같은 항염증성 adipokine을 감소시킴으로서 만성 또는 전신 염증 상태를 유발할 수 있다 (Bartchewsky et al., 2011; Samuel et al., 2013).
본 연구를 통하여 뽕잎이 항비만 효과를 나타내는 성분은 rutin과 같은 flavonoid계열의 물질을 유효성분으로 하며 HFD에서의 높은 수준인 IL-1β, IL-6, TNF-α 유전자 발현을 증가하는 것에 대하여 뽕잎 기원 flavonoid rich fraction 처리는 이러한 고지방 식이에 의한 증가된 전염증 adipokine 수준을 감소시킴으로서 비만에 의한 염증상태를 완화시키는 것을 확인하였다.
결과적으로 뽕잎 기원 flavonoid rich fraction의 식이는 고지방식군에 의해 유도된 비만이 C57BL/6 마우스에서 체중증가 억제, 간에서의 TG 감소, leptin의 분비를 억제함으로서 지방축적 억제 효과를 나타내며 인슐린 저항성 향상, 비만으로 인한 염증 완화 효과를 통해 항비만 효과를 나타내는 것으로 확인되었다. 뿐만 아니라 지방 세포의 분화에 영향을 미치고, 지질대사와 관련된 전사인자 및 신호전달 pathway를 조절하여 항비만 효과를 나타낸다는 것을 알 수 있었고 이를 통하여 rutin과 같은 뽕잎 기원 flavonoid 활성물질이나 이를 포함하는 flavonoid rich fraction은 항비만 효과를 갖는 제품개발의 소재로 제공될 수 있음을 확인할 수 있었다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ013606032020)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFFERENCES
-
Ahn J, Lee H, Kim S, Park J and Ha T. (2008). The anti-obesity effect of quercetin is mediated by the AMPK and MAPK signaling pathways. Biochemical and Biophysical Research Communications. 373:545-549.
[https://doi.org/10.1016/j.bbrc.2008.06.077]

-
Ali AT, Hochfeld WE, Myburgh R and Pepper MS. (2013). Adipocyte and adipogenesis. European Journal of Cell Biology. 92:229-236.
[https://doi.org/10.1016/j.ejcb.2013.06.001]

-
Alihaid G, Grimaldi P and Négrel R. (1992). Cellular and molecular aspects of adipose tissue development. Annual Review of Nutrition. 12:207-233.
[https://doi.org/10.1146/annurev.nu.12.070192.001231]

-
Ann JY, Eo H and Lim Y. (2015). Mulberry leaves(Morus alba L.) ameliorate obesity-induced hepatic lipogenesis, fibrosis, and oxidative stress in high fat diet-fed mice. Genes Nutrition. 10:1-13.
[https://doi.org/10.1007/s12263-015-0495-x]

-
Arçri DP, Bartchewsky W, dos Santos TW, Oliveira KA, Funck A, Pedrazzoli J, de Souza MF, Saad MJ, Bastos DH, Gambero A, Carvalho Pde O and Ribeiro ML. (2009). Antiobesity effects of yerba matéextract(Ilex paraguariensis) in high-fat diet-induced obese mice. Obesity. 17:2127-2133.
[https://doi.org/10.1038/oby.2009.158]

-
Attila H, Katalin V, Danko B, Zoltan K, Edit W, Anasztasia H, Istvan Z and Yusty-Jouan H. (2013). In vitro anti-diabetic activity and chemical characterization of an apolar fraction of Morus alba leaf water extract. Phytotherapy Research. 27:847-851.
[https://doi.org/10.1002/ptr.4803]

-
Bartchewsky W, Tanila W, Oliveira K, Deoliveira CC, Gotardo ÉM, Pedrazzoli J Jr, Gambero A, Ferraz LF, Carvalho Pde O and Ribeiro ML. (2011). Anti-inflammatory effects of yerba maté extract(Ilex paraguariensis) ameliorate insulin resistance in mice with high fat dietinduced obesity. Molecular and Cellular Endocrinology. 335:110-115.
[https://doi.org/10.1016/j.mce.2011.01.003]

-
Boney AM, Moats-ataats BM, Stiles AD and Dercole AJ. (1994). Expression of insulin-like growth factor-I(IGF-1) and IGF-binding proteins during adipogenesis. Endocrinology. 135:1863-1868.
[https://doi.org/10.1210/endo.135.5.7525256]

-
Cannon B and Nedergaard J. (2004). Brownadipose tissue: Function and physiological significance. Physiological Rev. 84:277-359.
[https://doi.org/10.1152/physrev.00015.2003]

-
Choi I, Park Y, Choi H and Lee EH. (2006). Anti-adipogenic activity of rutin in 3T3-L1 cells and mice fed with high-fat diet. BioFactors. 26:273-281.
[https://doi.org/10.1002/biof.5520260405]

-
Emamat H, Nouri M, Foroughi F, Rismanchi M, Eini-Zinab H and Hekmatdoost A. (2016). An accessible and pragmatic experimental model of nonalcoholic fatty liver disease. Middle East Journal of Digestive Diseases. 8:109-115.
[https://doi.org/10.15171/mejdd.2016.15]

-
Fu Y, Luo N, Klein RL and Garvey WT. (2005). Adiponectin promotes adipocyte differentiation, insulin sensitivity, and lipid accumulation. Journal of Lipid Research. 46:1369-1379.
[https://doi.org/10.1194/jlr.M400373-JLR200]

-
Han MH, Kim HJ, Jeong JW, Park C, Kim BW and Choi YH. (2018). Inhibition of adipocyte differentiation by anthocyanins isolated from the fruit of Vitis coignetiae Pulliat is associated with the activation of AMPK signaling pathway. Toxicological Research. 34:13-21.
[https://doi.org/10.5487/TR.2018.34.1.013]

-
Hwang JY, Wu YX, Hwang DI, Bae SJ and Kim T. (2014). Anti-obesity effect of Polygala tenuifolia. Korean Journal of Food Preservation. 21:97-106.
[https://doi.org/10.11002/kjfp.2014.21.1.97]

-
Jayarathne S, Koboziev I, Park OH, Oldewage-Theron W, Shen CL and Moustaid-Moussa N. (2017). Anti-inflammatory and anti-obesity properties of food bioactive components: Effects on adipose tissue. Preventive Nutrition and Food Science. 22:251-262.
[https://doi.org/10.3746/pnf.2017.22.4.251]

-
Kajimura S, Spiegelman BM and Seale P. (2015). Brown and beige fat: Physiological roles beyond heat generation. Cell Metabolism. 22:546-559.
[https://doi.org/10.1016/j.cmet.2015.09.007]

-
Khalilpourfarshbafi M, Gholami K, Murugan DD, Sattar MZA and Abdullah NA. (2019). Differential effects of dietary flavonoids on adipogenesis. European Journal of Nutrition. 58:5-25.
[https://doi.org/10.1007/s00394-018-1663-8]

-
Kim GS, Park HJ, Woo JH, Kim MK, Koh PO, Min W, Ko YG, Kim CH, Won CK and Cho JH. (2012). Citrus aurantium flavonoids inhibit adipogenesis through the Akt signaling pathway in 3T3-L1 cells. BMC Complement. Alternative Medicine. 12:31.
[https://doi.org/10.1186/1472-6882-12-31]

-
Kim HB, Seo SD, Koo HY, Seok YS, Kim SL and Sung GB. (2013). Quantitative analysis of 1-deoxynojirimycin in mulberry leaves. Journal of Sericultural and Entomological Science. 51:20-29.
[https://doi.org/10.7852/jses.2013.51.1.20]

-
Kim JE and Chen J. (2004). Regulation of peroxisome proliferator-activated receptor-γ activity by mammalian target of rapamycin and amino acids in adipogenesis. Diabetes. 53:2748-2756.
[https://doi.org/10.2337/diabetes.53.11.2748]

-
Kim KH. (1997). Regulation of mammalian acetyl-coenzyme a carboxylase. Annual Review of Nutrition. 17:77-99.
[https://doi.org/10.1146/annurev.nutr.17.1.77]

- Kim SK, Kim SY, Kim HJ and Kim AJ. (2001). The effect of mulberry-leaf extract on the body fat accumulation in obese fa/fa male zucker rats. Journal of the Korean Society of Food Science and Nutrition. 30:516-520.
-
Lefterova MI and Lazar MA. (2009). New developments in adipogenesis. Trends in Endocrinology and Metabolism. 20:107-114.
[https://doi.org/10.1016/j.tem.2008.11.005]

-
Lefterova MI, Zhang Y, Steger DJ, Schupp M, Schug J, Cristancho A, Feng D, Zhuo D, Stoeckert CJ, Liu XS and Lazar MA. (2008). PPARγ and C/EBP factors orchestrate adipocyte biology via adjacent binding on a genome-wide scale. Genes and Development. 22:2941-2952.
[https://doi.org/10.1101/gad.1709008]

-
Lowell BB and Spiegelman BM. (2000) Towards a molecular understanding of adaptive thermogenesis. Nature. 404:652-660.
[https://doi.org/10.1038/35007527]

-
Maratos-Flier E. (2008). The long reach of leptin. Nature Medicine. 14:604-606.
[https://doi.org/10.1038/nm0608-604]

-
Mattews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF and Turner RC. (1985). Hemeostasis model assessment: Insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetolodia. 282:412-419.
[https://doi.org/10.1007/BF00280883]

-
Prince PS and Kamalakkannan N. (2006). Rutin improves glucose homeostasis in streptozotocin diabetic tissues by altering glycolytic and gluconeogenic enzymes. Journal of Biochemical and Molecular Toxicology. 20:96-102.
[https://doi.org/10.1002/jbt.20117]

-
Rosenbaum M and Leibel RL. (1999). clinical review 107: Role of gonadal steroids in the sexual dimorphisms in body composition and circulating concentrations of leptin. Journal of Clinical Endocrinology and Metabolism. 84:1784-1789.
[https://doi.org/10.1210/jcem.84.6.5787]

-
Rucker D, Padwal R, Li SK, Curioni C and Lau DC. (2007). Long term pharmacotherapy for obesity and overweight: Updated metanalysis. British Medical Journal. 335:1194-1199.
[https://doi.org/10.1136/bmj.39385.413113.25]

-
Samuel Wu YH, Chiu CH, Yang DJ, Lin YL, Tseng JK and Chen YC. (2013). Inhibitory effects of litchi(Litchi chinensis Sonn.) flower-water extracts on lipase activity and diet-induced obesity. Journal of Functional Foods. 5:923-929.
[https://doi.org/10.1016/j.jff.2013.02.002]

-
Schmid B, Rippmann JF, Tadayyon M and Hamilton BS. (2005). Inhibition of fatty acid synthase prevents preadipocyte differentiation. Biochemical and Biophysical Research Communications. 328:1073-1082.
[https://doi.org/10.1016/j.bbrc.2005.01.067]

-
Skurk T, Alberti-Huber C, Herder C and Hauner H. (2007). Relationship between adipocyte size and adipokine expression and secretion. Journal of Clinical Endocrinology and Metabolism. 92:1023-1033.
[https://doi.org/10.1210/jc.2006-1055]

-
Song Y, Park HJ, Kang SN, Jang SH, Lee SJ, Ko YG, Kim GS and Cho JH. (2013). Blueberry peel extracts inhibit adipogenesis in 3T3-L1 cells and reduce high-fat diet-induced obesity. PLoS ONE. 8:e69925.
[https://doi.org/10.1371/journal.pone.0069925]

-
Spiegelman BM and Flier JS. (1996). Adipogenesis and obesity: Rounding out the big picture. Cell. 87:377-389.
[https://doi.org/10.1016/S0092-8674(00)81359-8]

-
Tao Y and Zhang Y. (2013). Rapid screening and identification of glucosidase inhibitors from mulberry leaves using enzyme immobilized magnetic beads coupled with HPLC/MS and NMR. Biomed Chromatography. 27:148e155.
[https://doi.org/10.1002/bmc.2761]

-
Torgerson JS, Hauptman J, Boldrin MN and Sjostrom L. (2004). XENical in the prevention of diabetes in obese subjects(XENDOS) study: A randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care. 27:155-161.
[https://doi.org/10.2337/diacare.27.1.155]

-
Tsuda M, Shigemoto-Mogami Y, Koizumi S, Mizokoshi A, Kohsaka S, Salter MW and Inoue K. (2004). P2X4 receptors induced in spinal microglia gate tactile allodynia after nerve injury. Nature. 424:778-783.
[https://doi.org/10.1038/nature01786]

-
Van der Wier B, Koek GH, Bast A and Haenen GRMM. (2015). The potential of flavonoids in the treatment of non-alcoholic fatty liver disease. Critical Reviews in Food Science and Nutrition. 57:834-855.
[https://doi.org/10.1080/10408398.2014.952399]

-
Wongs-Aree C, Giusti M and Schwartz S. (2006). Anthocyanins derived only from delphinidin in the blue petals of Clitoria ternatea. In Proceedings of the IV International Conference on Managing Quality in Chains-The Integrated View on Fruits and Vegetables Quality, Bangkok, Thailand. 30:437-442.
[https://doi.org/10.17660/ActaHortic.2006.712.51]

-
Wu Z, Rosen ED, Brun R, Hauser S, Adelmant G, Troy AE, McKeon C, Darlington GJ and Spiegelman BM. (1999). Cross-regulation of C/EBPα and PPARγ controls the transcriptional pathway of adipogenesis and insulin sensitivity. Molecular Cell. 3:151-158.
[https://doi.org/10.1016/S1097-2765(00)80306-8]

-
You Y, Yuan X, Lee HJ, Huang W, Jin W and Zhan J. (2015). Mulberry and mulberry wine extract increase the number of mitochondria during brown adipogenesis. Food and Function. 6:401-408.
[https://doi.org/10.1039/C4FO00719K]
