옻나무의 추출조건에 따른 페놀성 성분 함량 변화
 ; Yu Jin Hwang2, #
; Yu Jin Hwang2, # ; Beom Kyun An3
; Beom Kyun An3 ; Do Hyeong Kim4
; Do Hyeong Kim4 ; Jong Deuk Ahn5
; Jong Deuk Ahn5 ; Byung Wook Yang6, † ; Sung Kwon Ko7, ‡
; Byung Wook Yang6, † ; Sung Kwon Ko7, ‡
#Young Woo Chi and Yu Jin Hwang are contributed equally to this paper.
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In order to develop a method for enhancing the levels of constituents in Rhus verniciflua Stokes extracts, we assessed the effect of ultrasonic thermal fusion treatment and thermal water extraction on the stem of R. verniciflua over different lengths of time.
The phenolic constituents of R. verniciflua stem extracts were analyzed using high-performance liquid chromatogrpahy method. Total phenolic contents were found to be, highest in extracts obtained using ultrasonic thermal fusion treatment for 8 h (URV-8, 12.279%), and thermal water extraction for 4 h (WRV-4, 5.645%). Notably, the total phenolic content of the URV-8 extract was shown to be 2.32 times higher than that of an extract obtained using thermal water extraction for 8 h (WRV-8, 5.295%). Moreover, we found that whereas an extract obtained using ultrasolic thermal fusion for 1 h (URV-1) contained 0.156% urushiol, an allergy-inducing component, no trace of urushiol could be detected after extraction for 2 h.
Compared with thermal water extraction, ultrasonic thermal fusion treatment is a more effect method for obtaining plant extracts with high concetrations of phenolic constituetns.
Keywords:
Rhus verniciflua Stokes, Fustin, Thermal Water Extraction, Quercitrin, Ultrasonic Thermal Fusion, Urushiol서 언
옻나무 (Rhus verniciflua Stokes)는 옻나무과 (Anacardiaceae)에 속하는 낙엽 활엽 교목으로서 자웅이주 (雌雄異株)로 알려져 있다. 원산지로는 중앙아시아 고원 지대 및 히말라야 지방으로 알려져 있으며, 현재는 열대지방을 중심으로 한 아열대 지방과 온대 지방에 널리 분포하며 낙엽 또는 상록성으로 대부분이 교목 또는 관목성이나 일부는 덩굴성으로 자라는 것으로 알려져 있다 (Yook, 1981). 옻나무에 대한 기록으로는 중국에서 약 4,000 년 전부터 재배한 것으로 기록되어 있으며 우리나라에는 약 2,000 년 전인 낙랑고분과 광주 신창동 발굴지에서 칠기가 발굴되어 선사시대부터 우리나라 전역에서 목기에 옻칠을 하여 사용한 것으로 추측되고 있다. 우리나라에서 자라고 있는 옻나무는 중국에서 도입된 것으로 함경북도 지방을 제외한 전 지역에 고르게 분포하고 있다 (Ahn, 2020).
국내에서 자생하고 있는 Rhus속에 속하는 식물은 옻나무 (Rhus verniciflua Stokes), 개옻나무 (Rhus trichocarpa Miq.), 붉나무 (Rhus javanica L.), 덩굴 옻나무 (Rhus ambigua Lav.), 검양 옻나무 (Rhus succedanea L.), 산검양 옻나무 (Rhus sylvestris Sieb .et Zuc.) 등 6 종이 있다 (Yook, 1996). 우리나라와 중국, 일본의 옻액 또는 생칠에는 우루시올 (59.5%), 고무질 (7.1%), 질소화합물 (2.6%), 물 (30.8%)로 구성되어 있다. 수분을 적당히 제거한 칠 액에는 우루시올 (84.45%), 고무질 (8.90%), 질소화합물 (3.50%) 및 물 (3.20%)이며 옻의 주 효능 성분은 옻산으로 알려져 있으며, 우리나라는 원주산 옻에 약효가 많은 옻산 (urushiol) 성분이 다량 함유 되어 있어서 세계에서도 우수하다고 알려져 있다 (Yook, 1989). 옻나무의 식품 사용 기준은 식품 공전 식품일반에 대한 공통기준 및 규격에 옻나무는 우루시올 (urushiol) 성분을 제거한 옻나무 물 추출물 형태로 옻닭 또는 옻오리 조리용으로만 사용할 수 있다.
옻나무의 한방 효능으로는 살충 (殺蟲), 파혈거어통경 (破血祛瘀通經), 어혈 (瘀血), 징하 ( ), 충적복통 (蟲積腹痛)의 효능 이 있으며 (Kang et al., 2018), 생리활성에 관한 연구로는 옻나무 추출물이 MUC4 (mucin4)와 FAK (focal adhesion kinase)의 발현을 억제하여 췌장암 세포의 침습과 전이를 억제하고 (Kang et al., 2018), 염증반응을 억제 하며 (Kim et al., 2018), 면역반응을 조절하는 효과를 나타낸다 (Jiang et al., 2018).
옻나무의 성분은 우루시올 (urushiol)과 플라보노이드 (flavonoid) 계통과 페놀 (phenol) 화합물 계통인 갈산 (gallic acid) 등이 밝혀져 있다 (Kim et al., 2019b). 옻나무의 수피에는 urushiol, fisetin, fustin, sulfuretin, afzelin 등 다양한 유효성분이 함유되어 있으며 (Park et al., 2007), 목질부에는 fisetin, fustin이 주성분으로 확인되고 있으며 (Im et al., 2016), 옻나무의 2차 대사산물의 각 부위별 분포는 수피 부분에는 urushiol과 flavonoids 성분들이 추출물에 함께 존재하며, 목질부에는 전통적인 칠액 채취법에서는 발견되지 않았던 flavonoids 성분들이 주성분으로 존재한다고 알려져 있다.
옻나무의 주요 플라보노이드는 fustin, fisetin, quercitrin, sulfuretin, afzelin 등이며, fustin은 뛰어난 항산화 작용을 나타내고 (Van Acker et al., 1998), H2O2에 야기된 세포 독성에 대하여 대식세포를 보호한다 (Jung et al., 2006). 그리고, 유도성 nitric oxide synthase (NOS)와 cyclooxygenase 2 (COX-2)를 저해한다 (Moon et al., 2015). 또한, fustin의 반복투여는 마우스에서의 베타아밀로이드로 유도되는 학습장애 해마조직의 지질과산화와 단백질의 카르보닐화의 증가를 유의하게 억제하였다 (Kwon et al., 2015).
Quercitrin은 파골세포 활성화 억제작용 (Córdoba et al., 2018), 항산화 작용 (Li et al., 2016)을 나타내었다. 또한, afzelin은 간장기능 개선작용 (Lee et al., 2017), 전립선 항암작용 (Zhu et al., 2015), 각질 세포 항염증작용 (Kim et al., 2019a), 천식 개선작용 (Zhou and Nie, 2015)을 나타내었으며, sulfuretin은 항백혈병 작용 (Park et al., 2000), 항염증작용 (Lee et al., 2012)을 나타내었다.
국내 옻나무 재배 본수는 거의 1,000 만 그루 이상에 육박하고 있으며, 일제 강점기 칠액의 생산을 위하여 심은 야산의 옻나무까지 합한다면 10년생 이상만을 기준으로 할 때 1,000 만 그루 이상이라고 볼 수 있다. 옻나무는 지금까지는 칠액의 생산, 옻닭용 등이 주된 용도였으나, 옻나무를 이용한 건강기능식품을 개발하기 위해서는 기능성 성분 고농도 함유 조성물의 개발이 필요하며, 이와 같은 연구 필요성의 일환으로 옻나무 줄기의 초음파 열 융합 처리와 물 추출의 페놀성 성분의 함량을 비교 검토하고자 하였다.
재료 및 방법
1. 실험재료
실험에 사용한 옻나무 (Rhus verniciflua Stokes)는 한국 충북 제천에서 재배한 10년생 옻나무를 2019년 3월 20일에 옻나무 줄기를 자연 건조하여 제천시 금성면 활산리에서 분쇄하였으며, 옻나무 분말 (Rhus verniciflua powder)의 제품을 표본으로 사용하였다 (Fig. 1 and Fig. 2).
2. 물 추출 엑스 조제
옻나무 줄기 분말 500 g에 증류수 15ℓ를 원적외선 추출기에 넣고, 100℃에서 1 시간 (WRV-1), 2 시간 (WRV-2), 4 시간 (WRV-4), 8 시간 (WRV-8), 12 시간 (WRV-12), 16 시간 (WRV-16), 20 시간 (WRV-20), 24 시간 (WRV-24), 36 시간 (WRV-36), 48 시간 (WRV-48) 처리하고 얻은 시료를 동결건조하여 물 추출 옻나무 엑스를 얻었다.
3. 초음파 열 융합 처리 엑스 조제
옻나무 줄기 분말 500 g에 15ℓ의 증류수를 초음파 처리기 (출력 1,200 W, 주파수 28 ㎑, KODO, Hwaseong, Korea)에 넣고, 100℃에서 1 시간 (URV-1), 2 시간 (URV-2), 4 시간 (URV-4), 8 시간 (URV-8), 12 시간 (URV-12), 16 시간 (URV-16), 20 시간 (URV-20), 24 시간 (URV-24), 36 시간 (URV-36), 48 시간 (URV-48)을 처리하고 얻은 시료를 동결건조하여 초음파 열융합 처리 엑스를 얻었다.
4. HPLC 페놀성 성분 분석
Jang 등 (2018)의 방법에 따라 표준품과 직접 비교하여 성분의 함량 및 조성을 각 시료 당 3 회 반복 실험하여 결과의 재현성을 확인하여 분석한다. 표준품은 Chromadex (Los Angeles, CA, USA)와 Chemfaces (Wuhan, Hubei, China)로부터 구입한 fustin, quercitrin, afzelin, sulfuretin, urushiol을 사용하였다. 사용한 HPLC 장치는 Waters 1525 binary HPLC system (Waters Co., Milford, MA, USA)이며, 칼럼은 KNAUER Eurospher Ⅱ 100-5 C18 (Knauer, 3 ㎜ × 250 ㎜, Berlin, Germany)을 사용하였다.
이동상 용매는 acetonitrile (0.1% trifluoroacetic acid, HPLC grade, Sigma-Aldrich Co., St. Louis, MO, USA)과 HPLC용 증류수 (0.1% trifluoroacetic acid, Benedikt and Jager Inc., Clayton, NC, USA)이며, 이동상 조건은 acetonitrile의 비율을 0% (0 min)에서 5% (5 min), 95% (30 min), 100% (35 min), 그리고 마지막으로 다시 0%로 조절하였고, 전개온도는 실온, 유속은 분당 0.9 ㎖, 크로마토그램은 UV-Vis Detector Waters 2487 Dual λ Absorbance Detector (Waters, Milford, MA, USA)를 이용하여 220 ㎚에서 검출하였다 (Fig. 3).
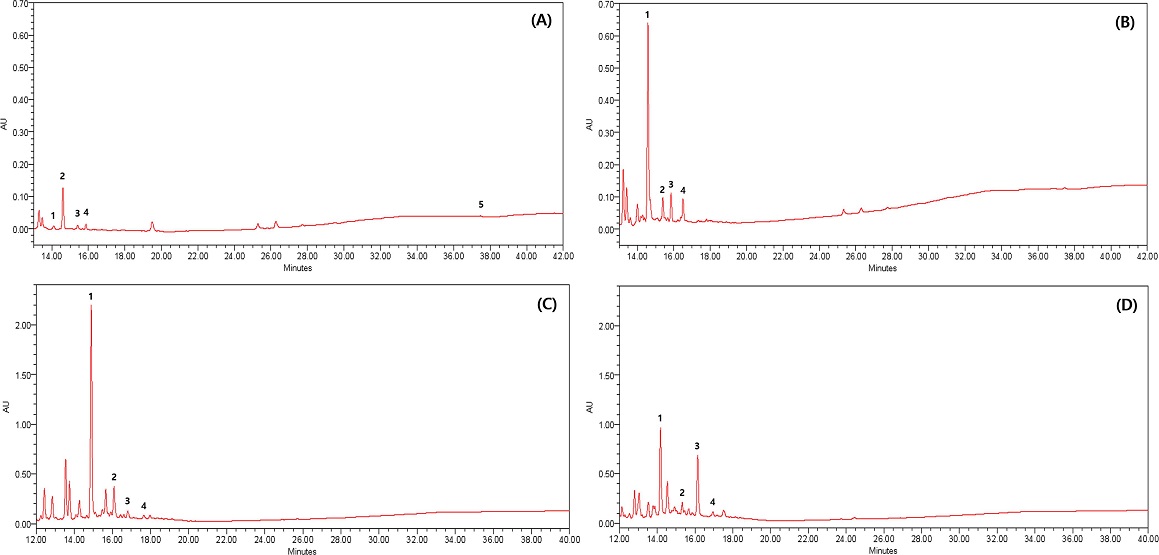
HPLC chromatograms of R. verniciflua stem extract according to ultrasonic thermal fusion treatment and thermal water extraction. URV-1 (A); R. verniciflua stem extract treated with ultrasonic thermal fusion for 1 hr, URV-8 (B); R. verniciflua stem extract treated with ultrasonic thermal fusion for 8 hr, WRV-2 (C); 1 hr thermal water extract of R. verniciflua stem, WRV-4 (D); 4 hr thermal water extract of R. verniciflua stem. The peak marked are 1; fustin, 2; quercitrin, 3; afzelin, 4; sulfretin, 5; urushiol).
5. 통계처리
3 회 반복 실험을 통해 얻은 결과는 평균과 표준오차로 나타내었으며, 통계분석은 SPSS Statistics ver. 22.0 (IBM Inc., Armonk, NY, USA) software를 이용한 일원배치분산분석 (One-way ANOVA)을 실시하여 Duncan’s Multiple Range Test (DMRT)에 의해 유의수준 5% 로 시료간의 유의적 차이를 검정하였다 (p < 0.05).
결과 및 고찰
옻나무 줄기 (Rhus verniciflua Stokes)를 이용한 기능성 성분 강화 조성물을 개발하기 위하여 옻나무 줄기에 초음파 열융합 처리와 물 추출을 시간대별로 실시하여 결과를 HPLC법으로 비교 검토하여 Table 1, 2에서 fustin, quercitrin, afzelin, sulfuretin, urushiol 의 성분 함량을 시간별 1, 2, 4, 8, 12, 16, 20, 24, 36, 48 시간 비교 분석하여 페놀성 성분 고농도 최적 조건을 확인하고자 하였다.

The components of Rhus verniciflua stem extract according to ultrasonic thermal fusion treatment conditions. (%, w/w)

The phenolic components of Rhus verniciflua stem extract according to thermal water extraction conditions. (%, w/w)
총 페놀성 성분 함량에 있어서는 Table 1에서 보는 바와 같이 초음파 열융합 8 시간 처리 엑스 (URV-8)에서 12.279%로 가장 높은 함량을 나타내었고, 12 시간 처리 엑스 (URV-12, 9.393%), 4 시간 처리 엑스 (URV-4, 8.157%)의 순서로 높은 함량을 나타내었다. 또한, 물 추출에서는 Table 2에서 보는 바와 같이 4 시간 처리 엑스 (WRV-4)에서 5.645%로 가장 높은 함량을 나타내었으며, 12 시간 처리 엑스 (WRV-12, 5.521%), 16 시간 처리 엑스 (WRV-16, 5.474%)의 순서로 높은 함량을 나타내었다. 가장 높은 총 페놀성 성분 함량을 나타낸 초음파 열융합 8 시간 처리 엑스 (URV-8, 12.279%)는 물 추출 8 시간 (WRV-8, 5.295%) 엑스에 비해서 2.32배 높은 함량을 나타내었다.
항산화 작용 (Van Acker et al., 1998), 학습장애 억제작용 (Kwon et al., 2015)을 나타내는 fustin은 초음파 열융합 8 시간 처리 엑스 (URV-8)에서 6.044%로 가장 높은 함량을 나타내었고, 4 시간 처리 엑스 (URV-4, 4.577%), 12 시간 처리 엑스 (URV-12, 3.859%)의 순서로 높은 함량을 나타내었다. 또한, 물 추출에서는 2 시간 처리 엑스 (WRV-2)에서 3.332%로 가장 높은 함량을 나타내었으며, 1 시간 처리 엑스 (WRV-1, 2.920%), 4 시간 처리 엑스 (WRV-4, 2.910%)의 순서로 높은 함량을 나타내었다.
이는 Park 등 (2015) 의 추출조건에 따른 옻나무 부위별 페놀화합물 함량 분석 결과에서 온도별 물추출물의 fustin의 함량은 25℃를 시작으로 추출 온도 100℃에서 최대 함량을 보였으나 160℃에서 최소 함량을 나타낸 것과 본 실험 결과가 같은 경향을 나타낸 것으로 열 추출을 진행하면서 배당체의 일부가 열 가수분해에 의한 성분 변화로 인해 성분 함량의 변화가 일어난 것으로 생각된다.
파골세포 활성화 억제작용 (Córdoba et al., 2018), 항산화 작용 (Li et al., 2016)을 나타내는 quercitrin은 초음파 열융합 8 시간 처리 엑스 (URV-8)에서 1.750%로 가장 높은 함량을 나타내었고, 12 시간 처리 엑스 (URV-12, 1.145%), 4 시간 처리 엑스 (URV-4, 0.975%)의 순서로 높은 함량을 나타내었다. 또한, 물 추출에서는 2 시간 처리 엑스 (WRV-2)에서 1.058%로 가장 높은 함량을 나타내었으며, 4 시간 처리 엑스 (WRV-4, 0.892%), 1 시간 처리 엑스 (WRV-1, 0.807%)의 순서로 높은 함량을 나타내었다.
간장기능 개선작용 (Lee et al., 2017), 전립선 항암작용 (Zhu et al., 2015), 각질 세포 항염증작용 (Kim et al., 2019b), 천식 개선작용 (Zhou and Nie, 2015)이 보고된 afzelin은 초음파 열융합 8 시간 처리 엑스 (URV-8)에서 3.340%로 가장 높은 함량을 나타내었고, 12 시간 처리 엑스 (URV-12, 2.828%), 4 시간 처리 엑스 (URV-4, 2.071%)의 순서로 높은 함량을 나타내었다. 또한, 물 추출에서는 24 시간 처리 엑스 (WRV-24)에서 3.374%로 가장 높은 함량을 나타내었으며, 16 시간 처리 엑스 (WRV-16, 2.858%), 36 시간 처리 엑스 (WRV-36, 2.738%)의 순서로 높은 함량을 나타내었다.
이와 같은 결과로부터 생리활성 플라보노이드 성분인 fustin, quercitrin, afzelin은 초음파 열융합 8 시간 처리 엑스 (URV-8)에서 6.044%, 1.750%, 3.340%로 가장 높은 함량을 나타내었다. 그리고, 물 추출에서는 2 시간 추출 엑스 (URV-2)에서 fustin, quercitrin이 3.332%, 1.058%로 가장 높은 함량을 나타내었다. 따라서, 초음파 열융합 처리가 물 추출보다 페놀성 성분 고농도 함유 조성물 제조에 효율적 방법이라는 것을 확인할 수 있었다. 한편, 알러지 유발 성분인 urushiol은 초음파 열융합 1 시간 처리 엑스 (URV-1)에서 0.156%를 함유하였으나, 2 시간 처리 이후부터는 함유되지 않음을 확인 하였다.
Acknowledgments
본 연구는 농림식품기술기획평가원 맞춤형혁신식품 및 천연 안심소재 기술개발사업(과제번호: 119023-3)의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
- Ahn JD. (2020). Comparison of phenolic components of Rhus verniciflua and removal method of urushiol. Ph. D. Thesis. Semyung University. Jecheon, Korea. p.1-6.
-
Córdoba A, Manzanaro-Moreno N, Colom C, Rønold HJ, Lyngstadaas SP, Monjo M and Ramis JM. (2018). Quercitrin nanocoated implant surfaces reduce osteoclast activity in vitro and in vivo. International Journal of Molecular Sciences. 19:3319. https://www.mdpi.com/1422-0067/19/11/3319, (cited by 2020 April 24).
[https://doi.org/10.3390/ijms19113319]

-
Im WK, Park HJ, Lee KS, Lee JH, Kim YD, Kim KH, Park SJ, Hong SM and Jeon SH. (2016). Fisetin-rich extracts of Rhus verniciflua Stokes improve blood flow rates in mice fed both normal and high-fat diets. Journal of Medicinal Food. 19:120-126.
[https://doi.org/10.1089/jmf.2015.3515]

-
Jang JY, Shin HJ, Lim JW, Ahn JH, Jo YH, Lee KY, Hwang BY, Jung SJ, Kang SY and Lee MK. (2018). Comparison of antibacterial activity and phenolic constituents of bark, lignum, leaves and fruit of Rhus verniciflua. PLOS ONE. 13:e0200257. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0200257, (cited by 2020 March 8).
[https://doi.org/10.1371/journal.pone.0200257]

-
Jiang PD and Sun HI. (2018). Sulfuretin alleviates atopic dermatitis-like symptoms in mice via suppressing Th2 cell activity. Immunologic Research. 66:611-619.
[https://doi.org/10.1007/s12026-018-9025-4]

-
Jung CH, Jun CY, Lee SD, Park CH, Cho KH and Ko SG. (2006). Rhus verniciflua stokes extract: Radical scavenging activities and protective effects on H2O2-induced cytotoxicity in macrophage RAW264.7 cell lines. Biological and Pharmaceutical Bulletin. 29:1603-1607.
[https://doi.org/10.1248/bpb.29.1603]

-
Kang YR, Yoon SW and Park BD. (2018). Allergen-removed Rhus verniciflua Stokes suppresses invasion and migration of pancreatic cancer cells through downregulation of the JAK/STAT and Src/FAK signaling pathways. Oncology Reports. 40:3060-3068.
[https://doi.org/10.3892/or.2018.6699]

-
Kim BG, Song YJ, Lee MG, Ku JM, Jin SJ, Hong JW, Lee SG and Kang H. (2018). Macrophages from mice administered Rhus verniciflua Stokes extract show selective anti-inflammatory activity. Nutrients. 10:1926. https://www.mdpi.com/2072-6643/10/12/1926, (cited by 2020 March 8).
[https://doi.org/10.3390/nu10121926]

-
Kim JH, Kim MJ, Kim JM, Lee MK, Seo SJ and Park KY. (2019a). Afzelin suppresses proinflammatory responses in particulate matter-exposed human keratinocytes. International Journal of Molecular Medicine. 43:2516-2522.
[https://doi.org/10.3892/ijmm.2019.4162]

-
Kim MS, Lee CW, Kim JH, Lee JC and An WG. (2019b). Extract of Rhus verniciflua Stokes induces p53-mediated apoptosis in MCF-7 breast cancer cells. Evidence-Based Complementary and Alternative Medicine. 2019:9407340. https://www.hindawi.com/journals/ecam/2019/9407340/, (cited by 2020 April 16).
[https://doi.org/10.1155/2019/9407340]

-
Kwon SH, Ma SX, Hwang JY, Lee SY and Jang CG. (2015). Involvement of the Nrf2/HO-1 signaling pathway in sulfuretin-induced protection against amyloid beta25-35 neurotoxicity. Neuroscience. 304:14-28.
[https://doi.org/10.1016/j.neuroscience.2015.07.030]

-
Lee KW, Chung KS, Seo JH, Yim SV, Park HJ, Choi JH and Lee KT. (2012). Sulfuretin from heartwood of Rhus verniciflua triggers apoptosis through activation of Fas, Caspase-8, and the mitochondrial death pathway in HL-60 human leukemia cells. Journal of Cellular Biochemistry. 113:2835-2844.
[https://doi.org/10.1002/jcb.24158]

-
Lee SB, Kang JW, Kim SJ, Ahn JM, Kim JW and Lee SM. (2017). Afzelin ameliorates D-galactosamine and lipopolysaccharide-induced fulminant hepatic failure by modulating mitochondrial quality control and dynamics. British Journal of Pharmacology. 174:195-209.
[https://doi.org/10.1111/bph.13669]

-
Li X, Jiang Q, Wang T, Liu J and Chen D. (2016). Comparison of the antioxidant effects of quercitrin and isoquercitrin: Understanding the role of the 6''-OH group. Molecules. 21:1246. https://www.mdpi.com/1420-3049/21/9/1246, (cited by 2020 April 3).
[https://doi.org/10.3390/molecules21091246]

-
Moon JE, Shin JH, Kwon OR and Kim JY. (2015). A standardized extract of Rhus verniciflua Stokes protects wistar rats against lipopolysaccharide-induced acute inflammation. Journal of Medicinal Food. 18:1223-1230.
[https://doi.org/10.1089/jmf.2014.3411]

-
Park BC, Lee YS, Park HJ, Kwak MK, Yoo BK, Kim JY and Kim JA. (2007). Protective effects of fustin, a flavonoid from Rhus verniciflua Stokes, on 6-hydroxydopamine-induced neuronal cell death. Experimental and Molecular Medicine. 39:316-326.
[https://doi.org/10.1038/emm.2007.35]

- Park HJ, Kwon SH, Kim GT, Lee KT, Choi JH, Choi JW and Park KY. (2000). Physicochemical and biological characteristics of flavonoids isolated from the heartwoods of Rhus verniciflua. Korean Journal of Pharmacognosy. 31:345-350.
-
Park HJ, Lee SH, Jang GY, Li M, Kim MY, Kim ST, Lee JH, Yoon GM, Lee JS and Jeong HS. (2015). Phenolic contents of different parts of Rhus verniciflua Stokes according to extraction conditions. Journal of the Korean Society of Food Science and Nutrition. 44:97-103.
[https://doi.org/10.3746/jkfn.2015.44.1.097]

-
Van Acker SABE, Van Balen GP, Van den Berg DJ, Bast A and Van der Vijgh W JF. (1998). Influence of iron chelation on the antioxidant activity of flavonoids. Biochemical Pharmacology. 56:935-943.
[https://doi.org/10.1016/S0006-2952(98)00102-6]

- Yook CS. (1981). Korea pharmaceutical plant encyclopedia. Jinmyung Press. Seoul, Korea. p.238-239.
- Yook CS. (1989). Colored medicinal plants of Korea. Academy Books. Seoul, Korea. p.328-329.
- Yook CS. (1996). Asian herbal medicine encyclopedia. Kyungwon Press. Seoul, Korea. p.317-318.
-
Zhou W and Nie X. (2015). Afzelin attenuates asthma phenotypes by downregulation of GATA3 in a murine model of asthma. Molecular Medicine Reports. 12:71-76.
[https://doi.org/10.3892/mmr.2015.3391]

-
Zhu K, Sun J, Shen J, Jin J, Liu F, Xu X, Chen L, Liu L and Lv J. (2015). Afzelin exhibits anti-cancer activity against androgen-sensitive LNCaP and androgen-independent PC-3 prostate cancer cells through the inhibition of LIM domain kinase 1. Oncology Letters. 10:2359-2365.
[https://doi.org/10.3892/ol.2015.3619]