
더덕의 생육 시기에 따른 주요 성분 변화
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The roots of Codonopsis lanceolata are widely used in natural traditional medicine, and cane be eaten either raw or cooked. This study was conducted to investigate changes in the content of the main components of C. lanceolata roots during different stages of growth.
To determine the changes in the main components of C. lanceolata at different growth stages, we analyzed the composition of six component types (saponins, amino acids, inorganic matter, free sugars, fatty acids, and organic acids) in C. lanceolata roots during three growth periods [dormancy (winter), high growth (spring) and later growth (autumn)]. We accordingly found that the contents of all six assessed component types tended to be high in January during the peroid of dormancy.
Our finding that the contents of the main constituents in C. lanceolata roots are high in January during dormancy are consistent with the general practice of harvesting roots during the authmn to winter peroid prior to the period of high growth in spring.
Keywords:
Codonopsis lanceolata (Siebold & Zuccarini) Benth. & Hook.f. ex Trautvetter, Content, Growth Period, Main Components, Saponin서 언
더덕 (Codonopsis lanceolata (Siebold & Zuccarini) Benth. & Hook.f. ex Trautvetter)은 다년생 초본의 덩굴성 식물로 초롱꽃과에 속하며 한국, 중국, 일본 등 동아시아 지역에서 주로 재배되고 있다. 더덕은 주로 뿌리를 약용으로 사용하며 식용으로도 많이 이용되고 있다.
예로부터 더덕은 진해, 거담, 두통완화에 효과가 있고 혈중 지질 개선, 비만예방, 고형암 억제 등 효과가 있으며 (Kim and Chung, 1975; Kim et al., 2009; Park et al., 2012; Choi et al., 2013), 최근에는 간 보호 작용 (Kim et al., 2008), 항산화 증진 (Song et al., 2012, Yoon et al., 2016), 남성호르몬 결핍 개선 (Ushijima et al., 2007) 등 다양한 약리작용이 입증되면서 기능성 식품 원료로 이용성이 주목받고 있다. 이에 따라 더덕의 재배면적은 2013년 1,751 ㏊에서 2019년 2,195 ㏊으로 증가하였고, 생산량은 2013년 7,340 톤에서 2019년 11,363 톤으로 증가하여 인삼을 제외한 약용작물 중 가장 많이 재배되고 있다 (KOSIS, 2019).
더덕은 사포닌을 포함하여 0.07 ㎎/100㎎ - 2.76 ㎎/100㎎의 아미노산 (Meang and Park, 1990), 2.22 ㎎/100g의 조단백질, 24.92 ㎎/100g의 당류, 112.97 ㎎/100g의 칼슘, 4.82 ㎎/100g의 조섬유 (Kim, 1985), 기타 섬유질, 비타민 등의 성분을 함유하고 있는 것으로 알려져 있다. 더덕의 사포닌은 triterpenoid saponin으로 eclalbasaponin, codonolasides, lancemasides 등 22 종의 사포닌 성분이 존재하는 것으로 알려져 있다 (He et al., 2015). 이 중 lancemaside A, lancemaside C, lancemaside E, lancemaside G, foetidissimoside A, aster sponin Hb 등이 주요한 사포닌이라 보고되고 있고, 한국산 더덕에서 lancemasides의 함량이 일본, 중국보다 3 배 - 4 배 더 높다고 알려져 있다 (Ichikawa et al., 2009).
특히 더덕의 주요 사포닌 lancemaside A는 남성 갱년기 장애개선, 기억력 및 불면증 개선, 대장염 완화, 피부염증 개선 (Ushijima et al., 2007; Joh et al., 2010; Jung et al., 2012; Joh et al., 2014)에 효과가 있는 것으로 알려지고 있으나 더덕에서 추출되는 사포닌의 함량이 소량이라서 산업화에 큰 걸림돌로 작용하고 있기 때문에 생육 시기별 사포닌을 포함한 약리성분 함량에 대한 연구가 필요하다.
인삼의 경우 주 사포닌인 ginsenoside의 함량은 개화기인 5월이 가장 높고 개체 당 조사포닌의 함량은 10월이 가장 높은 것으로 알려져 있고 (An et al., 2002), 도라지는 3월과 12월에 수확했을 때 조사포닌의 함량이 가장 높은 것으로 보고되고 있다 (Lee et al., 1999). 이와 같이 생육 시기에 따라 약리성분이 많이 함유된 시기와 수확시기가 일치하지 않을 수 있기 때문에 더덕의 생육 시기에 따라 사포닌을 포함한 약리성분 함량을 규명하는 것이 필요하다. 따라서 본 연구는 더덕의 생육 시기에 따라 사포닌을 포함한 더덕의 주요한 성분 변화를 분석하고자 수행하였다.
재료 및 방법
1. 실험재료
본 실험에 사용된 공시재료는 거창 더덕 농가에서 재배하는 2년생 더덕 (Codonopsis lanceolata (Siebold & Zuccarini) Benth. & Hook.f. ex Trautvetter) 뿌리를 1, 3, 5, 7, 9, 11월에 수확하여 사용하였고, 지상부의 경우 1, 5, 7, 9, 11월에 잎과 줄기를 함께 수확하여 500 g을 3 반복으로 사포닌 함량 분석에만 이용하였다. 시료는 수세하여 세절한 뒤 건조기 60℃에서 3 일 동안 건조시켜 분쇄한 후 분석 시료로 이용하였다.
더덕의 생육 시기 중 사포닌의 경우 지상부 (잎, 줄기)와 지하부 (뿌리)를 모두 분석하였고, 나머지 아미노산, 무기물, 유리당, 유기산, 지방산 분석은 뿌리 부분만을 이용하여 생육 시기에 따라 겨울철 (1월), 생육 성기인 봄 (5월), 가을철 (9월)로 나누어 분석하였다. 아미노산, 무기물, 유리당 분석은 더덕 뿌리 10 개를 1 반복으로 3 반복으로 조사하였고, 유기산, 지방산은 더덕 뿌리 20 개를 혼합하여 1 반복으로 조사하였다.
2. 더덕의 생육특성 조사 및 추출 방법
더덕 뿌리의 생육에 따른 특성 조사는 각 시기별로 뿌리 5개를 1 반복으로 하여 3 반복으로 조사하였고, 조사항목으로는 근장, 근경, 생근중, 건근중 등 4 가지를 조사하였다.
추출 방법은 생육 시기별로 건조·분쇄한 더덕 분말을 증류수로 10 배 희석하여 열수 추출 방법으로 autoclave (JSAC-40, JSR, Gongju, Korea)를 이용하여 100℃에서 20 분간 15 psi의 압력을 주어 추출한 뒤 여과 후 회전식 감압농축기 (N-1300VW, Sunillap, Busan, Korea)를 이용하여 농축하였다. 농축된 더덕 추출물을 초저온 냉동고 (deep-freezer)에 보관 후 동결건조기 (FD8508, Ilshin Biobase, Dongducheon, Korea)로 3 일간 동결건조 하여 분석 시료로 이용하였다.
3. 성분분석
더덕의 지상부 (잎, 줄기)와 지하부 (뿌리)는 동결건조 시료를 이용하여 HPLC grade water로 시료 무게의 100 배 희석하여 LC-MSMS (Qtrap, AB Sciex Co, Foster City, CA, USA)를 이용하여 사포닌 분석을 실시하였다.
Column은 YMC-Pack Pro C18 RS column (150 ㎜ × 2.0 ㎜ × I.D., 5㎛, YMC Korea Co., Ltd., Seongnam, Korea)을 사용하였고 column의 온도는 40℃로 설정하였다. 이동상은 H2O (0.1% formic acid) : acetonitrile (Daejung Chemicals and Metals Co., Ltd., Siheung, Korea)를 70 : 30 (v/v) 혼합하여 이용하였고, 유속을 0.2 ㎖/min, injection volume은 20 ㎕씩 주입하여 분석하였다.
Mass spectrometer은 negative ion과 selected ion monitoring (SIM) 하에서 분석하였다. Electrospray ionization (ESI)는 4.5 ㎸ spray voltage, capillary voltage는 -40 V, tube lens offset은 -130 V, capillary temperature은 350℃, sheath gas와 auxiliary gas로 사용된 nitrogen는 각각 35, 5 arbitrary units로 하였다. Lancemaside A는 m/z 1,189, lancemaside B는 m/z 1,351, lancemaside G는 m/z 1,205, aster saponin Hb는 m/z 925로 분석하였다. 표준물질로는 ginsenoside Rg1 (Ambo Institute, Daejeon, Korea)을 이용하여 최종 농도를 2, 4, 8 ppm 농도로 희석하여 정량 분석에 이용하였다.
더덕 뿌리의 건조 분말 시료에 70% EtOH로 5 배 혼합하고, 초음파 추출을 한 뒤 3,000 rpm으로 20 분간 원심분리를 한 다음 상등액 1 ㎖을 채취하였다. 상등액 1 ㎖은 동결건조기를 이용하여 감압상태에서 완전히 건조한 후 pH 2.2 lithium citrate loading buffer 1 ㎖을 이용하여 재용해 한 후 syringe filter 0.2 ㎛로 여과하여 amino acid analyzer (Biochrom 30+ series, Biochrom Ltd., Cambridge, U.K)로 분석하였다.
아미노산 분석은 column으로 lithium column (lithium high performance column, 4.6 ㎜ × 200 ㎜), buffer solution은 lithium buffer (pH 2.80, 3.00, 3.15, 3.50, 3.55)을 사용하였고 flow rate는 buffer 31 ㎖/hr, ninhydrin 20 ㎖/h, wave length는 570 ㎚, column 온도는 32℃ - 80℃까지 변온 하에서 측정하였고, injection volume은 40 ㎕ 씩 주입하여 분석하였다. 내부 표준물질로는 41 종의 아미노산을 10 nmol 농도로 정량 분석에 이용하였다.
더덕 뿌리의 건조 분말 시료를 microwave digestion (Ethos easy, Milestone, Milano, Italy)을 사용하여 전처리를 실시하였다.
전처리 과정은 건조 분말 (0.1 g)을 microwave digestion vessel에 넣고 vessel에 질산 10 ㎖을 첨가한 다음 30 분간 1,200 Mw, 220℃에서 가수분해한 후 30 분간 냉각시켜 주었다. 가수분해된 더덕 시료는 동량 (10 ㎖)의 3 차 증류수로 희석한 후 ICP-OES (Optima 8300DV, PerkinElmer, Waltham, MA, USA)를 이용하여 분석하였다.
ICP-OES의 작동조건은 RF power는 1,300 watts, nebulizer gas flow (Ar)는 0.55ℓ/min, plasma gas flow (Ar)는 10.00ℓ/min, auxiliary gas flow는 0.20ℓ/min로 하였고 Ca, Mg, K, Na, P, Fe, Zn, Cu, Mn 총 9 가지 무기성분을 분석하였다. 표준물질로는 P의 경우 1, 5, 10 ppm, 나머지 무기성분은 1, 5, 10, 20 ppm 농도로 정량 분석에 이용하였다.
더덕 뿌리의 동결건조 시료를 HPLC grade water로 100 배 희석하여 HPLC (Agilent 1260 Series, Agilent Technologies Inc., Santa Clara, CA, USA)를 이용하여 분석 하였다.
Columm은 Hi-Plex pb (300 ㎜ × 7.7 ㎜, Agilent Technologies Inc., Santa Clara, CA, USA)을 사용하였고 이동상은 100% water, flow rate는 0.6 ㎖/min, columm temperature는 70℃로 조정하였고, detector는 Agilent 1260 infinity RID (35℃)를 사용하였으며, injection volume은 0.5 ㎕ 씩을 주입하여 유리당을 분석하였다. 내부 표준물질로는 4 종의 유리당을 100, 500, 1,000 ppm 농도로 정량 분석에 이용하였다.
더덕 뿌리의 동결건조 시료를 증류수로 30 배 희석한 후 120 rpm에서 4 시간 동안 추출하였다. 추출이 끝난 시료는 4,000 rpm에서 15 분간 원심 분리 후 상층액만 취해 0.45 ㎛ membrane filter로 여과하여 100 배 희석한 후 HPLC (Prominence HPLC, Shimadzu Co., Kyoto, Japan)를 이용하여 분석하였다.
HPLC 분석조건은 column으로 Two Shim-pack (SCR-102H, 300 ㎜ × 8.0 ㎜, Shimadzu Co., Kyoto, Japan)을 사용하였고 guard column은 Shim-pack guard column (SCR-102H, 50 ㎜ × 6.0 ㎜, Shimadzu Co., Kyoto, Japan)를 사용하였다. Mobile phase는 4 mM p-toluenesulfonic acid, reaction reagent (16 mM bis-tris aqueous solution containing 4 mM p-toluenesulfonic acid and 100 μM EDTA)를 이용하였고 oven temperature는 40℃, flow rate은 0.8 ㎖/min, detection은 electroconductivity, injection volume은 20 ㎕씩 주입하여 7 종의 유기산을 분석 하였다. 내부 표준물질로는 7 종의 유기산을 10, 25, 50 ppm 농도로 정량 분석에 이용하였다.
더덕 뿌리의 동결건조 분말을 이용하여 chloroform-methanol (1 : 1)로 추출·여과하여 감압 농축한 지방질 약 100 ㎎을 가지형 플라스크에 취하고 1N-KOH·ethanol (300 배) 용액 3 ㎖를 섞어 유지 방울이 없어질 때까지 교반시킨 다음 14% boron trifluoride-methanol 3 ㎖를 첨가하였다. 환류냉각기를 부착하여 5 분간 80℃에서 가열하여 methylester화 하였고, 이 용액에 NaCl 포화용액 3 ㎖, hexane 1.5 ㎖를 순서대로 첨가하여 섞은 다음 시험관에 옮겨 정치하였다. 상층을 분취하여 무수 Na2SO4를 넣어 수분을 제거하고 0.5 ㎖를 vial에 채취한 후 Gas Chromatography (GC-17A, Shimadzu Co., Kyoto, Japan)로 분석하였다.
GC분석은 column으로 SPTM-2560 capillary column (100 m length × 0.25 ㎜ I. d. × 0.25 ㎛ film thickness), detector는 flame ionization detector를 사용하였고, oven temperature는 10 분간 140℃로 유지하고 4℃/min으로 240℃까지 상승시킨 후 240℃에서 30 분간 유지 하였다. injection temperature와 detector temperature는 260℃, split ratio는 1 : 100로 설정하고, injection volume은 2 ㎕씩 주입하여 37 종의 지방산을 분석 하였다. 내부 표준물질로는 Supelco 37 component fame mix (400 ppm - 600 ppm, Sigma-aldrich, St. Louis, MO, USA)를 정량 분석에 이용하였다.
4. 통계분석
수집된 데이터는 SPSS program (SPSS version 21, SPSS Inc., Chicago, IL, USA) 프로그램을 이용하여 일원배치 분산분석 (One way ANOVA)을 실시한 후, Duncan’s Multiple Range Test (DMRT)을 통해 5% 수준에서 통계학적 유의성을 검정하였다 (p < 0.05).
결과 및 고찰
1. 더덕의 생육 시기별 주요 성분 변화
더덕 (Codonopsis lanceolata (Siebold & Zuccarini) Benth. & Hook.f. ex Trautvetter)의 생육 시기에 따른 주요 성분 변화를 조사하기 위해 1월 - 11월까지 2 개월 간격으로 더덕 뿌리를 수확하여 사포닌, 아미노산, 무기물, 유리당, 지방산, 유기산 등 6 가지 성분 분석을 실시하였고 더덕의 지상부 (잎, 줄기)는 1, 5, 7, 9, 11월에 수확하여 사포닌만 분석하였다. 생육 시기에 따른 더덕 뿌리의 생육 특성을 조사한 결과 생육 초기 보다 생육 후기로 갈수록 근장, 근경, 생근중, 건근중이 증가하는 경향을 보였다 (Table 1).
더덕 뿌리의 주요 사포닌인 lancemaside A의 함량은 1월과 3월은 유사한 경향을 보이다가 5월에 가장 많이 증가하였고 그 이후로는 점차 감소하는 경향을 나타내었다. 반면에 aster saponin Hb, lancemaside G, lancemaside B는 생육 시기별 큰 차이가 없었다 (Fig. 1). 더덕 줄기에서 lancemaside A의 함량은 5월에 급격히 상승하여 가장 높은 함량을 나타내었고, 그 후로는 급격히 감소하였다 (Fig. 2).
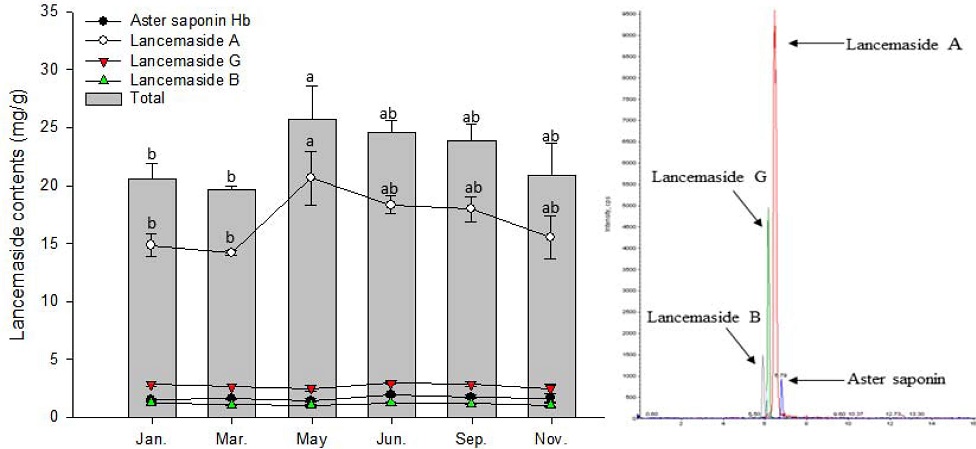
Comparison of lancemaside contents by growth period in C. lanceolata root. Vertical bars represent standard error of the means (n = 3). *Different letters are significantly different at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05). Right figure indicates LC-MS/MS chromatogram peak in C. lanceolata root.
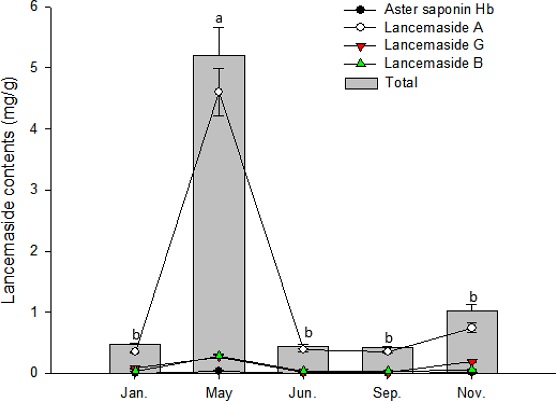
Comparison of lancemaside contents by growth period in C. lanceolata shoot. Vertical bars represent standard error of the means (n = 3). *Different letters are significantly different at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
따라서, 더덕의 지상부와 뿌리에서 모두 생육성기인 5월 (봄)이 함량이 가장 높았고, 전체 사포닌 함량은 lancemaside A에 의해 좌우되며, lancemaside A가 주요한 사포닌 중 하나임을 확인할 수 있었다 (Ichikawa et al., 2009; He et al., 2015; Um et al., 2019). 그리고 더덕 뿌리의 경우 수확시기인 11월의 lancemasides 함량은 생육성기인 5월 (봄)보다 다소 낮은 경향이었으나 5월 - 11월간의 통계적 유의성 차이는 없었다.
An 등 (2002)은 4년생 인삼의 월별 수확시기에 따른 사포닌 함량을 4월부터 10월까지 한 달 간격으로 조사한 결과 개화기인 5월이 7.60%로 조사포닌 함량이 다른 시기 (4.5% - 5.8%) 보다 월등히 높았고 ginsenoside 함량도 5월이 4.09%로 다른 시기의 1.75% - 2.52%보다 약 2 배 정도 높았다고 하였다. 본 실험에서도 5월 (봄)이 사포닌 함량이 가장 높았으나 인삼과는 다르게 개화기인 7월 - 8월에는 5월과 비교해서 통계적 유의성은 인정되지 않았지만 다소 감소하는 경향을 나타내었다.
농촌진흥청 (2017)에 의하면 더덕은 5월 - 6월에 지상부가 왕성하게 생육한다고 하였는데, 본 연구에서도 지상부의 경우 생육 성기인 5월 (봄)에 사포닌 함량이 가장 높다는 것을 확인할 수 있었고 이것은 인삼과 마찬가지로 생육이 왕성한 시기에 사포닌이 많이 생성되는 것으로 사료된다. 이 이후 생육이 진행될수록 지상부에서는 5월에 비해 사포닌 함량이 낮았고, 뿌리에서도 생육 성기인 5월 이후 lancemasides 함량이 낮아지는 경향이었지만 통계적으로 유의한 차이는 없었다.
Jang 등 (2018)은 과도한 빛 (광저해)과 Na의 축척은 인삼의 생육을 저해하고 탄수화물 및 사포닌의 축적을 방해한다고 하였고, Jeong 등 (2010)은 재배 인삼에 비해 산양삼, 산삼의 ginsenoside 함량이 높다고 하였다. 더덕에 있어서도 산 더덕 (야생 더덕)이 재배 더덕에 비해 사포닌 함량이 높다고 하여 (Lee, 1984) 광과 사포닌이 밀접한 관련이 있음을 시사하고 있으나 광과 사포닌 함량에 관한 연구는 미흡한 실정이다.
2. 더덕의 생육 시기별 아미노산 성분 변화
더덕 뿌리의 생육 시기에 따른 아미노산 성분 변화를 조사한 결과 1월 (겨울)이 가장 높았고, 5월 (봄)과 9월 (가을)로 갈수록 감소하는 경향이었다. 아미노산 구성 성분별로는 총 41 종 중 35 종이 검출되었고, 이 중 arginine의 함량 (111.3 ㎎/100g - 323.9 ㎎/100g)이 생육 시기에 관계없이 전체 아미노산 중 73% - 81% 차지할 정도로 주요한 아미노산으로 나타났다 (Table 2). 이외에 glutamic acid (2.6 ㎎/100g - 18.9 ㎎/100g), tryptophan (0.3 ㎎/100g - 14.6 ㎎/100g), ammonium chloride (2.7 ㎎/100g - 12.3 ㎎/100g), alanine (4.3 ㎎/100g - 14.7 ㎎/100g), asparagine (0.8 ㎎/100g - 13.0 ㎎/100g) 등이 검출되었으나 arginine에 비해 소량이었고, 생육 시기별로 그 함량이 다소 차이가 있으나 생육이 진전됨에 따라 감소하는 경향을 나타내었다.
Kim (1985)은 재배 더덕의 아미노산 함량은 arginine > glutamic acid > aspartic acid > leucine > lysine > valine 순으로 높다고 하였고, Meang and Park (1990)도 재배 더덕에서 arginine > glutamic acid > aspartic acid > lysine > histidine 순으로 아미노산 함량이 높다고 하였다. 이것은 본 연구와 더불어 arginine이 더덕 뿌리에서 가장 많이 함유하고 있는 아미노산 중의 하나라는 것을 확인할 수 있었다.
3. 더덕의 생육 시기별 무기물 함량 변화
더덕 뿌리의 생육 시기에 따른 무기물 함량을 분석한 결과 1월 (겨울)의 경우 K과 P이 가장 함량이 높았고, 다음이 Ca과 Mg 순으로 나타났다 (Table 3). 5월 (봄)의 경우 P > K > Ca > Mg 순이었고, 9월 (가을)의 경우 K > P > Ca > Mg 순이었다.
생육 시기별 무기물의 종류에 따른 함량은 생육 시기에 관계없이 P와 K 함량이 가장 높았고, P의 경우 생육 시기별로 차이가 없었으나 Ca는 생육이 진행될수록 감소하는 경향을 보였고 K은 1월 (겨울)에 가장 높았다가 5월 (봄)에 감소하는 경향을 보이다가 9월 (가을)에는 다시 증가하는 경향을 보였다. 전체적으로 P, K, Ca가 전체 무기물 함량의 70% 정도를 차지할 정도로 주요한 무기물이었다.
Park 등 (2009)은 발효더덕에서 무기질 함량을 분석하였을 때 K > P > Ca > Mg 순으로 함량이 높다고 하여 본 실험과 유사한 결과를 나타내었다. Lee 등 (1990)도 더덕 뿌리에서 K의 함량이 약 10,000 ppm 정도로 가장 많이 함유하고 있다고 하였으며 P, Ca, Mg의 경우 1,000 ppm – 2,000 ppm 정도로 함량이 비슷하다고 하였다. 하지만 Kim (1985)에 의하면 산 더덕의 경우 Ca의 함량 (185.91 ㎎/100g)이 P (17.72 ㎎/100g)보다 약 10 배 정도 높다고 하여 다른 결과를 보고한 바도 있다. 그러나 대부분의 연구 결과에서 무기물의 함량의 차이는 있지만 P, K, Ca, Mg가 주요한 무기물인 것을 확인할 수 있었다.
4. 더덕의 생육 시기별 유리당 함량 변화
더덕 뿌리의 생육 시기에 따른 유리당 분석 결과 생육 시기에 관계없이 fructose > sucrose > stachyose > glucose 순으로 함량이 높았으며 총 유리당 함량의 경우 1월이 가장 높았다 (Table 4).
Hwang 등 (2011)은 재배 더덕에서 fructose의 함량이 2.9%, sucrose 함량은 1.1%로 fructose의 함량이 약 3 배 정도 높았다고 하여 본 실험과 유사한 결과를 나타내었다. 그러나 Lee (1984)에 의하면 재배 더덕의 4 가지의 유리 당을 분석한 결과 sucrose (1.75%) > fructose (0.98%) > glucose (0.43%) > maltose (0.05%) 순으로 함량이 높다고 하여 다소 다른 결과를 나타내었다.
이것은 인삼의 경우 건조 온도 또는 저장 기간에 따라서 유리당이 변화된다는 보고 (Kim et al., 1981; Kim and Jo, 1984)가 있어 당 구성 성분 및 함량의 차이는 재배환경과 더불어 건조 조건 및 채취 시기, 저장 방법 등의 차이에 기인하는 것으로 생각된다.
5. 더덕의 생육 시기별 유기산 함량 변화
더덕 뿌리의 생육 시기에 따른 7 종의 유기산을 분석한 결과 citric acid, malic acid succinic acid, acetic acid가 검출되었고 tartaric acid, lactic acid, formic acid 등은 검출되지 않았다 (Table 5).
검출된 유기산 중 citric acid와 malic acid 함량이 가장 높았으며, citric acid의 경우 생육이 진행됨에 따라 증가하는 경향을 보였다. Malic acid의 경우 1월 (겨울)에 가장 높은 함량을 나타내었고 5월 (봄)과 9월 (가을)에는 다소 감소하는 경향을 보였다. Succinic acid의 경우 1월에는 검출되지 않았으나 5월과 9월에 아주 미량만 검출되었다. Acetic acid는 생육시기에 따라 큰 차이가 없었으며 함량 자체는 citric acid와 malic acid에 비해 아주 낮은 편이였다.
Hwang 등 (2011)은 더덕에서 citric acid, malic acid, succinic acid 3 가지의 유기산을 분석하였는데 malic acid (3.86 ㎎/g) > succinic acid (3.19 ㎎/g) > citric acid (0.34 ㎎/g) 순으로 함량이 높다고 하여 본 연구와 유사하게 citric acid, malic acid, succinic acid등이 주요 유기산인 것을 확인할 수 있었다. 그러나 succinic acid와 같이 유기산 성분 함량에 있어서는 다소 차이가 있었다.
6. 더덕의 생육 시기별 지방산 함량 변화
더덕 뿌리의 생육 시기에 따른 37 종의 지방산 함량을 조사한 결과 capric acid, palmitic acid, stearic acid 3 가지 포화 지방산만 검출되었다 (Table 6).
지방산의 함량은 palmitic acid > stearic acid > capric acid 순으로 높았으나 그 함량은 생육 시기와 상관없이 0.45 ppm - 0.60 ppm 수준으로 매우 소량이었다. 그러나 이 중에서도 palmitic acid가 전체 지방산의 60% 수준으로 포함되어져있었고 stearic acid가 30% - 40%의 비중을 차지하는 것으로 나타났다.
Park 등 (1985)은 linoleic acid > linolenic acid > palmitic acid 순으로 높다고 하였고, Meang and Park (1990)은 linoleic acid > palmitic acid > linolenic acid가 전체 지방산 성분 중 60% 이상을 차지한다고 하였다. 또한 재배 더덕과 산 더덕에 있어서 성분 조성의 차이가 있다고 하였다. 그러나 본 연구에서는 palmitic acid가 주요한 지방산 중의 하나인 것은 다른 연구와 일치하지만 capric acid, stearic acid 등이 소량 검출되어 이전의 연구와 다소 차이가 있었다. 이것은 지방산뿐만 아니라 아미노산, 무기물, 유리당, 유기산 등의 대부분의 구성 성분은 이전의 연구 결과와 일치하는 경향을 나타내었으나 특정 성분의 함량과 구성에 있어서 일부 차이가 있는 것으로 확인되었으며 이것은 더덕의 재배환경, 수확시기, 분석 방법 등의 차이에 의한 것으로 사료된다.
이상의 결과를 요약하며 더덕의 주요한 약리성분으로 알려진 lancemasides의 함량은 지상부와 지하부 모두 생육성기인 5월 (봄)이 가장 높은 경향이었다. 이것은 더덕의 생육이 왕성한 시기에 lancemasides의 생성이 촉진되는 것으로 보이며, 7월 이후부터는 lancemasides 함량이 감소하는 경향을 보여 지상부의 개화, 지하부의 뿌리 비대 및 성숙 등과 같은 생육 단계와 저장양분, 사포닌 함량과의 관계는 좀 더 많은 연구가 필요할 것으로 보인다. 또한 더덕의 생육 시기에 따른 아미노산, 무기물, 유리당, 유기산, 지방산 등 주요 성분은 겨울철인 1월이 가장 높아서 일반적인 더덕의 수확시기 (가을 – 봄)와 일치하는 것을 확인할 수 있었다. 따라서 본 결과는 더덕의 사포닌을 포함한 약리성분 함량 증대를 위한 시비, 적화, 적심과 같은 재배관리의 기초자료로 활용이 가능하리라 사료된다.
Acknowledgments
본 연구는 2020년도 한국연구재단 기초연구사업(과제번호: 2019R1G1A100242512)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
- An YN, Lee SY, Chung MG, Choi KJ and Kang KH. (2002). Ginsenoside concentration and chemical component as affected by harvesting time of four-year ginseng root. Korean Journal of Crop Science. 47:216-220.
-
Choi HK, Won EK, Jang YP and Choung SY. (2013). Antiobesity effect of Codonopsis lanceolata in high-calorie/high-fat-diet-induced obese rats. Evidence-Based Complementary and Alternative Medicine. 2013:210297. https://www.hindawi.com/journals/ecam/2013/210297/, (cited by 2020 Dec 11).
[https://doi.org/10.1155/2013/210297]

-
He J, Ma N, Zhu S, Komatsu K, Li Z and Fu W. (2015). The genus Codonopsis(Campanulaceae): A review of phytochemistry, bioactivity and quality control. Journal of Natural Medicines. 69:1-21.
[https://doi.org/10.1007/s11418-014-0861-9]

-
Hwang CR, Oh SH, Kim HY, Lee SH, Hwang IG, Shin YS, Lee JS and Jeong HS. (2011). Chemical composition and antioxidant activity of deoduk(Codonopsis lanceolata) and doragi(Platycodon grandiflorum) according to temperature. Journal of the Korean Society of Food Science and Nutrition. 40:798-803.
[https://doi.org/10.3746/jkfn.2011.40.6.798]

-
Ichikawa M, Ohta S, Komoto N, Ushijima M, Kodera Y, Hayama M, Shirota O, Sekita S and Kuroyanagi M. (2009). Simultaneous determination of seven saponins in the roots of Codonopsis lanceolata by liquid chromatography-mass spectrometry. Journal of Natural Medicines. 63:52-57. https://link.springer.com/article/10.1007/s11418-008-0294-4, (cited by 2020 Dec 11).
[https://doi.org/10.1007/s11418-008-0294-4]

-
Jang IB, Yu J, Suh SJ, Jang IB and Kwon KB. (2018). Growth and ginsenoside content in different parts of ginseng sprouts depending on harvest time. Korea Journal of Medicinal Crop Science. 26:205-213.
[https://doi.org/10.7783/KJMCS.2018.26.3.205]

-
Jeong HS, Lim CS, Cha BC, Choi SH and Kwon KR. (2010). Component analysis of cultivated ginseng, cultivated wild ginseng, and wild ginseng and the change of ginsenoside components in the process of red ginseng. Journal of Pharmacopuncture. 13:63-77.
[https://doi.org/10.3831/KPI.2010.13.1.063]

-
Joh EH, Jeong JJ and Kim DH. (2014). Inhibitory effect of echinocystic acid on 12-O-tetradecanoylphorbol-13-acetate-induced dermatitis in mice. Archives of Pharmacal Research. 37:225-231.
[https://doi.org/10.1007/s12272-013-0092-8]

-
Joh EH, Lee IA, Han SJ, Chae S and Kim DH. (2010). Lancemaside A ameliorates colitis by inhibiting NF-κB activation in TNBS-induced colitis mice. International Journal of Colorectal Disease. 25:545-551.
[https://doi.org/10.1007/s00384-009-0858-0]

-
Jung IH, Jang SE, Joh EH, Chung JY, Han MJ and Kim DH. (2012). Lancemaside A isolated from Codonopsis lanceolata and its metabolite echinocystic acid ameliorate scopolamine-induced memory and learning deficits in mice. Phytomedicine. 20:84-88.
[https://doi.org/10.1016/j.phymed.2012.09.005]

- Kim HJ and Jo JS. (1984). Studies on the physicochemical properties of korea ginseng(Panax ginseng, C. A. Meyer) root starch 1. Starch content and general features. Journal of Ginseng Research. 8:114-123.
- Kim HJ. (1985). Proximate and amino acid composition of wild and cultivated Codonopsis lanceolata. Korean Journal of Food Science and Technology. 17:22-24.
- Kim JH and Chung MH. (1975). Pharmacognostical studies on Codonopsis lanceolata. Korean Journal of Pharmacognosy. 6:43-47.
-
Kim SH, Choi HJ, Chung MJ, Cui CB and Ham SS. (2009). Antimutagenic and antitumor effects of Codonopsis lanceolata extracts. Journal of the Korean Society of Food Science and Nutrition. 38:1295-1301.
[https://doi.org/10.3746/jkfn.2009.38.10.1295]

- Kim SH, Choi HJ, Oh HT, Chung MJ, Cui CB and Ham SS. (2008). Cytoprotective effect by antioxidant activity of Codonopsis lanceolata and Platycodon grandiflorum ethyl acetate fraction in human HepG2 cells. Korean Journal of Food Science and Technology. 40:696-701.
-
Kim SK, Sakamoto I, Morimoto K, Sakata M, Yamasaki KK and Tanaka O. (1981). Seasonal variation of saponins, sucrose and monosaccharides in cultivated ginseng roots. Planta Medica. 42:181-186.
[https://doi.org/10.1055/s-2007-971623]

- Korean Statistical Information Service(KOSIS). (2019). Statistics DB. Special crop production statistics. https://kosis.kr/search/search.do, (cited by 2020 Dec 12).
- Lee SK. (1984). Chemical compositions of dried wild and cultivated Codonopsis lanceolata. Journal of the Korean Chemical Society. 27:225-230.
- Lee SR, Yoon ES and Lee YS. (1990). The mineral content of Codonopsis lanceolata Benth, et hook, fil, with different zone in Korea and Japan. Korean Journal of Plant Resources. 3:71-81.
- Lee ST, Ryu JS, Kim MB, Kim DK, Lee HJ and Heo JS. (1999). Crude saponin contents of Platycodon grandiflorum (Jacq.) A. DC. Korean Journal of Medicinal Crop Science. 7:172-176.
- Meang YS and Park HK. (1990). Fatty acid and amino acid aompositions of dodok(Codonopsis laceolata). Korean Journal of Food Science and Technology. 6:51-58.
- Park BD, Park YG and Choi KS. (1985). Chemical composition of cultured and wild Codonopsis lanceolata roots of different age groups- Ⅱ. separation of the lipid fractions. Journal of the Korean Society of Food Science and Nutrition. 14:280-283.
- Park SJ, Park DS, Yoon WB, He XL and Ahn JH. (2012). Effects of aged deodeok extract on serum lipid content in rats fed a high-fat diet. Journal of the East Asian Society of Dietary Life. 22:17-24.
-
Park SJ, Seong DH, Park DS, Kim SS, Gou JY, Ahn JH, Yoon WB and Lee HY. (2009). Chemical compositions of fermented Codonopsis lanceolata. Journal of the Korean Society of Food Science and Nutrition. 38:396-400.
[https://doi.org/10.3746/jkfn.2009.38.3.396]

- Rural Development Administration(RDA). (2017). Deodeok cultivation. Rural Development Administration. Suwon, Korea. http://www.nongsaro.go.kr/, (cited by 2020 Dec 15).
-
Song CH, Seo YC, Choi WY, Lee CG, Kim DU, Chung JY, Jung HC, Park DS, Ma CJ and Lee HY. (2012). Enhancement of antioxidative activity of Codonopsis lanceolata by stepwise steaming process. Korean Journal of Medicinal Crop Science. 20:238-244.
[https://doi.org/10.7783/KJMCS.2012.20.4.238]

-
Um IS, Lee MJ, Nam JH and Rho IR. (2019). Effects of additional fertilization after cultivating green manure crops on the growth and saponin content of Codonopsis lanceolata Trautv. Korean Journal of Medicinal Crop Science. 27:1-8.
[https://doi.org/10.7783/KJMCS.2019.27.1.1]

- Ushijima M, Mizuno I, Suzuki E, Amayasu R, Ishii S, Nishihama, T, Morihara N, Kashimoto N, Mouri Y and Sumioka I. (2007). Improvement of PADAM-like symptoms in middle-aged men by a designer food containing Codonopsis lanceolata. Pharmacometrics. 72:23-30.
-
Yoon KK, Moon KG, Kim SU, Um IS, Cho YS, Kim YG and Rho IR. (2016). Analysis of growth and antioxidant compounds in deodeok in response to mulching materials. Korean Journal of Medicinal Crop Science. 24:183-190.
[https://doi.org/10.7783/KJMCS.2016.24.3.183]


