
인삼 엽온과 미기상의 상관분석을 통한 최적 투광량 설정
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The biological responses of crops can be more accurately studied by measuring leaf temperatures instead of monitoring the surrounding atmospheric temperatures. This study analyzed the correlations between ginseng leaf temperatures and microclimate factors to determine the optimal light transmittance rate of shading.
The correlations between the ginseng leaf temperature and microclimate factors, such as the light intensity and temperature within the shading structure, were analyzed at light transmittance rates of 10% and 6%, and changes in leaf colorization, photosynthetic efficiency rates and root weights were measured. The rise in the leaf temperature was significantly positively related to the internal temperature, while the rise in the internal temperature was significantly positively related to the light intensity outside the shading structure. The colorization degree and photosynthetic rate of leaves were 36.3 and 1.948 μ㏖·m−2·s−1, respectively, at 6% light intensity, and 26.1 and 1.730 μ㏖·m−2·s−1, respectively, at 10% light intensity, equating to an 8.6% increase in the root weight at 6%.
To lower ginseng leaf temperatures and increase their photosynthetic rate and root weight, the amount of light transmitted inside the shading structure should be adjusted to 6%.
Keywords:
Panax ginseng C. A. Meyer, Leaf Temperature, Light Intensity, Photosynthesis, Photosynthetic Photon Flux Density서 언
인삼 (Panax ginseng C. A. Meyer)의 생육 온도는 20℃ - 25℃, 광량은 10,000 - 15,000 lux, 토양 수분함량은 18% - 20%가 적당한 것으로 보고되었다 (Bailey, 1990; Park et al., 2008; Lee et al., 2010). 현재 지구 온난화로 인해 고온 피해가 심하여 벼, 옥수수 등 주요 작물의 수량이 최소 1%에서 최대 30% 까지 감소된다고 한다 (Jha et al., 2014). 해가림 내부 온도가 30℃ 이상인 조건에서 인삼이 고온 피해를 받을 경우 6년생 근중은 10%가 감소되며 (Lee et al., 2010), 3년생 미국삼 (Panax quinquefolius L.)의 근중은 33%가 감소된다고 하였다 (Jochum et al., 2007).
인삼의 고온 피해를 방지하기 위한 재배적 방법으로 근장 15 ㎝ 이상의 묘삼 식재, 7월 - 8월 고온기에 18% - 20%의 토양수분 유지와 광량을 10% 이하로 조절하는 방법이 보고되었다 (Lee et al., 2010).
또한 해가림 피복물의 색상과 소재에 변화를 주어 인삼의 고온 피해를 줄이기 위한 연구가 많이 진행된 바, 인삼의 해가림 피복물의 소재는 1990년대에 해가림 내부로 투광량이 10% 투과되는 Polyethylene (이하 PE) 차광망 (흑1:청3)이 사용되었고, 2000년대에는 투광량이 20% 투과되는 차광지가 사용되었으며 이러한 투광량 증대는 수삼의 수량 증대에 도움이 되었다 (Jang et al., 2019). 그러나 차광지의 단점인 고온 피해를 낮추기 위해 해가림 내부의 투광량이 5%인 알루미늄 소재의 피복물이 이용되기도 하였다 (Lee et al., 2013). 이외에 인삼 잎의 표백화를 지연시키는 효과가 있는 녹색 계열의 소재 활용이 광합성 효율에 미치는 영향에 대하여 연구되기도 하였다 (Lee et al., 1999; Jang et al., 2019). 하지만 그동안의 인삼 재배환경 중 미기상에 대한 연구는 다양한 피복물 소재를 이용해 해가림 내부의 광량, 온도 및 습도를 조절하는 연구에 국한되어 진행되어왔다.
식물은 주변 환경조건의 변화에 따라 광온성 (eurythermic) 또는 온열성 (homeothermic)으로 변화하며, 식물의 잎은 열에 대한 항상성을 유지하기 위해 대기 온도와 다른 온도차를 유지한다. 따라서 대기의 온도만을 측정하여서는 식물의 생리적 반응을 명확히 해석할 수 없다 (Noffsinger, 1961; Mellor et al., 1964; Upchurch and Mahan, 1988; Michaletz et al., 2016).
현재 엽온 측정을 통해 작물의 환경 스트레스 (건조와 고온피해)를 판단할 수 있는 지표로 활용되고 있다. 복숭아 엽온의 변화와 토양 수분함량과의 상관성 분석으로 관수 대책 마련 (Yun et al., 2020), 천궁 엽온의 모니터링으로 고온과 냉해 피해의 방지 (Seo et al., 2018), 누에콩의 건조 피해 시 엽온과 기공의 개도 (Leinonen and Jones, 2004), 엽온의 변화를 통한 탄소 축적, 호흡, 광합성과 기공전도도 등의 예측모델 개발 (Blonder and Michaletz, 2018), 땅콩과 목화의 건조 스트레스 시 엽온 증가는 증산 능력과 기공전도도의 감소와 비광화학적 인산화 반응과 고도의 유의한 상관성이 있다고 보고 한 연구 (Shahenshah and Akihiro, 2010) 등이 이루어졌다. 또한 Hirayama 등 (2006)은 엽온과 증산율, 광합성의 상관성을 분석하여 건조 저항성 품종 개발에도 활용한 바 있다.
현재까지 인삼의 엽온과 광합성에 미치는 영향에 대해서는 Hyun 등 (1993)과, Hyun과 Yoo (1996)가 식물생장상을 활용하여 광량이 200 μ㏖·m−2·s−1이고 엽온이 18℃ 일 때 CO2 흡수, 기공전도율 및 세포내간극의 CO2 농도와 Rubisco의 효율이 최대라는 보고가 있고 인삼 재배 기간 중 해가림 내부의 미기상이 엽온 변화에 미치는 영향에 대한 연구는 미흡한 실정이다.
본 연구의 목적은 인삼의 엽온을 상승시키는 미기상의 주요인을 분석하여 인삼의 고온과 건조피해 시 엽온 변화에 대한 생리 연구의 기초자료를 확보하고 인삼 재배 시 최적 광량 설정을 위한 새로운 연구 방향을 제시하기 위해 실시되었다.
재료 및 방법
1. 재배조건 및 광량조절
시험포장은 경기도 안성시 삼죽면 내강리 462 (37° 03′47″N 127° 22′22″E)에 위치하였다. 두둑 폭은 90 ㎝, 두둑 높이는 30 ㎝, 두둑 간 거리는 30 ㎝로 조정하였다. 묘삼은 2016년 3월 20일에 두둑 1.62 ㎡에 인삼 품종인 금풍 (Panax ginseng C. A. Meyer, cv. Gumpoong) 70 본을 식재하였다.
해가림의 구조는 후주 연결식에 피복물은 투광율 30%인 청백색 차광지 (폭 160 ㎝)를 설치하였다. 6월 1일 부터 투광율 55%의 PE 흑색 2 중직 (폭 165 ㎝)을 추가피복 하였다. 투광량 조절은 PE 흑색 2 중직의 추가 피복 높이를 20 ㎝로 조절하여 해가림 내부 투광율을 10%로 조절하였고, 추가 피복 높이를 50 ㎝로 조절하여 투광율이 6%가 되도록 조절하였다 (Fig. 1). 투광량의 조절은 6월 1일부터 8월 31일까지 하였다.
2. 해가림 내부의 미기상 및 엽온 측정
해가림 내부의 광량을 측정하기 위하여 광량 센서 (LI-190R, Li-COR Bioscience, Lincoln, NE, USA)를 해가림 외부 210 ㎝ 높이에 설치하였고, 내부의 광량 센서 (LI-200R, Li-COR Bioscience, Lincoln, NE, USA)를 두둑의 중앙 부위 65 ㎝ 위 (인삼 장엽이 전개된 바로 위 10 ㎝)에 설치하였다. 광량 데이터는 로거 (CR300, Campbell Scientific Inc., Logan, UT, USA)를 활용하여 수집하였다.
해가림 내부의 온도와 습도 (S-THB-M002, HOBO Co., Bourne, MA, USA), 풍속 (S-WSB-M003, HOBO Co., Bourne, MA, USA) 센서를 설치하고 데이터는 로거 (U30, HOBO Co., Bourne, MA, USA)를 이용하여 수집하였다. 엽온은 비접촉식 적외선 센서 (SI-431-SS, Apogee Instrument Inc., Logan, UT, USA)를 이용하였고 설치 위치는 해가림 내부 광량센서 위치와 동일한 부위에 설치하였다. 데이터 로거 (C1000, Li-COR Bioscience, Lincoln, NE, USA)를 이용하여 1 초 단위로 수집되고 1 시간 후에 수집된 데이터의 평균값으로 기록되며 24 시간 동안 수집하였다.
수집한 데이터는 1 차 (6월 11일부터 6월 18일까지)와 2 차 (8월 25일부터 8월 31일까지)로 구분하였으며 이 기간 중 맑은 날 5 일 동안의 평균값을 분석에 활용하였다.
3. 엽색도, 광합성 효율 및 근중 조사
엽색도와 광합성 효율은 9월 1일에 조사하였다. 엽록소 함량을 간접적으로 나타내는 엽색도계 (SPAD-502, Minolta Inc., Tokyo, Japan)를 이용하여 광량조절 처리구별 2 행 - 3 행에서 정상적으로 생육한 30 개체의 중앙 소엽을 측정하였다. 엽색도 조사에 활용된 30 개체 중에서 6 개체를 선정하여 광합성 측정기 (LI-6400 TX, Li-COR Inc., Lincoln, NE, USA)를 이용하여 광합성률을 측정하였다.
광합성 측정 조건은 flow rate 500 μ㏖·s−1, CO2 400 μ㏖·m−2·s−1, 인공 광량은 300 μ㏖·m−2·s−1, 잎 측정용 block 온도는 30℃로 설정하여 오전 10시 - 오전 11시 사이에 측정하였다. 10월 5일에 처리구별 3 칸 (4.86 ㎡)을 수확하여 건전한 개체만을 골라 농업과학기술 연구조사 분석기준에 따라 근중의 차이를 조사하였다 (RDA, 2012).
4. 통계분석
실험 결과의 통계 처리는 SAS 분석 패키지 (SAS v9.2, SAS Institute Inc., Cary, NC, USA)를 사용하여 해가림 내·외부 광량, 해가림 내부의 온도, 습도 및 풍속과 엽온 사이의 상관관계를 분석하였다.
상관관계는 Pearson의 적률상관계수 (Pearson’s correlation coefficient)를 이용하여 유의성을 표기하였다. 투광량이 엽색도, 광합성률 및 근중에 미치는 영향은 Student’s t-test를 통하여 유의성을 분석하였다.
결과 및 고찰
1. 투광량 차이에 따른 해가림 내부 광량의 일변화와 계절적 변화
청백색 차광지 피복물 PE 흑색 2 중직을 추가 피복하지 않을 때의 광량은 Fig. 2A와 같다.
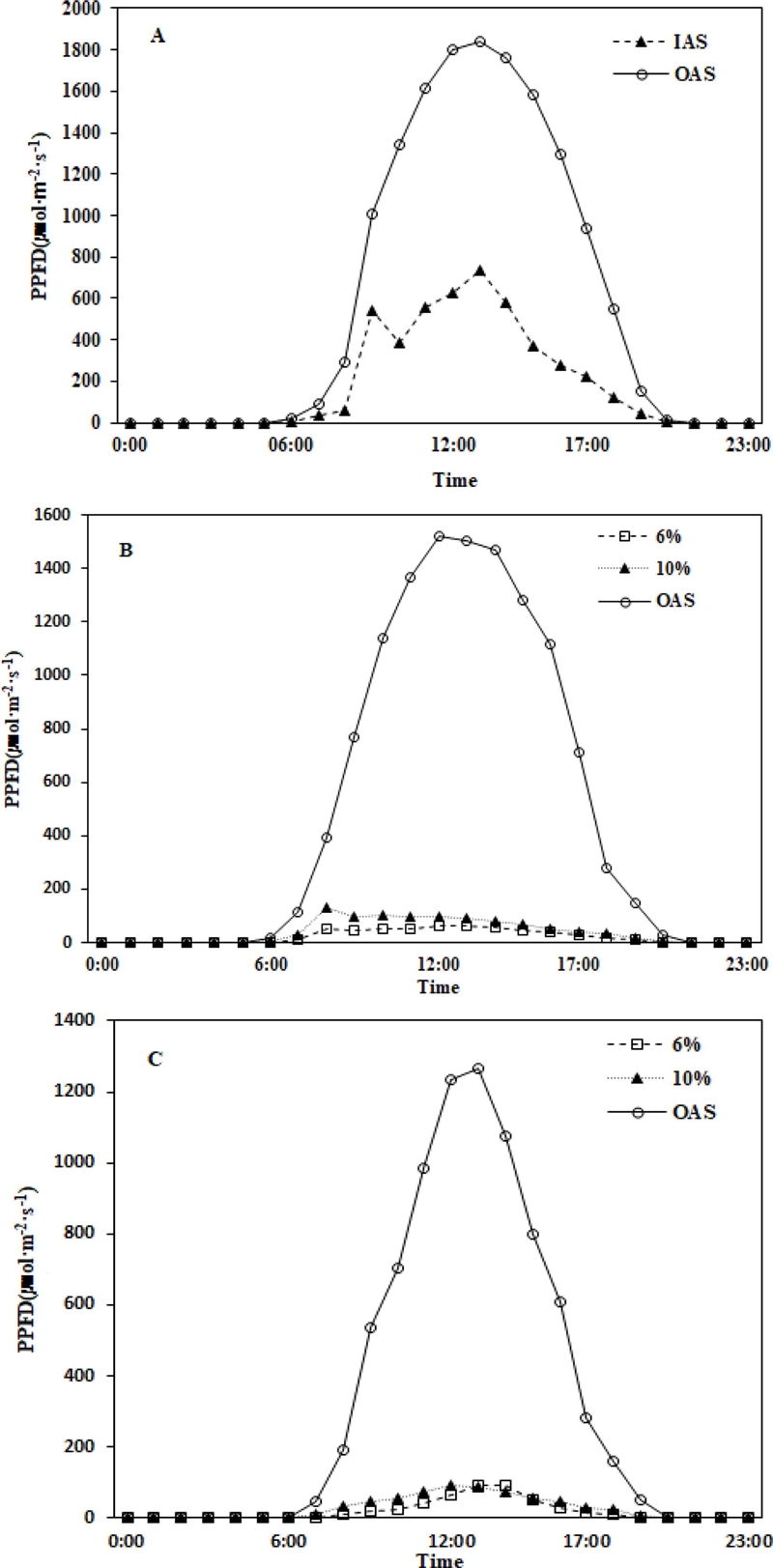
Monthly changes in light intensity inside the sun screen to light intensity control.A; light intensity inside and outside the shade before the light intensity control. B; light intensity in June. C; light intensity in August. IAS; inside light intensity of artificial shading structure, OAS; outside light intensity of artificial shading structure. PPFD; photosynthetic photon flux density.
맑은 날 오전 7시 -오후 7시 사이 (이하 주간) 동안의 외부 광량은 1098.5 μ㏖·m−2·s−1이었고 해가림 내부로 유입되는 평균 광량은 350.6 μ㏖·m−2·s−1이었으며 외부 광량 대비 30.9%가 해가림 내부로 유입되었다. 일출과 함께 해가림 내부의 광량은 증가하기 시작하여 일출 후 오전 9시에 높은 광량을 나타냈으며 오전 10시까지 조금 낮아지다가 오전 11시부터 다시 증가하기 시작하여 오후 1시에 가장 높은 값을 나타낸 후 서서히 감소하는 쌍봉형의 광 유입 형태였다. 이러한 해가림 내부의 쌍봉형 광 유입 패턴은 Jang 등 (2019)의 보고와도 동일하였다.
우리나라의 해가림은 두둑의 방향이 동서 120°이며, 북쪽이 180 ㎝, 남쪽이 110 ㎝ - 100 ㎝ 형식의 경사식 해가림 구조로 인해 지구의 자전과 남중고도의 영향으로 일별 및 월별에 따라 광량의 변화가 쌍봉형으로 나타난다. 반면 미국과 캐나다의 수평식 해가림은 일사량이 일출 후 오전 8시부터 서서히 증가하여 오후 2시에 최고의 일사량이 나타난 후 일몰까지 완만히 감소하는 단봉형이다. 수평식 해가림의 일사량이 쌍봉형과 달리 단봉형인 이유는 두둑의 방향이 경사식 구조와 같이 일정하지 않아 남중고도의 영향이 없고, 태양의 천정각이 커짐에 따라 해가림 내부로의 투광량이 감소되는 수평식 재배방식이기 때문이다 (Stathers and Bailey, 1986).
투광율을 6%와 10%로 조절 후 6월의 해가림 내부 광량의 차이는 Fig. 2B와 같다. 6월의 외부 광량은 908.3 μ㏖·m−2·s−1을 나타내었고 6% 조절구의 해가림 내부의 광량은 41.2 μ㏖·m−2·s−1이었으며 10% 조절구의 광량은 72.7 μ㏖·m−2·s−1이었다. 8월의 외부 광량은 610.9 μ㏖·m−2·s−1이었으며 6%와 10% 조절구 각각의 해가림 내부로의 광량은 35.9 μ㏖·m−2·s−1와 47.9 μ㏖·m−2·s−1 이었다 (Fig. 2C).
투광량 조절 후 6월에 해가림 내부 쌍봉형의 일사 패턴은 광량을 조절하기 전보다 뚜렷하지는 않았으나 기본적인 일사패턴은 유사하였다. 반면 8월에는 쌍봉형 패턴은 나타나지 않았으며 수평식 해가림과 유사한 패턴이었다. 이러한 이유는 8월에 남중고도가 하지를 지나면서 해가림 내부로 투입되는 일사의 시간이 짧아진 영향으로 판단된다.
2. 투광량의 차이에 따른 해가림 내부 온도와 엽온의 변화
투광율 6% 조절구에서 6월의 24 시간 동안 해가림 내부의 평균 온도가 23.1℃일 때 엽온은 평균기온보다 0.5℃ 더 낮았고 주간의 해가림 내부 평균 온도가 26.6℃일 때 엽온은 0.9℃ 낮았다. 투광율 10% 조절구의 경우 24 시간 동안 해가림 내부의 평균 온도는 23.0℃ 일 때 엽온은 평균기온보다 0.3℃ 낮았고 주간의 내부 평균 온도가 26.6℃일 때 엽온은 0.5℃ 낮았다 (Fig. 3A and Fig. 3B).
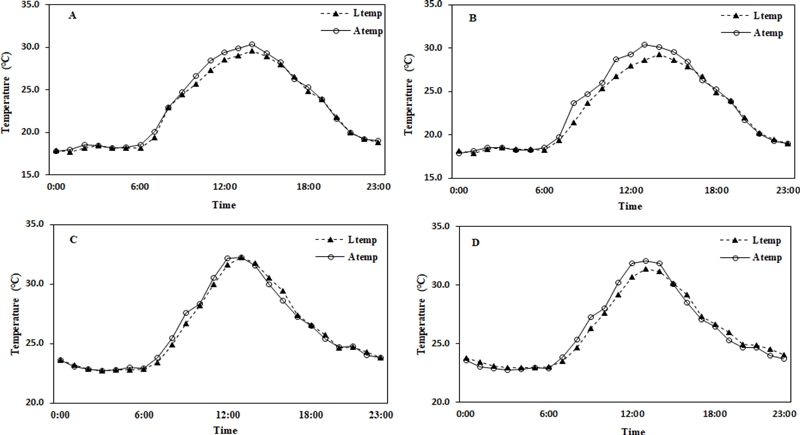
Monthly changes in leaf temperature (Ltemp.) and the air temperature (Atemp.) inside the sun screen by light intensity.A and C; 6% light intensity zone in June and August, B and D; 10% light intensity zone in June and August.
8월의 투광율 6% 조절구에서 24 시간 동안 내부 온도가 평균 26.2℃, 주간 내부 온도가 28.4℃ 일 때 엽온은 각각 0.1℃ 낮았다. 투광율 10% 조절구에서 24 시간과 주간의 평균 온도는 각각 26.1℃와 28.3℃일 때 엽온은 0.1℃와 0.3℃ 낮았다 (Fig. 3C and Fig. 3D).
투광율 10% 조절구에서 6월 야간의 해가림 내부 온도는 17.8℃ - 18.5℃를 유지하다가 일출이 시작되는 오전 7시부터 온도가 상승하기 시작하여 오전 12시 -오후 3시까지 28.3℃ - 29.4℃가 유지되었으며, 일몰이 시작되는 오후 4시부터 서서히 온도가 낮아진다. 8월에도 해가림 내부 온도의 상승은 6월과 동일한 경향이다 (Fig. 4A and Fig. 4C).
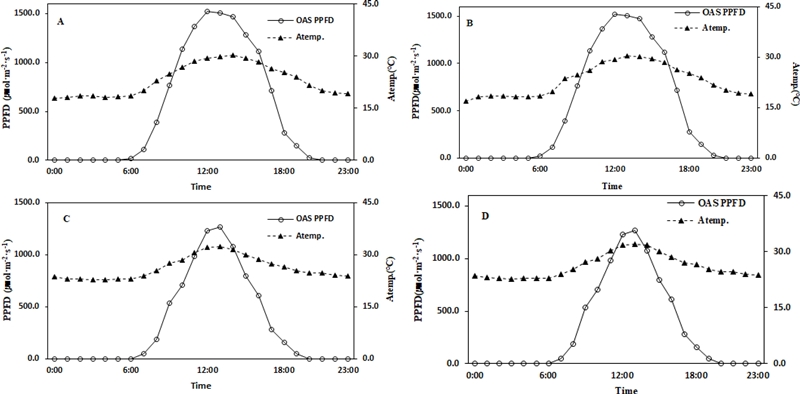
Monthly changes in the inside air temperature (Atemp.) and outside light intensity by light control.A and C; 6% light intensity zone in June and August, B and D; 10% light intensity zone in June and August. PPFD; photosynthetic photon flux density. OAS PPFD; photosynthetic photon flux density of outside light intensity of artificial shading structure.
Yun 등 (2020)은 복숭아의 엽온을 상승시키는 기상 요인 중 일사량 증가는 대기 온도와 엽온의 상승에 상관이 크다고 보고하였다. 이 외에도 일사량 증가에 따른 대기 온도의 상승과엽온 증가의 상관관계가 딸기 (Lee et al., 2020), 종가시나무와 고로쇠나무 (Park, 2011)에서도 보고되었다. 본 실험에서도 Fig. 3과 Fig. 4를 동시에 비교할 경우 광량의 상승이 해가림 내부의 대기 온도를 상승시키고 상승된 대기 온도에 의해 엽온이 상승하는 것을 알 수 있다.
투광율 10% 조절구에서 6월은 오후 4시, 8월은 오후 3시에 잎과 내부온도의 차 (이하 Ltemp. − Atepm.)가 0이 되는 시점이며 (Fig. 3B and Fig. 3D) 이때가 외부의 광량이 급격히 떨어지는 시기와 동일한 시점이다 (Fig 4B and Fig. 4D). 투광율 6% 조절구에서도 6월은 오후 5시에 Ltemp. − Atepm.의 온도차가 0이 되는 시점으로 (Fig. 3A and Fig. 3C) 광량이 낮아지는 시간 (Fig. 4A and Fig. 4C)과 동일했다. 8월은 오후 1시에 대기 온도와 엽온의 차이가 0이 되었다 (Fig. 3A and Fig. 3C). 그러나 광량이 낮아지는 시간은 오후 3시 (Fig. 4B and D)로 약간의 차이는 있었다. 이러한 이유는 6월과 달리 8월의 고온과 토양수분 스트레스의 영향으로 인삼의 생리적 활성이 저하된 것으로 추정된다. 향후 온도, 광과 수분의 인위적인 조절을 통하여 인삼 엽온 변화에 대한 명확한 연구가 필요하다.
Hyun 등 (1993)은 인삼재배에 있어 광도와 엽 온도의 변화가 5 단계로 구분되며 오후 4시에 엽온이 낮아지는 보고와 유사하였다. Hyun 등 (1993)은 일몰이 시작되는 시간에서 태양 복사가 낮아짐과 동시에 해가림 내부 기온도 낮아지기 시작하나 낮 동안 상승된 엽온이 낮아지기까지 상당한 시간이 필요하기 때문에 나타나는 현상이라고 하였다.
인삼의 엽온이 대기 온도와 차이가 크지 않은 이유는 해가림이라는 특수한 조건에서 재배가 됨으로 인해 상대습도가 높고, 빗물의 누수 방지와 6년간 사용하기 위해 피복물을 코팅함으로 통풍이 잘 이루어지지 않아 인삼 잎의 증산작용이 억제되기 때문이다. 또 다른 이유로 종가시나무 (Park, 2011), 천궁 (Seo et al., 2018)과 딸기 (Lee et al., 2020) 등은 하위 엽이 존재하며 하위 엽이 일사의 직접적인 영향을 받지 않기 때문에 전체적인 평균 엽온이 낮다. 그러나 인삼은 잎이 총생형으로 착생되며 하위엽이 없기 때문에 엽온과 대기 온도의 차이가 적은 편이다.
현재까지 식물 잎의 냉각의 법칙으로는 증산, 복사와 대류에 의해 잎의 온도가 주변의 대기 온도보다 낮아진다고 보고 되었다 (Curtis, 1936; Mellor et al., 1964; Martin et al., 1999). 잎의 온도는 대기 온도와 상호작용을 하며 냉각의 법칙에 따라 Ltemp. − Atepm.가 발생하고 이 차이를 이용하여 고온, 건조와 수분 스트레스 등을 추정할 수 있고, Ltemp. − Atepm.의 차이가 클수록 작물의 생육에 유리하다 (Mellor et al., 1964).
Fig. 2에서 보는 것과 같이 두 가지 광량 조절구의 6월과 8월의 주간과 오후 8시 - 오전 6시 (이하 야간)의 Ltemp. − Atepm.를 보면 주간이 항상 야간보다 차이가 크다. 상대습도가 높으면 수증기압 차이가 낮아지고 이로 인해 증산작용의 감소와 엽온이 상승하게 된다. 본 실험에서도 해가림 내부의 상대습도는 두 광량 조절구간 차이가 없이 야간에 100%에 가깝고 풍속도 야간이 주간보다 약하기 때문으로 야간의 엽온은 대기의 온도와 동일하거나 높게 유지된다 (Fig. 5).
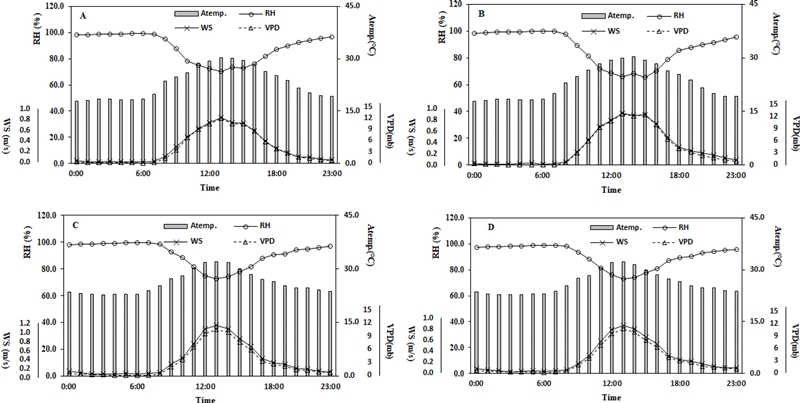
Change Changes in monthly air temperature (Atemp.), relative humidity (RH), wind speed (WS) and vapor pressure deficit (VPD) depending on light intensity level.A and C; measured values in June and August in the 6% light intensity zone. B and D; measured values in June and August in the 10% light intensity zone.
Ltemp. − Atepm.의 차이는 잎과 대기 온도간의 상호작용 시 증산에 의해 온도차가 발생한다는 것을 의미한다. 대기 온도가 높고 바람이 없으며 상대습도가 높을 때 증산작용이 0에 가깝게 되면 Ltemp. − Atepm.의 차이가 없어진다. 이는 증발산량이 낮아지고 작물이 외부 환경 스트레스에 더욱 쉽게 노출된다는 것이다 (Mellor et al., 1964). Pallas 등 (1967)은 목화에서 공기 중의 상대습도가 높을 때 광량에 관계없이 대기 온도보다 엽온이 1.5℃ 높다고 보고하였고, Yun 등 (2020)도 복숭아 재배 시 야간의 상대습도가 높을 때 엽온과 상대습도 사이에는 높은 부의 상관을 가진다고 하였다. 목화를 하우스에서 재배 시 대기의 온도가 27℃가 될 때 까지 엽온은 1℃ 정도 낮은 선형관계이나 27℃ 이상의 온도에서는 엽온이 낮아지지 않았다고 보고하였다. 이러한 이유는 잎 표면의 복사냉각이 이루어지지 않기 때문이며 또한 하우스에서 재배되어 야간의 순복사량이 0에 가깝기 때문이다 (Upchurch and Mahan, 1988). 인삼도 하우스와 유사한 반 차폐형 해가림에서 재배되기 때문에 야간의 복사냉각이 잘 이루어지지 않고 상대습도가 높고 풍속이 약하기 때문에 야간의 인삼 엽온의 저하가 낮은 것으로 판단된다.
보웬비 (bowen ratio)는 대기 중의 잠열에 대한 현열의 비를 이용하여 대기 중의 증발량의 높고 낮음을 추정하는 방법이다. 보웬비가 높아지면 잠열의 비율이 커지며 이로 인해 증산과 증발이 억제되는 조건이 된다. Stathers와 Bailey (1986)는 수평식 해가림 내부의 주간 보웬비는 3으로 매우 높다고 하였다. 이는 해가림 내부에서의 증산과 증발이 활발하게 작용할 수 없는 조건이라는 것을 알 수 있다. 이외에도 볏짚 멀칭으로 인해 지하부의 온도가 두둑 위보다 낮아 증발산이 낮고, 피복물의 공기 투과가 불량하여 수평적 온도구배가 형성되기 때문이다 (Stathers and Bailey, 1986; Bailey, 1990). 또 야간의 장파복사가 해가림 피복물에 의해 외부로 빠져나가지 못하고 해가림 내부에 정체됨으로 야간의 해가림 내부 온도가 쉽게 낮아지지 않아서 나타난 현상이다.
3. 투광량 차이에 따른 해가림 내부 미기상간의 상관관계
해가림 내부의 투광율을 6%로 조절한 처리구의 미기상 요인과 엽온의 상관관계를 분석한 결과, 엽온과 해가림 내부 기온의 상관계수는 6월은 0.976 (p < 0.01), 8월은 0.978 (p < 0.01)을 나타내었고, 해가림 내부 기온과 외부 광량의 상관계수는 6월은 0.903 (p < 0.01), 8월은 0.917 (p < 0.01)으로 유의한 정의 상관관계를 보였다.
해가림 내부의 투광율을 10%로 조절한 처리구의 엽온과 해가림 내부 기온의 상관계수는 6월은 0.986 (p < 0.01), 8월은 0.980 (p < 0.01)이었고, 해가림 내부 기온과 외부 광량의 상관계수는 6월은 0.906 (p < 0.01), 8월은 0.916 (p < 0.01)으로 유의한 정의 상관관계를 보였다 (Table 1). 따라서 외부 광량이 증가함에 따라 해가림 내부의 온도가 상승되고 이로 인해 인삼의 엽온이 높아지는 것으로 분석되었다.

The correlation between monthly leaf temperature (Ltemp.) in the 10% and 6% light intensity zone and external light intensity (ELI), internal light intensity (ILI), internal air temperature (Atemp.), internal wind speed (WS) and internal humidity (RH).
엽온과 상대습도는 -0.885 (p < 0.01)로 부의 상관을 나타내었다. 해가림 내부의 상대습도는 주간을 제외하고 야간에는 상대습도를 100%에 가까운 값으로 대기 중의 수분은 포화상태를 나타내었다 (Fig. 5).
대기중 상대습도가 높아지면 수증기압차이가 낮아지고 인삼 잎에서 대기중으로 증산 (발)을 통한 수분의 이동은 줄어들게 되어 잠열방출에 따른 잎의 냉각조건이 나빠지게 된다. 일반적으로 풍속이 높아짐에 따라 잎의 엽면경계층 저항을 감소시켜 엽온을 낮추는데 중요한 요인으로 작용한다 (Park, 2011). 높은 상대습도와 강한 광선 하에서는 증산작용이 저하되어 엽온을 낮추지 못한다 (Mellor et al., 1964). 그러므로 인삼의 엽온을 낮추기 위해서는 우선적으로 해가림 내부로 유입되는 광량을 줄이는 것이 가장 중요하지만 6월에는 태양의 남중고도가 가장 높은 계절로 일사 유입량이 가장 많고, 6월 이후부터 8월까지는 기온과 대기중 상대습도는 높은 수준을 나타내어 해가림 내부는 수증기압 차이가 낮은 대기상태를 나타낸다.
대기의 습도가 낮아져야 수증기압 차이가 높아서 증산작용이 활발해지고 엽온을 낮출 수 있으나 (Pallas et al., 1967), 인삼이 재배되는 해가림 구조는 하우스와 유사하게 외부와 차단되어 있으므로 상대습도가 높고, 통풍이 원활하지 못한 구조이다. 따라서 개량 울타리 설치, 고온기 측·후렴 개방과 해가림 전·후주의 높이를 현행 전주 180 ㎝, 후주 110 ㎝ 보다 높여서 통풍을 원활하게 것이 대안이 될 수 있을 것으로 생각된다.
4. 투광량 차이에 따른 엽색도, 광합성 효율과 근중의 변화
투광량 조절구별 엽색도 값과 광합성 효율의 차이는 Table 2와 같다. 투광율 6% 조절구의 엽색도 값은 36.3이고 투광율 10% 조절구의 엽색도 값은 26.1로 나타났다. 인삼재배 기간 중 4월 - 5월에 20% 이상의 광을 해가림 내부로 투과시켜도 해가림 내부 온도가 높지 않아서 인삼의 광합성 효율 증대에 효과적이다. 그러나 6월 - 8월에는 투광율이 10% 이상만 되어도 잎의 노화가 빨라진다고 하였다. Lee 등 (2010)의 실험에서도 고온기에 20% 이상의 광량에서 재배할 경우 잎의 노화로 인해 엽색도 값이 낮아진다는 보고와 동일하다.

Differences in leaf color, photosynthetic efficiency and root weight of ginseng in the 6% and 10% light intensity zones.
투광율 6% 조절구에서 광합성량은 1.948 μ㏖·m−2·s−1인 반면 투광율 10% 조절구의 광합성량이 1.730 μ㏖·m−2·s−1으로 낮았다. 10% 광량구의 광합성 효율이 6% 광량구 보다 낮은 이유는 고온에 의한 광계Ⅱ의 손상, 광 이용효율의 저하에 의한 것으로 생각되며 이러한 결과는 해가림 내부로 20% 이상의 광량이 투과되면 인삼은 고온에 의해 광계Ⅱ가 손상되어 과다한 광양자를 형광으로 소산시키지 못하게 되어 광이용 효율이 저하된다고 보고한 결과와 유사하였다 (Lee et al., 2011). 투광율 6% 조절구의 평균 근중은 82.2 g인 반면 10% 광량 조절구의 평균 근중 75.1 g으로 8.6% 증수 되었다 (Table 2). 투광량이 낮을 경우 인삼의 생육 후기에도 엽록소의 함량이 높고 노화가 늦어지고 후기 녹체성이 길어서 광합성 효율이 증대되고 결과적으로 수량의 증대와 연관이 있다 (Kumari et al., 2013).
이상의 결과에서 월별, 광량별 인삼의 엽온을 상승시키는 가장 중요한 요인으로 해가림 내부의 온도가 가장 큰 영향을 미치고, 해가림 내부의 온도 상승에는 외부의 광량이 가장 큰 영향을 주는 것으로 확인되었다. 따라서 외부의 광량이 해가림 내부로 들어오는 것을 인위적으로 줄여주는 것이 인삼의 엽온을 낮출 수 있는 방법이 된다. 또 바람이 약할 경우 인삼잎의 엽면경계층 저항이 강하게 되어 증산이 약해져 엽온이 상승하였다. 이와같이 엽온을 낮출 수 있는 추가적인 방법으로는 해가림 내부의 습도를 낮추고 풍속을 높이는 것 또한 중요한 것으로 판단된다.
본 실험을 통해서 인삼의 엽온을 낮추고 후기 녹체성과 광합성 효율 증진과 수량을 증대시키는 방법으로 해가림 내부로 투과되는 광량을 6% 정도로 조절하는 것이 인삼 생육에 가장 적합하였다. 앞으로 해가림 내부의 투광율을 6%로 조절하는 최적 시기와 기간에 대한 추가적인 연구가 더 필요할 것으로 생각된다.
References
- Bailey WG. (1990). The adaptation of ginseng production of semiarid environments: The example of british columbia, Canada. Journal of Ginseng Research. 14:297-309.
-
Blonder B and Michaletz ST. (2018). A model for leaf temperature decoupling from air temperature. Agricultural and Forest Meteorology. 262:354-360.
[https://doi.org/10.1016/j.agrformet.2018.07.012]

-
Curtis OF. (1936). Leaf temperature and the cooling of leaves by radiation. Plant Physiology. 11:343-364.
[https://doi.org/10.1104/pp.11.2.343]

-
Hirayama M, Wada Y and Nemoto H. (2006). Estimation of drought tolerance based on leaf temperature in upland rice breeding. Breeding Science. 56:47-54.
[https://doi.org/10.1270/jsbbs.56.47]

- Hyun DY and Yoo NH. (1996). Effect of leaf temperature on light response and respiration in Panax ginseng C. A. Meyer. Korean Journal of Crop Science. 41:725-728.
- Hyun DY, Hwang JK, Choi SY and Jo JS. (1993). Photosynthetic characteristics of Panax ginseng C. A. Meyer. Ⅰ. Photosynthetic response to change of light and leaf temperature. Korean Journal of Ginseng Science. 17:240-245.
-
Jang IB, Moon JW, Yu J, Jang IB, Suh SJ and Chun CH. (2019). Analysis of microclimate and high-temperature injury in ginseng as affected by shading. Korean Journal of Medicinal Crop Science. 27:278-283.
[https://doi.org/10.7783/KJMCS.2019.27.4.278]

-
Jha UC, Bohra A and Singh NP. (2014). Heat stress in crop plants: Its nature, impacts and integrated breeding strategies to improve heat tolerance. Plant Breeding. 133:679-701.
[https://doi.org/10.1111/pbr.12217]

-
Jochum GM, Mudge KW and Thomas RB. (2007). Elevated temperatures increase leaf senescence and root secondary metabolite concentrations in the understory herb Panax quinquefolius (Araliaceae). American Journal of Botany. 94:819-826.
[https://doi.org/10.3732/ajb.94.5.819]

-
Kumari M, Pudake RN, Singh VP and Joshi AK. (2013). Association of staygreen trait with canopy temperature depression and yield traits under terminal heat stress in wheat (Triticum aestivum L.). Euphytica. 190:87-97.
[https://doi.org/10.1007/s10681-012-0780-3]

-
Lee JG, Jeong YK and Yoon YC. (2020). Characteristics of leaf temperature in greenhouse strawberry based on light intensity and relative humidity. Journal of Agriculture and Life Science. 54:91-98.
[https://doi.org/10.14397/jals.2020.54.1.91]

-
Lee JS, Lee JH and Aho IO. (2010). Characteristics of resistant lines to high-temperature injury in ginseng(Panax ginseng C. A. Meyer). Journal of Ginseng Research. 34:274-281.
[https://doi.org/10.5142/jgr.2010.34.4.274]

- Lee SS, Proctor JTA and Choi KT. (1999). Influence of microclimate light on photosynthesis and leaf bleaching in Panax species. Journal of Ginseng Research. 23:1-7.
-
Lee SW, Kim GS, Hyun DY, Kim YB, Kim JW, Kang SW and Cha SW. (2011). Comparison of growth characteristics and ginsenoside content of ginseng(Panax ginseng C. A. Meyer) cultivated with greenhouse and traditional shade facility. Korean Journal of Medicinal Crop Science. 19:157-161.
[https://doi.org/10.7783/KJMCS.2011.19.3.157]

-
Lee SW, Park KC, Lee SH, Kim GS, Jang IB, Kim YB and Cha SW. (2013). Growth characteristics and ginsenoside contents of 6-year-old ginseng(Panax ginseng C. A. Meyer) by shade materials in paddy field. Korean Journal of Medicinal Crop Science. 21:118-123.
[https://doi.org/10.7783/KJMCS.2013.21.2.118]

-
Leinonen I and Jones HG. (2004). Combining thermal and visible imagery for estimating canopy temperature and identifying plant stress. Journal of Experimental Botany. 55:1423-1431.
[https://doi.org/10.1093/jxb/erh146]

-
Martin TA, Hinckley TM, Meinzer FC and Sprugel DG. (1999). Boundary layer conductance, leaf temperature and transpiration of Abies amabilis branches. Tree Physiology. 19:435-443.
[https://doi.org/10.1093/treephys/19.7.435]

-
Mellor RS, Salisbury FB and Raschke K. (1964). Leaf temperatures in controlled environments. Planta. 61:56-72.
[https://doi.org/10.1007/BF01895390]

-
Michaletz ST, Weiser MD, McDowell NG, Zhou J, Kaspari M, Helliker BR and Enquist BJ. (2016). The energetic and carbon economic origins of leaf thermoregulation. Nature Plants. 2:16129. https://www.nature.com/articles/nplants2016129, (cited by 2021 May 18).
[https://doi.org/10.1038/nplants.2016.147]

- Noffsinger TL. (1961). Leaf and air temperature under Hawaii conditions. Pacific Science. 4:304-306.
-
Pallas JE Jr, Michel BE and Harris DG. (1967). Photosynthesis, transpiration, leaf temperature, and stomatal activity of cotton plants under varying water potentials. Plant Physiology. 42:76-88.
[https://doi.org/10.1104/pp.42.1.76]

-
Park CS, Kang JY, Lee DY and Ahn DJ. (2008). Effect of furrow irrigation on the growth and quality of Panax ginseng plant in a loam. Journal of Ginseng Research. 32:279-282.
[https://doi.org/10.5142/JGR.2008.32.4.279]

-
Park YM. (2011). Leaf temperature characteristics being affected by light regimes. Journal of the Environmental Sciences. 20:1599-1605.
[https://doi.org/10.5322/JES.2011.20.12.1599]

- Rural Development Administration(RDA). (2012). Agricultural science technology standards for investigation of research. Rural Development Administration, Jeonju, Korea. p.759-770.
-
Seo YJ, Nam HY, Jang WC and Lee BY. (2018). Developing a model for estimating leaf temperature of Cnidium officinale Makino based on black globe temperature. Korean Journal of Medicinal Crop Science. 26:447-454.
[https://doi.org/10.7783/KJMCS.2018.26.6.447]

-
Shahenshah and Akihiro I. (2010). Effects of water stress on leaf temperature and chlorophyll fluorescence parameters in cotton and peanut. Plant Production Science. 13:269-278.
[https://doi.org/10.1626/pps.13.269]

-
Stathers RJ and Bailey WG. (1986). Energy receipt and partitioning in a ginseng shade canopy and mulch environment. Agricultural and Forest Meteorology. 37:1-14.
[https://doi.org/10.1016/0168-1923(86)90024-9]

-
Upchurch DR and Mahan JR. (1988). Maintenance of constant leaf temperature by plants-Ⅱ. Experimental observations in cotton. Environmental and Experimental Botany. 28:359-366.
[https://doi.org/10.1016/0098-8472(88)90060-3]

-
Yun SK, Kim SJ, Nam EY, Kwon JH, Do YS, Song SY, Kim MY, Choi YH, Kim GS and Shin HS. (2020). Evaluation of water stress using canopy temperature and crop water stress index(CWSI) in peach trees. Protected Horticulture and Plant Factory. 29:20-27.
[https://doi.org/10.12791/KSBEC.2020.29.1.20]


