갯방풍 지상부 용매 분획물의 비표적 대사체 프로파일링 및 항산화 활성
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The soft petiole of the Glehnia littoralis shoot is used as a raw material for food. It contains specific ingredients such as polyacetylene and coumarin. However, basic research considering their safety verification, efficacy, and ingredient identification is needed.
In this study, GC/MS compound profiling and LC/UVD were performed to evaluate the antioxidant activity of G. littoralis shoot extract fractions, and to identify the compounds contained therein. Total phenol and flavonoid content as well as antioxidant activity were maximum in the ethyl acetate layer, and a significant correlation was confirmed between total phenol content and antioxidant activity. GC/MS compound profiling, revealed a total of more than 40 compounds, and active ingredients such as coumarin-based phellopterin unique to G. littoralis and polyacetylene-based falcarinol (panaxinol) were qualitatively analyzed. The highest coumarin content was found in the ethyl acetate layer.
In this study, the antioxidant activity and compounds contained in the shoot (soft petiole) fractions of G. littoralis were confirmed. These basic data may contribute to expanding the material value of G. littoralis in the future.
Keywords:
Glehnia littoralis F. Schmidt ex Miq., Antioxidant Activity, Coumarin, Ethyl Acetate Fractions, Non-targeting Metabolic Profiling, Shoots서 언
노화는 시간이 흐름에 따라 개체의 기능이 퇴화되는 것을 말하며, 생물에서는 신체적 기능 손실 및 저하, 세포분열 능력의 상실로 다양한 질병을 초래하는 것으로 알려져 있다 (Naranjo et al., 2017; Kwon et al., 2021). 세포의 노화는 텔로미어 말단소립 기능장애, 종양유전자 활성화, 지속적인 DNA 손상, 산화 스트레스 등의 내·외생적 스트레스 반응에 의해 배아 발달 시기부터 노년기까지 광범위하게 일어나며, 노년기에 손상된 조직은 재생력 감소로 유기체 노화의 가속화를 유발 시킨다 (Micco et al., 2020; Helbling-Leclerc et al., 2021).
노화의 주요 원인인 산화 스트레스는 세포질과 미토콘드리아를 자극하여 유발되는 것으로 알려져 있으며, 세포막의 손상과 활성산소의 증가는 산화 스트레스를 증대시키고, DNA 핵 손상과 미토콘드리아의 산화적 인산화 저해로 세포를 사멸시키는 것으로 알려져 있다 (Hanzhi et al., 2017; Oh et al., 2020).
식물에 함유된 이차대사산물인 phytochemical은 생리적 활성을 나타내는 주요성분으로 유기황화합물, 테르펜, 폴리페놀, 유기산, 다당체, 지질로 구분된다. 이중 항산화 효과를 나타내는 폴리페놀은 플라보노이드, 이소플라본, 안토시아닌, 페놀산, 스틸벤 등으로 분류된다. 이차대사산물은 식물체에서 유전적 요인, 환경적 요인에 의해 생합성되는 것으로 알려져 있지만, 대부분 환경적 요인의 영향이 큰 부분을 차지하고, 알칼로이드, 글리코사이드, 스테로이드, 에센셜 오일 등의 활성 성분의 양적 변화가 나타나는 것으로 알려져 있다 (Zargoosh et al., 2019; Kim et al., 2020).
염생식물은 생육지 토양에 집적된 염분농도, 흡수된 염의 대사방법 등 염에 대한 적응성이 중성식물에 비해 높은 식물을 말하며, 계절변동과 생육지의 환경에 따라 형태적인 변이가 큰 것으로 알려져 있다 (Min, 1990). 염생식물은 직·간접적으로 염분이 식물체에 유입되는 독특한 생태계 구조에서도 생존 가능하며, 육상식물들과 다른 이차대사산물들을 함유하는 것으로 알려졌지만, 효능 및 성분에 관한 다양한 연구가 이루어지지 않고 있다 (Lee et al., 2004). 2019년 국가해양생태계종합조사에 따르면 국내에서 자생하는 염생식물은 72 종으로 확인되었고, 3 면의 해안에서 총 1,813,536 ㎡의 분포 면적을 차지하는 것으로 보고되었다 (Lee et al., 2019).
염생식물 중 갯방풍 (Glehnia littoralis Fr. Schmidt ex Miquel)은 국내 자생하는 다년생 해양 초본식물로 일본, 중국, 만주, 사할린, 오호츠크, 쿠릴열도 및 북미 캘리포니아에서 알래스카까지 태평양 연안에 분포하며 (Kim et al., 2005; Choo et al., 2008), 해양의 영향을 강하게 받는 바닷가 해안사구에 서식한다. 갯방풍 연구는 β-sitosterol과 bergapten을 추출해 낸 것을 시작으로 (Seo and Ryu, 1977), polyacetylene 화합물인 falcarindiol, falcarinol, coumarin 화합물인 bergapten, xanthotoxin, umbelliferone, scopoletin, 그리고 sesquiterpene 화합물인 (5β,10α)-Lasidiol angelate 등이 보고되었고 (Um et al., 2010) 함유된 정유물질은 항생 (Shin et al., 2005), 추출물은 항염 (Yoon et al., 2010) 및 항암 (de la Cruz et al., 2015)의 효과가 보고되었다.
현재, 갯방풍은 지상부 연한 잎자루만 식품공전에 식용할 수 있는 원료로 사용이 가능한 상태이며 (MFDS, 2021), 유효성, 성분규명 등에 관한 다양한 연구가 이루어지지 않은 상태이다.
따라서, 본 연구에서는 갯방풍 지상부 (연한 잎자루) 추출물 및 분획물의 항산화 생리활성 평가와 함유된 compound의 GC/MS non-targeting 정성분석과 LC/UVD 정량분석을 실시하여, 염생식물 갯방풍의 소재적 가치를 검증하고 활용범위를 확장하고자 시험을 수행하였다.
재료 및 방법
1. 재료
실험에 사용한 갯방풍은 2019년 5월에 강원도 강릉시 (위도 37.84083, 경도 128.65416)에서 재배된 갯방풍 (G. littoralis Fr. Schmidt ex Miquel, Solnaemall, Gangneung, Korea) 지상부를 건조하여 사용하였다.
건조에 사용된 열풍건조기는 KED-132A (Kiturami Co., Ltd., Cheongdo, Korea), 추출에 사용된 에탄올은 95% 발효주정 (Daehan Ethanol Life Co., Ltd., Hwasung, Korea)을 사용하였고, 추출기는 COSMOS-660 (Kyumgseo E&P, Incheon, Korea), 감압농축기는 R-220 pro set (Büchi, Postfach, Switzerland), 동결건조기는 PVTFD 300R (Ilshinbiobase, Yangju, Korea)을 이용하였다. 이외에 분획에 사용된 용매는 Thermo fisher scientific (Waltham, MS, USA), 생리활성에 사용된 시약은 Sigma-aldrich (St. Louis, MO, USA) 제품을 사용하였다.
2. 추출물 제조 및 용매별 분획
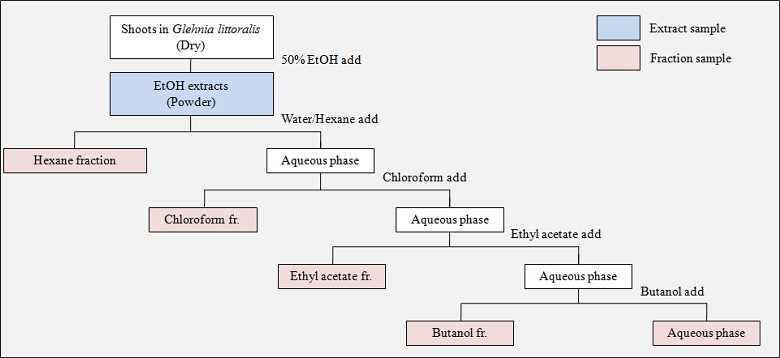
추출물은 갯방풍 지상부 건조물 2.5 ㎏에 50% 에탄올 50 ℓ를 첨가하고 50℃에서 5 시간 동안, 5 회 반복 추출한 후, 농축, 동결건조 한 분말을 시료로 사용하였다.
용매별 분획은 Jeon 등 (2012)의 방법을 변형하여 실시하였고, 위의 분말 시료 10 g을 증류수 500 ㎖에 용해한 후, 비극성 용매 n-hexane과 1 : 1로 혼합한 다음, 수층과 n-hexane 층이 나뉘도록 방치하여 n-hexane 층을 분리하였다. 동일한 방법으로 총 3 회 추출하여 n-hexane 분획물을 얻었다. 이후 수층에 chloroform, ethyl acetate, BuOH을 차례로 넣어 각각 추출하였다. 이때, 추출용매는 남은 용액과 동일한 양으로 첨가하였다.
n-hexane, chloroform, ethyl acetate, BuOH, 물층 순으로 극성의 차이를 이용한 분획물을 수득한 후, 분획물별로 농축, 동결건조하여 폴리페놀 함량 및 항산화활성 검정, LC/UVD를 이용한 coumarin 계열 정량분석의 시료로 사용하였다 (Fig. 1).
3. 폴리페놀 함량
총 페놀은 Folin & Ciocalteu의 방법을 변형한 Singleton 등 (1999)의 방법으로 갯방풍 지상부의 50% 에탄올 추출물과 용매별 분획물 (n-hexane, chloroform, ethyl acetate, BuOH, 물층)의 함량을 비교하였다.
시료 100 ㎕ (1 ㎎/㎖)에 Folin-ciocalteu's phenol 50 ㎕를 혼합하여 상온에서 5 분간 반응시키고, 이후, 20% sodium carbonate 300 ㎕를 첨가하여 상온에서 15 분간 추가로 반응시켰다. 반응이 종료된 후, 증류수 1 ㎖를 첨가하여 UV/Vis spectrophotometer (UMBS0300-3040, Molecular Devices, San jose, CA, USA)로 740 ㎚에서 흡광도를 측정하였다.
표준물질 gallic acid는 0, 100, 150, 250, 350, 500 ㎍/㎖ 농도로 희석하여 검량선 (y = 0.002x + 0.017, R2 = 0.999)을 작성하였고, gallic acid equivalents (㎎·GAE/g)로 정량값을 산출하였다.
총 플라보노이드는 Chandra 등 (2014)의 방법으로 50% 에탄올 추출물, 용매별 분획물의 함량을 비교하였다.
1 M potassium acetate 100 ㎕에 10% aluminum nitrate 100 ㎕을 혼합하고, 시료 500 ㎕ (1 ㎎/㎖)를 첨가하여 상온에서 40 분간 반응시키고, UV/Vis spectrophotometer (UMBS0300-3040, Molecular Device, San jose, CA, USA)를 이용하여 510 ㎚에서 흡광도를 측정하였다.
표준물질 quercetin은 0, 10, 25, 50, 100, 200 ㎍/㎖ 농도로 희석하여 검량선 (y = 0.004x + 0.035, R2 = 0.999)을 작성하였고, quercetin equivalents (㎎·QUE/g)로 정량 값을 산출하였다.
4. 항산화 활성
DPPH 소거능은 Clarke 등 (2013)의 방법으로 50% 에탄올 추출물, 용매별 분획물의 활성을 비교하였다.
농도별로 희석한 시료 100 ㎕와 1.5 mM DPPH 100 ㎕를 30 분간 암실 반응시키고, UV/Vis spectrophotometer (UMBS0300-3040, Molecular Device, San Jose, CA, USA)를 이용하여 517 ㎚에서 흡광도를 측정하였다. 양성대조군은 ascorbic acid를 사용하였고, 최대효과 50% 소거하는데 필요한 농도인 half maximal effective concentration (EC50)으로 활성 값을 산출하였다.
ABTS 소거능은 Ozgen 등 (2006) 방법으로 50% 에탄올 추출물, 용매별 분획물의 활성을 비교하였다. 2.6mM potassium persulfate와 7.4mM ABTS를 1 : 1 비율로 혼합한 후, 15 시간동안 암상태로 반응시켜 ABTS 용액을 제조하였다.
농도별로 희석한 시료 100 ㎕와 ABTS 용액 90 ㎕를 혼합하여 10 분간 상온에서 반응시킨 후, UV/Vis spectrophotometer (UMBS0300-3040, Molecular Device, San jose, CA, USA)를 이용하여 734 ㎚에서 흡광도를 측정하였다. 양성대조군은 ascorbic acid를 사용하였고, EC50으로 활성 값을 산출하였다.
SOD 유사활성은 Marklund and Marklund (1974)의 방법으로 50% 에탄올 추출물, 용매별 분획물의 활성을 비교하였다.
1,000 ㎍/㎖의 농도로 제조된 시료 40 ㎕에 Tris-HCl buffer (50 mM Tris + 10 mM EDTA, pH 8.5) 200 ㎕와 7.2 mM pyrogallol 10 ㎕를 혼합한 후, 25℃에서 10 분간 반응시켰다. 1 M HCl 10 ㎕를 가하여 반응을 종료시킨 후, UV/Vis spectrophotometer (UMBS0300-3040, Molecular Device, San jose, CA, USA)를 이용하여 420 ㎚에서 흡광도를 측정하였다.
양성대조군은 ascorbic acid를 사용하였고, 시료 첨가군과 미첨가군의 흡광도 차이를 백분율 (%)로 하여 활성을 산출하였다.
5. Gas chromatography/mass spectrometry (GC/MS) 정성분석
갯방풍 지상부의 50% 에탄올 추출물에 대한 비표적 대사체 분석 프로파일링 (non-targeting metabolic profiling)은 GC/MS로 실시하였다.
갯방풍 지상부를 50% 에탄올로 추출, 농축, 동결건조한 후, 분말 시료에 n-hexane을 첨가하여, 10,000 ㎍/㎖ 농도로 제조한 후, 적정한 농도로 희석하여 수행하였다.
GC는 6890N GC system (Agilent Technologies Inc., Santa Clara, CA, USA) MS는 Pegasus Ⅳ (LECO Co., St. Joseph, MI, USA)을 이용하였고, Column은 Agilent GC column DB-5MS (30 m × 25 m, 0.2㎛, Agilent Technologies Inc., Santa Clara, CA, USA)을 사용하였으며, Table 1과 같은 조건으로 정성분석을 실시하였다.
6. LC/UVD 정량분석
Compound 중 coumarin 계열 정량분석은 50% 에탄올 추출물, 용매별 분획물로 나누어 L C/UVD로 실시하였다. UltiMate 3000 HPLC system (Thermo Fisher Scientific Inc., San Jose, CA, USA)을 사용하였고, 컬럼은 (5 ㎛, 250 ㎜ × 4.6 ㎜, Bischoff Analysentechnik und -geräte GmbH., Böblinger, Leonberg, Garmany)을 사용하였다. 이동상은 water (A)와 acetonitrile (B)로 농도 구배에 따른 기울기 용리 조건 (0 - 5 min: 80% A, 5 - 60 min: 80 → 0% A, 60-70 min: 0% A, 70-71 min: 0 → 80% A, 71 - 80 min: 80% A)을 설정한 후, 컬럼 온도 30℃, 유속 1.0 ㎖/min, 주입량 10 ㎕, 검출파장 203 ㎚로 분석하였다.
표준물질은 sigma-aldrich의 scopoletin, umbelliferone, imperatorin과 chemfaces의 phellopterin을 구입하였고, 5 point 농도범위에서 표준곡선을 작성한 후 얻은 회귀식 (scopoletin y = 0.482x + 0.077, R2 = 0.999, umbelliferone y = 1.005x + 0.027, R2 = 0.999, imperatorin y = 0.996x + 0.017, R2 = 0.999, phellopterin y = 0.993x + 0.010, R2 = 0.999)에 값을 대입하여 정량값을 산출하였다.
7. 통계처리
실험은 3 회 반복으로 진행하였으며, 평균 ± 표준편차를 나타내었다. 시험 결과와 관련된 통계처리는 SPSS program (Statistical Package for Social Science, Version 24, IBM, Chicago, IL, USA)을 이용하여 분산분석(ANOVA)으로 5% 수준에서 Duncan`s Multiple Range Test (DMRT)에 의하여 대조군과 시험군 간의 유의차를 검증하였다 (p < 0.05).
결과 및 고찰
1. 폴리페놀 함량
갯방풍 (G. littoralis Fr. Schmidt ex Miquel) 지상부 분획 (Fig. 1)의 총 페놀 함량은 chloroform < hexane < 물층 < BuOH < ethyl acetate 순으로 8.44, 10.55, 14.92, 50.20, 72.52 ㎎·GAE/g, 총 플라보노이드 함량은 물층 < chloroform < hexane < BuOH < ethyl acetate 순으로 2.48, 3.09, 5.49, 17.40, 21.61 ㎎·QCT/g이 검출되었다. 총 페놀, 플라보노이드 모두 ethyl acetate 분획물에서 가장 높은 함량을 나타내었다 (Table 2).
2. 항산화 활성
분획물 (Fig. 1)의 DPPH radical 소거능은 chloroform < hexane < 물층 < BuOH < ethyl acetate 순으로 856.49, 608.12, 208.69, 108.56, 81.72㎍/㎖, ABTS 소거능은 chloroform < hexane < 물층 < BuOH < ethyl acetate 순으로 1250.13, 880.06, 293.19, 119.24, 113.26 ㎍/㎖ EC50이 측정되었다. DPPH, ABTS 모두 ethyl acetate 분획물에서 가장 높은 소거능을 나타내었다 (Table 2).
식물에 함유된 폴리페놀성 화합물은 고유한 색을 나타내고, 단백질 및 다른 분자들과 결합하는 phenolic hydroxyl group (Choi et al., 2011)은 대체적으로 중간 극성을 나타내어 ethyl acetate 층에서 함량이 높은 것으로 알려져 있다 (Kim et al., 2019).
산복사나무, 열처리 양파, 배초향 및 레몬그라스 분획물의 활성을 비교한 선행연구에서도 ethyl acetate 분획물의 총 페놀, 플라보노이드 추출수율이 높았고, 이에 따라 항산화 활성이 증가되는 것을 확인하였다 (Lee et al., 2007; Kim et al., 2012; Kim et al., 2017; Hacke et al., 2018). 또한, 염생식물 칠면초에서도 ethyl acetate 분획물의 높은 폴리페놀 함량과 항산화 활성의 상관관계가 확인되었다 (Choi et al., 2009).
본 시험에서도 선행연구와 유사한 것을 보았을 때, ethyl acetate 층의 높은 폴리페놀 함량에 의해 항산화 활성이 증가되는 것으로 생각되어진다.
분획물 (Fig. 1)의 SOD 유사활성 결과, 시료 농도 1,000 ㎍/㎖를 처리하였을 때, chloroform < hexane <물층 < BuOH < ethyl acetate 순으로 10.60, 12.98, 19.12, 40.83, 45.63% 활성이 측정되었다 (Table 2).
Jeon 등 (2012)은 참취 분획물의 SOD 측정값을 비교하였을 때, ethyl acetate 분획물 42.8% (농도 1,000 ㎍/㎖), Kwon 등 (2020)은 도라지 ethyl acetate 분획물 22.5% (농도 500 ㎍/㎖)로 총 페놀이 다량 함유되어 ethyl acetate 층이 높은 활성을 나타낸다고 보고하였다.
반면, 염생식물 50% 메탄올 전초 추출물의 SOD 유사활성을 측정한 Park (2006)은 갯까치수영 22.36%, 실망초 20.09%, 갯능쟁이 17.74%, 통보리사초 16.49%를 나타내었고, 본 실험에서는 50% 에탄올 지상부 추출물이 36.74%를 나타내어, 염생식물 중에 상대적으로 SOD 유사활성이 높은 것으로 확인되었다.
Superoxide는 체내에서 가장 많이 발생하는 활성 산소이며, 체내 SOD 효소는 활성산소를 과산화수소로 전환시키는 반응을 촉매하며, 이후 catalase와 peroxidase에 의해 물분자와 산소분자로 전환된다. 또한 SOD 효소와 다르지만 체내에서 이와 유사한 역할을 하는 물질을 SOD 유사활성물질이라 부른다 (Kim et al., 1994; Park, 2006). 본 시험의 갯방풍 50% 에탄올 추출물과 분획물의 SOD 유사활성 결과는 SOD나 SOD 유사물질들에 의해 자동산화가 억제되어 활성을 나타낸 것으로 생각되어진다.
추출물과 분획물 (Fig. 1)의 총 페놀 및 플라보노이드 함량과 항산화 활성 간의 상관관계는 Table 3과 같다.

Correlations between poly phenol and flavonoid contents and antioxidant activities of shoots extract and fractions from G. littoralis.
이중, 항산화 활성이 높은 ethyl acetate 분획물의 총 페놀과 DPPH, ABTS는 r = 0.990, r = 0.976으로 유의적인 상관관계를 나타내었고 (p < 0.01), DPPH와 ABTS 라디칼 소거능에서는 r = 0.934의 유의적 상관관계를 나타내었다 (p < 0.05). 반면, 총 플라보노이드와 SOD 유사활성에서는 유의적인 상관관계가 없는 것으로 나타났다.
총 페놀과 플라보노이드는 free radical을 소거할 수 있는 주요성분으로 알려져 있고, DPPH와 ABTS와의 상관관계를 통하여 항산화 활성을 검증하는 것으로 알려져 있다 (Esmaeili et al., 2015). Jeon 등 (2012)은 free radical 소거능, 효소적 반응, 환원적 반응 항산화를 비교한 시험에서 ethyl acetate에서 최대의 활성을 나타내었고, 총 페놀 및 플라보노이드와 항산화 활성과의 상관관계를 검증하였다. Park과 Kim (2017)은 서목태 발효물 (영지 균사체)에서 폴리페놀과 DPPH, ABTS의 유의적인 상관관계를 검증하였다. 또한, Jang 등 (2012)은 약초 추출물의 총 폴리페놀과 ABTS 라디칼 소거능 (r = 0.915)과 DPPH 라디칼 소거능 (r = 0.750)의 상관관계를 나타내었으며, 플라보노이드 양과 DPPH 라디칼 소거능 (r = 0.514)과 환원력 (r = 0.674)의 상관관계를 검증하였다.
3. GC/MS 정성분석
갯방풍 지상부에 함유된 compound profiling 결과, 총 40여종 compound가 확인되었고, 이중 19 종 compound (α-phellandrene, 4-isopropyl-2-cyclohexenone, 2,4-di-tert-butylphenol, 3,7,11,15-tetramethyl-2-hexadecen-1-OL, palmitic acid, methyl linolenate, ledene oxide-(I), phytol, linoleic acid, falcarinol, imperatorin, DL-alpha-tocopherol acetate, stigmasterol, 2-linoleoylglycerol, methyl (Z)-5,11,14,17-eicosatetraenoate, campesterol, 2-palmitoylglycerol, i-propyl 6,9,12-hexadecatrienoate, phytyl acetate)는 다른 compound에 비해 다량 검출되는 것을 확인할 수 있었다 (Fig. 2 and Table 4).
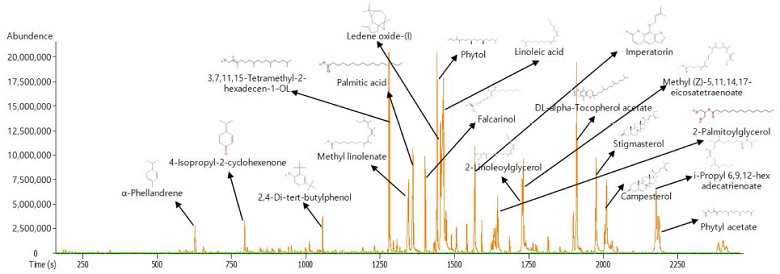
GC/MS compounds chromatogram of non-targeting metabolic profiling in n-hexane extract from G. littoralis shoots.

GC/MS qualitative analysis compounds of non-targeting metabolic profiling in n-hexane extract from G. littoralis shoots.
총 40 여종 compound는 fatty acid, terpenoids, coumarin, fatty alcohol, sterol, vitamin, polyacetylene, glycerol, wax ester, sesquiterpenes 등으로 확인되었으며, 갯방풍 특유의 유효 성분 coumarin 계열 phellopterin, imperatorin, isopimpinellin과 polyacetylene 계열 falcarinol (panaxinol)이 정성분석 되었고, 갯방풍 생육 및 대사산물 합성 경로에 대한 추가적인 연구가 수행되어야 할 것으로 생각되어진다.
4. LC/UVD 정량분석
갯방풍 지상부에 함유된 coumarin 4 종 성분을 측정한 결과, 50% 에탄올 추출물에서는 scopoletin 2.11 ㎎/g, umbelliferone 0.09 ㎎/g, imperatorin 0.47 ㎎/g, phellopterin 0.02 ㎎/g이 검출되었다. 4종의 coumarin 성분 중 scopoletin이 다량 함유되어 있는 것을 확인하였다. 반면, 분획물 (Fig. 1)의 coumarin 4종 성분을 측정한 결과, 물층 < BuOH < chloroform < hexane < ethyl acetate 순으로 불검출, 0.53, 0.54, 1.07, 4.46 ㎎/g의 총 함량이 측정되었다 (Fig. 3 and Table 5).
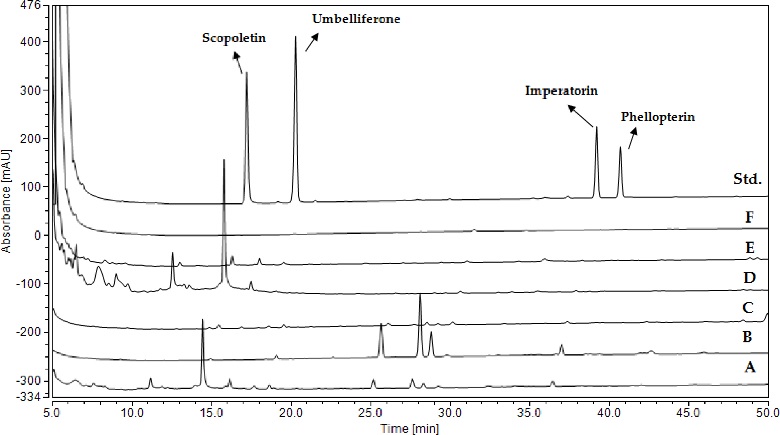
LC/UVD targeting compounds chromatogram of extract and solvent fractions from G. littoralis shoots.Representative LC/UVD chromatograms of coumarin type detected from shoots extract and fractions from G. littoralis. Std; standard coumarin chromatogram, A; 50% ethanol extraction, B; hexane fraction, C; chloroform fraction, D; ethyl acetate fraction, E; BuOH fraction, F; aqueous fraction.
분획물에서는 50% 에탄올 추출물과는 달리 phellopterin 검출되지 않았다. 이중, ethyl acetate 층에서는 scopoletin이 4.28 ㎎/g으로 다량 함유되어 있는 것이 확인되었고, haxane층의 chromatogram을 확인하였을 때, coumarin 4종 성분 이외에 정량되지 않은 미지의 peak들이 측정되어, 향후 추가적인 시험이 필요할 것으로 사료된다.
Um 등 (2010)은 갯방풍에서 scopoletin과 umblliferone을 분리하였고, 분리한 scopoletin 50 μM 농도에서 H2O2만 처리한 대조군 대비 약 60% 이상 reactive oxygen species (ROS) 소거능을 나타내었다. Chang 등 (1995)은 umbelliferone이 xanthine oxidase (XO) 억제에 매우 중요한 역할을 한다고 보고하였으며, Budzynska 등 (2015)는 imperatorin이 scopolamin에 의해 유발된 기억장애에 대해 보호할 수 있다고 보고하였다. 또한, Li 등 (2007)은 phellopterin이 전압 개폐형 및 수용체 의존성 칼슘 채널의 자극에 유도된 Ca2+ 유입을 억제한다고 보고하였으며, coumarin 계열은 항산화, 기억장애 보호 및 항균·함염 등의 활성이 보고되어지고 있다 (Ryu et al., 2001; Kontogiorgis and Hadjipavlou-Litina, 2005).
식물에는 다양한 항산화 성분이 함유되어 있고, 이러한 항산화 성분은 산화적 스트레스 및 신호로부터 식물체를 보호하는데 중요한 역할을 하며, 섭취 시에는 천연 항산화제의 역할을 하여 질병 예방에 도움을 줄 수 있지만 (Kasote et al., 2015), 항산화제 효능·효과, 경제성, 공급의 한계성과 같은 이유로 합성된 소재들이 사용되어왔다. 하지만, 안전성 및 소비자의 거부감으로 인하여 천연물 (육상, 해양식물) 자원 유래의 천연 항산화제 개발의 시도가 늘어나고 있다 (Park and Kweon, 2013).
본 시험에서 수행한 갯방풍 지상부 분획물에 대한 기초적인 생리활성 검증과 지상부에 함유된 compounds를 확인하였고, 분획 방법에 따른 유효성분 함량 변화를 측정하였다. 추가적인 연구를 통해 scopoletin, umbelliferone, phellopterin, imperatorin 외의 coumarin 계열의 compounds 분석 및 유효성 검증을 수행한다면, 기능성 소재로서의 가치와 해양식물의 활용도가 증가할 수 있을 것으로 생각되어진다.
References
-
Budzynska B, Boguszewska-Czubar A, Kruk-Slomka M, Skalicka-Wozniak K, Michalak A, Musik I and Biala G. (2015). Effects of imperatorin on scopolamine-induced cognitive impairment and oxidative stress in mice. Psychopharmacology. 232:931-942.
[https://doi.org/10.1007/s00213-014-3728-6]

-
Chandra S, Khan S, Avula B, Lata H, Yang MH, Elsohly MA and Khan IA. (2014). Assessment of total phenolic and flavonoid content, antioxidant properties, and yield of aeroponically and conventionally grown leafy vegetables and fruit crops: A comparative study. Evidence-Based Complementary and Alternative Medicine. 2014:253875. https://www.hindawi.com/journals/ecam/2014/253875/, (cited by 2021 July 27).
[https://doi.org/10.1155/2014/253875]

- Chang WS and Ciang HC. (1995). Structure-activity relationship of coumarins in xanthine oxidase inhibition. Anticancer Research. 15:1969-1973.
-
Choi JI, Kim YJ, Kim JH, Song BS, Yoon YH, Byun MW, Kwon JH, Chun SS and Lee JW. (2009). Antioxidant activities of the extract fractions from Suaeda japonica. Journal of the Korean Society of Food Science and Nutrition. 38:131-135.
[https://doi.org/10.3746/jkfn.2009.38.2.131]

-
Choi SJ, Cho EA, Cho EH, Jeong YJ, Ku CS, Ha BJ and Chae HJ. (2011). Screening of functional materials from solvent fractions of apple flower leaf extract. Korean Society for Biotechnology and Bioengineering Journal. 26:165-171.
[https://doi.org/10.7841/ksbbj.2011.26.2.165]

- Choo BK, Ji YU, Moon BC, Kim B, Lee AY, Yoon TS, Song HK and Kim HK. (2008). Ecological characteristics and native preservation method of Glehnia littoralis community in Korea coast. Journal of the Korean Society of Environmental Restoration Technology. 11:38-48.
-
Clarke G, Ting KN, Wiart C and Fry J. (2013). High correlation of 2,2-diphenyl-1-picrylhydrazyl(DPPH) radical scavenging, ferric reducing activity potential and total phenolics content indicates redundancy in use of all three assays to screen for antioxidant activity of extracts of plants from the malaysian rainforest. Antioxidants. 2013:2. https://www.mdpi.com/2076-3921/2/1/1, (cited by 2021 Oct. 10).
[https://doi.org/10.3390/antiox2010001]

-
de la Cruz JF, Vergara EJS, Cho YR, Hong HO, Oyungerel B and Hwang SG. (2015). Glehnia littoralis root extract induces G0/G1 phase cell cycle arrest in the MCF-7 human breast cancer cell line. Asian Pacific Journal of Cancer Prevention. 16:8113-8117.
[https://doi.org/10.7314/APJCP.2015.16.18.8113]

-
Esmaeili AK, Taha RM, Mohajer RM and Banisalam B. (2015). Antioxidant activity and total phenolic and flavonoid content of various solvent extracts from in vivo and in vitro grown Trifolium pratense L.(Red Clover). BioMed Research International. 2015:643285. https://www.hindawi.com/journals/bmri/2015/643285/, (cited by 2021 Oct 10).
[https://doi.org/10.1155/2015/643285]

-
Hacke ACM, Marques JA, Vellosa JCR, Boligon AA, da Silva FD, de Souza D, Bonini JS, Rocha JBT and Pereira RP. (2018). Ethyl acetate fraction of Cymbopogon citratus as a potential source of antioxidant compounds. New Journal of Chemistry. 42:3642-3652.
[https://doi.org/10.1039/C7NJ04352J]

-
Hanzhi L, Hou-Hsien C, Makensie L, Albert S and Danica C. (2017). Nutrient sensing and the oxidative stress response. Trends in Endocrinology and Metabolism. 28:449-460.
[https://doi.org/10.1016/j.tem.2017.02.008]

-
Helbling-Leclerc A, Garcin C and Rosselli F. (2021). Beyond DNA repair and chromosome instability-Fanconi anaemia as a cellular senescence-associated syndrome. Cell Death and Differentiation. 28:1159-1173.
[https://doi.org/10.1038/s41418-021-00764-5]

-
Jang GY, Kim HY, Lee SH, Kang YR, Hwang IG, Woo KS, Kang TS, Lee JS and Jeong HS. (2012). Effects of heat treatment and extraction method on antioxidant activity of several medicinal plants. Journal of the Korean Society of Food Science and Nutrition. 41:914-920.
[https://doi.org/10.3746/jkfn.2012.41.7.914]

-
Jeon SM, Lee JY, Kim HW, Lee YM, Jang HH, Hwang KA, Kim HR and Park DS. (2012). Antioxidant activity of extracts and fractions from aster scaber. Journal of the Korean Society of Food Science and Nutrition. 41:1197-1204.
[https://doi.org/10.3746/jkfn.2012.41.9.1197]

-
Kasote DM, Katyare SS, Hegde MV and Bae HH. (2015). Significance of antioxidant potential of plants and its relevance to therapeutic applications. International Journal of Biological Sciences. 11:982-991.
[https://doi.org/10.7150/ijbs.12096]

- Kim BM, Han YE and Lee HJ. (2017). Antioxidant and antiinflammatory effects of the ethyl acetate fraction of the Agastache rugosa extract. Korean Journal of Food Science and Technology. 49:331-337.
-
Kim CJ, Choi JH, Oh YS, Seong ES, Lim JD, Yu CY and Lee JG. (2020). Enhancement and conversion of ginsenoside contents in cultured wild ginseng adventitious root. Korean Journal of Medicinal Crop Science. 28:455-454.
[https://doi.org/10.7783/KJMCS.2020.28.6.445]

- Kim KC, Eom TK and Kim JS. (2019). Polyphenol contents and anti-oxidant activity of fruit extracts from Daphniphyllum macropodum. International Journal of Advanced Engineering. 12:149-155.
-
Kim SJ, Han DS, Park MH and Rhee JS. (1994). Screening for superoxide dismutase-like compounds and its activators in extracts of fruits and vegetables. Bioscience, Biotechnology, and Biochemistry. 58:2263-2265.
[https://doi.org/10.1271/bbb.58.2263]

- Kim SM, Shin DI, Song HS, Kim SK and Yoon ST. (2005). Geographical distribution and habitat characteristics of Glehnia littoralis Fr. Schmidt in South Korea. Korean Journal of Medicinal Crop Science. 13:171-177.
-
Kim WB, Park SH, Hwang HS, Woo JY, Lee HR, Hwang DY, Choi JH and Lee HS. (2012). Antioxidative activities and whitening effects of solvent fraction from Prunus davidiana (Carriere) Franch. Fruit. Journal of the Korean Society of Food Science and Nutrition. 41:1363-1370.
[https://doi.org/10.3746/jkfn.2012.41.10.1363]

-
Kontogiorgis CA and Hadjipavlou-Litina DJ. (2005). Synthesis and antiinflammatory activity of coumarin derivatives. Journal of Medicinal Chemistry. 48:6400-6408.
[https://doi.org/10.1021/jm0580149]

-
Kwon KC, Oh YS, Kim CJ, Yu CY and Lee JG. (2021). Biological activities and anti-wrinkle effects of Pinus koraiensis Siebold et Zucc. leaf extract. Korean Journal of Medicinal Crop Science. 29:117-123.
[https://doi.org/10.7783/KJMCS.2021.29.2.117]

- Kwon KM, Kim JH, Yang JH, Ki BH, Hwang IH and Kim DK. (2020). Antioxidant activity of ethyl acetate fraction of the Guzeunggupo procossed Platycodon grandiflorum A. De Candolle roots in Caenorhabditis elegans. Korean Journal of Pharmacognosy. 51:325-331.
- Lee BK, Han MS, Jung YK, Rha ES, Yun SJ and Yoo NH. (2004). Comparative effect of plant growth regulators on callus induction and plant regeneration in Glehnia littoralis Schmidt et Miquiel. Korean Journal of Plant Resources. 17:153-160.
- Lee MS, Kim SH and Jung HI. (2019). Distribution patterns of halophytes in the coastal area in Korea. Journal of the Korean Society Oceanography. 24:139-159.
- Lee YR, Hwang IG, Woo KS, Kim DJ, Hong JT and Jeong HS. (2007). Antioxidative activities of the ethyl acetate fraction from heated onion(Allium cepa). Food Science and Biotechnology. 16:1041-1045.
-
Li H, He L and Qiu J. (2007). Effects of the Chinese herb component phellopterin on the increase in cytosolic free calcium in PC12 cells. Drug Development Research. 68:79-83.
[https://doi.org/10.1002/ddr.20169]

-
Marklund S and Marklund G. (1974). Involvement of superoxide anion radical in the oxidation of pyrogallol and a convenient assay for superoxide dismutase. European Journal of Biochemistry. 47:469-474.
[https://doi.org/10.1111/j.1432-1033.1974.tb03714.x]

-
Micco RD, Krizhanovsky V, Baker D and Fagagna FDD. (2020). Cellular senescence in ageing: From mechanisms to therapeutic opportunities. Nature Reviews Molecular Cell Biology. 22:75-95.
[https://doi.org/10.1038/s41580-020-00314-w]

- Min BM. (1990). On the accumulation of minerals with the plant species in a reclaimed land. Korean Journal of Ecology. 13:9-18.
- Ministry of Food and Durg Safety(MFDS). (2021). Food code 2021. Ministry of Food and Drug Safety. Cheongju, Korea. p.1-17.
-
Naranjo JD, Dziki JL and Badylak SF. (2017). Regenerative medicine approaches for age-related muscle loss and sarcopenia: A mini-review. Gerontology. 63:580-589.
[https://doi.org/10.1159/000479278]

-
Oh YS, Choi JH, Kim CJ, Seong ES, Kim MJ, Yu CY and Lee JG. (2020). Changes of biological activities of rhizome and leaves of Polygonatum sibiricum redoute according to steaming rime and temperature. Korean Journal of Medicinal Crop Science. 28:331-338.
[https://doi.org/10.7783/KJMCS.2020.28.5.331]

-
Ozgen M, Reese RN, Jr Tulio AZ, Scheerens JC and Miller AR. (2006). Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(abts) method to measure antioxidant capacity of Selected small fruits and comparison to ferric reducing antioxidant power(FRAP) and 2,2'-diphenyl-1-picrylhydrazyl(DPPH) methods. Journal of Agricultural and Food Chemistry. 54:1151-1157.
[https://doi.org/10.1021/jf051960d]

-
Park JH and Kweon GR. (2013). Clinical applications of antioxidants. Hanyang Medical Reviews. 33:130-136.
[https://doi.org/10.7599/hmr.2013.33.2.130]

- Park JW. (2006). Antioxidative activities and activecompounds in the roots of turkestan rose(Rosa rugosa Thunberg var. rugosa). Mokpo National University. Ph.D. Thesis. p.1-124.
-
Park MH and Kim MR. (2017). Analysis of anti-oxidant and antiinflammatory activities of solvent fractions from Rhynchosia nulubilis cultivated with Ganoderma lucidum mycelium. Preventive Nutrition and Food Science. 22:365-371.
[https://doi.org/10.3746/pnf.2017.22.4.365]

- Ryu SY, Kim YS, Kim HT, Kim SK, Choi GJ, Kim JS, Lee SW, Heor JH, Cho KY and Kim JC. (2001). Antifungal activities of coumarins isolated from Angelica gigas and Angelica dahurica against plant pathogenic fungi. Korean Jounrnal of Pesticide Science. 5:26-35.
- Seo YK and Ryu KS. (1976). Study on the components of Glehniae Radix. Korean Journal of Pharmacognosy. 7:233-235.
-
Singleton VL, Orthofer R and Lamuela-Raventós RM. (1999). Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent. Methods in Enzymology. 299:152-178.
[https://doi.org/10.1016/S0076-6879(99)99017-1]

-
Um YR, Lee JI, Lee JL, Kim HJ, Yea SS and Seo YW. (2010). Chemical constituents of the halophyte Glehnia littoralis. Journal of the Korean Chemical Society. 54:701-706.
[https://doi.org/10.5012/jkcs.2010.54.6.701]

-
Yoon TS, Cheon MS, Lee AY, Lee DY, Moon BC, Chun JM, Choo BK and Kim HK. (2010). Anti-inflammatory activity of Methylene chloride fraction from Glehnia littoralis extract via suppression of NF-κB and mitogen-activated protein kinase activity. Journal of Pharmacological Sciences. 112:46-55.
[https://doi.org/10.1254/jphs.09168FP]

-
Zargoosh Z, Ghavam M, Bacchetta G and Tavili A. (2019). Effects of ecological factors on the antioxidant potential and total phenol content of Scrophularia striata Boiss. Scientific Reports. 9:16021. https://www.nature.com/articles/s41598-019.52605-8, (cited by 2021 July 27).
[https://doi.org/10.1038/s41598-019-52605-8]