수분스트레스가 땃두릅나무의 광합성 능력 및 광계 II의 활성에 미치는 영향
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
This study was performed to investigate the physiological responses of Oplopanax elatus by water condition. Drought stress was induced by withholding water for 26 days. The results show that PN max, SPAD, gs, E and Ci were significantly decreased with decreasing of soil moisture contents. However, AQY and WUE were decreased slightly only at 26 day. This implies that photosynthetic rate is reduced due to an inability to regulate water and CO2 exchange through the stomatal. According to JIP analysis, ΦPO, ψO, ΦEO and PIABS were dramatically decreased at 21 day and 26 day, which reflects the relative reduction state of the photosystem II. On the other hand, the relative activities per reaction center such as ABS/RC, TRo/RC were significantly increased at 26 day. Particularly, Dio/RC and DIo/CS increased substantially under drought stress, indicating that excessive energy was consumed by heat dissipation. These results of chlorophyll a fluorescence show that the sensitivity changes photosystem II activity. Thus, according to the results, O. elatus was exhibited a strong reduction of photosynthetic activity to approximately 10% soil moisture contents, and JIP parameters could be useful indicator to monitor the physiological states of O. elatus under drought stress.
Keywords:
Chlorophyll Fluorescence, JIP Analysis, Photosynthesis, Stomatal Conductance서 언
수분은 식물의 생장에 관여하는 여러 가지 환경인자 중 가 장 부족하기 쉬운 요인이며, 외부로부터 CO2를 흡수하여 광 합성을 수행하기 위해서는 필연적으로 수분손실이 발생하게 된다. 식물은 생활사 전반에 걸쳐 빈번히 수분부족을 경험하 게 되며, 수분환경에 대한 식물의 적응력 차이에 따라 수생식 물 (hydrophyte), 중생식물 (mesophyte), 건생식물 (xerophyte) 등으로 구분하기도 한다 (Kwon et al., 2003). 수분부족으로 인한 식물의 반응은 초기에는 엽의 확장이나 줄기 신장과 같 은 팽압에 영향을 받는 요소들이 감소하게 되며, 엽의 탈리, 기공 닫힘 등 체내 수분보존과 수분이용효율을 높이는 기작을 보이다가 극심한 스트레스를 받게 되면, 현저한 광합성속도의 감소, 삼투조절기능 (osmoregulation)의 상실 및 세포내 주요 대사에 심각한 장애 등을 유발하여 영구적인 손상을 끼치게 된다 (Taiz and Zeiger, 2006).
식물은 수분스트레스에 대응하기 위해 다양한 생존전략을 가지고 있으며, 이러한 능력은 식물의 양적 형질로써 여러 가 지 기작의 상호작용에 의하여 수분부족에 대한 내건성을 나타 내게 되고 (Oh et al., 2005), 식물의 생리적 피해 및 적응 기작을 이해하기 위해서는 복합적인 고찰이 필요하다. 수분스 트레스에 따른 광합성 활성과 관련하여 기공닫힘, 수분이용효 율 변화, 광계 II에서 일어나는 광화학반응 및 전자 흐름의 불 균형 등에 관한 정보는 이러한 이해를 돕는 유용한 지표이 며, 특히 엽록소 형광반응 측정은 광합성 기구의 변화를 모니 터링 하여 정량화 할 수 있는 민감하고 신뢰성 있는 방법으로 엽록소 형광반응 측정을 통해 광계 II의 구조와 기능변화를 빠 르고 간편하게 측정할 수 있어 최근 많은 연구가 이루어지고 있다 (Strasser et al., 2000; Naumann et al., 2007; Falqueto et al., 2010; Wang et al., 2012).
땃두릅나무는 두릅나무과의 낙엽관목으로 산림청 지정 희귀 식물로 분류되고 있으며 (Korea National Arboretum, 2013), 한방에서는 주로 해열, 기침, 염증의 치료 및 완화제로 사용되 어 왔다 (Kim et al., 2012). 최근 땃두릅나무와 관련하여 화 학적 성분 (Zhang et al., 1993), 에탄올 추출물의 독성시험 (Kwon et al., 2007), 현탁배양을 통한 체세포배 유도 (Kim et al., 2012) 등 기능성 소재로서의 가능성에 관한 연구가 이 루어졌으나, 환경요인에 따른 생리적 반응 등 적지생육 조건 에 대한 연구는 거의 이루어지지 않은 실정이다. 특히 임지에 자생하던 땃두릅나무를 인공적으로 재배할 경우 적절한 수분 환경에 대한 이해는 매우 필수적이라 할 수 있다. 따라서 본 연구는 수분스트레스에 따른 땃두릅나무의 생리적 반응을 조 사하여, 수분부족시 나타나는 광합성 기구의 피해와 조기 진 단을 위한 생리적 지표를 찾아보고, 건전한 생육을 위해 적절 한 수분공급에 대한 기초자료를 제공하고자 하였다.
재료 및 방법
1. 공시식물 및 수분스트레스 처리
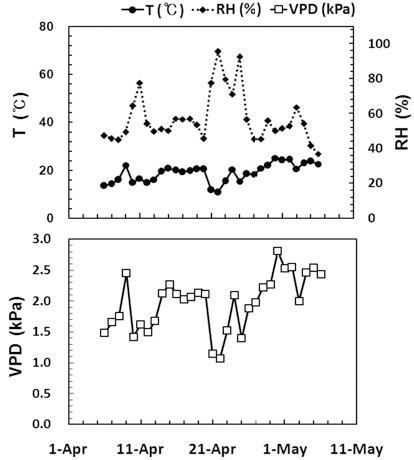
실험에 사용된 땃두릅나무 (Oplopanax elatus)는 2010년 4 월 강원도 평창군 발왕산에서 채취하여 줄기를 삽목한 뒤 2년 간 구내 온실에서 생육시켰으며, 2012년 4월 6일부터 2012년 5월 3일까지 인위적인 단수처리를 통하여 수분스트레스를 유 발하였다. 수분스트레스 처리 전 땃두릅나무의 근원경과 수고 는 각각 1.5 ± 0.2㎝, 22.6 ± 4.7㎝였으며, 엽은 개체당 2 ~ 3 개 였다. 수분스트레스의 증가에 따른 생리적 반응은 단수처 리 후 1일 (drought stress; DS 1), 7일 (DS 7), 14일 (DS 14), 21일 (DS 21) 그리고 가시적인 관찰 결과 엽이 고사 하기 직전인 26일째 (DS 26) 측정하였고, 재관수 2일 (rewatering; RW 2) 후 다시 측정하였다. 실험이 진행되는 기 간의 주요 환경인자를 알아보기 위해 온습도 측정기 (HOBO H08-004-02, ONSET, USA)를 지상에서 1 m 높이에 설치하 였으며 토양수분함량은 건조중량법 (gravimetric method)을 이 용하여 토양시료 채취 후 무게와 완전 건조시킨 뒤의 무게를 통해 5반복으로 조사하였다. Table 1
2. 광합성 반응
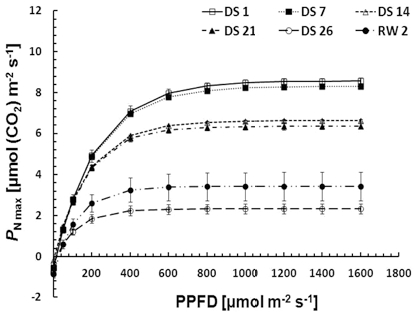
수분스트레스에 따른 순광합성속도 (net photosynthetic rate, PN), 기공증산속도 (stomatal transpiration rate, E), 기공 전도도 (stomatal conductance, gs), 엽육세포내 CO2 농도 (Intercellular CO2 concentration, Ci)를 조사하기 위해 휴대용 광합성 측정기 (Portable Photosynthesis system, Li-6400, Li- Cor Inc., USA)를 이용하였으며, 측정시 LED light source를 이용하여 PPFD (Photosynthetic Photon Flux Density)를 0, 50, 100, 200, 400, 800, 1,000, 1,200, 1,400 µmol·m−2·s−1 의 9단계로 조절하였다. 이때 공통된 측정 조건은 챔버로의 유 입 공기유량을 500 µmol·s−1, 온도를 20 ± 2°C로 유지하여 오 전 9시부터 오후 1시까지 3반복으로 광합성을 측정하였으며, 수분이용효율 (water use efficiency, WUE)은 순광합성속도를 기공증산속도로 나눈 값, 즉 µmolCO2·mmol H2O−1로 나타 냈다 (Lee et al., 2012). 측정된 자료를 이용하여 Kume 과 Ino (1993)식에 의해 광-광합성곡선 (PN-PPFD)을 나타내고 광 보상점 (light compensation point, LCP), 암호흡 (dark respiration, Rd), 순양자수율 (net apparent quantum yield, AQY), 최대광합성속도 (maximum photosynthesis rate, PN max)를 구하였다 (Kim and Lee, 2001).
3. 엽색도 및 엽록소 형광반응 분석
엽색도는 SPAD 측정기 (CCM-200, opti-sciences Inc, USA)를 이용하여 5반복으로 조사하였다. JIP 분석 (polyphasic rise of Chlorophyll a fluorescence transients)은 엽록소 형광 반응 측정기 (chlorophyll fluorometer, OSI 30P, ADC, UK) 를 이용하여 20분간 암적응시킨 엽에 1,500 µmol·m−2·s−1의 광량을 1초간 조사하고, 50 µs (O단계), 2 ms (J단계), 30 ms (I단계), 300 ms (P단계)에서 엽록소 형광밀도를 6반복으로 측 정하였다 (Oh and Koh, 2004). JIP 분석 결과를 통해 생체 물리학적 변수 (biophysical parameters; VJ, VI, ΦPO, ψO, ΦEO, ABS/RC, TRo/RC, ETo/RC, DIo/RC, ABS/CS, TRo/ CS, ETo/CS, DIo/CS, RC/CSo, PIABS)를 산출하여 제시하였 다 (Strasser et al., 2000).
4. 엽 수분포텐셜 및 수분불포화도 조사
엽 수분포텐셜 (water potential, WP) 및 수분불포화도 (water saturation deficits, WSD)는 DS 1, DS 26 및 RW 2 의 시료를 대상으로 측정하였다. 먼저 엽을 절취한 후 생체중 (Fresh Weight, FW)을 측정하고, 20 ~ 25°C의 실온에서 빛을 차단시킨 상태로 최대 포수상태에 도달하도록 24시간 이상 수분을 흡수시킨 후 포화중량 (Turgid Weight, TW)을 측 정하였다. 포화중량을 측정한 엽을 80°C에서 48시간 건조 후 건조중 (dry weight, DW)을 측정하여 수분불포화도 (WSD = TW-DW/FW-DW)를 산출하였다 (Lee et al., 1996). 엽 수분포텐셜은 오전 9시경 시료의 지상부를 절단한 뒤 Pressure Chamber (Model 3100 SAPS Console, Soil Moisture Corp. USA.)를 이용하여 측정하였고, 수분스트레스 에 따른 생리반응의 통계분석은 SPSS Statistics Program (Version 19.0)을 이용하였다.
결과 및 고찰
1. 수분스트레스에 따른 미기상환경 변화 및 건조피해 정도
실험을 진행한 4월 6일부터 5월 3일까지 평균기온은 18.9°C, 상대습도는 57.0%, 대기수증기압차 (vapor pressure deficit, VPD)는 2.0 kPa로 나타났으며, 4월에서 5월로 시간이 지남에 따라 수증기압이 점차 높아지는 경향을 나타내어 수분 스트레스가 더욱 증가하였을 것으로 생각된다. 특히 DS 7 ~ DS 14 구간과 DS 21 ~ DS 26 구간의 VPD는 각각 2.1 및 2.3 kPa로 다른 시기에 비해 비교적 높은 것으로 나타났으 며, 이때의 토양수분함량 감소 역시 큰 것으로 나타났다 (Fig. 1, Table 2).
수분스트레스 처리에 따라 토양 수분함량이 23.3%인 DS 14 이후부터 팽압의 감소로 인해 엽이 조금씩 말려들어가는 현상을 관찰할 수 있었고, DS 26에서 엽의 기저부위와 말단 부위에서 부분적인 위조현상이 일어나는 등 가시적인 수분스 트레스 피해가 나타나는 것을 알 수 있었다. 이 시기 토양수 분함량은 10.1%로 나타났으며, 이후 재관수를 통해 토양수분 함량이 33%이상으로 회복하여도 재관수 처리 5일 이후에 엽 은 완전히 고사하였다.
2. 수분스트레스에 따른 광합성의 변화
단수처리로 인해 수분스트레스가 유발됨에 따라 땃두릅나무 엽의 최대광합성속도는 DS 14부터 유의적인 감소를 보였 으며, 수분스트레스가 최대로 유발된 DS 26의 최대광합성속 도는 2.3 ± 0.2 µmolCO2·m−2·s−1로 DS 1의 약 27% 수준이 었다. 특히 건조한 대기환경으로 인해 토양수분함량이 18.1% 에서 10.1%까지 큰 폭의 감소를 보이는 DS 21 이후에 최대 광합성속도 역시 급격한 감소를 보였는데, Lee 등 (2007)이 보고한 묘삼의 경우에 토양수분함량의 감소에 따라 초기에는 광합성량이 점진적으로 감소하다가 토양수분함량이 매우 적은 환경에서 큰 폭으로 감소한다는 것과 유사한 결과였다. 광화 학계의 활성을 반영하는 순양자수율 (Evans, 1987)은 DS 26 에서 유의적인 감소를 보였으며, 23.0 mmolCO2·mol−1로 DS 1에 비해 약 55% 감소한 것으로 나타났다. 이후 재관수를 통 해 토양수분함량이 33% 이상으로 회복하도록 유도한 결과, RW 2의 최대광합성속도와 순양자수율은 DS 1에 비해 각각 약 40%, 87% 수준으로 일시적인 증가를 보였으나, 엽의 고사 는 계속 진행되어 재관수 처리 5일이 지난 뒤에는 완전히 고 사하였다. 암호흡과 광보상점의 변화는 스트레스 처리가 진행 되는 동안에 불규칙한 변화를 보였으나, 재관수 후 일시적으 로 크게 증가한 것을 알 수 있었다 (Fig. 2, Table 2).
Kim 등 (2000)에 따르면 토마토는 토양수분함량의 감소에 따라 엽의 SPAD 값이 증가한다고 보고하였으나, 땃두릅나무 의 경우 이와는 다른 경향을 나타냈으며, 오히려 DS 21부터 다소 감소되는 것을 알 수 있었다 (Table 2). 이는 수분스트레 스로 인한 엽의 수분부족이 엽록체 막의 손상을 야기하여 총 엽록소함량이 감소한 것으로 볼 수 있으며, Saraswathi와 Paliwal (2011)가 보고한 Albizia lebbeck 및 Cassia siamea 에서도 같은 경향을 보였다.
식물체에서 대기로의 수분확산을 의미하는 증산은 주로 기공에서 이루어지고 기공개폐를 중요한 조절인자로 들 수 있다. 특히 고등식물의 경우 수분공급이 제한되면 체내에 ABA 함량을 증가시켜 기공닫힘을 유발하고 수분 및 CO2 교 환에도 영향을 미치게 되어 광합성속도의 감소를 가져온다 (Taiz and Zeiger, 2006).
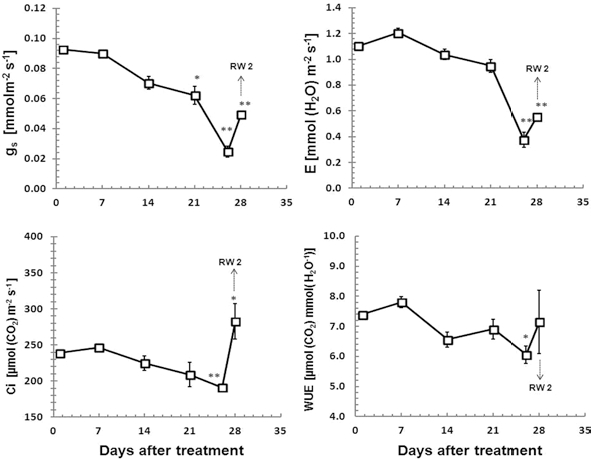
수분스트레스가 진행됨에 따라 기공전도도, 증산속도, 엽육 세포내 CO2 농도는 전반적으로 감소되는 경향을 보였으나, DS 7 (SMC 29.2% ± 0.6)에서 증산속도, 엽육세포내 CO2농도가 일시적으로 증가하였다. 급격한 최대광합성속도의 감소가 나 타난 DS 26은 DS 1과 비교해 기공전도도는 약 27%, 기공증 산속도는 약 34% 수준으로 매우 낮았으며, RW 2에서도 기공 전도도와 기공증산속도의 기능은 완전히 회복되지 못한 것으 로 나타났다 (Fig. 3). Table 3
대기 중의 CO2 농도는 상대적으로 일정한 수준을 유지하지 만 엽육세포내의 CO2 농도는 대기에서 엽육세포로의 CO2 확 산 저항에 의해 결정되고, 확산저항은 미기상 조건 및 식물의 수분상태에 따라 기공전도도에 의해 조절된다 (Franck and Vaast, 2009). 땃두릅나무의 엽육세포내 CO2 농도 역시 기공전 도도의 감소와 밀접한 관련이 있는 것으로 여겨지며, RW 2에 서는 DS 1보다도 높은 엽육세포내 CO2 농도를 보였는데, 이 는 기공열림으로 인해 엽육세포내 빈 공간으로 CO2 분자의 유입이 증가하였으나 광합성 활성은 미처 회복되지 못한 상태 로 CO2의 효율적인 소비가 일어나지 못하여 나타난 결과로 생각된다.
땃두릅나무의 수분이용효율은 수분스트레스가 비교적 약한 DS 7에 일시적으로 증가하였으나, 광합성속도의 감소가 시작 된 DS 14부터 크게 감소하였으며, DS 26에서 가장 낮은 값 을 나타냈다 (Fig. 3). 이는 땃두릅나무가 약한 수분스트레스 에서 광합성을 유지하면서 내부의 수분손실은 줄이기 위해 일 시적으로 수분이용효율을 증가시켰으나 (Lee et al., 2012), 심 한 수분스트레스에서는 기공닫힘으로 CO2 및 수분 공급이 크 게 제한되고 세포내 CO2의 확산저항 역시 높아지므로 광합성 과 더불어 수분이용효율이 감소된 것으로 생각된다 (Abril and Hanano 1998; Singh and Singh, 2003). 특히 CO2의 확산과 정에서 엽육 저항 (mesophyll resistance)의 증가는 광합성 대 사에 매우 큰 영향을 미치는 것으로 알려져 있다 (Flexas et al., 2004).
3. 수분스트레스에 따른 엽 수분포텐셜 및 수분불포화도
수분불포화도는 엽의 수분상태를 나타내는 유효한 지표 이며, 엽의 수분포텐셜과 높은 상관관계를 가진다고 알려져 있다 (Lee et al., 1996). 땃두릅나무의 경우 DS 26의 수분포 텐셜이 −0.80MPa로 DS 1에 비해 약 3.5배 감소되었고, 재 관수 처리에 따라 수분포텐셜은 회복되었다. 수분불포화도는 DS 1에 비해 DS 26이 약 20배 정도 증가하여 수분스트레스 를 많이 받고 있음을 알 수 있었으며, 재관수를 하여도 완전 히 회복되지 않는 것을 알 수 있었다 (Table 2). 이는 엽육세 포 조직의 손상으로 인해 재관수 처리를 계속하여도 이미 손 상된 조직은 회복되지 않고 종래에는 고사에 이르는 것으로 생각된다.
4. 수분스트레스에 따른 엽록소 형광반응
광계 II의 안테나 엽록소에 의해 흡수된 빛에너지 (ABS)는 에너지 전이과정 (energy transfer)을 통해 반응중심 (P680)을 들뜬 상태로 만들며, 들뜬 반응 중심은 전하 분리과정으로 인 접한 페오피틴(pheophytin)에 전자를 방출하고, 전하 안정화 과 정을 통해 초기 전자수용체인 QA를 환원시킨다 (TRo).
이 과정에서 일부 에너지는 반응중심에 포획되지 못하고 열 등의 형태로 방출되며 (DIo), QA의 환원 이후 일련의 전자전 달계를 거쳐 (ETo) 최종적으로 NADP+를 NADPH로 환원시 킨다 (Strasser et al., 2000). JIP 테스트는 이러한 에너지 전 달과정의 특성을 잘 보여준다. 가장 초기에 나타나는 O-J구간 은 광계 II의 반응중심에 QA의 환원 (QA −)을 의미하고, J-I구 간은 QA의 환원과 재산화간의 불균형을 반영하며, I-P구간은 plastoquinone pool (PQ pool)의 급격한 환원을 의미한다 (Stirbet et al., 1998; Oh et al., 2009).
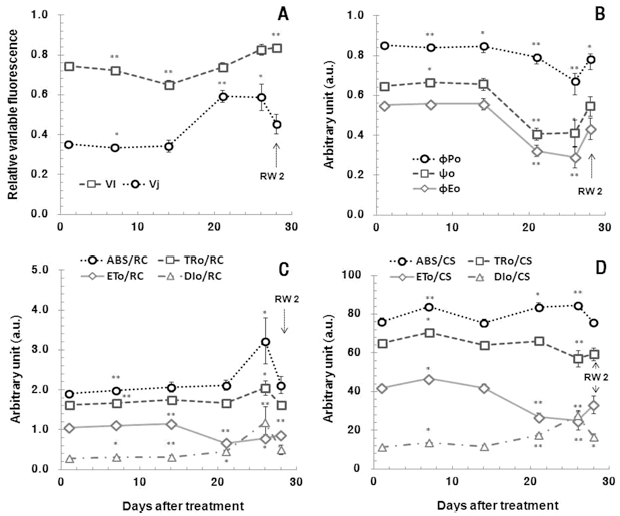
Fig. 4에서 미세 변이형광 VJ, VI 모두 DS 21에서 증가하 였으며, 특히 VJ의 증가가 두드러진 것을 알 수 있었다. 높은 VJ는 QA −의 재산화율이 낮아 전자전달이 저해됨을 의미하며, 산소발생복합체 (oxygen-evolving complex, OEC)의 비활 성화와도 관계가 깊다 (Wang et al., 2012; Spoustová et al., 2013).
ΦPO, ψO, 그리고 ΦEO는 광화학반응의 각 단계에 대한 에너 지전이 비율 및 형광수율을 의미하는 것으로 (Strasser et al., 2000), 초기광화학반응에서 최대양자수율을 나타내는 ΦPO는 수분스트레스가 가장 심한 DS 26에서 유의적인 감소를 보였 으나, QA − 이후 전자전달 효율인 ΦEO 및 ψO는 이보다 다소 앞선 DS 21부터 유의적인 감소를 보였다 (Fig. 4).
반응중심당 에너지 흐름의 변화를 나타내는 ABS/RC, TRo/ RC 그리고 DIo/RC는 DS 26에서 증가되었으나, ETo/RC는 오히려 다소 감소된 경향을 보였다 (Fig. 4). ABS/RC의 증가 는 환원상태로 존재하는 반응중심이 많아져 반응중심이 부분 적으로 비활성상태임을 나타내며 (Spoustová et al., 2013), TRo/RC 및 DIo/RC의 증가를 통해 전반적인 활성상태의 반응 중심이 감소됨에 따라 반응중심당 포획되는 에너지와 열 등으 로 방출되는 에너지 모두 증가하는 것을 알 수 있다. 특히 DIo/RC의 증가는 광저해현상의 발생과 밀접한 관련이 있 으며, 수분스트레스에서 과다한 여기에너지의 유입으로 인한 피해를 줄이기 위한 것으로 이해 할 수 있다 (Falqueto et al., 2010). 또한 ETo/RC의 감소를 통해 QA의 환원 이후 광 계 I의 반응중심 (P700)을 환원시키기 위한 전자전달이 저해 되고 있음을 알 수 있다.
엽면적당 에너지 흐름의 변화를 나타내는 ABS/CS, TRo/ CS, ETo/CS, DIo/CS의 경우 ABS/CS는 유의적인 변화를 보 이지 않았으나, TRo/CS와 ETo/CS는 DS 26에서 다소 감소하 여 엽면적당 광계 II에서 포획되는 에너지와 전자전달로 전해 지는 에너지가 모두 감소하고 있는 것으로 나타났고, 열로 버 려지는 비광화학적 에너지의 소실 (DIo/CS)은 증가됨을 보여 준다 (Fig. 4).
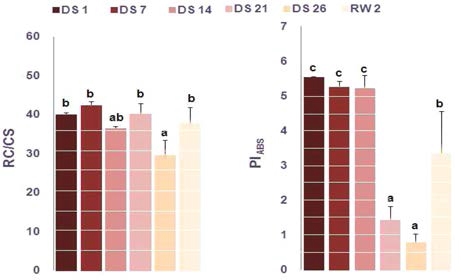
엽면적당 활성상태의 반응중심 밀도 (RC/CS)는 DS 26에서 유의적으로 낮은 경향을 보여 비활성상태의 반응중심이 많은 것을 알 수 있었으며 (Fig. 5), 반응중심의 밀도는 광합성 반 응의 강도를 조절하여 광저해와 같은 손상에 대응하는 것으로 알려져 있다 (Rathod et al., 2011).
PIABS는 흡수된 빛에너지를 이용해 전자 운반자들 (electron carriers)이 환원되는 과정에서 에너지 보존효율을 의미하며 (Holland et al., 2013), 광계 II의 반응중심에서 광합성 활성 을 조절하는 3가지 주요한 단계, 즉 활성 반응중심의 전체밀 도, 반응중심에 의해 흡수된 에너지가 광화학과정으로 포획되 는 비율, QA의 환원 후 전자수송과정 내에 전자 이동 등을 모두 반영한다. 또한 광계 II의 최대양자수율 (ΦPO= Fv/Fm)보 다 더욱 민감한 환경스트레스 지표로 알려져 있다 (Strasser et al., 2000; Boureima et al., 2012; Wang et al., 2012; Zushi et al., 2012). 특히 PIABS는 수분스트레스를 평가 및 모니터링 하는데 좋은 지표로 사용되며 (Van Heerden et al. 2007), 수분스트레스에 따라 PIABS는 감소되는 것으로 알려져 있다 (Rathod et al., 2011; Wang et al., 2012). 땃두릅나무 의 경우에는 DS 21부터 PIABS가 DS 1에 비해 약 26% 수준 으로 크게 감소하였으며, DS 26에서 약 14% 수준으로 가장 낮았다. 이후 재관수를 통해 약 60%까지 기능을 회복을 하는 것으로 나타났다 (Fig. 5).
전반적으로 DS 21 이후 광화학과정에 이용하기 위해 포획 되는 에너지가 줄어들고 전자전달에 이용되지 못하는 에너지 는 증가하여 광계 II의 활성이 감소하는 것으로 나타났으며, 극심한 수분스트레스시 과도한 여기에너지로 인한 광산화를 막기 위해 환원상태의 반응중심과 비광화학적 에너지의 소실 을 증가시키는 기작을 보였다. 또한 ΦPO, ψO, ΦEO 및 PIABS 는 광합성 속도의 현저한 감소 및 가시적인 징후가 나타나기 전에 민감한 반응을 보여 수분스트레스에 따른 조기 진단의 지표로 이용될 수 있을 것으로 판단된다.
위의 결과에서 땃두릅나무는 수분스트레스 처리 초기에는 기공증산속도 및 수분이용효율이 다소 증가하였으나, 처리 후 14일부터는 최대 광합성속도, 순양자수율, 엽록소 함량, 광화 학반응 효율, 기공증산속도 및 기공전도도 등이 점진적으로 감 소하였다. 특히 토양수분함량이 10% 내외로 감소되면, 기공개 폐 기능이 크게 저하되어 엽육세포내 CO2 농도의 감소를 비 롯한 광합성능력이 크게 감소되었고, 부분적으로 잎이 고사되 고 최후에는 줄기와 잎이 완전히 고사되는 현상이 나타나는 것을 알 수 있었다. 또한 수분스트레스 처리 21일부터 광계 II 의 전자전달이 원활히 수행되지 못하여 흡수한 에너지가 광화 학반응에 이용되지 못하고, 과다한 여기에너지에 의한 산화적 피해를 막기 위해 환원상태의 반응중심과 열 등의 방출을 증 가시켰다. 이를 통해 땃두릅나무는 토양수분함량이 10% 미만 으로 감소하면 생리적인 활성이 급격하게 저하되어 건조한 환 경에 비교적 취약한 종임을 알 수 있었고, 엽록소 형광반응 중 ΦPO, ψO, ΦEO 및 PIABS의 분석지표를 이용하면 수분 스트레스에 따른 피해를 조기에 진단할 수 있을 것으로 생 각된다.
REFERENCES
-
Abril, M, Hanano, R, Ecophysiological responses ofthree evergreen woody mediterranean species to water stress, Acta Oecologica, (1998), 19, p377-387.
[https://doi.org/10.1016/s1146-609x(98)80042-8]

-
Boureima, S, Oukarroum, A, Diouf, M, Cisse, N, Van Damme, P, Screening for drought tolerance in mutant germplasm of sesame (Sesamum indicum) probing by chlorophyll a fluorescence, Environmental and Experimental Botany, (2012), 81, p37-43.
[https://doi.org/10.1016/j.envexpbot.2012.02.015]

-
Evans, JR, The dependence of quantum yield on wavelength and growth irradiance, Australian Journal of Plant Physiology, (1987), 14, p69-79.
[https://doi.org/10.1071/pp9870069]

-
Falqueto, AR, Silva, FS, Cassol Magalhães Júnior, AM, Oliveira, AC, Bacarin, MA, Chlorophyll fluorescence in rice probing of senescence driven changes of PSII activity on rice varieties differing in grain yield capacity, Brazilian Journal of Plant Physiology, (2010), 22, p35-41.
[https://doi.org/10.1590/s1677-04202010000100004]

-
Flexas, J, Bota, J, Loreto, F, Cornic, G, Sharkey, T, Diffusive and metabolic limitations to photosynthesis under drought and salinity in C3plants, Plant Biology, (2004), 6, p269-279.
[https://doi.org/10.1055/s-2004-820867]

-
Franck, N, Vaast, P, Limitation of coffee leaf photosynthesis by stomatal conductance and light availability under different shade levels, Trees, (2009), 23, p761-769.
[https://doi.org/10.1007/s00468-009-0318-z]

-
Holland, V, Koller, S, Brüggemann, W, Insight into the photosynthetic apparatus in evergreen and deciduous European oaks during autumn senescence using OJIP fluorescence transient analysis, Plant Biology(Stuttg), (2013).
[https://doi.org/10.1111/plb.12105]

- Kim, HY, Seong, ES, Lee, JG, Yoo, JH, Hwang, IS, Kim, MJ, Lim, JD, Kim, NY, Yu, CY, Establishment of suspensionculture system to induce somatic embryo inOplopanax elatusNakai, Korean Journal of Medicinal Crop Science, (2012), 20, p461-465.
- Kim, PG, Lee, EJ, Ecophysiology of hotosynthesis 1 Effects of light intensity and intercellular CO2pressure on photosynthesis, Korean Journal of Agricultural and Forest Meteorology, (2001), 3, p126-133.
- Kim, YB, An, CG, Lee, YH, Effect of soil moisture on quality and yield in tomotoes, Journal of the Korean Society for Horticultural Science, (2002), 41, p139-142.
- Korea National Arboretum, Korea biodiversity informationsystem. http://www.nature.go.kr/, (2013).
- Kume, A, Ino, Y, Comparison of cophysiological response to heavy snow in two varieties ofAcuba japonicawith different areas of distribution, Ecological Research, (1993), 8, p111-121.
- Kwon, HS, Kim, DH, Shin, HK, Yu, CY, Kim, MJ, Lim, JD, Park, JK, Kim, JK, Fourteen-day repeated-dose oral toxicity study of the ethanol extracts isolated fromOplopanax elatusin sprague-dawley rat, Korean Journal of Food Science and Technology, (2007), 39, p470-475.
- Kwon, YM, Ko, SC, Kim, JC, Moon, BY, Park, MC, Park, HB, Park, IH, Lee, YS, Lee, IH, Lee, JS, Lee, JB, Lee, CH, Jeon, BU, Jo, SH, Hong, JB, Plant physiology, (2003), Seoul, Korea, Academybook, p422-440.
- Lee, KC, Noh, HS, Kim, JH, Ahn, SY, Han, SS, Changes of characteristics related to photosynthesis inSynurus deltoidesdeltoides under different shading treatments, Korean Journal of Medicinal Crop Science, (2012), 20, p320-330.
- Lee, SW, Hyun, DY, Park, CG, Kim, TS, Yeon, BY, Kim, CG, Cha, SW, Effect of soil moisture content on photosynthesis and root yield ofPanax ginsengC. A. Meyer seedling, Korean Journal of Medicinal Crop Science, (2007), 15, p367-370.
- Lee, WS, Kim, BS, Kang, SK, Jeong, SD, Hwang, JM, Drought tolerance of pepper and correlations among WSD, leaf water potential and stomatal density, Journal of Horticulture Environment and Biotechnology, (1996), 37, p1-4.
-
Naumann, JC, Young, DR, Anderson, JE, Linking leaf chlorophyll fluorescence properties to physiological responses for detection of salt and drought stress in coastal plant species, Physiologia Plantarum, (2007), 131, p422-433.
[https://doi.org/10.1111/j.1399-3054.2007.00973.x]

- Oh, CY, Han, SH, Kim, YY, Lee, JC, Changes of drought tolerance and photosynthetic characteristics ofPopulus davidianadode according to PEGconcentration, Korean Journal of Agricultural and Forest Meteorology, (2005), 7, p296-302.
- Oh, SJ, Koh, SC, Chlorophyll fluorescence and antioxidative enzyme activity ofCrinumleaves exposed to natural environmental stress in winter, Korean Journal ofEnvironmental Biology, (2004), 22, p233-241.
-
Oh, SJ, Zhin, KL, Koh, SC, Characterization of chl a fluorescence of hydrophytes under cadmium stress, Environmental Sciences, (2009), 18, p1361-1368.
[https://doi.org/10.5322/jes.2009.18.12.1361]

- Rathod, D, Brestic, M, Shao, H, Chlorophyll a fluorescence determines the drought resistance capabilities in two varieties of mycorrhized and non-mycorrhizedGlycine maxLinn, African Journal of Microbiology Research, (2011), 5, p4197-4206.
- Saraswathi, SG, Paliwal, K, Drought induced changes in growth, leaf gas exchange and biomass production inAlbizia lebbeckandCassia siameaseedlings, Journal of Environmental Biology, (2011), 32, p173-178.
-
Singh, B, Singh, G, Biomass partitioning and gas exchange inDalbergia sissooseedlings under water stress, Photosynthetica, (2003), 41, p407-414.
[https://doi.org/10.1023/b:phot.0000015465.86985.53]

- Spoustová, P, Synková, H, Valcke, R, Cerovská, N, Chlorophyll a fluorescence as a tool for a study of thePotato virusY effects on photosynthesis of nontransgenic andtransgenic Pssu-ipttobacco, Photosynthetica, (2013), 51, p1-11.
- Strasser, RJ, Srivastava, A, Tsimilli-Michael, M, Yunus, M, , The fluorescence transient as a tool to characterize and screen photosynthetic samples, Probing Photosynthesis: Mechanism, regulation and adaptation, (2000), New York. NY, USA, Taylor and Francis, p445-483.
-
Stirbet, A, Strasser, BJ, Strasser, RJ, Chlorophyll a fluorescence induction in higher plants: Modelling and numerical simulation, Journal of Theoretical Biology, (1998), 193, p131-151.
[https://doi.org/10.1006/jtbi.1998.0692]

- Taiz, L, Zeiger, E, Plant physiology, (2006), 4th, Sunderland. MA, USA, Sinauer Associates, p672-705.
-
Van Heerden, P, Swanepoel, J, Krüger, G, Modulation of photosynthesis by drought in two desert scrub species exhibiting C3-mode CO2assimilation, Environmental and Experimental Botany, (2007), 61, p124-136.
[https://doi.org/10.1016/j.envexpbot.2007.05.005]

-
Wang, ZX, Chen, L, Ai, J, Qin, HY, Liu, YX, Xu, PL, Jiao, ZQ, Zhao, Y, Zhang, QT, Photosynthesis and activity of photosystem II in response to drought stress in amur grape(Vitis amurensisRupr.), Photosynthetica, (2012), 50, p189-196.
[https://doi.org/10.1007/s11099-012-0023-9]

- Zhang, HG, Wu, GX, Zhang, YM, Chemicalconstituents from stems ofOplopanax elatusNakai, Journal ofChinese Materia Medica, (1993), 18, p104-105.
-
Zushi, K, Kajiwara, S, Matsuzoe, N, Chlorophyll a fluorescence OJIP transient as a tool to characterize and evaluate response to heat and chilling stress in tomato leaf and fruit, Scientia Horticulturae, (2012), 148, p39-46.
[https://doi.org/10.1016/j.scienta.2012.09.022]