초고압 공정을 이용한 강황 잎 추출물의 항산화 활성 증진
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
This study was designed to evaluate antioxidant activity of Curcuma longa L. leaves treated by ultra high pressure extraction. Curcuma longa L. leaves was subjected to 5,000 bar for 5 and 15 min at 25°C The highest phenolics and flavonoids content was observed in the treatment of high pressure extraction for 15 min (308.28 µg/mg, 124.33 µg/mg). The DPPH scavenging activity was 82.34% at 1.0 mg/ml of Curcuma longa L. leaves treated by ultra high pressure process for 15 min. The highest SOD-like acitivity of Curcuma longa L. leaves (1.0 mg/ml) was observed at ultra high pressure extraction for 15 min (67.54%). The high pressure extraction significantly increased the contents of phenolics and flavonoids and also enhanced the antioxidant activity. These results provide useful information for enhancing biological properties of Curcuma longa L. leaves.
Keywords:
Curcuma longa L. Leaves, Antioxidant, High Pressure Process서 언
사람의 피부는 항상 산소와 접촉하고 자외선에 노출되어 있 어 활성산소 종에 의한 피부의 광산화적 손상 위험이 항상 존 재한다. 산화반응에 대한 활성 산소 자유라디칼 이론은 Harman (Harman, 1956) 에 의해 제시된 이후 신체의 노화과 정, 신진대사과정 및 유기물의 화학적 변화에 관한 이론과 관 련하여 관련 분야에서 주목을 받아오고 있다 (Ahn and Lee, 1999). 자유라디칼은 인체와 관련해 세포의 파괴, 피부 진피층 의 결합조직을 절단 또는 교차 결합을 일으키므로 주름 형 성, 피부암, 류머티스성 관절염, 아토피성 피부염, 여드름 등의 각종 문제를 발생시킨다 (Leibovita and Siegel, 1980). 이러 한 자유라디칼을 제거하거나 중화시켜 세포의 산화를 방지하 는 것을 항산화라 하며, 항산화 물질에는 합성항산화물질인 BHA (Butylated Hydroxy Anisole), BHT (Butyl Hydroxy Toluen)가 있고, 천연물 항산화제로는 베타카로틴, 비타민 C, 비타민 E, 카테킨, 프로안토시아니딘 등이 있다. 체내에서도 superoxide dismutase, catalase, vitamin E, vitamin C, ubiquinol 등이 생성되나, 노화나 공해, 자외선, 스트레스 등에 의하여 자유라디칼이 증가된다 (Meneghini et al., 1993; Fridovich, 1986).
최근에는 인체에 미치는 합성 항산화제에 대한 유해성의 논 란으로 최근 천연물의 항산화 활성이 주목되고 있다. 높은 항 산화력과 저렴한 가격 때문에 광범위하게 사용되고 있는 BHA, BHT의 경우 암을 유발시키는 등 인체에 독성을 나타 낸다는 문제점을 가지고 있다 (Branen, 1975). 이러한 이유로 tocopherol, L-ascorbic acid와 같은 천연 항산화물질들이 각종 화장품과 의약품에 배합되어 주름 및 기타 피부질환의 방지에 사용되어 왔으나, 가격이 고가일 뿐 아니라 불안정한 물성으 로 인해 실질적 항산화력을 가지는데 어려운 문제점이 있다 (Fukuzawa and Takaishi, 1990). 이러한 천연 항산화제 및 합 성 항산화제를 대체할만한 천연물의 항산화 효능과 안전성, 경 제성을 두루 가지는 천연 항산화제에 대한 연구가 필요한 실 정이다.
유용한 천연 항산화능을 가지는 식물 중 강황 (Curcuma longa L.)은 울금을 기원식물로 약용하는 부위에 따라 울금과 강황으로 나뉜다. 옛 동의 문헌에 기재된 식물형태, 약성 등을 보면 울금은 식물의 덩이 뿌리를 이용하는 반면 강황은 식물 의 줄기뿌리를 이용하며 맛은 울금보다 더 매우며 색은 울금 보다 더 진한 오렌지색을 나타낸다고 하였다. 또한, 잎 뒷면에 작은 가시 솜털 같은 꽃이 봄에 핑크색을 띄우고 자라고 열대 아시아가 원산으로서 국내에는 강황속 식물은 자생하지 않으 며 열대 각 지방 및 중국의 남부지방에 자생, 재배하는 생강 과의 다년생 초본이다 (Ryu et al., 2005). 최근 강황의 생리 활성물질인 curcuminoids의 약리효과가 알려지면서 의학 분야 를 중심으로 간장염, 담도염, 담석증, 카타르성 황달, 소화기 및 심혈관계에 대한 작용, 항혈소판응집, 혈중지질강하, 항산 화, 항돌연변이, 항종양, 항균작용 등에 대한 연구가 활발히 이 루어지고 있다 (Jayaprakasha et al., 2005).
하지만 이러한 연구는 강황의 뿌리줄기에 대해서만 국한되 어 있으며, 수확된 강황의 잎이나 꽃 등은 사용이 극히 미미 하며 이에 대한 연구도 거의 없는 실정이다. 강황 부산물인 잎은 부피와 표면적이 넓어 10a당 30 ~ 40톤에 달하고 있음에 도 극히 일부만이 사료용으로 이용되어질 뿐 대부분이 버려지 고 있다 (Ahn et al., 2012). 이렇듯이 폐자원인 강황의 잎을 활용하여 신소재를 발굴하고 사용하는 연구가 활발하게 이루 어진다면 새로운 고부가가치 산업 성장의 동력이 될 것으로 사료된다.
기존에 강황 잎의 주요활성 성분이 정유상태로 얻어지는 것 을 감안하면 천연물로부터 기능성 소재를 얻기 위해 필수적 단계인 추출 공정에 있어, 기존 수용성 성분 추출에만 중점을 둔 종래 공정이 아닌 여러 가지 형태의 성분을 고 수율로 추 출할 수 있는 신기술 추출공정이 요구되는 실정이다. 강황 잎 과 같이 표면적이 넓고 열 변성에 취약한 작물의 경우, 가공 시 저온 전처리 및 고온 가공이 불필요한 초고압 및 초음파 등의 가공조건이 필수적이다. 기존에 사용되어진 전통적인 천 연물 추출방법은 추출 효율 및 에너지 효율이 낮으며 고온으 로 인한 많은 활성성분의 파괴와 단백질의 변이, 가용성분 위 주의 추출과 열에 대한 불안정 등의 단점을 가지고 있다 (Park et al., 2004). 이러한 단점을 보완하기 위해 초고압 공 정 기술을 천연물 활성성분 추출에 적용하였다.
초고압 공정은 초고압 하에서 세포막을 파괴하여 세포 내로 의 용매를 침투시켜 보다 많은 성분이 세포 밖으로 용출되는 원리를 이용하여, 천연물의 유효성분을 비교적 저온에서 단시 간 내에 추출이 가능하며, 순도가 높은 단일성분과 불순물이 적은 추출물을 얻게한다 (Bennett et al., 1998). 특히 천연물 에 작용되어진 초고압의 높은 에너지와 압력은 보통 열수 추 출로 얻을 수 없는 유용 생리활성 물질을 얻을 수 있게 하여 식물 내에 함유된 천연물질을 재평가 할 수 있게 한다. 천연 물의 화학성분 추출에 가장 효율적으로 활용될 수 있는 고에 너지 저효율, 열에 의한 유용성분의 변성 및 손실, 가용성분 위주의 추출 등의 문제점을 개선하여 식물로부터 단시간에 불 순물이 적은 고 순도의 단일 성분 추출이 가능할 것으로 사료 된다 (Kim et al., 2007).
본 연구는 향장원료로써 강황 잎의 항산화력을 증진시키기 위하여 초고압 공정을 이용해 식물의 유용활성물질의 손실을 최소화하며 단시간 내에 추출이 가능하도록 하였다. 또한, 대 규모로 폐기되는 강황의 부산물인 잎을 사용해 초고압 공정 추출로 항산화 효능을 증진시킴으로써 낮은 가격으로 최대의 효능을 나타내는 방법을 제시하여 강황 잎의 높은 항산화력을 가지는 화장품 원료로의 이용가치를 높이고자 연구를 수행하 였다.
재료 및 방법
1. 실험재료 및 시약
본 실험에 사용한 강황 (Curcuma longa L.)은 전북지역에 자생하고 있는 것을 2011년 9월 중 잎 부분만 채취하였으며, 동결건조기 (PVTFD 100R, ILSHINLAB, Korea)를 이용하여 진공도 10㎜ Torr, −70°C 조건에서 동결건조 하였다. 건조수 율은 건조 전 시료에 대한 건조 후 무게백분율로 계산하였다.
2. 시료 추출 조건
열수 추출 (WE)은 수직 환류냉각기가 부착된 flask에 10배 의 증류수를 이용하여 70°C에서 24시간 동안 추출하였으며, 에탄올 추출물 (EE)은 열수추출과 같이 수직 환냉각기가 부착 된 flask에 10배의 70% ethyl alcohol을 이용하여 동일한 온 도와 시간에서 추출하였다.
초고압 추출은 동결 건조시킨 강황 잎 10 g을 비닐 팩에 물 과 함께 넣어 공기가 들어가지 않도록 잘 밀봉한 후, 초고압 추출장치 (Ilshin autoclave, Daejeon, Korea)를 이용하여 500Mpa의 압력으로 각각 5분 (Ultra High Pressure Extraction 5, HPE5), 15분간 (Ultra High Pressure Extraction 15, HPE15) 초고압 추출을 시행하였다. 초고압 추출이 끝난 강황 잎을 수직 환류냉각기가 부착된 flask에 10배의 증류수를 이 용하여 70°C에서 12시간동안 추출하였다.
위와 같이 얻어진 추출물을 여과한 뒤 회전감압농축기 (Rotary Vacuum Evaporator N-N series, EYELA, Germany) 로 농축한 뒤 동결건조한 후 얻은 시료를 가지고 실험에 사용 하였다.
3. 세포주 및 세포 생육 배지
실험에 이용된 세포주로 Human fibroblast CCD-986sk (KCLB 21947, Korea)를 사용하였으며, 세포배양에 필요한 배 지로 Dulbeco’s Modified Eagle’s Medium (Gibco, USA)을 사용하였고, 그 밖의 세포 배양에 필요한 시약으로 hepes buffer (Sigma, USA)와 fetal bovine serum (Gibco, USA), gentamycin sulfate (Sigma, USA), trypsin-EDTA (Sigma, USA)를 사용하였다. 실험에 사용된 세포는 Dulbeco's Modified Eagle’s Medium (Gibco, USA) 배지 90%에 FBS 를 10%로 적용시켜 배양하여 실험에 이용하였다.
4. 세포 독성 측정
3-(4,5-dimethythiazo-2-yl)-2,5-dipheny-tetrazoliumbromide (MTT)를 사용하여 Mosmann (1983) 방법을 변형시켜 세포 생존율을 측정하였다. CCD-986sk 세포를 96 well plate에 1.5 × 10⁴ cells/well 농도로 접종한 후, 80% 정도의 배양시점 에서 각 well에 공정별 강황 잎 추출물을 투여하고 CO₂ incubator에서 24시간 동안 배양하였다. 5㎍/ml 농도의 MTT 용액을 각 well에 첨가하고 4시간 후 상층액을 제거하고, 10µl의 acid-isopropanol (0.04 N HCl in isopropanol)을 첨 가한 후 microplate reader (Tecan, USA)로 565㎚의 파장에 서 흡광도를 측정하였다.
5. 총 페놀 및 플라보노이드 함량 측정
총 페놀함량은 Folin-Denis (Gutfinger, 1981) 방법에 따라 공정별 강황 추출물 1ml에 Folin-Ciocalteau 시약 및 10% Na2CO3 용액을 각 1ml씩 차례로 가한 다음 실온에서 1시 간 정치한 후 spectrophotometer (UV1600 PC, Shimadzu, Tokyo, Japan)를 이용하여 700㎚에서 흡광도를 측정하였다. Caffeic acid (Sigma, USA)를 0 ~ 100 ㎍/ml의 농도로 제조하 여 시료와 동일한 방법으로 분석하여 얻은 표준 검량선으로부 터 시료 추출물의 총 페놀함량을 산출하였다.
총 플라보노이드 함량은 Moreno (2000) 방법에 따라 공정 별 강황 추출물 0.5ml에 10% aluminum nitrate 0.1ml 및 1 M potassiumacetate 0.1ml, ethanol 4.3ml를 차례로 가하 여 혼합하고 실온에서 40분간 정치한 다음 415㎚에서 흡광 도를 측정하였다. Quercetin (Sigma, USA)를 표준물질로 하여 0 ~ 100㎍/ml의 농도범위에서 얻어진 표준 검량선으로부터 추 출물의 총 플라보노이드 함량을 계산하였다.
6. DPPH Radical에 대한 전자공여능 측정
공정별 강황 추출물의 전자공여작용 (Electron Donating Abilities, EDA)은 각각의 추출물에 대한 DPPH (1,1- diphenyl-2-picrylhydrazyl)의 전자공여 효과로 각 시료의 환원 력을 측정하였다. 즉, 에탄올 1ml, 시료 10µl, 100 mM sodium acetate buffer (pH 5.5) 990µl를 분주한 시험관에 0.5 mM DPPH 용액 (Abs. EtOH soln.) 0.5ml를 넣어 교반 하고, 암실에서 5분간 반응을 유도한 후 잔존 radical의 농도 를 UV spectrophotometer (Tecan, USA)를 이용하여 517㎚ 에서 측정하였다 (Lee and Lee, 2008). As와 Ac에 실험군과 대조군의 흡광도 값을 각각 대입하여 계산하였다.
7. Superoxide (SOD) 유사활성
SOD 유사활성은 Marklund와 Marklund (1975)의 방법에 따라 과산화수소로 전환반응을 촉매하는 pyrogallol의 생성량 을 측정하여 SOD 유사활성으로 나타내었다. 즉, 각 공정별 강 황 추출물 0.2ml에 pH 8.5로 보정한 Tris-HCl buffer (50 mM Tris (hydroxymethyl) aminomethane + 10 mM EDTA, pH 8.5) 2.6ml와 7.2 mM pyrogallol 0.2ml을 첨가하여 25°C 에서 10분간 반응시키고 1 N HCl 1ml을 가하여 반응을 정 지시켰다. 반응액 중 산화된 pyrogallol의 양은 420㎚에서 UV spectrophotometer (Tecan, USA)를 사용하여 흡광도를 측정하였으며 SOD 유사활성은 시료 용액의 첨가구와 무첨가 구 사이의 흡광도의 차이를 백분율로 나타내었다.
As: 추출물 첨가군의 흡광도
Ac: 추출물 무첨가군의 흡광도
단, As와 Ac는 대조군의 흡광도를 제외한 수치
8. 통계처리
모든 실험의 데이터 통계처리는 3회 반복으로 행해졌으며, 실험값의 통계는 SAS (Statistical Analysis System) 프로그램 의 student t-test를 통해 평균 값을 구하여 처리한 뒤, 처리구 간의 최소유의수준의 차 (p < 0.05)로 통계처리 하였다.
결과 및 고찰
1. 강황 잎의 추출 공정별 수율
Table 1에 강황 잎 추출물의 추출 조건별 수율을 나타내었 다. 추출 수율 측정을 통해 저온 고압 공정을 이용한 강황 잎 추출물이 일반 추출 공정을 이용한 추출물에 비해 약 1.5배 수율이 향상된 것을 확인하였다.
초고압 공정을 이용한 복분자의 면역 활성에 관한 연구에서 초고압 추출물이 일반 열수 추출물에 비해 1.9배까지 증가된 것이 보고되었으며 (Kwon et al., 2007), 이를 통하여 고압 공정에 의해 조직 및 세포벽의 파괴로 세포 내의 유용 활성성 분 용출이 극대화되며 종래의 추출법으로는 용출이 어려웠던 활성성분까지 추출이 가능하여졌기 때문으로 사료된다. 본 연 구의 추출물 중 초고압을 15분 동안 가하여 추출한 강황 잎 추출물이 25.5%의 가장 높은 수율을 보였으며, 열수추출물이 18.3%의 가장 낮을 수율을 보였다. 이를 통하여 초고압 추출 공정이 강황 잎 추출 수율 증가에 효과적이라는 것을 알 수 있었다.
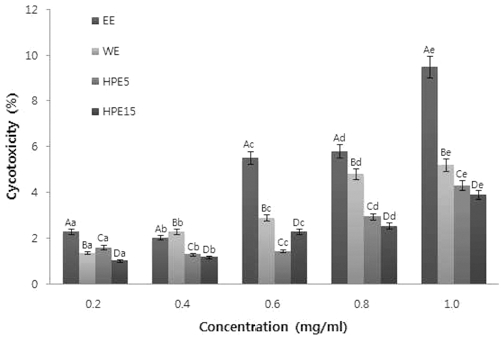
2. 세포 독성 측정
실험에 사용된 각 공정별 추출물의 농도는 0.2, 0.4, 0.6, 0.8, 1.0 mg/ml로 조절하여 인간섬유아세포인 CCD-986sk에 대 한 세포독성을 측정하였다. 실험 결과 Fig. 1을 살펴보면 에탄 올 추출물이 모든 농도에서 가장 세포독성이 높았다. 대부분 농도 의존적으로 모든 시료가 유의적인 차이를 보이며 세포독 성이 증가하는 것을 확인할 수 있었으며, 초고압 15분 처리 강황 잎 추출물이 거의 모든 농도에서 가장 낮은 세포독성을 나타내었다. 에탄올 추출물이 1.0mg/ml의 농도에서 9.5%의 세포독성을 보였으며 열수 추출물, 초고압 5분 추출물 및 초 고압 15분 추출물은 같은 농도에서 각각 5.2%, 4.3%, 3.89% 의 세포독성을 보였다. 이는 고로쇠수피 초고압 추출물의 항 암활성 증진에 대한 연구결과에서 같은 1mg/ml의 고로쇠 추 출물이 20.12%를 나타낸 것 (Jeong et al., 2009)과 비교해 현저하게 낮은 세포독성을 보임으로써, 추후 식품이나 향장 원 료로서 사용될 가능성이 있을 것으로 사료된다. 이 결과를 토 대로 강황 잎에 함유된 세포독성을 유발할 수 있는 물질이 초 고압공정을 이용했을 때, 그 독성 물질이 변성되거나 파괴되 어 강황 잎 추출물의 독성을 완화하는데 탁월한 효과가 있는 것으로 사료된다 (Ling et al., 2011; Kim et al., 2013 ).
3. 총 페놀 및 플라보노이드 함량 측정
열수 추출물, 에탄올 추출물, 초고압 시간별 추출물에 대한 총 페놀 화합물 및 플라보노이드 함량 결과는 Table 2에 나타 내었다. 대부분 페놀 화합물과 플라보노이드의 함량이 초고압 공정을 했을 때가 하지 않았을 때 보다 큰 유의적인 차이 를 보이며 증가하였다. 총 페놀 화합물 함량은 열수 추출물이 282.92µg/mg로 가장 낮은 함량을 보였고, 에탄올 추출물 283.56µg/mg, 초고압 5분 추출물이 301.67µg/mg, 초고압 15 분 추출물이 308.28µg/mg 순으로 높은 함량을 보였다. 또한 플라보노이드 함량은 페놀화합물과 유사한 경향으로 초고압 15분 추출물이 124.33µg/mg으로 열수 추출물과 에탄올 추출 물이 각각 95.68µg/mg 및 106.87µg/mg으로 측정 된 것과 비 교해 15% 가량 높은 수치를 나타내었다. 이러한 결과는 민자 주방망이버섯의 폴리페놀 함량과 항산화활성에 대한 연구에서 민자주방망이버섯 마이크로웨이브 추출물의 폴리페놀 함량이 6.45 g/100 g으로 측정된 것 (Lee et al., 2006)과 비교하여 강 황 잎의 폴리페놀 함량이 현격히 높게 나타난 것을 알 수 있 다. 초고압 공정을 병행하였을 시 총 페놀 화합물과 플라보노 이드 함량이 초고압 공정을 가하지 않은 시료보다 다소 증가 한 것으로 보아 활성성분의 용출이 고압으로 인하여 증진된 것으로 보인다. 이 실험으로 항산화에 중요한 물질인 총 페놀 과 플라보노이드 함량을 확인함으로써 강황 잎의 항산화 활성 증진을 확인하였다.
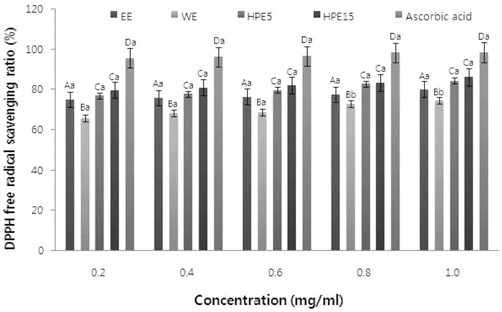
4. DPPH Radical에 대한 전자공여능 측정
각 추출물에서 자유라디칼을 환원시키거나 상쇄시키는 능력 이 높으면 강한 항산화 활성 및 활성산소 소거활성을 기대할 수 있으며, 인체 내에서 활성 라디칼에 의한 노화를 억제하는 척도로도 이용이 가능하다 (Seo et al., 2008; Park et al., 2005). 추출 공정에 따른 강황 잎 추출물의 DPPH free radical 소거 활성을 측정한 결과를 Fig. 2에 나타내었다. 같은 샘플에서 농도에 따라 추출물의 radical 소거활성의 큰 차이는 보이지 않았으나 같은 농도에서는 초고압 5분 강황 잎 추출물 과 초고압 15분 강황잎 추출물을 제외하고는 유의적인 차이 를 보였다. 1mg/ml의 농도에서의 강황 잎 추출물의 DPPH radical 소거활성은 에탄올 추출물, 열수 추출물, 초고압 5 분, 초고압 15분 강황 잎 추출물이 각각 80.11%, 74.65%, 84.26%, 86.15%로 초고압 15분 강황 잎 추출물이 가장 높은 자유라디칼 소거력을 보였으며, 가장 낮은 열수 강황 잎 추출 물에 비해 12% 정도 활성이 증진된 것을 확인할 수 있었다.
약용식물의 항산화 활성 연구에서 1mg/ml 농도의 오가피, 산 수유 추출물이 약 70 ~ 77%의 자유라디칼 소거력을 나타낸 것 (Jung et al., 2004)과 비교하면 본 연구 결과에서 강황 잎의 초고압 추출물이 77%이상의 뛰어난 활성산소 소거력을 나타 냈다는 것을 알 수가 있다. 이러한 결과는 고압 추출 공정을 통하여 강황 잎 세포 및 조직의 파괴로 인해 유용물질의 용출 이 증가된 것이라 사료된다.
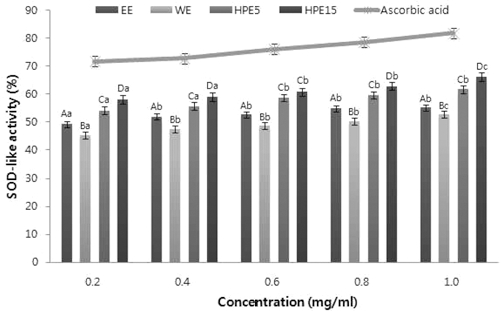
5. SOD 유사활성 측정
SOD 유사활성을 확인한 결과는 Fig. 3에 나타내었다. 같은 샘플의 경우에 농도에 따라 미미한 차이를 보여 큰 유의적 차 이는 나타나지 않았으며, 샘플간에는 모두 유의적인 차이를 보 였다. 초고압 15분 강황 잎 추출물이 1.0mg/ml의 농도에서 66.25%의 가장 높은 활성을 나타내었다. 표준검량 물질로 사 용되어진 ascorbic acid가 81%의 활성을 나타낸 것과 비교하 면 다소 낮은 결과를 보였다. 강황 잎 추출물의 SOD 유사활 성이 ascorbic acid보다는 낮으나 한국 약용 및 식용식물들의 항산화성 식물탐색 연구에서 보고된 약용식물 60여종의 평균 34.8% 보다는 비교적 높은 수치를 나타내었다 (Chung et al., 1998). 외부로부터 산화스트레스를 받으면 체내에 활성산소가 발생하며 노화, 발암의 원인인 유기물을 산화시켜 독성이 강 한 산화물과 superoxide가 생성되는데 이 때 SOD에 의하여 소거되는 것으로 알려져 있다. SOD는 superoxide 음이온을 정상상태의 산소로 환원시킴으로써 superoxide에 의해 발생하 는 노화를 억제한다고 알려져 있다 (Pyror, 1986). 앞서 진행 한 폴리페놀 및 플라보노이드 함량, DPPH 자유라디칼 소거력 의 결과와 더불어 본 실험은 강황 잎의 초고압 추출물이 항산 화 활성을 가지며 초고압 공정을 통하여 그 효능에 더 증진된 것이라 사료된다.
REFERENCES
- Ahn, BJ, Lee, JT, Skin aging and cosmetic, Seonmyoungsa. Seoul. Korea, (1999), p85-112.
- Ahn, MS, Choi, SR, Song, EJ, Seo, SY, Chiu, MK, Jin, YS, Dyeing properties and antibactyerial activity of silk fabric using extracts of turmeic, Korean Journal of Human Ecology, (2012), p107-108.
- Bennett, PB, Marquis, RE, Demchenko, I, High pressure biology and medicine, (1998), New York City. New York. USA, University of Rochester Press, p1-428.
-
Branen, AS, Toxicology and biochemistry of butylated hydroxyanisole and butylated hydroxytoluene, Journal of the American Oil Chemist's Society, (1), p59-62.
[https://doi.org/10.1007/bf02901825]

- Chung, IM, Kim, KH, Ahn, JK, Screening of Korean medicinal and food plants with antioxidant activity, Korean Journal of Medicinal Crop Science, (1998), 6, p311-322.
-
Fridovich, I, Biological effects of the superoxide radical, Archives of Biochemistry and Biophysics, (1986), 247, p1-11.
[https://doi.org/10.1016/0003-9861(86)90526-6]

- Fukuzawa, K, Takaishi, Y, Antioxidants, Journal of Active Oxygen and Free Radicals, (1990), 1, p55-70.
-
Gutfinger, T, Polyphenols in olive oils, Journal of the American Oil Chemist's Society, (1981), 58, p966-967.
[https://doi.org/10.1007/bf02659771]

-
Harman, D, Aging: A theory based on free radical and radiation chemistry, The Journals of Gerontology, (1956), 11, p298-300.
[https://doi.org/10.1093/geronj/11.3.298]

-
Jayaprakasha, GK, Jagan, M, Rao, L, Sakariah, KK, Chemistry and biological activities ofC. longa, Trends in Food Science and Technology, (2005), 16, p533-548.
[https://doi.org/10.1016/j.tifs.2005.08.006]

-
Jeong, MH, Kim, SS, Ha, JH, Jin, L, Lee, HJ, Kang, HY, Park, SJ, Lee, HY, Enhancement of anticancer activity ofAcer monoby high pressure extraction process, Journal of the Korean Society of Food Science and Nutrition, (2009), 38, p1243-1252.
[https://doi.org/10.3746/jkfn.2009.38.9.1243]

- Jung, SJ, Lee, JH, Song, HN, Seon, SS, Lee, SE, Baek, NI, Screening for antioxidant activity of plant medicinal extracts, Journal of the Korean Society for Applied Biological Chemistry, (2004), 47, p135-140.
- Kim, CH, Kwon, MC, Syed, AQ, Hwang, B, Nam, JH, Lee, HY, Toxicity reduction and improvement of anticancer activities fromRhodiola sacha-linensisA. Bor by ultra high pressure extracts process, Korean Journal of Medicinal CropScience, (2007), 15, p411-416.
-
Kim, JS, Kim, JW, Kwon, HS, Lim, HW, Lee, HY, Screening of skin whitening activity ofCodonopsis lanceolataextract by complex steaming process, Korean Journal of Medicinal Crop Science, (2013), 21, p54-60.
[https://doi.org/10.7783/kjmcs.2013.21.1.54]

- Kwon, MC, Kim, CH, Na, CS, Kwak, HG, Kim, JC, Lee, HY, Comparison of immuno-modulatory regulatory activities ofRubus coreanusMiquel by ultra high pressure extracts process, Korean Journal of Medicinal Crop Science, (2007), 15, p398-404.
- Lee, HH, Lee, SY, Cytotoxic and antioxidant effects ofTaraxacum coreanumNakai. andT. officinaleWeb extracts, Korean Journal of Medicinal Crop Science, (2008), 16, p79-85.
- Lee, YS, Joo, EY, Kim, NW, Polyphenol contents and antioxidant activity ofLepista nuda, Journal of the Korean Society of Food Science and Nutrition, (2006), 35, p1309-1314.
-
Leibovita, BE, Siegel, V, Aspects of free radical reactions in biological systems: Aging, The Journals of Gerontology, (1980), 35, p45-56.
[https://doi.org/10.1093/geronj/35.1.45]

- Ling, J, Ha, JH, Choi, WY, Seo, YC, Kim, S, Kim, YO, Cha, SW, Kim, JC, Lee, HY, Enhancement of cosmecceutical activities ofBerberis koreanabark by high pressure and ultrasonification extraction processes, Korean Journal of Medicinal Crop Science, (2011), 19, p54-65.
- Marklund, S, Marklund, G, Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase, European Journal of Biochemistry, (1975), 47, p469-474.
-
Meneghini, R, Martins, EAL, Calderaro, M, Poli, G, , DNA damage by reactive oxygen species: The role of metal, Free radicals: From basic science to medicine. Molecular and cell biology updates, (1993), Basel Stadt, Switzerland, Birkhäuser Verlag. Basel, p102-112.
[https://doi.org/10.1007/978-3-0348-9116-5_9]

-
Moreno, MI, Isla, MI, Sampietro, AR, Vattuone, MA, Comparison of the free radical-scavenging activity of propolisfrom several regions of Argentina, Journal of Ethnopharmacology, (2000), 71, p109-114.
[https://doi.org/10.1016/s0378-8741(99)00189-0]

-
Mosmann, T, Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays, Journal of Immunological Methods, (1983), 65, p55-63.
[https://doi.org/10.1016/0022-1759(83)90303-4]

- Park, JH, Lee, HS, Mun, HC, Kim, DH, Seong, NS, Jung, HG, Bang, JK, Lee, Y, Effect of ultrasonification process on enhancement of immuno-stimulatory activity ofEphedra sinicaStapf andRubus coreanusMiq, Korean Society for Biotechnology and Bioengineering, (2004), 19, p113-117.
- Park, KE, Jang, MS, Lim, CW, Kim, YK, Seo, Y, Park, HY, Antioxidant activity on ethanol extract from boiled-water ofHizikia fusiformis, Journal of the Korean Society for Applied Biological Chemistry, (2005), 48, p435-439.
-
Pyror, WA, Oxy-radicals and related species: Their formation, lifetime, and reactions, Annual Review of Physiology, (1986), 48, p657-667.
[https://doi.org/10.1146/annurev.physiol.48.1.657]

- Ryu, GY, No, KH, Ryu, SR, Yang, HS, Study of separation and analysis method an effective component from Ugeum(Curcuma longa) and a contained curcumin as product of national and partially region cultures, Applied Chemistry, (2005), 9, p57-60.
- Seo, HS, Chung, BH, Cho, YG, Antioxidant and anticancer effects of agrimony(Agrimonia pilosaL.) and chinese lizardtail(Saururus chinensisBaill), Applied Chemistry, (2008), 9, p57-60.