지실의 Poncirin, Naringin의 동시분석법 확립과 초음파 추출법 최적화
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
The Ponciri fructus immaturus (Poncirus trifoliata Rafinesque) has been used in oriental medicine for uterine contraction, stomachache, abdominal distension and cardiovascular diseases. Two main compounds, poncirin and naringin were successfully analyzed by high performance liquid chromatography (HPLC) and carried out method validation according to ICH guideline. A successful resolution and retention times were obtained with a C18 reversed phase column, at an 1 ml min−1 flow rate, with a gradient elution of a mixture of methanol, water and acetonitrile. Poncirin and naringin showed good linearity (R2 > 0.999) in relatively wide concentration ranged. The recovery of each compound was 95.81 ~ 101.48% with R.S.D. values less than 1.0%. The application of ultrasound-assisted extraction was shown to be more efficient in extracting poncirin and naringin from Ponciri fructus immaturus. The predicted optimal poncirin and naringin yield were poncirin 2.15%, naringin 1.65% under an extraction temperature of 40°C, an extraction time of 10 min in a solvent of 70% methanol.
Keywords:
Ponciri Fructus Immaturus, Poncirin, Naringin, HPLC, Ultrasound-Assisted Extraction, Optimization서 언
지실 (Ponciri fructus immaturus)은 운향과 (Rutaceae)에 속한 탱자나무 (Poncirus trifoliata Rafinesque)의 익지 않은 열매로 봄• 여름철에 1 ~ 2㎝의 어린 열매를 채취하여 쪼개 서 말린 것을 사용한다 (Hwang, 1997). 한의학에서 지실의 효능은 가슴과 복부 팽만, 수종, 변비 등에 사용하였으며, 또 한 위를 튼튼하게 하고 소화를 촉진시키기 위하여 널리 사용 되고 있다 (Chung et al., 2005; Lee et al., 2009; Yoon et al., 2012). 최근에는 항염효능, 항과민증 효과와 지실 추출물 이 암세포의 세포사멸을 유도하는 효과가 있다고 보고되었다 (Lee et al., 2008). 지실의 성분으로는 정유성분인 limonene, linalool, camphene과 flavonoid 성분인 poncirin, naringin, natrirutin, hesperidin, neohesperidin 그리고 coumarin 성분인 umbelliferone, auraptene, imperatorin이 보고되었다 (Lee et al., 2011; Wang et al., 2010). Flavonoid는 식물의 줄기, 뿌 리, 껍질에 분포하는 색소성분이며 항산화 작용을 비롯하여 항 암, 항혈전, 항염증 및 항균 작용 등 다양한 생리활성을 보여 주고 있다 (Jeon et al., 2012; Kim et al., 2004). 지실의 flavonoid 성분인 poncirin은 항혈소판 작용 및 장내세균 억제 작용, 조골세포 분화효과와 항 헬리코박터파이로리 활성이 있 다고 알려져 있다 (Kim et al., 1999; Teng et al., 1992; Zhu et al., 2013). Naringin은 콜레스테롤 억제효과와 백혈병 세포를 정상세포로 변화시키는 작용, 항 바이러스성, 간 보호 효과, 유방암 세포증식 저해작용이 있는 것으로 보고되었다 (Gordon et al., 1995; Jung et al., 2003; Ng et al., 1996).
Flavonoid 성분을 정성, 정량 분석하기 위해서 많은 분석방 법들이 개발되었는데 그 중에서도 High Performance Liquid Chromatography (HPLC)이 많이 사용되고 있다 (Ribeiro and Ribeiro, 2008). 지실에 함유된 flavonoid 성분 분석 (Hwang, 1997), 지실과 지각 중 flavonoid glycosides의 분리 및 정량 에서 HPLC를 이용하였고, 최근에 naringin은 식물추출물, 생 체액과 제약 처방약품에서 분리 및 정량하는데 역상 HPLC가 많이 사용되어진다고 보고된다 (Kanaze et al., 2003).
일반적으로 천연물로부터 유효 성분 추출을 위해서 환류 추 출, 속실렛 추출을 사용하였는데 많은 용매와 에너지 사용, 긴 시간이 소요되는 단점 때문에 초임계 유체 추출과 마이크로웨 이브 추출이 사용되고, 특히 flavonoid 성분은 초음파 추출법 이 많이 사용되고 있다 (Sun et al., 2012; Yang et al., 2013). 초음파 추출법 (ultrasound-assisted extraction)은 비가 열 방식의 추출법으로 가열에 의한 활성성분의 파괴를 최소화 할 수 있으며, 초음파가 용매를 통과하며 생성되는 공동화현 상 때문에 추출수율의 향상과 유용성분의 안전한 용출이 가능 하며 추출시간을 감소시키는 효율적인 추출 기법이다 (Jang et al., 2012; Ling et al., 2011; Xia et al., 2011).
지실의 성분분석과 관련하여 Hwang (1997)과 Kim 등 (1989)에서는 환류추출법을 사용하였고 Wang 등 (2010)에서는 naringin의 함량분석에서 환류추출법과 마이크로파추출법을 비 교하였다. Lee 등 (2011)은 poncirin과 naringin의 함량 분석 에서 초음파 추출법을 이용하였지만 초음파를 이용한 최적의 추출법과 관련된 연구는 미비한 실정이다. 식물체 내에 존재 하는 많은 화합물들은 추출용매, 용매비율, 추출 시간과 온도 등 추출조건이 식물 화합물의 함량과 이화학적인 특성에 영향 을 미치므로 (Kim et al., 2010) 조건별 추출법을 최적화하고 자 한다.
본 연구에서는 지실의 KP 10 (MFDS Notification No. 2013-103, 2013)에 지표물질로 설정되어있는 poncirin과 naringin의 효과적인 동시 분석법을 정립하고 추출용매, 시 료• 용매조성 비율, 추출시간 및 추출온도 등의 최적의 추출 조건을 확립하고자 한다.
재료 및 방법
1. 재료 및 시약
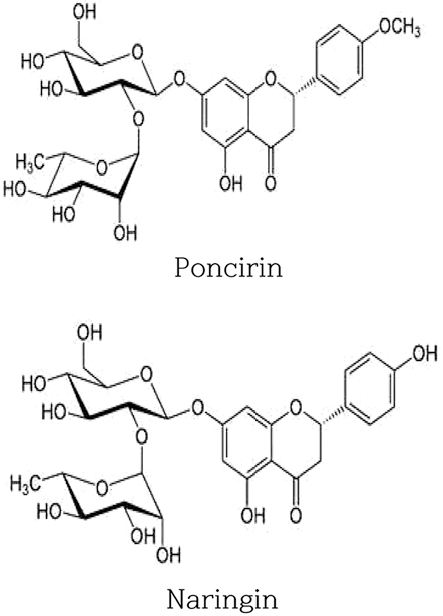
경북 춘양산에서 수집한 자연산 지실을 운곡한약품에서 2013년 6월에 구입하였고 최고야 박사로부터 기원의 진위와 품질상태를 검증받았다. 건조 지실은 Mixer (HMF-3000s, Hanil, Korea)로 분쇄한 후 70 mesh의 체로 쳐서 기밀용기에 보관하여 사용하였다. 지실의 지표성분인 poncirin (≥ 96.0%) 은 Fluka사 (USA), naringin (≥ 96.8%)은 Chromadex사 (USA) 에서 구입하였으며 (Fig. 1), 시료의 추출 및 분석에 사용된 용매인 acetonitrile, distilled water, ethyl alcohol, methanol은 Burdick & Jackson사 (USA)의 HPLC급 제품을 사용하였다.
2. 전처리 및 HPLC 분석 방법
지실 분말을 50ml 용량 플라스크에 넣은 후, 용매 종류별, 용매 농도별, 시료·용매 비율별, 추출 시간별, 추출 온도별로 초음파 추출기 (Branson 8510, 40 kHz, Emerson Industrial Automation, USA)를 이용하여 추출하였고 추출조건별 수율 및 성분 정량분성은 3회 반복 실시하였다. 분석 전 추출액은 0.45㎛ syringe filter를 통과시킨 여액을 시료로 사용하였다. Poncirin, naringin 표준품 각 2㎎을 정밀히 재어 10ml methanol에 용해시켜 200µg/ml로 만들어 표준원액을 제조한 후, methanol로 단계적으로 희석하여 10, 25, 50 및 100µg/ml 농도가 되도록 표준용액을 만들어 3반복 정량 분석 하였다.
HPLC는 LC-20AD pump, SPD-10A UV-Vis detector 과 SIL-20A auto sampler등으로 구성된 LC-20A series (Shimadzu, Japan)이고 분석용 컬럼은 XBridgeTM C18 (4.6 × 250㎜, 5㎛, Waters, USA)를 이용하였다. 이동상으로는 Water :Methanol : Acetonitrile을 gradient mode로 흘려주었다. 주입량은 10㎕, 유속은 1.0ml/min, 검출은 UV detector를 이 용하여 313㎚에서 검출하였다 (Table 1).
분석법 validation은 ICH 가이드라인 (Gandhimathi and Ravi, 2008)에 준하여 지실의 poncirin, naringin의 검량선은 10 ~ 200µg/ml 범위에서 작성하였다. 검출한계 (Limit of Detection)와 검량한계 (Limit of Quantification) 값은 HPLC/ UV-vis에 주입 후 얻은 결과 값을 통해 측정에 대한 표준편차 (σ)를 계산하고, 선형검정곡선을 작성하여 기울기 (s)를 LOQ 는 3.3× σ/S와 LOQ는 10 × σ/S로 계산하였다 (Ma et al., 2013). 동일 시료에 대해 실험환경의 변동이 미치는 변화를 확인하기 위해 일내 (intra day, repeatability) 및 일간 (inter day, reproducibility) 정밀성 (precision)을 3가지 농도에서 평 가하였고, 결과는 상대표준편차 (RSD)로 나타내었다. 정확성 평가를 위한 회수율 시험 (recovery)은 표준물 첨가법에 의하 여 상대표준편차를 측정하여 확인하였다.
통계분석은 Minitab 16 (Minitab Inc., USA)을 이용하였 고, 추출방법에 따른 추출수율은 ANOVA (Analysis of Variance)를 이용하여 분산 분석 후 Tukey법으로 사후검정을 실시하였고, Korean Pharmacopoeia Tenth Edition (KP 10, MFDS Notification No. 2013-103, 2013) 추출 방법과의 비교는 독립표본 t-test로 분석하여 추출 수율의 유의성을 검증하였다.
결과 및 고찰
1. 분석 조건의 확립
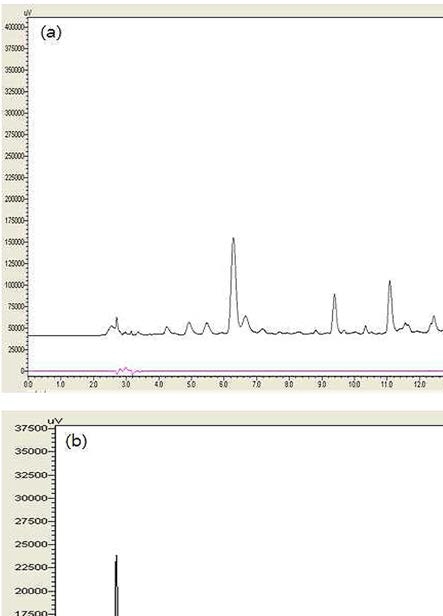
지실의 지표성분인 poncirin, naringin에 대한 동시 정량 분 석법을 확립하고자 KP 10 (MFDS Notification No. 2013- 103, 2013) 기준을 참고하여 다양한 용매와 용매조성에 대하 여 분석조건을 변화시킨 결과 Water :Methanol : Acetonitrile (70 : 15 : 15→50 : 25 : 25) 기울기 용리조건을 확립하여 분석 하였다. 기존의 방법으로 분석한 크로마토그램 (Fig. 2a)에서 는 naringin은 추출물에서 피크의 겹침이 심해 분리능이 좋지 않았는데 새로 정립한 분석조건에서는 높은 분리능과 좋은 크 로마토그램 (b)을 보였다 (Fig. 2b).
2. 검량성 및 검출한계 (LOD), 검량한계 (LOQ) 검증
지실의 지표성분인 poncirin (R2= 1), naringin (R2= 0.999) 은 모두 양호한 직선성을 보였다. 농도범위와 LOD, LOQ 값 은 poncirin은 10.2 ~ 203.0µg/ml농도범위에서 0.019µg/ml, 0.056µg/ml이고, naringin은 10.3 ~ 205.0µg/ml 농도범위에서, 0.016µg/ml, 0.049µg/ml으로 미량의 성분까지 검출 가능하였 다 (Table 2).
3. 분석법의 정밀성 (Precision)과 정확성 (Recovery) 검증
분석법의 정밀성 평가를 위해 두 지표물질의 직선성이 확인 된 농도 구간 중 3가지 농도를 기준으로 일간 (inter-day) 정 밀도와 일내 (intra-day) 정밀도를 3회 반복 측정하였는데 일간 정밀도는 0.02 ~ 0.11%, 일내 정밀도는 0.01 ~ 0.07%의 상대표 준편차 (RSD%) 값을 보여주었다 (Table 3).
분석법의 정확성 평가를 위하여 회수율 실험을 진행한 결 과 poncirin은 98.77%, naringin은 100.80%의 회수율을 나타 내었고 각각 0.082, 0.023% 상대표준편차를 보였다 (Table 4).
4. 용매종류 및 용매 조성에 따른 추출수율 변화
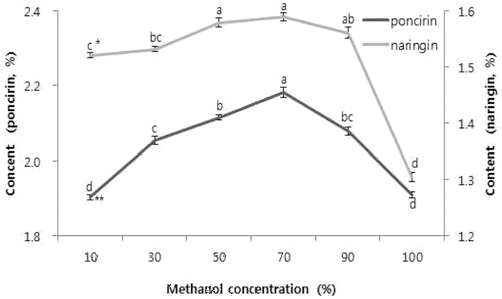
추출용매 조건의 변화에 따른 추출효율을 알아보기 위하여 지실 분말 0.5 g, 용매 50ml, 60 min, 상온에서 flavonoid glycoside계 화합물은 alcohol, 물 또는 이들의 혼합용매로 추 출하는 것이 일반적이라는 것을 참고하여 (Kim et al., 1989) 에탄올, 물, 메탄올로 추출하였다. 평균 함량은 에탄올, 물, 메탄올에서 각각 poncirin 1.40%, 1.97%, 2.01%, naringin 0.86%, 1.55%, 1.28%로 poncirin은 메탄올에서 naringin은 물 에서 높은 수율을 보였다. 메탄올은 극성용매와 비극성용매에 서 용출되는 물질 모두가 잘 용출되고 용해도가 크고 가격이 저렴하고 추출 조작이 편리하여 식물추출 용매로 자주 사용 되어진다 (Shin and Lee, 2011). 가장 추출 수율이 높은 메탄 올과 물을 혼합하여 비교한 결과, 물과 메탄올 추출물보다 혼 합용매에서 더 높은 수율을 보였고 혼합용매에서 추출효율이 더 높은 것은 일정비율의 물이 함유될 때 건조된 시료의 조직 을 팽창시켜 용매가 시료공극내부로 부터 많이 침출되어 추출 효과가 좋다는 보고가 있었다 (Kim et al., 2010). 70% 메탄 올 추출물에서 poncirin 함량은 2.18%로 통계적으로 유의성 있 게 함량이 가장 높았고, naringin은 50, 70% 메탄올에서 유의 적으로 높은 결과를 보였지만 평균수율이 50% 메탄올은 1.57%, 70% 메탄올은 1.59%로 산술적으로 높은 값을 보였다 (Fig. 3).
5. 시료와 용매 비율에 따른 추출수율 변화
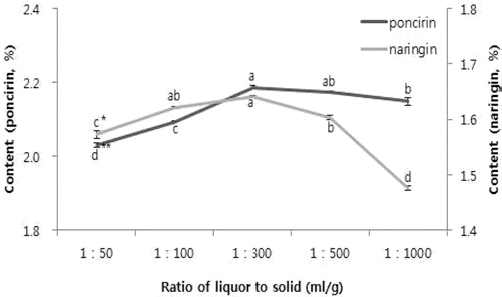
용매 조성 추출수율이 가장 높은 70% 메탄올 50ml와 60 min, 상온에서 각 시료용매 비율별 지실 분말을 사용하여 추출수율 변화를 비교해 보았다. 시료와 용매의 비율을 1 : 50, 1 : 100, 1 : 300, 1 : 500, 1 : 1000으로 설정하여 추출한 결과, 각각 1 : 300에서 poncirin 2.19%, naringin 1.64%으로 높은 수율을 보였고, 통계 결과는 두 성분 모두 1 : 300에서 유의적 으로 높은 결과를 보였다 (Fig. 4).
6. 추출 시간에 따른 추출수율 변화
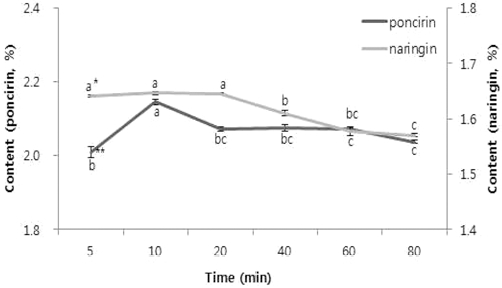
추출수율이 가장 높은 70% 메탄올 50ml, 지실 분말 0.167 g과 상온에서 다른 초음파 시간 (5, 10, 20, 40, 60, 80 min)을 설정하여 추출하였을 때, 각각 10 min에서 poncirin 2.15%, naringin 1.65%으로 높은 수율을 보였다. Tukey 사후 검정 결과 poncirin은 10분에서 유의적으로 높았고 naringin은 5, 10, 20분에서 유의적으로 높았지만 10분에서 산술적으로 높 은 평균 수율을 보였으며 시간이 길수록 추출수율이 떨어지는 것을 확인 할 수 있었다 (Fig. 5).
7. 추출 온도에 따른 수율변화
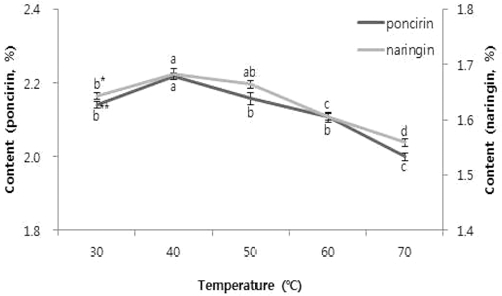
추출수율이 가장 높은 70% 메탄올 50ml, 지실 분말 0.167 g, 초음파 시간 10 min과 온도에 따른 함량변화를 알아 보기 위해 30, 40, 50, 60, 70°C의 조건에서 추출하였을 때, 각각 40°C에서 poncirin 2.22%, naringin 1.68%으로 높은 수 율을 보였다. 통계 결과는 두 성분 모두 40°C에서 유의적으로 높은 결과를 보였고 40°C 이후로 온도가 올라갈수록 추출수율 이 떨어지는 경향이 나타났다 (Fig. 6).
본 연구를 통하여 지실의 poncirin, naringin에 대한 동시분 석 정량법과 초음파를 이용하여 최적의 추출법을 확립하고 검 증하였다. 지실의 poncirin, naringin은 70% methanol로 1 : 300의 시료용매비율, 10 min 동안 40°C에서 추출효율이 가 장 좋은 최적의 추출조건을 확립하였다. 조건별로 살펴본 결 과 용매와 용매비율별로 비교하였을 때 추출수율이 poncirin 1.40 ~ 2.18%, naringin 0.86 ~ 1.59%로 가장 많은 차이를 보 였는데 이는 초음파 추출에서 용매가 추출효율에 가장 효과적 인 영향을 미친다는 기존의 연구결과 (Ma et al., 2008)와 비 슷한 결과를 보였다. 또한 초음파 추출법은 낮은 온도에서 추 출하여 유용성분의 파괴를 줄일 수 있고 짧은 시간에도 높은 추출수율과 생리활성을 기대할 수 있다는 결과 (Woo et al., 2009)와 같이 10분이라는 짧은 추출시간과 40°C의 온도에서 높은 추출수율을 보였다.
새롭게 개발된 분석방법을 검증하고자 직선성, 특이성, 정밀 성, 정확성의 검증하여 신뢰성을 높이고자 하였고, 2가지 성분 을 동시 분석할 수 있도록 그 조건을 확립함으로써 경제적, 시간적 및 인력에 대한 효율을 증대시킬 수 있었다. 기존의 KP 10 (MFDS Notification No. 2013-103, 2013)의 추출법 과 정립된 추출법과 비교하였을 때 poncirin 함량은 2.12%와 2.15%로 최적화된 추출법에서 더 높은 함량을 보였다. Naingin은 약전 추출법에서 1.49%와 최적화된 추출법에서 1.60% 함량을 보였고, t-test결과 p-value가 0.05이하로 나타나 유의적인 차이를 보이는 것을 확인 할 수 있었다.
지실의 유효성분인 poncirin, naringin의 동시 분석법과 최적 의 추출조건 확립을 위하여 실험을 진행하였고, 정립된 분석 법과 초음파를 이용한 최적의 추출조건이 지실의 품질관리에 신속하고 효율적으로 사용될 수 있을 것으로 사료된다.
감사의 글
본 연구는 한국한의학연구원 전통의학 소재 자원 관리 시스템 구축사업(K14142) 및 ICT 융합 대체 한약자원 확보사 업(K14410)의 고유생물자원 특성평가 및 대체 한약 자원 발 굴 연구과제(K14411)의 지원으로 이루어졌으며 이에 감사드 립니다.
REFERENCES
- Chung, HS, Hwang, SH, Youn, KS, Physicochemical characteristics of Ponciri fructus in relation to drying treatment, Korean Journal of Food Preservation, (2005), 12, p449-454.
-
Gandhimathi, M1, Ravi, TK, Use of Folin-Ciocalteu phenol reagent and 3-methyl-2-benzothiazolinone hydrazine hydrochloride in the determination of oxcarbazepine in pharmaceuticals, Acta Pharmaceutica, (2008), 58, p111-118.
[https://doi.org/10.2478/v10007-007-0049-x]

-
Gordon, PB, Holen, I, Seglen, PO, Protection by naringin and some other flavonoids of hepatocytic autophagy and endocytosis against inhibition by okadaic acid, The Journal of Biological Chemistry, (1995), 270, p5830-5838.
[https://doi.org/10.1074/jbc.270.11.5830]

- Hwang, GS, Analytical study on the flavonoid ofPoncirus trifoliata, Korean Journal of Oriental Preventive Medical Society, (1997), 1, p55-58.
-
Jang, GY, Kim, HY, Lee, SH, Kang, YR, Hwang, IG, Woo, KS, Kang, TS, Lee, JS, Jeong, HS, Effects of heat treatment and extraction method on antioxidant activity of several medicinal plants, Journal of the Korean Society of Food Science and Nutrition, (2012), 41, p914-920.
[https://doi.org/10.3746/jkfn.2012.41.7.914]

-
Jeon, SY, Baek, JH, Jeong, EJ, Cha, YJ, Optimal extraction conditions of flavonoids from onion peels via response surface methodology, Journal of the Korean Society of Food Science and Nutrition, (2012), 41, p695-699.
[https://doi.org/10.3746/jkfn.2012.41.5.695]

-
Jung, UJ, Kim, HJ, Lee, JS, Lee, MK, Kim, HO, Park, EJ, Kim, HK, Jeong, TS, Choi, MS, Naringin supplementation lowers plasma lipids and enhances erythrocyte antioxidant enzyme activities in hypercholesterolemic subjects, Clinical Nutrition, (2003), 22, p561-568.
[https://doi.org/10.1016/s0261-5614(03)00059-1]

-
Kanaze, FI, Gabrieli, C, Kokkalou, E, Georgarakis, M, Niopas, I, Simultaneous reversed-phase high-performance liquid chromatographic method for the determination of diosmin, hesperidin and naringin in different citrus fruit juices and pharmaceutical formulations, Journal of Pharmaceutical and Biomedical Analysis, (2003), 33, p243-249.
[https://doi.org/10.1016/s0731-7085(03)00289-9]

- Kim, DH, Bae, EA, Han, MJ, Anti-halicobacter pylori activity of the metabolites of poncirin fromPoncirus trifoliataby human intestinal bacteria, Biological & PharmaceuticalBulletin, (1999), 22, p422-424.
- Kim, JS, Choi, YH, Seo, JH, Lee, JW, Kim, SK, Choi, SU, Kang, JS, Kim, YK, Kim, SH, Kim, YS, Ruy, SY, Antiproliferative activity of naturally occurring flavonoids on cultured human tumor cell lines, Korean Journal of Pharmacognosy, (2004), 35, p164-170.
- Kim, MK, Jeong, CS, Shin, YK, Park, KH, Lee, WJ, Lee, EJ, Paek, KY, Effects of extraction condition on extraction efficiency of rubiadin in adventitious roots of Noni(Morinda citrifolia), Korean Journal of Horticultural Science & Technology, (2010), 28, p685-690.
- Kim, MO, Kim, JS, Sa, YJ, Jeong, HJ, Chun, WJ, Kwon, YS, Kim, TY, Choi, HS, Yu, CY, Kim, MJ, Screening of extraction solvent condition of fermented Rhus verniciflua stem bark by antioxidant activities, Korean Journal of Medicinal Crop Science, (2010), 18, p217-223.
- Kim, TJ, No, JY, Ko, JS, Rhee, JS, The separation and determination of flavonoid glycosides fromPoncirus trifoliatarafia and Citrus aurantium L, Analytical Science & Technology, (1989), 2, p301-307.
- Lee, AY, Chun, JM, Jang, S, Choo, BK, Lee, HW, Kim, HK, Change of quality inPoncirus trifoliatarafinesque according to storage conditions, Korean Journal of Medicinal Crop Science, (2008), 16, p188-191.
-
Lee, JH, Lee, SH, Kim, YS, Jeong, CS, Protective effects of neohesperidin and poncirin isolated from the fruits ofPoncirus trifoliataon potential gastric disease, Phytotherapy Research, (2009), 23, p1748-1753.
[https://doi.org/10.1002/ptr.2840]

- Lee, SL, Seo, CS, Kim, JH, Shin, HK, Contents of poncirin and naringin in fruit ofPoncirus trifoliataaccording to different harvesting times and locations for two years, Korean Journal of Pharmacognosy, (2011), 42, p138-143.
-
Ling, J, Ha, JH, Choi, YY, Seo, YC, Kim, JS, Kim, YO, Cha, SW, Kim, C, Lee, HY, Enhancement of cosmeceutical activities of Berberis koreana bark by high pressure and ultrasonification extraction processes, Korean Journal of Medicinal Crop Science, (2011), 19, p54-65.
[https://doi.org/10.7783/kjmcs.2011.19.1.054]

-
Ma, KN, Cho, HW, Myung, SW, Analysis of gibberellic acid from fruits using HPLC/UV-vis, AnalyticalScience & Technology, (2013), 26, p19-26.
[https://doi.org/10.5806/ast.2013.26.1.019]

- Ma, Y, Ye, X, Hao, Y, Xu, G, Xu, G, Liu, D, Ultrasoundassisted extraction of hesperidin from penggan(Citrrus reticulata) peel, Ultrasonics Sonochemistry, (2008), 15, p227-232.
- Ministry of Food and Drug Safety(MFDS), The Korean pharmacopoeia, (2013), (10th ed.), 103, p1198-1199.
-
Ng, TB, Ling, JM, Wang, ZT, Cai, JN, Xu, GJ, Examination of coumarins, flavonoids and polysaccharopeptide for antibacterial activity, General Pharmacology, (1996), 27, p1237-1240.
[https://doi.org/10.1016/0306-3623(95)02143-4]

-
Ribeiro, IA, Ribeiro, MHL, Naringin and naringenin determination and control in grapefruit juice by a validated HPLC method, Food Control, (2008), 19, p432-438.
[https://doi.org/10.1016/j.foodcont.2007.05.007]

-
Shin, SL, Lee, CH, Screening of effective extraction conditions for increasing antioxidant activities from fronds of Osmunda japonica, Korean Journal of Plant Resources, (2011), 24, p174-180.
[https://doi.org/10.7732/kjpr.2011.24.2.174]

-
Sun, Y, Bi, J, Zhang, L, Ye, B, Ultrasound-assisted extraction of three bufadienolides from chinese medicine Chansu, Ultrasonics Sonochemistry, (2012), 19, p1150-1154.
[https://doi.org/10.1016/j.ultsonch.2012.03.003]

-
Teng, CM, Li, HL, Wu, TS, Huang, SC, Huang, SC, Huang, TF, Antiplatelet actions of some coumarin compounds isolated from plant sources, Thrombosis Research, (1992), 66, p549-557.
[https://doi.org/10.1016/0049-3848(92)90309-x]

- Wang, C, Pan, Y, Fan, G, Chai, Y, Wu, Y, Application of an efficient strategy based on MAE, HPLC-DAD-MS/MS and HSCCC for the rapid extraction, identification, separation purification of flavonoids from Fructus aurantii immaturus, Biomedical Chromatography, (2010), 24, p235-244.
- Woo, JH, Shin, SL, Chang, YD, Lee, CB, Comparison of antioxidant effects by different extraction methods in flowers ofAster scaber, Aster maackii, Coreopsis lanceolataandCoreopsis tinctoria, Aster maackii. Coreopsis lanceolata and Coreopsis tinctoria. Korean Journal of Plant Resources, (2009), 22, p381-388.
-
Xia, EQ, Ai, XX, Zang, SY, Guan, TT, Xu, XR, Li, HB, Ultrasound-assisted extraction of phillyrin from Forsythia suspensa, Ultrasonics Sonochemistry, (2011), 18, p549-552.
[https://doi.org/10.1016/j.ultsonch.2010.09.015]

-
Yang, YC, Wei, MC, Huang, TC, Lee, SZ, Lin, SS, Comparison of modified ultrasound-assisted and traditional extraction methods for the extraction of baicalin and baicalein from Radix Scutellariae, Industrial Crops and Products, (2013), 45, p182-190.
[https://doi.org/10.1016/j.indcrop.2012.11.041]

-
Yoon, HY, Cho, YS, Jin, Q, Kim, HG, Woo, ER, Chung, YS, Effects of ethyl acetate extract ofPoncirus trifoliatafruit for glucocorticoid-induced osteoporosis, Biomolecules & Therapeutics, (2012), 20, p89-95.
[https://doi.org/10.4062/biomolther.2012.20.1.089]

- Zhu, X, Luo, F, Zheng, Y, Zhang, J, Huang, J, Sun, C, Li, X, Chen, K, Characterization, purification of poncirin from Edible citrus ougan(Citrus reticulatecv.suavissima) and its growth inhibitory effect on human gastric cancer cells SGC-7901, International Journal of Molecular Sciences, (2013), 14, p8684-8697.