만성스트레스로 유발된 우울증 동물모델에서 오미자 물 추출물의 항우울 효과
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Depression is one of the most common neuropsychiatric disorders and has been associated with the neuroendocrine system and alterations in behavior. Schisandra chinensis Baillon is one of major medicinal plants used as a Korea medicine and food sources, and has been processed in the fields of various food products and medicinal herbs. The chronic mild stress (CMS) protocol is widely used to evoke depressive-like behaviors in laboratory mice or rat. The CMS procedure induced some behavioral changes that are compatible with the common expectations, i.e. ‘anhedonic’ behavior and can affect corticosterone level. The present study, Schisandra chinensis extract administration by daily gavage from the 3 weeks exhibited an antidepressant-like effect on CMS-induced depression in mice. Schisandra chinensisextract administration at dose of 200mg/㎏ significantly increased the sucrose consumption, and decreased the immobility durations in forced swim test and tail suspension test. Furthermore the corticosterone level decreased than control group. In conclusion, Schisandra chinensis extract showed antidepressant-like effects on sucrose preference test, forced swimming test and tail suspension test based on CMS model.
Keywords:
Antidepressant, Schisandra chinensis Baillon, Chronic Mild Stress, Forced Swimming Test, Tail Suspension Test, Sucrose Preference Test서 언
일반적으로 사람의 정신적 상태 또는 신체적 활동을 무기력 하게 만드는 것으로 알려진 우울증은 현대사회에서 많은 사람 들이 앓고 있는 대표적인 사회적 질병으로 세계보건기구 (WHO)는 전 세계 인구 중 15 ~25% 정도가 앓고 있는 우울 증을 현대사회에 가장 위험한 질병 중 하나로 분류하였다 (Patten, 2008; Nemeroff, 2007; Kessler et al.,2003). 우울 증 치료 및 원인 규명에 대한 관련 연구들이 많이 이루어지고 있지만 우울증 유발의 정확한 기전은 아직 파악되지 않았으며, 대부분의 우울증 치료제들은 화학적 합성 항우울제제인 삼환 성 항우울제 (tricyclic antidepressants, TCA), 모노아민 산화 효소 억제제 (monoamine oxidase inhibitor, MAOI), 선택적 세로토닌 재흡수 억제제 (selective serotonin reuptake inhibitor, SSRI), 노르아드레날린 재흡수 억제제 (noradrenergic reuptake inhibitor, NARI), 세로토닌-노르아드레날린 재흡수 억 제제 (serotonin and noradrenergic reuptake inhibitor, SNRIs) 등의 약물을 통한 치료들이 많이 이루어지고 있다 (Mandrioli et al.,2012; Nemeroff, 2007; Bouvier et al., 2003; Anderson, 1998; Steffens et al., 1997). 하지만 이러한 화학적 합성 항우울제제들은 낮은 반응성 및 낮은 회복률을 보이며 심지어 피로, 수면 장애, 인지 장애, 성기능 장애들과 같은 부 작용도 보고되어 있다 (Kennedy, 2006; Sarko, 2000). 이러한 화학적 합성 항우울제제들의 낮은 회복률과 부작용으로 인해, 최근에는 화학적 합성 약물들 보다 안전성이 입증되어진 Hypericum perforatumL. (Linde et al., 2005), Nelumbo nucifera Gaertn (Kang et al., 2005) Ginkgo bilobaL. (Kang et al., 2005) 등과 같은 약용식물을 통한 천연물 항우울제 개발 에 많은 학문적 연구들이 이루어지고 있다 (Schulz, 2006).
스트레스는 현대인들의 우울증 유발의 여러 원인들 중 대표 적인 원인 요소로 보고되어 있으며 (Kendler et al., 1999), 효과적인 우울증 치료 약물 개발을 위한 실험방법으로 스트레 스적 환경에 지속적으로 노출시켜 인간의 우울증과 비슷한 행 동 양상을 보이는 Chronic Mild Stress (CMS) 동물모델을 이용한 항우울제제 효능검증법을 많이 사용하고 있다. CMS를 통한 우울증 유발 동물모델에서는 우울증의 가장 대표적인 증 상 중 하나인 무쾌감 (anhedonia) 반응과 같은 행동적 증상들 이 나타난다 (Willner et al., 1992).
이 실험방법의 특징은 실험동물이 예측할 수 없는 경미한 스트레스를 반복적으로 부여함으로써 습관화가 나타나지 않도 록 한다는 것이며, CMS 과정이 3주 이상 지속된 실험동물의 육안적 행동양상으론 체중 감소, 자당용액에 대한 선호도 또 는 섭취량 감소가 나타난다 (Willner et al., 1987). 자당용액 의 섭취 또는 선호도가 줄어드는 것은 보상에 대한 흥미가 줄 어드는 것을 반영하는 것이며, 이는 우울증에서 나타나는 여 러 증상 중 무쾌감증과 같이 외부적 반응에 대한 반응 감소 행동 양상으로 볼 수 있다 (Bergstrom et al., 2008; Willner, 2005; Papp et al., 1991).
오미자 (Schisandra chinensis Baillon)는 오미자과에 속하는 낙엽활엽 덩굴성 식물로 한국, 일본, 중국 등 동아시아 지역에 주로 분포한다. 오미자는 주요 약용식물로써 생약제, 음식 재 료 및 다양한 기능성 제품들에 사용된다. 전통의약 분야와 현 대의약 연구에서 오미자의 효능은 진정, 진해, 해열, 중추신경 억제, 혈압 강하 및 알콜 해독 작용 등의 약리작용 (Kim et al., 2007) 뿐만 아니라 암세포 사멸 및 면역력 증가 (Lee et al., 2009; Park et al., 2004), 항산화 (Chae et al.,2005), 항경련 (Baek et al., 2000), 간 보호 (Sadako et al., 1993) 등의 연구 결과들도 보고되어 있다.
본 연구에서는 현대사회에서 빈번하게 발생되는 스트레스로 인한 우울증의 해결 방안을 모색하고자, CMS 방법을 통하여 우울증 증상을 유발시킨 동물모델에서 항경련, 중추신경 억제, 진정 및 항산화 효과가 우수한 오미자의 천연 항우울제제로써 의 효능을 검증하고자, 우울증 유발 동물 모델에서 나타나는 우울증 연관 행동의 개선 유무를 확인 할 수 있는 자당 선호 도 (Sucrose Preference Test, SPT) 변화, 강제 수영법 (Forced Swim Test, FST), 꼬리 매달기 (Tail Suspension Test, TST) 등의 행동 변화 및 스트레스 관련 호르몬인 corticosteron 함 량 변화를 측정하였다.
재료 및 방법
1. 약제 및 추출물 제조
본 실험에서 사용된 오미자는 ㈜ 광명당 제약 (Ulsan, Korea)으로부터 구입하여 진행하였으며, 표본은 한국한의학연 구원에 보관되어 있다 (표본번호: K011915). 오미자 추출물은 오미자 분말 200 g에 10배량의 3차 증류수를 가하여 2시간 동안 환류추출(100°C) 하고 전액을 여과지 (Whatman No. 2) 로 여과한 후 잔류물에 동량의 물을 첨가하여 2차 추출하였다. 1, 2차 추출액을 감압농축 (1 L Rotary Evaporator N-1001SW, EYELA, USA) 한 후, 동결건조 (Freeze Dryer FD5508A, ilShinBioBase, Korea)를 통하여 오미자 물 추출물 건조분말을 제조하였다. 제조된 건조분말은 균일한 품질을 위한 균질화 작 업 후 바코드를 부착하여 냉장보관 (4°C이하)하여 실험에 사 용하였다. 본 논문에서는 실험에 사용된 오미자 추출물은 ‘Omija’란 약자로 표기하였다.
2. 실험동물
실험동물로 사용된 8주령 수컷 ICR 마우스는 ㈜ 샘타코 바 이오 코리아에서 공급 받아 사용하였다. 실험동물은 한국한의 학연구원의 specific pathogen free (SPF) 시설인 실험동물연 구센터에서 7일간 적응 시킨 후 스트레스를 주지 않는 정상군 (normal group, n = 10), 스트레스만 주는 스트레스 대조군 (control group, n = 10), 스트레스와 시판 항우울제를 투여하는 양성대조군 (positive group, n = 10), 스트레스와 오미자 물 추출물을 투여하는 실험군 (test group, n = 10) 등 총 4군으로 구분하였다. 실험방법은 한국한의학연구원 실험동물 윤리위원 회의 심의 (승인번호: 13-079)를 거쳤으며, 실험동물 사육 및 유지는 한국한의학연구원 실험동물연구센터의 동물 관리 및 사용 규정에 입각하여 온도 23 ±2°C, 습도 50 ±10% 내외, 12시간 명암주기로 일정하게 유지된 사육실에서 individually ventilated cage (IVC)에 5마리씩 넣어 사육하였다.
3. 몸무게 측정 및 경구 투여
실험동물의 몸무게는 5주간 매주 측정 하였으며, 경구 투여 에 사용한 Omija와 양성대조군인 imipramine은 생리식염수에 200mg/㎏과 20mg/㎏의 용량으로 녹여 매일 오전 9시에 3주 간 경구투여 하였다. 약물 투여 없이 스트레스만 주는 대조군 은 동일한 용량에 생리식염수를 경구투여 하였다. Imipramine 은 시그마 알드리치 (St. Louis, Mo, USA)의 제품을 사용하 였다.
4. Chronic Mild Stress (CMS) 방법
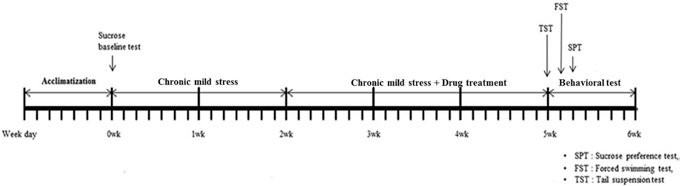
Chronic mild stress 모델은 Willner (1984)에 의해 제안된 실험 모델을 기반으로 본 실험에서는 실험방법을 일부 수정하 여 실시하였다. CMS는 총 5주 동안 진행하였으며, 정상군을 제외한 모든 실험군에 처음 2주간은 CMS만을 적용하였고, 그 후 3주간은 CMS 및 약물 투여를 병행 하였다 (Fig. 1). 실 험동물에 가해진 스트레스는 물 또는 먹이 박탈, 물 박탈 후 빈 물병 제시, 먹이 박탈 후 먹이 제한, 주간 • 야간 주기의 역전, 고밀집 사육, 사육 상자 기울이기 (45°) , 깔집 제거, 축 축한 깔집 등이 포함되어 있다 (Table 1). 실험동물은 언제 어 떤 종류의 스트레스가 제시될지 예측할 수 없었다. 정상군은 스트레스가 적용되는 집단과 접촉을 피하도록 다른 사육실에 서 사육 하였고, 자당 선호도 검사 전날 먹이, 물 박탈 이외 에는 물과 먹이를 자유롭게 공급 하였다.
5. 자당용액 섭취 검사 (Sucrose Preference Test, SPT)
CMS를 진행 후 실험동물의 1% 자당용액 섭취량 변화를 통하여 우울증 유발 관련 행동 변화 중 자극에 대한 무쾌감 반응을 확인 지표로 결정하였다 (Luo et al., 2008; Willner et al., 1987). 자당용액 섭취량 변화 확인 전 실험동물을 1% 자당용액에 적응시키기 위하여 검사 48시간 전 물통에 자당용 액을 넣어 섭취할 수 있게 하였다. 검사 24시간 전에는 절수, 절식을 시켰으며, 검사 당일 3시간 동안의 자당용액 섭취량 변 화를 물병 무게의 변화를 통하여 확인하였다. 측정은 스트레 스 전 (0 주)과 CMS만 적용 (2 주), CMS + 3주 약물 투여 (5 주) 등 총 3번 실시하였다.
6. 강제수영 실험 (Forced Swimming Test, FST)
Omija의 항우울 효과를 측정하기 위해 Porsolt 등 (1997)의 방법을 이용하였다. 높이 40cm, 직경 20cm인 수조에 온도 25 ±1°C의 물을 물 30cm를 채운 후 실험용 쥐를 한 마리씩 수조에 넣고 총 6분 중 최초 2분은 적응시간으로 측정하지 않 고, 마지막 4분 동안의 실험동물 부동상태 (immobility) 시간 을 측정하였다. 부동상태는 머리만을 물 위로 드러내기 위한 최소한의 움직임만 하면서 똑바로 서서 움직이지 않고 떠 있 는 경우로 정의하였다.
7. 꼬리 매달기 (Tail Suspension Test, TST)
꼬리 매달기 실험은 Steru 등 (1985)의 방법을 이용하였다. 실험용 쥐 꼬리 끝 1cm 정도에 고정 장치를 장착 후 지면에 서 50cm 떨어진 위치에 매달고, 총 6분 동안의 측정 중 최초 2분은 적응시간으로 측정하지 않고 마지막 4분 동안의 실험동 물 상태 중 부동상태 (immobility) 시간을 측정하였으며, 매달 려있는 상태에서 아무런 움직임 없이 완전히 멈춰 있는 상태 를 부동상태로 간주하였다.
8. 혈액 채취 및 corticosterone의 측정
혈액 채취는 모든 실험동물을 치사 전 18시간 이상 절식 시킨 후, 심장에서 혈액을 각각 1ml씩 채취하였으며, heparin 이 코팅되어 있는 blood collection vacutainer tube (BD, NJ, USA)에 넣어 잘 섞어준 후 상온에서 2시간을 방치하였다. 그 후 4°C, 15,000 rpm에서 15분간 원심 분리하여 상등액 (plasma) 을 분리, 실험 전까지 냉동보관 (−20°C) 하였다. Corticosterone 농도는 일반적으로 사용하는 EIA kit (Corticosterone EIA kit, Oxford Biomedical Research, USA)를 이용하여 측정하였다.
9. 통계처리
결과 값의 표기는 ‘평균 ±표준편차’로 표시하였으며, 실험 군별 차이의 유의성 검증은 독립표본 t-test를 실시하였으며, p < 0.05인 경우 유의한 것으로 판정하였다.
결 과
1. 몸무게 변화
CMS 모델에서의 각 그룹별 체중 변화에 대한 효과를 확 인해 본 결과, 초기CMS에 노출되기 전 체중은 정상군 32.1 ±0.8 g, 대조군 32.5 ±0.7 g, Omija 투여군 31.9 ±0.5 g, imipramine 투여군 31.9 ±1.0 g으로 모두 오차범위 내에서 유 사하게 나타났다. 그러나 CMS 진행 2주차부터 CMS가 진행 된 실험군들의 체중은 정상군에 비해 약 3 g 이상씩 급격하게 감소하기 시작했다. 2주간의 CMS에만 노출 된 실험동물에게 Omija와 imipramine를 3주간 투여하였을 때, 5주 동안 지속적 인 CMS에만 노출된 대조군의 체중은 감소한 반면에 비해 Omija와 imipramine를 투여한 군의 체중은 정상군과 비교하였 을 때 체중이 점차 회복 되는 것을 확인할 수 있었다. 하지만 Omija 투여군의 체중 회복은 imipramine 투여군 보다는 낮았 다 (Table 2).
2. 자당 선호도 변화
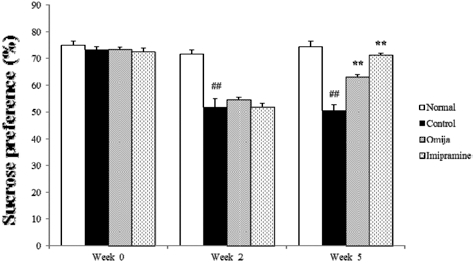
우울증 유발 증상 중 하나인 무쾌감 반응에 대한 확인 지표 인 자당 선호도 확인은 CMS 진행 전 (0 주)에서는 각 그룹 별 자당 선호도의 변화는 크게 나타내지 않았다. 하지만 약물 투여 없이 2주간의 CMS만 진행하였을 때 정상군 (73.32%)을 제외한 CMS에 노출된 3개의 그룹 (대조군, 양성대조군, Omija 투여군) 모두 자당 선호도가 20% 이상씩 감소하였다. 2주간의 CMS 노출 후 imipramine과 Omija를 CMS를 계속 진행하며 3주간 투여한 결과 자당 선호도는 정상군과 비교해 보았을 때 스트레만 받은 대조군은 변화가 없던 반면 Omija 투여군과 imipramine 투여군의 자당 선호율은 각각 8.87%, 18.63% 증가 하였다 (Fig. 2). 하지만 양성대조군인 imipramine 투여군 보다는 Omija 투여군의 자당선호도 회복률은 9.76% 낮 았다.
3. 강제 수영에서의 부동상태 시간 변화
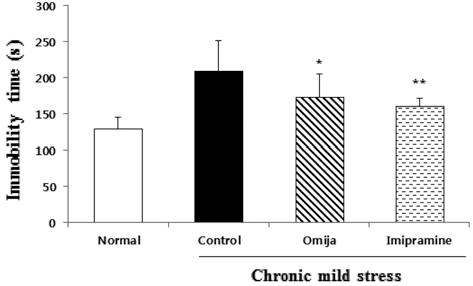
총 5주 동안 CMS 노출 후 강제 수영법을 통한 Omija의 우울행동 개선 유무를 확인해 보았다. 우울적 행동 개선 유무 의 척도인 부동상태의 시간 변화는 정상군에 비해 대조군의 부동상태 지속시간은 80초 이상 더 오래 지속되었다. 반면 Omija 투여군과 imipramine 투여군의 부동상태 시간은 정상군 에 비해 증가하였지만 스트레스만 받은 대조군과 비교하였을 땐 각각 36초, 49초 유의성 있게 감소하였다 (p < 0.05). 하지 만 Omija 투여군의 부동상태 시간은 imipramine 투여군 보다 13초 더 길게 나타났다 (Fig. 3).
4. 꼬리 매달기에서의 부동상태 시간 변화
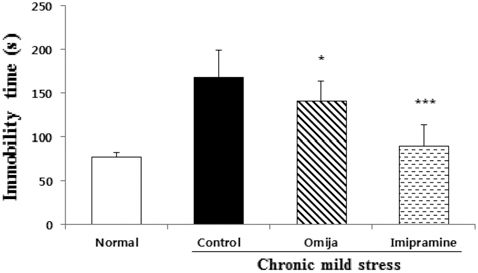
5주간의 CMS를 진행하는 동안 3주간 Omija를 투여한 군의 우울 행동 개선 유무를 꼬리 매달기의 부동상태 시간 변화를 통하여 확인해 본 결과 (Fig. 4), 정상군에 비해 스트레스만 받은 대조군, Omija, imipramine 투여군의 부동상태 시간은 각각 84초, 64초, 27초 이상 더 오래 지속되었다. 부동상태 시간은 정상군에 비해서는 증가하였지만, 스트레스만 받은 대 조군과 비교하였을 때 Omija, imipramine 투여군은 20초, 57 초로 유의성 있게 감소하였다 (p < 0.05). 하지만 Omija 투여 군의 부동상태 시간은 imipramine 투여군 보다는 37초 더 길 게 나타났다.
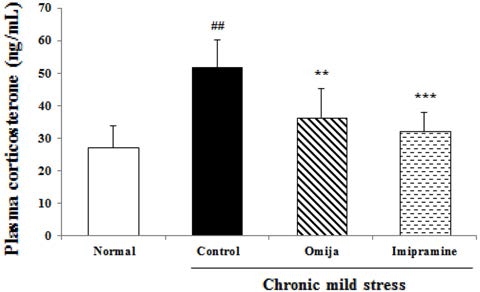
5. Corticosterone 함량 변화
스트레스 관련 호르몬인 corticosterone의 함량 변화는 5주간 의 CMS 진행 후 실험동물의 혈장을 이용하여 측정하였다 (Fig. 5). 정상군 (27.06 ng/ml)과 비교하였을 때 CMS 진행군 들의 corticosterone 함량은 대조군 51.57 ng/ml, Omija 투여 군 36.42 ng/ml, imipramine 투여군 32.15 ng/ml으로 스트레스 로 인해 증가하였다. 반면, 스트레스만 받은 대조군과 비교하 였을 땐 Omija 투여군의 corticosterone 함량은 15.15 ng/ml 감소, imipramine 투여군은 19.42 ng/ml 감소하였다. Omija 투여군의 corticosterone 감소량은 imipramine 투여군 보다 변 화는 적었다.
고 찰
본 연구는 CMS 동물모델을 통한 오미자 물 추출물의 항우 울 효과를 검증하기 위해 진행되었다. 우울증 유사 상태가 유 발된 실험동물은 체중 감소, 쾌감 상실, 부동시간 증가의 행동 적 특징이 나타나며, 스트레스로 인해 우울증이 유발되면 HPA (hypothalamic-pituitary-adrenal)축의 과잉 활성으로 corticosterone 의 농도가 증가한다. HPA 축의 과잉 활성은 우울증과 연관된 생물학적 이상의 한 지표이며, 이러한 지속적인 스트레스 자극 들은 해마를 축소시키고, corticosterone 농도를 지속적으로 증 가시켜 BDNF (brain-derived neurotrophic factor) 발현양 또 한 감소시킨다 (Tanti and Belzung, 2010; Holsboer and Barden, 1996). 이번 행동실험 결과를 보면 5주 동안 CMS를 진행한 실험동물들은 우울증 유사 행동 상태를 나타내는 것을 확인할 수 있었다. CMS 노출 그룹들의 자당 선호도는 정상군 에 비해 감소하였으며 강제 수영 및 꼬리 매달기에서의 부동 시간이 증가하였다. 즉 지속적인 스트레스는 우울증 유발 확 률을 증가시키며, 그 확인지표로 자당 선호도 측정은 CMS를 통한 우울증 유사 모델 제작에 있어 가장 큰 확인 지표로 사 용된다. CMS 동물모델에서 자당 선호도의 감소는 우울증에서 나타나는 증상 중 쾌감에 대한 반응 상실 행동으로 볼 수 있 다 (Willner, 1997; Willner, 2005). 우울증 환자들 중 일부는 급격한 체중 감소가 나타나는 경우가 있는데, CMS 모델에서 도 우울증 유발시 체중 감소의 결과가 나타났다. 이 결과는 여러 CMS 관련 우울증 동물 실험 결과들에서 비슷한 경향을 나타내었다 (Surget et al., 2009; Vancassel et al., 2008). 하 지만 최근 몇몇 CMS 모델 실험에서 실험동물의 체중 변화가 나타나지 않는 경향도 보였다 (Mutlu et al., 2009; Ibarguen- Vargas et al., 2008). 즉 체중 감소만으로는 우울증에 대한 진 단을 내릴 수 없다 사료되며, 동물모델에서는 개체간의 차이 에 따라 체중 변화 차이가 있음이 사료된다.
본 실험에서 오미자 물 추출물을 투여한 그룹의 투여 3주 후 체중 및 자당 선호도 증가, 강제 수영, 꼬리 매달기에서의 부동시간 감소는 양성대조군인 imipramine 보다는 높은 효과 는 나타나지 않았지만 스트레스만 받은 대조군에 비해 일정 부분 증가한 것으로 보아 오미자 물 추출물은 우울행동 개선 효과가 있는 것으로 사료된다. Imipramine보다 효과가 크게 나타나지는 않았지만 한약의 장점은 장기복용이 가능하므로 장기적인 관점에서 보면 오히려 부작용이 적은 한약을 이용한 신약 개발은 의미가 있을 것으로 생각된다.
CMS에 노출된 동물모델에서 HPA축의 과잉활동으로 인해 과발현되는 corticosterone과 사람의 cortisol은 유사하다 검증 되었으며 (Tsigos and Chrousos, 1994), 지속적인 CMS에 노 출된 대조군은 corticosterone의 농도가 다른 그룹에 비해 월등 히 높았고, 오미자 물 추출물을 투여한 그룹의 corticosterone 농도는 양성대조군인 imipramine보다는 높았지만 스트레스로 인해 발생되는 HPA축의 과잉 활동을 저해하는 기능이 있는 것으로 생각되며, 스트레스로 인한 뇌의 산화적 손상에 대한 보호 효과도 예측해 볼 수 있었다.
이번 행동 실험 및 corticosterone 측정 결과를 종합해 볼 때 오미자 물 추출물은 항우울 효과를 나타내며, 오미자의 주요 약리성분으로 알려진 schizandrin, schizandrol, rschizandrin, gomisin A-H, gomisin J, gomisin K, gomisin O, angeonylgomisin Q, pregomisin 등의 주요 약리효과가 중추신 경 억제 및 진정, 진해, 위액 분비 억제, 스트레스 궤양 예방, 항산화, 항균, 항암작용 등의 효능이 알려져 보고된 걸 감안할 때 (Hwang et al., 2004; Panossian and Wikman, 2008), 향후 스트레스로 인한 뇌의 산화적 손상 예방 효능 및 오미자 의 항산화 효능과 연계된 항우울 효능 검증 실험 및 항우울 효능을 나타내는 물질 분리, 분석을 통한 보다 자세한 검증 작업이 수행되어져야 할 것으로 본다.
감사의 글
본 연구는 한국한의학연구원 주요사업 ‘한의 생체에너지 대 사 기반 노화조절 연구(K13101)’의 지원을 받아 수행된 결과 로 이에 감사드립니다.
REFERENCES
-
Anderson, IM, SSRIs versus tricyclic antidepressants in depressed inpatients: a meta-analysis of efficacy and tolerability, Depression and Anxiety, (1998), 7, p11-17.
[https://doi.org/10.1002/(sici)1520-6394(1998)7:1+<11::aid-da4>3.3.co;2-o]

- Baek, NI, Han, JT, Ahn, EM, Park, JK, Cho, SW, Jeon, SG, Jang, S, Kim, CK, Choi, SY, Isolation of anticonvulsant compounds from the fruits ofSchizandra chinensisBaill, Journal of the Korean Society of Agricultural Chemistry and Biotechnology, (2000), 43, p72-77.
-
Bergstrom, A, Jayatissa, MN, Mork, A, Wiborg, O, Stress sensitivity and resilience in the chronic mild stress rat model of depression; anin situhybridization study, Brain Research, (2008), 1196, p41-52.
[https://doi.org/10.1016/j.brainres.2007.12.025]

- Bouvier, N, Trenque, T, Millart, H, Development of antidepressant drugs. Experience and prospects, Presse Medicale, (2003), 32, p519-522.
- Chae, HJ, Hwang, HI, Lee, IS, Moon, HY, Comparison of on rat intestinal digestive enzyme inhibitory activity and antioxidant enzyme activity of Korean and ChineseSchizandra chinensis, Journal of Experimental & Biomedical Sciences, (2005), 11, p517-523.
-
Holsboer, F, Barden, N, Antidepressants and hypothalamic-pituitary-adrenocortical regulation, Endocrine Reviews, (1996), 17, p187-205.
[https://doi.org/10.1210/er.17.2.187]

- Hwang, SJ, Pyo, BS, Lee, HJ, Hwang, B, Production of gomisin J from cell suspension cultures ofSchisandra chinensisBaillon, Korean Journal of Medicinal Crop Science, (2004), 12, p442-447.
-
Ibarguen-Vargas, Y, Surget, A, Touma, C, Palme, R, Belzung, C, Multifaceted strain-specic effects in a mouse model of depression and of antidepressant reversal, Psychoneuroendocrinology, (2008), 33, p1357-1368.
[https://doi.org/10.1016/j.psyneuen.2008.07.010]

-
Kang, M, Pyun, KH, Jang, CG, Kim, H, Bae, H, Shim, I, Nelumbinis semen reverses a decrease in hippocampal 5-HT release induced by chronic mild stress in rats, Journal of Pharmacy and Pharmacology, (2005), 57, p651-656.
[https://doi.org/10.1211/0022357056055]

-
Kendler, KS, Karkowski, LM, Prescott, CA, Causal relationship between stressful life events and the onset of major depression, The American Journal of Psychiatry, (1999), 156, p837-841.
[https://doi.org/10.1176/ajp.156.6.837]

- Kessler, RC, Berglund, P, Demler, O, Jin, R, Koretz, D, Merikangas, KR, Rush, AJ, Walters, EE, Wang, PS, The epidemiology of major depressive disorder: Results from the National Comorbidity Survey Replication(NCS-R), The Journal of the American Medical Association, (2003), 289, p3095-3105.
-
Kennedy, SH, A review of antidepressant treatments today, European Neuropsychopharmacology, (2006), 16, p619-624.
[https://doi.org/10.1016/s0924-977x(06)70007-4]

- Kim, CH, Kwon, MC, Kim, SH, Bae, GJ, Ahn, JH, Chio, GP, Chio, YB, Ko, JR, Lee, HY, Enhancement of immune activites ofKadsura japonicaDunal. through conventional fermentation process, Korean Journal of Medicinal Crop Science, (2007), 15, p162-169.
- Lee, YM, Lee, KS, Kim, DK, Aqueous extract ofSchizandra chinensissuppresses dextran sulfate sodium induced generation of IL-8 and ROS in the colonic epithelial cell line HT-29, Natural Product Sciences, (2009), 15, p185-191.
- Linde, K, Berner, M, Egger, M, Mulrow, C, St. John's wort for depression: Meta-analysis of randomized, controlled trials, The British Journal of Psychiatry, (2005), 184, p99-107.
-
Luo, DD, An, SC, Zhang, X, Involvement of hippocampal serotonin and neuropeptide Y in depression induced by chronic unpredicted mild stress, Brain Research Bulletin, (2008), 77, p8-12.
[https://doi.org/10.1016/j.brainresbull.2008.05.010]

-
Mandrioli, R, Mercolini, L, Saracino, MA, Raggi, MA, Selective serotonin reuptake inhibitors(SSRIs): Therapeutic drug monitoring and pharmacological interactions, Current Medicinal Chemistry, (2012), 19, p1846-1863.
[https://doi.org/10.2174/092986712800099749]

-
Mutlu, O, Ulak, G, Laugeray, A, Belzung, C, Effects of neuronal and inducible NOS inhibitor 1-[2-(trifluoromethyl) phenyl] imidazole(TRIM) in unpredictable chronic mild stress procedure in mice, Pharmacology Biochemistry and Behavior, (2009), 92, p82-87.
[https://doi.org/10.1016/j.pbb.2008.10.013]

-
Nemeroff, CB, The burden of severe depression: A review of diagnostic challenges and treatment alternatives, Journal of Psychiatric Research, (2007), 41, p189-206.
[https://doi.org/10.1016/j.jpsychires.2006.05.008]

-
Papp, M, Willner, P, Muscat, R, An animal model of anhedonia: Attenuation of sucrose consumption and place preference conditioning by chronic unpredictable mild stress, Psychopharmacology(Berlin), (1991), 104, p255-259.
[https://doi.org/10.1007/bf02244188]

- Park, JH, Kim, JH, Kim, DH, Mun, HC, Lee, HJ, Seo, SM, Paik, KH, Ryu, LH, Park, JI, Lee, HY, Comparison of immuno-stimulatory activities by purification process ofSchizandra chinensisBaillon fruits, Korean Journal of Medicinal Crop Science, (2004), 12, p141-148.
-
Patten, SB, Major depression prevalence is very high, but the syndrome is a poor proxy for community populations’ clinical treatment needs, Canadian Journal of Psychiatry, (2008), 53, p411-419.
[https://doi.org/10.1177/070674370805300702]

-
Panossian, A, Wikman, G, Pharmacology ofSchisandra chinensisBail: An overview of Russian research and uses in medicine, Journal of Ethnopharmacology, (2008), 118, p183-212.
[https://doi.org/10.1016/j.jep.2008.04.020]

-
Porsolt, RD, Le Pichon, , Jalfre, M, Depression: A new animal model sensitive to antidepressant treatments, Nature, (1977), 266, p730-732.
[https://doi.org/10.1038/266730a0]

- Sadako, Y, Yoshikazu, M, Hironaka, K, Preventive effect of gomisin A, a lignan component ofSchizandrafruits, on acetaminophen-induced hepatotoxicty in rats, Biochemical Pharmacology, (1993), 46, p1801-1085.
- Sarko, J, Antidepressants, old and new. A review of their adverse effects and toxicity in overdose, Emergency Medicine Clinics of North America, (2000), 18, p637-654.
-
Schulz, V, Safety of St. John's Wort extract compared to synthetic antidepressants, Phytomedicine, (2006), 13, p199-204.
[https://doi.org/10.1016/j.phymed.2005.07.005]

-
Steru, L, Chermat, R, Thierry, B, Simon, P, The tail suspension test: A new method for screening antidepressants in mice, Psychopharmacology, (1985), 85, p367-370.
[https://doi.org/10.1007/bf00428203]

-
Steffens, DC, Krishnan, KR, Helms, MJ, Are SSRIsbetter than TCAs? Comparison of SSRIs and TCAs: A meta-analysis, Depression and Anxiety, (1997), 6, p10-18.
[https://doi.org/10.1002/(sici)1520-6394(1997)6:1<10::aid-da2>3.0.co;2-9]

-
Surget, A, Wang, Y, Leman, S, Ibarguen-Vargas, Y, Edgar, N, Griebel, G, Belzung, C, Sibille, E, Coricolimbic transcriptome changes are state-dependent and region-specific in a rodent model of depression and of antidepressant reversal, Neuropsychopharmacology, (2009), 34, p1363-1380.
[https://doi.org/10.1038/npp.2008.76]

-
Tanti, A, Belzung, C, Open questions in current models of antidepressant action, British Journal of Pharmacology, (2010), 159, p1187-1200.
[https://doi.org/10.1111/j.1476-5381.2009.00585.x]

- Tsigos, C, Chrousos, GP, Physiology of the hypothalamic-pituitary-adrenal axis in health and dysregulation in psychiatric and autoimmune disord, Endocrinology and Metabolism Clinics of North America, (1994), 23, p451-466.
-
Vancassel, S, Leman, S, Hanonick, L, Denis, S, Roger, J, Nollet, M, Bodard, S, Kousignian, I, Belzung, C, Chalon, S, n-3 Polyunsaturated fatty acid supplementation reverses stress-induced modification on brain monoamine levels in mice, The Journal of Lipid Research, (2008), 49, p340-348.
[https://doi.org/10.1194/jlr.m700328-jlr200]

-
Willner, P, The validity of animal models of depression, Psychopharmacology, (1984), 83, p1-16.
[https://doi.org/10.1007/bf00427414]

-
Willner, P, Towell, A, Sampson, D, Sophokleous, S, Muscat, R, Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant, Psychopharmacology, (1987), 93, p358-364.
[https://doi.org/10.1007/bf00187257]

-
Willner, P, Muscat, R, Papp, M, Chronic mild stress-induced anhedonia: A realistic animal model of depression, Neuroscience & Biobehavioral Reviews, (1992), 16, p525-534.
[https://doi.org/10.1016/s0149-7634(05)80194-0]

-
Willner, P, Validity, reliability and utility of the chronic mild stress model of depression: A 10-year review and evaluation, Psychopharmacology, (1997), 134, p319-329.
[https://doi.org/10.1007/s002130050456]

-
Willner, P, Chronic mild stress (CMS) revisited: Consistency and behavioural-neurobiological concordance in the effects of CMS, Neuropsychobiology, (2005), 52, p90-110.
[https://doi.org/10.1159/000087097]