한국 자생 석곡 메탄올 추출물의 미백 및 주름개선 효과
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Dendrobium moniliforme (DM) is a valuable and versatile herbal medicine with the anecdotal claims of antioxidant and anti-inflammation. In the present study, we investigated the whitening and anti-wrinkling effects of DM under various conditions with B16F10 melanoma cells and human dermal fibroblasts. The DM extract inhibited melanin contents and tyrosinase activity in a dose-dependent manner, compared with untreated group. Treatment of the DM extract effectively suppressed the α-MSH-stimulated melanin formation, tyrosinase activity and dendrite outgrowth. Moreover, the α-MSH-induced mRNA expressions of tyrosinase-related protein-1 (TRP-1) and tyrosinase-related protein-2 (TRP-2) and protein expression of tyrosinase were significantly attenuated by DM treatment. We also investigated the DM increased the production of type I procollagen and inhibited TNF-α-induced mRNA expressions of MMP-1, -3 in the human dermal fibroblast. These results indicate that DM may be a great cosmeceutical ingredient for its whitening and anti-wrinkle effects.
Keywords:
Whitening, Anti-wrinkling, Dendrobium moniliforme, Melanin, Tyrosinase서 언
오늘날 국민소득의 상승으로 생활수준이 향상되었고, 의학 기술의 발달로 고령화 인구가 증가함에 따라 건강에 대한 기 대수준이 높아지고 있으며, 그 결과 건강한 피부에 대한 관심 역시 증가하고 있다. 그로 인해 인간의 궁극적인 목표 중 하 나인 노화를 지연시켜 아름다움을 오랫동안 유지시키기 위한 기능성 화장품 원료에 대한 연구로써 melanin에 의한 과 색소 침착을 조절하기 위하여 tyrosinase의 활성을 억제할 수 있는 물질을 찾아내거나 피부를 구성하는 물질인 collagen 생성을 유도하거나 collagenase 활성을 억제할 수 있는 물질을 찾아내 고 이를 활용하려는 노력이 계속되고 있다.
Melanin은 melanin세포에 있는 멜라노좀의 표면에서 생기는 물질로써 tyrosinase와 tyrosinase related protein-1 (TRP-1), tyrosinase related protein-2 (TRP-2, DCT) 3개의 key 효소 들에 의해 생성된다. Tyrosinase는 tyrosine을 가수분해하여 3,4-dihydroxy-phenylalanine (DOPA), DOPA quinone으로 변 환되어 붉은 계열의 eumelanin과 갈색계열의 pheomelanin이 합성된다. tyrosinase related protein-1 (TRP-1), tyrosinase related protein-2 (TRP-2, DCT)는 eumelanin 합성에 중요한 역할을 하는 것으로 알려져 있으며 이의 조절에 관여하는 신 호전달 경로 중에 microphthalmia-associated transcription factor (MITF)가 중요한 역할을 한다 (Hemesath et al., 1998; Kim et al., 2011; Liu et al., 2010; Olivares et al., 2009; Wu et al., 2000).
Collagen은 진피조직을 형성하는 단백질로, 피부 탄력성은 진피조직의 두께로 결정이 된다. collagen의 형성억제나 파괴증 가는 피부탄력성을 저하시켜 주름살의 원인이 되고 있다 (Lee et al., 2003). 따라서 collagen 생성을 촉진하거나 collagen을 분해하는 collagenase나 다양한 기질 단백질 분해 효소인 matrix metalloproteinases (MMPs)의 발현이나 활성을 저해함 으로써 주름생성을 억제할 수 있다 (Fisher et al., 1999).
국내 자생 석곡은 난초과에 속한 다년생 초본으로 바위나 나무 위에 붙어사는 상록성 여러해살이풀이며, 주요 연구로는 약용석곡으로 알려진 금채석곡 (Dendrobium nobile Lindley) 의 항산화 효능에 관한 연구와 H2O2에 의해 손상된 신경세포 주에 대한 보호효과 그리고 항산화, 항염증, 미백, 주름개선 효 능에 대한 보고가 있다 (Kim et al., 2005; Lo et al., 2004; Min et al., 2010; Yoon et al., 2007). 그리고 Dendrobium 속 식물은 면역조절작용, 간보호효과, 항산화, 항암, 고혈압 등 의 작용이 있다고 알려져 있다 (Choi et al., 2002; Tzi et al., 2012).
현재 중국, 일본, 대만 등에서는 이미 항노화 작용이 있는 Dendrobium chysotoxum 추출물 화장품, 난류 식물의 보습작 용 등 석곡류의 기능성 및 산업화에 관련된 국제 특허를 출원 하고 다양한 차 (Tea), 화장품, 식품 등 석곡 관련 제품들이 생산 판매되고 있다. 하지만 우리나라에서는 자생 석곡은 대 부분 관상용으로 판매 유통되고 있으며, 산업화와 관련된 기 능성 연구가 미흡한 실정이다. 이에 본 연구에서는 자생 석곡 (Dendrobium moniliforme) 의 추출물을 활용하여 미백 및 주 름개선 효능을 평가하여 향후에 향장제품 소재로 이용하고자 하였다.
재료 및 방법
1. 실험 재료
한국 자생 석곡 (Dendrobium moniliforme)은 완도 수목원 으로부터 진도지역 자생 석곡을 기증 받아 전남한방산업진흥 원 유리온실에서 생육시켜 정선, 수세 후 건조하여 분쇄기를 이용하여 균일하게 분쇄한 다음 냉장보관 하였다. MeOH를 시 료무게의 10배를 넣고 환류냉각으로 3시간, 3회 반복하여 추 출물을 제조하였다. 이 추출물을 감압농축기 (NE-10001V, Eyela, Japan)로 농축하여 완전히 용매를 제거한 시료를 실험 목적에 맞춰서 용매에 녹여 사용하였다.
2. 시약
Dulbecco’s modified eagle’s medium (DMEM)과 fetal bovine serum (FBS), penicillin, streptomycin, Medium 106, Low Serum Growth Supplement는 Gibco/BRL (Eggenstein, Germany)에서 구입하였고, 3-(4,5-dimethylthiazol-2-yl)-5- (3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium (MTS, CellTiter 96AQueous One Solution Cell Proliferation Assay)는 Promega (Madison, WI, USA)에서 구입하였다. α- MSH와 L-DOPA는 Sigma Chemical Co. (St. Lousi, MO, USA)에서 구입하였고, Tyrosinase antibody는 Santa Cruz Biotechnology, Inc. (Santa Cruz, CA, USA), Gapdh antibody 는 Cell Signaling Technology, Inc. (Danvers, MA, USA)에 서 구입하였다. Procollagen type I C-prtide EIA kit는 Takara Bio, Inc. (Otsu, Shiga, Japan)에서 protein 정량에 사 용하는 Bradford 시약은 Bio-Rad Laboratories (Hercules, CA, USA)에서 구입을 하였다.
3. 세포주 및 세포배양
B16F10 melanin 세포주는 한국세포주은행 (KCLB, Seoul, Korea)에서 분양 받아 10% fetal bovine serum (FBS)이 첨 가된 Dulbecco’s modified eagle's medium (DMEM)을 사용 하였고, Human Dermal Fibroblasts, neonatal (HDFn) 세포 는 Gibco에서 구입하여 Medium 106 배지에 Low Serum Growth Supplement (LSGS)를 넣고 CO2배양기 (MCO- 17A1, Sanyo, Japan)에서 온도 37°C, 5% CO2조건에서 배양 하였다.
4. 세포 독성 측정
B16F10 세포를 96 well에 5 × 103씩 세포를 분주하여 24시 간동안 세포를 안정화 시킨 뒤에 자생 석곡 시료를 농도별로 처리를 하였다. 24시간 배양을 한 뒤에 MTS 용해액을 세포배 양액 용액의 1/10을 첨가한 후 37°C에서 2시간 배양하였다. ELISA microplate reader (Infinite 200 pro, TECAN Ltd., Mannedorf, Switzerland)를 이용하여 490nm에서 흡광도를 측 정하였다.
5. 세포내 Ttyrosinase Activity 측정
B16F10 세포를 6 well에 5 × 104씩 세포를 분주하여 24시 간동안 세포를 안정화 시킨 뒤에 자생 석곡시료를 농도별로 10, 50, 100, 200μg/mℓ 처리를 하였고 1시간 뒤에 α-MSH를 100 nM이 되게 처리를 한 뒤에 72시간 동안 배양을 하였다. PBS로 2회 세척을 하고 RIPA protein lysis buffer을 처리를 한 후에 4°C에서 30분 동안 incubation을 하였다. 그 후에 4°C 13000 rpm 30분동안 원심분리를 통해 단백질이 든 상층 액만을 가지고 tyrosinase activity를 측정하였다. 단백질 양을 Bradford 정량법 (Bradford, 1976)을 통해 595 nm로 ELISA를 측정을 하고 동일한 단백질을 이용해서 L-DOPA를 처리를 하 여 540nm 흡광도로 세포내 tyrosinase activity를 측정하였다.
6. Melanin 측정 및 관찰
B16F10 세포에 60mm dish에 5 × 104씩 세포를 분주하여 자 생 석곡추출물을 a-MSH (100 nM)보다 1시간이전에 처리를 하 고 72시간동안 배양을 하였다. 그 후에 PBS로 2회 세척하고 Trypsin-EDTA를 처리하여 세포를 수확한 뒤 3000 rpm에 5분동 안 세포를 모으고 상층액을 제거한 후 10% dimethylsulfoxide (DMSO)가 첨가된 1N NaOH용액을 처리하여 80°C에서 1시간 동안 반응시켰다. melanin 정량은 합성melanin을 이용하여 ELISA microplate reader로 410nm에서 각각의 흡광도를 측정 하였다.
7. 미백 및 주름 관련 유전자 발현 Real-Time PCR
미백관련 유전자 발현을 확인하기 위해서 B16F10 세포를 60mm dish에 1 × 105개씩 분주한 후 24시간 배양한다. 자생 석곡추출물을 다양한 농도로 1시간 동안 처리 한 뒤 α-MSH (100 nM)로 melanin 생성을 유도하여 24시간동안 배양을 하고 PBS로 2회 세척 후 세포를 수확하였다.
또한 주름 관련 유전자 발현을 확인하기 위해서 HDFn 세 포를 60mm dish에 2 × 105개씩 분주한 후 24시간 동안 배양 하고 자생 석곡추출물을 다양한 농도로 1시간 처리 한 뒤 TNF-α (10μg/mℓ)농도로 처리하여 주름 형성 관련 유전자 발 현을 유도하여 6시간 동안 배양하고 PBS로 2회 세척 후 세 포를 수확하였다.
수확한 세포는 Tripure Isolation Reagent (Roche Diagnostics, Mannheim, Germany)를 이용하여 RNA를 분리하였다. 5μg의 mRNA를 High Capacity cDNA Reverse Transcription Kit (Applied Biosystem, Foster City, CA, USA)를 이용하여 cDNA로 합성을 하였다. 실험은 제조사 매뉴얼에 따라 수행하 였다. 합성된 cDNA 1μℓ, taqman primer 1μℓ, Taqman Universal Master Mix II (Applied Biosystem, Foster City, CA, USA) 10μℓ, 3차 증류수 8μℓ를 넣고 Real-time PCR기 기 (ABI7500, Applied Biosystem, Foster City, CA, USA)를 이용하여 PCR을 수행하였다. 정량 중합 효소 반응에 쓰인 TaqMan gene은 http://www.lifetechnologies.com/kr/ko/home/life-science/pcr/real-time-pcr/real-time-pcr-assays.html 에서 검색 하여 주문 후 사용하였고 분석하고자 하는 유전자 특이적 gene 의 정보는 Table 1에서 나타내었다. 또한 Real-time PCR 반응 조건은 50°C에서 2분 95°C에서 10분 동안 1회 수행하고, 변성 온도 95°C에서 15초 어닐링 온도 60°C에서 15초인 사이클을 40회 반복 수행하였다.
8. Immunoblotting 분석
Western blot을 이용하여 tyrosinase 단백질의 발현 정도를 분 석하였다. PAD 시료를 농도별로 처리한 실험군과 대조군 을 24시간 배양 후 62.5 mM Tris-HCl (pH 6.8), 2% SDS, 5% β-mercaptoethanol, 2mM phenyl-methylsulfonyl fluoride, protease inhibitors (completeTM, Roche Diagnostics, Mannheim, Germany), 1mM Na3VO4, 50mM NaF과 10mM EDTA을 함유하는 완충제를 사용하여 세포를 용해시켰다. 세포 용해액을 15,000 g로 4°C에서 30분간 원심 분리하여 단백질만 포함하고 있는 상층액만을 얻었다. 정량한 단백질 20μg을 10% SDS-PAGE에 전기 영동시킨 후 PVDF (polyvinylidene difluoride) membrane (Bio-Rad Laboratories, Hercules, CA, USA)으로 옮겼다. 그리고 membrane의 blocking은 5% bovine serum albumin (BSA)이 함유된 TTBS (0.1% Tween 20 + TBS) 용액을 상온에서 2시간 동안 실시한 다음 Tyrosinase, Gapdh에 대한 1차 항체와 반응시킨 후 2차 항체인 horseradish peroxidase-conjugated anti-rabbit 또는 anti-mouse IgG를 반응시키고 ECL detection reagents (Millipore, Billerico, MA, USA)를 사용하여 단백질의 발현정도를 확인하였다.
9. Procollagen type I C-peptide 생합성 측정
Collagen 생합성량 측정은 procollagen type I C-peptide EIA kit (Takara Bio, Inc., Otsu, Shiga, Japan))를 이용하여 kit 매뉴얼에 따라 실험하였다. Human Dermal Fibroblasts, neonatal (HDFn) 세포를 Medium 106 배지에 LSGS를 넣고 배양한뒤, 24 well plate에 2 × 105개로 분주하여 24시간 후에 배양액을 교환하여 석곡 시료 용액을 농도 별로 처리한 뒤 24시간 뒤에 세포배양액을 채취하여 procollagen type I Cprtide EIA kit를 이용하여 collagen 생합성량을 측정하였다. 먼저 1차 collagen 항체가 균일하게 도포된 96 well plate에 채취한 세포 배양액 20μℓ과 2'항체 100μℓ를 섞어 넣고, 37°C 항온조에서 3시간 반응 시킨 뒤 PBS로 4회 세척한 다 음 발색시켜 ELISA reader (Infinite 200 pro, TECAN Ltd., Mannedorf, Switzerland)로 450nm에서 흡광도를 측정하였다.
10. 통계처리
본 실험에서 얻은 결과에 대해서는 평균 ±표준편차 (Mean ± SD)로 나타내었으며, 실험군 간의 유의성을 검정하기 위하여 SPSS (18.0, Statistical Package for Social Science, Inc., Chicago, IL, USA) 통계 패키지 프로그램을 활용하여 일원변량분석 (One way ANOVA)을 실시하였다. 유의성이 있 는 경우, p < 0.05 수준에서 Duncan’s Multiple Range Test (DMRT)를 실시하였다.
결 과
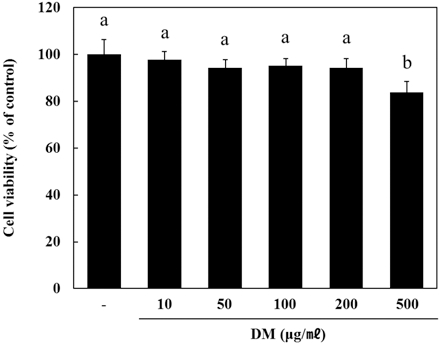
1. 한국 자생 석곡 메탄올 추출물의 B16F10 세포주에 대한 세포독성 평가
B16F10 세포주에서 자생 석곡 메탄올 추출물의 독성을 조 사하기 위해, MTS 실험을 수행하였다. 각각 B16F10 세포에 농도별 (10, 50, 100, 200, 500μg/mℓ)로 자생 석곡 추출물을 처리하고 24시간 후에 MTS를 처리한 결과 (Fig. 1) 가장 고 농도인 500μg/mℓ은 약 80 %의 세포생존율을 나타내 약 20% 세포독성이 나타났지만 나머지 10, 50, 100, 200μg/mℓ 처리한 농도에서는 독성이 없는 것으로 나타났다.
2. 한국 자생 석곡 메탄올 추출물의 Melanin 생성 저해 효과
자생 석곡 추출물이 B16F10 세포주에서 melanin 생합성에 미치는 영향을 확인하기 위해, 자생 석곡 추출물 (10, 50, 100, 200μg/mℓ)과 대조군인 Arbutin 100μg/mℓ을 처리한 후 1시간 뒤에 α-MSH를 처리하여 melanin 생성을 유도한 후 72시간 배양하여 전체 melanin 함량을 비교하였다. 그 결과, α-MSH를 단독으로 처리한 세포군에 비해 자생 석곡추출물시 료를 처리한 군에서 농도 의존적으로 melanin 함량이 감소되 는 것을 알 수 있었다 (Fig. 2). 또한 자생 석곡추출물 시료 100, 200μg/mℓ 처리한 그룹에서는 유의성 있게 감소되는 것 을 확인할 수 있었다.
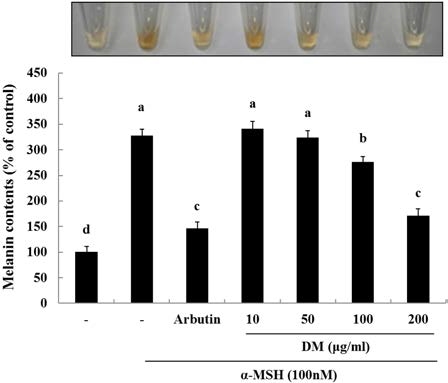
The effect of DM on melanin contents in melanoma cells. Cells were seeded at 1 × 105cells/ well. After 24 hours, cells were treated with several concentrations of DM and α-MSH (100 nM) cultured for 72 hours. Then, melanin contents were measured as described in Materials and Methods. Data are mean ± SD of three experiments per-formed in triplicate. Different letters are significantly different at p < 0.05 by DMRT.
3. 한국 자생 석곡 메탄올 추출물의 세포내 Tyrosinase Activity 측정
Melanin은 멜라노좀이라고 불리우는 기관표면에 합성되는 물질로 알려져 있는데 tyrosinase 효소는 melanin 합성에 중요 한 역할을 하는 것으로 알려져 있다. 본 실험에서 자생 석 곡추출물이 α-MSH의해 증가된 tyrosinase 활성에 어떠한 영향을 미치는지 확인하기 위해 세포내 tyrosinase 활성도를 확 인하여 보았다. 그 결과, α-MSH에 의해 tyrosinase 활성도가 증가한 것을 확인할 수 있었고 이를 자생 석곡추출물에 의해 α-MSH에 의해 증가된 tyrosinase 활성을 낮출 수 있는 것을 확인하였다 (Fig. 3). 이는 자생 석곡추출물 시료가 tyrosinase 활성을 낮춤으로써 미백기능을 할 수 있음을 시사한다.
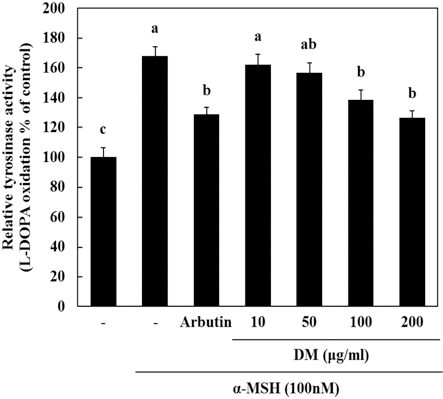
Effect of DM and α-MSH on tyrosinase activity in melanoma cells. Cells were seeded at 1 × 105cells/ well. After 24 hours, cells were treated with several concentrations of DM, arbutin 100 ng/mℓ and α- MSH (100 nM) cultured for 72 hours. Then, tyrosinase activity were measured as described in Materials and Methods. Data are mean ± SD of three experiments performed in triplicate. Different letters are significantly different at p < 0.05 by DMRT.
4. B16F10 세포주에서 한국 자생 석곡 메탄올 추출물에 의한 Tyrosinase 단백질의 발현 감소
Tyrosinase는 melanin 생합성에 결정적인 효소로 알려져 있 다. 자생 석곡추출물에 의해 tyrosinase 단백질 발현에 어떠한 영향을 미치는지 확인하기 위해, B16F10 세포주에 농도별 (10, 50, 100, 200μg/mℓ)처리를 한 후 72시간 배양을 하였다. 그 결과 tyrosinase 단백질의 양이 두드러지게 자생 석곡추출 물시료를 처리하였을 때 농도의존적으로 감소되는 것을 확인 할 수 있었다 (Fig. 4).
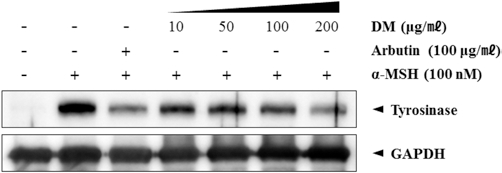
Effect of the water extracts of DM on α-MSH induced tyrosinase protein expression in B16F10 cells. B16F10 cells were seeded at 1 × 105cells/dish. After 24 hours, cells were treated with several concentrations of the water extracts of DM and α-MSH (100 nM) cultured for 72 hours. Then, expression of tyrosinase protein were measured as described in Materials and Methods. Data are mean ± SD of three experiments performed in triplicate.
5. B16F10 세포주에서 한국 자생 석곡 메탄올 추출물에 의한 TRP1, MITF, TRP2 mRNA 발현 감소
TRP1과 TRP2는 MITF의 전사인자에 의해 발현이 증가하는 것으로 알려져 있고, melanin 생합성에 관여하는 기전으로 알 려져 있다. 자생 석곡시료가 이러한 유전자의 발현에 어떠한 영향을 미치는지 확인하기 위해 B16F10 세포주에 α-MSH와 자생 석곡 시료를 처리하여 24시간 후에 Reatime-PCR로 유 전자발현을 확인하였다. 그 결과 자생 석곡시료는 α-MSH에 의해 증가된 MITF, TRP1, TRP2의 mRNA level을 농도의존 적으로 감소시켰다 (Fig. 5).
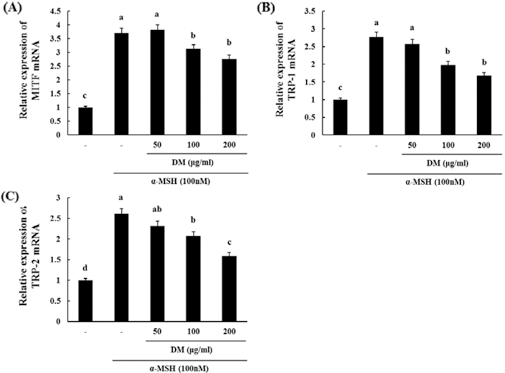
Effect of DM on expression of MITF (A), TRP-1 (B) and TRP-2 (C) mRNA in melanoma cells. Cells were seeded at 1 × 105 cells/well. After 24 hours, cells were treated with several concentrations of DM and α- MSH (100 nM) cultured for 24 hours. Then, expression of MITF, TRP-1 and TRP-2 mRNA were measured as described in Materials and Methods. Data are mean ± SD of three experiments performed in triplicate. Different letters are significantly different at p < 0.05 by DMRT.
6. HDFn 세포주에서 한국 자생 석곡 메탄올 추출물에 의한 Procollagen 생합성 증대
Collagen (type I, II, III, IV and V)들은 세포내에서 procollagen이라는 전구물질로 합성된 후 세포외로 분비되어 collagen 섬유로 중합된다. 자생 석곡시료가 인체 진피 섬유아 세포의 procollagen 합성에 미치는 영향을 조사하기 위하여 자 생 석곡시료를 50, 100, 200μg/mℓ 농도로 처리하고 24시간 배양 후 procollagen 양을 조사하였다. 그 결과 자생 석곡 추 출물은 처리하지 않은 대조군에 비하여 procollagen 합성을 농 도 의존적으로 증대시켰으며, 처리한 가장 고농도인 200μg/mℓ 농도에서 무처리군에 비해 procollagen 합성이 약 49% 증가 하였다 (Fig. 6).
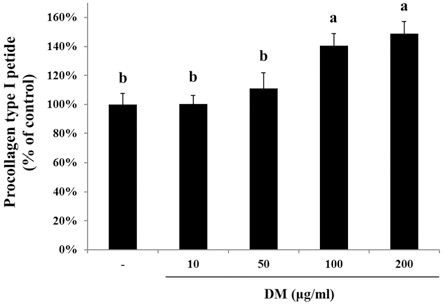
Effect of DM on procollagen synthesis of human dermal fibroblast. Cells were seeded at 1 × 105cells/well. After 24 hours, cells were treated with several concentrations of DM cultured for 24 hours. Data are mean ± SD of three experiments performed in triplicate. Different letters are significantly different at p < 0.05 by DMRT
7. HDFn 세포주에서 한국 자생 석곡 메탄올 추출물에 주름 관련 유전자 발현 억제
증가된 MMP들은 진피층에 collagen을 붕괴시킴으로써 피 부 주름형성에 매우 중요한 역할을 하고 있다. 이에 자생 석 곡시료가 인체 진피 섬유아세포의 collagen 분해에 관련된 MMP 합성에 미치는 영향을 조사하기 위하여 자생 석곡시료 를 50, 100, 200μg/mℓ 농도로 처리하고 1시간 뒤에 TNF-α 를 처리한 뒤 6시간 배양한 후에 MMP들의 유전자 발현을 확인하였다. 그 결과 자생 석곡 추출물은 TNF-α를 처리한 대 조군에 비하여 MMP-1, −3 유전자 발현을 농도 의존적으로 억제시키는 경향을 나타냈으나, 가장 고농도인 200μg/mℓ 농 도에서만 TNF-α 처리 대조군에 비하여 유의성을 나타냈다 (Fig. 7).
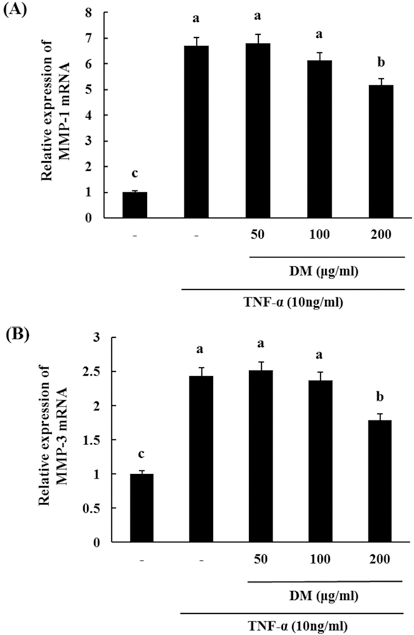
Effect of DM on expression of MMP-1 (A) and MMP-3 (B) mRNA in HDF cells. Cells were seeded at 1 × 105cells/well. After 24 hours, cells were treated with several concentrations of DM and TNF-α (10 ng/mℓ) cultured for 6 hours. Then, expression of MMP-1 and MMP-3 mRNA were measured as described in Materials and Methods. Data are mean ± SD of three experiments performed in triplicate. Different letters are significantly different at p<0.05 by DMRT.
고 찰
Melanin은 자외선으로부터 인체를 보호하기 위해 melanin 형성 세포에서 합성되는 것으로 생성된 melanin은 각질세포로 이동하여 있다가 각질세포가 떨어져 나갈 때 외부로 나가게 된다. Melanin은 eumelanin과 pheomelanin의 2종류로 구분되 는데, eumelanin은 3,4-dihydroxy-phenylalanine (DOPA), DOPA quinone를 거쳐 melanin이 생합성 된다고 알려져 있고 이때 TRP1, TRP2 단백질이 관계한다고 알려져 있다 (Schiaffino et al., 2010). Melanin세포는 자외선 (UV)에 대 하여 α-MSH (melanocyte stimulating hormone)와 부신피질 자극호르몬 (adrencorticotropic hormone, ACTH)과 같은 melanocortin peptide를 분비하게 된다 (Thody and Graham, 1998). 표피세포 중 melanin세포는 자외선 (UV)이나 proinflammatory cytokine과 같은 자극에 의해 MSH를 생성하며 melanocortin receptors 1 (MC1R)과 결합하여 표피세포의 증 식과 성장, 국소조직의 면역조절 그리고 가장 표면적으로 하는 melanin 생합성 등 다양한 생리적 기능을 관여한다 (Park et al., 2009; Slominski et al., 2004; Choung et al., 2013; Kim et al., 2013).
이에 따라 자생 석곡 추출물이 melanin 형성세포주에서 melanin 생성에 미치는 영향을 알아보기 위하여 α-MSH를 처 리하여 멜라닌 생성을 유도한 결과 자생 석곡 추출물에서 농 도 의존적으로 melanin 형성을 억제하였고 200μg/mℓ 농도에 서는 양성대조군으로 사용한 arbutin 100μg/mℓ 처리한 것과 유사한 멜라닌 형성 억제 효과를 나타내었다. 이에 따라 멜라 닌 형성에 관여하는 tyrosinase 활성을 조사한 결과 자생 석곡 추출물에서는 멜라닌 형성과 마찬가지로 농도의존적인 tyrosinase 활성의 억제와 단백질 발현 억제효과를 나타냈으며 이 또한 가장 고농도인 200μg/mℓ 농도에서는 양성대조군인 arbutin과 유사한 활성을 나타내었다.
Tyrosinase 활성에 관여한다고 알려진 대표적인 전사인자는 MITF로써 MSH에 의해 MC1R이 신호전달을 하게 되는데 이 를 통하여 MITF 유전자가 발현을 하게 되고 번역반응을 통해 단백질로 생성 된다. 이러한 MITF 단백질은 핵안으 로 translocation 되어 melanin 합성과 관련된 key 효소인 tyrosinase, TRP1, TRP2의 유전자 발현을 증가시키게 된다 (Liu and Fisher, 2010). 자생 석곡 추출물에서 tyrosinase 활성 기전을 알아보기 위하여 MITF 및 TRP-1, −2 유전자 발현을 확인하였다. 그 결과 MITF 전사인자의 유전자 발현을 억제하 였고, 그에 따라 TRP-1, TRP-2 유전자 발현량 또한 억제함을 확인하였다.
Collagen은 피부 진피층을 구성하고 있는 주요 구조 단백질 로 type-1 collagen이 대부분을 차지하며, 자외선으로부터 피부 손상을 막아주고 수분 균형을 유지하여 주름 예방 및 탄력적 인 피부를 유지하는데 필수적인 요소로 collagen의 감소는 피 부노화 및 주름생성과 매우 밀접한 관계를 가지고 있다 (Yang et al., 2009). 자생 석곡의 주름 개선 효과를 확인하기 위하여 인체 섬유아세포주를 이용하여 석곡을 농도별로 처리한 뒤 24시간 배양하여 kit를 이용하여 procollagen 합성에 미치는 영 향을 조사하였다. 그 결과 석곡은 농도 의존적으로 procollagen 합성을 유도하는 것으로 나타났다. 또한 각질형성세포와 섬유 아세포에 의해 분비되어 피부주름 생성에 관여하는 MMPs에 관하여 조사하였다. MMPs는 촉매부분에 금속을 포함하는 효 소로 현재까지 약 25개 이상이 밝혀졌고, 자외선, 산화스트레 스, TNF-α 등과 같은 다양한 자극에 의해 활성이 나타나게 된다 (Steenprot et al., 2009). 이러한 MMPs family 들 중 에서도 주름형성에 관여하는 collagenase 역할을 하는 대표적 인 MMPs family는 collagenases인 MMP-1, −8, −13이 있으 며 그중에서도 MMP-1이 MMP-13에 비해서 약 10배 정도 발현이 높게 일어난다고 알려져 있다. 또한 MMP-3의 경우에 는 fibronectin, elastin, laminin, aggrecan을 기질로 하는 효 소이면서 proMMP-1의 활성에 기여한다 (Elliott et al., 2003; Kim et al., 2013; Unemori et al., 1991). 이에 MMP-1, −3의 유전자 발현을 조사하기 위하여 자생 석곡 추출물을 1시 간 동안 전처리한 뒤 TNF-α로 MMP-1, −3 유전자 발현을 유도하고 유전자 발현을 Taqman gene expression 방식을 사 용한 Real-Time PCR로 확인하였다. 그 결과 TNF-α 처리 그 룹에서는 MMP-1, −3 유전자 발현이 높게 나타남을 확인하였 고, 그와 대조적으로 자생 석곡 추출물 처리군 중 가장 고농 도인 200 μg/mℓ 그룹에서는 유의성 있게 유전자 발현이 억제 함을 확인하였다.
위 연구결과들을 종합해 보면 자생 석곡 메탄올 추출물은 미백 및 주름개선 기능성이 있어 향후 피부자극, 피부감작성 등 식약처 기능성 화장품 인증 규정에 따른 안전성 실험으로 안전성이 확보된다면 기능성 화장품으로 개발 가능할 것으로 보인다.
감사의 글
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ009470)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFERENCES
-
Bradford, MM, A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Analytical Biochemistry, (1976), 72, p248-254.
[https://doi.org/10.1006/abio.1976.9999]

- Choi, GP, Chung, BH, Lee, DI, Lee, HY, Lee, JH, Kim, JD, Screening of inhibitory activities on angiotensin converting enzyme from medicinal plants, Korean Journal of Medicinal Crop Sciences, (2002), 10, p399-402.
-
Choung, MG, Hwang, YS, Kim, GP, Ahn, KG, Shim, HS, Hong, SB, Choi, JH, Yu, CY, Chung, IM, Kim, SH, Lim, JD, Antimelanogenic effect and whitening of anthocyanin rich fraction from seeds ofLiriope platyphylla, Korean Journal of Medicinal Crop Sciences, (2013), 21, p361-371.
[https://doi.org/10.7783/kjmcs.2013.21.5.361]

- Elliott, S, Hays, E, Mayor, M, Sporn, M, Vincenti, M, The triterpenoid CDDO inhibits expression of matrix metalloproteinase-1, matrix metalloproteinase-13 and Bcl-3 in primary human chondrocytes, Arthritis Research & Therapy, (2003), 5, p285-291.
-
Fisher, GJ, Talwar, HS, Lin, J, Voorhees, JJ, Molecular mechanisms of photoaging in human skin in vivo and their prevention by all-trans retinoic acid, Photochemistry and Photobiology, (1999), 69, p154-157.
[https://doi.org/10.1111/j.1751-1097.1999.tb03268.x]

-
Hemesath, TJ, Price, ER, Takemoto, C, Badalian, T, Fisher, DE, MAP kinase links the transcription factor Microphthalmia to c-Kit signalling in melanocytes, Nature, (1998), 391, p298-301.
[https://doi.org/10.1038/34681]

- Kim, DS, Jeon, BK, Lim, NY, Mun, YJ, Lee, YE, Woo, WH, Ethanol extract ofDioscorea batatasstimulates procollagen production and reduces UVB-induced MMPs activity in skin, Korean Journal of Oriental Physiology & Pathology, (2013), 27, p183-188.
-
Kim, DH, Moon, YS, Park, TS, Hwang, JY, Son, JH, Potent whitening activity ofAruncus dioicusextract in B16F10 melanoma cell by suppression of melanin biosynthesis, Korean Journal of Horticultural Science & Technology, (2013), 31, p813-820.
[https://doi.org/10.7235/hort.2013.13067]

-
Kim, JS, Kim, JW, Kwon, HS, Lim, HW, Lee, HY, Screening of skin whitening activity ofCodonopsis lanceolataextract by complex steaming process, Korean Journal of Medicinal Crop Sciences, (2013), 21, p54-60.
[https://doi.org/10.7783/kjmcs.2013.21.1.54]

-
Kim, TH, Kim, JM, Baek, JM, Kim, TW, Kim, DJ, Park, JH, Choe, M, Antioxidant and whitening effects ofAgrimonia pilosaledeb water extract, Korean Journal of Medicinal Crop Sciences, (2011), 19, p177-184.
[https://doi.org/10.7783/kjmcs.2011.19.3.177]

- Kim, YG, Yang, GH, Cho, SI, Anti-oxidative effect ofDendrobii herbaon toxic, The Korea Journal of Herbology, (2005), 20, p55-60.
-
Liu, JJ, Fisher, DE, Lighting a path to pigmentation: Mechanisms of MITF induction by UV, Pigment Cell & Melanoma Research, (2010), 23, p741-745.
[https://doi.org/10.1111/j.1755-148x.2010.00775.x]

-
Lo, SF, Mulabagal, V, Chen, CL, Kuo, CL, Tsay, HS, Bioguided fractionation and isolation of free radical scavenging components from in vitro propagated chinese medicinal plantsDendrobium tosaenseMakino andDendrobium moniliformeSW, Journal of Agricultural and Food Chemistry, (2004), 52, p6916-6919.
[https://doi.org/10.1021/jf040017r]

- Lee, SY, An, JH, Cho, HY, Isolation and characterization of MMP-1 inhitor peptide fromCrataegus pinnatifidaBunge in fibroblast cell line HS68 cells, Journal of the Korean Society for Applied Biological Chemistry, (2003), 46, p60-65.
- Hwang, BM, Roh, SS, Seo, HS, Effects ofDendrobii herbaandpnicagranatum extract on the anti-oxidant, antiinflammatory, anti-wrinkle and whitening, The Journal of Korean Oriental Medical Ophthalmology & Otolaryngology & Dermatology, (2010), 23, p11-13.
-
Olivares, C, Solano, F, New insights into the active site structure and catalytic mechanism of tyrosinase and its related proteins, Pigment Cell & Melanoma Research, (2009), 22, p750-760.
[https://doi.org/10.1111/j.1755-148x.2009.00636.x]

-
Park, HY, Kosmadaki, M, Yaar, M, Gilchrest, BA, Cellular mechanisms regulating human melanogenesis, Cellular and Molecular Life Sciences, (2009), 66, p1493-1506.
[https://doi.org/10.1007/s00018-009-8703-8]

-
Schiaffino, MV, Signaling pathways in melanosome biogenesis and pathology, The International Journal of Biochemistry & Cell Biology, (2010), 42, p1094-1104.
[https://doi.org/10.1016/j.biocel.2010.03.023]

-
Steenport, M, Khan, KM, Du, B, Barnhard, SE, Dannenberg, AJ, Falcone, DJ, Matrix metalloproteinase(MMP)-1 and MMP-3 induce macrophage MMP-9: Evidence for the role of TNF-a and cyclooxygenase-2, Journal of Immunology, (2009), 183, p8119-8127.
[https://doi.org/10.4049/jimmunol.0901925]

-
Slominski, A, Tobin, DJ, Shibahara, S, Wortsman, J, Melanin pigmentation in mammalian skin and its hormonal regulation, Physiological Reviews, (2004), 84, p1155-1228.
[https://doi.org/10.1152/physrev.00044.2003]

-
Ng, TB, Liu, J, Wong, JH, Ye, X, Wing Sze, SC, Tong, Y, Zhang, KY, Review of research onDendrobium, a prized folk medicine, Applied Microbiology and Biotechnology, (2012), 93, p1795-1803.
[https://doi.org/10.1007/s00253-011-3829-7]

- Thody, AJ, Graham, A, Does alpha-MSH have a role in regulating skin pigmentation in humans?, Pigment Cell Research, (1998), 11, p265-274.
- Unemori, EN, Bair, MJ, Bauer, EA, Amento, EP, Stromelysin expression regulates collagenase activation in human fibroblasts. Dissociable control of two metalloproteinases by interferon-gamma, The Journal of Biological Chemistry, (1991), 266, p23477-23482.
- Wu, M, Hemesath, TJ, Takemoto, CM, Horstmann, MA, Wells, AG, Price, ER, Fisher, DZ, Fisher, DE, c-Kit triggers dual phosphorylations, which couple activation and degradation of the essential melanocyte factor Mi, Genes & Development, (2000), 14, p301-312.
- Bo, Y, Chao, J, Jian, K, Wenqi, C, Zhigang, B, Yinsheng, W, Trans-Zeatin inhibits UVB-induced matrix metalloproteinase-1 expression via MAP kinase signaling in human skin fibroblasts, International Journal of Molecular Medicine, (2009), 23, p555-560.
- Yoon, MY, Kim, JY, Hwang, JH, Cha, MR, Lee, MR, Jo, KJ, Park, HR, Protective effect of methanolic extracts fromDendrobium nobileLindl. on H2O2-induced neurotoxicity in PC12 cells, Journal of the Korean Society for Applied Biological Chemistry, (2007), 50, p63-67.