추출용매와 부위에 따른 고추 추출물의 세포독성
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In order to find out anticancer activity of Korean pepper (Capsicum annuum L.), the cytotoxicity against 8 cell lines including 293 (normal kidney cells) and A-431 (epidermoid carcinoma cells) of extracts by extraction solvents and plant parts were investigated using MTT assay. Also the correlation between content of capsaicin known as anticancer ingredient and cytotoxicity of extracts from pepper were analyzed. The distilled water extracts from seed and germinated seed showed very high cytotoxicity against 6 cancer cell lines including A549 (lung carcinoma cells), AGS (stomach adenocarcinoma cells), HeLa (cervix adenocarcinoma cells), HepG2 (hepatoblastoma cells), HT-29 (colon adenocarcinoma cells), and MCF-7 (breast adenocarcinoma cells). But 80% ethanol and methanol extracts showed cytotoxicity against 293 and AGS. The RC50, that was, the concentration of sample required for 50% reduction of cell viability, of seed and germinated seed extracts against AGS were 33.4 ~ 389.1μg/mℓ and 63.9 ~ 1,316.7μg/mℓ, respectively, so anticancer activity was higher in seed than in germinated seed. In capsaicin contents, seed with high cytotoxicity and pericarp with a little cytotoxicity contained 47.4 ~ 1,260.0μg/g and 58.3 ~ 1,498.0μg/g, respectively. As these results, the correlation was not between cytotoxicity and capsaicin content.
Keywords:
AGS, Anticancer Activity, Capsaicin, Dihydrocapsaicin, Pepper Seed서 언
고추 (Capsicum annuum L.)는 가지과 (Solanaceae)에 속 하며 중남미가 원산이다. 2012년 국내 고추 재배면적은 45,360 ha, 생산량은 117,816톤으로 주요 재배지역은 전북, 경 북, 충북 등이며 10a당 수량은 260kg, 총생산금액은 1,596.9 십억원인 고소득 작물로 주요 조미채소이다 (MAFRA, 2014).
우리나라에서 고추는 발효음식인 김치와 찜이나 탕류에 매 운 맛과 붉은 색을 나타내는 향신채소로 사용되며 매운 맛은 capsaicinoid의 일종인 capsaicin, dihydrocapsaicin 함량과 높 은 상관관계를 보인다 (Lee et al., 1992). 고추에서 분리 된 capsaicinoid는 capsaicin, dihydrocapsaicin, norcapsaicin, nordihydrocapsaicin, homocapsaicin I, II, homodihydrocapsaicin I, II, N-vanillyl decanamide 등 9종이 있는데 (Ana et al., 2006) 이 중 capsaicin, dihydrocapsaicin이 capsaicinoid의 대부 분을 차지하고 있다 (Kim et al., 1997; Yun et al., 2002). 특히 capsaicin은 방광암, 위암, 결장암, 췌장암 등의 암세포 사멸 효과 (Lee et al., 2004; Zhang et al., 2008; Yang et al., 2009; Wang et al., 2011), 항비만 (Seo et al., 2009), 지방간 개선 (Jun et al., 2004), 항산화 효과 (Gang et al., 2008) 등이 높은 기능성 물질로 밝혀져 있다. 따라서 capsaicinoid 함량이 높은 고추 품종이나 부위는 항암 효과 등 과 같은 생리활성 또한 높을 것으로 추정된다.
우리나라 고추의 부위별 중량비는 과피 65.2 ~ 66.2%, 종자 25.2 ~ 25.8%, 과경 6.7 ~ 8.0%, 태좌부 2.8 ~ 3.0%로 조사되었 는데 (Yoon et al., 1983) 고추의 capsaicinoid 함량은 태좌와 격벽에서 가장 높게 나타나고 과피와 종자 순으로 감소하여 부위별로 매운 맛의 차이가 많았다 (Lee, 1971). 고추의 생리 활성에 관한 연구는 주로 유효성분인 capsaicinoid의 기능성 분석에 치중되어 있으며 (Lee, 1971; Lee et al., 2013) 일부 품종별 고추씨와 고춧잎의 항산화성 (Ku et al., 2008; Ku et al., 2009)에 관한 연구결과가 보고된 바 있지만 부위에 따른 다양한 생리활성에 관한 연구는 미미한 실정이다.
최근에는 건고추 생산이 고추 종합처리장에서 대량으로 이 루어짐에 따라 전체 중량의 13 ~ 15%를 차지하는 고추 종자 가 부산물로 발생하고 있으며 일부 발아력이 있는 종자도 생 산되고 있다. 따라서 본 실험은 고추의 부위별 항암 효과를 알아보고자 ‘강력대통’ 등 세 품종의 과피, 잎, 종자, 발아종자 의 용매 추출물을 일정 농도로 처리한 후 A-431 (피부암세 포주) 등 7종의 암세포주에 대한 세포독성을 조사하여 기능성 소재로 개발하고자 하였으며 또한 추출물에서 capsaicinoid류인 capsaicin과 dihydrocapsaicin 함량을 분석하여 capsaicinoid와 고추 추출물에서 나타나는 세포독성과의 관련여부를 알아보고 자 하였다.
재료 및 방법
1. 실험재료
시험품종은 ‘강력대통’, ‘무한질주’ 및 ‘원기 1호’로 전북 임실고추연구소 비닐하우스에 2011년 2월 8일에 파종하여 3월 7일에 가식하였고 5월 13일에 포장에 정식하였으며 농촌 진흥청 표준영농기술에 준하여 재배하였다. 9월 10일 잎과 과 실을 수확하였고 과실은 과피와 종자로 분리하였다. 일부 종자는 60°C 열풍건조기 (FED-240, Wtl binder, Tuttlingen, Germany)에서 건조되었다. 발아종자는 채종하여 25°C로 건조 된 종자를 6시간 동안 침지하고 냉장고 (GC-114KDMP, LG Electronics, Seoul, Korea)를 이용하여 4°C 저온처리를 3일간 실시한 후 배양기 (FP108-1, Kumsung Hitech, Seoul, Korea) 온도를 28°C로 조절하여 유근장 5mm 내외로 발아를 유도하 여 준비한 발아된 종자는 건조기 (J-300M, Jisico, Seoul, Korea)를 이용하여 40°C로 건조한 후 시료로 사용하였다.
2. 세포독성 검정
세포독성 검정을 위해 증류수와 80% 에탄올 및 메탄올을 추출용매로 사용하였는데 시료 5 g을 각각의 추출용매 150mℓ 에 넣어 30분간 초음파 추출 후 25°C에서 24시간, 200 rpm으 로 진탕추출 하였으며 이를 3회 반복하여 얻어진 추출여액을 여과 (No. 2, Toyo, Tokyo, Japan)한 후 회전감압 농축기를 이용하여 농축, 동결건조하고 각각의 용매에 일정 농도로 희 석하여 사용하였다. 또한 capsaicin과 dihydrocapsaicin의 세포 독성을 알아보고자 25 ~ 125μg/mℓ의 농도로 희석하여 세포독 성을 검정하였다.
시험에 사용된 8종의 세포주는 한국세포주은행 (KCLB, Seoul, Korea)에서 분양받았다. 293 (정상 신장세포)는 Dulbecco’s Modified Eagle Medium (DMEM; Gibco, Grand Island, New York, NY, USA) + 25 mM 4-(2-hydroxyethyl)-1- piperazineethanesulfonic acid (HEPES)(Gibco) 배지에, A-431 (피부암세포주)는 DMEM 배지, A549 (폐암세포주), AGS (위 암세포주), MCF-7 (유방암세포주), HeLa (자궁암세포주)는 RPM1 1640 (Gibco) 배지, HepG2 (간암세포주)는 Minimum Essential Medium (Gibco) + 25 mM HEPES 배지, HT-29 (대장암세포주)는 RPMI 1640 + 25 mM HEPES 배지에 각각 배양하였다. 배양 후 세포를 trypsin + EDTA (Gibco)로 탈립 시킨 후 세포 종류에 따라 mℓ당 1 ~ 3 × 104로 조정하여 microplate well당 200μℓ씩 분주하고 24시간 동안 37°C의 CO2 incubator에서 배양하였다. 시료 5㎎을 각각의 추출용매 에 녹인 후 0.2μm membrane filter로 제균하였다. 배양된 세 포를 PBS로 세척하여 배지 190μℓ를 첨가한 후 시료 10μℓ 를 주입하여 최종 농도를 50 ~ 250μg/mℓ로 처리하였는데 이 때 대조구로는 각각의 시료 추출 용매를 사용하였다. 3일 동 안 37°C의 CO2 incubator에서 배양한 후 생존된 세포를 3- (4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT; Sigma-Aldrich, St. Louis, MO, USA) 용액으로 염색 하고 DMSO로 녹여 ELISA reader (Spectra Max 190, Molecular Devices, Downingtown, PA, USA)를 사용 570nm 에서 흡광도를 3반복으로 검정하였으며 대조군 흡광도에 대한 시료처리군 흡광도의 비율을 백분율로 환산하여 세포생존율과 RC50을 구하였다. 이 때 본 실험의 대조구로 항암제인 adriamycin을 사용하였다.
3. Capsaicinoid 함량 분석
고추 용매 추출물에서 나타난 세포독성이 capsaicinoid 함량 과 연관성이 있는지 알아보고자 품종, 추출용매 및 부위에 따 른 capsaicin과 dihydrocapsaicin 함량을 분석하였다. 증류수, 80% 에탄올 및 메탄올로 추출하여 농축된 시료 1 g을 각각의 추출용매 100mℓ에 녹여 0.45μm filter로 여과하여 HPLC (Agilent 1100 series, Agilent Technologies, Santa Clara, CA, USA)로 분석하였는데 시료는 3반복으로 준비하였다. 표 준품은 모두 Sigma-Aldrich Co.에서 구입하였는데 이 때 capsaicin과 dihydrocapsaicin의 순도는 각각 95%, 90%이 었다. 칼럼은 Zorbax eclipse XDB-C18 (4.6 × 150mm, 5.0μm, Agilent Technologies)이며 이동상은 water-CH3CN (50 : 50, v/ v)(Fisher Scientific, Fisher Scientific Korea Ltd., Sungnam, Korea)이고 유속은 분당 1.0mℓ이었으며 UV detector를 사용하여 230.0nm에서 조사하였다. 이 때 injection volume은 20μℓ이고 retention time의 경우 capsaicin은 약 7.0, dihydrocapsaicin은 10.1이었다.
4. 통계처리
통계처리를 위해 SAS 프로그램 (SAS 9.1, SAS Institute Inc., Cary, NC, USA)을 이용하여 분산분석 (ANOVA)과 Duncan’s Multiple Range Test (DMRT)를 실시하였으며 유의 차를 5% 수준에서 검증하였다.
결과 및 고찰
1. 추출용매, 품종 및 부위별 세포독성
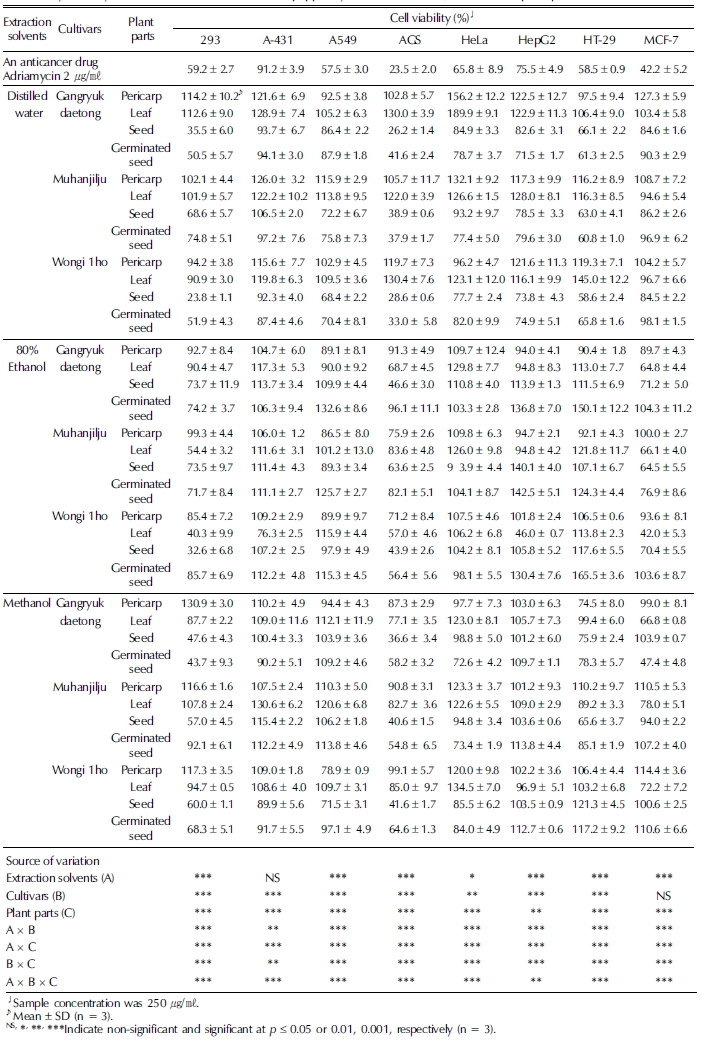
고추 품종 ‘강력대통’ 등 3품종을 수확하여 부위를 과피, 잎, 종자, 발아종자로 구분하여 증류수와 80% 에탄올, 메탄올로 추출하고 293과 A-431 등 7종의 암세포주에 대한 세포독성을 검정하였다 (Table 1).

Cytotoxicity of methanol extracts from Korean pepper by extraction solvents, cultivars and plant parts.
과피, 잎, 종자, 발아종자 가운데 종자와 발아종자의 경우 증 류수와 80% 에탄올, 메탄올 추출시 세포독성이 나타났는데 특 히 증류수 추출물에서 거의 모든 세포주에 대해 세포독성이 검정된 반면 80% 에탄올 추출물은 293과 AGS에 대해, 메탄 올 추출물은 293, AGS, HT-29에 대한 세포독성이 나타났다. 종자와 발아종자의 증류수 추출물은 세포독성이 거의 비슷한 경향을 보였는데 높은 세포독성을 보인 세포주는 AGS로 시 료농도 250μg/mℓ로 처리했을 때 41.6% 이하를 보였으며 다 음은 66.1% 이하를 보인 HT-29로 나타났고 A549에서도 87.9% 이하를 보여 위암세포주와 대장암세포주, 폐암세포주 사멸에 효과적인 것으로 관찰되었다. 자궁암세포주인 HeLa에 대해서는 77.4 ~ 93.2%의 세포생존율을 보였으며 유방암세포 주인 MCF-7에 대한 세포생존율은 84.5 ~ 98.1%로 세포독성이 낮았다. 피부암세포주인 A-431에 대해서는 92.3 ~ 106.5%를 보여 세포독성이 없었다. 대조구로 처리된 293 세포주에 대해 서도 다소 세포독성이 관찰되었다. 과피와 잎의 증류수 추출 물은 정상 신장세포주인 293을 비롯한 8종의 세포주에 대한 세포독성이 거의 나타나지 않았으나 80% 에탄올 추출물과 메 탄올 추출물에서는 AGS에 대한 세포생존율이 각각 57.0 ~ 91.3%, 77.1 ~ 99.1%로 나타나 종자에 비해 추출용매에 따른 성분 차이가 많은 것으로 관찰되었다. MCF-7에 대한 세 포독성은 세 품종 모두 잎을 80% 에탄올과 메탄올 추출했을 때에만 보였으며 증류수 추출시에는 관찰되지 않았다. 고추 추출물과 capsaicin은 유방암세포주, 대장암세포주, 자궁암세 포주, 위암세포주 등에 대해 세포독성이 보고된 바 있다 (Wilkinson et al., 1996; Kim et al., 2002; Lo et al., 2005; Yoon et al., 2012). 고추 추출물과 유방암과의 관련성 에 대한 연구 결과 청고추인 풋고추 ‘녹광’, 꽈리고추 ‘노홍’, 오이고추 ‘길상’, 청양고추 ‘신흥’의 4종류와 Jalapeno pepper 의 메탄올 추출물이 유방암 세포주인 MCF-7, MDA-MB-231 2종에 대한 농도의존적인 세포독성이 보고된 바 있으나 (Yoon et al., 2012) 본 실험에서 사용된 품종의 과피와 종자의 메탄 올 추출물에서는 MCF-7에 대한 세포독성이 나타나지 않아 품 종이나 성숙정도에 따른 차이로 생각되었다. 또한 Jung 등 (2011)은 부위별 검토는 못 했으나 고추 육성계통의 메탄올 추 출물에서 MCF-7 세포주에 대한 증식억제 활성은 계통에 따 라 26.2 ~ 80%로 큰 차이를 보였다고 하였는데 본 실험에서는 80% 에탄올을 추출용매로 사용했을 때 종자에서 MCF-7에 대 해 세포독성이 64.5 ~ 71.2%를 보였으며 메탄올의 경우 94.0 ~ 103.9%로 나타나 세포독성이 높지 않았는데 이는 품종 간의 차이로 생각되었다. 또한 추출용매, 품종 및 부위에 따른 세포독성은 분산분석 결과 대체로 고도의 유의성을 보였다. 강 화 사자발쑥의 경우에도 간암세포 (Hep3B)와 위암세포 (AGS) 에 대해 세포독성을 보였으며 초음파를 병행 추출한 물 추출물 이 에탄올 추출물에 비해 높은 효과를 나타낸 바 있다 (Kwon et al., 2007).
본 실험에서 종자와 발아종자에서 AGS에 대한 세포생존율 이 다른 세포주에 비해 낮아 매우 높은 세포독성이 나타났기 때문에 추출용매별 세포생존율을 50%로 감소시키는데 필요한 시료 농도 RC50을 분석하였다 (Table 2). 대조구로 항암제인 adriamycin을 사용하였는데 이 때 RC50은 0.4μg/mℓ로 매우 낮았다. 종자 증류수 추출물의 RC50이 33.4 ~ 111.2μg/mℓ인데 비해 발아종자 추출물은 63.9 ~ 169.6μg/mℓ으로 높아 상대적 으로 세포독성이 떨어짐을 알 수 있었으며 여러 품종 가운 데 ‘원기 1호’는 33.4 ~ 63.9μg/mℓ로 낮은 RC50을 보여 세포 사멸에 효과적이었다. 80% 에탄올과 메탄올 추출물은 증류수 에 비해 높은 RC50을 보여 세포독성이 감소하였으며 특히 발 아종자의 경우 165.7μg/mℓ 이상으로 관찰되어 세포 사멸 효과 가 거의 없었다. 발아 메밀 추출물의 세포독성 분석 결과에서 도 2 ~ 5 mm 발아시 일부 Calu-6 (폐암세포주)와 SNU- 601 (위암세포주)에서 세포독성이 증가하였으나 발아 전에 비 해 큰 효과는 없었다 (Hwang et al., 2006). 또한 고추의 위 암세포주 억제 효과에 대해 Kim 등(2005)도 붉은 고춧가루와 이를 이용해 만든 고추장에서 AGS에 대한 항암 효과에 대해 보고한 바 있으나 품종이 명확하지 않고 본 실험에 비해 고농 도로 처리되어 비교 검토는 어려웠다.

The RC50 of cytotoxicity against AGS of seed extracts by extraction solvents and germination status in Korean pepper.
본 실험에서는 고추 추출물이 위암 세포주 생존율 억제 효 과가 높았던 것으로 나타났으나, 이에 관한 연구결과가 현재 많지 않은 실정으로 앞으로 고추 추출물의 AGS 항암 기전과 이에 관여하는 성분에 관해 심도있는 검토가 진행되어야 한다.
2. Capsaicinoid의 세포독성
Capsaicinoid와 고추 추출물의 세포독성의 차이를 알아보고자 본 실험에서는 capsaicin과 dihydrocapsaicin을 25 ~ 125μg/mℓ의 농도로 처리한 후 암세포주의 생존율을 어느 정도 감소시키는 지 조사하였다. Capsaicin과 dihydrocapsaicin 두 성분 모두 실 험에 사용된 293 등 8종의 세포주에 대해 농도의존적으로 높 은 세포독성이 관찰되었는데 특히 125μg/mℓ 농도에서 세포생 존율은 A549의 경우 25.8 ~ 26.3%, AGS은 37.4 ~ 38.4%, HT- 29은 20.5 ~ 21.2%, MCF-7은 15.4 ~ 16.3%로 매우 낮아 폐암 과 위암, 대장암, 유방암에 항암 효과가 더욱 클 것으로 생각 되었다 (Fig. 1).
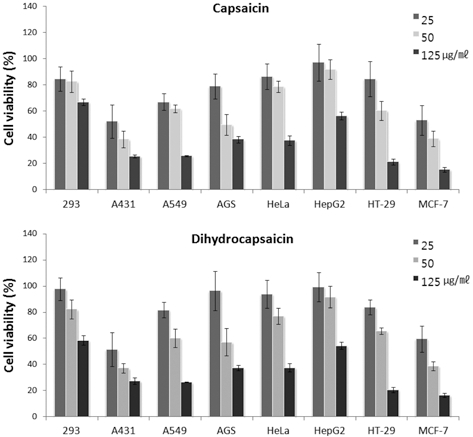
Cytotoxicity of capsaicin and dihydrocapsaicin by concentration. Vertical bars mean standard error (n = 3).
Capsaicinoid는 고추에서만 발견되는 성분으로 capsaicin과 dihydrocapsaicin 두 성분이 주종을 이루며 이 가운데 capsaicin은 자궁암, 위암, 간암, 유방암, 백혈병 등에 대한 항 암 효과가 높은 것으로 보고되고 있다 (Wilkinson et al., 1996; Lo et al., 2005; Erin et al., 2006; Tsou et al., 2006; Huang et al., 2009).
Kim 등(2002)은 대장암세포주 CoLo320DM과 LoVo에 capsaicin을 0.5 mM 농도로 처리했을 때 16.8 ~ 17.2%의 낮은 세포생존율을 보인다고 하였으며 이는 capsaicin이 시간과 용 량 의존적으로 세포의 생활력을 감소시키고, 세포의 수축과 DNS 분절을 야기하며 DNA 함량을 감소시켜 일어나는 현상 이라고 하였다. 또한 capsaicin은 위암세포주인 SNU-668의 apoptosis를 일으키는데 pro-apoptotic Bax에 대한 antiapoptotic Bcl-2의 비율을 감소시켜 세포를 사멸시키고, DNA 손상 시 종양억제유전자 p53은 G1 cyclin-dependent kinase (CDK)의 억제자인 p21 유전자의 발현을 유도하여 세포를 G1 기에서 진행을 정지시키고 정상세포주기를 조절하거나, p53의 발현과 활동능을 증가시켜 세포 사멸이 일어난다고 보고되기 도 하였다 (Kim et al., 2008). 다른 항암기전으로 capsaicin 이 암세포 내 활성세포종을 발생시켜 세포 사멸을 유도하고 세포 주기를 억제한다고 보고되어 (Oyagbemi et al., 2014) 세포주를 통한 capsaicin의 항암 기전이 다양한 분석방법을 통 해 밝혀지고 있다.
3. 추출용매, 품종 및 부위별 capsaicinoid 함량
고추 종자와 발아종자에서 나타난 세포독성이 capsaicinoid 에 의해 발현되는 현상인지 알아보고자 추출용매, 시험품종 및 부위별 capsaicinoid 함량을 조사하였다.
Capsaicin과 dihydrocapsaicin은 과피와 종자 추출물에서 검 출되었으며 발아종자와 잎에서는 거의 나타나지 않았고 두 성 분 가운데 capsaicin이 dihydrocapsaicin보다 높은 함량을 보였 다 (Table 3). 특히 80% 에탄올 추출시 높은 capsaicinoid 함 량을 보였으며 증류수 추출시 낮은 함량을 보여 세포독성이 높았던 증류수 추출물이 오히려 capsaicinoid 함량이 적게 나 타났다. 품종 간 차이도 많아 신미도가 강한 ‘강력대통’에서 capsaicinoid 함량이 높았으며 ‘원기 1호’는 상당히 낮은 함량 을 보였다. 세포독성이 높았던 종자와 발아종자의 capsaicinoid 함량을 비교한 결과 capsaicin은 종자에서 47.4 ~ 1,260.0μg/g 이 함유되어 있었으며 발아종자에서는 32.3μg/g 미만으로 적 은 함량을 보여 세포독성과 capsaicin과의 연관성을 찾기 어려 웠다. 과피 역시 capsaicin 함량은 58.3 ~ 1,498.0 μg/g으로 높 았으나 세포독성은 거의 나타나지 않아 고추의 항암효과는 capsaicn 뿐만 아니라 다양한 성분들에 의한 것으로 추정되었 다. 본 실험에서 고추 종자와 발아종자에서 나타난 AGS 암세 포주 생존율 억제 효과와 capsaicinoid 농도와의 상관분석을 실 시한 결과 종자와 발아종자 내 capsaicin 함량과 AGS 암세 포주 생존율과의 상관계수는 0.03 (p > 0.05)로 유의성이 인 정되지 않았으며 dihydrocapsaicin과의 상관계수도 0.07 (p > 0.05)로 나타나 역시 둘 사이의 연관성을 찾을 수 없었다 (결과 미제시).
고추의 세포독성과 관련된 연구로 Kwon 등(2005)은 고추 종자 단백질인 lunasin peptide를 동정하였는데 lunasin peptide은 종양 유전자가 전이된 세포의 콜로니 형성을 억제시 켜 암을 예방하는 특성을 가지고 있으며 종자를 제외한 다른 부위에 존재하지 않기 때문에 고추 추출물의 항암 효과는 lunasin peptide에 의한 것이라고 보고하였다. 콩 종자로부터 처음 분리된 lunasin peptide는 murine의 섬유아세포와 간세포, 그리고 인간의 자궁암 세포의 염색체 조각화나 세포 용해 등 을 일으키는 것으로 알려져 있다 (Galvez and de Lumen, 1999). 그러나 본 연구에서는 lunasin peptide가 함유되어 있지 않는 과피와 잎에서도 일부 암세포주에 대한 세포독성이 나타 났기 때문에 세포독성 효과에 관여하는 또 다른 물질이 존재 할 것으로 생각된다. 최근 luteolin, quercetin, apigenin 등 플 라보노이드와 비타민C 함량이 높았던 꽈리고추에서 유방암 세 포주인 MCF-7과 MDA-MB-231 세포의 증식 억제 효과가 보고된 바 있으며 (Yoon et al., 2012) 육성계통 중인 고추에 서도 유방암 세포주에 대한 증식 억제 효과와 capsaicinoid 함 량과의 상관분석 결과 상관계수 값이 매우 낮아 capsaicinoid 뿐만 아니라 다양한 polyphenol 및 기타 phytochemical이 세 포 사멸에 관여하는 것으로 추정되었다 (Jung et al., 2011).
이상의 결과 고추의 과피, 잎, 종자, 발아종자 등 여러 부위 중 종자와 발아종자의 증류수 추출물에서 A549 등 7종의 암 세포주에 대해 세포독성이 나타났으며 80% 에탄올과 메탄올 추출물은 293, AGS에 대해 낮은 세포생존율을 보였고 HT-29 와 MCF-7에 대해서도 일부 세포독성이 나타났다. 특히 AGS 에 대해 세포생존율이 낮아 위암세포에 대한 항암 효과가 기 대되었는데 종자와 발아종자의 AGS에 대한 RC50을 조사한 결과 종자 증류수 추출물의 RC50이 발아종자 추출물보다 낮 아 상대적으로 종자에서 높은 세포독성이 있었고 특히 세 품 종 가운데 ‘원기 1호’는 매우 낮은 RC50을 보였다. 또한 잎을 80% 에탄올과 메탄올로 추출했을 때 MCF-7에 대해 세포 사 멸 효과가 있었다. 그러나 강력한 세포독성을 지닌 것으로 밝 혀진 capsaicin과 고추 추출물의 세포독성과의 연관성은 나타 나지 않아 고추 종자와 발아종자의 암세포 사멸에는 capsaicin 뿐만 아니라 다양한 성분들이 관여하는 것으로 생각된다.
감사의 글
본 연구는 농촌진흥청에서 주관하는 고추씨 이용증대를 위 한 생리활성 탐색 및 고추씨기름 생산방법 개발(과제번호: PJ907171) 연구비 지원으로 수행된 결과로 이에 감사드립니다.
REFERENCES
- Ana, GC, Maria, SAA, Javier, A, Ramiro, GO, Ana, AF, Determination of capsaicin and dihydrocapsaicin inCapsicumfruits by liquid chromatograhy-electrospray/time-offlight mass spectrometry, Journal of Agricultural Food Chemistry, (2006), 54, p9303-9311.
-
Erin, N, Zhao, W, Bylander, J, Chase, G, Clawson, G, Capsaicin-induced inactivation of sensory neurons promotes a more aggressive gene expression phenotype in breast cancer cells, Breastcancer Research and Treatment, (2006), 99, p351-364.
[https://doi.org/10.1007/s10549-006-9219-7]

-
Galvez, AF, de Lumen, BO, A soybean cDNA encoding a chromatin-binding peptide inhibits mitosis of mammalian cells, Nature Biotechnology, (1999), 17, p495-500.
[https://doi.org/10.1038/8676]

-
Gang, HM, Park, HS, Kwon, KB, Rhim, TJ, A study on the comparison of antioxidant effects between hot pepper extract and capsaicin, Journal of Korean Pharmacopuncture Institute, (2008), 11, p109-118.
[https://doi.org/10.3831/kpi.2008.11.1.109]

- Huang, SP, Chen, JC, Wu, CC, Chen, CT, Tang, NY, Ho, YT, Lo, C, Lin, JP, Gung, JG, Lin, JG, Capsaicin-induced apoptosis in human hepatma HepG2cells, Anticancer Research, (2009), 29, p165-174.
- Hwang, EJ, Lee, SY, Kwon, SJ, Park, MH, Boo, HO, Antioxidative, antimicrobial and cytotoxic activities ofFagopyrum esculentumMench extract in germinated seeds, Korean Journal of Medicinal Crop Science, (2006), 14, p1-7.
- Jun, BS, Cha, JY, Yoo, KS, Cho, YS, Improvement effect of capsaicin against orotic acid-induced fatty liver in rats, Journal of the Korean Society of Food Science and Nutrition, (2004), 33, p815-820.
- Jung, MR, Hwang, Y, Kim, HY, Cho, MC, Hwang, IG, Yoo, SM, Jeong, HS, Lee, JS, Evaluation of biological activity in pepper(Capsicum annuumL.) breeding lines, Journal of the Korean Society of Food Science and Nutrition, (2011), 40, p642-648.
- Kim, GY, Yang, KM, Pyo, JO, Sung, MK, Park, UC, Choi, DH, Nam, CW, Nah, YW, Ko, BK, Park, KC, Im, YC, Kim, BS, Cho, HR, Study of capsaicin-induced apoptosis in human colon cancer cell lines, Journal of Korean Surgical Society, (2002), 62, p103-111.
- Kim, SH, Kim, YH, Lee, ZW, Kim, BD, Ha, KS, Analysis of chemical constituents in fruits of red pepper (Capsicum annuumL. cv. Bugang), Journal of the Korean Society for Horticultural Science, (1997), 38, p384-390.
-
Kim, SO, Kong, CS, Kil, JH, Kim, JY, Han, MS, Park, KY, Fermented wheat grain products and kochujang inhibit the growth of AGS human gastric adenocarcinoma cells, Journal of Food Science and Nutrition, (2005), 10, p349-352.
[https://doi.org/10.3746/jfn.2005.10.4.349]

-
Kim, SY, Lee, YJ, Park, EH, Yi, HK, Jo, DS, Kim, JS, Hwang, PH, Capsaicin induced apoptosis and the enhanced anticancer effect of anticancer drugs in cancer cells, Korean Journal of Pediatrics, (2008), 51, p307-314.
[https://doi.org/10.3345/kjp.2008.51.3.307]

-
Ku, KH, Choi, EJ, Park, WS, Functional activity of water and ethanol extracts from red pepper(Capsicum annuumL.) seeds, Journal of the Korean Society of the Food Science and Nutrition, (2008), 37, p1357-1362.
[https://doi.org/10.3746/jkfn.2008.37.10.1357]

-
Ku, KM, Kim, HS, Kim, BS, Kang, YH, Antioxidant activities and antioxidant constituents of pepper leaves from various cultivars and correlation between antioxidant activities and antioxidant constituents, Journal of the Applied Biological Chemistry, (2009), 52, p70-76.
[https://doi.org/10.3839/jabc.2009.013]

- Kwon, KS, Park, JH, Kim, DS, Jeong, JB, Sim, YE, Kim, MS, Lee, HK, Chung, GY, Jeong, HJ, Antioxidant activity and identification of lunasin peptide as an anticancer peptide on growing period and parts in pepper, Journal of Life Science, (2005), 15, p528-535.
- Kwon, MC, Kim, CH, Kim, HS, Lee, SH, Choi, GP, Park, UY, You, SG, Lee, HY, Optimal extract condition for the enhancement of anticancer activities ofArtemisia princepsPampanini, Korean Journal of Medicinal Crop Science, (2007), 15, p233-240.
- Lee, HD, Kim, MH, Lee, CH, Relationships between the taste components and sensory preference of Korean red peppers, Korean Journal of Food Science and Technology, (1992), 24, p266-271.
-
Lee, JS, Chang, JS, Lee, JY, Kim, JA, Capsaicininduced apoptosis and reduced release of reactive oxygen species in MBT-2 murine bladder tumor cells, Archives Pharmacal Research, (2004), 27, p1147-1153.
[https://doi.org/10.1007/bf02975121]

-
Lee, SE, Ham, HM, Kim, YH, Sung, JH, Hwang, IG, Yu, SM, Jeong, HS, Lee, JS, The content of capsaicinoids in peppers by cultivation region in Korea, Journal of the Korean Society of Food Science and Nutrition, (2013), 42, p129-133.
[https://doi.org/10.3746/jkfn.2013.42.1.129]

- Lee, SW, Physio-chemical studies on the after-ripening of hot pepper fruits(part 6):Hot-taste component in different parts and of capsaicin homologues, Journal of Korean Society of Agricultural Chemistry and Biotechnology, (1971), 14, p157-163.
-
Lo, YC, Yang, YC, Wu, IC, Kuo, FC, Liu, CM, Wang, HW, Kuo, CH, Wu, JY, Wu, DC, Capsaicin-induced cell death in a human gastric adenocarcinoma cell line, World Journal of Gastroenterology, (2005), 11, p6254-6257.
[https://doi.org/10.3748/wjg.v11.i40.6254]

- Ministry of Agriculture, Food and Rural Affairs(MAFRA), The cultural situation and actual output of greenhouse vegetables in 2013, (2014), Sejong, Korea, Ministry of Agriculture, Food and Rural Affairs, p11-43.
- Oyagbemi, AA, Saba, AB, Azeea, OI, Capsaicin: A novel chemopreventive molecule and its underlying molecular mechanisms of action, Indian Journal of Cancer, (2014), 47, p53-58.
-
Seo, YJ, Kim, JY, Noh, SK, Effect of enteral capsaicin on the lymphatic absorption of cholesterol and fats in rats, Journal of the Korean Society of Food Science and Nutrition, (2009), 38, p1712-1717.
[https://doi.org/10.3746/jkfn.2009.38.12.1712]

- Tsou, MF, Lu, HF, Chen, SC, Wu, LT, Chen, YS, Kuo, HM, Lin, SS, Chung, JG, Involvement of Bax, Bcl-2, Ca2+and caspase-3 in capsaicin-induced apoptosis of human leukemia HL-60 cells, Anticancer Research, (2006), 26, p1965-1971.
-
Wang, HM, Chuang, SM, Su, YC, Chueh, PJ, Down-regulation of tumor-associated NADH oxidase, tNOX(ENOX2), enhances capsaicin-induced inhibition of gastric cancer cell growth, Cell Biochemistry and Biophysics, (2011), 61, p355-366.
[https://doi.org/10.1007/s12013-011-9218-0]

-
Wilkinson, F, Kim, C, Cho, N, Chueh, PJ, Leslie, S, Moya-Camarena, S, Wu, LY, Morre, DM, Morre, D, Isolation and identification of a protein with capsaicin-inhibited NADP oxidase activity from culture media conditioned by growth of HeLa cells, Archives of Biochemistry and Biophysics, (1996), 336, p275-282.
[https://doi.org/10.1006/abbi.1996.0558]

-
Yang, KM, Pyo, JO, Kim, GY, Yu, R, Han, IS, Ju, SA, Kim, WH, Kim, BS, Capsaicin induces apoptosis by generating reactive oxygen species and disrupting mitochondrial transmembrane potential in human colon cancer cell lines, Cellular Molecular Biology Letters, (2009), 14, p497-510.
[https://doi.org/10.2478/s11658-009-0016-2]

-
Yoon, HJ, Lee, S, Hwang, IK, Effects of green pepper(Capsicum annuumvar.) on antioxidant activity and induction of apoptosis in human breast cancer cell lines, Korean Journal of Food Science and Technology, (2012), 44, p750-758.
[https://doi.org/10.9721/kjfst.2012.44.6.750]

- Yoon, HS, Kwon, JJ, Bae, MJ, Hwang, JH, Studies on the development of food resources from waste seeds. IV. Chemical composition of red pepper seed, Journal of the Korean Society of Food Science and Nutrition, (1983), 12, p46-50.
- Yun, HK, Kim, KY, Kim, YC, Lee, JW, Kim, IS, Yoo, KC, Higashio, H, Change of some constituents along with the fruit maturity inCapsicumspecies, Journal of Korean Society for Horticultural Science, (2002), 43, p39-42.
-
Zhang, R, Humphreys, I, Sahu, RP, Shi, Y, Srivastaya, SK, In vitro and in vivo induction of apoptosis by capsaicin in pancreatic cancer cells is mediated through ROS generation and mitochondrial death pathway, Apoptosis, (2008), 13, p1465-1478.
[https://doi.org/10.1007/s10495-008-0278-6]