
발효 공정을 통한 아로니아 추출물의 항염증 효능 증진
© The Korean Society of Medicinal Crop Science. All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was indicated to enhance the anti-inflammation activities by the fermentation of the fruits of Aronia melanocarpa (Michx.) Elliott. The extracts by 70% ethanol (EE) showed better biological activities than those by hot water (WE) from campared result of the effect of extraction solvents. Then, the extract from 70% ethanol extraction was further fermented by lactic acid, denoted as FEE. For antioxidant activities, the FEE had showed the highest value as 0.832 of reducing powder, in comparison with those of EE and WE. Cytotoxicity of the water extraction (WE) was measured for 12.06% in addition of 1.0 mg/mℓ of FEE. For anti-inflammation activities, NO production from the macrophage, RAW 264.7 was observed as 7.24 μM and 8.52 μM from FEE and EE, respectively. Prostaglandin E2 (PGE2) production from human fibroblast cell, CCD-986sk, was also estimated for 152 pg/mℓ in addition of 1.0 mg/mℓ of the FEE. The lowest production of both IL-6 and TNF-α were 3.5 pg/mℓ and 865.5 pg/mℓ, respectively in addition of 1.0 mg/mℓ of the FEE, whereas 74.5 pg/mℓ and 982.4 pg/mℓ in treated with same concenrations of the EE. It was also found that the FEE was higher amounts than other extracts through HPLC analysis of the anthocyanins. These results strongly indicate that fermentation process of the lactic acid could enhance anti-inflammation activities of extracts by increasing the amounts of the anthocyanins, especially cyanidin-galactoside. Our results suggest that the application of the fermentation process for other medicinal herbs can be improved their biological activities.
Keywords:
Aronia melanocarpa, Anti-inflammation, Lactic Acid Fermentation서 언
멜라노카르파아로니아 (Aronia melanocarpa (Michx.) Elliott 이하 아로니아)는 베리류에 속한다. 검붉은 색을 띠고 페놀함량이 많다고 알려져 있으며 그 중 안토시아닌의 함량이 매우 많은 것으로 보고되었으며, 동유럽 및 북아메리카에서 서 식한다 (Jan and Jean, 1988). 다량 함유 된 안토시아닌을 포 함한 기타 생리활성물질에 의해 아로니아는 항산화에 대한 활 성이 좋은 것으로 보고 되었으며 그 밖에도 항염증 및 면역증 진, 항 당뇨, 심혈관계 질환에 대한 효능이 알려져 있다 (Jakobek et al., 2012). 이처럼 기존에 알려진 아로니아의 효 능을 바탕으로 하여 기존에 아로니아의 발효에 대한 연구가 매우 적기 때문에, 유산균을 이용한 아로니아의 발효를 이용 한 항염증에 대한 효능 증진을 통하여 향장제품 소재 개발의 폭을 넓히기 위한 연구를 진행하였다.
유산균을 이용한 발효 공정은 인간에게 유익한 미생물을 이 용함으로서 미생물의 대사 작용을 통해 천연물의 주요 성분 추출에 용이할 수 있으며, 또한 천연물의 각 종 생리활성에 대한 효능을 증진시킬 수 있는 공정이라고 연구 된 바 있다 (Kong et al., 2008). 항산화 및 면역 효능에 대해 보고 된 유산균을 사용함으로서
아로니아가 가지는 효능을 향상시킬 수 있을 것으로 사료 된다 (Kim and Ham, 2003).
면역에 깊이 관여하는 염증반응이란 외부의 여러 자극에 의 한 체내의 면역체계의 반응이며 자극에 의하여 손상 된 각 종 조직을 원 상태로 되돌리려하는 기전이다. 외부의 자극에 의 하여 대식세포는 사이토카인 및 PGE2 (prostaglandin E2), NO (nitric oxide)를 분비하게 된다. PGE2는 염증성 사이토카인인 IL-6 (interleukin-6)와 TNF-α (tumor necrosis factor-alpha)의 생성을 촉진시켜 외부 자극이나 감염에 대한 면역작용을 한다 (Medaniel et al., 1996). 그러나 여기서 만들어진 과도한 NO 의 생성은 체내 독성유발 및 유전자 돌연변이를 야기하는 위 험요소가 있다 (Choi et al., 2010). 또한 활성산소는 염증반 응유발의 주요 물질로 알려져 있는데, 활성산소는 체내의 단 백질, 지질 등을 통하여 염증을 유발하는 것으로 연구된 바 있다 (Takizawa, 2003).
이 점에 착안하여 본 연구에서는 항산화, 항염증효능에 대 해 효능이 있다고 알려진 아로니아를 종래 공정법인 열수 추 출물과 에탄올 추출물 중 실험을 통하여 효율이 더 좋게 확인 된 에탄올 추출물을 발효시킴으로서 기존의 보고되지 못했던 발효 아로니아의 항염에 대한 효과를 확인하여 유산균 발효 아로니아에 대한 항염증 효능의 증진을 확인하고 향장소재로 서의 이용가치를 검증하기 위해 실험을 진행하였다.
재료 및 방법
1. 시료 제조
시료 제조에 사용 된 아로니아는 2013년도 산 단양군에서 채취한 아로니아를 사용하였다. 아로니아 시료의 추출은 열수, 에탄올, 발효 추출 3가지 추출방법으로 각각 수직 환류냉각기 가 설치되어있는 둥근바닥 플라스크를 사용하여 수행하였다. 열수추출물은 1ℓ의 증류수에 아로니아 열매 100 g을 사용하 여 100℃의 조건에서 24시간 추출하였고, 에탄올 추출물 또한 동일한 조건에서 용매를 70% 에탄올로 하여 80℃에서 24시 간 추출하였다. 발효 추출물의 경우 아로니아 100 g을 유산균 Lactobacillus rhamnosus에 7일 동안 37℃, 90 rpm에서 배양 하였으며, 배양한 뒤 상기와 마찬가지로 70% 에탄올 추출 후 아로니아 추출액을 감압여과기를 사용하여 여과하였다. 여과 후에 회전식 감압농축기 (EYELA N-1000, Tokyo Rikakikai Co., Tokyo, Japan)로 농축한 후, 동결건조기 (PVTFA 10AT, ILSHINBioBase, Dongducheon, Korea)에 72시간동안 동결건 조하여 분말로 만들어 실험을 진행하였다.
2. 세포 및 시약
쥐의 대식세포인 RAW 264.7과 Jurkat T 세포, HDF (Human dermal fibroblasts) 세포는 한국세포주은행 (KCLB, Seoul, Korea)에서 동결 된 것으로 구입하였다. 구입한 세포는 DMEM (Gibco, Carlsbad, CA, USA)배지에 10% fetal bovine serum (Gibco, Carlsbad, CA, USA)을 첨가하여 37℃, 5% CO2 조건하에서 배양하였다. 그 밖에 사용 된 모든 시약 들은 Sigma-Aldrich (St. Louis, MO, USA)을 통하여 구입, 사용하였다.
3. 환원력 측정
환원력 측정은 Oyaizu 방법 (1986)을 참고하였다. 0.25㎖의 아로니아 시료 추출물과 0.2 M의 sodium phosphate buffer와 1%만큼의 potassium ferricyanide 0.25㎖을 함께 첨가하여 50℃ 조건에서 20분 간 반응시킨 후 10% trichloroacetic acid 0.25㎖을 첨가하여 반응을 종료시키고 4,000 rpm에서 10분 동 안 원심분리하였다. 원심분리 한 상등액 500㎕에 증류수 500 ㎕를 혼합하고 0.1%의 ferric chloride 용액 100 ㎕만 큼 넣어 상온에서 10분 동안 반응한 뒤 mircro plate reader (Thermo Fisher Scientific, Waltham, MA, USA)로 700㎚에 서 흡광도를 측정하였다.
4. 세포 독성평가
세포독성평가는 MTT (3-(4,5-dimethythiazol-2-yl)-2,5-diphenyltetrazolium bromide, Sigma-Aldrich, St. Louis, MO, USA) 시 약을 사용하여 실험을 진행하였다. 독성평가에는 HDF세포인 CCD-986sk를 사용하였으며, 7.5 × 105 cells/well 만큼의 세포를 96-well plate에 주입한 후 하루 동안 배양하였다. 하루 뒤 배지 를 제거하고 알맞은 농도로 아로니아 시료를 총 200㎕만큼 투여하고 CO2 배양기에서 다시 한 번 24시간 동안 배양한다. 24시간 후 처리한 시료를 제거하고, MTT 용액을 200㎍/㎖의 농도로 하여 96-well plte에 첨가하고 빛을 차단한 채 37℃에 서 3시간 배양한다. 3시간 뒤 PBS buffer로 세척한 뒤 DMSO 를 각 well에 200㎕ 만큼 주입하고 20분 후 microplate reader로 570㎚의 파장에서 흡광도를 측정하였다.
5. NO (Nitric Oxide)생성량 측정
Nitric Oxide 생성량 측정은 RAW 264.7 세포를 사용하였다. 세포를 1.2 × 106 cells/㎖ 만큼 96-well plate에 주입한 뒤 24시 간 배양하였다. 24시간 후 아로니아 추출물 시료를 0.5㎎/㎖의 농도로 처리한 뒤 추가로 시료에 LPS (Lipopolysaccharide)를 처리하여 각 well에 200㎕가 되도록 하고, 시료에 LPS를 처 리한 군과 처리하지 않은 군을 나누어 샘플처리 한 뒤 24시 간 동안 다시 배양하였다. 24시간 뒤 샘플의 상층액 50㎕를 취하여 새로운 96-well plate에 옮기고 난 뒤 Griess 시약 50㎕를 첨가하고 15분 간 반응하였다. 15분 후 microplate reader를 이용하여 540㎚에서 흡광도를 측정하였다. 정량은 standard인 NaNO2를 사용한 standard curve를 통하여 NO생 성량을 정량하였다.
6. 사이토카인 생성 확인
Cytokine 생성량은 IL-6 (Interleukin-6), TNF-α (Tumor necrosis factor-alpha)의 정량 kit를 통하여 측정하였다. IL-6 는 Quantikine ELISA Mouse IL-6 kit (R&D Systems, Minneapolis, MN, USA)를 사용하였다. Jurkat T 세포 5.3 × 105 cells/㎖만큼의 농도를 96-well plate에 넣어 24시간 배양한 후 샘플을 농도별로 처리하고 0.2 g/㎖농도로 맞춘 LPS (Lipopolysaccharide)를 모든 샘플에 같은 양으로 처리한 뒤 24시간 동안 다시 배양하였다. 24시간 뒤 kit의 실험 방법 에 맞춰 우선 assay diluent 50㎕를 넣고 적절히 준 뒤, 샘 플과 정량하기 위한 standard를 넣고 1분동안 충분히 섞어준 뒤 2시간 동안 실온에 두었다. 2시간이 지난 후에 wash buffer로 세척한 뒤 IL-6 conjugate를 넣고 2시간 동안 실온에 방치하였다. 그 뒤 wash buffer로 씻은 후 substrate solution 100㎕를 모든 시료군에 넣고 다시 30분 간 빛을 차단한 채 실온에 방치하였다. 30분 뒤 반응을 멈추기 위해 stop solution 을 넣고 microplate reader를 이용하여 450㎚ 파장에서 흡광 도를 측정하였으며, 정량은 standard를 이용하여 정량하였다.
TNF-α 역시 kit 실험 전까지 IL-6와 동일한 샘플처리를 한 후 동일한 회사의 kit인 Quantikine ELISA Mouse TNF-α kit (R&D Systems, Minneapolis, MN, USA)를 사용하여 TNF-α의 양을 확인하였다. 50㎕의 assay diluent를 준비 된 plate에 넣은 뒤 standard와 샘플 50㎕만큼 첨가하고 2시간 동안 실온에 두었다. 2시간 뒤에 wash buffer로 세척하고 TNF-α conjugate 100㎕를 첨가하고 2시간 동안 실온에 방치 하였다. 2시간 뒤 그 전과 마찬가지로 wash buffer로 세척해주 고 substrate solution 100㎕를 넣은 후 빛을 차단하여 30분 동안 실온에 두었다. IL-6와 같이 마지막으로 stop solution 100㎕를 첨가하여 반응을 멈추고 microplate reader를 이용하 여 450 ,㎚에서 흡광도를 측정하고, standard 곡선을 이용하여 각 샘플에 대한 TNF-α의 양을 정량 하였다.
7. PGE2 생성확인
PGE2 (Prostaglandin E2)생성량의 확인은 정량 가능한 kit를 이용하였다. 실험에는 Prostaglandin E2 Assay Parameter kit (R&D Systems, Minneapolis, MN, USA)를 정량 하였다. 필 요한 아로니아 샘플과 standard를 150㎕ 만큼 농도별로 주입 한 뒤 각 well에 50㎕ 만큼의 primary antibody solution을 주입하고 1시간 동안 microplate shaker를 이용하여 500 rpm 의 속도로 실온에 방치하였다. 1시간이 지난 후 샘플 및 standard에 50㎕의 PGE2 conjugate 를 첨가 한 뒤 다시 2시 간 동안 실온에 두었다. 그 후에 wash buffer를 이용하여 4회 세척 후 substrate solution을 각 well에 200㎕씩 첨가하고 30분간 빛을 차단한 채로 방치 하였다. 30분 후에 100㎕의 stop solution을 넣고 450㎚에서 흡광도를 측정하고 측정 된 흡광값에서 standard 곡선 그래프를 통해 샘플의 PGE2의 양을 정량하였다.
8. HPLC 측정
아로니아의 열수 추출물, 70%에탄올 추출물, 발효시킨 열수 추출물 그리고 발효 70% 에탄올 추출물로 HPLC 측정을 실 시하였으며, 샘플은 1000 ppm의 농도로 하였고 standard 안토 시아닌 (cyanidin-3-galactoside, chromadex, Irvine, CA, USA)은 100 ppm 으로 분석하여 비교하였다. 조건은 아로니아 의 안토시아닌함량에 대한 연구에서 참고하였다 (Marie B et al., 2013). 고성능 액체크로마토그래피 (Aglient 1260 series, Aglient, Santa Clara, CA, USA)를 사용하였으며, 칼럼은 Jupiter 5u C18 3000A (150 × 4.6㎜)을 사용하였다. 이동상은 (A)HCOOH-H2O (1 : 9), (B)HCOOH-MeOH-H2O (1 : 5 : 4) 의 비율로 하여 (A) 100%에서 시간은 0 ~ 2분, (A) 30%, (B) 70%에서 220분 구간, (B) 100%에서 20 ~ 22분 구간 그 리고 (A) 100%에서 22 ~ 24분 구간을 측정하였다. 모든 시료 는 0.45㎛ 필터링을 하였으며 모든 구간에서 유속은 0.8㎖/ min하고, 칼럼의 온도는 30℃로 유지하였다. HPLC의 크로마 토그램은 520㎚의 파장에서 측정하여 비교분석하였다.
9. 통계처리
모든 실험의 데이터 통계처리는 3회 반복하였으며, 실험값 의 통계는 SPSS 프로그램을 통하여 Duncan’s Multiple Range Test (DMRT) 방법으로 처리하였다. 처리구간의 최소 유의 수준의 차는 p < 0.05로 처리 하였다.
결과 및 고찰
1. 환원력 측정
아로니아 추출물의 항산화 효능을 평가하기 위하여 샘플의 농도 별로 측정하였으며, Fig. 1에 그 결과를 확인하였다. 항 산화능이 높을수록 색은 진하며 흡광값은 높게 나타난다. 단 일물질인 cyanidin-galactoside (cya-gal)의 경우 0.02㎎/㎖의 농도로 진행하였으며, 아로니아 1 g당 20㎎의 안토시아닌이 함량 되어있다고 보고한 선행 연구를 참고하여 1.0㎎/㎖ 농도 의 추출물과 비교하기 위하여 농도를 설정하였다 (Jan and Aneta, 2005). 아로니아 시료와 대표적인 항산화물질인 ascorbic acid을 비교하였을 때, ascorbic acid는 0.2㎎/㎖의 농도에서 1.054에 해당하는 흡광값이 측정되었다. Cya-gal의 흡광값은 0.469로 0.2㎎/㎖ 농도의 ascorbic acid보다 농도는 10배 낮 지만 절반에 가까운 흡광값으로 보아 단일물질의 환원력을 확 인할 수 있다. 이에 반해 아로니아 시료의 흡광값을 살펴보면 가장 높게 확인 된 흡광도가 1.0㎎/㎖의 농도에서 발효 아로 니아 70% 에탄올 추출물이 0.832로 측정 되었으며, 70% 에 탄올 추출물이 0.735의 흡광도를 보였다. 낮은 농도에서는 추 출방법별 샘플간의 유의적인 차이가 확인 되지 않았으나, 농 도가 증가할 수록 그 차이가 증가함을 확인하였다. 상기와 같 은 결과를 보면 일반적인 종래 추출법 중 에탄올 추출물의 항 산화 효능이 더 높게 측정 되었고, 이러한 에탄올 추출물에 유산균을 통한 발효를 실시함으로서 에탄올 추출물에 비해 더 욱 증진 된 항산화 효능을 확인하였으며, 발효 추출물의 환원 력은 같은 안토시아닌이 함유 된 복분자 연구에서의 환원력과 비교하였을 때 (Park et al., 2014), 항산화능이 훨씬 더 뛰어 난 것을 확인하였다. 2
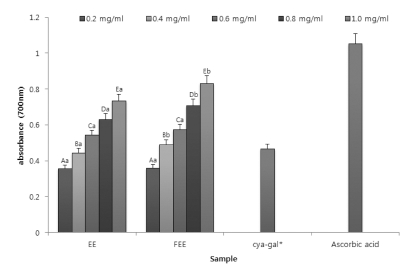
Reducing power from the Aronia melanocarpa extracts obtained by different extraction process.Mean values ± SD from triplicate separated experiments are shown. Mean with difference letter (A-E) within same sample are significantly different at p < 0.05 (A-E; a-b). 1)EE: 70% Ethanol Extract. 2)FEE: 70% Ethanol Extract after lactic acid fermentation. *Concentration of cyanidin-3-galactoside: 0.02㎎/㎖.
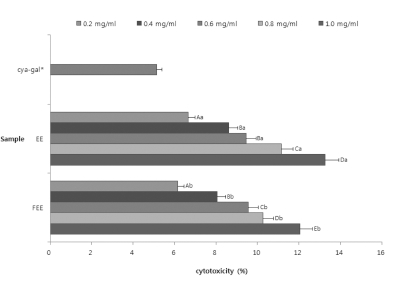
Cell cytotoxicity from the Aronia melanocarpa extracts obtained by different extraction process.Mean values ± SD from triplicate separated experiments are shown. Mean with difference letter within same sample are significantly different at p < 0.05 (A-E; a-b). 1)EE: 70% Ethanol Extract. 2)FEE: 70% Ethanol Extract by fermentation process. *Concentration of cyanidin-3-galactoside: 0.02㎎/㎖.
2. MTT 세포 독성평가
피부면역에 대한 활성평가를 하기에 앞서, 아로니아 시료의 세포독성을 확인하기 위하여 MTT 용액을 이용한 세포 독성 을 측정하였다. 세포 독성평가의 결과로 cya-gal은 5.15%만큼 의 독성을 보였으며, 아로니아 시료 중 가장 독성이 높은 추 출물은 발효를 통한 70% 에탄올 추출물로 1.0㎎/㎖의 농도 에서 12.06%의 독성이 확인되었다. 뒤를 이어 70% 에탄올 추출물이 8.19%가 측정되었다.
발효한 에탄올 추출물이 일반 추출물보다 세포독성이 높긴 하나 이 값은 세포실험을 진행함에 있어 독성이 실험에 영향 을 끼칠 만큼 높지 않은 것으로 판단하였다. 기타 다른 향장 연구가 보고 된 더덕에 대한 선행연구와 비교하였을 때 20% 미만의 독성을 가지는 것으로 보아 (Kim et al., 2013), 발효 한 아로니아 시료 역시 세포에 대한 독성이 높지 않은 것을 확인할 수 있었다.
3. NO (Nitric Oxide)생성량 측정
NO 생성량을 측정함으로서 면역에 대한 효능을 확인해보고 자 하였다. 실험의 결과는 Fig. 3에 나타내었다. NO는 사이토 카인 및 LPS 같은 내독소에 의해 생성되며, 염증 유발로 인 하여 생성된 NO 생성량을 확인함으로서 아로니아 샘플의 항 염증의 효과를 알아보았다. 실험은 LPS 처리군과 무처리군으 로 나누어 진행하여 그 결과 값을 확인하였다. Cya-gal의 경 우 LPS 처리시 9.52 μM의 NO생성량으로 에탄올 추출물보다 는 높게 측정 되었다. 샘플은 LPS 처리군과 무 처리군 두 가 지군 모두 발효 70% 에탄올 추출물의 NO생성량이 가장 낮게 측정 되었다. LPS 처리군의 경우 7.24 μM의 NO 생성량이 측정되었다. 상기와 같은 결과 값은 면역효능이 있다고 보고 된 지치의 논문에서 같은 조건하에 NO생성량이 10.5 μM인 것을 확인하였을 때 (Seo et al., 2013), 적은 생성량으로 보 아 유산균을 통하여 발효 된 아로니아 시료는 NO생성억제에 대한 효능이 있음을 확인할 수 있었다. 또한 유산균을 통한 발효를 실시함으로서 기존의 추출물 보다 NO 생성에 대한 억 제능이 증진 된 것을 알 수 있다.
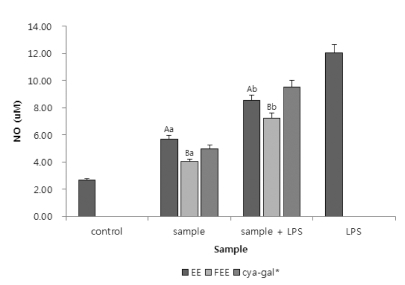
Estimation of nitric oxide production in the macrophages by adding the Aronia melanocarpa extracts obtained through three different extraction processes.Mean values ± SD from triplicate separated experiments are shown. Mean with difference letter within sample are significantly different at p < 0.05 (A-B; a-b). 1)EE: 70% Ethanol Extract. 2)FEE: 70% Ethanol Extract by fermentation process.
4. PGE2 생성량 확인
염증 생성에 주 원인이 되는 PGE2 생성량을 확인함으로서 아 로니아의 염증억제에 대한 효능을 확인해 보고자 실시하였다. 그 결과는 Fig. 4에 나타내었다. 단일물질인 cya-gal은 0.02㎎/㎖의 농도에서 대부분의 아로니아 시료 0.5 ~ 0.75㎎/㎖ 농도의 PGE2 생성량을 보였으며, 모든 샘플에 대하여 농도에 따라 PGE2의 생성량이 감소하는 것을 확인할 수 있다. NO생 성과 마찬가지로 발효를 실시하였을 때 그 생성량이 점차 낮 아지는 것을 알 수 있었다. 0.25 ~ 0.75㎎/㎖의 농도에서는 에 탄올 추출물과 발효 에탄올 추출물의 생성량이 유의적인 차이 를 나타내지 않았으나, 가장 높은 1.0㎎/㎖의 농도에서 발효 시킨 에탄올 추출물의 PGE2 생성량이 다른 추출물과 비교하 여 확연하게 낮은 생성량을 나타내었다. 발효 에탄올 추출물 에서 가장 낮게 측정된 PGE2생성량은 152 pg/㎖ 로 측정 되 었고 이 값은 같은 발효를 통한 황금 추출물에 대한 항염증 연구에서 측정 되었던 PGE2생성량 392 pg/㎖과 비교하여 (Choi et al., 2013), 상당히 낮은 값을 확인하였고 이와 같은 PGE2의 생성량을 확인함으로서 항염증에 대한 효능 역시 뛰 어나며 발효 공정을 실시하였을 때 그 값이 증진 됨을 확인 하였다.
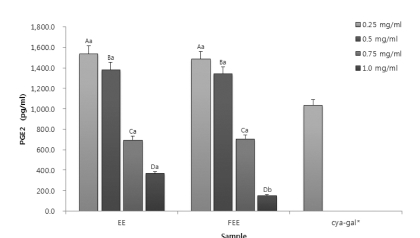
Variation of PGE2 production from the Aronia melanocarpa extracts through different extraction process.Mean values ± SD from triplicate separated experiments are shown. Mean with difference letter within same sample are significantly different at p < 0.05 (A-D; a-b). 1)EE: 70% Ethanol Extract. 2)FEE: 70% Ethanol Extract by fermentation process. *Concentration of cyanidin-3-galactoside: 0.02㎎/㎖.
5. Cytokine 생성 확인
PGE2의 생성량을 확인한데 이어, PGE2가 촉진하는 사이토카 인 중 IL-6 (Interleukin-6)의 생성량을 Fig. 5에 나타내었다. IL-6의 생성량은 발효 전보다 발효 후에 IL-6의 생성량이 저 감되는 것을 확인할 수 있었으며 발효한 70% 에탄올 추출물 에서 가장 낮은 IL-6의 생성량을 확인 할 수 있었다. 단일물 질인 cya-gal은 에탄올 추출물보다는 다소 높은 생성량을 나 타내었다. 아로니아 시료는 에탄올 추출물을 이용하여 발효를 실시하였을 때, 발효 70% 에탄올 추출물은 3.5 pg/㎖의 생성 량을 보여 아로니아를 발효 함으로서 IL-6생성량이 저감되어 항염증에 대한 효과를 향상시킬 수 있는 것을 확인하였다. TNF-α 생성량 역시 확인하여 Table 2에 나타내었다. 역시 IL-6와 마찬가지로 에탄올 추출물을 발효하여 TNF-α의 생성 저해 정도를 확인하였을 때, 발효 70% 에탄올 추출물이 865.5 pg/㎖의 생성량을 보여 일반 에탄올 추출물보다 낮은 생 성량이 확인되었으며, 이를 통해 발효공정을 실시함으로서 염 증을 억제하는 효능이 증진 된 것을 확인 하였다. 두 사이토 카인에 대하여 에탄올 추출물의 사이토카인 억제활성이 뛰어 났으며, 더 좋은 효능을 보인 에탄올 추출물을 이용하여 유산 균 발효를 실시하였을 때, 그 효과가 더욱 증진된 것을 확인 하였다.
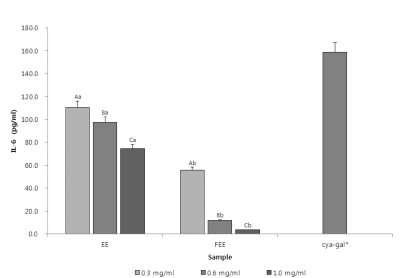
Comparison of IL-6 production from Jurkat T cell by adding the Aronia melanocarpa extracts through different extraction process.Mean values ± SD from triplicate separated experiments are shown. Mean with difference letter within same sample are significantly different at p < 0.05 (A-C; a-b). 1)EE: 70% Ethanol Extract. 2)FEE: 70% Ethanol Extract by fermentation process. *Concentration of cyanidin-3-galactoside: 0.02㎎/㎖.
6. HPLC 측정을 통한 안토시아닌 함량 비교
상기와 같은 활성 실험 결과에서 유산균 발효를 통한 아로 니아 추출물의 효능이 왜 좋은가에 대한 설명 및 입증하기 위 하여 아로니아의 지표물질 함량에 대한 일반 추출법과 발효 추출의 상관관계를 알아보고자 하였다. 아로니아 시료와 아로 니아에 함유 되어있다고 알려진 cya-gal을 standard로 하여 HPLC 분석을 하고 (Marie et al., 2013), 그에 대한 결과를 Fig. 6와 Table 1에 나타내었다. 그 결과 일반적인 추출법 중 아로니아 열수 추출물에 비해 70% 에탄올 추출물의 cya-gal 의 함량이 14배 높게 나온 것을 확인할 수 있었다. 이와 같은 결과는 안토시아닌의 열에 대한 변성 및 파괴에 대한 선행 연 구를 참고하여 (Choung et al., 2008; Oren-shamir and Levi-nissim, 1997), 보다 높은 온도에서 추출한 열수추출물의 경우 안토시아닌의 한 종류인 standard 물질의 파괴 및 변성 으로 인하여 수용성인 안토시아닌이라 하더라도 그 함량이 매 우 미미하게 관찰 된 것으로 확인되며, 70% 에탄올 추출물은 물과 에탄올이 같이 있을뿐더러 열수 추출물보다 저온에서 추 출하기 때문에 상대적으로 안토시아닌의 파괴 및 변성이 덜 일어났기 때문에 안토시아닌의 손실이 적어 standard의 함량 이 더 높은 것으로 사료된다. 열수 추출물보다는 에탄올 추출 물의 안토시아닌 함량이 더 많아 유산균을 통한 발효를 에탄 올 추출물로 실시함으로서 발효 추출물에 대한 안토시아닌의 함량을 확인하였다. Fig. 6의 (D)와 Table 1에서 타겟물질로 한 지표물질인 발효 에탄올 추출물의 안토시아닌 cya-gal의 함 량이 증가하는 것을 확인하였고, 그 외에 물질에 대한 피크를 살펴보면 일반 에탄올 추출물과 비교하였을 때 그 크기가 감 소하는 피크를 확인하였다. 이와 반대로 지표물질 안토시아닌 과 마찬가지로 증가하는 피크 또한 확인하였으며 16분 직 후 에서는 에탄올 추출물에서 볼 수 없었던 피크 또한 새롭게 나 타난 것을 확인할 수 있었다. Table 1에서 지표물질인 cya-gal 의 함량을 비교하면 발효한 에탄올 추출물은 기존의 에탄올 추출물보다 많은 4.58㎎/g의 함량이 관찰되었다. 발효를 통한 안토시아닌 함량의 증가에 관한 타 논문인 흑미에 관한 논문 을 보면, 발효 시에 안토시아닌의 함량이 증가한 것을 확인할 수 있다 (Kim et al., 2012). 또한, 안토시아닌의 함량 증가는 유산균 발효를 실시함으로서 낮아진 pH가 안토시아닌의 안정 성에 영향을 준 것으로 사료된다 (Hwang and Ki, 2013). 이 를 토대로 확인하였을 때 상기의 HPLC 결과에 대하여 발효 를 통하여 cya-gal의 함량이 증가하였으며, 증가 된 안토시아 닌의 함량은 앞서 진행한 항염증의 효능 결과에 영향을 미쳤 을 것으로 사료된다.
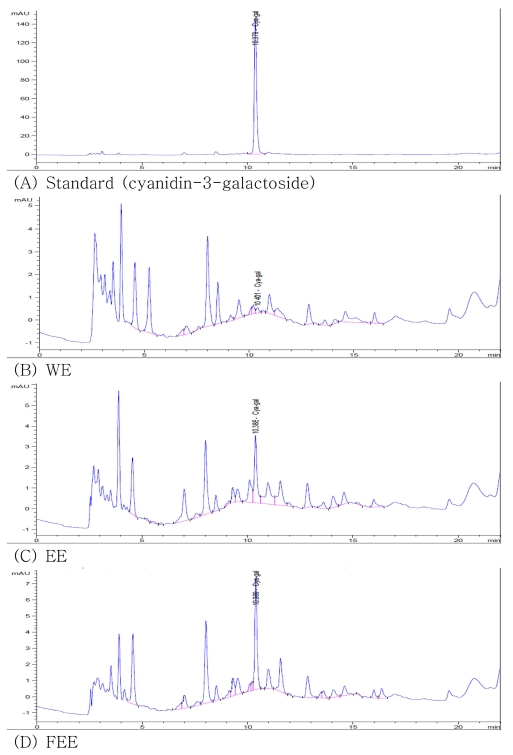
Comparison of HPLC chromatograms from Aronia melanocarpa extracts.1)WE: Water Extract.2)EE: 70% Ethanol Extract.3)FEE: 70% Ethanol Extract after lactic acid fermentation.

Comaprison of anthocyanin contents from the extracts of Aronia melanocarpa obtained by different extraction processes.
아로니아 추출물을 이용한 각 활성실험에서 발효 에탄올 추 출물의 항염증에 대한 활성이 두드러지게 나타난 것을 확인할 수 있었다. 실험결과에서 cya-gal만으로도 항염증에 대한 효능 을 확인하여 HPLC의 측정결과와 활성실험결과를 비교하면 추 출별 아로니아 시료의 cya-gal의 함량이 증가할 수록 항염증 에 대한 효능이 증진됨을 확인하였다. 아로니아를 발효함으로 서 항염증 효능이 증가하였으나, 사용한 유산균 lactobacillus rhamnosus 자체의 항염증에 대한 효과가 있어 (Lin et al., 2009; Donato et al., 2010), 이것에 대한 연구가 더욱 필요할 것을 보인다. 아로니아에 함유 된 안토시아닌 cya-gal을 기준 물질로 하여 추출법별 안토시아닌 함량을 측정하였을 때, 열 수 보다 에탄올 추출물의 함량이 높게 측정되었다. 이는 열에 따른 안토시아닌의 변성 및 파괴 그리고 함량에 대한 선행연 구를 확인하였을 때 열수 추출물의 고온으로 인한 안토시아닌 의 변성 및 파괴로 확인되며 (Choung et al., 2008; Orenshamir and Levi-nissim, 1997), 이에 더해 발효 에탄올 추출물 의 안토시아닌 함량 증진을 확인하였다. HPLC chromatogram 에서 일부 피크에서 마찬가지로 일반 에탄올 추출물보다 발효 에탄올 추출물에서 증가하는 피크를 볼 수 있었으나 반대로 감소하는 피크의 물질 또한 존재함을 확인하였다. 발효를 실 시함으로서 안토시아닌의 함량 증가를 도모할 수 있으며, 항 염증 효능이 증진됨을 확인하였다. 상기와 같은 결과를 통하 여 발효한 아로니아 추출물은 염증에 대한 억제 기능이 증진 됨을 확인하여 아토피, 여드름 등 염증관련 피부민감성 질환 에 대한 제품의 소재로서 각광 받아 향장산업에 크게 기여할 수 있을 것으로 보인다.
감사의 글
이 논문은 충청북도 단양군청의 지원에 의하여 수행 된 연 구결과로 이에 감사드립니다.
REFERENCES
- Choi, WS, Kwon, HS, No, RH, Choi, GP, Lee, HY, Enhancement of anti-inflammatory activities of fermentedScutellaria baicalensisextracts using aLactobacillus rhamnosus, Journal of the Society of Cosmetic Scientists of Korea, (2013), 39, p303-311.
-
Choi, YJ, Jo, WS, Kim, HJ, Nam, BH, Kang, EY, Oh, SJ, Lee, GA, Jeong, MH, Anti-inflammatory effect ofChlorella ellipsoideaextracted from seawater by organic solvents, Korean Journal of Fisheries and Aquatic Sciences, (2010), 43, p39-45.
[https://doi.org/10.5657/kfas.2010.43.1.039]

- Choung, MG, Hwang, YS, Lee, HJ, Choi, SSN, Lim, JD, Kang, ST, Han, WY, Baek, IY, Kim, HK, Optimal extraction condition of anthocyanins in soybean(Glycine max) with black seed coats, Korean Journal of Crop Science, (2008), 53, p110-117.
- Donato, KA, Gareau, MG, Wang, YJJ, Sherman, PM, Lactobacillus rhamnosusGG attenuates interferon-c and tumour necrosis factor-a-induced barrier dysfunction and proinflammatory signalling, Microbiology, (2010), 156, p3288-3297.
-
Hwang, ES, Ki, KN, Stability of the Anthocyanin Pigment Extracted from Aronia(Aronia melancocarpa), Korean Journal of Food Science and Technology, (2013), 45, p416-421.
[https://doi.org/10.9721/kjfst.2013.45.4.416]

-
Jakobek, L, Drenjan evi, M, Juki, V, eruga, M, Phenolic acids, flavonols, anthocyanins and antiradical activity of “Nero”, “Viking”, “Galicianka” and wild chokeberries, Scientia Horticulturae, (2012), 147, p56-63.
[https://doi.org/10.1016/j.scienta.2012.09.006]

- Jan, O, Jean, CS, Anthocyanins in fruits ofAronia melanocarpa(chokeberry), Journal of Food Science, (1988), 53, p1241-1242.
- Jan, O, Aneta, W, Aronia melanocarpaphenolics and their antioxidant activity, European Food Research and Technology, (2005), 221, p809-813.
- Kim, HS, Ham, JS, Antioxidative ability of lactic acid bacteria, Korean Journal for Food Science of Animal Resources, (2003), 23, p186-193.
-
Kim, JS, Choi, WS, Chung, JY, Chung, HC, Lee, HY, Enhancement of cosmeceutical activity fromCodonopsis lanceolataextracts by stepwise steaming process, Korean Journal of Medicinal Crop Science, (2013), 21, p204-212.
[https://doi.org/10.7783/kjmcs.2013.21.3.204]

-
Kim, OS, Park, SS, Sung, JM, Antioxidant activity and fermentation characteristics of traditional black rice wine, Journal of the Korean Society of Food Science and Nutrition, (2012), 41, p1693-1700.
[https://doi.org/10.3746/jkfn.2012.41.12.1693]

- Kong, BM, Park, JW, Min, HB, Kim, SH, Kim, SY, Yang, DC, Physico-chemical characteristics of white, fermented and red ginseng extracts, Journal of Ginseng Research, (2008), 23, p238-243.
-
Lin, PW, Myers, LES, Ray, L, Song, SC, Nasr, TR, Berardinelli, AJ, Kundu, K, Murthy, N, Hansen, JM, Neish, AS, Lactobacillus rhamnosusblocks inflammatory signaling in vivo via reactive oxygen species generation, Free Radical Biology & Medicine, (2009), 47, p1205-1211.
[https://doi.org/10.1016/j.freeradbiomed.2009.07.033]

- Marie, B, Rune, S, Helle, W, Cato, B, Karl, EM, Hilde, B, Extracts, anthocyanins and procyanidins fromAronia melanocarpaas radical scavengers and enzyme inhibitors, Nutrients, (2013), 5, p663-678.
- Medaniel, ML, Kwon, G, Hill, Jr, Marshall, CA, Corbett, JA, Cytokines and nitric oxide inislet inflammation and diabetes, Proceeding of the Society for Experimental Biology and Medicine, (1996), 211, p24-32.
-
Oren-shamir, M, Levi-nissim, A, Temperature effects on the leaf pigmentation ofCotinus coggygria‘Royal Purple’, The Journal of Horticultural Science and Biotechnology, (1997), 72, p425-432.
[https://doi.org/10.1080/14620316.1997.11515530]

- Oyaizu, M, Studies on products of browning reaction prepared from glucoseamine, Japanese Journal of Nutrition, (1986), 44, p307-314.
- Park, SJ, Choi, YB, Ko, Jr, Kim, YE, Lee, HY, Enhancement of antioxidant activities of blueberry(Vaccinium ashei) by using high-pressure extraction process, Journal of the Korean Society of Food Science and Nutrition, (2014).
-
Seo, YC, No, RH, Kwon, HS, Lee, HY, Immune activity ofLithospermum erythrorhizonextracted by extreme low temperature extraction process, Korean Journal of Medicinal Crop Science, (2013), 21, p105-111.
[https://doi.org/10.7783/kjmcs.2013.21.2.105]

-
Takizawa, S, Free radical production in ischemic cerebrovascular disease, Nitiroisi, (2003), 40, p319-321.
[https://doi.org/10.3143/geriatrics.40.319]
