
우슬과 인삼 열수추출 혼합물의 파골세포와 조골세포 분화 효과
© The Korean Society of Medicinal Crop Science All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Osteoporosis induces a bone mineral density loss due to imbalance of bone homeostasis that is achieved by osteoclasts (which are involved in bone resorption) and osteoblasts (which are involved in bone formation). Thus, this study was performed to evaluate the effects of hot water extract of the Achyranthes bidentata Blume (ABB) and Panax ginseng (Gin) on osteoclast and osteoblast differentiation. In this study, there was no cytotoxicity by ABB, 50 and 100 μg/ml of Gin significantly decreased cell viability of RANKL-induced osteoclast in RAW264.7 cell (p < 0.01). But, it was 50 μg/ml of ABB and Gin mixtures increased due to protective action of ABB. Furthermore, Gin contained groups (Gin, ABB and Gin mixtures) were inhibitory effects on osteoclast differentiation and bone resorption, and increased in osteoblast differentiation activity. Gin clearly inhibited RANKL-induced osteoclast differentiation by decreased calcitonin and TRAP (p< 0.01). Also, these extracts significantly increased calcium accumulation formation of osteoblastic differentiation reagents-induced osteoblast in MC3T3-E1 cell (p < 0.05). These results suggest that ABB and Gin mixtures may be a potential as drug for the treatment of osteoporosis.
Keywords:
Achyranthes bidentata Blume, Panax ginseng, Osteoporosis, Osteoclast, Osteoblast, Differentiation서 언
노화, 호르몬 이상 (에스트로겐 감소), 대사성 질환 및 골 전이성 암 등과 같은 유전적생리적환경적 인자의 변화로 발병 되는 골다공증 (osteoporosis)은 골 형성에 관여하는 조골세포 (osteoblast) 감소 혹은 파골세포 (osteoclast)에 의한 골 흡수 증가로 인하여 골질량 감소를 유발한다 (Grigoriades et al., 1994). 이에 반하여 조골세포의 상대적인 증가는 골수강 확장 장애가 유발되어 미흡한 골수 생성에 의해 조혈작용이 감소되 는 골화석증 (osteoptrosis)을 초래하게 된다 (Del et al., 2008). 그러므로 정상적인 골조직 구조를 유지하기 위해서는 이들 골 세포 간 상호 균형에 따른 골 재형성 및 항상성 유 지가 매우 중요하다.
전구세포인 단핵/대식세포 (monocyte/macrophage)로부터 다 핵형세포로 분화되는 파골세포는 조혈모세포 (hematopoietic precursor)에서 유래하며 (Boyle et al., 2003), macrophage colony-stimulating factor (M-CSF)와 receptor activator of nuclear factor-kB ligand (RANKL) 등의 사이토카인에 의하 여 분화유도 된다. 무엇보다도 RANKL이 파골세포의 생존, 분화, 다핵화 및 활성화 등에 중추적 역할을 하는 것으로알려 졌다 (Darnay et al., 1999). 조골세포는 전구세포인 중간엽줄 기세포 (mesenchymal stem cell)로부터 기원한다. 골 형성과 재형성 과정 동안 조골세포로의 성장 및 분화유도는 골형성단 백질 (bone morphogenetic protein, BMP)에서부터 시작되어 조골세포 특이 전사인자인 Runx2 (Lee, 2009)가 osteocalcin, osteopontin, bone sialoprotein 그리고 alkaline phosphatase 등과 같은 분화 인자를 조절하여 이루어진다 (Komori, 2006). 이러한 파골세포와 조골세포의 성장과 분화 조절인자 정보는 골 질환 치료 및 예방을 위한 신약후보 물질의 주요 목표 인 자로 적용될 것이다.
현대 고령화 사회에서 골질환 환자, 특히 골다공증에 대한 사회적, 의학적 관심이 골다공증 예방 및 치료를 위한 연구로 활발하게 이어지고 있다. Yoon 등 (2014)은 골다공증의 선택 적 치료 방법 중 하나로 파골세포 분화를 억제시키는 것이라 하였다. 에스트로겐, 칼시토닌 그리고 비스포스포네이트 계열 등의 약물이 파골세포의 기능 저하를 통한 골 흡수 억제제로 널이 이용되어져 오고 있지만 (Pole et al., 1999), 이들 치료 법들은 낮은 골밀도 증가 효과, 체중증가, 위장관계 손상, 자 궁내막암과 유방암 발병, 저칼륨혈증, 심방세동 및 하악골 괴 사 등 일부 부작용이 보고되고 있다 (Kannel and Drake, 2009; Aldercreutz and Mazur, 1996). 근래에는 이러한 부작 용을 최소하기 위하여 독성이 적고, 일상생활에서 식용으로 섭 취 가능한 식품과 약용 식물 등 천연물 소재를 이용하여 골 손실의 최소화와 더불어 골 형성을 촉진시킬 수 있는 골다공 증 예방 또는 치료 물질 개발에 대한 응용 연구가 다양하게 이루어지고 있다.
많은 연구자들에 의하여 두충, 노각나무, 삼백초, 작약 등이 RANKL로 유도된 파골세포 분화를 억제시켜 골 흡수가 저하 된다고 하였다 (Kwak et al., 2008; Tsai et al., 2008). 또한, 우슬 (Achyranthes bidentata Blume, ABB)은 비름과에 속한 다년생 초본의 뿌리로 triterpenoid saponin과 가수분해물인 oleanolic acid 등의 성분과 linoleic acid, serin, flavonoid 및 다량의 칼슘염이 함유되어 있어 진통, 항염, 항산화, 항암 및 골형성 촉진효과가 있다고 하였다 (Chen and Tian, 2003; Li et al., 2007; Kim et al., 2008). 더욱이 오갈피나무과의 인삼 속에 속하는 고려인삼 (Panax ginseng C. A. Meyer, P. ginseng, Gin)은 면역기능 강화, 항암, 성기능강화 등을 비롯한 골다공증 예방 효과에 이르기까지 다양한 분야에서 연구되고 있지만, 이들 대부분은 사포닌 계의 진세노사이드 (ginsenoside) 를 중심으로 이루어지고 있다 (Choi et al., 2014). 특히 진세 노사이드 Rh2가 파골세포 분화를 억제하는 것으로 보고되었으 나 (He et al., 2012), 인삼 열수추출물의 파골세포 분화 억제 효과에 대한 연구는 극히 미흡한 실정이다.
따라서 본 연구는 RANKL에 유도된 파골세포의 분화 억제 에 대한 우슬과 인삼 열수추출물의 효과를 밝히고자 시행하였 다. 또한, 우슬과 인삼 혼합물 처리가 골다공증 골 대사 질환 에 관여하고 있는 파골세포와 조골세포의 분화 효과를 규명하 여 골 질환 개선제로써의 가능성을 제시하고자 한다.
재료 및 방법
1. 실험재료
우슬과 인삼은 시중에 유통되고 있는 원료를 이용하였다. 세 척된 우슬은 일정 간격으로 절단 후 물 3 L에 시료 100 g의 비율로 가하여 20분씩 100°C에서 3회 추출하였다. 또한, 뇌 두가 제거된 인삼 역시 일정 간격으로 절단하여 물 1 L에 시 료 100 g의 비율로 가하여 6시간씩 85°C에서 3회 반복 추출 하고, 실온에서 냉각 • 여과한 후 추출액을 회전 감압농축기 (Rotavapor RII, Buchi, Switzerland)로 농축하였다. 획득된 추출물을 동결건조 (Martin Christ, Osterode. Germany)하여 분말의 형태로 –20°C에서 보관하였다. 최종 수율 (yield)은 우슬 24.8%, 인삼 33.3%이었다. 이를 실험 직전 DPBS (Dulbecco’s phosphate buffered saline, Daegu, Korea)에 용해하여 사용하였다.
Dulbecco’s modified Eagle’s medium (DMEM; Bremen, Germany)과 alpha-modified minimum essential medium (α- MEM), fetal bovine serum (FBS) 및 penicillin-streptomycin 등은 Gibco BRL (Gaithersburg, MD, USA)사, 파골세포 분화 제 RANKL은 PeproTech EC (London, England)사, 조골세포 분화제로 2-glycerophosphate, ascorbic acid, dexamethasone 등 은 Sigma-Aldrich (St. Louis, MO, USA)사의 제품을 사용하 였다. MTT 용액 [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide]과 dimethyl sulfoxide (DMSO), TRAP 활성 분석을 위한 TRAP 염색 kit 및 TRAP 용액 (sodium tartrate, p-nitrophenyl phosphate), 그리고 석회화 결절 측정 을 위한 AR-S 용액 (alizarin red-sulfate, cetylpyridinium chloride, sodium phosphate)등 모든 시약은 SigmaAldrich 사를 이용하였다. RT-PCR 분석을 위하여 TRIzol (Invitrogen, Carlsbad, CA, USA), iScript cDNA synthesis kit (Bio-Rad, Hercules, CA, USA), Emerald Taq (Takara, Japan) 등을 구 입하였다.
2. 세포배양
파골세포 분화 유도를 위한 마우스 대식 세포주 RAW264.7 세포와 마우스 두개관에서 유래한 전조골세포주인 MC3T3-E1 세포는 American Type Culture Collection (ATCC; Rockville, MD, USA)로부터 구입하였다. RAW264.7 세포는 10% FBS와 1% penicillin-streptomycin (100 U/ml, 100μg/ml)이 포함된 DMEM 배지 (Jung et al., 2014), MC3T3-E1 세포는 α- MEM 배지에 10% FBS와 1% penicillin-streptomycin을 첨가 하여 5% CO2, 37°C incubator에서 계대 배양하였다.
3. 세포 생존율
각 추출물의 RAW264.7 세포에 대한 생존 및 간접적 독성 평가를 위하여 MTT assay를 시행하였다. 96-well plate에 1 × 104 cells/well 농도로 분주하여 DMEM에 10% FBS와 1% penicillin-streptomycin 조건으로 24시간 동안 안정화 시켰다. 파골세포 분화 유도를 위하여 10% FBS와 1% penicillinstreptomycin이 첨가된 α-MEM에 RANKL (100 ng/ml)을 첨 가한 뒤 우슬과 인삼 열수추출물은 각각 0, 10, 25, 50, 100μg/ml 농도, 우슬과 인삼 혼합물은 동량의 농도 비율이 되 도록 혼합하여 처리하였다. 3일 후 MTT 용액(2mg) 첨가하여 5% CO2, 37°C incubator에서 2시간 동안 반응시킨 뒤 생성된 formazan crystals을 DMSO로 용해하였다. ELISA reader (BIO-RAD 450, Hercules, CA, USA)를 이용하여 540nm에 서 흡광도를 확인하였다.
96-well plate (8 × 103 cells/well)에 10% FBS와 1% penicillinstreptomycin이 첨가된 α-MEM 배지에 분주하여 24시간 동안 세포를 안정시켰다. 동일한 배지에 조골세포 분화제 (osteoblastic differentiation reagents; OS, 1M 2-glycerophosphate, 50mM ascorbic acid, and 10mM dexamethasone)를 첨가하였고, 인삼 과 우슬 그리고 혼합물의 시료를 0, 25, 50μg/ml 농도로 각각 처리한 뒤 5% CO2, 37°C incubator에서 24시간 배양 후 생 존율을 측정하기 위해 MTT assay를 시행하였다.
4. TRAP 염색
RAW264.7 세포로부터 유도 분화된 파골세포에서 TRAP (tartate resistant acid phosphate) 염색을 통하여 성숙 파골세 포 형태를 관찰하였다. 분화제와 시료처리 3일된 세포는 PBS 로 수세 후 10% formalin으로 5분간 고정하고, DW로 다시 수세하였다. 시그마 TRAP 염색 (kit no. 387; Sigma- Aldrich, St. Louis, MO, USA) 사용 설명에 따라 신선한 TRAP 용액으로 30분간 처리하였다. 염색된 세포는 광학현미 경 (CKX41, Olympus, Tokyo, Japan)으로 관찰하고, 디지털 영상카메라 (DIXI 3000, Olympus, Tokyo, Japan)로 이미지 를 영상화하여 둥근 모양 형태의 파골세포 (round-shaped osteoclast, ROC) 수를 측정하였다.
5. TRAP 활성도 분석
파골세포 특이 지표 TRAP 효소의 활성을 측정하기 위하여 TRAP solution assay를 Tintut 등 (2002)의 방법으로 수행하였 다. 분화제와 시료처리 3일된 세포를 PBS로 수세 후 cold lysis buffer (90mM citrate, pH 4.8, 0.1% Triton X-100 containing 80mM sodium tartrate)를 80μl씩 분주하여 10분간 처리하고, substrate solution (20mM p-nitrophenyl phosphate) 을 80μl씩 첨가하여 5% CO2, 37°C incubator에서 20분간 반 응시켰다. 40μl의 0.5 N NaOH로 반응을 중지시킨 다음, ELISA reader (BIO-RAD 450, Hercules, CA, USA)를 이용 하여 405nm에서 흡광도를 확인하였다.
6. 역전사 중합효소 연쇄반응 (RT-PCR) 분석
파골세포의 calcitonin receptor (Cal-R)와 TRAP의 발현을 관찰하기 위하여 TRIzol을 사용하여 total RNA를 추출하고, iScript cDNA synthesis kit으로 cDNA를 합성 하였다. 중 합효소 연쇄반응 (polymerase chain reaction, PCR)은 Emerald Taq을 이용하여 초기 번성 과정을 95°C에서 10분간 시행한 후, 95°C 1분, 51 ~ 58°C에서 30초, 72°C에서 1분으로 총 25 ~ 32 주기를 시행한 후, 최종 증폭 과정을 72°C에서 10분 간 시행하였다. PCR primer 순서는 Table 1에 나타낸 바와 같다. 반응 끝난 시료는 2% agarose gel에서 전기영동하고 Et-Br로 염색하여 UV상에서 관찰 및 densitometric analysis를 이용하여 수치화하였다.
. 석회화 결절 형성 측정
조골세포로부터 석회화 결절 형성은 alizarin red-sulfate (AR-S)를 이용하여 측정하였다. 24-well plate (2 × 104 cells/ well)에 10% FBS와 1% penicillin-streptomycin이 첨가된 α- MEM 배지에 분주하여 24시간 동안 세포를 안정시켰다. 조골 세포 유도 분화제와 우슬, 인삼 및 혼합물의 시료를 0, 25, 50μg/ml의 농도로 처리한 후 21일 동안 배양하였다. ice-cold 4% paraformaldehyde로 4°C에서 30분간 세포를 고정하고, 40 mM AR-S staining 용액으로 실온에서 10분 동안 염색하 였다. DW로 수세하고 난 뒤 10% (w/v) cetylpyridinium chloride / 10 mM sodium phosphate (pH 7.0)로 15분간 반 응시켜 염색제를 용해한 후 용액을 ELISA reader (BIO-RAD 450, Hercules, CA, USA)를 이용하여 540nm에서 흡광도를 확인하였다.
. 통계분석
모든 실험군은 3개 이상 수행하였으며 정량적 결과는 대조 군에 대한 백분율로 평균 ±표준편차로 나타냈다. 모든 실험은 3번 이상 반복하여 동일한 실험결과로 사용하였고, two-tailed Student’s t-test로 통계적 유의성을 분석하여 p < 0.05 이하를 통계적으로 유의한 것으로 간주하였다.
결과 및 고찰
1. 우슬과 인삼의 파골세포 생존율
마우스 대식 세포주 RAW264.7 세포를 이용하여 RANKL 에 의해 유도된 파골세포에 대한 각 추출물의 10, 25, 50, 100μg/ml 농도에 따른 세포 생존율을 측정하였다. 우슬 열수 추출물은 모든 농도에서 대조군과 유사한 생존율을 보였다. 그 러나 100μg/ml 농도에서는 다소 낮은 생존율을 나타냈지만 통계적 유의성은 없었다. 인삼 열수추출물의 경우 50, 100μg/ml 농도에서 대조군과 비교하여 각각 85.56%, 79.03% 로 현저하게 낮은 생존율을 보였다 (Fig. 1). Jung 등 (2000) 은 인삼과 홍삼의 동체보다 뇌두 부분에서 높은 세포독성을 보이며 백삼의 동체 분획물을 RAW264.7 세포에 처리한 결과 100μg/ml 농도에서 약 60%의 세포치사 활성을 나타낸다고 보고하였다. 이는 인삼의 지용성 분획 중 항암물질로 알려진 panaxydol, panaxinol, panaxitiol 및 acetyl panaxydol 등과 같은 diacetylene 유도체 (Kim et al., 1989)에 의한 세포독성 의 가능성을 배제할 수 없다.
그러나 Fig. 1에서와 같이 우슬과 인삼 추출물을 동량의 비 율로 혼합 처리한 경우 100μg/ml 농도에서 87.06%의 생존율 로 통계적 유의한 세포 독성을 보였으나 인삼 단독 처리군보 다 세포 생존율이 높았고, 더욱이 세포 생존율이 현저하게 감 소된 인삼 단독 처리군의 50μg/ml 농도 보다 우슬과 인삼의 동량 혼합물 50μg/ml 농도에서는 높은 생존율(95.76%)을 나 타내고 있다. 우슬은 lipopolysaccharide (LPS) 유도로 증가되 는 염증성 사이토카인과 매개물질의 억제 (kim et al., 2010), 혈류개선으로 인한 항노화 효과 (Han et al., 2005), 그리고 cadmium chloride와 같은 산화제에 의해 감소된 배양 골모세 포에서 우슬 추출물 처리가 세포독성으로부터 방어하여 세포 생존율 증가시켰다고 하였다 (Choi et al., 2012). 본 연구에 서 세포 독성을 보이는 고농도 인삼 추출물 처리군에서의 감 소되었던 세포 생존율이 우슬 추출물의 항염과 항산화작용에 의한 세포 보호 작용에 기인하여 세포 생존율이 증가된 것으 로 사료된다.
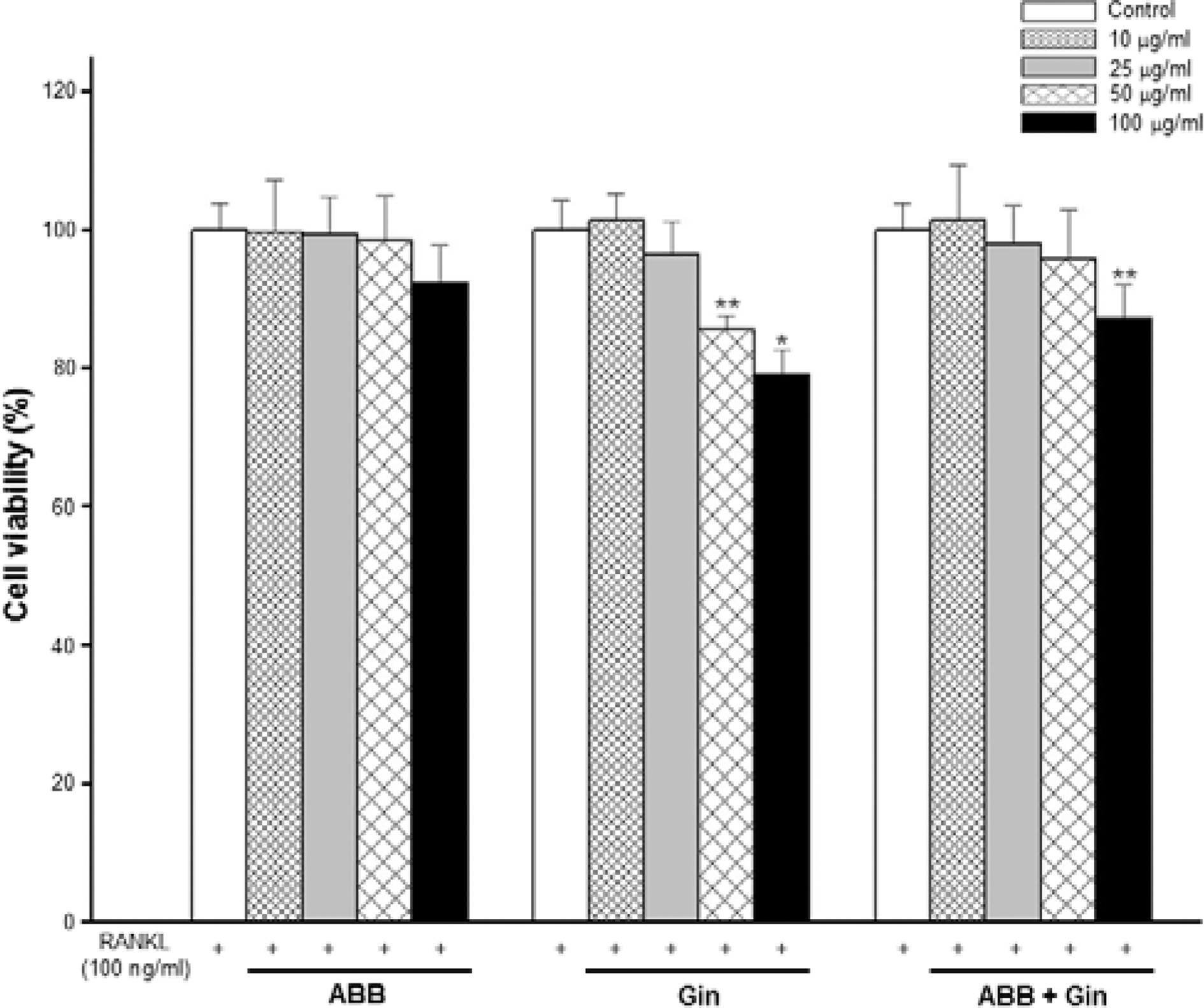
Cytotoxicity and proliferation profile were evaluated using the MTT assay after 3 days of culture. RAW264.7 cells were induced osteoclast by RANKL. 50μg/ml and 100mg/ml concentration of Gin group was inhibited the growth of osteoclasts with the cell survival approximately 80%. But, 50μg/ml concentration of ABB + Gin group did not inhibit the growth of the cells. Each column represents mean ± SD (*p < 0.05, **p < 0.01) vs Control. Control; only RANKL treatment, ABB; Achyranthes bidentata Blume, Gin; Panax ginseng, ABB + Gin; Achyranthes bidentata and Panax ginseng mixture.
2. 우슬과 인삼의 TRAP 양성 파골세포 분화 억제
TARP 효소는 ATP와 nitrophenyl phosphate가 존재할 때 높은 활성을 가지고, 골 흡수작용 시 분비가 증가되기 때문에 그 활성도 측정하여 파골세포 분화 정도를 확인하는데 이용되 어지고 있다 (Mok and Shin, 1996). RAW264.7 세포에 RANKL을 첨가하고, 우슬과 인삼 열수추출물에 의한 세포 치 사 활성이 보이지 않는 25와 50μg/ml 농도에서 3일간 배양한 후 TRAP 염색과 TRAP assay를 통하여 성숙 파골세포의 분 화 형태와 세포막의 특이 효소인 TARAP 효소 활성을 확인하 였다. RANKL만 처리한 대조군에서 둥근 모양 형태 파골세포 (ROC) 즉, 세포가 융합되면서 형성된 다핵의 성숙 파골세포가 골 표면에 부착하여 골 흡수 작용 (Karst et al., 2004)을 하 는 TRAP 양성 다핵형 파골세포가 뚜렷하게 관찰되었다. 우슬 추출물 25와 50μg/ml 농도 처리군에서 대조군과 유사한 파골 세포 분화 형태를 보이는 반면, 인삼 추출물이 포함된 실험군 (인삼 단독 처리군과 우슬과 인삼 혼합 처리군)의 모든 농도에 서 대조군에 비해 현저하게 감소된 ROC와 융합되지 않은 단 핵의 전파골세포와 불규칙 모양 형태 파골세포(irregular shaped osteoclast, IOC)가 풍부하게 관찰되었다 (Fig. 2). 이 상의 결과는 RANKL에 의해 유도되는 파골세포 분화과정 중 에 우슬은 영향을 미치지 못하였으나 인삼이 파골세포 분화 억제에 직접적으로 관여한다는 것을 의미한다.
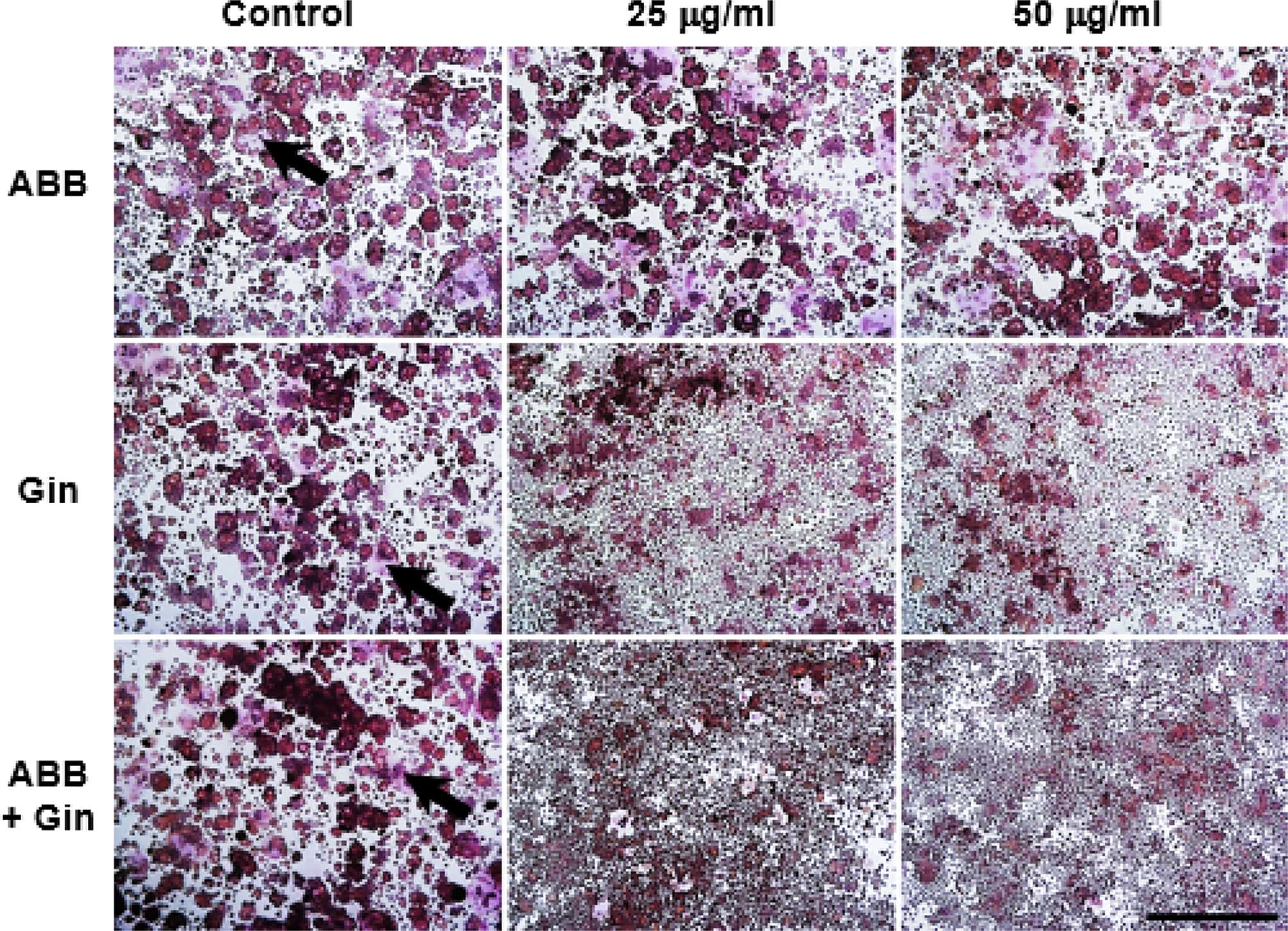
Round-shaped osteoclast (ROC) formation derived from RAW264.7 cell under different concentration of ABB and Gin. TRAP staining was performed after 3 days of culture, representing TRAP + multinucleated cells. Arrow indicates that ROC formation is obvious, and rarely was formed in the Gin contained groups. Scale bar = 500 μm. Control; only RANKL treatment, ABB; Achyranthes bidentata Blume, Gin; Panax ginseng, ABB + Gin; Achyranthes bidentata and Panax ginseng mixture.
Fig. 3에서와 같이 우슬 추출물의 TRAP 활성도는 농도와 관계없이 대조군과 유의한 차이가 없었지만 인삼 추출물 25와 50 μg/ml의 모든 농도에서 각각 43.51%와 55.19%의 현저 한 감소율을 나타냈다. 우슬과 인삼 혼합물 역시 25μg/ml (42.03%)와 50μg/ml (54.40%) 농도에서 뚜렷하게 감소되었 다. TRAP 활성과 마찬가지로 ROC 수 역시 인삼을 포함한 모든 군의 25와 50μg/ml 농도에서 농도 의존적으로 유의하게 감소되었다. Kim 등 (2010)은 마우스로부터 채취한 대식세포 (bone marrow macrophages, BMM)에 우슬 열수추출 20μg/ml 농도로 처리하여 세포독성 없이 현저하게 억제된 파골세포 분 화에 따른 골 흡수 억제 효과를 확인하였다. 본 연구에서는 우슬 열수추출물 모든 농도에서 파골세포 분화 억제가 나타나 지 않았다. 이는 다른 파골전구세포 (대식세포주, RAW264.7 세포)의 이용과 처리된 농도가 높았기 때문인 것으로 판단 된다. 그러므로 골수세포 (bone marrow cell, BMC), BMM 및 RAW264.7 세포와 같은 다양한 파골전구세포에서 낮은 농 도 처리에 의한 파골세포 분화 효과 규명을 위한 연구가 추가 적으로 이루어져야할 것이다.
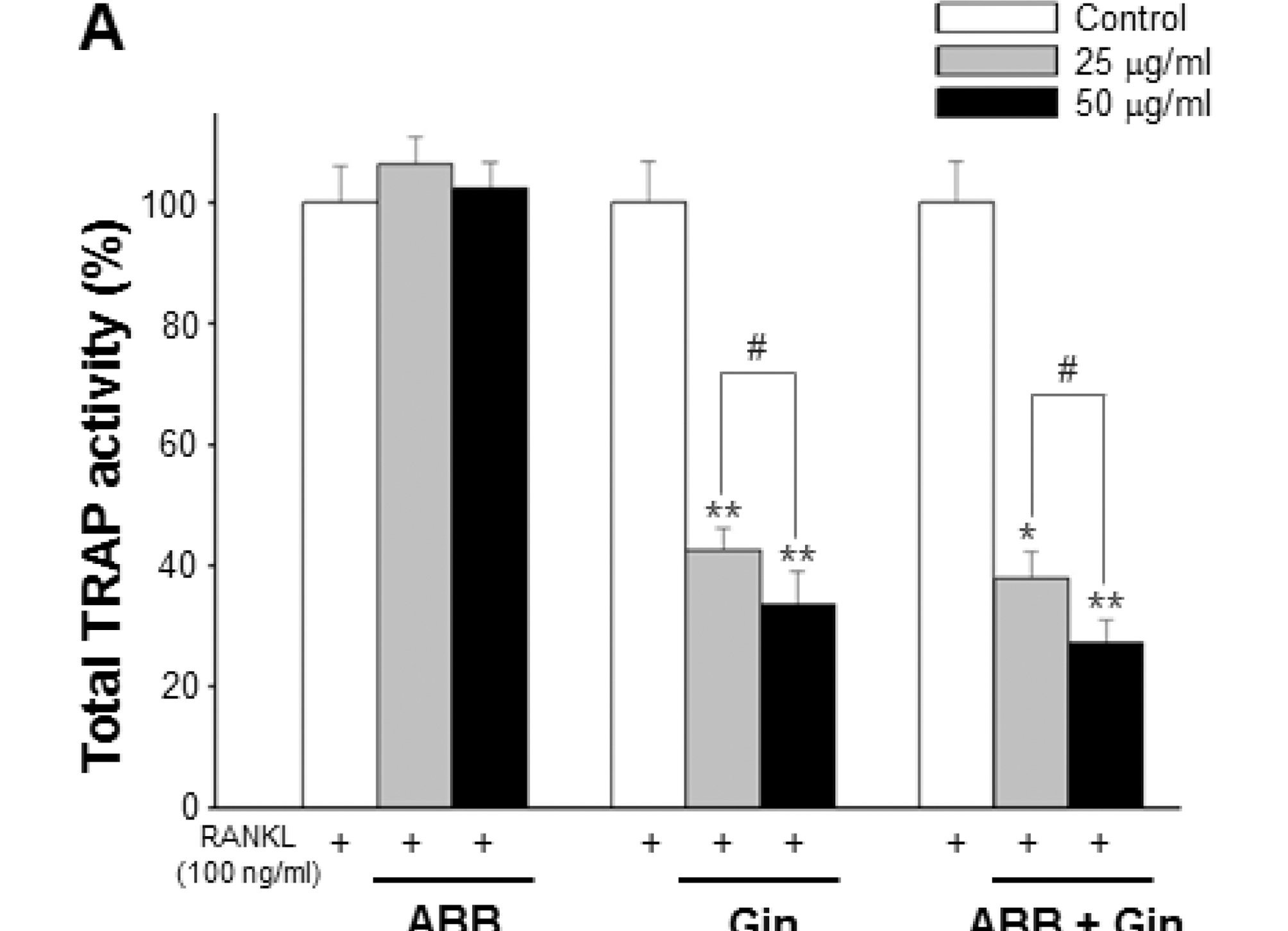
Gin contained groups inhibits RANKL-induced osteoclast differentiation from RAW264.7 cell. (A); Total osteoclasts including ROC and irregular shaped osteoclast (IOC) evaluated by TRAP solution assay. (B); ROC cells counted under a light microscope. Each column represents mean ± SD (*p < 0.05, **p < 0.01, ***p < 0.001) vs Control. #p < 0.05 as compared to the 25μg/ml treatment. Control; only RANKL treatmentABB; Achyranthes bidentata Blume, Gin; Panax ginseng, ABB + Gin; Achyranthes bidentata and Panax ginseng mixture.
3. 우슬과 인삼의 파골세포 분화 유도인자 억제
파골세포는 다양한 사이토카인, 호르몬 및 유전인자 조절 등 으로 시작, 분화, 다핵화 그리고 성숙화 등 복잡한 과정에 의 해 형성되는데 (Yavropoulou and Yovos, 2008), 풍부한 칼시 토닌 수용체 (calcitonin receptor, Cal-R)와 TRAP이 존재하며 실제적으로 골 흡수 작용을 하는 산 생성이 활발하고, acting ring을 형성하여 골 기질을 흡수한다고 알려졌다 (Boyle et al., 2003). 성숙 파골세포의 골 기질 흡수단계에서 우슬과 인 삼 추출물에 의한 Cal-R와 TRAP의 mRNA 발현양 변화를 분석한 결과, 우슬과 인삼을 동량으로 혼합물의 25μg/ml (50.96%)와 50μg/ml (64.43%)의 모든 농도에서 Cal-R의 현 저한 감소율과 25μg/ml에 비해 50 μg/ml 농도에서도 유의하 게 감소된 발현양을 확인하였다. TRAP 발현양 역시 우슬과 인삼 혼합물에서 대조군과 비교하여 50μg/ml 농도에서 현저 한 감소율 (38.66%)과 25μg/ml 농도와 비교하여도 50μg/ml 농도에서 34.95%의 유의한 감소율을 나타냈다 (Fig. 4).
RANKL에 의한 MAPKs 인산화는 PU1, MITF, AP-1, NFATc1 등을 활성화시켜 핵 내 형성된 복합체가 파골세포 분 화에 중요한 유도인자를 촉진하게 된다. 특히 NFATc1은 파 골세포 분화의 결정적 조절인자로서 (Takayanagi et al., 2002), 파골세포의 특이 유전자인 cathepsin K, TRAP, Cal-R, OSCAR 및 β-integrin 등의 발현을 조절하는 것으로 알려졌다 (Kim et al., 2005; Matsumoto et al., 2004). 본 연구자들의 이전 연구에서 RANKL에 의해 유도된 파골세포의 TRAP 효 소 활성 억제와 마찬가지로 Cal-R와 TRAP의 mRNA 발현 역시 인삼 추출물에 의해서 유의하게 억제된다는 것을 확인하 였다 (Lee et al., 2015). 진세노사이드 Rb1은 NF-kB과 MAPKs 경로 조절 (Cheng et al., 2012), 진세노사이드 Rh2 는 NF-kB, NFATc1 그리고 c-Fos 등을 조절하여 파골세포 분화를 억제한다고 하였다 (He et al., 2012). 그러므로 인삼 열수추출물은 파골세포 분화 전사인자인 NFATc1의 억제를 통 한 Cal-R와 TRAP의 감소가 유발되었을 것으로 예상되고, 최 종적으로 골 기질 흡수가 억제될 것으로 사료된다.
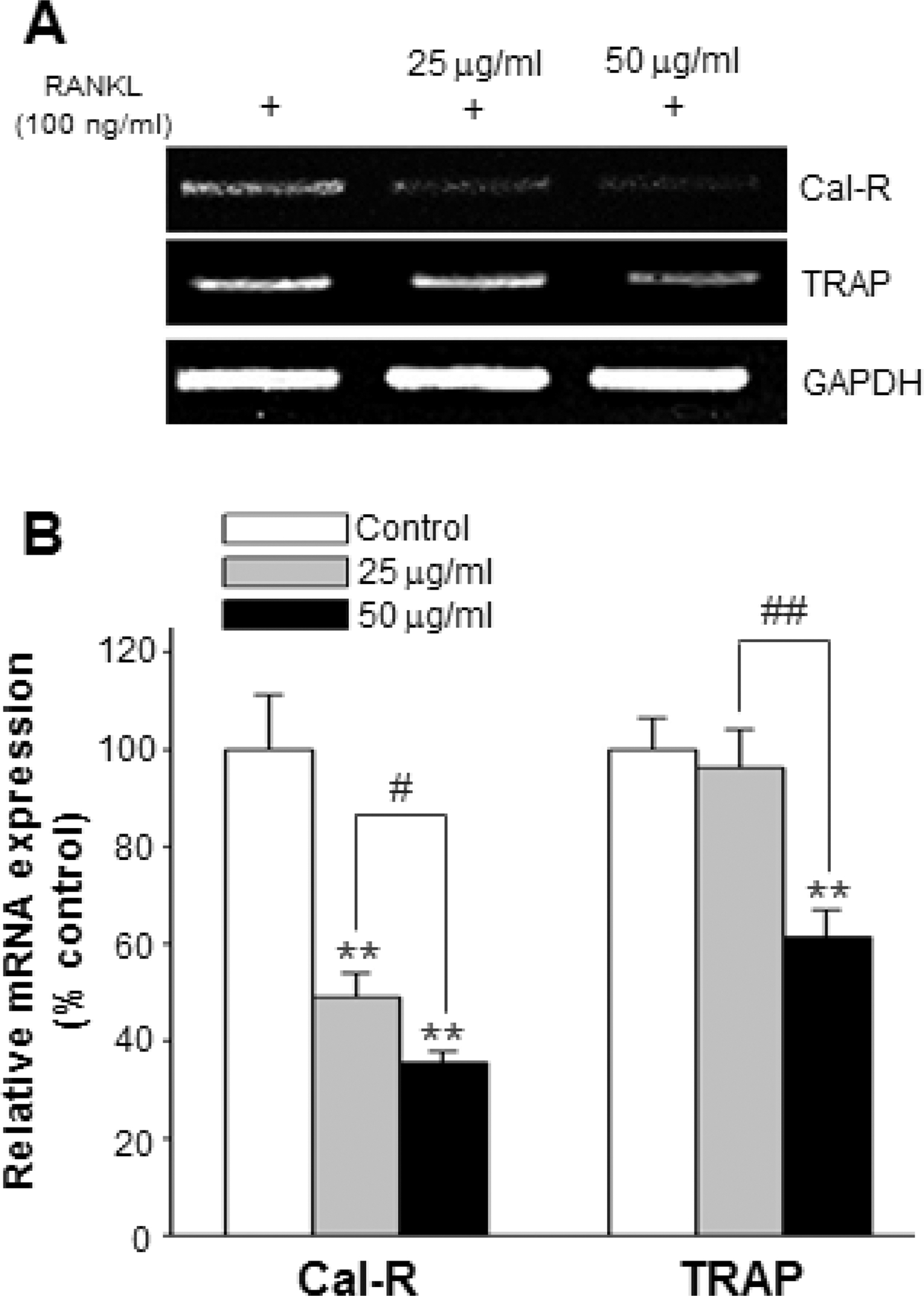
ABB and Gin mixture group inhibits RANKL-induced gene expression in the resorption stage of osteoclast differentiation. RAW264.7 cells were treated with RANKL in the different concentration of ABB and Gin mixture. RT-PCR was performed to detect the expression of the indicated genes, and performed with 25 cycles. Each column represents mean ± SD (**p < 0.01) vs Control. #p < 0.05 and ##p < 0.01 as compared to the 25 g/ml treatment. Control; only RANKL treatment, Cal-R; calcitonin receptor, TRAP; tartrate resistant acid phosphate.
4. 우슬과 인삼의 조골세포 분화 효과
골조직에 존재하는 조골세포와 유사하여 골기질의 축적, 석 회화와 성장요소 및 대사 변화 등 (Choi and Koh, 2003)의 연구에 이용되고 있는 MC3T3-E1 세포에 우슬과 인삼 열수추 출물을 처리하여 세포증식 및 세포 생존율에 따른 세포 독성 평가와 석회화 결절 (calcium accumulation) 형성의 관찰을 통하여 조골세포 후기 분화단계 활성을 확인하였다. 대조군을 포함한 모든 실험군의 농도에서 24시간 처리 후 세포 생존율 에는 영향을 미치지 않았다 (Fig. 5A). alizarin red에 염색된 석회화 결절을 용해하여 흡광도를 측정한 결과 인삼 추출물의 25μg/ml 농도 (25.96 %), 우슬과 인삼 혼합물 25μg/ml 농도 (26.41 %)에서 대조군과 비교하여 유의하게 증가하였다 (Fig. 5B). 우슬 추출물 역시 증가의 경향을 보이지만 통계적으로 유 의성을 나타내지 않았다. 그러나 일부 연구자들은 우슬 추출 물 (500mg/kg)을 난소가 적출된 골다공증 동물 모델에 경구 투여하였을 경우 골밀도와 혈중 알칼린포스파타제 (alkaline phosphatase, ALP)가 유의하게 증가되어 골다공증 치료제로서 의 가능성을 제시하고 있지만 (Kim et al., 2007), 이들 결과 는 파골세포 분화의 억제인지 혹은 조골세포 활성에 따른 골 형성의 증가 효과인지 명확한 규명이 요구된다. Kim (2012) 등은 MC3T3 E1 세포에서 진세노사이드 Rd가 AMPK와 BMP-2 신호전달 경로의 활성을 통하여 활발한 조골세포로 분 화를 유도한다고 보고하였다. 본 연구결과 조골세포 분화 활 성의 증가는 인삼이 포함된 처리군에서 뚜렷하게 나타났다. 이 는 인삼의 사포닌계 진세노사이드 성분이 영향을 미쳤을 것으 로 사료된다.
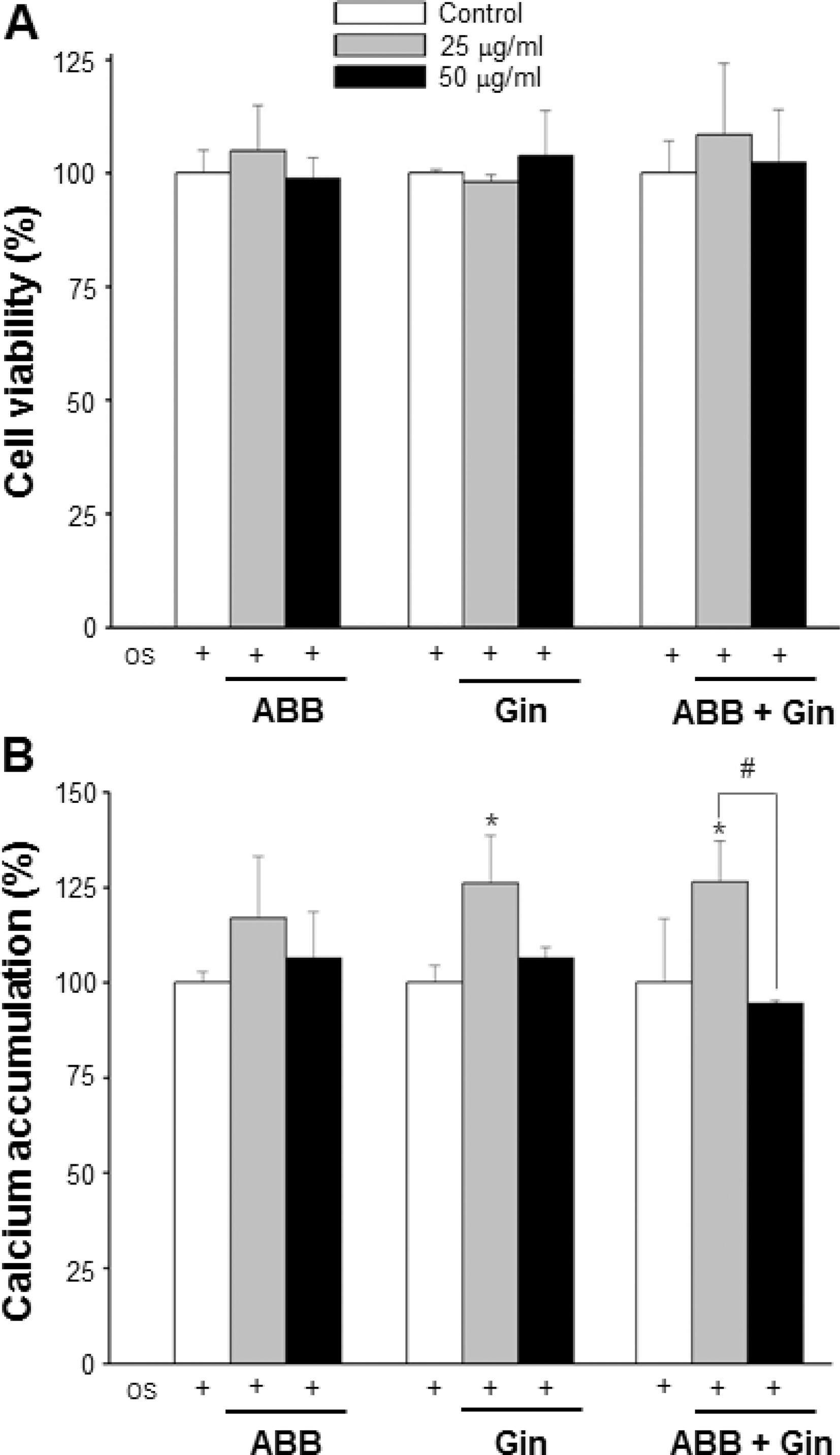
Effect of Gin and ABB on the cytoxicity and calcium accumulation of MC3T3-E1 cells. (A); Osteoblastic cell viability were treated in media with osteogenic induction reagents (OS) and different concentration of Gin and ABB for 24 hours. (B); Calcium accumulation was assessed after 21 days of culturing. Each column represents mean ± SD (*p < 0.05, **p < 0.01) vs Control. #p < 0.05 as compared to the 25 g/ml treatment. Control; only RANKL treatment, ABB; Achyranthes bidentata Blume, Gin; Panax ginseng, ABB + Gin; Achyranthes bidentata and Panax ginseng mixture.
본 연구는 골 흡수와 골 형성의 불균형에 의해 골밀도 감소 를 초래하는 대사성 골질환인 골다공증 개선제로서 우슬과 인 삼 열수추출물 혼합물의 가능성을 제시하고자 시행하였다. 인 삼의 고농도 처리에서 나타나는 세포 독성은 우슬에 의해 감 소되었고, 인삼의 농도 의존적에 따른 파골세포의 분화 억제 와 조골세포 분화 활성이 촉진되어 골 항상성 유지에 관여하 고 있음을 확인하였다. 이러한 결과는 우슬과 인삼 혼합물이 골다공증 치료제로서 가능성을 제시하며 좀 더 효율적인 치료 제 개발을 위한 기초 자료 제공을 위하여 추후 우슬과 인삼 혼합물의 파골세포와 조골세포 분화 작용 기전에 대한 연구가 필요할 것이다.
감사의 글
본 연구는 농촌진흥청 국립원예특작과학원 기관고유사업 ‘성장호르몬 분비 촉진 약용식물의 골다공증 개선 소재 탐색 및 발굴(과제번호: PJ009559)’의 지원을 받아 수행된 결과로 이에 감사드립니다.
REFERENCES
- Aldercreutz, H, Mazur, W, Phyto-estrogens in relation to cancer and other human health risks, Proceedings of the Nutrition, (1996), 55, p399-417.
-
Boyle, WJ, Simonet, WS, Lacey, DL, Osteoclast differentiation and activation, Nature, (2003), 423, p337-342.
[https://doi.org/10.1038/nature01658]

-
Chen, XM, Tian, GY, Structural elucidation and antitumor activity of a fructan from Cyathula officinalis Kuan, Carbohydrate Research, (2003), 338, p1235-1241.
[https://doi.org/10.1016/s0008-6215(03)00073-9]

-
Cheng, B, Li, J, Du, J, Lv, X, Weng, L, Ling, C, Ginsenoside Rb1 inhibits osteoclastogenesis by modulating NFkB and MAPKs pathways, Food and Chemical Toxicology, (2012), 50, p1610-1615.
[https://doi.org/10.1016/j.fct.2012.02.019]

- Choi, SY, Koh, KJ, The effects of irradiation on the mRNA expression of type I collagen and alkaline phosphatase in the MC3T3-E1 osteoblastic cell line, Korean Journal of Oral and Maxillofacial Radiology, (2003), 33, p51-57.
-
Choi, WY, Lim, HW, Choi, GP, Lee, HY, Enhancement of ginsenosides conversion yield by steaming and fermentation process in low quality fresh ginseng, Korean Journal of Medicinal Crop Science, (2014), 22, p223-230.
[https://doi.org/10.7783/kjmcs.2014.22.3.223]

- Choi, YR, Kang, MJ, Son, YW, Protective effect of Achyranthis radixs extract on cadmium of osteoporosis-induced agent in cultured osteoblasts, Journal of Korean Society for People. Plants. And Environment, (2012), 15, p319-324.
- Darnay, BG, Ni, J, Moore, PA, Aggarwal, BB, Activation of NF-kappa B by RANK requires tumor necrosis factor receptor-associated factor(TRAF) 6 and NF-kappa B inducing kinase. Identification of a novel TRAF6 interaction motif, Journal of Biological Chemistry, (1999), 274, p7724-7731.
- Del, FA, Cappariello, A, Teti, A, Genetics, pathogenesis and complications of osteopetrosis, Bone, (2008), 42, p19-29.
- Grigoriades, AE, Wang, ZQ, Cecchini, MG, Hofstetter, W, Felix, R, Fleisch, HA, Wagner, EF, c-Fos: A key regulator of osteoclast-macrophage lineage determination and bone remodeling, Science, (1994), 266, p443-448.
-
Han, SB, Lee, CW, Yoon, YD, Lee, JH, Kang, JS, Lee, KH, Yoon, WK, Lee, KH, Park, SK, Kim, HM, Prevention of arthritic inflammation using an oriental herbal combination BDX-1 isolated from Achyranthes bidentata and Atractylodes japonica, Archives of Pharmacal Research, (2005), 28, p902-908.
[https://doi.org/10.1007/bf02973875]

- He, L, Lee, JW, Jang, JH, Lee, SH, Nan, MH, Oh, BC, Lee, SG, Kim, HH, Soung, NK, Ahn, JS, Kim, BY, Ginsenoside Rh2 inhibits osteoclastogenesis through downregulation of NF-B, NFATc1 and c-Fos. Bone, (2012), 50, p1207-1213.
-
Jung, HK, Kang, BM, Jang, JH, Ahn, BK, Yeo, JH, Jung, WS, Cho, JH, Kuk, YI, Hyun, KH, Cho, HW, Inhibitory effect of Alopecurus aequalis Sobol ethanol extracts on LPSinduced inflammatory response in RAW 264.7 cells, Korean Journal of Medicinal Crop Science, (2014), 22, p98-104.
[https://doi.org/10.7783/kjmcs.2014.22.2.98]

- Jung, NP, Song, SO, Choi, SU, Cytotoxicity of white and red ginseng against cancer cells and their effects on the cell cycle, Journal of Ginseng Research, (2000), 24, p183-187.
- Kannel, KA, Drake, MT, Adverse effects of bisphosphonates: Implications for osteoporosis management, Mayo Clinic Proceedings, (2009), 84, p632-638.
-
Karst, M, Gorny, G, Galvin, RJ, Oursler, MJ, Roles of stromal cell RANKL, OPG, and M-CSF expression in biphasic TGF-regulation of osteoclast differentiation, Journal of Cellular Physiology, (2004), 200, p99-106.
[https://doi.org/10.1002/jcp.20036]

-
Kim, DY, Park, YG, Quan, HY, Kim, SJ, Jung, MS, Chung, SH, Ginsenoside Rd stimulates the differentiation and mineralization of osteoblastic MC3T3-E1 cells by activating AMP-activated protein kinase via the BMP-2 signaling pathway, Fitoterapia, (2012), 83, p215-222.
[https://doi.org/10.1016/j.fitote.2011.10.017]

- Kim, EJ, Kim, GY, Kim, GE, Jang, MK, Kim, YI, Kim, HW, Chung, HW, Effect of biochemical makers of bone metabolism by administraion of Achyrantes radix concentration in ovariectomized rat, Korean Journal Oriental Physiology & Pathology, (2007), 21, p967-972.
- Kim, EJ, Chung, HW, Kim, GY, Effect of Achyrantis radix on rat chondrocyte oxidative stress and its signal transduction, Korean Journal of Oriental Physiology & Pathology, (2008), 22, p841-848.
- Kim, JH, Ki, JY, Ann, JY, Park, HJ, Kim, HJ, Kwak, HB, Oh, JM, Kim, YK, Inhibitory effects of Achyranthis bidentatae radix on osteoclast differentiation and bone resorption, The Korea Journal of Herbology, (2010), 25, p65-74.
- Kim, SI, Lee, YH, Kang, KS, 10-Acetyl panaxitriol, a new cytotoxic polyacetylene from Panax ginseng, Yakhak Hoeji, (1989), 33, p118-123.
- Kim, Y, Sato, K, Asagiri, M, Morita, I, Soma, K, Takayanagi, H, Contribution of NFATc1 to the transcriptional control of immunoreceptor OSCAR but not TREM-2 during osteoclastogenesis, Journal of Biological Chemistry, (2005), 280, p32905-32913.
-
Komori, T, Regulation of osteoblast differentiation by transcription factors, Journal of Cell Biochemistry, (2006), 99, p1233-1239.
[https://doi.org/10.1002/jcb.20958]

- Kwak, HB, Kim, JH, Kim, DJ, Kwon, YM, Oh, JM, Kim, YK, Effect of water extract of deer antler in osteoclast differentiation, Korean Journal of Oriental Physiology & Pathology, (2008), 22, p891-895.
-
Lee, HY, Park, SH, Chae, SW, Soung, NK, Oh, MJ, Kim, JS, Kim, YO, Chae, HJ, Aqueous ginseng extract has a preventive role in RANKL-induced osteoclast differentiation and estrogen deficiency-induced osteoporosis, Journal of Functional Foods, (2015), 13, p192-203.
[https://doi.org/10.1016/j.jff.2014.12.039]

- Lee, JW, Activity of medicinal plants on proliferation and differentiation of osteoblasts, Korean Journal of Pharmacognosy, (2009), 40, p190-195.
-
Li, J, Qi, H, Qi, LW, Yi, L, Li, P, Simultaneous determination of main phytoecdysones and triterpenoids in radix Achyranthis bidentatae by high-performance liquid chromatography with diode array-evaporative light scattering detectors and mass spectrometry, Analytica Chimica Acta, (2007), 596, p264-272.
[https://doi.org/10.1016/j.aca.2007.05.016]

- Matsumoto, M, Kogawa, M, Wada, S, Takayanagi, H, Tsujimoto, M, Katayama, S, Hisatake, K, Nogi, Y, Essential role of p38 mitogen-activated protein kinase in cathepsin K gene expression during osteoclastogenesis through association of NFATc1and PU, Journal of Biological Chemistry, (2004), 279, p45969-45979.
- Mok, SK, Shin, HS, The effects of prostagladine and dibutyryl cAMP on osteoblastic cell activity and osteoclast generation, Journal of Wonkwang Dental Research International, (1996), 6, p43-62.
- Pole, HA, Felsenberg, D, Hanley, DA, Stenpan, J, Munoz-Torres, M, Wolkins, TJ, Qui-sheng, G, Galich, M, Vandormael, K, Yates, AJ, Multinational, placebo-controlled, randomized trial of the effects of alendronate on bone density and fracture risk in postmenopausal women with low bone mass: Results of the FOSIT study, Osteoporosis International, (1999), 9, p461-468.
-
Takayanagi, H, Kim, S, Koga, T, Nishina, H, Isshiki, M, Yoshida, H, Saiura, A, Isobe, M, Yokochi, T, Inoue, J, Wagner, EF, Mak, TW, Kodama, T, Taniguchi, T, Induction and activation of the transcription factor NFATc1(NFAT2) integrate RANKL signaling in terminal differentiation of osteoclasts, Developmental Cell, (2002), 3, p889-901.
[https://doi.org/10.1016/s1534-5807(02)00369-6]

- Tintut, Y, Parhami, F, Tsingotjidou, A, 8-Isoprostaglandin E2 enhances receptor-activated NFkappa B ligand(RANKL)-dependent osteoclastic potential of marrow hematopoietic precursors via the cAMP pathway, Journal of Biological Chemistry, (2002), 277, p14221-14226.
-
Tsai, HY, Lin, HY, Fong, YC, Wu, JB, Chen, YF, Tsuzuki Tang, CH, Paeonol inhibits RANKL-induced osteoclastogenesis by inhibiting ERK, p38 and NF-B pathway, European Journal of Pharmacology, (2008), 588, p124-33.
[https://doi.org/10.1016/j.ejphar.2008.04.024]

- Yavropoulou, MP, Yovos, JG, Osteoclstogenesis current knowledge and future perspectives, Journal of Musculoskeletal and Neuronal Interactions, (2008), 8, p204-216.
-
Yoon, KH, Baek, JM, Kim, JY, Kwak, SC, Cheon, YH, Jeon, BH, Lee, CH, Choi, KM, Oh, JM, Lee, MS, Kim, JJ, Inhibitory effect on RANKL-Induced osteoclast differentiation by water extract of Zizyphus Jujuba Mill, Korean Journal of Oriental Physiology & Pathology, (2014), 28, p29-34.
[https://doi.org/10.15188/kjopp.2014.02.28.1.29]

