마우스 수컷 생식세포에서 비스페놀 A에 대한 인삼 에탄올 추출물의 보호 효과
© The Korean Society of Medicinal Crop Science All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was carried out to evaluate the preventive effect of three forms of Korean ginseng roots (fresh, white and red) against bisphenol A (BPA) toxicity in mouse male germ cells (GC-2spd, TM3, TM4). ROS (reactive oxygen species) generation were measured by DCF-DA (2’,7’-dichlorohydrofluorescein diacetate) assay. Also, semi-quantitative reverse transcriptase polymerase chain reaction (RT-PCR) was performed to quantify the mRNA expression levels of apoptosis- related genes, Bax (pro-apoptotic gene) and Bcl2 (anti-apoptotic gene). ROS generation was increased by 50 μM BPA, but definitely decreased by treatment with Korean ginseng extracts (fresh, white and red) in mouse male germ cells. In especial, Korean fresh ginseng extract reduced significantly ROS production to normal control. In addition, Korean fresh and white ginseng extracts suppressed the apoptosis of mouse male germ cells by fine-tuning mRNA levels of apoptotic genes changed by BPA. In general, Korean fresh ginseng extract was more effective than white ginseng extract for reducing BPAinduced oxidative stress and apoptosis in mouse male germ cells. Therefore, Korean fresh and white ginseng may help to alleviate biphenol A toxicity in mouse male germ cells.
Keywords:
Panax ginseng, Bisphenol A, Germ Cell, Apoptosis, Reproductive Toxicity서 언
내분비 장애물질 (Endocrine Disrupting Chemicals, EDCs) 은 동식물의 생체 내에 존재하는 정상 호르몬의 수용체 (receptor)와 결합하여 호르몬의 생성을 억제 혹은 증가시킴으 로써 생식기능의 이상, 성비균형의 파괴, 호르몬 분비의 불균 형, 면역기능 저해, 신경계 마비, 간독성, 폐기능 저하, 유방암 및 전립선암 증가 등의 다양한 질환을 초래하는 것으로 알려 져 있다 (Degen and Bolt, 2000; Guillette et al., 1995; Kim et al., 2005). 그 중 전 세계에서 가장 많이 생산되고 있는 화학물질 중의 하나인 비스페놀 A (bisphenol A, BPA) 는 대표적인 환경호르몬으로서 화장품의 항균제, 통조림내의 코팅제, 치과 치료용 수지, PVC 재질로 된 유아용 완구 및 플라스틱 생산과정에 폭 넓게 사용되고 있다. 다양한 용도로 사용되는 BPA의 특성 때문에 환경 중에서 쉽게 인체에 노출 되어 지속적인 노출 감시와 방지 등 다양한 예방 대책이 필요 하며 BPA의 사용을 줄이고, 노출에 대항하여 인체를 보호해 줄 방어물질 탐색 연구가 필요한 실정이다 (Kho et al., 2010). 이에 인삼은 중금속을 포함한 다양한 독성 물질에 대 한 해독 효과가 있는 것으로 알려져 있으므로 (Lee et al., 2011; Shukla and Kumar, 2009) 유력한 후보 물질이라 할 수 있고, 기존 연구에서 이미 고려 홍삼의 BPA에 대한 방어 물질로서의 가능성도 제시되었다 (Kho et al., 2010; Yang et al., 2014).
BPA는 에스트로겐 활성을 가지는 특성 때문에 주로 동물의 암컷 생식계에 미치는 영향이 큰 것으로 알려져 있지만, 수컷 생식계에도 영향을 미친다고 보고하였다 (Eo and Lim, 2008; Vom Saal et al., 1998). 또한 BPA는 여러 종류의 세포들에 서 활성 산소 (Reactive Oxygen Species, ROS) 증가를 통해 독성을 일으키고, 결국 세포 사멸을 유도하는 것으로 알려져 있다 (Eo and Lim, 2008; Xu et al., 2002). 따라서 본 연 구는 마우스의 수컷 생식세포주를 가지고 BPA가 생식세포에 미치는 영향과 인삼의 생식세포 보호 효과를 밝히고자 시행하 였다.
재료 및 방법
1. 세포주 배양
본 연구에 사용한 마우스 정모세포주 (Spermatocyte cell line) GC-2spd (ts), 라이디히세포주 (Leydig cell line) TM3, 세르톨리세포주 (Sertoli cell line) TM4는 American Type Culture Collection (ATCC, Rockvile, MD, USA)에서 구입하 였다. 세포는 10% Fetal bovine serum (FBS)과 100units/mL Penicillin과 100μg/mL streptomycin이 포함된 Dulbecco’smodified Eagle’s medium (DMEM, high glucose) 배양액으 로 배양하였으며, 37°C, 5% CO2 조건 (MCO-2OAIC, Sanyo, Moriguchi, Osaka. Japan)을 유지하였다.
2. 수삼, 백삼, 홍삼 추출물 제조
실험에 사용된 수삼 (4년근), 백삼 (4년근) 시료는 증평농협 에서, 홍삼 (6년근) 시료는 정관장에서 각각 구입하였다. 구입 한 시료는 각각 1cm3 크기로 절단하고 70% Ethanol에 담가 80°C 조건에서 3번 환류추출 후 농축하고 동결건조하여 분말 화하고, DMSO/PBS을 50/50로 혼합한 용액에 100mg/mL 농 도로 용해하여 실험에 사용하였다.
3. 활성산소 (Reactive Oxygen Species, ROS) 생성량 측정
마우스 생식세포의 세포내 산화적 손상 보호 효과를 측정하 기 위하여 2 ‘,7’-dichlorohydrofluorescein diacetate (DCF-DA; Sigma-aldrich, St. Louis, MO, USA) assay를 하였다. GC- 2spd (ts), TM3, TM4 cell을 96-well plate에 5 × 103 cells/well 의 농도로 분주하여 24시간 동안 세포를 안정화시켰다. BPA (50 μM), 인삼 추출물 (50μg/mL, 100μg/mL) 및 추출물 용매 (vehicle, DMSO 0.1%)를 각각 전처리하고 24시간 배양 후 Serum-free media에 20 μM DCF-DA와 0.25mM probenecid 를 혼합하여 5% CO2, 37°C incubator에서40분간 처리하고, Krebs Henseleit Buffer (KHB)로 교체하여 incubator에서 1시 간 동안 반응시킨 뒤 microplate reader (Biotek, Winooski, Vermont, USA)를 이용하여 형광도 (exitation 485nm / emission 535nm)를 측정하였다.
4. Semi-quantitative Reverse Transcriptase Polymerase Chain Reaction (RT-PCR)
마우스 생식세포의 세포사멸 관련 유전자들의 발현 정도를 조사하기 위해 BPA (50 μM), 인삼 추출물 (100μg/mL), 추 출물 용매 (vehicle, DMSO 0.1%)를 30분 동안 처리하여 배 양한 세포로부터 Trizol reagent를 처리하여 total RNA를 추 출하고 역전사 kit (Fermentas, Vilrius, Lithuania)에 의해 cDNA를 제조한 다음, 동량의 cDNA를 PCR로 증폭시켰다. 유 전자 증폭을 위하여 Bax forward primer: 5'-AGCTCTG AACAGATCATGAAGAC-3'와 reverse primer: 5'-CTAGCA AAGTAGAAGAGGGCAAC-3', Bcl2 forward primer: 5'- GGGAGATCGTGATGAAGTACATA-3'와 reverse primer: 5'- GGTAGCGACGAGAGAAGTCAT-3' 그리고 GAPDH forward primer: 5'-TCAACTACATGGTCTACATGTTCC-3'와 reverse primer: 5'-TGAGTGAGTTGTCATATTTCTCGT-3'를 사용하였다. 2% agarose gel에서 전기영동하고, Et-Br로 염색한 뒤 UV 상 에서 관찰하여 분석하였다.
5. HPLC ginsenoside의 분석
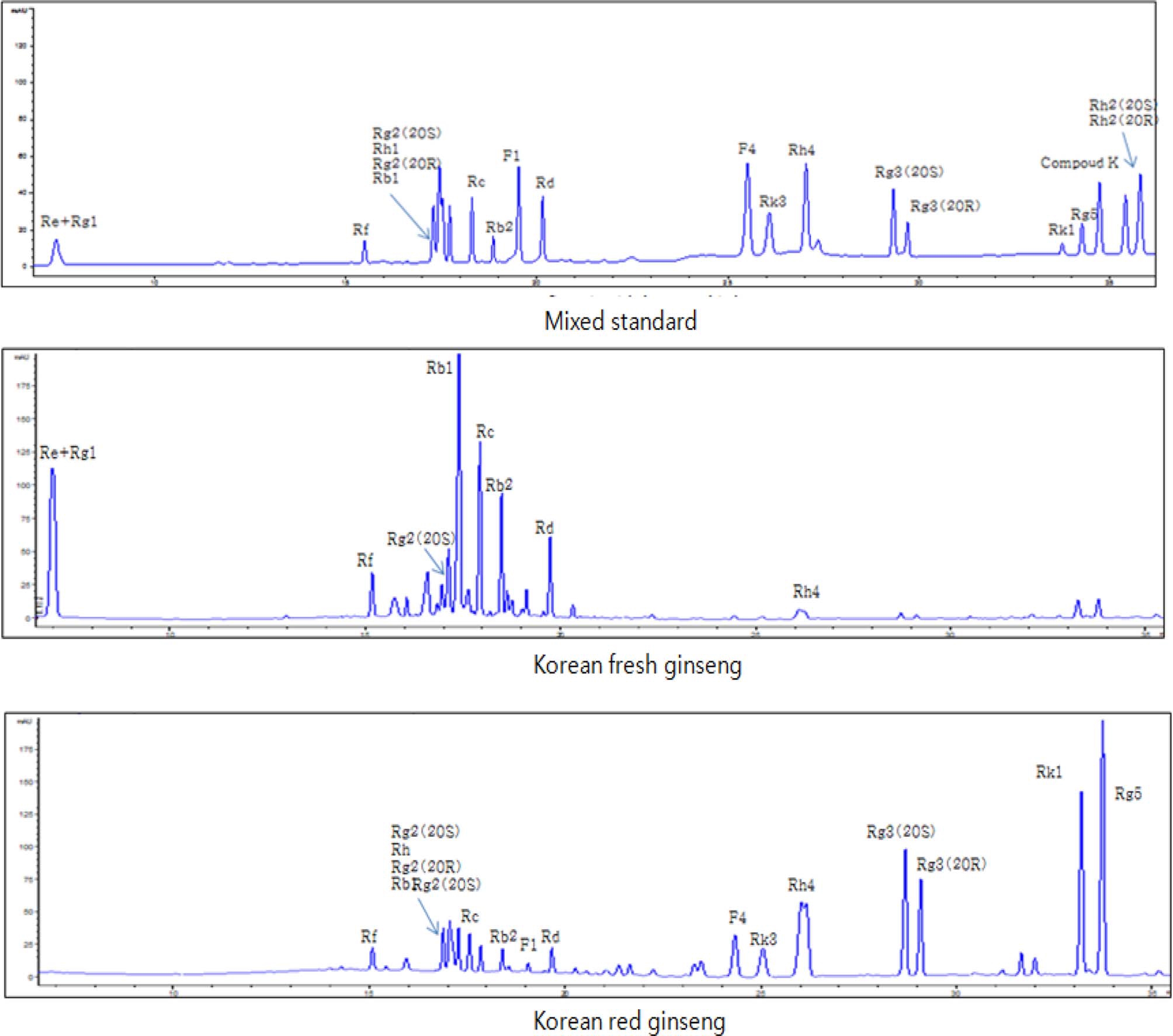
수삼과 홍삼의 조추출물을 비교한 HPLC 조건은 다음과 같다. Column은 Kinetex C18 (14.6mm × 100mm, 2.6μm)이며 유속은 1 mL/min, column 온도는 35°C, 시료주입량은 10μl 로 UV 203nm에서 실험하였다. 이동상은 분석하고자 하는 Table 1에 나타내었다.
6. 통계 처리
모든 실험은 3번 이상 반복 측정하여 평균±표준편차로 표 기하였으며, 처리간 유의성은 Student’s t-test로 검정하여 pvalue 값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다.
결과 및 고찰
1. Ginsenoside 분포 확인
본 연구에서는 수삼과 홍삼 추출물들의 개별 ginsenoside의 분포를 조사함으로써 사포닌 함유 패턴의 차이점을 확인하였 고 ginsenoside Rg3, Rg5, Rk1 등의 인삼 활성 prosapogenin 도 홍삼에서 확인하였다. 분석한 인삼 사포닌은 ginsenoside Rb1, Rb2, Rc, Rd, Re, Rf, Rg1, Rg2, Rg3, Rg5, Rh1, Rh4, Rk1, Rk3, Compound K, F1, F4이었으며 이들은 Fig. 1과 같이 HPLC를 통하여 표준품과 직접 비교확인하였다. 가 공방법에 따라 ginsenoside의 종류와 함량이 다양하게 변하는 데, 특히 홍삼 특유 사포닌으로 최근에 종양전이억제 (Mochizuki et al., 1995), NO 분비와 혈관이완 효과 (Kim et al., 2006) 및 뇌기능 개선 효과 (Joo et al., 2006) 등이 있다고 알려져 있는 ginsenoside Rg3의 증가가 가장 획기적이 였다. Lee 등 (2006)의 연구결과에서는 Rg3는 증숙하지 않은 수삼에는 존재하지 않았지만 홍삼에는 존재하여 본 연구 결과 와 일치하였다. 한편 ginsenoside Rg3의 에피머 (epimers)로 20(S)-ginsenoside Rg3와 20(R)-ginsenoside Rg3로 구분되는데 그림 1에서와 같다. 수삼에는 거의 존재하지 않는 Ginsenoside Rg3는 가열처리에서 생성되는 prosapogenin으로서 가열에 의해 현저히 증가되었다. 또한 그 조성은 20(R)-ginsenoside Rg3가 20(S)-ginsenoside Rg3 함량보다 약간 적었다. Hong 등 (2007) 은 PD계 ginsenoside인 Rb1, Rc의 경우 증숙초기부터 감소하 여 소멸하였는데 본 연구 결과와 같은 결과를 나타내었다. 결 과로 보아 항당뇨성분인 Rb2 (Yokozawa et al., 1996)와 Re (Attele et al., 2002)는 수삼에서 많았고, 혈관이완효과 (Kim et al., 2003)와 혈관신생억제효과 (Yue et al., 2006)가 있는 Rg3는 홍삼에만 나타났다. 또한 정자의 운동성을 강력히 증가 시킴을 알 수 있는 ginsenoside Rc도 홍삼보다 수삼에서 많은 양이 있음을 확인하였다.
2. 마우스 정모세포에서 비스페놀A에 대한 인삼 추출물의 보호 효과
마우스 정모세포주인 GC-2spd (ts)를 이용하여 마우스 정모 세포에서 BPA 노출에 대한 인삼 추출물의 보호 효과를 분석 하였다. MTT assay를 통하여 GC-2spd (ts)에서 BPA 50 μM 까지 세포독성이 없음을 확인하였다. BPA에 의한 활성 산소 (ROS) 증가에 대해 인삼 추출물이 미치는 영향을 확인하기 위 하여 DCF-DA assay를 실시하였다. GC-2spd (ts) 세포내 ROS 생성은 BPA 50 μM에 의해 1.5배로 증가하였고, 증가된 ROS는 인삼 추출물에 의해 현저하게 억제되었다 (Fig. 1A). 수삼, 백삼 및 홍삼 추출물은 농도 의존적으로 ROS 생성을 억제하는 것으로 나타났다. 100μg/mL 처리군의 ROS 생성량 은 BPA 무처리군과 유사한 수준이었고, 추출물 종류에 따른 차이는 크지 않았다 (Fig. 1A). BPA에 의한 정모세포의 세포 사멸 (apoptosis)에 인삼 추출물이 어떤 영향을 미치는지 확인 하기 위해, 인삼 추출물에 의한 세포사멸 관련 유전자의 mRNA 변화량을 Semi-quantitative RT-PCR로 정량하였다. 수 삼, 홍삼 추출물은 BPA에 의해 늘어난 Bax (세포사멸 유발 단백질) mRNA 발현을 억제하였으며, BPA에 의해 줄어든 Bcl2 (세포사멸 억제 단백질) mRNA 발현을 촉진시켰다 (Fig. 1B, 1C). 백삼 추출물도 수삼, 홍삼 추출물과 마찬가지로 Bax mRNA 발현을 억제하고 Bcl2 mRNA 발현을 촉진시켰지만, Bax mRNA 감소 효과가 통계적으로 유의한 수준까지는 아니 었다 (Fig. 1B, 1C). GC-2spd (ts)에서의 실험 결과를 통해 수삼, 백삼, 홍삼 추출물이 마우스 정모세포에서 BPA에 의한 ROS 증가를 억제하고, 세포사멸 관련 유전자들의 mRNA 발 현에 영향을 줌으로써 세포사멸을 억제하는 효과가 있음을 확 인하였다.
3. 마우스 라이디히 세포에서 비스페놀A에 대한 인삼 추출물의 보호 효과
마우스 정소 내 세포 중 하나인 라이디히 세포에서 BPA에 대한 인삼 추출물의 보호 효과를 확인하기 위해 마우스 라이 디히 세포주인 TM3를 이용하여 실험하였다. MTT assay를 통해 TM3 세포에서 BPA 50 μM까지 세포독성이 없음을 확 인하였는데, 이 결과는 기존의 보고와 일치하였다 (Kim et al., 2005). BPA에 의한 활성 산소 (ROS) 생성량 증가에 대 해 인삼 추출물이 어떤 영향을 미치는지 확인하기 위해 DCFDA assay를 실시하였다. BPA 50 μM에 의해 증가된 TM3 세포 내 ROS 생성은 인삼 추출물에 의해 억제되었다 (Fig. 2A). 수삼, 백삼 및 홍삼 추출물은 농도 의존적으로 ROS 생 성을 억제하였고, 수삼의 ROS 생성 억제 효과가 가장 우수하 였다 (Fig. 2A). Semi-quantitative RT-PCR을 통해 BPA에 의한 라이디히 세포의 세포사멸에 미치는 인삼 추출물의 영향 도 확인하였다. 수삼, 백삼 및 홍삼 추출물은 BPA에 의해 늘 어난 Bax mRNA 발현을 억제하였으며, BPA에 의해 줄어든 Bcl2 mRNA 발현은 촉진시켰다 (Fig. 2B, 2C). 특히, 수삼 추출물에 의한 mRNA 발현량 변화는 Bax, Bcl2 gene 모두 에서 통계적으로 유의한 수준이었고, 변화량의 폭도 가장 컸 다 (Fig. 2B, 2C). TM3 세포에서의 실험 결과를 종합해 볼 때, 마우스 라이디히 세포에서의 BPA에 대한 인삼 추출물의 보호 효과는 수삼 >백삼 >홍삼의 순으로 나타났다.
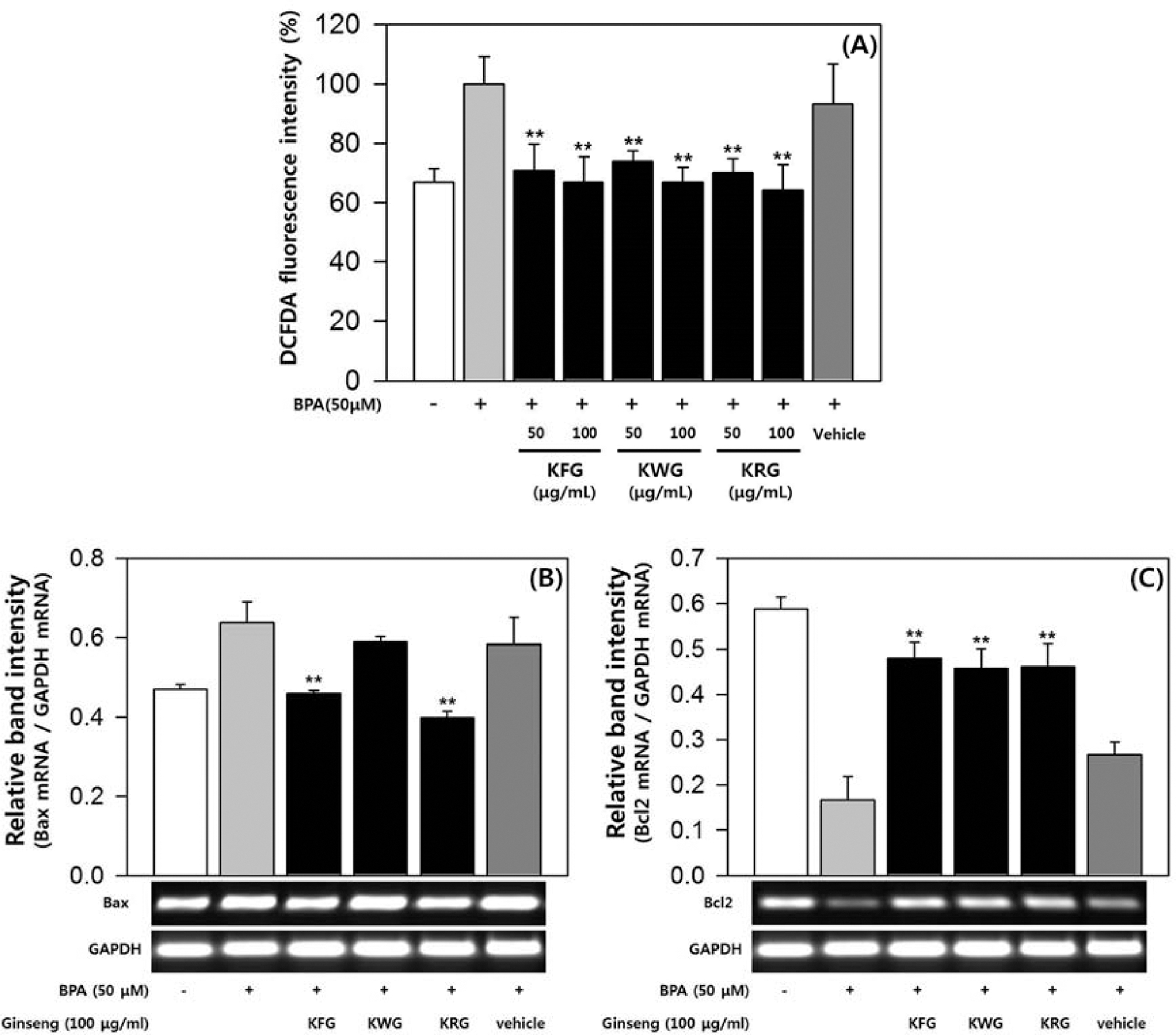
Effects of ginseng extracts on reactive oxygen species (ROS) generation and apoptosis by bisphenol A (BPA) in GC-2spd (ts) cells. All fluorescence intensity values (A) were normalized to BPA-treated group and presented as the mean ± SD (n = 3). The band intensity of Bax and Bcl2 gene (B, C) was measured by densitometry, normalized to GAPDH and presented as the mean ± SD (n = 3). Statistical differences (*, p < 0.05; **, p < 0.01) compared to cell cultures stimulated with BPA in the absence of ginseng extract are indicated. KFG; Korean Fresh Ginseng, KWG; Korean White Ginseng, KRG; Korean Red Ginseng.
4. 마우스 세르톨리 세포에서 비스페놀A에 대한 인삼 추출물 의 보호 효과
마우스 정소 내 세포 중 하나인 세르톨리 세포에서 BPA 독성에 대해 인삼 추출물이 미치는 영향을 확인하기 위해 마 우스 세르톨리 세포주인 TM4를 이용하여 실험하였다. MTT assay를 통해 TM4 세포에서 BPA 50 μM까지 세포독성은 없 었으며 이러한 결과는 기존의 보고와 일치하였다 (Kim et al., 2005). DCF-DA assay를 통해 BPA에 의한 TM4 세포내 ROS 증가에 대한 인삼 추출물의 효과를 확인하였다. BPA 50 μM에 의해 증가된 ROS 생성은 인삼 추출물에 의해 억제 되었다 (Fig. 3A). 그러나 백삼과 홍삼 추출물의 ROS 생성 억제 효과는 통계적으로 유의한 수준으로 나타나지 않았다 (Fig. 3A). Semi-quantitative RT-PCR을 통해 BPA에 의한 세 르톨리 세포의 세포사멸에 미치는 인삼 추출물의 영향을 확인 한 결과, 수삼과 백삼 추출물은 BPA에 의해 늘어난 Bax mRNA 발현을 억제하였으며, BPA에 의해 줄어든 Bcl2 mRNA 발현을 촉진시켰다 (Fig. 3B, 3C). 수삼과 백삼 추출 물에 의한 mRNA 발현 변화는 Bax, Bcl2 gene 모두에서 통 계적으로 유의하였지만, 변화폭은 수삼 추출물이 백삼 추출물 보다 큰 것으로 관찰되었다 (Fig. 3B, 3C). TM4 세포에서의 실험을 통해, 마우스 세르톨리 세포에서 BPA에 대한 수삼과 백삼의 보호 효과를 확인할 수 있었고, 수삼이 백삼보다 우수 한 것으로 나타났다.Fig .4
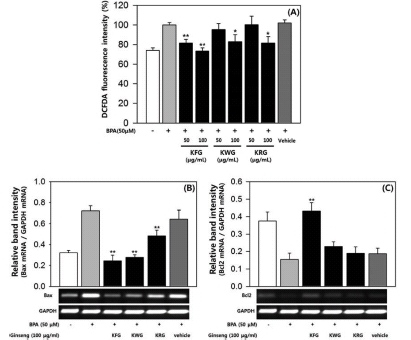
Effects of ginseng extracts on reactive oxygen species (ROS) generation and apoptosis by bisphenol A (BPA) in TM3 cells. All fluorescence intensity values (A) were normalized to BPA-treated group and presented as the mean ± SD (n = 3). The band intensity of Bax and Bcl2 gene (B, C) was measured by densitometry, normalized to GAPDH and presented as the mean ± SD (n = 3). Statistical differences (*, p < 0.05; **, p < 0.01) compared to cell cultures stimulated with BPA in the absence of ginseng extract are indicated. KFG; Korean Fresh Ginseng, KWG; Korean White Ginseng, KRG; Korean Red Ginseng.
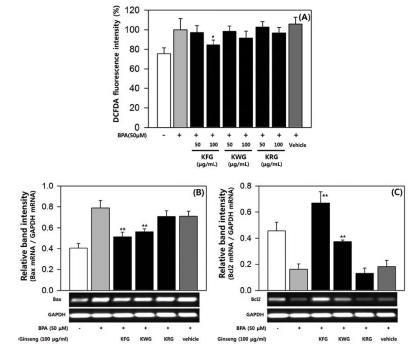
Effects of ginseng extracts on reactive oxygen species (ROS) generation and apoptosis by bisphenol A (BPA) in TM4 cells. All fluorescence intensity values (A) were normalized to BPA-treated group and presented as the mean ± SD (n = 3). The band intensity of Bax and Bcl2 gene (B, C) was measured by densitometry, normalized to GAPDH and presented as the mean ± SD (n = 3). Statistical differences (*, p < 0.05; **, p < 0.01) compared to cell cultures stimulated with BPA in the absence of ginseng extract are indicated. KFG; Korean Fresh Ginseng, KWG; Korean White Ginseng, KRG; Korean Red Ginseng.
비스페놀 A와 같은 내분비 장애물질 (Endocrine Disrupting Chemicals, EDCs)은 환경 중에서 쉽게 인체에 노출되고, 지속 적이기 때문에 다양한 예방 대책과 더불어 방어물질 탐색 연 구가 중요하다. 인삼 뿐만 아니라 산수유와 같은 여러 가지 천연물에 대한 연구가 진행되고 있고 방어 효과가 보고된 바 도 있지만 (Kwon et al., 2009), 기작까지 밝혀진 유력한 후 보 물질은 아직 없어서 지속적인 연구가 필요한 실정이다.
BPA에 의한 세포사멸은 여러 종류의 세포에서 보고되었는 데, 본 연구의 대상이었던 수컷 생식세포에서도 BPA에 의한 세포사멸이 보고되었다 (Eo and Lim, 2008; Iida et al., 2003; Kim et al., 2005). 또한, 인삼은 EDCs에 대한 방어 물질로 지속적으로 연구되어 왔으며 EDCs에 대한 보호 효과 도 보고된 바 있다 (Lee et al., 2011). 따라서 본 연구에서는 수컷 생식세포에서의 BPA에 대한 인삼의 보호 효과를 분석하 였다. 마우스 수컷 생식세포 (정모세포, 라이디히세포, 세르톨 리세포)는 BPA 노출에 의해 활성산소 생성이 증가되었고, 세 포사멸이 유도되었으며 수삼, 백삼 및 홍삼 추출물에 의해 유 의하게 억제되었다. 그 효과는 수삼 >백삼 >홍삼 추출물의 순 으로 나타났다. 수삼은 백삼 또는 홍삼으로 가공되면서 성분 의 변화가 생기므로 (Choi et al., 2010; Nam et al., 2012), 보호 효과의 차이는 수삼이 백삼 또는 홍삼으로 가공되는 과 정에서 변화하는 유효 성분 총량의 차이 때문일 것이라 판단 된다. 가공을 통해 인삼, 더덕과 같은 약용작물의 유효 성분을 늘리는 연구는 많이 진행되고 있지만 (Nam et al., 2012; Song et al., 2012), 상대적으로 가공을 통해 줄어드는 성분에 대한 연구는 미흡한 실정이다. 본 연구는 후자의 중요성을 새 삼 일깨워 준다는 점에서 시사하는 바가 크다. 그러나 조금 더 심도 있는 연구 결과를 위해서는 BPA에 대해 생식세포 보 호 활성을 가지는 인삼 유래 물질을 탐색하고, 그 물질의 세 포사멸 억제 기작 작용점을 찾는 연구가 병행되어야 할 것 이다. 또한, 지금까지의 in vitro 연구 결과가 생체 내에서도 재현되는지 확인하는 추가 연구도 필요하다.
감사의 글
본 논문은 농촌진흥청 어젠다사업(과제번호: PJ00938502) 의 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFERENCES
-
Attele, AS, Zhou, YP, Xie, JT, Wu, JA, Zhang, L, Dey, L, Pugh, W, Rue, PA, Polonsky, KS, Yuan, CS, Antidiabetic effects of Panax ginseng berry extract and the identification of an effective component, Diabetes, (2002), 51, p1851-1858.
[https://doi.org/10.2337/diabetes.51.6.1851]

-
Chen, JC, Chen, LD, Tsai, CC, Chen, BC, Chen, YJ, Effects of ginsenoside Rb2 and Rc on inferior human sperm motility in vitro, American Journal of Chinese Medicine, (2001), 29, p155-160.
[https://doi.org/10.1142/s0192415x01000174]

- Choi, JE, Nam, KY, Li, X, Kim, BY, Cho, HS, Hwang, KB, Changes of chemical compositions and ginsenoside contents of different root parts of ginsengs with processing method, Korean Journal of Medicinal Crop Science, (2010), 18, p118-125.
-
Degen, GH, Bolt, HM, Endocrine disruptors: Update on xenoestrogens, International Archives of Occupational and Environmental Health, (2000), 73, p433-441.
[https://doi.org/10.1007/s004200000163]

- Eo, J, Lim, H, Effects of bisphenol A on gene expression and apoptosis of leydig cells in the mouse testis, Korean Journal of Reproductive Medicine, (2008), 35, p181-191.
- Guillette, LJ, Crain, DA, Rooney, AA, Pickford, DB, Organization versus activation: The role of endocrinedisrupting contanminants(EDCs) during embryonic development in wildlife, Environmental Health Perspectives, (1995), 103, Supplement 7p157-164.
- Hong, HD, Kim, YC, Rho, JH, Kim, KT, Lee, YC, Changes on physicochemical properties of Panax ginseng C. A. Meyer during repeated steaming process, Journal of Ginseng Research, (2007), 31, p222-229.
-
Iida, H, Maehara, K, Doiguchi, M, Mori, T, Tamada, F, Bisphenol A-induced apoptosis of cultured rat sertoli cells, Reproductive Toxicology, (2003), 17, p457-464.
[https://doi.org/10.1016/s0890-6238(03)00034-0]

- Joo, SS, Won, TJ, Lee, YJ, Hwang, KW, Lee, SG, Yoo, YM, Lee, DI, Ginsenoside Rg3 from red ginseng prevents damage of neuronal cells through the phosphorylation of the cell survival protein Akt, Food Science and Biotechnology, (2006), 15, p244-247.
- Kho, MJ, Bae, MJ, Yang, M, Chemopreventive effects of Korean red ginseng on urinary bisphenol a and malondialdehyde, Cancer Prevention Research, (2010), 15, p231-235.
-
Kim, ND, Kim, EM, Kang, KW, Cho, MK, Choi, SY, Kim, SG, Ginsenoside Rg3 inhibits phenylephrine-induced vascular contraction through induction of nitric oxide synthase, British Journal of Pharmacology, (2003), 140, p661-670.
[https://doi.org/10.1038/sj.bjp.0705490]

- Kim, JH, Kim, JK, Do, BR, Lee, CJ, Yoon, YD, Evaluation of bisphenol a induced apoptosis in sertoli cell-lines, Development and Reproduction, (2005), 9, p115-121.
-
Kim, JH, Lee, JH, Jeong, SM, Lee, BH, Yoon, IS, Lee, JH, Choi, SH, Kim, DH, Park, TK, Kim, BK, Nah, SY, Stereospecific effects of ginsenoside Rg3 epimers on swine coronary artery contractions, Biological and Pharmaceutical Bulletin, (2006), 29, p365-370.
[https://doi.org/10.1248/bpb.29.365]

-
Kwon, SH, Kwon, SJ, Kim, JY, Park, KW, Shim, KH, Seo, KI, Protective effect of Corni fructus ethanol extracts against environmental hormones in human prostate cancer cells, Journal of the Korean Society of Food Science and Nutrition, (2009), 38, p663-666.
[https://doi.org/10.3746/jkfn.2009.38.6.663]

-
Lee, HS, Park, JY, Yang, M, Chemopreventive effects of Korean red ginseng(Panax ginseng Meyer) on exposure to polycyclic aromatic hydrocarbons, Journal of Ginseng Research, (2011), 35, p339-343.
[https://doi.org/10.5142/jgr.2011.35.3.339]

- Lee, JH, Shen, GN, Kim, EK, Shin, HJ, Myung, CS, Oh, HJ, Kim, DH, Roh, SS, Cho, W, Seo, YB, Park, YJ, Kang, CW, Song, GY, Preparation of black ginseng and its antitumor activity, Korean Journal of Oriental Physiology & Pathology, (2006), 20, p951-956.
-
Mochizuki, M, Yoo, YC, Matsuzawa, K, Sato, K, Saiki, I, Tono-Oka, S, Samukawa, KI, Azuma, I, Inhibitory effect of tumor metastasis in mice by saponins, ginsenoside-Rb2, 20(R)-and 20(S)-ginsenoside Rg3, of red ginseng, Biological and Pharmaceutical Bulletin, (1995), 18, p1197-1202.
[https://doi.org/10.1248/bpb.18.1197]

-
Nam, KY, Lee, NR, Moon, BD, Song, GY, Shin, HS, Choi, JE, Changes of ginsenosides and color from black ginsengs prepared by steaming-drying cycles, Korean Journal of Medicinal Crop Science, (2012), 20, p27-35.
[https://doi.org/10.7783/kjmcs.2012.20.1.027]

-
Yokozawa, T, Yasui, T, Oura, H, Molecular biological analysis of the effects of ginsenoside-Rb2 on albumin mRNA in streptozotocin-induced diabetic rats, Journal of Pharmacy and Pharmacology, (1996), 48, p763-767.
[https://doi.org/10.1111/j.2042-7158.1996.tb03967.x]

-
Shukla, R, Kumar, M, Role of Panax ginseng as an antioxidant after cadmium-induced hepatic injuries, Food and Chemical Toxicology, (2009), 47, p769-773.
[https://doi.org/10.1016/j.fct.2009.01.002]

-
Song, CH, Seo, YC, Choi, WY, Lee, CG, Kim, DU, Chung, JY, Chung, HC, Park, DS, Ma, CJ, Lee, HY, Enhancement of antioxidative activity of Codonopsis lanceolata by stepwise steaming process, Korean Journal of Medicinal Crop Science, (2012), 20, p238-244.
[https://doi.org/10.7783/kjmcs.2012.20.4.238]

- Vom Saal, FS, Cooke, PS, Buchannan, DL, Palanza, P, Thayer, KA, Nagel, SC, Parmigiani, S, Welshons, WV, A physiologically based approach to the study of bisphenol A and other estrogenic chemicals on the size of reproductive organs, daily sperm production, and behaviour, Toxicology and Industrial Health, (1998), 4, p239-260.
-
Xu, J, Osuga, Y, Yano, T, Morita, Y, Tang, X, Fujiwara, T, Takai, Y, Matsumi, H, Koga, K, Taketani, Y, Tsutsumi, O, Bisphenol A induces apoptosis and G2-to-M arrest of ovarian granulosa cells, Biochemical and Biophysical Research Communications, (2002), 292, p456-462.
[https://doi.org/10.1006/bbrc.2002.6644]

-
Yang, M, Lee, HS, Hwang, MW, Jin, M, Effects of Korean red ginseng(Panax ginseng Meyer) on bisphenol A exposure and gynecologic complaints: single blind, randomized
clinical trial of efficacy and safety, BMC Complementary and Alternative Medicine, (2014), 14, -265.
[https://doi.org/10.1186/1472-6882-14-265]

-
Yue, PY, Wong, DY, Wu, PK, Leung, PY, Mak, NK, Yeung, HW, Liu, L, Cai, Z, Jiang, ZH, Fan, TP, Wong, RN, The angiosuppressive effects of 20(R)-ginsenoside Rg3, Biochemical Pharmacology, (2006), 72, p437-445.
[https://doi.org/10.1016/j.bcp.2006.04.034]