
추출조건에 따른 배암차즈기 추출물의 지방세포 분화 및 지방축적 억제 효과
© The Korean Society of Medicinal Crop Science All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was carried out to investigate the effects of Salvia plebeia R. Br. ethanolic extract with different aspects (stem/leaf and whole plant) on differentiation and lipid accumulation in 3T3-L1 preadipocytes. The morphological changes and the degrees of lipid accumulation in 3T3-L1 cells were measured by Oil Red O staining and intra-cellular triglyceride (TG) assay. The mRNA expressions of special peroxisome proliferation activated receptor- genes (PPAR), CCAAT/ enhancer-binding protein (C/EBPα), fatty acid synthase (FAS) and lipoprotein lipase (LPL) were detected by reverse transcriptase polymerase chain reaction (RT-PCR). The 50% ethanolic extracts (100 µg/mL) of stem and leaf (SALE) and 30% ethanolic extracts (100 g/mL) of whole plant (SAE) from Salvia plebeia R. Br. were significantly attenuated lipid accumulation during adipogenesis in 3T3-L1 cells. Ethyl acetate-soluble fractions (50 µg/mL) significantly inhibited lipid droplet accumulation in 3T3-L1 cells. In addition, SALE induced down-regulation of specific adipogenic transcriptional factors (C/ EBPα and PPARγ) and target genes (FAS and LPL) during adipogenesis. Salvia plebeia R. Br. may be used as a safe and efficient natural substance to manage obesity.
Keywords:
Salvia plebeia, 3T3-L1, Adipogenesis, C/EBPα, PPARγ, FAS, LPL서 언
비만 (Obesity)은 에너지 섭취와 소비의 밸런스 조절기능의 이상으로 지방조직이 과다하게 축적되어 각종 질병의 이환율 과 사망률을 높이는 대사성 만성질환으로 지방 대사와 당 대 사에 불균형을 초래하여 고지혈증, 고혈압, 동맥경화, 당뇨병, 지방간, 관절 이상 등 각종 대사성 질환, 심혈관계 질환 및 암을 유발하는 직접적인 상관관계를 보이는 것으로 밝혀져 그 심각성이 세계적으로 대두되고 있다 (Leung et al., 2003). 세 계보건기구 (WHO)의 보고에 따르면, 2008년 20세 이상 성인 중 5억 명이 비만으로, 세계 성인 인구의 11%에 달하는 숫자 이며, 2015년에는 15억 명으로 증가할 것이라 예측된 바 있다 (World Health Organization, 2013).
비만은 지방전구세포의 분화 및 지방생성 (adipogenesis) 과 정에 의하여 섭취한 영양소를 중성지방 (trigelyceride)의 형태 로 지방세포에 축적되어 발생한다. 미분화 지방전구세포 (preadipocyte)가 성숙한 지방세포 (matured adipocyte)로 분화되 는 과정은 세포의 형태, 호르몬 민감성 변화, 유전자 및 단백 질의 발현 등을 수반하며, CCAAT/enhancer binding proteins (C/EBPs)과 peroxisome proliferator activated receptor-γ (PPARγ)를 중심으로 adipogenesis를 조절하면서 분화가 진행되 는 것으로 알려져 있다 (Morrison and Farmer, 2000). 또한 지방세포 내의 지방구 (lipid droplet) 내에 주로 존재하고 있는 triglyceride의 분해와 이로 인한 glycerol의 유출은 세포 내 지 방의 축적을 조절하는 중요한 기작으로 보고되고 있다 (Frayn et al., 2003). 따라서 이러한 기작 조절을 기반으로 비만 예방 및 치료를 위한 세포 내 지방의 축적을 예방하거나 축적된 지 방을 분해하도록 자극하는 방안에 관한 연구가 최근 주목을 받고 있다 (Kim et al., 2012; Lee et al., 2012).
비만조절 요법 중 약물 치료제인 sibutramine과 orlistat 제 제의 부작용이 보고되면서 안전성과 유효성이 입증된 치료제 개발의 필요성이 절실한 실정이며 최근 안전성이 확보된 천연 물로부터 항비만 효능을 보유한 소재 발굴과 그에 대한 연구 가 다수 진행되고 있다. 항비만 활성의 생물학적 연구를 위해 mouse embryo로부터 유래된 지방전구세포인 3T3-L1 세포에 3-isobutyl-1-methylxanthine (IBMX), dexamethasone, insulin 등의 MDI 분화유도인자를 사용하는 연구가 주를 이루고 있 고 (Jessen and Stevens, 2002), 이에 대한 각종 천연물 추출 물의 항비만 연구가 최근까지 보고되고 있다 (Kim et al., 2011; Park et al., 2014; Jeong et al., 2014).
배암차즈기 (Salvia plebeia R. Br.)는 꿀풀과 (Labiatae)에 속하는 일년생 또는 이년생 직립초목으로 우리나라 전 지역에 서 자생한다. 설견초, 나인초, 수양이(水羊耳), 과송청(過冬靑) 이라고도 하며 경엽 (어린잎)은 식용으로 이용되고 있으며, 한 방에서는 향기로운 가지가 달린 풀이라 하여 여지초 (枝草)라 불리며 약용으로 사용된다. 예로부터 기침, 천식, 간염, 설사, 염증 등에 대한 효과가 알려져 있다 (Lim et al., 2007). 주 요 성분으로 flavonoid, polyphenol, saponin, 강심배당체, 불 포화 스테롤, 정유 등이 있으며 종자의 지방유 등이 보고되어 있다 (Shin et al., 2001). 현재 배암차즈기 추출물에 대한 항 산화, 항균, 항알레르기, 항염증, 콜레스테롤 유출 촉진 효과 등이 보고되어 있다 (Jo et al., 2010; Jeong et al., 2012; Park, 2003). 또한 배암차즈기의 flavonoid 성분인 hispidulin은 AMPK 활성화를 유도하여 난소암에서 apoptosis를 일으키며 (Yang et al., 2010), glioblastoma multiforme 뇌종양 세포에 서 mTOR 억제 및 p21을 유도기전으로 암세포 증식을 억제 하는 것으로 보고되어 있다 (Lin et al., 2010).
이에 본 연구에서는 배암차즈기 경엽 (지상부)과 전초의 주 정 및 용매분획물에 대한 지방세포분화 및 지방축적 억제 효 능을 비교 측정하였고 비만관련 기능성 소재 또는 식품첨가물 로써의 가능성을 확인하였기에 이를 보고하고자 한다.
재료 및 방법
1. 시약 및 재료
본 실험에 사용한 mouse embryonic fibroblast 3T3-L1 지 방전구 세포주는 American type culture collection (ATCC, Rockville, MD, USA)에서 분양받아 사용하였다. 세포배양에 필 요한 Dulbecco’s modified Eagle’s medium (DMEM) 및 fetal bovine serum (FBS), calf serum, penicillin-streptomycin, trypsin-EDTA는 Gibco® (Waltham, MA, USA)사에서, insulin, dexamethasone, 3-isobuthyl-1-methylxanthin, Oil red O, formalin, dimetyl sulfoxide (DMSO)은 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하였다. 세포 생존율 측정은 Promega (Madison, WI, USA)사의 MTS 시약 (CellTiter 96® Aqueous One Solution Cell Proliferation Assay)을 이 용하였으며, 중성지방 측정은 아산제약 (Seoul, Korea)의 Cleantech TG-S 제품을 구입하여 사용하였다. RNA 분리 및 RT-PCR을 위한 Trizol reagent는 Invitrogen Life Technologies (Waltham, MA, USA), Maxime RT PreMix Oligo dT 및 Maxime PCR PreMix i-StarTaq는 IntronBio (Seongnam, Korea)에서 구입하였고, Oligo-nucleotide (primer)는 Bioneer (Deajeon, Korea)에서 제작하여 사용하였다. 또한 시료 추출 및 분획물 제조 등에 사용한 시약 및 용매는 일급 또는 특급으로 ㈜SCI international (Seoul, Korea)로부터 구입하여 사용하였다.
2. 배암차즈기 주정추출물 및 분획물 제조
본 실험에 사용된 배암차즈기 (Salvia plebeia R. Br.)는 경 기도 여주 농가에서 재배된 것으로 경엽 지상부와 전초를 각 각 4월 초와 6월 중순에 수확하여 음지에서 건조한 것을 시료 로서 사용하였다. 실험에 사용된 배암차즈기 경엽 표본 (GCY- 201404)과 전초 표본 (GC-O-201406)은 ㈜와이디생명과학 기업부설 연구소에 보관되어 있다. 경엽지상부와 전초는 이물 질 제거 및 수세 후 열풍건조하였다. 배암차즈기의 생육시기 에 따른 최적 추출용매를 확보하기 위해 건조된 경엽 지상부 와 전초를 각각 100 g씩 추말 세절한 다음 각각 10배의 30, 50, 70, 95% (v/v) 주정용매에 침적하여 상온에서 24시간동안 침지추출 하였다. 추출물은 여과하여 여액과 잔사를 얻었고, 잔사를 동일한 방법으로 2회 반복하여 추출 및 여과하여 최종 배암차즈기의 경엽 지상부 주정추출물 (SALE) 및 전초 주정추 출물 (SAE)을 얻었다. 전초 시료의 극성에 따른 용매 분획물을 확보하기 위해 95% 주정조추출물 100 g을 증류수에 완전히 현탁시킨 후 용매극성에 따라 n-hexane (Hex), methylene chloride (MC), ethyl acetate (EA), n-butanol (BuOH)으로 순 차분획을 실시하여 전초 용매분획물을 확보하였다. 각각 얻어 진 추출물 및 분획물은 감압 농축 및 동결 건조하여 수율을 확 인하였고 –20°C 냉동보관하면서 실험에 사용하였다.
3. 3T3-L1 지방전구세포 배양 및 세포 독성 시험
3T3-L1 지방전구세포를 DMEM 배지 (10% calf serum, 100 units/mL penicillin, 0.1mg/mL streptomycin)에 첨가하여 37°C, 5% CO2 조건에서 75% confluence가 되도록 배양한 후, 0.25% (w/v) trypsin-0.53 mM EDTA 용액으로 처리하여 2 ~ 3일 간격으로 계대배양하여 실험에 사용하였다. 3T3-L1 세 포에 대한 세포생존율은 MTS 검정법으로 측정하였다. 96 well plate에 2 × 106 cells/mL로 분주하여 배양한 3T3-L1 세포 에 각각의 주정추출물 및 용매분획물을 10 ~ 100μg/mL으로 처리하고 37°C, 5% CO2 조건에서 24시간 배양하였다. 시료를 처리한 각각의 well에 MTS 시약을 첨가하여 2시간 반응 후 분광기를 이용하여 490nm에서 흡광도를 측정하여 세포생존 율을 확인하였다.
4. 3T3-L1 지방전구세포의 분화 유도 및 Oil Red O 염색
미분화된 3T3-L1 지방전구세포의 분화유도를 위해 6-well plate에 세포가 confluent 상태가 되도록 동일한 조건에서 배양 하고 48시간 후에 분화유도배지 (MDI; 10% FBS, 0.5 mM IBMX, 0.25 μM dexamethasone, 10μg/mL insulin가 포함된 DMEM)로 교환하여 지방전구세포의 분화를 유도 (D0)하였다. 분화유도 2일째 (D2)와 5일째 (D5)에 각각 10μg/mL insulin 이 포함된 분화유도 배지로 교환하여 지방전구세포의 분화를 촉진하였고 8일째까지 분화시켰다. 배암차즈기 추출물의 지방 전구세포의 지방세포로의 분화 억제 효능을 확인하기 위해 지 방전구세포 분화 시에 형성된 지방과립의 함량을 Oil Red O 염색법 (Jeong et al., 2014)을 이용하여 측정하였다. 각각의 배암차즈기 주정 추출물 및 분획물은 배지에 각각 100μg/mL 의 농도로 녹여 처리하였고, 배지만 처리한 것을 대조군 (MDI)으로 하였다. 세포분화 후 배지는 제거하고 PBS로 3회 세척한 후 10% formalin 용액으로 상온에서 1시간 동안 지방 세포를 고정시켰다. 60% isopropyl alcohol로 세척한 후 Oil Red O 용액으로 실온에서 30분간 염색하고 PBS로 세척한 후 현미경으로 지방세포의 염색정도를 관찰하였다. Isopropyl alcohol을 사용하여 염색된 지방을 용해하고 540nm의 흡광도 를 측정한 후 생성된 지방과립의 함량을 분석하였다.
5. 3T3-L1 지방세포 내 중성지질 함량 측정
3T3-L1 세포를 분화유도시킨 후 세포에 축적된 중성지방 (triglyceride, TG) 함량을 TG assay kit을 이용하여 정량법에 따라 측정하였다. 3T3-L1 세포분화 후 배지를 제거한 후 PBS로 세척하고 1 mM EDTA가 포함된 25 mM Tris buffer (pH 7.5)를 이용하여 lysis 시킨 후 13,000 rpm에서 20분간 원심분리하여 상등액만 취하여 Cleantech TG-S 시약을 첨가 하여 10분간 반응시킨 후 540nm에서 흡광도를 측정하였다. 중성지질의 함량은 중성지질 표준용액곡선을 이용하여 환산하 였으며, 이때 단백질 양을 Bradford (1976) 방법으로 정량하여 세포수를 보정하였다.
6. RT-PCR (Reverse-transcription polymerase chain reaction) 분석
3T3-L1 세포를 분화유도 시킨 후 8일째에 세포를 회수하였 고 세포 내 총 RNA는 Trizol reagent를 이용하여 분리하였다. cDNA 합성 및 RT-PCR은 Maxime RT PreMix Oligo dT와 Maxime PCR PreMix i-StarTaq을 이용하여 수행하였다. RT-PCR에 사용된 oligo-nucleotide의 염기서열과 annealing temperature (Tm)은 Table 1에 나타내었다. PCR 반응은 predenaturation; 95°C, 10분, denaturation; 95°C, 30초, annealing; 55 ~ 50°C, 30초, elongation; 72°C, 1분, final-elongation; 72°C, 5분으로 35 cycles 실시하였고, 반응물은 2% agarose gel에 전기영동한 후, EtBr 염색하여 UV transilluminator (UVP ChemiDoc-It, Upland, CA, USA)로 band를 관찰하였고, 정량 적 분석은 VisionWorksLS (version 7.1) 프로그램을 이용하여 측정하였다.
7. 통계분석
본 실험 결과는 Graphpad Prism® Version 4.0 (Graphpad Software, USA) 프로그램을 이용하여 평균 (mean) ±표준편차 (standard deviation, SD)로 표시하였다. 통계적 유의성은 Oneway ANOVA로 분석한 후, Tukey’s multiple comparison test 로 p < 0.05 수준에서 검정하였다.
결과 및 고찰
1. 배암차즈기 조추출물 및 용매분획물의 추출 수율
배암차즈기의 경엽과 전초의 건재 추말 시료를 각각 30%, 50%, 70%, 95% 주정용매로 추출한 조추출물과 전초 95% 주정조추출물을 용매극성에 따라 분획하여 얻은 분획물에 대 하여 추출수율을 측정하였다 (Table 2). 경엽조추출물 (SALE) 의 수율은 건조시료 중량 대비 약 17%였으며, 전초조추출물 (SAE)은 약 22%로 경엽의 추출수율보다 5% 정도 높았으며 모두 주정 함유량에 따른 수율 차이는 보이지 않았다. 전초의 용매분획물은 n-hexane 분획물이 74.5%로 가장 높은 수율을 나타내었고, MC, EA, BuOH 분획물은 약 3.5% 정도로 상대 적으로 매우 낮았다. 물분획물은 약 13%의 수율을 나타냈다.
2. 지방전구세포 3T3-L1에 대한 세포 독성
배암차즈기 경엽추출물 (SALE)과 전초추출물 (SAE) 및 전 초 용매분획물의 처리에 따른 3T3-L1 지방전구세포의 생존율 을 측정하기 위하여 MTS solution을 이용한 검정법을 실시하 였다. 그 결과 (Table 2), 경엽의 95% 주정추출물에서 세포 독성을 나타내었고, IC50 농도는 149.1μg/mL (p < 0.05)였다. 전초의 경우 모든 추출물 200μg/mL 처리 농도에서 세포독성 은 나타내지 않았다. 또한 전초 용매분획물의 경우 비극성인 n-hexane 및 MC 분획물에서 세포독성을 보였고, IC50 농도는 각각 92.4μg/mL, 77.2μg/mL (p < 0.05)였다.
3. 3T3-L1 지방세포 분화 및 지방생성 억제 효과
지방전구세포인 3T3-L1는 in vitro에서 분화유도물질인 MDI 를 첨가하였을 때 지방세포로 전환되며 세포내 지방을 축적 (adipogenesis)한다. 세포분화가 유도되는 동안 C/EBP family 와 PPARγ 등의 전사인자들의 전사 발현이 증가되고 이들 전 사인자들 사이의 상호 전사를 유도함으로써 지방세포 분화를 유도하는 것으로 알려져 있다 (Morrison and Farmer, 2000).
배암차즈기 추출물 및 용매분획물의 처리에 따른 3T3-L1 지방전구세포의 지방세포로의 분화 억제 효과는 Oil Red O 염색법을 이용하여 측정하였다. SALE 30%, 50%, 70%, 95% 주정추출물 각각 100μg/mL씩을 세포에 처리한 경우 (Fig. 1A), 각각 33%, 51%, 49%, 38% (p < 0.001)의 지방세 포 분화 억제활성을 나타내었으며, 50%와 70% 추출물에서 IC50 농도는 약 100μg/mL로 저해효과가 가장 높았다. 반면, SAE 주정추출물 각각 100μg/mL씩을 세포에 처리한 경우 (Fig. 1B), 70%, 95% 주정추출물에서는 저해효과를 보이지 않았으나, 30%, 50% 주정추출물에서 각각 32% 및 16% (p < 0.001)의 분화 저해활성을 나타내었다. 동일 처리 농도에서 SALE 추출물의 경우 지방분해 억제 효과가 더 우수하였다.
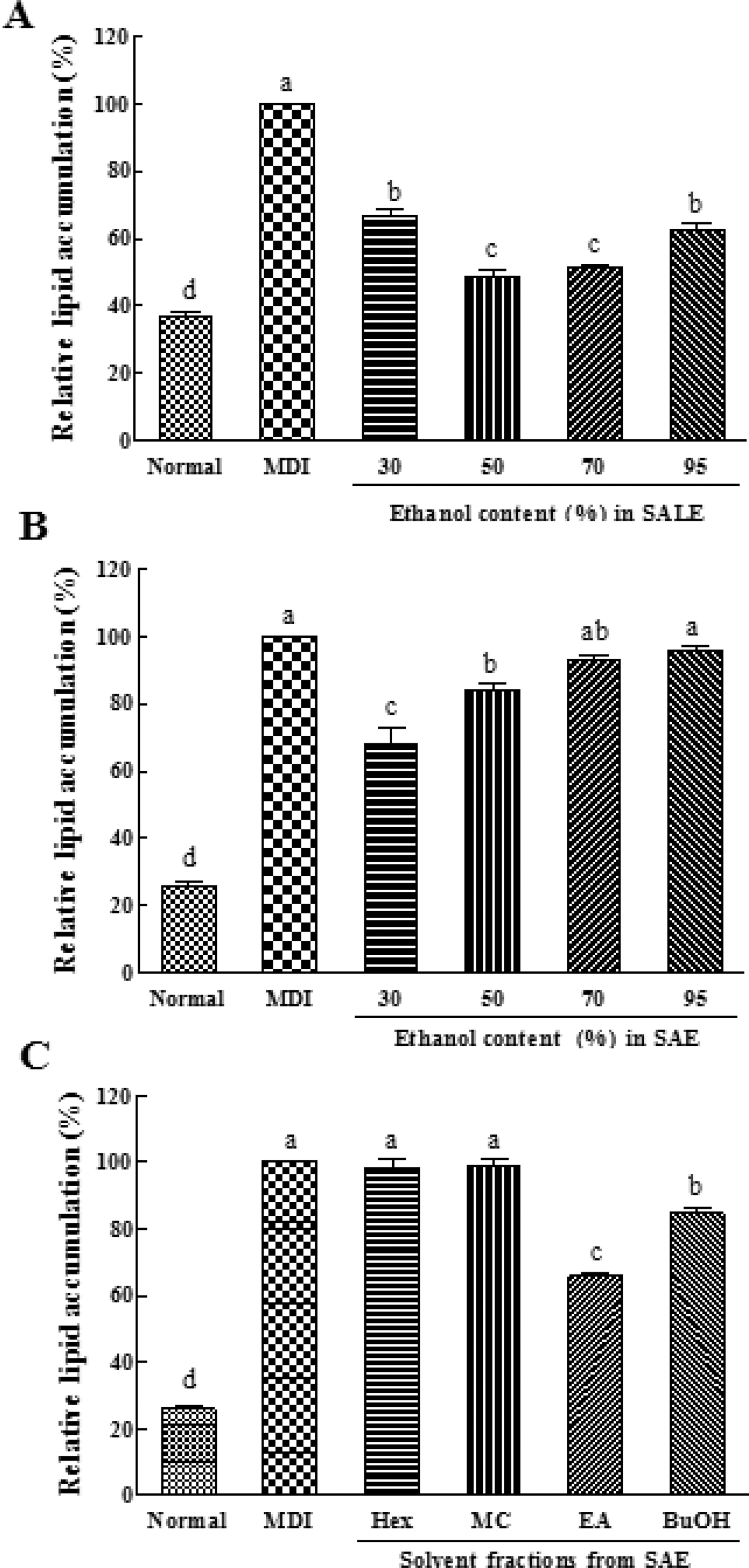
Inhibitory effect of Salvia plebeia R. Br. on the lipid accumulation in MDI-induced 3T3-L1 adipocytes.3T3-L1 cells were cultured in differentiation medium (MDI) with (A) SALE (100μg/ mL), (B) SAE (100 μg/mL), and (C) Solvent fractions from SAE (50μg/mL) during adipogenesis. The intercellular lipid accumulation contents of adipocytes were determined by Oil red O staining. Results are expressed as the mean ± SD. Values with different letter (a-d) within sample concentration are significantly different at p < 0.05. SALE; ethanolic extract of stem and leaf, SAE; ethanolic extract of whole plant, Solvent fractions; n-hexane, methylene chloride, ethyl acetate, and n-butanol from 95% SAE.
전초 조추출물로부터 얻어진 용매분획물의 지방세포분화 억 제 활성을 측정하였다. 세포 독성을 나타내지 않은 농도로서 각각 50μg/mL로 처리한 결과 (Fig. 1C), 비극성 n-hexane과 MC 분획물은 지방세포분화 억제 활성을 나타내지 않은 반면, BuOH 분획물이 15% (p < 0.001)의 약간의 활성을 나타내었으 며, EA의 분획물이 35%로 가장 우수한 저해활성 (p < 0.001) 을 나타내었다. Cho 등 (2007)은 배암차즈기 경엽을 메탄올 로 추출하여 추출액의 EA 분획물로부터 rosmarinic acid, luteolin-7-O-β-glucopyranoside, hispidulin-7-O-glucopyranoside 등을 구조 동정하였으며, 이 중 rosmarinic acid의 항산화활성 이 가장 높은 것으로 보고하였다. 최근 지방 세포 내 과도하 게 생성된 활성산소 (reactive oxygen species, ROS)는 지방전 구세포의 분화를 촉진시키거나 지방세포 주변에 위치한 macrophage를 자극하여 다른 활성산소종을 생성함으로서 비 만의 주요 원인으로 작용한다고 보고된 바 있다 (Lee et al., 2009).
4. 3T3-L1 지방세포에서의 중성지방 축적 억제 효과
지방세포 내 지방구의 형성이 증가하면서 중성지방 생성량 이 증가하고 지방축적에 관여하는 효소가 활성화되면서 점차 적으로 지방세포 내 지방 축적이 일어나게 된다 (Frayn et al., 2003).
본 연구에서 배암차즈기 추출물 및 용매분획물의 처리에 따 른 3T3-L1 지방전구세포의 지방세포로의 분화과정 시 지방세 포 내 중성지방의 축적에 미치는 영향을 확인하였다. 결과, 배 암차즈기 경엽 (SALE) 30%, 50%, 70%, 95% 주정추출물 각각 100μg/mL씩을 세포에 처리한 경우 (Fig. 2A), 28%, 41%, 35%, 28%의 중성지방 축적 저해활성을 나타내었고, 50% 주정추출물에서 가장 효과가 우수하였다. 반면, 배암차즈 기 전초 (SAE)의 주정 함량별 추출물에 대한 중성지방 축적 저해활성을 확인한 결과 (Fig. 2B), 각각 100μg/mL로 각각 처리했을 경우, 30% 주정추출물에서 38%의 분화 저해활성 (p < 0.001)으로 가장 우수하였으며, 50% 및 70% 주정추출물 에서 각각 24% (p < 0.001), 10% (p < 0.01)의 저해활성을 보 였고, 95% 주정추출물에서는 효과를 나타내지 않았다. 또한 전 초 조추출물로부터 얻어진 극성에 따른 용매분획물의 중성지 질 축적 저해활성을 측정한 결과 (Fig. 2C), 각각 50μg/mL로 처리했을 경우, BuOH 분획물이 14% (p < 0.01)의 약간의 활 성을 나타내었으며, EA의 분획물이 46%로 가장 우수한 저해 활성 (p < 0.001)을 나타내었다. 반면, 비극성 n-hexane과 MC 분획물은 지방세포 내 중성지방의 축적 억제 활성을 보이지 않았다. 배암차즈기 경엽 50%과 전초의 30% 조추출물에 대 한 성분분석패턴이 유사하여 전초의 EA 분획물의 활성 결과 가 경엽에서도 동일할 것으로 사료된다.
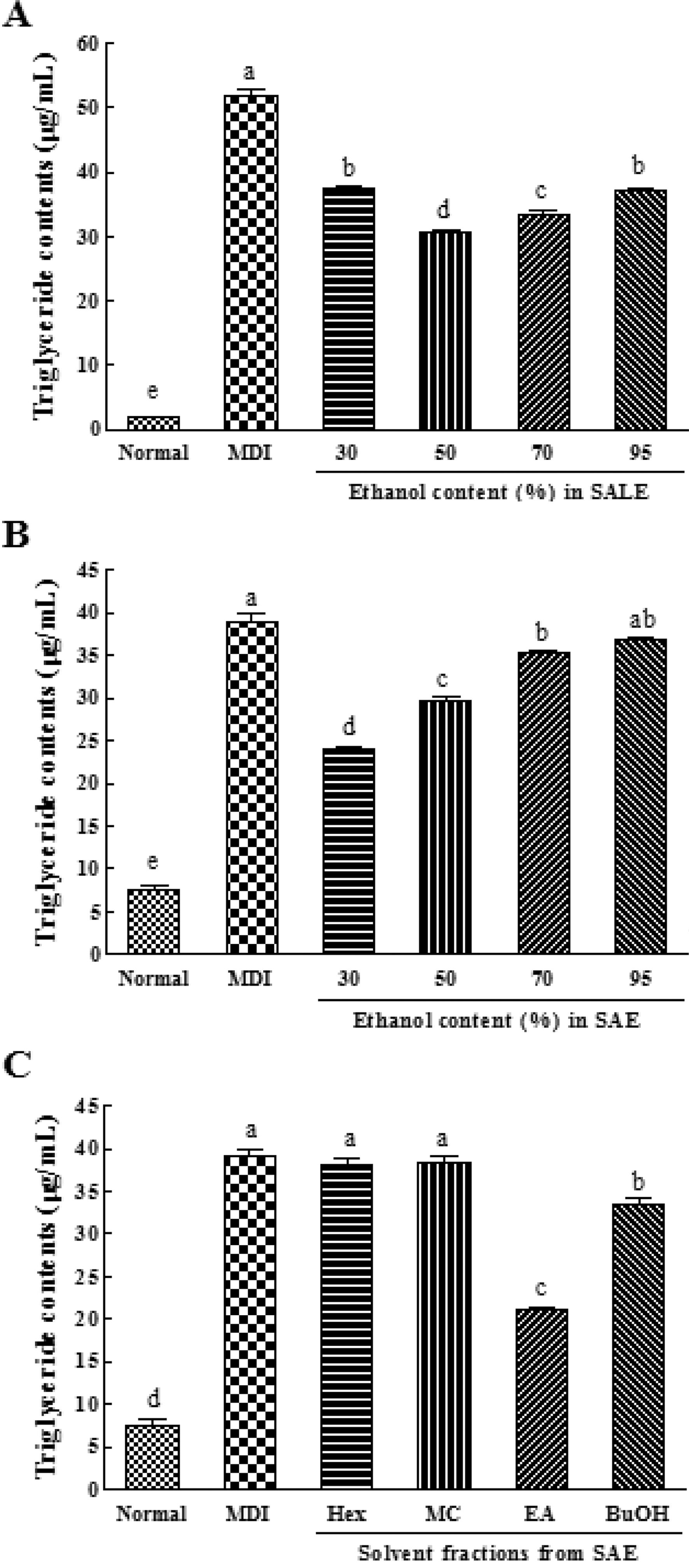
Inhibitory effect of Salvia plebeia R. Br. on the triglyceride contents in MDI-induced 3T3- L1 adipocytes.3T3-L1 cells were cultured in differentiation medium (MDI) with (A) SALE (100μg/mL), (B) SAE (100μg/mL), and (C) Solvent fractions from SAE (50μg/mL) during adipogenesis. The intercellular triglyceride contents of adipocytes were determined by TG-S staining. Results are expressed as the mean ± SD. Values with different letter (a-e) within sample concentration are significantly different at p < 0.05. SALE; ethanolic extract of stem and leaf, SAE; ethanolic extract of whole plant, Solvent fractions; n-hexane, methylene chloride, ethyl acetate, and n-butanol from 95% SAE.
지방세포 내 축적된 중성지방이 분해되면 glycerol과 지방산 으로 나누어지는데 glycerol의 유출은 세포 내 지방의 축적을 조절하는 중요한 기전으로 3T3-L1 지방세포계에서는 free glycerol의 함량이 지방구 내 중성지방의 분해 정도를 간접적 으로 나타내는 척도가 된다고 알려져 있다 (Slavin et al., 1994). 분화된 3T3-L1 지방세포에 경엽추출물 (SALE)과 전초 추출물 (SAE)을 처리한 후 배지내로 분비된 free glycerol의 함량을 측정한 결과 대조군 (MDI)과 비교하여 분비량에서 통 계유의적인 차이는 없었다 (결과 미제시). 따라서 배암차즈기 추출물은 지방세포의 중성지방 합성에는 관여하나 기 축적된 세포내 중성지방의 분해에는 관여하지 않음을 확인하였으며, 이때 경엽 50% 주정추출물, 전초 30% 주정추출물 및 EA 용 매분획물에서 저해 효과가 가장 높았다.
5. 지방세포 분화 전사인자 C/EBPα 및 PPARγ mRNA 발현 측정
지방세포 분화유도 후 세포는 형태의 변화가 유발되고 일정 세포분열이 동반되며 5 ~ 7일간에 지방세포의 표현형을 나타 내게 된다. 지방세포의 지방세포 내 지방 합성과 저장에 관여 하는 효소들의 발현을 조절하는 전사인자는 분화초기에 발현 이 유도되고 분화 후기가 되면 다양한 adipogenic 유전자들의 발현을 유도하며, 그 발현양이 현저히 증가된다. C/EBPβετα 와 C/EBPδ는 각각 IBMX와 dexamethasone에 의해 분화과정 의 초기에 발현이 유도되며, 분화 후기에 C/EBPα와 PPARγ가 발현되면서 다수 종류의 지방세포 특이성 mRNA 등의 전사 활성화가 유도되는 것으로 알려져 있다 (Brun et al., 1996).
배암차즈기 경엽 주정추출물 (SALE)은 지방세포 분화 및 지방축적 저해 효과가 가장 높게 나타났으며 현재 식용으로 이용되고 있어 기능성 소재로서 개발 가능이 용이하다. 본 연 구에서는 배암차즈기 경엽 주정추출물 (SALE)에 대하여 지방 세포 분화 전사인자인 C/EBPα 및 PPARγ와 이들의 표지 유 전자인 lipoprotein lipase (LPL) 및 fatty acid synthase (FAS) 발현에 미치는 영향을 확인하였다. 그 결과 (Fig. 3), 분화 배지만 처리한 군 (MDI)에서 이들 전사인자 및 유전자 의 발현은 현저하게 증가되는 양상을 나타내었다. 30% SALE 10μg/mL 처리한 경우, C/EBPα와 PPARγ에 대한 mRNA 발 현 억제율은 각각 94.2%, 77.7% (p < 0.001)로 매우 높았으나, FAS 및 LPL 유전자에 대한 발현 억제율은 각각 33.2%, 23.5%로 상대적으로 낮았다. C/EBPα는 지방전구세포에서 인 슐린 민감성을 유도하고, 지방생성 및 PPARγ와 더불어 지방 세포로의 분화 후기과정에서 중요한 역할을 하며 분화와 관련 된 유전자들의 발현을 조절한다 (Freytag et al., 1994). 또한 PPARγ는 지방조직에 주로 존재하고 지방형성을 총괄적으로 조절하며 지방세포를 분화시키는 능력이 다른 전사인자들보다 월등히 높고 지방세포로 분화시키는 분화된 상태를 유지하는 데 필수적이다. PPARγ는 C/EBPs에 의해 그 발현량이 조절되 며 그 중에서도 C/EBPβ에 의해 지방세포분화의 초기단계에 PPARγ의 발현이 유도된다고 알려져 있다 (Schroeder-Gloeckler et al., 2007).
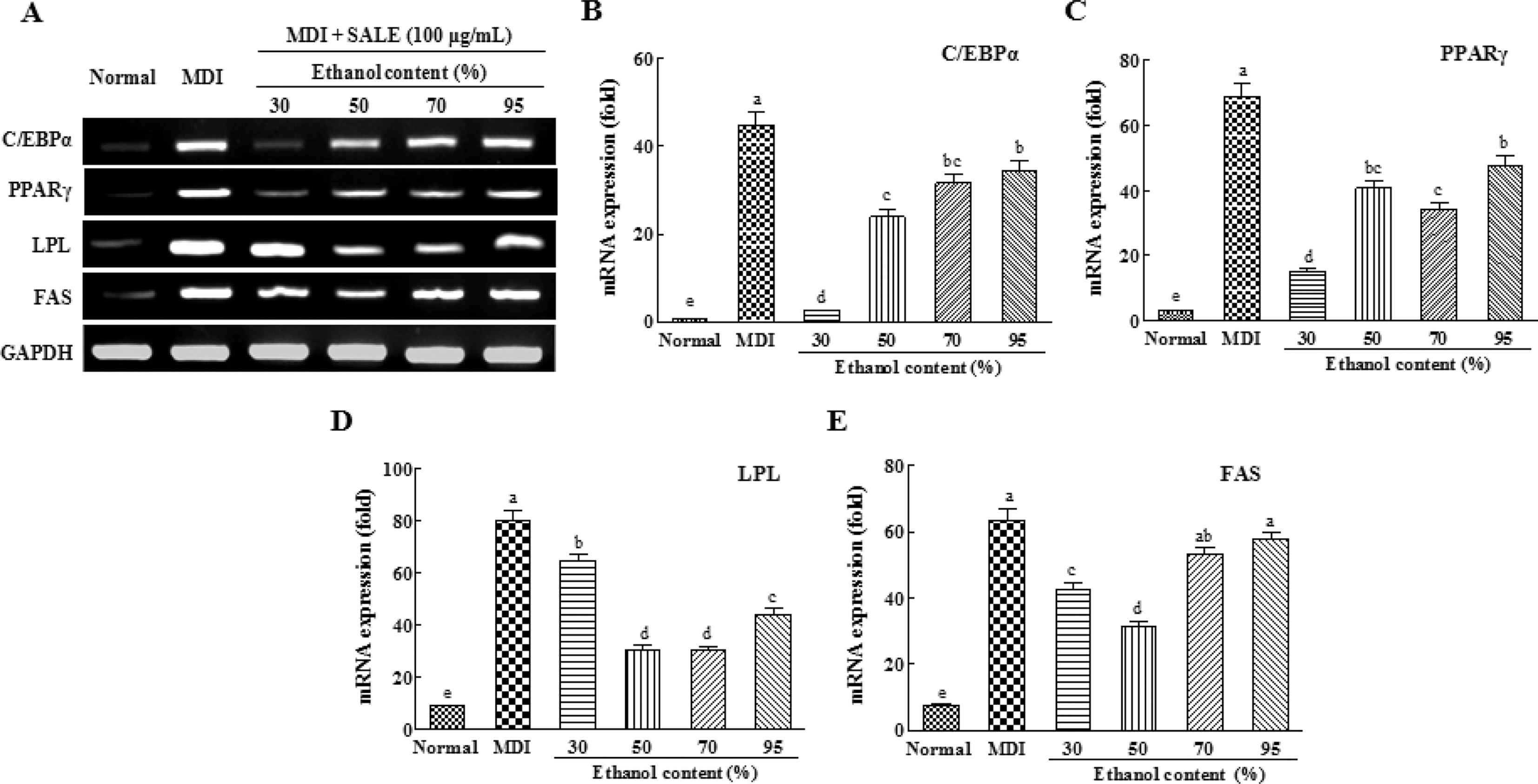
Effect of SALE on the mRNA expression of transcriptional factors and adipocytes-specific genes.3T3-L1 cells were cultured in differentiation medium (MDI) with SALE (100μg/mL) for 8 days. The mRNA levels of C/EBPα, PPARγ, LPL and FAS were analyzed by RT-PCR. Relative mRNA expression was normalized with GAPDH expression. The values were calculated as fold of gene expression of the MDI-treated group. Results are expressed as the mean ± SD of triplicate experiments. Values with different letter (a-e) within sample concentration are significantly different at p < 0.05. SALE; ethanolic extract of stem and leaf.
반면, 50% 주정추출물은 상기 C/EBPα와 PPARγ에 대한 mRNA 발현 억제율은 각각 46.6%, 44.0% (p < 0.001)였으나, 상대적으로 FAS 및 LPL 유전자 mRNA 발현 억제율은 각각 52.8% 및 63.6% (p < 0.001)로 더 높았다. 70% 주정추출물의 경우 PPARγ 및 LPL에 대해서만 각각 53.2%, 61.2% (p < 0.001)의 발현 억제효과를 보였다. 전사인자인 PPARγ가 발현되면 이의 표지 유전자인 FAS, LPL, aP2 등 adipogenic 유전자들의 발현이 유도 및 발현 양이 크게 증가하며, triglyceride의 축적과 같은 형태적 특징을 나타낸다 (Flier and Maratos Flier, 1998). 특히, 지방대사에 관여하는 지방합성 효 소인 FAS는 지방조직에서 가장 많이 발현되며 지방세포분화 의 최종인자로써 항비만 효과의 지표중 하나로 알려져 있다. LPL은 혈중 지방산을 세포 내로 전달하는 효소로서 지방조직 내 LPL로 인해 세포내로 유입된 fatty acid가 triglyceride로 전 환되어 저장되므로 LPL의 발현 및 활성이 억제되면 lipoprotein 내의 분해되지 않은 triglyceride가 체내로의 흡수가 저해되어 체중감소의 효과를 나타낼 수 있다고 알려져 있다 (Lafontan and Langin, 2009). Lee 등 (2009)은 미나리 (Oenanthe javanica) 및 율무 (Coicis lachryma-jobi L. var.) 추출물이 지질대사 관련 효소인 LPL의 활성을 억제시켜 중성지방의 지 방세포 유입 억제 활성을 나타내는 것으로 보고하였고, Seo 등 (2011)은 회향종자 (Foeniculi fructus) 추출물이 고지방식 이 유도 비만 마우스에서 LPL의 활성을 억제시켜 세포내로 지방산의 유입을 억제하는 항비만 효능이 있음이 보고하였다. 상기 결과로부터 배암차즈기 경엽추출물 (SALE)의 C/EBPα 와 PPARγ에 대한 발현 저해 효과는 30% 주정추출물에서 현 저히 우수하였고, 50% 주정추출물은 C/EBPα, PPARγ, FAS 와 LPS에 대하여 모두 50% 이상의 높은 발현 억제율을 나타 내었다. 또한 70% 주정추출물은 PPARγ 및 LPL 발현을 억제 하였다.
본 연구결과로서 배암차즈기 경엽 및 전초추출물은 3T3-L1 지방전구세포의 지방세포로의 분화 및 지방세포 내 중성지방 축적을 현저히 억제시켰으며, 전초보다 경엽에서, 극성용매추 출물 및 에틸아세테테이트 분획물에서 더 우수한 효과를 나타 내었다. 또한 주요 지방세포분화 전사인자인 C/EBPα와 PPARγ의 발현을 억제시킴으로써 FAS 및 LPL의 지방세포 표 지 유전자 발현량을 감소시키고 최종 세포 내 중성지방의 생 성 및 축적을 감소시키는 것으로 확인하였으며, 이는 배암차 즈기 추출물이 비만을 예방할 수 있는 우수한 기능성 식품 소 재로서의 가능성을 보여주었다.
감사의 글
본 논문은 농림축산식품부 고부가가치식품기술개발사업 연 구비 지원에 의해 이루어진 연구결과의 일부로 이에 감사드립 니다.
REFERENCES
-
Bradford, MM, A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Analytical Biochemistry, (1976), 72, p248-254.
[https://doi.org/10.1006/abio.1976.9999]

-
Brun, RP, Kim, JB, Hu, E, Altiok, S, Spiegelman, BM, Adipocyte differentiation: A transcriptional regulatory cascade, Current Opinion in Cell Biology, (1996), 8, p826-832.
[https://doi.org/10.1016/s0955-0674(96)80084-6]

- Cho, KJ, Development of functional medicinal food materials and separation of physiological active substances from native plants, (2007), Ministry of Agriculture. Food and Rural Affairs, Sejong. Korea, p3-146.
-
Flier, JS, Maratos, FE, Obesity and the hypothalamus: Novel peptides for new pathways, Cell, (1998), 92, p437-440.
[https://doi.org/10.1016/s0092-8674(00)80937-x]

-
Frayn, KN, Karpe, F, Fielding, BA, Macdonald, IA, Coppack, SW, Integrative physiology of human adipose tissue, International Journal of Obesity, (2003), 27, p875-888.
[https://doi.org/10.1038/sj.ijo.0802326]

-
Freytag, SO, Paielli, DL, Gilbert, JD, Ectopic expression of the CCAAT/enhancer-binding protein alpha promotes the adipogenic program in a variety of mouse fibroblastic cells, Genes and Development, (1994), 8, p1654-1663.
[https://doi.org/10.1101/gad.8.14.1654]

-
Gregoire, FM, Smas, CM, Sul, HS, Understanding adipocyte differentiation, Physiological Reveiws, (1998), 78, p783-809.
[https://doi.org/10.1152/physrev.1998.78.3.783]

-
Jeong, HR, Sung, MS, Kim, YH, Ham, HM, Choi, YM, Lee, JS, Anti-inflammatory activity of Salvia plebeia R. Br. leaf through heme oxygenase-1 induction in LPS-stimulated RAW264.7 macrophages, Journal of the Korean Society of Food Science and Nutrition, (2012), 41, p888-894.
[https://doi.org/10.3746/jkfn.2012.41.7.888]

-
Jeong, HY, Jin, SJ, Nam, SW, Hyun, SK, Kim, SG, Kim, BW, Kwon, HJ, Anti-adipogenic activity of cortex ulmi pumilae extract in 3T3-L1 preadipocytes, Journal of Life Science, (2014), 24, p137-147.
[https://doi.org/10.5352/jls.2014.24.2.137]

-
Jessen, BA, Stevens, GJ, Expression profiling during adipocyte differentiation of 3T3-L1 fibroblasts, Gene, (2002), 299, p95-100.
[https://doi.org/10.1016/s0378-1119(02)01017-x]

- Jo, SY, Lee, UY, Kim, EY, Lee, SJ, Her, JW, Yoon, TJ, A study on the anti-inflammatory and anti-allergic effect of Salvia plebeia R. extracts, Korean Journal of Pharmacognosy, (2010), 41, p31-37.
-
Kim, HY, Lim, SH, Kwon, CJ, Park, YH, Lee, KJ, Park, DS, Kim, KH, Kim, SM, Park, CB, Effect of Lythrum salicaria L. ethanol extract on lipid metabolism and anti-obesity in rat fed high fat diet, Korean Journal of Medicinal Crop Science, (2011), 19, p319-324.
[https://doi.org/10.7783/kjmcs.2011.19.5.319]

-
Kim, HJ, Kang, CH, Kim, SK, Anti-adipogenic effect of Undaria pinnatifida extracts by ethanol in 3T3-L1 adipocytes, Journal of Life Science, (2012), 22, p1052-1056.
[https://doi.org/10.5352/jls.2012.22.8.1052]

-
Lafontan, M, Langin, D, Lipolysis and lipid mobilization in human adipose tissue, Progress in Lipid Research, (2009), 48, p275-297.
[https://doi.org/10.1016/j.plipres.2009.05.001]

-
Lee, HJ, Chung, MJ, Kim, DJ, Choe, M, Effects of Oenanthe javanica, Coicis lachryma-jobi L. var., and Plantaginis asiatica L. water extracts on activities of key
enzymes on lipid metabolism, Journal of the Korean Society of Food Science and Nutrition, (2009), 38, p1516-1521.
[https://doi.org/10.3746/jkfn.2009.38.11.1516]

-
Lee, JK, Kang, MG, Kim, YH, Lee, JS, Screening of medicinal plants containing lipase inhibitor and optimal extraction conditions, Korean Journal of Medicinal Crop Science, (2012), 20, p1-7.
[https://doi.org/10.7783/kjmcs.2012.20.1.001]

-
Lee, OH, Kwon, YI, Hong, HD, Park, CS, Lee, BY, Kim, YC, Production of reactive oxygen species and changes in antioxidant enzyme activities during differentiation of 3T3-L1 adipocyte, Journal of the Korean Society for Applied Biological Chemistry, (2009), 52, p70-75.
[https://doi.org/10.3839/jksabc.2009.012]

-
Leung, WY, Thomas, GN, Chan, JC, Tomlinson, B, Weight management and current options in pharmacotherapy: Orlistat and sibutramine, Clinical Therapeutics, (2003), 25, p58-80.
[https://doi.org/10.1016/s0149-2918(03)90009-9]

- Lim, JA, Yun, BW, Baek, SH, Antioxidative activity and nitrite scavenging ability of methanol extract from Salvia plebeia R. Br, Korean Journal of Medicinal Crop Science, (2007), 15, p183-188.
-
Lin, YC, Hung, CM, Tsai, JC, Lee, JC, Chen, YL, Wei, CW, Kao, JY, Way, TD, Hispidulin potently inhibits human glioblastoma multiforme cells through activation of AMPactivated protein kinase(AMPK), Journal of Agricultural and Food Chemistry, 58, p9511-9517.
[https://doi.org/10.1021/jf1019533]

-
Morrison, RF, Farmer, SR, Hormonal signaling and transcriptional control of adipocyte differentiation, Journal of Nutrition, (2000), 130, p3116-3121.
[https://doi.org/10.1093/jn/130.12.3116s]

-
Park, SH, Kim, JL, Kang, MK, Gong, JH, Han, SY, Shim, JH, Lim, SS, Kang, YH, Sage weed (Salvia plebeia) extract antagonizes foam cell formation and promotes cholesterol efflux in murine macrophages, International Journal of Molecular Medicine, (2012), 30, p1105-1112.
[https://doi.org/10.3892/ijmm.2012.1103]

-
Park, YJ, Kim, MS, Kim, HR, Kim, JM, Hwang, JK, Yang, SH, Kim, HJ, Lee, DS, Oh, HC, Kim, YC, Ryu, DG, Lee, YR, Kwon, KB, Ethanol extract of Alismatis rhizome inhibits adipocyte differentiation of OP9 cells, Evidence-Based Complementary and Alternative Medicine, (2014), 2014, p1-9.
[https://doi.org/10.1155/2014/415097]

- Schroeder-Gloeckler, JM, Rahman, SM, Janssen, RC, Qiao, L, Shao, J, Roper, M, Fischer, SJ, Lowe, E, Orlicky, DJ, McManaman, JL, Palmer, C, Gitomer, WL, Huang, W, O'Doherty, RM, Becker, TC, Klemm, DJ, Jensen, DR, Pulawa, LK, Eckel, RH, Friedman, JE, CCAAT/enhancer-binding protein beta deletion reduces adiposity, hepatic steatosis and diabetes in Lepr(db/db) mice, Journal of Biological Chemistry, (2007), 282, p15717-15729.
-
Seo, DJ, Kim, TH, Kim, HS, Choe, M, Effects of Foeniculi fructus water extracts on activities of key enzymes of lipid metabolism related with obesity, Korean Journal of Plant Resources, (2011), 24, p181-188.
[https://doi.org/10.7732/kjpr.2011.24.2.181]

- Shin, MK, Kim, SK, Lee, SK, Yang, EY, Lee, HO, Baek, SH, Cytotoxicity and antimicrobial effect of the extract of Salvia plebeia, Korean Journal of Pharmacognosy, (2001), 32, p55-60.
- Slavin, BG, Ong, JM, Kern, PA, Hormonal regulation of hormone-sensitive lipase activity and mRNA levels in isolated rat adipocytes, Journal of Lipid Research, (1994), 35, p1535-1541.
- World Health Organization(WHO), Obesity and overweight. http://www.who.int/mediacentre/factsheets/fs311/en/index.html, (2013).
-
Yang, JM, Hung, CM, Fu, CN, Lee, JC, Huang, CH, Yang, MH, Lin, CL, Kao, JY, Way, TD, Hispidulin sensitizes human ovarian cancer cells to TRAIL-induced apoptosis by AMPK activation leading to Mcl-1 block in translation, Journal of Agricultural and Food Chemistry, (2010), 58, p10020-10026.
[https://doi.org/10.1021/jf102304g]

