
기내배양을 통한 황기 부정근의 생산과 유효성분 분석
© The Korean Society of Medicinal Crop Science All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
A series of studies were conducted to optimize adventitious root induction in vitro from explants of Astragalus membranaceus using various nutrient media supplemented with plant hormones.
Levels of active components were analyzed from adventitious roots induced under different media conditions. Among the different media conditions, Murashige and Skoog medium supplemented with 1.0㎎• ℓ −1 indole-3-butyric acid resulted in the greatest adventitious root induction rate. The amount of the major active component of the adventitious roots of Ama1, calycosin-7-O-β-D-glucopyranoside was higher than that of other adventitious root samples.
These results suggest that the adventitious roots of A. membranaceus could be used for the commercial production of medicines.
Keywords:
Astragalus membranaceus, Adventitious Roots, Calycosin-7-O-β-D-Glucopyranoside서 언
황기는 단너삼이라고도 하며 콩과의 다년생 초본식물로 학명 은 Astragalus membranaceus, 약명은 Astragali Radix 이다. 황기는 뿌리를 그대로 또는 주피를 제거하여 사용한다. 황기 는 주산지인 한국, 중국, 몽골 등 아시아 지역에 주로 분포하 는 것으로 알려져 있으며 한국에서는 최근 충북 제천, 강원도 정선이 주산지를 이루고 있으며 그 외 강원도 영월, 경북 봉 화 등지에도 재배하고 있다. 한국에서는 황기를 주로 식품과 한약재로서 재배하고 있으며, 그 뿌리는 원뿌리가 곧게 뻗으 며 외피는 황갈색이지만 잘라 보면 둘레는 유백색이고 속은 황백색을 띈다. 황기의 뿌리는 독성이 없어 안전하면서도 다 양한 약리효능이 있기 때문에 식용과 약용으로 모두 사용되는 주요 약초이다. 황기는 전통적으로 피로, 식욕감퇴, 자연발한, 호흡곤란 등의 증세를 치료하고 쇠약해진 기운을 회복시켜주 는 약재로 많이 사용되어 왔으며, 이외에도 항염증 및 항고혈 압, 간장보호, 항산화, 항바이러스, 심장혈관보호, 면역증진활 성, 항노화 등의 효능이 보고된 바 있다 (Kim et al., 2007; Zhang et al., 1984, 2003; Dong et al., 2003; Wang and Feng, 2000; Kajimura et al., 1996; Lee et al., 2003; Du et al., 2012; Lei et al., 2003). 최근에는 새로운 cycloartane type saponin 물질이 발견되어 항염증효과를 비롯해 항암효과, 골다공증 개선 및 관절연골 분해 억제효과 등에 대하여 보 고되기도 하였다 (Lee et al., 2013; Cho and Leung, 2007; Kim et al., 2012b; Choi et al., 2005). 이러한 다양한 활성은 황기가 triterpenoid glycosides, flavonoid 및 polysaccharide와 같은 다양한 생리활성 화합물들을 함유하고 있기 때문이다 (Liu et al., 2011). 황기의 주요 triterpenoid glycosides로는 astragalosides 화합물이 알려져 있으며, 연근별, 수확시기별 astragalosides 함량변이가 보고되기도 하였다 (Kim et al., 2012a). 특히 황기의 flavonoid 성분은 다양한 생리활성의 주 요 활성물질로 평가되고 있다 (Kim and Kim, 1997, 2000). 그중에도 calycosin-7-O-β-D-glucopyranoside는 항염증 및 골 관절염 억제효과가 보고된 바 있어 관절건강 개선 기능성 원 료로 주목받고 있다 (Choi et al., 2005, 2007).
따라서 황기 뿌리추출물은 다양한 형태의 건강식품으로써의 가능성뿐만 아니라 추출물의 분리, 정제를 통하여 의약품 개 발도 가능할 것으로 기대되고 있다. 건강식품이나 의약품 원 료로 사용되기 위해서는 계속적인 황기의 공급이 필요하나 공 급량이 증가되기 위해서는 많은 경작지가 필요하며 황기의 수 확시기까지는 평균적으로 3 - 4년에 걸친 재배와 관리가 필수 적이다 (Ma et al., 2000). 따라서 최근 연구자들은 이러한 재배적인 문제점을 해결하기 위해 식물 조직배양기술을 이용 하여 기내배양 시스템을 계속적으로 개발하고 있으며 성공적 인 사례로 인삼 배양근이 있다 (Kim et al., 2003; Paek and Hahn, 2005; Jeong et al., 2006; Sivakumar et al., 2006). 황기를 대상으로 Agrobacterium rhizogenes를 이용한 모상근 형성과 호르몬을 이용한 부정근 형성에 대한 보고가 있으며, 황기 모상근이 재배적인 문제점을 해결하고 이용할 수 있는 잠재력을 가진다고 하였다 (Hirotani et al., 1994; Du et al., 2003; Ionkova et al., 2010; Wu et al., 2011; Thwe et al., 2012). 또한 선행연구자들에 의하면 조직배양법에 의해 생산 된 식물의 캘러스나 조직이 재배식물과 동일한 약효성분을 가 지며 이를 대량으로 생산하여 제조된 엑기스나 식물 사포닌으 로 재배식물의 원료를 대체하여 의약품 및 건강음료 등의 원 료로 사용할 수 있을 것이라고 보고하였다 (Yoshikawa and Furuya, 1987; Staswick, 1992; Lee et al., 2004). 특히, 황 기 추출물을 이용한 반복경구투여 독성시험에서도 투여가능 최 대 용량으로 실험하였을 때 독성이 나타나지 않았기 때문에 안 전한 천연물임이 보고되었다 (Park et al., 2013). 따라서 약용 작물 특히, 장기간 재배시기가 소요되는 뿌리작물에 대해 유용 성분을 대량으로 생산할 수 있는 기내배양 시스템이 계속적으 로 연구되어야 한다.
본 연구에서는 황기 유용물질 생산량 증대에 효과적인 부정 근을 유도하기 위하여 식물 호르몬인 IBA를 농도별로 배지 에 첨가하여 이상적인 배지조건을 확립하고 황기의 유효성 분인 calycosin-7-O-β-D-glucopyranoside, calycosin 그리고 formononetin을 HPLC 분석으로 비교 하였다. 이를 바탕으로 황기 부정근의 대량생산을 통해 건강식품 및 의약품을 개발할 수 있는 기초기반을 마련하는 것이 본 연구의 목적이다.
재료 및 방법
1. 식물재료
식물재료는 인삼특작부 약용작물과 시험포장에서 육성한 황 기 (Astragalus membranaceus)식물체를 사용하였다. 부정근을 생산하기 위하여 황기종자를 1% NaOCl 5분, 70% EtOH 3 분간 표면 살균 후 멸균수에서 3회 세척하여 1/2 MS (Murashige and Skoog, 1962; Duchefa Biochemie, Haarlem, Netherlands)배지에 치상하였고 1일 16시간 조명, 25 ± 2°C, 3000럭스의 광량으로 조절되는 배양실에서 생육시키며 무균발 아를 유도하였다.
2. 부정근 생산을 위한 황기 캘러스 유도
부정근 유도를 위해 잎, 줄기, 뿌리 절편을 재료로 사용하 였다. 각 부위별 절편은 0.5㎝의 길이로 절단하였다. 캘러스 유도배지는 indole-3-butyric acid (IBA)를 각각 3, 4, 5mg• ℓ–1로 하고 3% sucrose에 0.35% gelite가 첨가된 고체 1/2 MS 배지를 사용하였다. 배양조건은 1일 16시간 조명, 25 ± 2°C, 3000럭스의 광량으로 조절되는 배양실에서 4주간 배 양하였다. 캘러스 유도배지에 접종된 황기 부위별 절편에서 캘 러스를 유도한 후 각각의 부정근을 약 0.5㎝로 절단하여 1, 2, 3, 4, 5mg• ℓ–1 IBA와 3% sucrose, 0.35% gelite가 첨가 된 고체 MS 배지로 옮겨 증식하였다. 배양조건은 캘러스 유 도조건과 동일한 환경에서 2주간 배양하였다. 부정근의 진탕 배양을 위해 증식배지에서 배양된 부정근 1 g (FW)을 1, 0.5mg IBA와 3% sucrose, 0.35% gelite가 첨가된 액체 MS 배지 30mℓ에 넣어 인큐베이터에서 진탕배양 하였다. 배양조 건은 암조건으로 25 ± 2°C에서 2주간 배양하였다.
3. 분석 시약 및 기기
황기 부정근의 정량분석에 사용된 지표성분 (calycosin-7-O- β-D-glucopyranoside, calycosin, formononetin)은 ChromaDex 사 (Santa Ana, CA, USA)로부터 구입하여 사용하였다. 분석에 사용된 acetonitrile은 HPLC급 용매 (J. T. Baker, Phillipsburg, NJ, USA)를 사용하였고 황기의 추출에는 주정 (Daehan Ethanol life Ltd., Seoul, Korea)을 사용하였다. 황기 지표성분 분석 장비 는 Agilent 1100 series HPLC system (Agilent Technologies, Wilmington, DE, USA)을 사용하였다. 그 외 기타 시약은 Sigma Chemical Co. (St. Louis, MO, USA) 및 Junsei Chemical Co. (Tokyo, Japan)의 일급 또는 특급 시약을 사용하였다.
4. 추출조건
성분 분석을 위해 황기 부정근은 앞서 연구된 배양조건에서 가장 우수하게 배양된 부정근 4개 라인 (Ama1, Ama2, Ama3, Ama4)을 선발하여 사용하였다. 각 시료는 동결건조기 에서 48시간 건조하고 커터기 (Hanil, Seoul, Korea)를 이용해 조분쇄 하고, 30 g씩 정량하여 추출시료에 이용하였다. 선행연 구에서 추출물 및 지표성분의 수율을 확인한 결과 50% EtOH 를 사용하여 추출 하였을 때 수율이 가장 높은 것을 확인하였 고 (Kim et al., 2013), 추출을 위하여 각 분석 시료에 50% EtOH를 300mℓ을 넣은 후, 80°C 수조에서 40분간 2회 반복 환류추출을 실시하였다. 추출된 시료는 rotary evaporator (N1000-S, Eyela, Tokyo, Japan)로 농축하였고, 건조된 시료 10mg을 1mℓ 50% MeOH에 녹인 후 0.45μm membrane filter (Waters, Milford, MA, USA)로 여과하여 HPLC 분석 을 실시하였다.
5. 분석조건
HPLC 분석에 사용된 컬럼은 Thermo Hypersil (4.6 × 250mm, 5μm, Thermo Fisher Scientific, San Jose, CA, USA)을 사용하여 오븐 온도 30°C에서 실시하였다. 사용된 이 동상은 water (A) 및 acetonitrile (B)를 각 20분씩 초음파 처 리를 하여 사용하였다. Autosampler를 이용해 20μl를 주입하 였다. 이동상의 기울기 조건은 0 - 30분 : 15→ 55% B, 30 -35 분 : 55→ 100% B, 35 - 40분 : 100→ 15% B, 40 - 45분 : 15% B의 조건으로 기울기 용리하였다. 이때 유속은 0.8mℓ/ min으로 하고, UV 검출기의 230nm 파장에서 흡광도를 측정 하였다.
6. 통계분석
HPLC 추출조건별 수율 및 성분 정량분석은 3회 반복으로 실시하였다. 분석된 데이터 값은 means ± SE 값으로 나타내었 으며 실험값의 통계처리 및 유의성 검정은 SAS (Statistical Analysis System)프로그램을 사용하여 분산분석 (ANOVA)과 Duncan’s Multiple Range Test (DMRT)로 유의성을 검증하 였다. 또한 각 처리구간의 최소유의차 (p < 0.05) 수준에서 통 계처리 하였다.
결과 및 고찰
1. 황기 기내배양을 위한 부정근 유도
황기 (Astragalus membranaceus)의 잎, 줄기, 뿌리절편을 3, 4 및 5mg• ℓ–1의 IBA와 sucrose 30 g • ℓ–1가 첨가된 1/ 2 MS 배지위에 치상하여 캘러스 유도율을 조사하였더니 캘러 스의 유도는 Table 1에서 보는바와 같이 잎은 4mg• ℓ–1 IBA에서 75.4%, 줄기는 3mg• ℓ–1 IBA에서 40.2% 그리고 뿌리에서 5mg• ℓ–1IBA에서 75.4%의 유도율을 보였다 (Fig. 1A).
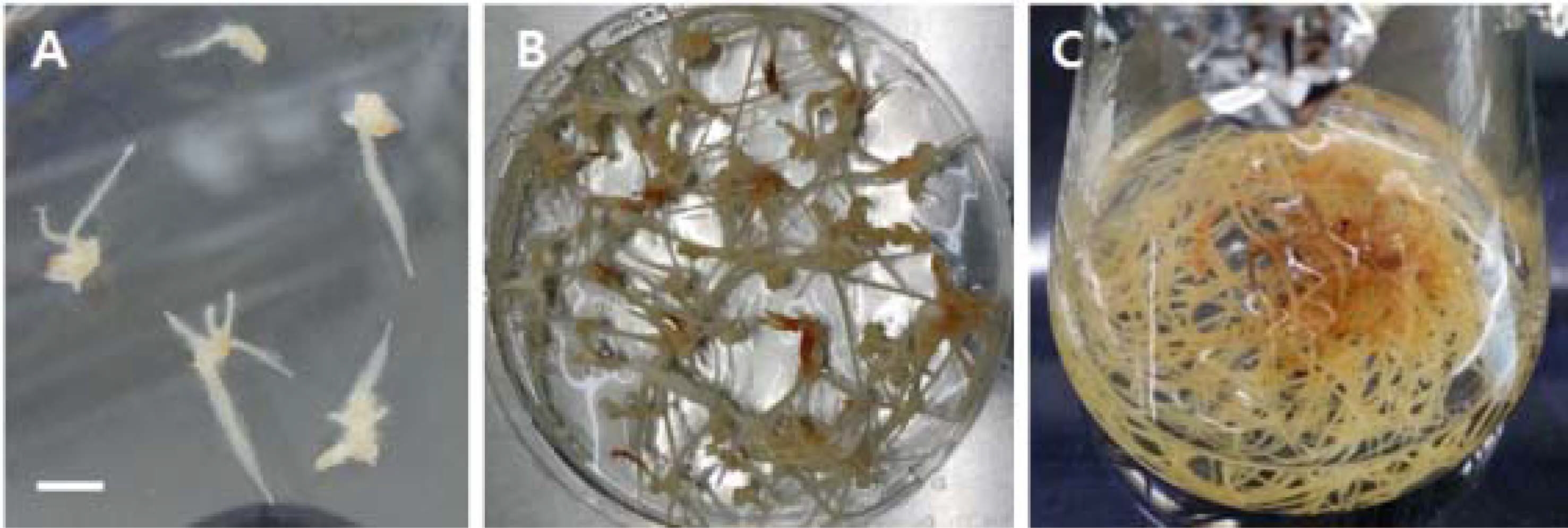
Development of adventitious roots from root of A. membranaceus.A; young roots produced on the 1/2 MS medium using adventitious roots, B; subcultured callus, C; adventitious root cultured on MS liquid medium. Scale bars indicate as a 1㎝ (A).

Effect of callus induction by explant types and IBA concentrations in tissue culture of A. membranaceus.
유도된 부정근을 이용하여 증식배지로 계대배양 하였을 때 캘러스의 유도율이 가장 우수한 조건인 유도배지에서 얻어진 각 조직부위별 부정근을 이용하여 고체배양을 실시하였으며 기본배지는 MS로 교체하였다. 선행연구자 (Thwe et al., 2012)에 의하면 Gamborg’s B5 (B5), MS 그리고 Schenk and Hildebrandt (SH)배지에서 황기 부정근을 배양하였을 때 MS배지에서 성장이 가장 양호한 결과로 보고하였기 때문에 해당 배지를 선택하였다.
부정근 유도를 위해서는 식물호르몬 중 auxin을 많이 사용 한다. 이는 부정근의 측근형성과 길이신장에 큰 영향을 미치 는 식물생장조절물질로써 연구자들이 많이 사용하는 auxin의 종류로는 IAA, IBA, NAA 등이 있다. 부정근의 생장에 있어 서 호르몬의 종류와 농도에 관한 보고는 식물 종류과 실험조 건에 따라 상이하지만 대체로 고농도의 IBA와 저농도의 NAA 에서 생장이 양호한 것으로 알려져 있다 (Jang et al., 2012). 황기 부정근에 대해 선행 연구한 Thwe 등 (2012)에 의하면 황기의 부정근을 유도하기 위하여 IAA, IBA 그리고 NAA를 이용한 결과 NAA에 의해 부정근 생장이 가장 양호한 것으로 보고하였다. 본 연구에서도 3종의 auxin을 이용해서 부정근을 유도한 결과 IAA에서 12.4%, NAA에서 23.6% 그리고 IBA 에서 56.3%의 캘러스 발아율을 보였다. 따라서 본 연구에서는 황기의 부정근을 유도하기 위하여 기내에서 무균발아 된 황기 의 잎, 줄기, 뿌리 절편을 이용하여 높은 캘러스 발아율을 나 타낸 IBA를 사용하였고 호르몬의 농도를 다르게 첨가하여 유 도용 배지를 제조하였다.
황기 부정근의 증식을 위한 증식용 배지는 IBA의 농도를 더욱 세분화하여 1, 2, 3, 4, 5mg• ℓ–1로 첨가한 배지에 부 정근을 치상하였다. 그 결과 황기 뿌리로부터 유도된 부정근 은 1mg• ℓ–1 IBA에서 부정근 증식이 가장 우수하였다 (Table 2, Fig. 1B).

Effect of adventitious roots by IBA concentrations in tissue culture using roots of A. membranaceus.
황기의 세 조직부위별 증식배지에서 성장이 가장 우수한 뿌 리로부터 유도된 부정근을 사용하여 부정근 대량생산을 위한 액체배양을 수행하였다. 황기 부정근의 액체배양을 위해 MS 배지에 0.5와 1.0mg• ℓ–1 IBA 농도로 배지를 제조하여 배양 하였다 (Fig. 1C). 그 결과 Table 3에서와 같이 0.5mg• ℓ–1 IBA의 배지에서 2.80 ± 0.84 g, 1.0mg• ℓ–1 IBA의 배지에서 4.70 ± 1.32 g으로 고농도의 IBA가 첨가된 배지에서 배양된 황 기 부정근이 저농도의 배지에서 배양된 황기 부정근에 비해 약 2배의 생산량 차이를 관찰할 수 있었다.
이와 유사한 실험으로 Jang 등 (2012)은 1.0mg• ℓ–1의 IBA가 첨가된 처리구에서 에키네시아 (Echinacea) 부정근의 형성과 부정근 내 생리활성물질 축적이 촉진되었다고 보고하 였다. 또한 Wu 등 (2011)이 황기 부정근의 polysaccharide, saponin 및 flavonoid의 함량을 분석한 결과 노지 재배된 황기 보다 높은 함량을 보였다. 따라서 본 연구에서 검증된 황기 부정근 생산조건으로 bioreactor에 적용하여 부정근을 생산한 다면 단기간에 대량으로 원료를 공급할 수 있어 식품과 의약 품 산업의 기대 효과가 클 것으로 사료된다.
2. 유효성분 분석
황기의 주요성분 정량을 위하여 황기의 isoflavonoid 성분인 calycosin-7-O-β-D-glucopyranoside, calycosin 및 formononetin 을 지표성분으로 하여 HPLC로 분석하였다. 분석시료는 본 연 구에서 유도된 황기 부정근 중에서 생장이 활발한 4개 라인을 선발하여 이용하였다. 선발된 각 라인을 Ama1, Ama2, Ama3 그리고 Ama4로 명명하였다. 그 결과 Fig. 2와 같이 Ama1의 calycosin-7-O-β-D-glucopyranoside과 calycosin성분함량이 최 대치를 나타내었다.
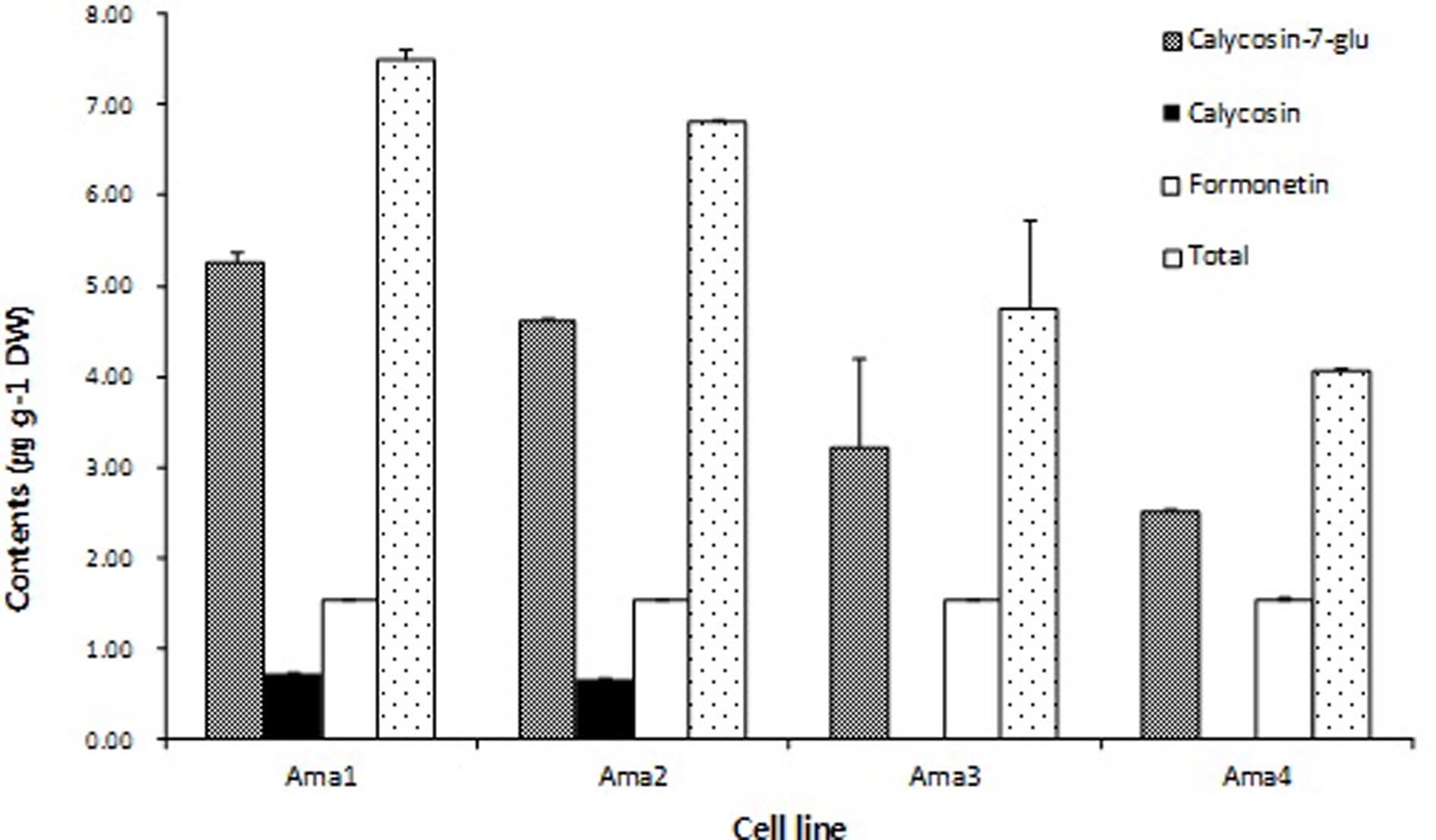
Contents of effective components from adventitious root of A. membranaceus cultured in liquid medium for 2 weeks.Ama; cell line. Data were represented as mean values (n = 3) with standard error.
각 성분의 함량을 살펴보면 calycosin-7-O-β-D-glucopyranoside 는 5.25± 0.10μg• g–1으로 calycosin과 formononetin의 함량은 각각 0.73± 0.01μg• g–1, 1.53± 0.01μg• g–1로 분석되었다. Kim 등 (2013)이 보고한 연구에서도 황기의 유효성분인 calycosin-7-O-β-D-glucopyranoside은 모든 조건에서 높은 함량 을 가지는 것으로 분석되었다. 따라서 황기의 flavonoid 성분 중에는 calycosin-7-O-β-D-glucopyranoside의 함량이 calycosin 과 formononetin에 비해 높은 비율로 차지한 다는 것을 확인할 수 있었다. 특이한 점은 모든 황기 부정근 라인에서 formonetin 의 함량은 Ama1 1.52± 0.01μg• g–1, Ama2 1.53± 0.01μg• g–1, Ama3 1.53± 0.02μg• g–1, Ama4 1.54± 0.03μg• g–1로 동일한 검출량을 보이는 반면 calycosin-7-O-β- D-glucopyranoside과 calycosin의 함량은 변화하는 것으로 나타 났다. Calycosin-7-O-β-D-glucopyranoside의 약리효능은 이미 많은 연구자들에 의해 보고되어 왔으며 특히 관절염에 대한 완 화효과와 간보호 효과, 염증유발 물질인 COX-2 효소활성 억 제효과, 항균효과 및 허혈재관류 증상이 있는 실험용 쥐에서 뇌 세포막의 유동성을 증가시킬 수 있다는 보고가 있다 (Choi and Leung, 2007; Baek et al., 1996; Kim et al., 2001; Yu et al., 2005; Lu et al., 2002; Wang et al., 2006). 결 과적으로 유도된 황기 부정근 4개 라인 중 Ama1의 유효성분 함량이 가장 우수한 것으로 보아 Ama1을 선발하여 bioreactor 를 이용한 대량생산시스템에 적용한다면 황기 부정근에 다량 으로 함유된 calycosin-7-O-β-D-glucopyranoside을 상업적으로 유용하게 이용할 수 있을 것이라고 사료된다. 또한 본 연구결 과로부터 생산된 부정근을 이용하여 체세포배를 유도하고 식 물체를 순화하여 노지에서 재배하는 방법을 지속적으로 연구 한다면 오랜 시간 걸쳐 얻을 수 있는 우수 개체를 단기간에 얻 을 수 있고 나아가 황기 전통육종법의 개선이 가능할 것이다.
결과적으로 본 연구에서 검증한 황기부정근 생산의 최적조 건을 바탕으로 황기의 이차대사산물의 대량생산과 산업화를 위한 기초자료로써 활용 가치가 높을 것으로 사료된다.
감사의 글
본 연구는 농촌진흥청 국립원예특작과학원 기관고유사업 황기 고품질 품종육성 및 재배기술개선 연구(과제번호: PJ010288022015) 과제의 연구비 지원으로 수행된 결과로 이 에 감사드립니다.
REFERENCES
- Baek, NI, Kim, YS, Kyung, JS, Park, KH, Isolation of antihepatotoxic from the root of Astragalus membranceus, Korean Journal of Pharmacognosy, (1996), 27, p111-116.
-
Cho, WCS, Leung, KN, In vitro and in vivo antitumor effects of Astragalus membranaceus, Cancer Letters, (2007), 252, p43-54.
[https://doi.org/10.1016/j.canlet.2006.12.001]

- Choi, S, Park, SR, Heo, TR, Inhibitory effect of Astragali radix on matrix degradation in human articular cartilage, Journal of Microbiology and Biotechnology, (2005), 15, p1258-1266.
- Choi, SI, Heo, TR, Min, BH, Cui, JH, Choi, BH, Park, SR, Alleviation of osteoarthritis by calycosin-7-O-β-Dglucopyranoside(CG) isolated from Astragali radix(AR) in rabbit osteoarthritis(OA) model, Osteoarthritis and Cartilage, (2007), 15, p1086-1092.
-
Dong, TTX, Ma, XQ, Clarke, C, Song, ZH, Ji, ZN, Lo, CK, Tsim, KWK, Phylogeny of Astragalus in China: Molecular evidence from the DNA sequences of 5S rRNA spacer, ITS, and 18S rRNA, Journal of Agricultural and Food Chemistry, (2003), 51, p6709-6714.
[https://doi.org/10.1021/jf034278x]

- Du, M, Wu, XJ, Ding, J, Hu, ZB, White, KN, Branford-White, CJ, Astragaloside IV and polysaccharides production by hairy roots of Astragalus membranaceus in bioreactors, Biotechnology Letters, (2003), 25, p1853-1856.
-
Du, XG, Zhao, B, Li, JY, Cao, XH, Diao, MK, Feng, HB, Chen, XB, Chen, ZY, Zeng, XY, Astragalus polysaccharides enhance immune responses of HBV DNA vaccination via promoting the dendritic cell maturation and suppressing Treg frequency in mice, International Immunopharmacology, (2012), 14, p463-470.
[https://doi.org/10.1016/j.intimp.2012.09.006]

-
Hirotani, M, Zhou, Y, Lui, H, Furuya, T, Astragalosides from hairy root cultures of Astragalus membranaceus, Phytochemistry, (1994), 36, p665-670.
[https://doi.org/10.1016/s0031-9422(00)89793-9]

-
Ionkova, I, Momekov, G, Proksch, P, Effects of cycloartane saponins from hairy roots of Astragalus membranaceus Bge., on humantumor cell targets, Fitoterapia, (2010), 81, p447-451.
[https://doi.org/10.1016/j.fitote.2009.12.007]

-
Jang, YS, Cui, HY, Lee, EJ, Kim, HW, Paek, KY, Auxin affects on production of adventitious roots and secondary metabolites in Echinacea angustifolia, Korean Journal of Medicinal Crop Science, (2012), 20, p479-486.
[https://doi.org/10.7783/kjmcs.2012.20.6.479]

-
Jeong, CS, Chakrabarty, D, Hahn, EJ, Lee, HL, Paek, KY, Effects of oxygen, carbon dioxide and ethylene on growth and bioactive compound production in bioreactor culture of ginseng adventitious roots, Biochemical Engineering Journal, (2006), 27, p252-263.
[https://doi.org/10.1016/j.bej.2005.08.025]

-
Kajimura, K, Takagi, Y, Ueba, N, Yamasaki, K, Sakagami, Y, Yokoyama, H, Yoneda, K, Protective effect of Astragali radix by intraperitoneal injection against Japanese encephalitis virus infection in mice, Biological and Pharmaceutical Bulletin, (1996), 19, p855-859.
[https://doi.org/10.1248/bpb.19.855]

- Kim, EJ, Oh, OJ, Lee, SK, Yang, KS, Inhibitory effect of Astragali Radix on COX-2 activity, Korean Journal of Pharmacognosy, (2001), 32, p311-315.
-
Kim, GS, Lee, DY, Lee, SE, Noh, HJ, Choi, JH, Park, CG, Choi, SI, Hong, SJ, Kim, SY, Evaluation on extraction conditions and HPLC analysis method for bioactive compounds of Astragali radix, Korean Journal of Medicinal Crop Science, (2013), 21, p486-492.
[https://doi.org/10.7783/kjmcs.2013.21.6.486]

- Kim, JH, Park, SY, Lim, HK, Park, AY, Kim, JS, Kang, SS, Youm, JR, Han, SB, Quantitative evaluation of radix Astragali through the simultaneous determination of bioactive isoflavonoids and saponins by HPLC/UV and LCESI-MS/MS, Bulletin of the Korean Chemical Society, (2007), 28, p1187-1194.
- Kim, JS, Kim, CS, A study on the constituents from the roots of Astragalus membranaceus Bunge (II), Korean Journal of Pharmacognosy, (1997), 28, p75-79.
- Kim, JS, Kim, CS, A study on the constituents from the roots of Astragalus membranaceus Bunge (III), Korean Journal of Pharmacognosy, (2000), 31, p109-111.
-
Kim, SH, Jun, YM, Lim, JJ, Kim, SH, Chung, IM, Kim, EH, Variation of astragalosides contents in cultivated Astragalus membranaceus, Korean Journal of Medicinal Crop Science, (2012a), 20, p372-380.
[https://doi.org/10.7783/kjmcs.2012.20.5.372]

- Kim, SP, Kim, SM, Ryu, HS, Shin, JC, Lee, DG, Lee, OJ, Lee, JH, Kim, JH, The effects of Astraglai radix pharmacopuncture at CV12 on osteoporosis of senescence accelerated mice(SAM) P6, The Journal of Korean Acupuncture and Moxibustion Medicine Society, (2012b), 29, p59-71.
-
Kim, YS, Chakrabarty, D, Hahn, EJ, Paek, KY, Methyl jasmonate increases saponin content in bioreactor culture of ginseng(Panax ginseng C. A. Meyer) adventitious roots, Acta Horticulturae, (2003), 625, p289-292.
[https://doi.org/10.17660/actahortic.2003.625.35]

- Lee, BS, In, JG, Song, WS, Yang, DC, Increase of ginsenosides production by the treatment of chitosan and jasmonic acid in the adventitious roots of Korean ginseng(Panax ginseng C.A. Meyer), Korean Journal of Plant Resources, (2004), 17, p48-53.
-
Lee, DY, Noh, HJ, Choi, JH, Lee, KH, Lee, MH, Lee, JH, Hong, YP, Lee, SE, Kim, SY, Kim, GS, Anti-inflammatory cycloartane type saponins of Astragalus membranaceus, Molecules, (2013), 18, p3725-3732.
[https://doi.org/10.3390/molecules18043725]

-
Lee, YS, Han, OK, Park, CW, Suh, SI, Shin, SW, Yang, CH, Jeon, TW, Lee, ES, Kim, KJ, Kim, SH, Yoo, WK, Kim, HJ, Immunomodulatory effects of aqueous extracted Astragali radix in methotrexate treated mouse spleen cells, Journal of Ethnopharmacology, (2003), 84, p193-198.
[https://doi.org/10.1016/s0378-8741(02)00298-2]

- Lei, H, Wang, B, Li, WP, Yang, Y, Zhou, AW, Chen, MZ, Anti-aging effect of astragalosides and its mechanism of action, Acta Pharmacologica Sinica, (2003), 24, p230-234.
- Liu, J, Zhao, ZZ, Chen, HB, Review of Astragali radix, Chinese Herbal Medicines, (2011), 3, p90-105.
- Lu, JF, Li, CX, Muteliefu, G, Li, TF, Tu, PF, Yin, JJ, Cai, SQ, Effects of BYHW decoction and its effective constituents on the fluidity of the cell membrane in a stroke modeled rat brain, Journal of Chinese Pharmaceutical Sciences, (2002), 11, p132-136.
- Ma, XQ, Duan, JA, Zhu, DY, Dong, TX, Tsim, KWK, Chemical comparison of Astragali radix(Huangqi) from different regions of China, Natural Medicines, (2000), 54, p213-218.
-
Murashige, T, Skoog, F, A revised medium for rapid growth and bio assays with tobacco tissue cultures, Physiologia Plantarum, (1962), 15, p473-497.
[https://doi.org/10.1111/j.1399-3054.1962.tb08052.x]

-
Park, YC, Lee, JS, Kim, DY, Son, HY, Lee, JW, Cheoi, YS, Kim, KK, Yu, CY, Chung, IM, Im, MH, Lee, KJ, Choi, RN, Shim, HS, Lim, JD, A 90 day repeated dose oral toxicity study of extracts from Astragalus membranaceus aboveground parts in rats, Korean Journal of Medicinal Crop Science, (2013), 21, p474-485.
[https://doi.org/10.7783/kjmcs.2013.21.6.474]

-
Paek, KY, Hahn, EJ, Increase of saponin contents via elicitor treatments in bioreactor culture of ginseng(Panax ginseng C. A. Meyer) adventitious roots, Acta Horticulturae, (2005), 679, p145-148.
[https://doi.org/10.17660/actahortic.2005.679.17]

-
Sivakumar, G, Yu, KW, Paek, KY, Enhanced production of bioactive ginsenosides from adventitious roots of Panax ginseng in bioreactor culture, Journal of Horticultural Science and Biotechnology, (2006), 81, p549-552.
[https://doi.org/10.1080/14620316.2006.11512102]

-
Staswick, PE, Jasmonate, genes, and fragrant signals, Plant Physiology, (1992), 99, p804-807.
[https://doi.org/10.1104/pp.99.3.804]

- Thwe, AA, Mai, NTT, Li, X, Kim, Y, Kim, YB, Uddin, MR, Kim, YS, Bae, H, Kim, HH, Lee, MY, Park, SU, Production of astragaloside and flavones from adventitious root cultures of Astragalus membranaceus var. mongholicus, Plant Omics Journal, (2012), 5, p466-470.
- Wang, JH, Kong, J, Li, W, Molchanova, V, Chikalovets, I, Belogortseva, N, Luk'yanov, P, Zheng, YT, A betagalactose-specific lectin isolated from the marine worm Chaetopterus variopedatus possesses anti-HIV-1 activity, Comparative Biochemistry and Physiology Part C. Toxicology and Pharmacology, (2006), 142, p111-117.
- Wang, XJ, Feng, P, Antioxidant activity of Qizhu tang, Acta Pharmacologica Sinica, (2000), 21, p1141-1144.
-
Wu, SQ, Lian, ML, Gao, R, Park, SY, Piao, XC, Bioreactor application on adventitious root culture of Astragalus membranaceus, InVitro Cellular and Developmental Biology Plant, (2011), 47, p719-724.
[https://doi.org/10.1007/s11627-011-9376-1]

- Yoshikawa, T, Furuya, T, Saponin production by cultures of Panax ginseng transformed with Agrobacterium rhizogenes, Plant Cell Reports, (1987), 6, p449-453.
-
Yu, DH, Duan, YL, Bao, YM, Wei, CL, An, LJ, Isoflavonoids from Astragalus mongholicus protect PC12 cells from toxicity induced by L-glutamate, Journal of Ethnopharmacology, (2005), 98, p89-94.
[https://doi.org/10.1016/j.jep.2004.12.027]

- Zhang, WJ, Hufnagl, P, Binder, BR, Wojta, J, Antiinflammatory activity of astragaloside IV is mediated by inhibition of NF-kappa B activation and adhesion molecule expression, Thrombosis and Haemostasis, (2003), 90, p904-914.
- Zhang, YD, Wang, YL, Shen, JP, Li, DX, Effect of astragaloside IV on inflammatory and hypertension, Acta Pharmacologica Sinica, (1984), 19, p333-337.