
한국산 오미자로부터 디벤조사이클로옥타디엔 계열 리그난 화합물 정성 및 정량 분석
© The Korean Society of Medicinal Crop Science All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Dibenzocyclooctadiene lignans are secondary metabolites present abundantly in the fruits belonging to the genus Schisandra. According to previous studies, Schisandra lignans exhibit anti-inflammatory, anti-cancer and anti-diabetic properties, as well as an inhibitory effect on platelet aggregation. Therefore, establishing the Korean “Omija” (Schisandra chinensis) as a lignanrich source, in addition to identifying and quantifying the lignans, is extremely valuable.
Dibenzocyclooctadiene lignans were analyzed with liquid chromatography using diode array detection/ mass spectrometry, from methanol extracts subsequently identified by a constructed chemical library of 50 lignans. A total of 27 components of lignan including gomisin S were identified, of which schisandrin, gomisin A, gomisin N, deoxyschisandrin, γ- schisandrin, and schisandrin C were identified as the major components in the Korean Omija, Schisandra chinensis. These compounds were divided into two groups, S-biphenyl and R-biphenyl based on the configurations of the stereoisomers structures with contents of 661.7 and 1350.1㎎ per 100 g dry weight, respectively. The total lignan content averaged 2011.4㎎ per 100 g dry weight, of which schisandrin and gomisin N comprised the majority (771.8 and 420.5㎎ per 100 g dry weight respectively).
Lignans which are present in high quantities in the ripe fruit of Schisandra chinensis are important functional compounds that play a major role in the prevention and treatment of human diseases.
Keywords:
Schisandra chinensis, Lignan, LC-MS서 론
오미자 (Schisandra chinensis Baill.)는 오미자과 (Schisandraceae)에 속하는 낙엽관목인 덩굴식물로, 약 10여종 이 동남아시아 지역에 주로 분포하고 있으며, 붉은 색의 과실 을 생약재 및 식품원료로 이용하는 약용식물이다 (Kang et al., 2014). 예로부터 강장 및 진정효과로 알려진 오미자 건조 열매는 한국, 중국, 일본의 전통약재로서 광범위하게 사용되어 왔으며 (Chang et al., 2005; Huang et al., 2005), 특히 중 국에서는 익은 열매가 ‘Wuweizi’로 불렸다. 학명에 따라 Schisandra chinensis Baill.는 ‘Bei-Wuweizi’로, Schisandra sphenanthera Rehd. et Wils.는 ‘Nan-Wuweizi’로 각각 명칭 되었다 (Lu and Chen, 2009). 오미자 열매에 함유된 주요 기 능성분은 리그닌이 합성되는 과정의 중간단계 물질인 리그난 화합물로 지금까지 약 40여종 이상의 리그난 화합물이 확인되 었고 (He et al., 1997), 휘발성 정유성분, 색소, 유기산 등 다 양한 성분이 함유되어 있는 것으로 보고되어 있다 (Lu and Chen, 2009). HPLC-DAD 및 질량분석기 (Mass Spectrometry) 를 이용하여 S. chinensis으로부터 각각 15종, 25종의 리그난을 동정 및 정량하는데 성공하였으며 (He et al., 1997; Deng et al., 2008), S. sphenanthera 에서는 8종의 리그난에 대한 정 성 및 정량 정보가 보고되었고 리그난 함량 및 분포는 종 및 재배지역에 따라 극히 다르게 나타났다고 보고되었다 (Wei et al., 2010). S. chinensis에는 schisandrin 및 gomisin N이 주 요성분으로 확인되는 반면, S. sphenanthera에는 γ-schisandrin 및 deoxyschisandrin이 주요성분으로 나타났다 (Deng et al., 2008; Zhu et al., 2007; Wei et al., 2010; Yuan et al., 2011).
이들 리그난 개별성분 중 주요 화합물인 gomisin A, γ- schisandrin, deoxyschisandrin, gomisin N 및 schisandrin C에 대해 high-speed counter-current chromatography (HSCCC) 분 리법 등의 고순도 정제연구기법이 보고된 바 있으며 (Huang et al., 2005, 2013), 개별성분에 대한 약리적 효능 연구는 최 근까지 계속되고 있다. Schisandrin, gominsin N, gomisin J, schisandrin C는 염증반응 유발물질인 lipopolysaccharide (LPS) 처리에 의해 급격히 생산되는 NO 수치를 저해하는 등 항염효과를 나타냈으며 (Guo et al., 2008; Oh et al., 2010), pregomisin 및 gomisin N은 혈소판응집저해제로서 platelet activation factor (PAF)에 대해 아스피린보다 더 강한 활성을 나타냈다 (Kim et al., 2010). 또한 deoxyschisandrin은 인간 장 상피세포 (HCT116 cells)에 있어 H2O2로 유도된 apoptotic cell death를 저해하여 잠재적인 항암효과를 보였으며 (Gu et al., 2010), schisandrin, gomisin A, angeloylgomisin H를 함 유하고 있는 분획은 지질 및 당대사를 조절하는 유전자들의 발 현 증가에 관련된 PPAR-γ의 전사활성을 증가시켜 인슐린 저 항성을 증진시킴으로서 항당뇨 효과를 나타냈다 (Kwon et al., 2011). 이처럼 오미자 리그난의 주요 성분에 대한 효능은 밝 혀지고 있으나, 그 외 다른 리그난에 대한 연구보고는 거의 전무한 상태이며, 한국산 오미자 열매 추출물로부터 리그난 개 별성분 조성에 대한 연구 역시 아직 미흡한 실정이다.
따라서 본 연구는 구조 동정을 위해 개별 리그난 화합물 라 이브러리 50종을 구축 하여, LC-DAD 및 MS 분석을 통해 한국산 오미자 종실에 함유되어 있는 리그난 함량 및 조성을 평가하여 기초자료를 제공하고자 하였다.
재료 및 방법
1. 공시 재료
오미자 (Schisandra chinensis Baill.)는 2013년 경북 문경시 농업기술센터에서 분양받은 열매를 동결건조한 후 cyclone sample mill (UDY Co., Fort Collins, CO, USA)로 2차 분 쇄하여 균질화한 후 100 mesh 이하의 분말로 만들고, 이 분말 시료를 분석을 위한 시료 전처리에 사용하였다.
2. 기기 및 시약
전처리 과정 중에 refrigerated multi-purpose centrifuge (Hanil Science Industrial, Incheon, Korea), ultrasonic bath (Daihan Scientific, Wonju, Korea)가 추출 기기로 사용되었으며, 정량을 위한 내부표준물질로서 bicyclol (Sigma, St. Louis, MO, USA)이 사용되었다. 그 밖의 HPLC 용매 methanol (MeOH), water, acetonitrile (ACN), formic acid 등은 Sigma- Aldaich (St. Louis, MO, USA) 제품을 사용하였다.
3. 시료 전처리
0.5 g의 powder 시료를 50mℓ conical tube에 담아 15mℓ의 MeOH 및 internal standard solution (내부표준물질; bicyclol 500 ppm) 1mℓ을 넣어(Wang et al., 2008) 30°C의 초음파추출 기에서 30분 동안 추출한 후, 원심분리하여 (3300 rpm, 15분, 4°C) 상층액을 취하는 과정을 3번 진행하였다. 추출물로부터 당 을 포함한 불순물을 제거하기 위해 Strata C18-E solid phase extraction (SPE, Phenomenex, Torrance, CA, USA) precolumn에 MeOH 10mℓ, H2O 10mℓ의 순으로 흘려주어 활성화 시켜주었다. 감압 농축하여 물에 재용해된 추출총액 10mℓ을 loading 후, H2O 10mℓ로 세척하여 MeOH 10mℓ로 elution 시 켰다. 정량을 위해 용출된 리그난 여과액은 N2 가스로 농축한 다음, 1mℓ의 MeOH로 재용해하여 리그난 동정 및 정량분석 의 시료로 사용하였다.
4. 오미자 열매로부터 리그난 화합물 라이브러리 제작
개별 성분에 대한 효율적인 동정을 위해 여러 가지 인용문 헌 (Table 1)으로부터 오미자 열매에 존재하는 50종의 리그난 LC-MS 라이브러리 (화합물명, 분자량, 구조, 단편이온패턴, 인 용문헌 등 포함)를 직접 제작하여 사용하였다.
5. HPLC-DAD-ESI/MS를 이용한 개별 리그난 동정 및 정량 분석
개별 리그난을 동정 및 정량하기 위해 Luna C18 (4.6 × 250mm I.D., 5μm; Phenomenex, Torrance, CA, USA) 역상 컬럼과 더불어 2998 photodiode array detector (PDA)를 장 착한 Alliance e2695 HPLC system (Waters Co., Milford, MA, USA) 및 Micromass ZQ ESI-MS (Waters Co., Milford, MA, USA)를 이용하여 분석하였다. 검출 파장은 210 - 400nm (대표파장 254nm) 에서 수행되었으며, oven 온 도는 35°C, 유속은 1mℓ/min이었다. 이동상은 0.1% formic acid 을 포함하는 water (이동상 A) 및 acetonitrile (이동상 B)가 사 용되었으며, 상기 전처리 샘플 분석은 이동상 B의 상대적 비 율을 조정하여 gradient 조건으로 수행 하였다 (0 - 12 min, 45 - 52%; 12 - 15 min, 52 - 53%; 15 - 16 min, 53 - 58%; 16 - 24 min, 58 - 64%; 24 - 26min, 64 - 75%; 26 - 40min, 75 - 76%; 40 -41min, 76 - 100%; 41 - 55min, 100%; 55 - 57min, 100 - 45%; 57 - 65 min, 45%). MS 분석은 electrospray ionization (ESI) source를 이용한 positive ionization mode로 진행되었으며, MS parameter로 각각 cone voltage 30 V, source 온도 120°C, desolvation 온도 350°C 및 desolvation N2 가스 800ℓ/hr이 설정되었다. 분자량 범위는 full scan 타입 으로 50 -600m/z이었다. 개별 리그난 정량은 각각의 표준물질 을 구비하기 어려운 관계로 relative response factor (RRF)을 고려하지 않고 내부표준물질 bicyclol을 이용하여 비례식 (a/ b = x/y)으로 계산 한 결과를 이용하였다.
결과 및 고찰
오미자 (Schisandra chinensis Baill.)의 리그난은 구조적 이성 질체화에 따라 분리 및 동정이 상당히 까다로우며, 앞으로 발생 가능 한 물질이 수백 종으로 예상되나, 선행 연구 결과로부터 dibenzocyclooctadiene lignans 및 2,3-dimethyl-1,4-diarylbutane lignans 계열 총 50종의 리그난 화합물 정보가 구축되었다 (Table 1). 직접 제작된 오미자 리그난 화합물 라이브러리를 바 탕으로 PDA detection에 따른 UV spectrum, LC-ESI/MS spectrum 등을 확인한 결과, schisandrin을 포함한 총 27종의 개별 성분의 peak가 분리 및 동정되었다 (Fig. 1). 한국산 오미 자 함유 27종의 dibenzocyclooctadiene 리그난은 크게 2가지 타입의 S-biphenyl configuration 및 R-biphenyl configuration 이성질체 구조로서 구분되며, 이들은 Fig. 2 및 Table 1에서 알 수 있듯이, 복합적 대칭 특징, 이성질체특성 및 작용기 (angeloyl, tigloyl, benzoyl) 등에 따라 복잡하고 다양한 구조를 나타내고 있다.
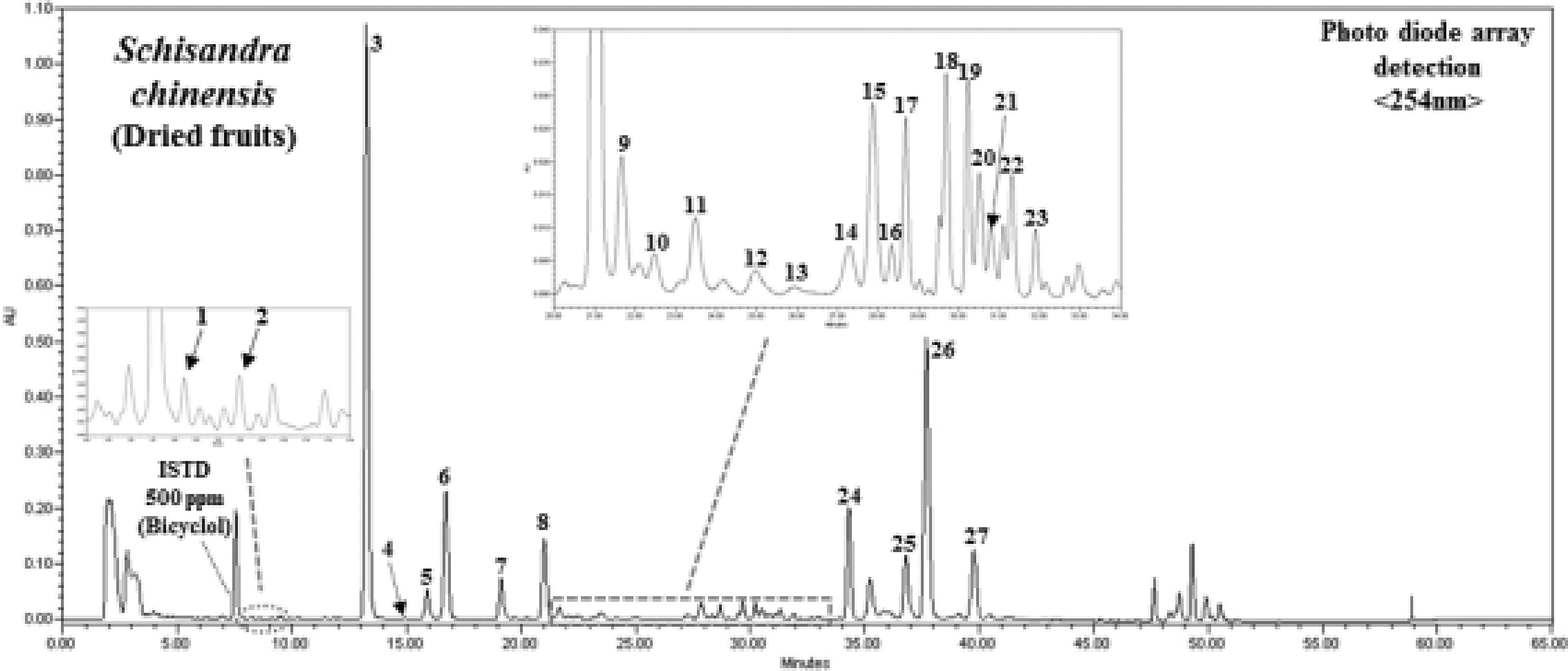
HPLC chromatogram of 27 dibenzocyclooctadiene lignans from an methanol extract of Schisandra chinensis (Omija) fruits.1; gomisin S, 2; isoschisandrin, 3; schisandrin, 4; gomisin D, 5; gomisin J, 6; gomisin A, 7; tigloylgomisin H, 8; angeloylgomisin H, 9; benzoylgomisin H, 10; benzoylgomisin Q, 11; tigloylgomisin Q, 12; gomisin G, 13; tigloylgomisin P, 14; (+)-gomisin K2, 15; (–)-gomisin K1, 16; schisantherin A, 17; schisantherin B, 18; schisanhenol, 19; (+)-gomisin M2, 20; (±)-gomisin M1, 21; gomisin E, 22; (–)-gomisin L1, 23; (–)-gomisin L2, 24; deoxyschisandrin, 25; γ-schisandrin, 26; gomisin N, 27; schisandrin C.
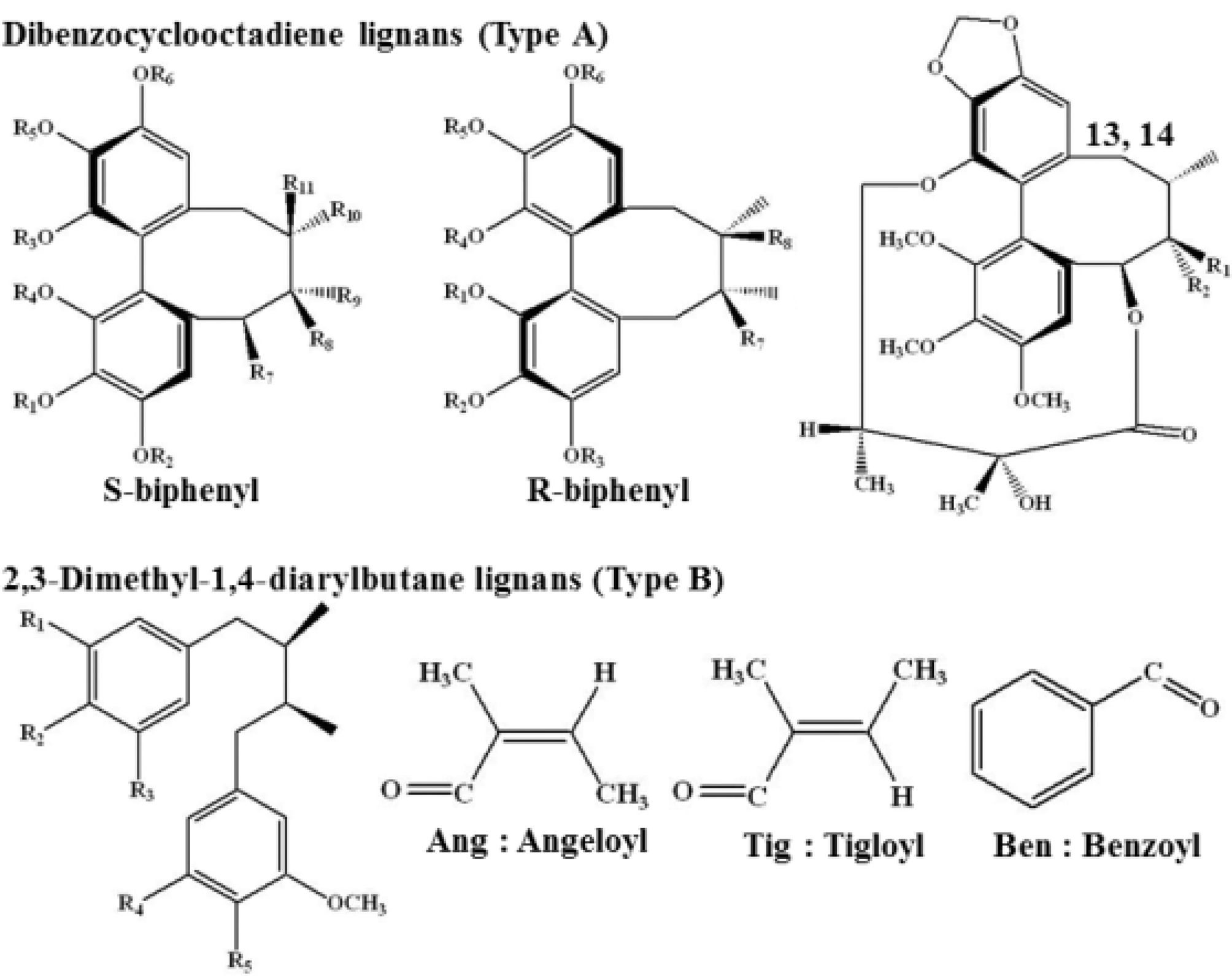
Chemical structures of individual 50 lignans reported from fruits of Schisandra chinensis and Schisandra sphenanthera.
모든 개별 리그난은 ESI source를 장착한 single quadrupole MS에서 positive ionization mode 분석시, [M+H]+, [M+Na]+, [M+NH4]+ 형태의 ion peak가 확인되었으며, 전체구조로부터 H2O (m/z 18) 또는 CH3O (m/z 31)이 잘려나가는 fragment 패 턴을 확인할 수 있었다. 특히 tigloylgomisin H, tigloylgomisin Q, tigloylgomisin P, angeloylgomisin H는 모분자 이온으로부터 C5H8O2 (tigloyl, angeloyl moieties)가 단편으로 소실되었으며, benzoylgomisin H, benzoylgomisin Q는 C7H6O2 (benzoyl moiety)가 소실되는 패턴을 보였다. Table 2 및 Fig. 3을 보았을 때, 본 연구결과에서 제시된 리그난의 질량 단편 이온 패턴은 기존 연구 문헌 (He et al., 1997; Deng et al., 2008; Wei et al., 2010)에서 제시한 [M + H]+, [M + Na]+, [M+ K]+, [M + H-H2O]+의 단순패턴보다 자세하게 나타나 이들 구조의 정확한 확인이 가능하였다.
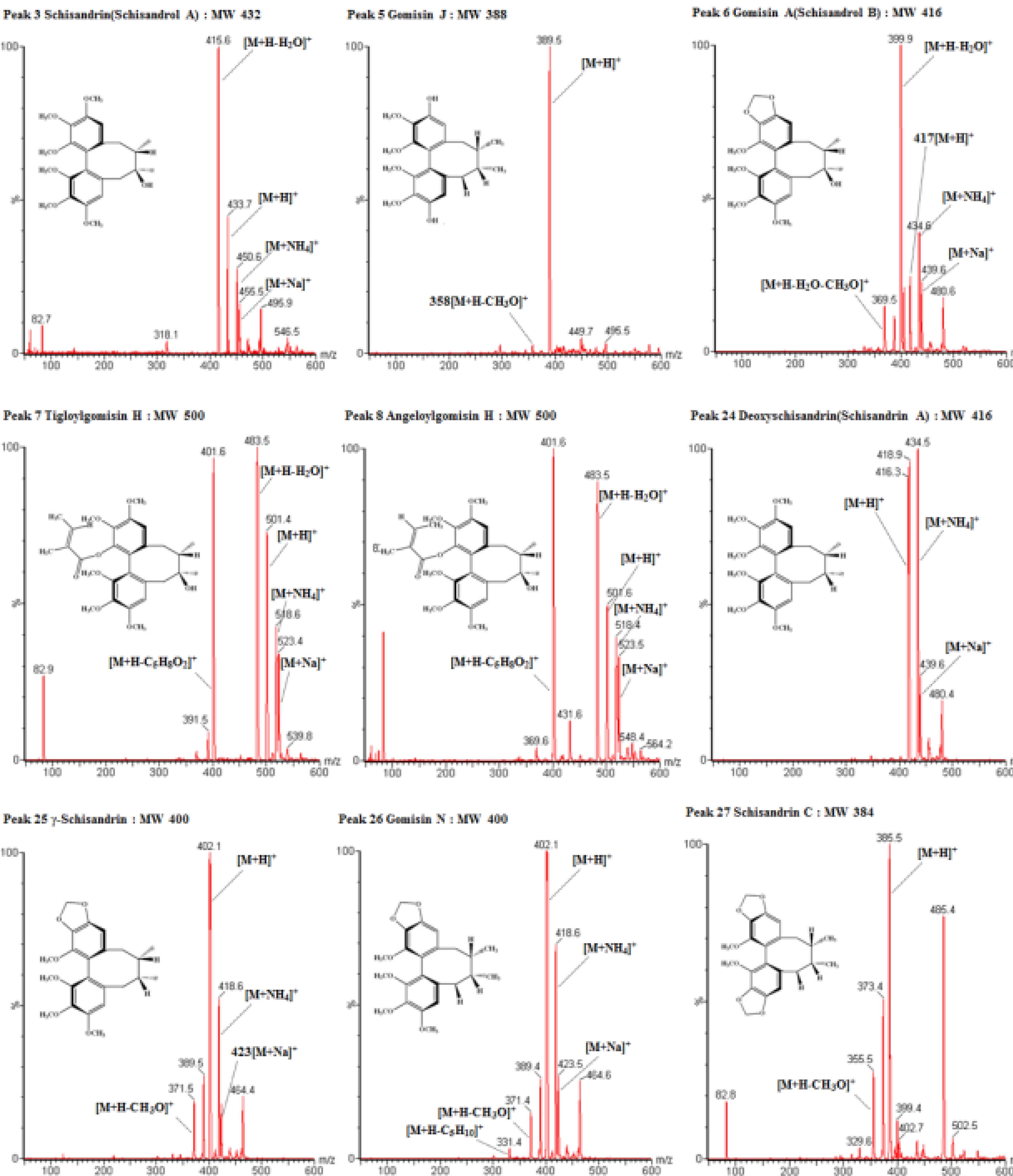
MS spectra of major lignans detected from an methanol extract of Schisandra chinensis (Omija) fruits.

MS spectrometric data and amounts of 27 lignans from an methanol extract of Schisandra chinensis (Omija) fruits.
한국산 오미자 건조 열매의 메탄올 추출물에서 분리된 개별 dibenzocyclooctadiene 리그난 함량 및 MS fragment 패턴을 나타내었다 (Table 2). 리그난 정량은 relative response factor (RRF)을 고려하지 않은 상태로 내부표준물질 bicyclol을 이용 하여 수행하였으며 (Wang et al., 2008), 일반적으로 과육에 포함 되었을 것으로 판단되는 당 성분의 방해를 피하기 위하 여 SPE (solid phase extraction) 과정을 통해 당을 포함한 불순물을 제거하는 과정을 포함하였으며 분석 가능한 MS spectrum을 얻을 수 있었다.
오미자 함유 총 리그난 함량은 2011.4mg/100 g (S 및 Rbiphenyl 계열 각각 661.7 및 1350.1mg/100 g DW)으로, 건 조열매 중 약 2%를 차지하여 주요 기능성분임을 재확인할 수 있었다. 이는 참깨 (Sesamum indicum L.) 종자 함유 리그난 인 세사민 및 세사몰린 총량 (한국 9개 지역; 164 - 982mg/ 100 g DW, 평균 621mg/100 g DW)보다 약 3배 이상 높은 함량을 나타냈으며 (Lee et al., 2008), 태국 58 계통 (평균 217mg/100 g DW) 보다 약 10배 가까이 높게 나타났다 (Rangkadilok et al., 2010). 본 연구결과는 중국 12개 지역에 서 수집된 S. chinensis 시료가 15종 리그난에 대해 1192.2 - 3641.3 (평균 2038.6) mg/100 g DW의 총 함량 분포를 나타낸 결과와 비슷했으며 (Deng et al., 2008), 중국 3개 지역에서 수집된 S. sphenanthera 시료 (8종 리그난; 1346, 1907, 2225mg/100 g DW) 보다는 약간 높은 함량을 나타내었다 (Yuan et al., 2011). 분리된 27종의 리그난 중 schisandrin, gomisin J, gomisin A, tigloylgomisin H, angeloylgomisin H, deoxyschisandrin, γ-schisandrin, gomisin N, schisandrin C의 총 9종이 주요성분으로 확인되었다. 특히 schisandrin은 711.8mg/100 g DW으로 가장 높은 함량을 나타내어, 총 리그 난 함량 중 약 30% (R-biphenyl 계열 함량 중 약 50%)를 차지하였다. 그 다음으로 gomisin N이 420.5mg/100 g DW으 로 높은 함량을 나타내어 전체 함량의 약 20% (S-biphenyl 계열 함량 중 약 60%)를 차지하였다 (Table 2). 기존의 연구 결과에서도 S. chinensis 에서는 schisandrin, gomisin A, gomisin N, schisandrin C이 주요 리그난 성분으로 나타나 본 연구결과와 비슷한 패턴을 나타냈다 (He et al., 1997; Deng et al., 2008; Zhu et al., 2007; Lu and Chen, 2009). 반면에 S. sphenanthera에서는 deoxyschisandrin 및 γ-schisandrin이 가 장 높은 함량을 나타내는 것으로 보고되었다 (Yuan et al., 2011; Zhu et al., 2007; Lu and Chen, 2009).
최근 이들 주요 리그난 개별성분에 대해 고순도 정제 연 구가 진행되고 있다. 잘 알려진 schisandrin을 제외하고 deoxyschisandrin, γ-schisandrin은 high speed counter current chromatography (HSCCC) 분리법을 통해 순도 95% 이상으로 고순도 정제되었으며 (Huang et al., 2005), gomisin A, gomisin N 등 5종은 column 분획 및 supercritical antisolvent (SAS) 침전법을 이용하여 회수율 및 순도가 증진되었다 (Huang et al., 2013). 그리고 개별 리그난 화합물에 대해 항염 효과 (Guo et al., 2008; Oh et al., 2010), 혈소판응집 저해효 과 (Kim et al., 2010), 항암효과 (Gu et al., 2010), 인슐린저 항성 증진의 당뇨개선효과 (Kwon et al., 2011) 등 주요 성분 들이 정제 되면서 관련 효능 메커니즘이 밝혀지고 있다.
대칭구조, 이성질체 등의 특성에 따라 생리활성 정도가 다르 게 나타날 것으로 사료되어, 차후 이들의 구조에 따른 다양한 효능 평가 및 비교 확인이 필요하며, dibenzocyclooctadiene 리 그난이 오미자 함유 주요 기능성분일 뿐만 아니라 뛰어난 약리 효능을 가진 화합물으로서 재조명 받아야 할 것이다. 이로서 농 가소득 증대 및 기능성식품, 의약 등의 제조를 통해 고부가가 치화 실현이 가능할 것으로 사료된다.
감사의 글
본 연구는 농촌진흥청 국립농업과학원 기관고유사업 ‘농식 품자원 유래 플라보노이드 소재탐색 및 DB구축(과제번호: PJ010056)’의 지원을 받아 수행된 결과로 이에 감사드립니다.
REFERENCES
-
Chang, GT, Kang, SK, Kim, JH, Chung, KH, Chang, YC, Kim, CH, Inhibitory effect of the Korean herbal medicine, Dae-Jo-Whan, on platelet activating factor induced platelet aggregation, Journal ofEthnopharmacology, (2005), 102, p430-439.
[https://doi.org/10.1016/j.jep.2005.07.003]

-
Deng, X, Chen, X, Cheng, W, Shen, Z, Bi, K, Simultaneous LC-MS quantification of 15 lignans in Schisandra chinensis(Turcz.) Baill fruit, Chromatographia, (2008), 67, p559-566.
[https://doi.org/10.1365/s10337-008-0589-3]

- Gu, BH, Minh, NV, Lee, SH, Lim, SW, Lee, YM, Lee, KS, Kim, DK, Deoxyschisandrin inhibits H2O2 induced apoptotic cell death in intestinal epithelial cells through nuclear factor KB, International Journal of Molecular Medicine, (2010), 26, p401-406.
-
Guo, LY, Hung, TM, Bae, KH, Shin, EM, Zhou, HY, Hong, YN, Kang, SS, Kim, HP, Kim, YS, Anti-inflammatory effects of schisandrin isolated from the fruit of Schisandra chinensis Baill, European Journal of Pharmacology, (2008), 591, p293-299.
[https://doi.org/10.1016/j.ejphar.2008.06.074]

-
He, XG, Lian, LZ, Lin, LZ, Analysis of lignan constituents from Schisandra chinensis by liquid chromatographyelectrospray mass spectrometry, Journal of Chromatography A, (1997), 757, p81-87.
[https://doi.org/10.1016/s0021-9673(96)00685-1]

- Huang, T, Shen, P, Shen, Y, Preparative separation and purification of deoxyschisandrin and γ-schisandrin from Schisandra chinensis(Turcz, Journal of Chromatography A, (2005), 1066, p239-242.
-
Huang, TL, Lin, JCT, Chyau, CC, Lin, KL, Chang, CMJ, Purification of lignans from Schisandra chinensis fruit by using column fractionation and supercritical antisolvent precipitation, Journal of Chromatography A, (2013), 1282, p27-37.
[https://doi.org/10.1016/j.chroma.2013.01.091]

-
Ikeya, Y, Taguchi, H, Yosioka, I, The constituents of Schizandra chinensis Baill. The structures of two new lignans, pre-gomisin and gomisin, Journal of Chemical and Pharmaceutical Bulletin, (1978), 26, p682-684.
[https://doi.org/10.1248/cpb.26.682]

- Ikeya, Y, Taguchi, H, Yosioka, I, Kobayashi, H, The constituents of Schizandra chinensis Baill. III. The structures of four new lignans, gomisin H and its derivatives, angeloyl-, tigloyl- and benzoyl-gomisin H, Chemical and Pharmaceutical Bulletin, (1979a), 27, p1576-1582.
- Ikeya, Y, Taguchi, H, Yosioka, I, Kobayashi, H, The constituents of Schizandra chinensis Baill. Ⅴ. The structures of four new lignans, gomisin N, gomisin O, epigomisin O and gomisin E, and transformation of gomisin N to deangeloylgomisin B, Chemical and Pharmaceutical Bulletin, (1979b), 27, p2695-2709.
- Ikeya, Y, Taguchi, H, Yosioka, I, The constituents of Schizandra chinensis Baill. The cleavage of the methylenedioxy moiety with lead tetraacetate in benzene, and the structure of angeloylgomisin Q, Chemical and Pharmaceutical Bulletin, (1979c), 27, p2536-2538.
- Ikeya, Y, Taguchi, H, Yosioka, I, The constituents of Schizandra chinensis Baill. Ⅶ. The structures of three new lignans, (−)-gomisin K1 and (+)-gomisins K2 and K3, Chemical and Pharmaceutical Bulletin, (1980a), 8, p2422-2427.
- Ikeya, Y, Taguchi, H, Yosioka, I, Kobayashi, H, The constituents of Schizandra chinensis Baill. VIII. The structures of two new lignans, tigloylgomisin P and angeloylgomisin P, Chemical and Pharmaceutical Bulletin, (1980b), 28, p3357-3361.
- Ikeya, Y, Taguchi, H, Yosioka, I, The constituents of Schizandra chinensis Baill. VII. The structures of γ-schizandrin and four new lignans, (−)-gomisin L1and L2, (±)-gomisins M1 and (+)-gomisin M2, Chemical and Pharmaceutical Bulletin, (1982a), 30, p132-139.
- Ikeya, Y, Ookawa, N, Taguchi, H, Yosioka, I, The constituents of Schizandra chinensis Baill. XI. The structures of three new lignans, angeloylgomisin O, and angeloyl- and benzoylisogomisin O, Chemical and Pharmaceutical Bulletin, (1982b), 30, p3202-3206.
- Ikeya, Y, Taguchi, H, Yosioka, I, The constituents of Schizandra chinensis Baill. XII. Isolation and structures of new lignans, gomisin R, the absolute structures of wuweizisu C and isolation of schisantherin D, Chemical and Pharmaceutical Bulletin, (1982c), 30, p3207-3211.
- Ikeya, Y, Kanatani, H, Hakozaki, M, Taguchi, H, Mitsuhashi, H, The constituents of Schizandra chinensis Baill. XV. Isolation and structure determination of two new lignans, gomisin S and gomisin T, Chemical and Pharmaceutical Bulletin, (1988a), 36, p3974-3979.
-
Ikeya, Y, Taguchi, H, Mitsuhashi, H, Takeda, S, Kase, Y, Aburada, M, A lignan from Schizandra chinensis, Phytochemistry, (1988b), 27, p569-573.
[https://doi.org/10.1016/0031-9422(88)83143-1]

-
Ikeya, Y, Miki, E, Okada, M, Mitsuhashi, H, Chai, JG, Benzoylgomisin Q and benzoylgomisin P, two new lignans from Schisandra sphenanthera Rehd. et Wils, Chemical and Pharmaceutical Bulletin, (1990), 38, p1408-1411.
[https://doi.org/10.1248/cpb.38.1408]

-
Ikeya, Y, Sugama, K, Okada, M, Mitsuhashi, H, Two lignans from Schisandra sphenanthera, Phytochemistry, (1991), 30, p975-980.
[https://doi.org/10.1016/0031-9422(91)85290-g]

-
Kang, MG, Kim, YH, Im, AR, Nam, BS, Chae, SW, Lee, MY, Antidepressant-like effects of Schisandra chinensis Baillon water extract on animal model induced by chronic mild stress, Korean Journal of Medicinal Crop Science, (2014), 22, p196-202.
[https://doi.org/10.7783/kjmcs.2014.22.3.196]

-
Kim, MG, Lee, CH, Lee, HS, Anti-platelet aggregation activity of lignans isolated from Schisandra chinensis fruits, Journal of the Korean Society for Applied Biological Chemistry, (2010), 53, p740-745.
[https://doi.org/10.3839/jksabc.2010.112]

-
Kwon, DY, Kim, DS, Yang, HJ, Park, SM, The lignanrich fractions of Fructus Schisandrae improve insulin sensitivity via the PPAR-? pathways in in vitro and in vivo studies, Journal of Ethnopharmacology, (2011), 135, p455-462.
[https://doi.org/10.1016/j.jep.2011.03.037]

-
Lee, JH, Beak, IY, Ko, JM, Shim, KB, Kang, NS, Kim, HT, Kang, CH, Park, KY, Park, KH, Ha, TJ, Correlation of lignan contents with protein and oil contents in the seeds of Sesamum indicum L, Journal of Applied Biological Chemistry, (2008), 51, p20-27.
[https://doi.org/10.3839/jabc.2008.005]

-
Lu, Y, Chen, DF, Analysis of Schisandra chinensis and Schisandra sphenanthera, Journal of Chromatography A, (2009), 1216, p1980-1990.
[https://doi.org/10.1016/j.chroma.2008.09.070]

- Oh, SY, Kim, YH, Bae, DS, Um, BH, Pan, CH, Kim, CY, Lee, HJ, Lee, JK, Anti-inflammatory effects of gomisin N, gomisin J, schisandrin C isolated from the fruit of Schisandra chinensis, Bioscience, Biotechnology and Biochemistry, (2010), 74, p285-291.
-
Rangkadilok, N, Pholphana, N, Mahidol, C, Wongyai, W, Saengsooksree, K, Nookabkaew, S, Satayavivad, J, Variation of sesamin, sesamolin and tocopherols in sesame (Sesamum indicum L.) seeds and oil products in Thailand, Food Chemistry, (2010), 122, p724-730.
[https://doi.org/10.1016/j.foodchem.2010.03.044]

-
Taguchi, H, Ikeya, Y, The constituents of Schizandra chinensis Baill. The structures of two new lignans, gomisin F and G, and the absolute structures of gomisin A, B, and C, Chemical and Pharmaceutical Bulletin, (1977), 25, p364-366.
[https://doi.org/10.1248/cpb.25.364]

-
Wang, BL, Hu, JP, Tan, W, Sheng, L, Chen, H, Li, Y, Simultaneous quantification of four active schisandra lignans from a traditional Chinese medicine Schisandra chinensis (Wuweizi) in rat plasma using liquid chromatography/mass spectrometry, Journal of Chromatography B, (2008), 865, p114-120.
[https://doi.org/10.1016/j.jchromb.2008.02.016]

-
Wang, YH, Qiu, C, Wang, DW, Hu, ZF, Yu, BY, Zhu, DN, Identification of multiple constituents in the traditional Chinese medicine formula Sheng-Mai San and rat plasma after oral administration by HPLC-DAD-MS/MS, Journal of Pharmaceutical and Biomedical Analysis, (2011), 54, p1110-1127.
[https://doi.org/10.1016/j.jpba.2010.11.034]

-
Wei, H, Sun, L, Tai, Z, Gao, S, Xu, W, Chen, W, A simple and sensitive HPLC method for the simultaneous determination of eight bioactive components and fingerprint analysis of Schisandra sphenanthera, Analytica Chimica Acta, (2010), 662, p97-104.
[https://doi.org/10.1016/j.aca.2009.12.039]

-
Yang, JM, Ip, PSP, Yeung, JHK, Che, CT, HPLC-MS analysis of Schisandra lignans and their metabolites in Caco-2 cell monolayer and rat everted gut sac models and in rat plasma, Acta Pharmaceutica Sinica B, (2011), 1, p46-55.
[https://doi.org/10.1016/j.apsb.2011.04.007]

-
Yuan, G, Liu, Y, Li, T, Wang, Y, Sheng, Y, Guan, M, Simultaneous and rapid determination of main lignans in different parts of Schisandra sphenanthera by micellar electrokinetic capillary chromatography, Molecules, (2011), 16, p3713-3722.
[https://doi.org/10.3390/molecules16053713]

-
Zhu, M, Chen, XS, Wang, KX, Variation of the lignan content of Schisandra chinensis(Turcz.) Baill. and Schisandra sphenanthera Rehd. et Wils, Chromatographia, (2007), 66, p125-128.
[https://doi.org/10.1365/s10337-007-0261-3]

