마름 추출물의 항산화활성 및 암세포증식 억제 활성
© The Korean Society of Medicinal Crop Science. All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study aimed to investigate the antioxidant and antiproliferative activities of extract from different parts of water chestnut (Trapa japonica Flerow).
The total polyphenol content of pericarp and seed extract was 438.31 ㎎/g and 25.32 ㎎/g respectively. DPPH radical scavenging assay showed that the half maximal inhibitory concentration (IC50 values) of pericarp and seed extract were 5.28 ㎍/㎖ and 355.51 ㎍/㎖ respectively. In addition, the pericarp extract showed strong reducing power. In the MTT assay, the pericarp extract significantly inhibited the viability of A549, AGS, HeLa, PC-3, HCT116, HT29 and SW620 cell lines compared with the seed extract.
These results suggest that T. japonica Flerow extracts have significant antioxidant and antiproliferative activity.
Keywords:
Trapa japonica Flerow, Antioxidant, Antiproliferative, Cancer서 언
암은 현대인들이 가장 두려워하는 질병으로 전 세계인의 주 요 사망원인이며 우리나라의 경우에는 인구 5명중 1명이 사망 에 이르는 질병이다 (Kim, 2014). 암이란 환경, 식생활, 삶의 패턴, 유전 등의 여러 가지 원인들로 인해 정상세포의 불필요 한 세포분열 억제 조절 기능이 제 기능을 하지 못하게 되고 이로부터 세포가 비정상적으로 분열을 거듭해 나가면서 세포 집단을 형성하게 되는 것을 일컫는다 (Chung, 2003). 이러한 암은 주위조직 및 장기를 해하며 다른 장기까지 전이해 나가 면서 인체의 정상적인 기능을 마비시키고 끝내 사망으로 이르 게 하는 질환으로 보통 활성산소종 (reactive oxygen species, ROS)에 의해 많이 발병되어진다고 알려져 있다 (Anwar et al., 2013). 우리 인체는 물질대사 및 에너지 생성을 위해 필 수적으로 산소를 필요로 하며 호흡과정을 통하여 몸속으로 들 어온 산소는 인체 내 산화과정에 이용 된다 (Kang et al., 1999). 그러나 이때 불안전하게 전자를 흡수하게 되면 생체조 직 및 세포를 손상시키는 산화력이 강한 산소인 활성산소가 발생되며 각종질병의 원인이 되는 것이다 (Kim et al., 2013).
실험 재료로 사용된 마름 (Trapa japonia Flerow)은 쌍떡잎 식물 이판화군 도금양목 마름과이며 연못이나 소택지에서 자 라는 수생식물로 (Kim et al., 2014b) 실험에 사용되어진 열 매는 뼈대같이 딱딱하고 양끝은 꽃받침이 변하여 가시처럼 되 며 가지 끝 부분에 밑을 향한 가시가 있고 열매 내부에 1개 의 무배유 종자가 있으며 자엽에 전분이나 단백질 등을 포함 하고 있다 (Nam et al., 2014). 예로부터 종자는 구활식품으 로 이용하였으며 열매를 당뇨병, 위궤양, 자궁경암, 식도암 치 료 등에 이용하여 왔다 (Choi et al., 1997).
민간에서는 자궁이나 식도 등 다양한 부위의 암치료제로 사 용되었던 마름열매에 대한 항암 성분의 객관적인 연구는 미비 한 바, 본 연구에서는 마름열매 추출물의 항암효과를 규명하 기 위하여 폐암, 간암, 자궁경부암, 전립선암, 대장암 세포의 증식억제효과를 확인, 식품 및 의약품 등 천연소재로서의 개 발가능성을 규명하고자 한다.
재료 및 방법
1. 실험재료
본 연구에서 사용된 마름 (Trapa japonia Flerow)열매는 2013년 8월경 경북 영천에서 채취된 것을 사용하였다. 부위별 추출물의 활성을 비교검정하기 위해 열매를 과피 (pericarp)와 종자 (seed)로 각각 90.19 g와 72.01 g씩 분리하였으며 100% methanol에 침치하여 일주일 간격으로 3회 반복 추출하였다. 추출 후에 filter paper로 여과 시켜 rotary evaporator (N- 1100 and N-1000, EYELA Co., Tokyo, Japan)을 이용하여 감압 농축하였으며 그 결과 과피 5.8 g와 종자 3.2 g의 추출물 을 얻었다.
Folin-Ciocalteu's phenol, gallic acid, quercetin, 2,2-diphenyl- 1-picryl hydrazyl (DPPH), potassium ferricyanide, ferric chloride, ascorbic acid 및 butylated hydroxy anisole (BHA), butylated hydroxy toluene (BHT), 3-(4,5-dimethylthiazol-2-yl)- 2,5-diphenyltetrazolium bromide (MTT) 등의 시약은 Sigma- Aldrich (St. Louis, MO, USA)사의 것을 구입하여 사용하였으 며, 세포 실험에 사용된 Dulbecco's modified Eagle's medium (DMEM), RPMI 1640 medium, fetal bovine serum (FBS)과 1% antibiotics (penicillin and streptomycin, 100 U/㎖)는 HyClone (Logan, UT, USA)에서 구입하여 사용 하였다.
2. 총 페놀 및 총 플라보노이드 함량 측정
총 페놀 함량은 Liu (2004)와 Taga 등 (1984)에 의해 보고되 어진 Folin-Ciocalteau방법을 변형하여 측정하였다. 추출물 100㎕에 Folin-Ciocalteu reagent 50㎕, 20% sodium carbonate 300㎕를 가하고 15분 후 증류수 1㎖을 넣어 혼합한 후 UVVis spectrophotometer (V-530, Jasco Co., Tokyo, Japan)를 이용하여 725㎚에서 흡광도를 측정하였다. 페놀 화합물 함량 은 표준물질 gallic acid를 사용하여 작성된 표준 검량 곡선에 적용하였으며 gallic acid equivalents (GAE)로 나타내었다 (Hong et al., 2011).
총 플라보노이드 함량은 Moreno 등 (2000)의 방법을 변형 하여 측정하였다. 추출물 100㎕에 10% aluminum nitrate 20㎕, 1M potassium acetate 20㎕, 80% ethanol 860 ㎕를 차례로 가하여 혼합하고 실온에서 40분간 안정화시킨 다음 415㎚에서 흡광도를 측정하였다. 함량은 quercetin을 표준물 질로 사용하여 작성된 표준 검량 곡선에 적용하여 검량선을 작성한 다음 quercetin equivalents (QE)로 나타내었다 (Hyun et al., 2011).
3. DPPH radical 소거능 측정
DPPH radical 소거능 검정은 Blois (1958)의 방법을 변형하 여 측정하였다. DPPH 용액 100 ㎕에 여러 농도의 시료 100㎕를 각각 혼합하여 30분간 상온에서 반응시킨 후에 microplate reader (Model-680, BIO-RAD, Hercules, CA, USA)를 이용하여 517㎚에서 흡광도를 측정하였으며, 측정값 은 다음과 같은 식을 이용하여 EDA (electron donating ability, %)로 산출한 후 IC50 (the half maximal inhibitory concentration)값으로 확인하였다. 이때 소거효과의 비교를 위 한 양성 대조군으로는 ascorbic acid와 BHT를 사용하였다.
| ABSsample: : | Absorbance of the experimental sample |
| ABScontrol: : | Absorbance of the control |
4. 환원력 측정
환원력 (reducing power) 측정은 Oyaizu (1986)의 방법을 변형하여 측정하였다. 25, 50, 100, 250㎍/㎖의 농도별로 희 석한 각각의 시료 100㎕에 0.2M sodium phosphate buffer (pH 6.6) 100㎕, 1% potassium ferricyanide 100㎕를 가한 후 증류수 400㎕를 혼합 하고 0.1% ferric chloride를 50㎕ 를 첨가하여 혼합한 반응 액을 700㎚에서 측정하였으며 흡 광 값을 결과 값으로 사용하였다. 환원력 활성 비교를 위한 양성 대조군으로는 ascorbic acid와 BHA를 사용하였다.
5. 세포배양
본 실험에 사용되어진 HKE293 (Human normal kidney cell), A549 (Human lung cancer cell), AGS (Human stomach cancer cell), HeLa (Human cervix cancer cell), PC-3 (Human prostate cancer cell), HCT-116 (Human colon cancer cell), HT29 (Human colon cancer cell) 그리 고 SW620 (Human colon cancer cell) 세포는 한국세포주은 행 (KCLB, Seoul, Korea)에서 분양받아 사용하였으며 세포 배양 시 사용된 DMEM 및 RPMI 1640 배지는 10% FBS와 1% antibiotics를 첨가하여 사용하였고 5% CO2, 37°C 조건으 로 CO2 incubator (NU-4750, NuAire, Plymouth, MA, USA)에서 배양하여 실험하였다.
6. MTT assay
MTT assay는 암세포 증식 억제 능을 평가하는 실험방법으 로 Mosmann (1983)과 Kim 등 (1995)의 방법을 변형하여 측 정하였다. 96 well-plate에 1 × 105 cell/well의 밀도로 암 세포 를 배양하고 24시간 후 plate에 10, 50, 100, 250, 500㎍/㎖ 농도로 100㎕씩 시료를 처리하였으며 24시간 후 배지를 걷 어내고 1000㎍/㎖ 농도의 MTT를 100㎕씩 처리하였다. 4시 간 후 dimethyl sulfoxide (DMSO) 100㎕을 처리하였으며, microplate reader를 이용하여 540㎚에서 흡광도를 측정하였 고, 측정값은 다음과 같은 식을 이용하여 inhibition rate (%)로 산출한 다음 IC50 (the half maximal inhibitory concentration) 값으로 확인하였다.
7. 통계처리
모든 실험은 3회 반복 측정하여 means ± standard으로 나타 내었으며 통계처리는 SPSS (Statistical Package for Social Sciences, version 22.0, SPSS Inc., Chicago, IL, USA)를 이 용하여 one-way ANOVA 분석을 실시한 후 Duncan's Multiple Range Test (DMRT)로 유의성을 p < 0.05 수준에서 검증하였다.
결과 및 고찰
1. 총 페놀성 화합물 및 플라보노이드 함량
일반적으로 식물에 존재하는 polyphenol 화합물은 hydroxyl 기를 가지는 방향족 화합물로서 항산화, 항암 활성 등 다양한 생리활성에 관여 한다 (Stankovic et al., 2012). 이러한 폴리 페놀 화합물중 대표적인 물질인 플라보노이드는 C6-C3-C6의 기본구조를 가지며, 플라보노이드의 polyphenolic한 성질은 superoxide, hydroxyl radical과 같은 세포손상을 초래하는 free radical을 제거하는 항산화 활성을 비롯하여 항암, 항균 등 다양한 생리활성을 가진다고 알려져 있다 (Im and Lee, 2013).
총 페놀성 화합물 및 플라보노이드 함량은 각각 gallic acid 와 quercetin을 기준물질로 하여 검량선을 작성한 후 Table 1 에 나타내었다. 측정 결과 과피 추출물의 총 페놀성 화합물 및 플라보노이드 함량은 438.31㎎• GAE/g와 61.40㎎• QE/g 으로 페놀성 화합물에 비해 이에 속하는 플라보노이드는 5배 도 미치지 못하는 적은 함량을 보였고 종자 추출물의 총 페놀 성 화합물 함량은 25.32㎎• GAE/g으로 438.31㎎• GAE/g의 함량을 보인 과피 추출물에 비해 적은 함량을 가지고 있었으 며 플라보노이드 함량 또한 매우 낮아 그 수치가 확인되지 않 았다. 이는 Kim (2012) 등이 40여종의 자생식물과 생약자원 추출물의 폴리페놀, 플라보노이드 함량 및 항산화 활성을 연 구한 논문에서도 유사한 결과를 보고하였는데 분석시료들의 전반적인 폴리페놀, 플라보노이드 함량에 대한 경향을 살펴보 았을 때 각 시료에 대한 폴리페놀 함량이 플라보노이드 함량 보다 항상 큰 값을 가지기는 하지만 폴리페놀 함량이 높을 때 플라보노이드 함량이 반드시 높은 값을 가지는 것은 아니라는 것을 증명한 바 있다. 호두, 머루, 감귤, 리치 등의 식물 또한 마름열매와 같이 주로 식용하는 부위는 과피가 아닌 종자 등 의 다른 부위임에도 불구하고 페놀성 화합물이 다량이거나 항 산화능이 우수한 식물에 대한 생리활성 연구가 많이 이루어지 고 있으며 (Han et al., 2015; Park, 2011; Ahn et al., 2007; Jeong et al., 2010; Lee, 2008), 따라서 상기 결과는 식물체의 다양한 부위를 이용하는 기타 연구에서의 기초적인 자료가 될 것이라고 사료된다 (Table 1).
2. DPPH 라디칼 소거활성
Free radical인 DPPH는 홀수전자에 의해 특정파장에서 강한 흡수를 보이나 전자공여체와 반응하게 되면 전자 또는 hydrogen radical을 받아 phenoxy radical을 생성하게 되고, 비가역적으로 결합한 전자 수와 비례하여 탈색 된다 (Sharma and Bhat, 2009). 이때 시료가 free radical을 환원 시키거나 상쇄시키는 능력이 크면 높은 항산화 활성 및 활성산소를 비 롯한 다른 radical에 대한 소거활성을 기대할 수 있고 인체 내 의 활성 산소에 의한 노화를 억제하는 척도로 이용될 수 있다 (Lugemwa et al., 2013). 본 연구에서 마름의 부위별 추출물 의 항산화 효과를 평가하기 위하여 DPPH free radical 소거 능 검정을 실시하였으며, 소거효과의 비교를 위한 양성대조군 으로는 ascorbic acid, BHT를 이용하였다. 측정 결과는 Table 2와 같았으며 부위에 따라 열매 추출물의 큰 활성차이를 보 였다. 10㎍/㎖의 농도로 처리한 과피와 종자 추출물에서의 소거 능은 각각 86.02% 와 7.98%으로 확인되었으며 IC50값은 5.28㎍/㎖와 355.51㎍/㎖으로 과피 추출물에서의 DPPH radical 소거능이 종자 추출물에 비해 70배 정도의 높은 활성 을 보였다. 또한 양성대조군으로 사용한 ascorbic acid의 IC50 12.42㎍/㎖ 와 BHT의 IC50 232.18㎍/㎖ 보다도 약 2배와 40배 정도 높은 활성을 보였다. 이와 유사한 결과로 Kang 등 (2009)의 연구에서 methanol로 추출한 마름열매의 과피 와 종 자를 200㎍/㎖의 농도로 처리하였을 때 radical 소거능이 각 각 94.6%, 22.7%로 과피 추출물에서의 항산화 활성이 높았음 이 보고되어진 바 있다 (Table 2).
3. 환원력 측정
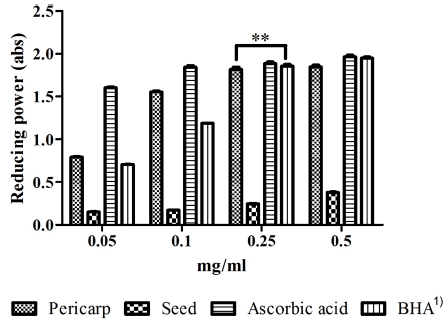
환원력은 일반적으로 수소원자에 의해 free radical 사슬을 끊어서 항산화 기능을 하는 reductones의 존재와 관련 있다. Reductants의 존재는 Fe3+/ferricyanide 혼합물의 감소를 일으키 는 원인이 된다 (Lue et al., 2010). 즉, ferricyanide 혼합물이 Fe2+로 전환되면서 노란색에서 녹색으로 변하는 prussian blue 의 형성을 관찰하고 환원력을 흡광도 값으로 나타낸 것이다. 환원력에 대한 결과는 Fig. 1에 나타내었으며 본 실험에서는 과피 및 종자 추출물 시료를 각각 0.05, 0.1, 0.25, 0.5㎎/㎖ 의 농도로 처리하여 실험하였다. 측정 결과 과피 와 종자 추 출물 모두 농도 의존적으로 환원력이 높아졌으나 과피 추출물 에 비하여 종자 추출물에서는 비교적 낮은 환원력을 보임으로 써 앞선 DPPH radical 소거능 실험과 유사한 결과로 항산화 활성과 환원력 간의 연관성을 확인하였다 (Suh et al., 2015). 특히 처리한 시료의 농도 0.05, 0.1㎎/㎖ 에서 과피 추출물이 Abs 0.23, 0.71의 수치로 양성대조군으로 사용한 BHA Abs 0.18, 0.44 수치보다 약 2배 이상의 우수한 환원력을 보였으며 종자 추출물에서는 Abs 0.09, 0.12 수치로 낮은 환원력을 보 였다. 위 결과는 Park 과 Lim (2009) 그리고 Park와 Lee (2015)의 보고에서와 같이 페놀성 화합물의 함유량이 많을수 록 높은 항산화 활성 및 환원력을 가진다는 연구 결과를 뒷받 침하는 것으로 사료된다 (Fig. 1).
4. 암세포 증식저해 효과
MTT는 colorimetic assay로 mitochondrial succinate dehydrogenase에 의해 MTT가 환원되는 정도를 측정하는 것 으로 암세포 증식 저해 효과를 검증하기위한 실험이다 (Bruggisser et al., 2002). 암세포 사멸이 과피 및 종자 추출 물의 세포독성에 기안하는 것인지 확인하기 위해 인간 신장 정상세포인 HEK293에 각 추출물을 250, 500, 1000㎍/㎖ 농 도로 희석하여 처리한 뒤 세포 생존율을 살펴본 것으로 실험 결과 처리 농도 1000㎍/㎖에서도 생존율에 영향을 미치지 않 았으며 (Fig. 2), 따라서 이후 암세포 생장억제 실험에서 각 추출물이 세포 손상에 영향을 미치지 않는 농도인 10, 50, 100, 250, 500㎍/㎖로 희석하여 처리하였다. A549, AGS, HeLa, PC-3, HCT-116, HT29, SW620 총 7종의 암세포 주 의 세포 증식 저해 정도를 확인한 것으로 7종의 암 세포 모 두 농도 의존적인 결과를 보였고 종자 추출물보다 과피 추출 물의 저해 활성이 효과적이었다. 과피 추출물을 처리한 암 세포의 증식 저해율을 IC50 값으로 나타내었을 때 PC-3 (85.95㎍/㎖) > A549 (90.29㎍/㎖) > HeLa (129.82㎍/㎖) > HCT116 (114.92㎍/㎖) > AGS (163.41㎍/㎖) > HT29 (204. 21㎍/㎖) > SW620 (236.55㎍/㎖)의 순으로 활성을 보였다 (Fig. 3, 4). 식물의 과피 부위를 이용하여 PC-3 세포의 증식 저해 효과를 연구한 An (2004)등의 논문에서 80% ethanol로 추출한 배 과피의 polyphenol 분획물을 500㎍/㎖의 농도로 처리 하였을 때 20%의 세포 생존율을 보였으며 본 연구에서 는 과피 추출물을 500㎍/㎖의 농도로 처리하였을 때 22%의 세포 생존율을 나타냄으로써 유사한 항암 활성을 확인하였으 며, 항산화와 항암 작용 등에 효과적이라고 알려진 오미자를 (Kim et al., 2014a) 이용한 Moon (2012)등의 논문에 따르면 methanol로 추출한 오미자 시료를 PC-3 세포에 100㎍/㎖의 농도로 처리하였을 때 70% 이상의 세포생존율을 보였지만, 본 연구에서는 마름 과피 methanol 추출물을 100㎍/㎖의 농도 로 처리 하였을 때 31%의 세포 생존율을 보였으며 따라서 오 미자 보다 마름의 과피가 더 우수한 항암 활성을 가지고 있다 고 판단된다. 현재 마름에 대한 연구 및 과피 추출물의 항암 기전과 이에 관여하는 성분 등의 연구가 많이 이루어지지 않 은 바, 심도 깊은 연구의 필요성이 요구되며 다양한 분야에서 이용되어지지 않았던 마름열매의 과피 부위를 활용하여 항산 화 및 암세포 증식 억제에 관련한 기능성 식품 및 의약품 개 발가능성을 제고하는 바이다 (Fig. 2, 3, 4).
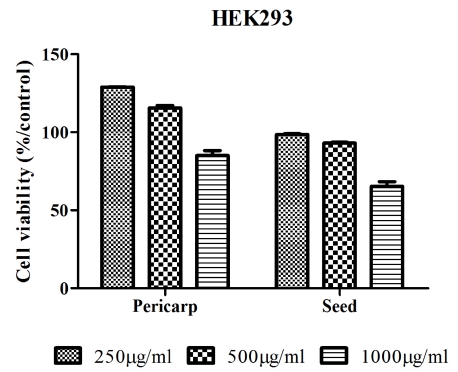
Cytotoxicity of methanol extracts from Trapa japonica Flerow on human embryonic kidney cell, HEK293.Mean values ± SD from triplicate separated experiments are shown.
Antiproliferative effect of methanol extracts from Trapa japonica Flerow on human cancer cell lines.Inhibitory effect of methanol extracts from Trapa japonica Flerow on proliferation of A549 (Human lung cancer cell), AGS (Human stomach cancer cell), HeLa (Human cervix cancer cell) and PC-3 (Human prostate cancer cell). Mean values ± SD from triplicate separated experiments are shown. Statistical difference (*p < 0.05, **p < 0.01, ns; no significantly different).
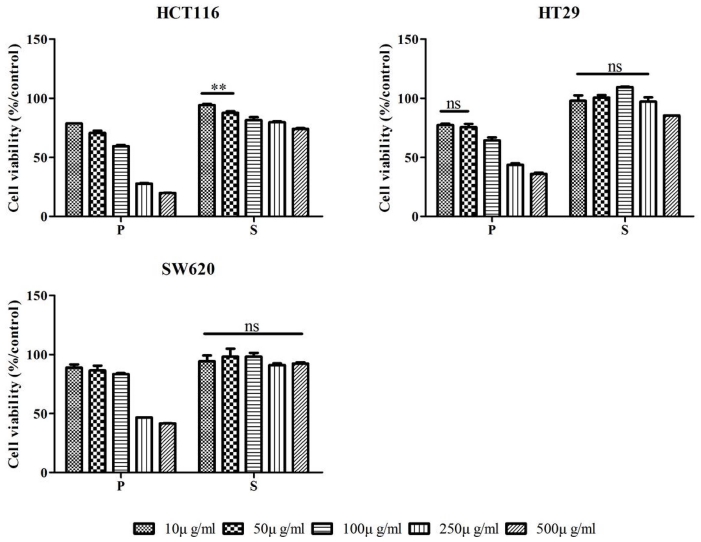
Antiproliferative effect of methanol extracts from Trapa japonica Flerow on human colon cancer cells.Inhibitory effect of methanol extracts from Trapa japonica Flerow on proliferation of HCT116, HT29 and SW620. Mean values ± SD from triplicate separated experiments are shown. Statistical difference (**p < 0.01, ns; no significantly different).
REFERENCES
- Ahn, MS, Kim, HJ, Seo, MS, A study on the antioxidative and antimicrobial activities of the CitrusUnshjupeel extracts, Journal of the Korean Society of Dietary Culture, (2007), 22, p454-461.
- An, BJ, Lee, JT, Kwak, JH, Park, JM, Lee, JY, Son, JH, Bae, JH, Choe, C, Biological activity of polyphenol group fraction from Korean pear peel, Journal of the Korean Society for Applied Biological Chemistry, (2004), 47, p92-95.
- Anwar, F, Shaheen, N, Shabir, G, Ashraf, M, Alkharfy, KM, Gilani, AH, Variation in antioxidant activity and phenolic and flavonoid contents the flowers and leaves of Ghaneri(Lantana camaraL.) as affected by different extraction solvents, International Journal of Pharmacology, (2013), 9, p442-453.
-
Blois, MS, Antioxidant determinations by the use of a stable free radical, Nature, (1958), 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Bruggisser, R, von Daeniken, K, Jundt, G, Schaffner, W, Tullberg-Reinert, H, Interference of plant extracts, phytoestrogens and antioxidants with the MTT tetrazolium assay, Planta medica, (2002), 68, p445-448.
[https://doi.org/10.1055/s-2002-32073]

- Choi, JS, Kim, JS, Lim, HK, Kwak, HH, Cho, KY, Study on the seed germination characteristics ofTrapa japonicaFEROV, Korean Journal of Weed Science, (1997), 17, p413-420.
- Chung, IJ, Cancer gene therapy: History and major developments, Journal of Toxicology and Public Health, (2003), 19, p247-257.
-
Han, KI, Kim, MR, Jo, BK, Kim, MJ, Kang, MJ, Park, KH, Koo, YE, Kim, BS, Jung, EG, Han, MD, Antimicrobial and antioxidative activities of the extracts from walnut(Juglans regiaL.) green husk, Journal of Life Science, (2015), 25, p422-440.
[https://doi.org/10.5352/jls.2015.25.4.433]

-
Hong, JI, Kim, HJ, Kim, JY, Factors affecting reactivity of various phenolic compounds with the Folin-Ciocalteu reagent, Journal of Korean Society of Food Science and Nutrition, (2011), 40, p205-213.
[https://doi.org/10.3746/jkfn.2011.40.2.205]

- Hyun, MR, Lee, YS, Park, YH, Antioxidative activity and flavonoid content ofChrysanthemum zawadskiiflowers, Korean Journal of Horticultural Science and Technology, (2011), 29, p68-73.
-
Im, DY, Lee, KI, Antioxidative activity and tyrosinase inhibition effect of ethanol extract and its fractions from the branch of Rhododendron schlippenbachii, Korean Journal of Medicinal Crop Science, (2013), 21, p439-443.
[https://doi.org/10.7783/kjmcs.2013.21.6.439]

- Jeong, HR, Choi, GN, Kim, JH, Kwak, JH, Kim, YS, Jeong, CH, Kim, DO, Heo, HJ, Nutritional components and their antioxidative protection of neuronal cells of litchi(Litchi chinensisSonn.) fruit pericarp, Korean Journal of Food Science and Technology, (2010), 42, p481-487.
- Kang, MH, Ryu, SN, Min, KS, Kim, KS, Bang, JK, Lee, BH, Current research activities of antioxidative compound in plants, Korean Journal of International Agriculture, (1999), 11, p207-215.
- Kang, MJ, Lee, SK, Song, JH, Kim, ME, Kim, MJ, Jang, JS, Lee, JH, Kim, JI, Water chestnut(Trapa japonicaFlerov.) exerts inhibitory effect on postprandial glycemic response in rats and free radical scavenging activityin vitro, Food Science and Biotechnology, (2009), 18, p808-812.
- Kim, DH, Recognition of cancer risk and consumption of cancer insurance possibility of adverse selection, Journal of Insurance Studies, (2014), 25, p35-62.
-
Kim, EJ, Choi, JY, Yu, MR, Kim, MY, Lee, SH, Lee, BH, Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants., Korean Journal of Food Science and Technology, (2012), 44, p337-342.
[https://doi.org/10.9721/kjfst.2012.44.3.337]

- Kim, JN, Chae, H, Kwon, YK, Kim, BJ, Effects ofSchisandra chinensison human breast cancer cells, Korean Journal of Oriental Physiology and Pathology, (2014a), 28, p162-168.
-
Kim, JS, Lee, YJ, Yang, JF, Sa, YJ, Kim, MO, Park, JH, Park, DS, Yu, CY, Kim, MJ, Biological activity of Sorghum bicolor M. cv. Bulgeunjangmoksusu extracts, Korean Journal of Plant Resources, (2013), 26, p111-118.
[https://doi.org/10.7732/kjpr.2013.26.1.111]

- Kim, KH, Park, HM, O, SH, Lee, CH, Tetrazolium (MTT) assay for chemosensitivity testing of the squamous cell carcinoma cell lines of the head and neck, Korean Journal of Otolaryngology-Head and Neck Surgery, (1995), 38, p1225-1236.
- Kim, YS, Hwang, JW, Han, YK, Kwon, HJ, Hong, H, Kim, EH, Moon, SH, Jeon, BT, Park, PJ, Antioxidant activity and protective effects ofTrapa japonicapericarp extracts against tert-butylhydroperoxide-induced oxidative damage in Chang cells, Food and Chemical Toxicology, (2014b), 64, p49-56.
- Lee, SK, Anti-diabetic effect of Trapa japonica Flerov, (2008), p1-70, Master Thesis. Inje University. Korea.
-
Liu, RH, Potential synergy of phytochemicals in cancer prevention: Mechanism of action, Journal of Nutrition, (2004), 134, Supplement 12p3479S-3485S.
[https://doi.org/10.1093/jn/134.12.3479s]

-
Lue, BM, Nielsen, NS, Jacobsen, C, Hellgren, L, Guo, Z, Xu, X, Antioxidant properties of modified rutin esters by DPPH, reducing power, iron chelation and human low density lipoprotein assays, Food Chemistry, (2010), 123, p221-230.
[https://doi.org/10.1016/j.foodchem.2010.04.009]

-
Lugemwa, FN, Snyder, AL, Shaikh, K, Determination of radical scavenging activity and total phenols of wine and spices: A randomized study, Antioxidants, (2013), 2, p110-121.
[https://doi.org/10.3390/antiox2030110]

-
Moon, JM, Seok, GH, Cho, SI, Antiproliferative effect of Schisandrae fructus extract on PC-3 human prostate cancer cells, The Korea Journal of Herbology, (2012), 27, p17-23.
[https://doi.org/10.6116/kjh.2012.27.4.17]

-
Moreno, MIN, Isla, MI, Sampietro, AR, Vattuone, MA, Comparison of the free radical-scavenging activity of propolis from several regions of Argentina, Journal of Ethnopharmacology, (2000), 71, p109-114.
[https://doi.org/10.1016/s0378-8741(99)00189-0]

-
Mosmann, T, Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays, Journal of Immunological Methods, (1983), 65, p55-63.
[https://doi.org/10.1016/0022-1759(83)90303-4]

-
Nam, JJ, Lee, KE, Park, JE, Moon, SJ, Youm, JK, Inhibitory effect of fractionated Trapa japonica extracts on UVB-induced skin photoaging, Journal of the Society of Cosmetic Scientists of Korea, (2014), 40, p321-330.
[https://doi.org/10.15230/scsk.2014.40.4.321]

-
Oyaizu, M, Studies on products of browning reactions: Antioxidative activities of products of browning reaction prepared from glucosamine, The Japanese Journal of Nutrition and Dietetics, (1986), 44, p307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

- Park, HS, Antioxidant activity of solvent extracts fromVitis coignetiaeskins, The Korean Journal of Culinary Research, (2011), 17, p208-217.
-
Park, SJ, Lee, HY, Component analysis and antioxidant activity ofWasabi japonicaMatsum leaves, Korean Journal of Medicinal Crop Science, (2015), 23, p207-213.
[https://doi.org/10.7783/kjmcs.2015.23.3.207]

-
Park, YO, Lim, HS, Antioxidant activities of bamboo(Sasa Borealis) leaf extract according to extraction solvent, Journal of Korean Society Food Science and Nutrition, (2009), 38, p1640-1648.
[https://doi.org/10.3746/jkfn.2009.38.12.1640]

-
Sharma, OP, Bhat, TK, DPPH antioxidant assay revisited, Food Chemistry, (2009), 113, p1202-1205.
[https://doi.org/10.1016/j.foodchem.2008.08.008]

- Stankovic, MS, Niciforovic, N, Mihailovic, V, Topuzovic, M, Solujic, S, Antioxidant activity, total phenolic content and flavonoid concentrations of different palnt parts ofTeucrium poliumL. subsp.poloum, Acta Societatis Botanicorum Poloniae, (2012), 81, p117-122.
-
Suh, JT, Choi, EY, Yoo, DL, Kim, KD, Lee, JN, Hong, SY, Kim, SJ, Nam, JH, Han, HM, Kim, MJ, Comparative study of biological activities at different harvesting times and new varieties for highland culture of Gom-chwi, Korean Journal of Plant Resource, (2015), 28, p391-399.
[https://doi.org/10.7732/kjpr.2015.28.4.391]

-
Taga, MS, Miller, EE, Pratt, DE, Chia seeds as a source of natural lipid antioxidants, Journal of the American Oil Chemists’ Society, (1984), 61, p928-931.
[https://doi.org/10.1007/bf02542169]