흰목이버섯 추출물의 미백 및 주름개선 효과
© The Korean Society of Medicinal Crop Science. All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The white jelly mushroom (Tremella fuciformis), one of the most popular edible fungi, has medicinal properties. However, the effects of T. fuciformis in skin whitening or anti-wrinkle efficacy has not been defined to date. The aim of the present study was to investigate the effects of T. fuciformis extracts on whitening and anti-wrinkle efficacy in skin cells.
We prepared T. fuciformis extracts with water. The extracts (80°C) contained 12.11 ㎎/g polyphenol and 8.54 ㎎/g flavonoid concentration. T. fuciformis extracts markedly decreased melanin contents and tyrosinase activity in α-MSHstimulated melanocytes (B16F10 cells). In addition, the mRNA expression of melanin formation factors, such as microphthalmiaassociated transcription factor (MITF), tyrosinase-related protein-1 (TRP-1) and tyrosinase-related protein-2 (TRP-2) were significantly down-regulated in α-MSH-stimulated melanocyte. Furthermore, T. fuciformis extracts increased the synthesis of type I procollagen and reduced mRNA expression of matrix metalloproteinase 1 (MMP-1) in the human dermal fibroblast (HDFn cells). These data indicated that T. fuciformis extracts induce repression of cellular melanogenesis and protect against wrinkles caused by UVB-stimulated damage.
Thus T. fuciformis extracts could be a cosmetic candidate for skin whitening and anti-wrinkle effects.
Keywords:
Tremella fuciformis, Anti-Wrinkle, Collagen, Melanin, Natural Product, Whitening서 언
흰목이버섯 (Tremella fuciformis)은 이담자균강 (Heterobasidiomycetes) 흰목이목 (Tremellales) 흰목이과 (Tremellaceae)에 속하며 봄부터 가을에 걸쳐 활엽수의 고목, 마른 가지 및 줄기 위에 발생하는 목재부후성 버섯으로 한국, 일본, 중국, 유럽 및 아메리카 등 전 세계에 걸쳐 분포하고 있다 (Oh et al., 2006). 일반명은 흰 젤리버섯 (white jelly fungus) 혹은 은이 (silver ear)로 불리고 있으며, 일본에서는 ‘로키쿠라게’로 불린 다 (Ko, 2012). 또한 중국에서는 예로부터 목이버섯을 꾸준히 먹으면 면역체계가 활성화되어 암과 노화를 막고, 고혈압과 동 맥경화를 예방할 수 있다고 알려져 있다 (Chen and Cai, 2008). 흰목이버섯의 생리활성에 대한 연구에서는 흰목이버섯 에서 분리한 산성다당류를 이용하여 동물모델에서 sarcoma- 180에 대해 37 - 64% 정도의 항 종양활성을 보이는 것으로 나 타났다 (Ukai et al., 1972). 또한 흰목이버섯 추출물이 체지 방 개선 및 콜레스테롤 증가를 억제하는 효능이 있다는 결과 도 보고되고 있으며, 장• 단기적 항스트레스 효과가 있다고 알 려지고 있다 (Cheng et al., 2002; Cheung, 1996; Ko et al., 2009). 추가적으로 흰목이버섯이 항산화 효과가 매우 뛰어 나며, 면역작용에 중요한 역할을 하는 T세포를 활성화 시킨다 는 연구도 보고되었다 (Li et al., 2014; Shi et al., 2014). 이와 같이 다양한 효능이 밝혀지고 있지만 아직까지 미백 및 주름 개선과 연관되어 피부에 관한 연구는 알려진바 없다.
건강한 피부를 만들기 위한 현대인의 노력이 많아지면서 여 러 가지 미백 및 주름개선 화장품에 대한 연구가 활발히 진행 되고 있으며, 다양한 방법으로 피부질환과 노화를 예방하려는 관심이 높아지고 있다 (Jung et al., 2014; Kim and Lee, 2015a; Urabe et al., 1994). 색소침착은 자외선 흡수에 의한 피 부 세포의 손상을 억제할 목적으로 melanin 생성이 증가하여 진 행되며 melanin 합성은 tyrosine을 기질로 하여 tyrosinase, tyrosinase related protein-1 (TRP-1), tyrosinase related protein- 2 (TRP-2, DCT)에 의해 생성된다. 3,4-dihydroxyphenylalanine (DOPA)를 거쳐 DOPA quinone으로 전환되고 eumelanin과 pheomelanin으로 합성되게 된다 (Kim and Lee, 2015a; Parvze et al., 2006; Wu et al., 2000). Microphthalmia-associated trancription factor (MITF)는 melanin 합성을 조절하는 인자로 알려져 있으며, 이를 통하여 melanin 합성에 중요한 역할을 하 는 TRP-1, TRP-2의 발현을 조절하게 된다 (Liu and Fisher, 2010; Olivares and Solano, 2009). 피부가 노화가 진행됨에 따 라 주름이 발생하게 되는데 노화가 진행될수록 피부를 구성하 는 물질인 collagen, elastin 등 구조 단백질을 생성하는 능 력이 감소되며, collagenase의 생합성이 증가하여 matrix metalloproteinases (MMPs)의 발현이 증가되면 진피 내 기질 단 백질 분해를 유도하여 피부탄력을 저하시키고 주름을 형성한다 (Brenneisen et al., 2002; Kim et al., 2015; Lee et al., 2015). 결국 collagen의 생성을 촉진하게 만들거나 collagen을 분해하는 collagenase 및 MMPs의 발현이나 활성을 저해할 수 있다면 주 름을 억제할 수 있다고 알려지고 있다 (Jung et al., 2014).
현재 arbutin, kojic acid, linoleic acid를 포함하는 tyrosinase 저해제가 주로 미백 개선 효능을 가지는 원료로 사용중이 며, 피부 주름 개선 효과가 있는 다양한 소재로는 retinol, epigallocatechin gallate, retinyl palmitate, adenosine 등이 있다 (Chun et al., 2002; Kim et al., 2010; Seo et al., 2003). 하 지만 피부 안정성 등의 문제가 알려지게 되면서 비교적 안전성 이 높은 천연물 소재의 기능성 제품 개발이 요구되고 있으며, 천연물 및 한방 추출물을 이용한 화장품은 꾸준히 인기를 끌고 있다. 따라서 본 연구는 천연 작물 소재인 흰목이버섯 추출물 에 대한 미백 및 주름개선 효능을 평가하여 향후에 기존보다 안전성 높고 효과적인 제품화 소재로 이용하기 위해 진행하였다.
재료 및 방법
1. 시료 추출물 제작
흰목이버섯 시료를 200 g씩 정량하여 열수추출물은 각각 80°C와 100°C 환류추출기를 이용하여 추출하였다. 모든 추 출물들은 Rotary evaporator (NE-1001V, Eyela, Tokyo, Japan)를 이용 수조 온도 70°C로 감압 농축하고 동결건조기 (PVTFD20A, Ilshin, Dongducheon, Korea)를 이용하여 콜드 트랩 온도를 –70°C 기본설정으로 하여 동결건조를 실시하였다. 수득률은 80°C와 100°C 각각 13%, 23%로 나타났다.
2. 총 페놀 함량 측정
총 페놀 함량은 Folin-Ciocalteu’s phenol (F9252, Sigma, St. Louis, MO, USA) 시약을 각각 160㎕를 첨가하여 1시간 동안 반응시켰다. 그 후 10,000 rpm으로 10분 동안 원심분리 하였으며 상등액을 이용하여 750㎚ 파장에서 흡광도를 측정 하였다. 표준물질의 검량선 작성을 위해 gallic acid (G7384, Sigma, St. Louis, MO, USA)를 이용하였다.
3. 총 플라보노이드 함량 측정
총 플라보노이드 함량은 96 well plate에 농도별 시료 10㎕에 10% aluminum nitrate (237973, Sigma, St. Louis MO, USA)와 1M potassium acetate (236497, Sigma, St. Louis, MO, USA)를 각각 4㎕, methanol을 82㎕를 첨가 한 뒤 40분간 암실에서 반응 한 뒤 415㎚에서 흡광도를 측 정하였으며, 표준물질의 검량선 작성을 위해 rutin (R5143, Sigma, St. Louis, MO, USA)을 이용하였다.
4. 세포배양
B16F10 과 HDFn 세포는 한국세포주은행 (KCLB, Seoul, Korea)으로부터 분양 받았으며, penicillin/streptomycin 100 unit/㎖ (10378, Invitrogen, Grand Island, NY, USA) 과 10% FBS (16000, Invitrogen, Grand Island, NY, USA) 가 함유된 DMEM 배지 (11995, Invitrogen, Grand Island, NY, USA)를 사용하여 37°C, 5% CO2 incubator (MCO- 17A1, Sanyo, Osaka, Japan)에서 배양하였다.
5. MTS 시험법을 이용한 세포 생장률 평가
96 well plate에 5× 104 cells/㎖로 분주하였고 Media-FBS 10% 조건에서 각 시료 추출물을 농도별로 72시간 처리하였다. 그 후의 각각 세포 배양액 용량의 1/10 배의 MTS 용해액 을 첨가한 후 37°C에서 2시간 배양한 후 ELISA reader (Spectrostar-nano, BMG Labtech, Offenburg, Germany)를 이용하여 490㎚에서 흡광도를 측정하였다.
6. Tyrosinase 효소의 활성 측정 및 melanin 함량측정
6 well plate에 1 × 105 cells/㎖의 B16F10 cell suspension 을 가하여 CO2 incubator에서 안정화 시켰다. 그 후 시료의 추출물을 농도별로 처리하고 1시간 후에 100 nM의 α-MSH 를 각 세포에 처리하였다. 72시간 후 배지를 제거하고 PBS로 2번 세척한 후 lysis buffer를 이용하여 세포를 용해하였다. 4°C, 15,000 rpm에서 30분간 원심분리를 하여 얻은 상층액을 tyrosinase 활성측정 용액으로 사용하였고, Bradford 법으로 (Bradford, 1976) 595㎚에서 흡광도를 측정하여 동량의 단백 질 양을 계산 하였다. 시료 50㎕와 10 mM L-DOPA 50㎕ 를 분주하여 혼합한 후 37°C에서 30분 반응시킨 뒤 ELISA reader (BMG Labtech, Offenburg, Germany)를 이용하여 490㎚의 파장으로 흡광도를 측정하였다. Melanin 함량은 lysis buffer를 이용하여 세포를 용해한 뒤 4°C, 15,000 rpm에 서 30 분간 원심분리를 한 후 세포 침전물을 이용하였다. 세 포 침전물에 10% DMSO가 첨가된 1 N NaOH 용액을 첨가 하여 80°C에서 1시간 동안 melanin을 용해시킨 뒤 475㎚에 서 흡광도를 측정하였다.
7. Real-time PCR을 이용한 미백 및 주름 관련 유전자 발 현분석
미백관련 인자 발현에 미치는 영향을 검증하기 위해 B16F10 세포를 6 well plate에 1 × 10 cells/well로 분주하여 안전화 시킨 후 다양한 농도의 시료를 1시간 처리한 후 α- MSH (100 nM)로 melanin 생성을 유도하여 24시간 뒤에 세 포를 수확하였다. 주름 관련 인자 발현을 확인하기 위해 HDFn 세포를 6 well plate에 1 × 10 cells/well 세포로 분주하 여 안정화 시킨 후 다양한 농도의 시료를 1시간 처리한 후 UV (300 mJ/㎠)를 처리하여 주름 형성 관련 유전자를 유도하 여 24시간 후에 세포를 수확하였다.
각각 처리된 세포를 TRIzol (15596018, Invitrogen, Grand Island, NY, USA) 1㎖를 가하여 실온에서 교반하였다. 클로 로포름 200㎕를 넣고 다시 교반하여 13,000 rpm, 4°C에서 10분간 원심분리한 후 상등액 500 ㎕에 이소프로판올을 가 하여 다시 원심 분리하여 RNA pellet을 얻었다. 5 ㎍의 mRNA를 High Capacity cDNA Reverse Transcription Kit (Appiled biosystem, Foster city, CA, USA)를 이용하여 cDNA로 합성을 하였다. 합성된 cDNA 1㎕, taqman primer 1㎕, Taqman Universal Master Mix II (Appiled biosystem, Foster city, CA, USA) 10㎕, 3차 증류수 8 ㎕를 넣고 realtime PCR 기기 (ABI7500, Applied biosystem, Foster city, CA, USA)를 이용하여 PCR을 수행하였다. 정량 중합 효소 반 응에 쓰인 TaqMan gene은 Appiled biosystem 에서 검색하여 주문 후 사용하였다. 또한 real-time PCR 반응 조건은 50°C에 서 2분 95°C에서 10분 동안 1회 수행하고, 변성 온도 95°C에 서 15초, annealing 온도 60°C에서 15초인 사이클을 40회 반 복 수행하였다.
8. Western blot을 통한 tyrosinase 단백질의 발현 측정
B16F10 melanoma 세포를 6 well plate에 1 × 105 cells/㎖ 로 분주하고 24시간 동안 배양하였다. 배지를 제거한 후 시료 를 농도별로 처리한 배지로 교환하고 72시간 배양한 후 PBS 로 세척하였다. Lysis buffer 200㎕를 첨가하여 세포를 용해 시키고 15,000 rpm으로 4°C에서 20분 동안 원심분리하여 세 포막 성분들을 제거하였다. 원심분리하여 얻은 단백질을 Bradford 법으로 (Bradford, 1976) 정량하였으며, 30㎍의 단 백질을 10% SDS-PAGE를 이용하여 전기 영동한 후 PVDF membrane에 transfer 하였다. Transfer가 끝나면 TBST buffer로 2회 이상 씻은 후 꺼내서 5% skin milk로 blocking 하였다. 그 뒤 1차 antibody (1 : 1000)를 overnight 하여 붙인 뒤 다시 2차 antibody를 붙이고 ECL detection reagents (Millipore, Billerica, MA, USA)를 이용하여 단백 질 발현을 현상하였다.
9. Collagen 합성 촉진효과 측정
피부의 주름개선 효과를 검정하는 collagen 합성효과를 보 기 위해 HDFn 세포를 96 well plate에 1 × 105 cells/well씩 24시간 배양시킨 다음 새로운 무혈청 배지로 단계적으로 희석 한 시료를 분주하여 가하고 다시 24시간 동안 CO2 incubator 에서 배양하였다. 배양액을 얻은 후 procollagen type I Cpepited EIA kit (MK101, Takara Bio inc, Shiga, Japan)을 이용하여 매뉴얼에 따라 진행하였다. 1차 collagen 항체가 있 는 96 well plate에 세포 배양액 20㎕와 2차 항체 100㎕를 혼합하여 넣은 후 37°C에서 3시간 반응 시킨 후 PBS로 4회 세척한 다음 ELISA reader (BMG Labtech)를 이용하여 450㎚에서 흡광도를 측정하였다.
10. 통계분석
실험에서 얻어진 결과의 통계적 유의성은 SPSS (18.0, Statistical Package for Social Sciences, Inc., Chicago, IL, USA) 프로그램을 이용하여 일원변량분석 (One way ANOVA) 을 시행하였다. 또한 평균 ±표준편차로 표시하였으며, 유의성 이 있는 경우 p < 0.05 수준에서 Duncan’s Multiple Range Test (DMRT)로 사후 검정하였다.
결과 및 고찰
1. 흰목이버섯 추출물의 총 페놀함량 및 플라보노이드 함량 측정
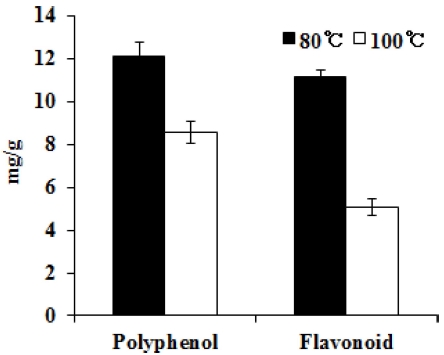
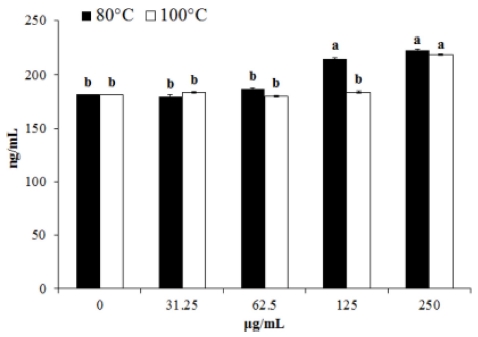
페놀성 화합물은 식물계에 널리 분포되어 있는 2차 대사산 물의 하나로서, phenolic hydroxyl (OH)기를 가지기 때문에 단백질 및 기타 거대 분자들과 쉽게 결합하며, 항산화, 항암 등의 다양한 생리활성을 가진다 (Kim et al., 2011). 폴리페놀 함량을 gallic acid, 총 플라보노이드 함량은 rutin을 기준물질 로 하여 측정하였다. 80°C와 100°C 추출물에서의 각 폴리페놀 함량은 12.11㎎/g, 8.54㎎/g으로 나타났으며 플라보노이드 함 량은 11.12㎎/g, 5.05㎎/g으로 확인되었다. 즉, 80°C 추출물 이 100°C 추출물에 비해 더 많은 양의 폴리페놀 및 플라보노 이드를 함유하고 있는 것으로 확인되었다 (Fig. 1). 최근 연구 에 식물 추출물에서 페놀함량에 비례하게 항산화 효능을 나타 내어 (Suh et al., 2014), 흰목이버섯에서도 함유된 페놀 및 플라보노이드로 인해 항산화 효능 및 다양한 생리활성 효능을 나타낼 것으로 예상된다.
2. 흰목이버섯 추출물의 세포독성 평가
각 흰목이버섯 추출물이 세포 생존율에 영향을 주는지 검사 하기 위해서 B16F10 및 HDFn 세포에 각 추출물을 처리하고 MTS assay 방법으로 생존율을 측정하였다. 각 흰목이버섯 추 출물의 농도는 31.2 - 1,000㎍/㎖ 범위에서 처리하였다. 100°C 추출물에서는 독성이 없었으나 80°C 추출물에서는 500㎍/㎖ 농도부터 세포 생존율에 영향이 있으므로, 모든 실험은 높은 생 존율을 보이는 500㎍/㎖ 이하 농도에서 진행하였다 (Fig. 2).
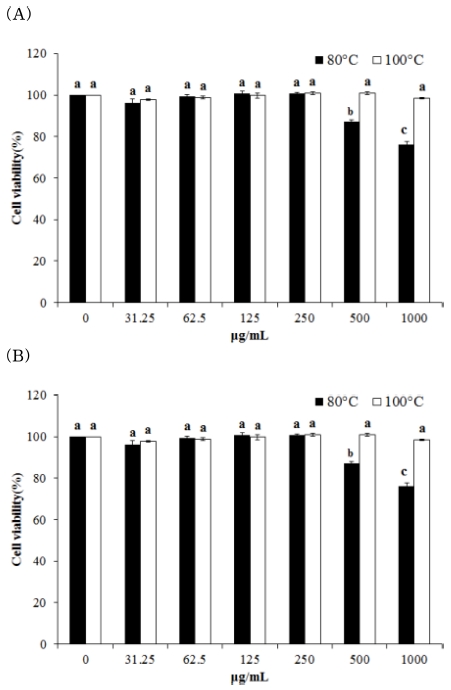
Cytotoxicity of Tremella fuciformis extracts on the (A); B16F10 melanocyte and (B); HDFn cells.Cell cytotoxicity was evaluated with the MTS assay. Mean values ± SD from triplicate separated experiments are shown. Different letters (a - c) are significantly difference between groups based on one-way ANOVA with Duncan’s Multiple Range Test (DMRT) at p < 0.05 post hoc.
3. 흰목이버섯 추출물에 의한 B16F10 melanoma 세포에서의 melanin 함량 및 tyrosinase 저해 활성
Melanin은 세포 내 소기관인 리보솜에서 tyrosinase 효소 의 생합성에서 합성되기 시작한다. 이 효소의 작용으로 아미 노산의 일종인 티로신에서 몇 단계의 합성을 통해 기저층의 세포 흑색소포 표면에 검고 갈색의 작은 melanin 입자가 만 들어지게 된다. 또한 이 tyrosinase 효소는 전사 인자인 MITF (microphthalmia-associated transcription factor) 와도 밀접한 관계가 있다 (Kim and Lee, 2015a; Parvze et al., 2006; Wu et al., 2000). 흰목이버섯 추출물이 melanin 형성 과정 중 억제효과를 나타내는지 규명하기 위해 tyrosinase의 활성을 확인하였다. B16F10 melanoma cell에서 각 시료를 농 도별로 처리하여 72시간 후 측정하였으며, 대조군으로는 kojic acid (100㎍/㎖)를 사용하였고 모든 결과는 blank 대비 백분율 로 나타내었다. 80°C 추출물에서 melanin 함량은 농도 의존적 으로 감소했으나, 100°C 추출물에서는 효능을 보이지 않았다. tyrosinase 저해활성을 확인할 결과에서도 80°C 추출물에서 62.5㎍/㎖ 농도부터 농도 의존적으로 감소하였고 100°C 추출 물에서는 저해효과를 보이지 않았다 (Fig. 3). 기존의 천연물 중의 하나인 미선나무 추출물의 결과 (Kim and Lee, 2015b) 에서 최대 25% 정도 저해효과를 보인 것에 비해 흰목이버섯 추출물이 월등한 저해효과를 나타내고 있기 때문에 다른 천연 물 이상의 효과가 있음을 시사한다.
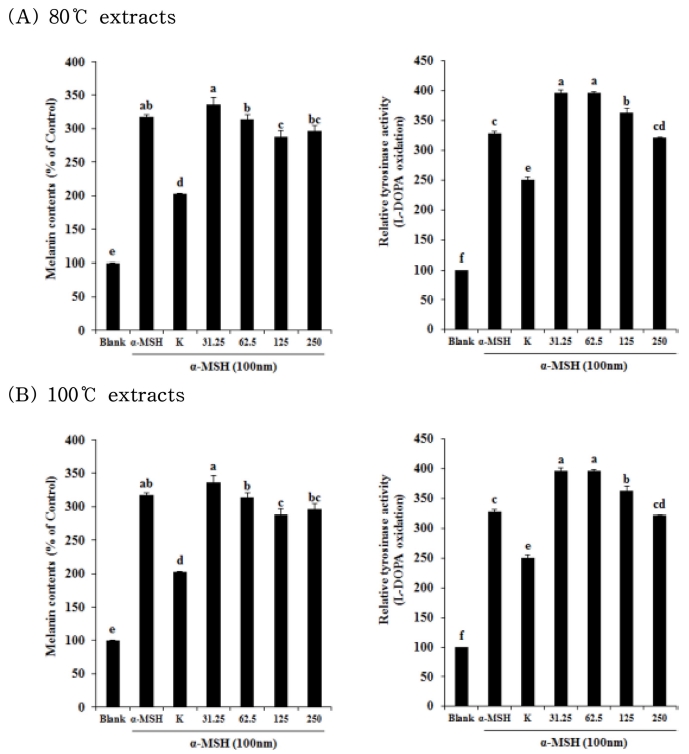
Melanin contents and relative tyrosinase activity of B16F10 melanocyte after treatment with Tremella fuciformis extracts.B16F10 melanocyte were pretreated with Tremella fuciformis extracts, kojic acid (25 uM) and α-MSH (100 nM) cultured for 72 hours. Mean values ± SD from triplicate separated experiments are shown. Different letters (a - f) are significantly difference between groups based on one-way ANOVA with Duncan’s Multiple Range Test (DMRT) at p < 0.05 post hoc.
4. 흰목이버섯 추출물에 의한 B16F10 melanoma 세포에서의 tyrosinase 단백질 발현 확인
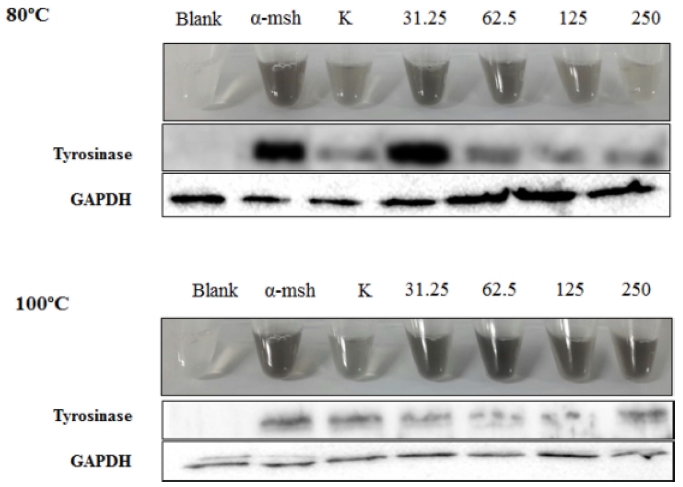
Western blot을 통하여 tyrosinase 단백질 발현을 확인한 결 과 앞선 결과와 동일하게 80°C 추출물에서는 농도 의존적으로 tyrosinase 발현이 감소하였고 100°C 추출물에서는 큰 영향을 미치지 못하였다. 또한 tyrosinase 발현이 감소함에 따라 B16F10 melanoma 세포의 색도 점차 검은색에서 투명한 색으 로 바뀜을 확인하였다 (Fig. 4). 결과를 종합해 보면 흰목이 버섯 80°C 추출물에 의해 tyrosinase 활성이 감소함을 확인하 였으며, 이로 인해 melanin 합성이 저해되어 총 melanin 함량 이 감소하는 효과를 나타내는 것으로 예상할 수 있다. 특히 그 농도가 높아짐에 따라 더 좋은 효능을 보이는 것으로 확인 되었다. 또한 최근에 대추 및 포도 발효물에 대한 미백관련연 구 (Park et al., 2014)와 비교하여 흰목이버섯 추출물이 더 좋은 효과를 나타내었다.
5. 흰목이버섯 추출물에 의한 MITF, TRP-1, Dct의 mRNA 발현 변화
Melanin 생합성 신호전달 체계에는 매우 다양한 신호전달 물 질이 관여하고 있다. 이 중 MITF는 melanin 합성과정에 중요 한 전사 조절 인자로 TRP-1과 Dct 의 전사과정을 촉진한다고 알려져 있다 (Liu and Fisher, 2010; Olivares and Solano, 2009). 앞선 결과에서 더 좋은 효능을 보인 80°C 추출물을 이 용하여 melanin 합성관련 인자인 MITF, TRP-1, Dct의 발현 정도를 측정하였다. 흰목이버섯 80°C 추출물이 melanin 합성 관련 인자인 MITF, TRP-1, Dct 발현을 모두 유의성 있게 감 소시켰다 (Fig. 5). 이는 환초석곡 메탄올 추출물에 대한 연구 결과 (Jung et al., 2015)와 유사한 결과로 melanin 합성관련 인자들을 감소시켜 미백효능을 지니고 있음을 예상할 수 있다.
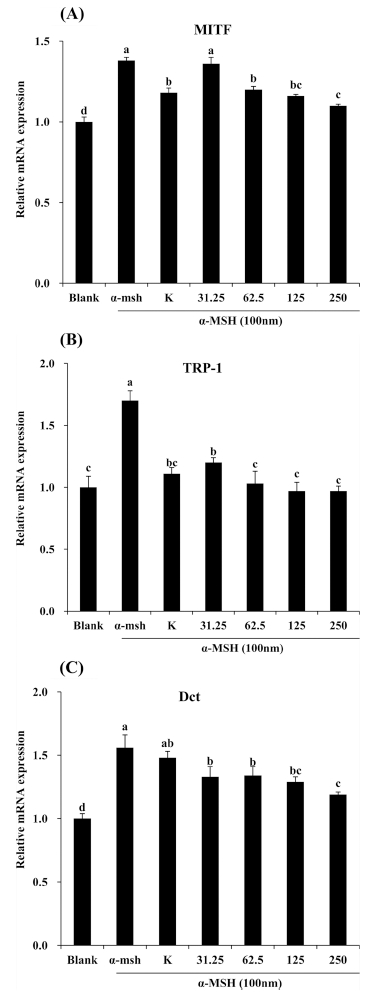
Effect of Tremella fuciformis extracts on mRNA expression of MITF, TRP-1 and Dct in α-MSH stimulated B16F10 melanocyte.Expression of mRNA was estimated by real-time PCR. Findings were normalized to the expression of GAPDH mRNA. Mean values ± SD from triplicate separated experi-ments are shown. Different letters (a - d) are significantly difference between groups based on one-way ANOVA with Duncan’s Multiple Range Test (DMRT) at p < 0.05 post hoc. MITF; Microphthalmia-associated transcrip-tion factor, TRP-1; Tyrosinase related protein- 1, Dct; Dophachrome tautomerase.
6. 흰목이버섯 추출물에 의한 HDFn 세포에서의 procollagen 합성 증가
세포외기질 주요 구성 성분인 collagen은 피부의 섬유아세 포에서 발현되는 단백질로 피부, 뼈 및 치아의 유기 물질의 대부분을 형성하고 피부의 견고성, 결합조직의 저항력, 조직의 결합력, 세포 증식과 분화 유도, 세포의 지탱 등 다양한 기능 을 가진다 (Brenneisen et al., 2002; Kim et al., 2015). Collagen은 피부에서 주름 형성과 밀접한 연관이 있다고 알려 져 있고 collagen이 부족할 경우 주름을 유발할 수 있다. Collagen은 전구물질인 procollagen의 형태로 합성되며, collagen 중합반응 시 collagen 분자로부터 절단 및 분리되어진다고 알려 져 있다 (Lee et al., 2015). 즉 프로펩타이드의 양을 측정하여 세포내에서의 collagen 생합성정도를 파악할 수 있다. 흰목이 버섯을 이용하여 collagen 합성 실험을 진행하였고, 100°C 추 출물에서는 큰 변화는 보이지 않았지만 80°C 추출물에서는 125㎍/㎖ 농도에서부터 유의적으로 procollagen 합성이 증가 하였다 (Fig. 6). 이는 노간주나무의 주름개선 효과를 증명한 연구논문 (Jun et al., 2013)처럼 흰목이버섯 추출물이 procollagen 합성을 촉진하여 탄력 있는 피부를 만들어주는 주 름개선 효능을 나타냄을 알 수 있다.
Effect of Tremella fuciformis extracts on procollagen synthesis in HDFn cells.HDFn cells were incubated overnight. Cells were pretreted with the indicated concentrations of Tremella fuciformis extracts. Procollagen synthesis were perfomed as described in materials and methods. Mean values ± SD from triplicate separated experiments are shown. Different letters (a - b) are significantly difference between groups based on one-way ANOVA with Duncan’s Multiple Range Test (DMRT) at p < 0.05 post hoc.
7. 흰목이버섯 추출물에 의한 HDFn 세포에서의 MMP-1 mRNA 발현
Collagen은 결합조직의 탄력을 유지시켜주는데 이 collagen 을 분해하는 효소는 결국 피부조직에 손상을 가져오게 만드는 역할을 한다. Collagen을 분해하는 효소는 그 종류가 다양하 지만 그 중 MMP-1 (matrix metalloproteinase 1)이 가장 많 이 알려져 있으며, MMP-1 효소의 활성을 저해하는 역할을 할 수 있다면 collagen을 보호하여 피부조직의 탄력을 유지하 고 지속시킨다고 알려져 있다 (Jung et al., 2015). 흰목이 버 섯 추출물이 MMP-1을 저해하여 이러한 효능이 있는지 알아 보기 위해 mRNA 발현을 확인하였다. 그 결과 100°C 추출물 에서는 가장 높은 농도에서 유의적인 감소를 보였으며, 80°C 추출물에서는 농도의존적으로 모든 농도에서 유의적으로 MMP-1을 감소시켰다 (Fig. 7). 우산고로쇠의 화장품효능에 대 한 연구논문에서도 MMP-1 발현을 억제함을 증명하였다 (Sohn et al., 2013). 이와 같은 결과로 흰목이버섯의 80°C 추 출물은 유의적으로 MMP-1 발현을 억제하여 collagen 활성을 유지 및 증가시켜 피부에 도움을 줄 것으로 예상할 수 있다.
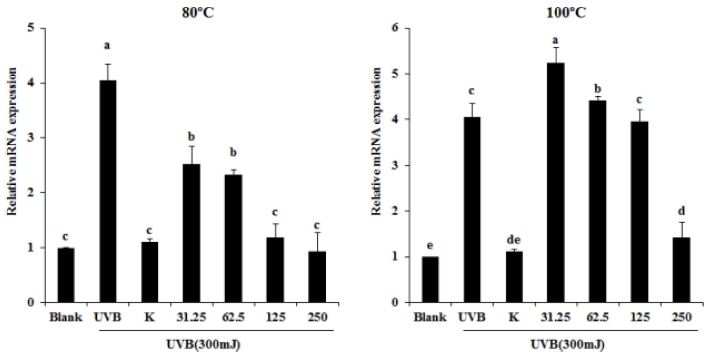
Effect of Tremella fuciformis extracts on mRNA expression of MMP-1 in UVB stimulated HDFn cells.Expression of mRNA was estimated by real-time PCR. Findings were normalized to the expression of GAPDH mRNA. Mean values ± SD from triplicate separated experiments are shown. Different letters (a - e) are significantly difference between groups based on one-way ANOVA with Duncan’s Multiple Range Test (DMRT) at p < 0.05 post hoc.
본 연구는 흰목이버섯 추출물의 미백 및 주름개선 효능을 증명하기 위해 melanin 생성 억제 및 tyrosinase 활성 및 미백 관련유전자 발현을 분석하였고, collagen 합성 증가 및 collagen 분해효소 억제를 확인하였다. Melanin 세포는 자외선 (UV)에 일 정 이상 노출되면 melanocortin peptide 인 α-MSH (melanocyte stimulating hormone) 및 ACTH (adrenocorticotropic hormone) 를 분비하게 된다 (Thody and Graham, 1998). 또한 melanin 세포는 자외선이나 다양한 cytokine과 같은 외부자극에 의해 MSH를 생성하고, melanocortin 1 receptors (MC1R)과 결합하 여 표피에서 세포의 증식, 면역조절, melanin 생합성 등 다양 한 생리적 기능을 하게 된다 (Slominski et al., 2004). 흰목 이버섯 추출물은 α-MSH를 처리하여 melanin 생성이 유도된 상태에서 농도 의존적으로 melanin 생성을 억제하였으며, 기 존 효과가 알려진 양성대조군으로 kojic acid 100㎍/㎖를 처 리했을 때보다 유사하거나 월등한 melanin 억제 효능을 나타 내었다. 이어서 melanin 생성에 관여하는 tyrosinase 활성을 측정했을 때도 흰목이버섯 추출물은 양성대조군인 kojic acid 와 유사하거나 뛰어난 tyrosinase 활성 억제 및 단백질 발현 억제 효과를 보였다.
앞서 언급되었듯이 tyrosinase 활성에 관여하는 중요한 전사 인자인 MITF는 melanin 합성을 위해 관련된 tyrosinase, TRP-1, TRP-2 등 유전자 발현을 증가시킨다 (Liu and Fisher, 2010; Olivares and Solano, 2009). 흰목이버섯 추출 물에 의한 tyrosinase 억제효능과 관련하여 그 기전에 관련된 인자들인 MITF, TRP-1, DCT 유전자 발현을 확인하였다. 그 결과 melanin 형성에 관련된 전사인자들의 유전자 발현을 흰 목이버섯 추출물에 의해 감소시킴을 확인할 수 있었다. Collagen은 피부를 구성하는 주요단백질로 피부노화와 주름생 성에 밀접한 관계이므로 collagen 생성 및 유지는 피부건강에 중요다고 알려져 있으며 MMP-1은 collagenase 역할을 하는 피부주름 생성의 큰 원인임이 밝혀져 있다 (Brenneisen et al., 2002; Kim et al., 2015; Lee et al., 2015). 이와 관련하여 흰목이버섯 추출물이 주름개선 효능이 있는지 알아보기 위해 procollagen 및 MMP-1의 변화를 측정하였다. 그 결과 흰목이 버섯 추출물은 procollagen 합성을 촉진하는 것으로 나타났으 며, MMP-1 유전자를 효과적으로 감소시킴을 확인하였다.
결과를 요약하면, 흰목이버섯 추출물이 B16F10 세포에서 tyrosinase 효소 활성을 저해하였고 melanin 합성 인자들을 조 절함을 통하여 melanin 함량을 감소시킴을 확인할 수 있었으 며, 추가적으로 HDFn 세포에서 procollagen 합성을 증가 시 켰고 이를 분해하는 효소는 반대로 억제함을 나타내었다. 또 한 추출온도와 처리농도를 다르게 설정하여 가장 효능이 좋은 방법을 모색하고자 하였고 결과적으로 80°C 추출물에서 250㎍/㎖의 농도로 처리하였을 때 가장 뛰어난 미백 및 주름 개선 효과를 보였다.
이러한 연구결과를 통하여 흰목이버섯 추출물은 미백 기능 성을 보이며 효과적으로 주름을 개선할 수 있는 화장품 및 다 양한 소재로 사용할 수 있을 것으로 예상되며, 식용이 가능한 천연작물소재를 이용하기 때문에 현대인들이 신뢰하는 안전한 제품이 될 수 있을 것으로 기대된다.
REFERENCES
-
Bradford, MM, A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Analytical Biochemistry, (1976), 72, p248-254.
[https://doi.org/10.1006/abio.1976.9999]

- Brenneisen, P, Sies, H, Scharffetter-Kochanek, K, Ultraviolet-B irradiation and matrix metalloproteinases: From induction via signaling to initial events, Annals of the New York Academy of Sciences, (2002), 973, p31-43.
-
Chen, FF, Cai, DL, Research advances in primary biological effects ofTremellapolysaccharides, Chinese Journal of Integrative Medicine, (2008), 6, p862-866.
[https://doi.org/10.3736/jcim20080818]

-
Cheng, HH, Hou, WC, Lu, ML, Interactions of lipid metabolism and intestinal physiology withTremella fuciformisBerk edible mushroom in rats fed a high-cholesterol diet with or without nebacitin, Journal of Agricultural and Food Chemistry, (2002), 50, p7438-7443.
[https://doi.org/10.1021/jf020648q]

- Cheung, PCK, The hypocholesterolemic effects of two edible mushrooms:Auricularia auricula(tree-ear) andTremella fuciformis(white jelly-leaf) in hypocholesterolemic rats, Nutrition Research, (1996), 16, p1721-1725.
- Chun, HJ, Choi, WH, Baek, SH, Woo, WH, Effect of quercetin on melanogenesis in mela-α melanocyte cells, Korean Journal of Pharmacognosy, (2002), 33, p245-251.
- Jun, HJ, Lee, SY, Kim, JH, An, BJ, Lee, JY, Antiwrinkling effects ofJuniperus rigidaSied, Korean Journal of Microbiology and Biotechnology, (2013), 41, p449-455.
-
Jung, HK, Jang, JH, Ko, JH, Kang, BM, Yeo, JH, Cho, JH, Cho, HW, Bean, CG, Kim, SC, Jung, WS, Whitening and anti-wrinkle effects of Korean nativeDendrobium moniliformemethanol extract, Korean Journal of Medicinal Crop Sciences, (2014), 22, p331-338.
[https://doi.org/10.7783/kjmcs.2014.22.5.331]

-
Jung, HK, Jang, JH, Sim, MO, Lee, KH, Yeo, JH, Kang, BM, Cho, JH, Bean, CG, Kim, SC, Jung, WS, Effect ofDendrobium loddigesiiRolfe methanol extract on melanogenesis in α-MSH stimulated B16F10 cells, Korean Journal of Medicinal Crop Sciences, (2015), 23, p298-304.
[https://doi.org/10.7783/kjmcs.2015.23.4.298]

- Kim, BY, Kim, TG, Kang, WY, Baek, H, Cheon, HY, Kim, D, Functional cosmetic effect of porcine placenta, Korean Chemical Engineering Research, (2010), 48, p327-331.
- Kim, HM, Hur, W, Lee, SY, Polysaccharide extraction and comparison of free radical scavenging activities fromTremella fuciformisandAuricularia auriculafruit body, Food Engineering Progress, (2011), 15, p6-14.
- Kim, NY, Lee, HY, Effect of antioxidant and skin whitening of ethanol extracts from ultrasonic pretreatedAbeliophyllum distichumNakai, Korean Journal of Medicinal Crop Sciences, (2015a), 23, p155-160.
- Kim, NY, Lee, HY, Enhancement of anti-wrinkle activities ofAbeliophyllum distichumNakai through low temperature extraction process, Korean Journal of Medicinal Crop Sciences, (2015b), 23, p231-236.
-
Kim, NY, Park, DS, Lee, HY, Effect of anti-skin wrinkle and antioxidant ofAgastache rugosaKentz through fermentation process of the lactic acid, Korean Journal of Medicinal Crop Sciences, (2015), 23, p37-42.
[https://doi.org/10.7783/kjmcs.2015.23.1.37]

- Ko, MS, Lee, SJ, Kang, SM, Effect ofTremella fuciformisBerk on anti stress activities during long-term and short-term in mice, Korean Journal of Biotechnology and Bioengineering, (2009), 24, p131-139.
- Ko, MS, The growth level of hair follicles and hairs about stress-induced mice ofTremella fuciformisBerk, Journal of the Korean Society of Cosmetology, (2012), 18, p1158-1165.
-
Lee, MK, Kim, DH, Park, TS, Son, JH, Antioxidant and anti-wrinkling effects of extracts fromVitex trifoliaL, Journal of Applied Biological Chemistry, (2015), 58, p125-129.
[https://doi.org/10.3839/jabc.2015.022]

-
Li, H, Lee, HS, Kim, SH, Moon, BK, Lee, C, Antioxidant and anti-inflammatory activities of methanol extracts ofTremella fuciformisand its major phenolic acids, Journal of Food Science, (2014), 79, pC460-C468.
[https://doi.org/10.1111/1750-3841.12393]

-
Liu, JJ, Fisher, DE, Lighting a path to pigmentation: Mechanisms of MITF induction by UV, Pigment Cell and Melanoma Research, (2010), 23, p741-745.
[https://doi.org/10.1111/j.1755-148x.2010.00775.x]

- Oh, YH, Kim, SB, Lee, GW, Kim, HY, Shim, MJ, Rho, HS, Lee, HS, Lee, MW, Lee, UY, Lee, TS, The immunomodulatory and antitumor effects of crude polysaccharides extracted fromTremella fuciformis, The Korean Journal of Mycology, (2006), 34, p105-111.
-
Olivares, C, Solano, F, New insights into the active site structure and catalytic mechanism of tyrosinase and its related proteins, Pigment Cell and Melanoma Research, (2009), 22, p750-760.
[https://doi.org/10.1111/j.1755-148x.2009.00636.x]

-
Park, TS, Kim, DH, Kwon, OJ, Son, JH, A study on biological activities of fermented jujube and grape, Korean Journal of Microbiology and Biotechnology, (2014), 42, p106-113.
[https://doi.org/10.4014/kjmb.1312.12003]

- Parvze, S, Kang, MK, Chung, WS, Cho, CW, Hong, MC, Shin, MK, Bae, HS, Survey and mechanism of skin depigmenting and lightening agents, Phytotherapy Research, (2006), 20, p921-934.
-
Seo, SY, Sharma, VK, Sharma, N, Mushroom tyrosinase: Recent prospects, Journal of Agricultural and Food Chemistry, (2003), 51, p2837-2853.
[https://doi.org/10.1021/jf020826f]

-
Shi, ZW, Liu, Y, Xu, Y, Hong, YR, Liu, Q, Li, XL, Wang, ZG, Tremella polysaccharides attenuated sepsis through inhibiting abnormal CD4+CD25highregulatory T cells in mice, Cellular Immunolgy, (2014), 288, p60-65.
[https://doi.org/10.1016/j.cellimm.2014.02.002]

-
Slominski, A, Tobin, DJ, Shibahara, S, Wortsman, J, Melanin pigmentation in mammalian skin and its hormonal regulation, Physiological Reviews, (2004), 84, p1155-1228.
[https://doi.org/10.1152/physrev.00044.2003]

- Sohn, SH, Lee, SW, Shin, YS, Kim, HD, Yang, SO, Kim, SY, Kim, YO, The effect of cosmetic on anti-wrinkle ofacer monoSap, Korean Journal of Medicinal Crop Sciences, (2013), 21, p262-267.
-
Suh, SS, Hwang, J, Park, M, Park, HS, Lee, TK, Phenol content, antioxidant and tyrosinase inhibitory activity of mangrove plants in micronesia, Asian Pacific Journal of Tropical Medicine, (2014), 7, p531-535.
[https://doi.org/10.1016/s1995-7645(14)60089-4]

-
Thody, AJ, Graham, A, Does α-MSH have a role in regulating skin pigmentation in humans?, Pigment Cell Research, (1998), 11, p265-274.
[https://doi.org/10.1111/j.1600-0749.1998.tb00735.x]

-
Ukai, S, Hirose, K, Kiho, T, Hara, C, Irikura, T, Antitumor activity on sarcoma 180 of the polysaccharides fromTremella fuciformisBerk, Chemical and Pharmaceutical Bulletin, (1972), 20, p2293-2294.
[https://doi.org/10.1248/cpb.20.2293]

-
Urabe, K, Aroca, P, Tsukamoto, K, Mascagna, D, Paulumbo, A, Prota, G, Hearing, VJ, The inherent cytotoxicity of melanin precursors: A revision, Biochimica et Biophysica Acta, (1994), 1221, p272-278.
[https://doi.org/10.1016/0167-4889(94)90250-x]

- Wu, M, Hemesath, TJ, Takemoto, CM, Horstmann, MA, Wells, AG, Price, ER, Fisher, DZ, Fisher, DE, c-Kit triggers dual phosphorylations, which couple activation and degradation of the essential melanocyte factor Mi, Genes and Development, (2000), 14, p301-312.