산민들레 종자의 발아특성 연구
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Many Taraxacum spp. plants are widely used in medicine, but some of them have propagation problems, such as strong dormancy and poor germination rates. This study investigated the effects of temperature, gibberellic acid (GA3), and potassium nitrate (KNO3) on seed germination in Taraxacum ohwianum.
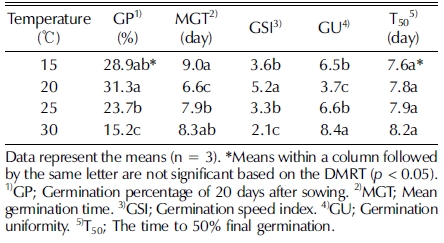
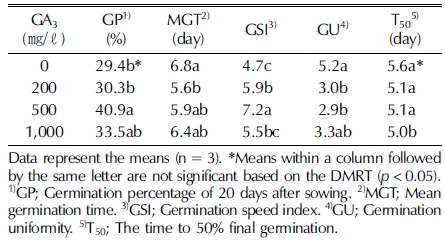
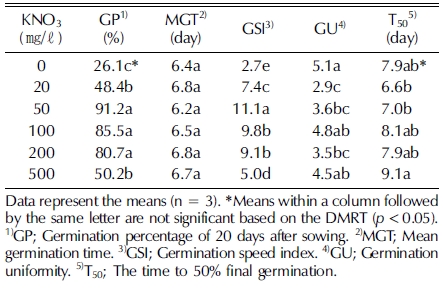
The seeds (NIBRGR0000135524) were exalbuminous, and their length and width were 4.54 ± 0.032㎜ and 0.97 ± 0.029㎜, respectively. Various germination temperatures were tested (15, 20, 25, and 30°C), the optimum temperature for germination was found to be 20°C (31.3%). High temperature (30°C) resulted in non-typical seedlings (thickened and crumpled cotyledons, with a restricted root system). To increase the germination capacity, GA3 (200, 500, and 1,000 ㎎/ℓ ) or KNO3 (20, 50, 100, 200, and 500 ㎎/ℓ ) solutions were used as pre-soaking solutions instead of water. The GA3 treatments increased the germination percentage and rate, but germination percentage was higher with the KNO3 treatments. Under the 50 - 200 ㎎/ℓ KNO3 treatments, the germination percentage exceeded 80% after 12 days, and 50 ㎎/ℓ KNO3 was notably effective (91.2% after 15 days).
T. ohwianum seeds showed improved germination at low temperatures. The best method for germination was presoaking in 50 ㎎/ℓ KNO3 for 24 h, in the dark at 4°C, and then incubating the germinated seed at 20°C for 15 days.
Keywords:
Taraxacum ohwianum Kitam., Asteraceae, Tetrazolium Test, Germinability, Gibberellic Acid, Potassium Nitrate서 언
산민들레 (Taraxacum ohwianum Kitam.)는 국화과 식물로 중국 동북지역과 한국에 분포하며, 국내에서는 고산지대에 분 포하는 다년생 초본이다 (NIBR, 2013). 우리나라에는 총 8종 의 민들레속 식물 [흰민들레, 영도민들레 (큰민들레), 좀민들레 (한라민들레), 붉은씨서양민들레, 털민들레, 서양민들레 (양민 들레), 산민들레 및 흰털민들레 (북방민들레)]이 보고되었고 (NIBR, 2011), 이 중 서양민들레와 붉은씨서양민들레는 귀화 종이다.
민들레속 식물은 예로부터 약용소재로 사용되어왔고 (Schütz et al., 2006), 우리나라에서는 민들레, 서양민들레, 털민들레와 흰민들레의 전초가 생약소재 [생약명: 포공영 (蒲公英)]로 이 용되고 있다 (MFDS, 2016). 산민들레는 전통적으로 사용되어 온 식의약 소재는 아니지만, 최근 뿌리에서 지방분해효소 (pancreatic lipase) 저해를 통한 항비만 효과 (Kim and Kim, 2011)와 포도상구균 (Staphylococcus aureus) 저해활성 (Sun et al., 2014)이 보고되었고, 지상부는 당뇨합병증 (당뇨성 망 막증, 신경병증과 신장손상 등)을 유발하는 aldose 환원효소 억 제 효과 (Mok et al., 2010), 전초에서는 항산화효과와 항염증 효과 (Choi et al., 2013)가 보고되어 있으므로 식의약 소재로 개발 가능성이 높다. 그러나 식물소재 대량증식을 위한 연구 가 미흡하고 특히 저장종자의 발아연구가 보고된 바 없어 육 묘 생산을 위한 체계적인 발아특성 연구가 필요하다.
초본식물 대부분은 실생번식방법으로 증식 및 재배를 하는 데, 자생 민들레는 발아율이 낮아 적정 입묘율 확보가 어려워 발아율 및 발아속도 향상, 발아균일성 확보를 통해 실생번식 에 적합한 증식방법 개발이 필요하다 (Ahn and Choi, 2000;Kang et al., 2004). 자생 민들레 중 발아특성이 보고된 흰민 들레와 좀민들레는 초기에 일부 발아하고 저온처리에 의해 발 아율이 향상되는 휴면유형을 보이며, 30일 이상 장기간의 저온 층적처리 후 광조건에서 발아되는 발아특성 결과가 보고된 바 있다 (Ahn and Choi, 2000). 저온처리는 다수의 온대성 식물 의 휴면타파를 촉진하는 중요한 요인이지만 (Jung and Kim, 2009), 장기간의 저온층적처리로 인한 비용 증가와 저온성 미 생물의 증식으로 종자활력 감소 등의 문제가 발생할 수 있기 때문에 발아기간을 단축시키고 발아력을 향상시킬 수 있는 효 율적인 방법 개발이 필요하다.
따라서 본 연구는 산민들레 종자의 실생번식을 위한 효율적 인 발아조건을 확립하기 위하여 종자의 형태적 특성, 활력 검 증, 적정 발아온도 및 지베렐린 (GA3)과 질산칼륨 (KNO3)이 발아력 향상에 미치는 영향을 분석하여 발아특성을 규명하고 자 수행되었다.
재료 및 방법
1. 실험재료
연구재료로 사용된 산민들레 (Taraxacum ohwianum Kitam.) 종자는 2012년 5월 25일 강원도 평창군 대관령면에서 채집되 었다. 모본은 확증표본 (NIBRVP0000417518)으로 제작하여 국 립생물자원관에 보존하였고, 종자 (NIBRGR0000135524)는 파 쇄립, 저질, 병충해립, 감염립, 이물질 등을 제거하여 건조실 (15℃, 10%)에서 수분함량 5 - 10% 미만으로 건조 후 국가야생 식물종자은행 장기수장고 (−18℃, 상대습도 40%)에 보존 (3년 6개월)하였다.
2. 종자의 형태학적 특성 및 활력검증
종자의 외부형태는 해부현미경 (SMZ1500, Nikon, Tokyo, Japan)으로 관찰하였다. 종자의 크기는 디지털카메라 (DS-Ri1, Nikon, Tokyo, Japan)로 촬영된 이미지를 이미지 분석 프로그램 인 NIS-Elements BR 3.10 software (Nikon GmbH, Vienna, Austria)로 측정하였으며, 종자 100립 중 20립을 무작위 선발하 여 3반복으로 길이와 너비를 측정한 후 평균과 표준오차를 구 하였다. 종자의 천립중은 종자계수기 (Contador, Pfeuffer GmbH, Kitzingen, Germany)로 1,000립씩 계수한 후 정밀전자저울 (MS1003S, Mettler-Toledo GmbH, Greifensee, Switzerland)로 무게를 측정하였고, 3반복으로 수행하여 평균과 표준오차를 구 하였다.
종자를 발아하기 전에 International Seed Test Associate의 tetrazolium test (이하, TZ 테스트) 방법을 다음과 같이 응용 하여 활력을 검증하였다 (ISTA, 2014). 종자 상단에 단면도 (Single edge blades DN-52, Dorco, Seoul, Korea)로 얇은 칼 집을 낸 후 멸균수 침지하여 20℃에서 18시간 동안 전처리하였 고, 멸균수를 제거하고 종자를 2, 3, 5-triphenyl tetrazolium chloride (T8877, Sigma Chemical Co., St. Louis, MO, USA) 을 1%로 희석한 용액을 넣고 30℃에서 20시간 처리 후 종단 면을 절단하여 종자 내부 배의 염색 정도와 상태를 해부현미 경으로 관찰하여 활력을 판단하였다.
3. 종자 발아 실험
종자는 파종 전 70% 에탄올 (30초)과 2%의 NaOCl (10분) 으로 소독하고 멸균수로 5회 수세하였다. 100립씩 무작위 선 발하여 치상하였으며, 3반복으로 발아 실험을 수행하였다.
발아 최적 온도조건을 찾기 위해 소독된 종자를 멸균수에 24시간 동안 침지 (4℃, 암조건) 후 여과지 (Whatman No. 2, Whatman Ltd., Maidstone, Kent, England)를 넣은 페트리디 쉬 (10090, SPL Life Science Co., Ltd., Pocheon, Korea) 내에 치상하여 각각 다른 온도조건 (15, 20, 25, 30℃)하에서 20일간 발아연구를 수행하였다.
식물생장조절물질 중 하나인 GA3를 사용하여 발아촉진 효 과를 연구하기 위해 소독된 종자를 GA3 희석액 (0, 200, 500, 1,000㎎/ℓ)에 침지 (4℃, 암조건) 후 여과하여 치상하였 고, 상기 연구에서 발아적온으로 규명된 온도 20℃ 상에서 20 일간 발아연구를 수행하였다.
또한 무기염류에 의한 발아촉진 효과를 연구하기 위하여 종 자를 KNO3 수용액 (0, 20, 50, 100, 200, 500㎎/ℓ)에 침 지 (4℃, 암조건) 후 여과하여 치상하였으며, 20℃에서 20일간 발아연구를 진행했다.
발아 환경 조건에 따른 발아특성을 분석하고자 각 실험에서 파종 후 2 - 3일 간격으로 종자의 발아 상태를 조사하였고, 발 아율 (germination percentage, GP), 평균발아소요일수 (mean germination time, MGT), 발아속도지수 (germination speed index, GSI), 발아균일도 (germination uniformity, GU)와 T50 (파종 후 최종 발아율에 대한 50% 발아까지 도달하는데 소요 되는 기간)을 아래와 같이 계산하였다 (Coolbear et al., 1984;Gavassi et al., 2014).
N; 총 치상한 종자 수, n; 발아 수, Tx; 치상 후 조사일수, Nx; 조사 당일 발아 수, Ti; ni까지 소요된 기간, Tj; nj까지 소요된 기간, ni; 최종 발아율 대비 50% 미만까지의 누적 발 아 수, nj; 최종 발아율 대비 50% 초과된 누적 발아 수.
4. 통계처리
모든 실험은 3반복으로 수행되었고, Microsoft™ Office Excel 2007 (Microsoft corporation, Redmond, WA, USA)을 사용하여 평균과 표준오차를 구하고, 통계프로그램 (Statistical analysis system version 9.2, SAS Institute, Cary, NC, USA)을 이용하여 ANOVA (analysis of variance) 및 DMRT (Duncan's Multiple Range Test)를 수행하였으며, 5% 유의수준에서 각 처리간의 유의성을 비교하였다.
결과 및 고찰
1. 종자의 형태적 특성 및 활력
산민들레 (Taraxacum ohwianum Kitam.) 종자는 선단이 날 카롭게 돌출되고 가시모양의 돌기가 있는 주걱형 모양으로 종 피는 황갈색이다 (Fig. 1A). 크기는 길이 4.54 ± 0.032㎜, 너비 0.97 ± 0.029㎜이고, 천립중은 0.97 ± 0.087 g이였다. 종자의 단 면을 확인한 결과, 무배유종자로 TZ 테스트에서 모두 배가 전 체적으로 붉은색으로 염색되었고 배 상태가 매우 양호하여 활 력이 있는 것으로 판단되었다 (Fig. 1B).
2. 온도조건에 의한 발아특성
산민들레 종자 발아는 자엽이 먼저 돌출되는 유형 (Fig. 2A)과 유근이 돌출되는 유형 (Fig. 2B)으로 각각 관찰되었으 며, 발아된 종자의 70% 이상이 배로부터 자엽이 빠르게 발달 하여 유근보다 먼저 출현하면서 발아가 개시되었다.

Germination process of Taraxacum ohwianum. A; the cotyledons emerges first. B; the roots emerge first. Bar, 10㎜.
온도조건별 실험에서 발아가 빠르게 시작된 온도는 20℃로, 파종 2일 후 발아가 시작되어 10일까지 발아하고 10일 이후 에는 거의 발아하지 않았다 (Fig. 3). 산민들레 종자는 20℃에 서 통계적으로 유의하게 최종 발아율과 발아속도가 우수하였 으며, 평균발아소요일수와 발아균일도가 가장 낮아 발아가 짧 은 기간 동안 동시에 진행됨을 알 수 있었다 (Table 1). 반면 고온 (30℃)에서는 발아가 억제되었을 뿐 아니라, 발아속도가 느리고, 발아묘의 자엽이 두껍고 뿌리가 거의 발달하지 못하 는 비정상묘로 관찰되었다 (Fig. 4, Table 1).
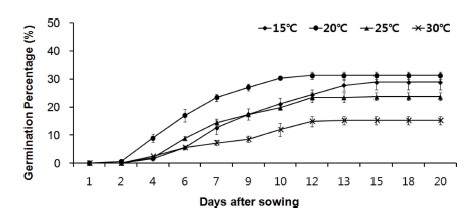
Effect of temperature on the germination of Taraxacum ohwianum. Mean values ± SD of each with 100 seeds from triplicate separated experiments are shown.

Effects of temperature on the seed germination percentage, time, rate and uniformity in Taraxacum ohwianum.

Growth of Taraxacum ohwianum seedling according to the different temperature. A; normal seedling development at 15℃, B; normal seedling development at 20℃, C; abnormal seedling development at 25℃, D; abnormal seedling development at 30℃. Bar, 10 ㎜.
선행연구에서 상동나무 (Song et al., 2015)와 갈매보리수나 무 (Choi, 2012) 등 일부 자생식물 종자 또한 고온에서는 발 아율이 급격하게 낮아지거나 비정상묘 출현율이 증가하는 결 과가 보고된 바 있다. 온도는 종자의 발아율과 발아속도를 결 정하는 가장 중요한 요인 중 하나로 (Phartyal et al., 2003), 유묘의 발달과 생육에도 영향을 미치므로 (Washitani, 1985), 실생번식으로 식물을 증식하기 위해서는 종자 발아율과 발아 속도를 촉진하고 유묘의 정상적인 발달에 적합한 온도 규명은 반드시 필요하다. 종자 발아를 평가할 때 양적 지표로는 발아 율, 질적 지표로는 평균발아소요일수와 발아속도를 고려하는 데 (Choi, 2012), 본 연구에서 산민들레 종자는 발아의 양적 지표, 질적지표와 유묘의 발달을 모두 고려했을 때 발아 최적 온도 20℃였고, 고온에서는 발아와 유묘의 생육이 억제되므로 파종 시 온도관리에 주의해야 할 것으로 판단되었다.
3. 지베렐린에 의한 발아촉진 효과
종자 발아를 촉진하는 GA3는 대표적인 생장조절물질 중 하 나로, 휴면타파의 신호전달물질로 작용하며, 저온처리 대체효 과와 종자 내부의 α-amylase 활성 증진을 통한 발아 촉진효과 가 보고된 바 있다 (Kim and Lee, 2013;Yoon et al., 1999).
산민들레 종자를 GA3 (0 - 1,000㎎/ℓ) 희석액으로 전처리한 결과 GA3는 발아율과 발아속도를 향상시켰다 (Table 2). 특히 GA3 500㎎/ℓ 처리구에서 최종 발아율이 통계적으로 유의하 게 가장 높았고 (40.9%), 평균발아소요일수는 5.9일로 대조구 인 멸균수 처리구 (6.8일)보다 13.2% 단축되었으며, 발아속도 는 7.2로 대조구 (4.7)보다 53% 증가되었다. 또한 발아 후 자 엽과 뿌리가 정상적으로 발육하였으며 비정상묘는 관찰되지 않았다 (data not shown). 한편 고농도 (1,000㎎/ℓ)에서는 오히려 발아가 억제되었는데, 선행연구에서 동일 속인 서양민 들레 종자 또한 GA3 고농도 (1.5 mM) 처리구에서는 발아가 억제되어 본 연구와 유사한 결과가 도출되었다 (Kim and Lee, 2013). 따라서 GA3는 민들레속 식물의 종자 발아를 촉진 할 수 있으나, 처리 농도에 따라 발아특성이 달라지며, 고농도 에서는 발아가 억제될 수 있으므로 처리농도를 조절할 필요가 있는 것으로 판단되었다.

Effects of gibberellic acid (GA3) treatment on the seed germination percentage, time, rate and uniformity in Taraxacum ohwianum.
일반적으로 야생식물 종자 발아율은 재배작물보다 매우 낮 으며, 50% 이하의 낮은 발아율을 보이는 것으로 보고되어 있 다 (Kang et al., 1997). 최근 효능이 인정된 야생식물의 작물 화 연구가 많이 진행되고 있는데, 야생식물을 자원화하기 위 해 입묘과정에서 적정 입묘율 확보가 필요하며, 파종 후 종자 대부분이 동시에 빠르게 발아하여 정상묘로 자랄 수 있는 종 자처리방법을 개발해야 한다 (Kim et al., 2014, 2015; Lee et al., 2014).
본 연구에서 산민들레 종자는 GA3 500㎎/ℓ 처리로 발아율, 발아속도와 발아동시성이 향상되었으나, 최종 발아율은 40.9% 로 대조구보다 1.4배 증가되어 발아율의 증가세가 낮고, 우슬 (90% 내외), 노랑하늘타리 (90% 이상), 지치 (80% 내외)와 같이 약용식물로 작물화된 야생식물보다 발아율이 낮아 작물 화를 위해 발아율을 개선할 수 있는 방법을 개발할 필요가 있 는 것으로 판단하여 무기염류를 이용한 발아촉진연구를 진행 하였다 (Kim et al., 2014, 2015; Lee et al., 2014).
4. 무기염류에 의한 발아촉진 효과
종자 휴면타파에 자주 사용되는 KNO3는 무기염류 중 하나 로, 휴면타파, 발아촉진 및 유묘의 건강한 생육을 유도하는 것 으로 보고된 바 있다 (Raisi et al., 2013). KNO3 처리가 휴 면타파에 미치는 정확한 기작은 밝혀지지 않았으나, 종자의 호 흡과정에서 KNO3에 의해 시트르산회로 (citric acid cycle)의 산소요구량이 감소되어 대기 중 산소 농도가 증가되는 방법으 로 발아 촉진에 영향을 주는 것으로 보고되었다 (Bewley and Black, 1994;Raisi et al., 2013).
본 연구에서는 산민들레 종자에 KNO3 수용액 (50 - 200㎎/ℓ)을 처리하였을 때 발아율이 80% 이상으로 증가되었 고 (Table 3), 발아묘는 모두 자엽과 뿌리가 정상적인 형태로 발달하는 정상묘였으며 특히 멸균수 처리구에 비해 뿌리가 빨 리 자라는 특징을 보였다 (data not shown).

Effects of potassium nitrate (KNO3) treatment on the seed germination percentage, time, rate and uniformity in Taraxacum ohwianum.
특히 KNO3 50㎎/ℓ 농도에서 최종 발아율 91.2%로 GA3 처리와 비교하여 발아율이 2.2배 이상 향상되었고, 발아속도가 빠르고 발아균일도가 낮아 종자가 동시에 발아하는 발아특성 을 보였다 (Table 2와 3). 발아 개시 후 종료까지 소요되는 일자를 뜻하는 평균발아소요일수는 모든 처리구에서 6.2 - 6.8 일이었으며 통계적으로 유의한 차이가 없어 KNO3 처리는 발 아소요일수와 관계가 없는 것으로 사료되었다.
야생식물 종자 발아에 KNO3 수용액 침지처리가 자주 사용 되는데, 산민들레와 동일속의 흰민들레와 Taraxacum koksaghyz 종자는 각각 20mM과 500mM의 KNO3 수용액에 의해 발아 가 촉진된 바 있으며 (Levitt and Hamm, 1943;Park et al., 2014), 민들레속 이외에도 지치 (지치속) 종자는 100 mM (Kim et al., 2014), 우슬 (쇠무릎속) 종자는 200 mM (Kim et al., 2015)의 KNO3 수용액 침지처리에 의해 발아가 촉진되 는 것으로 보고되어있다. 따라서 KNO3 처리는 야생식물 종자 발아를 향상시킬 수 있는 효율적인 전처리 방법 중 하나로 사 료되며, 식물 종에 따라 발아에 영향을 미치는 농도 차이가 있어 종 특성에 따른 최적 처리방법 개발 및 특성 연구가 중 요할 것으로 사료되었다.
약용식물의 안정적 공급을 위해 실생묘의 연중생산체계를 갖춰야하고, 종자 활력을 유지할 수 있는 저장 방법과 저장종 자의 발아조건을 구축하는 것이 가장 중요하다. Ahn 등 (2012)은 산민들레 종자는 채종 후 직파하면 80 - 90% 발아하 고, 25℃에 30일 또는 5℃에 60일 저장해도 85% 이상 발아 하여 휴면성이 낮다고 하였으나, 본 연구에서 3년 6개월 동안 저온저장된 (−18℃, RH 40%) 산민들레 종자는 발아율이 30% 내외로 낮았고, KNO3에 의하여 발아율이 90% 내외로 크게 향상되었다. 따라서 산민들레 종자는 저온저장시 종자 활 력은 유지되지만, 2차 휴면이 발생하는 것으로 사료되며, 이는 KNO3 처리로 타파될 수 있는 것으로 확인되었다.
식물증식의 효율적 생산 관리를 위해서는 종자가 동시에 발 아되는 것이 유리하기 때문에 발아조건을 확립하기 위해서는 발아율 뿐 아니라 발아시간, 속도, 균일성과 함께 동시성도 고 려되어야 한다. 본 연구에서 발아율이 91.2%로 가장 높았던 KNO3 (50㎎/ℓ) 처리구에서는 높은 발아율 뿐 아니라 발아 소요일수가 짧고 발아속도가 빠르며 동시에 발아하는 특징을 보였다.
따라서 산민들레 종자는 저온 (−18℃)에서 장기보존이 가능 하며, 산민들레 증식과 대량생산을 위해서는 종자를 KNO3 용 액 (50㎎/ℓ)에 저온 상태로 1일간 침지 후 20℃ 전광조건하 에 파종하는 방법 적용이 효율적임을 판단할 수 있었다.
감사의 글
본 연구는 국립생물자원관 국가 야생식물 종자 확보 및 은 행 운영사업(과제번호: NIBR201519101)의 지원에 의해 이루 어진 결과로 이에 감사드립니다.
References
- Ahn, SY, Kim, JH, Kim, YJ, Kwon, SB, (2012), Cultivation of wild vegetables, Gangwondo Agricultural Research and Extension Services, Chuncheon, Korea, p165-166.
- Ahn, YH, Choi, KY, (2000), The comparisons of germination characteristic in nativeTaraxacumspp. andTaraxacumofficinaleSeeds, Korean Journal of Environment and Ecology, 14, p199-204.
-
Bewley, JD, Black, M, (1994), Seeds: Physiology of development and germination, Plenum Press, New York. NY,USA, p160-171.
[https://doi.org/10.1007/978-1-4899-1002-8]

-
Choi, CH, (2012), Effect of temperature and various pre-treatments on germination ofHippophae rhamnoidesseeds, Korean Journal of Plant Resources, 25, p132-141.
[https://doi.org/10.7732/kjpr.2012.25.1.132]

-
Choi, KH, Nam, HH, Choo, BK, (2013), Effect of five Korean nativeTaraxacumon antioxidant activity and nitric oxide production inhibitory activity, Korean Journal of Medicinal Crop Science, 21, p191-196.
[https://doi.org/10.7783/KJMCS.2013.21.3.191]

-
Coolbear, P, Francis, A, Grierson, D, (1984), The effect of low temperature pre-sowing treatment on the germination performance and membrane integrity of artificially aged tomato seeds, Journal of Experimental Botany, 35, p1609-1617.
[https://doi.org/10.1093/jxb/35.11.1609]

-
Gavassi, MA, Fernandes, GC, Monteiro, CC, Peres, LEP, Carvalho, RF, (2014), Seed germination in tomato: A focus on interaction between phytochromes and gibberellins or abscisic acid, American Journal of Plant Sciences, 5, p2163-2169.
[https://doi.org/10.4236/ajps.2014.514229]

- International Seed Testing Association(ISTA), (2014), International rules for seed testing, Chapter 6: The tetrazolium test, International Seed Testing Association, Bassersdorf, Switzerland, p1-25.
- Jung, HH, Kim, KS, (2009), Chilling requirements for dormancy breaking and floweringAdonis amurensisRegel et Radde, Horticulture Environment and Biotechnology, 50, p502-508.
- Kang, BH, Shim, SI, Lee, SG, Park, SH, (1997), Survey on wild edible plant resources in Korea and its germination characteristics, Korean Journal of Crop Science, 42, p236-246.
- Kang, JH, Yoon, SY, Jeon, SH, (2004), Analysis on practicality of seed treatments for medicinal plants published in Koreanscientific journals, Korean Journal of Medicinal Crop Science, 12, p328-341.
-
Kim, DH, Ahn, BJ, An, HJ, Ahn, YS, Kim, YG, Park, CG, Park, CB,
Cha, SWSong, BH, , (2014), Studies on seed germinationcharacteristics and patterns of protein expression ofLithospermum erythrorhizonby plant growth regulators and seed primings, Korean Journal of Medicinal Crop Science, 22, p435-441.
[https://doi.org/10.7783/KJMCS.2014.22.6.435]

-
Kim, DH, Ahn, BJ, An, HJ, Ahn, YS, Kim, YG, Park, CG, Park, CB, Cha, SW, Song, BH, (2015), Studies on seed germination characteristics and patterns of protein expression ofAchyranthes japonicaby treating plant growth regulators and seed primings, Korean Journal of Medicinal Crop Science, 23, p13-19.
[https://doi.org/10.7783/KJMCS.2015.23.1.13]

-
Kim, T, Kim, TH, (2011), Pancreatic lipase inhibitors in the roots ofTaraxacum ohwianum, a herb used in Korean traditional medicine, Korean Journal of Food Preservation, 18, p53-58.
[https://doi.org/10.11002/kjfp.2011.18.1.053]

-
Kim, YH, Lee, IJ, (2013), Influence of plant growth regulator application on seed germination of dandelion(Taraxacum officinale), Weed and Turfgrass Science, 2, p152-153.
[https://doi.org/10.5660/WTS.2013.2.2.152]

-
Lee, SG, Kim, HY, Ku, JJ, (2014), Effects of seed storage temperature and pre-treatment on germination, seedling quality on wildTrichosanthes kirilowiiMaxim andTrichosanthes kirilowiivar.japonicaKitam, Korean Journal of Medicinal Crop Science, 22, p53-59.
[https://doi.org/10.7783/KJMCS.2014.22.1.53]

-
Levitt, J, Hamm, PC, (1943), A method of increasing the rate of seed germination ofTaraxacum kok-saghyz, Plant Physiology, 18, p288-293, 16653847.
[https://doi.org/10.1104/pp.18.2.288]

- Ministry of Food and Drug Safety(MFDS), (2016), The Korean herbal pharmacopeia, Ministry of Food and Drug Safety, Cheongju, Korea, p418-418.
- Mok, SY, Kim, HM, Han, S, Lee, JM, Cho, EJ, Choi, K, Park, KW, Lee, S, (2010), Aldose reductase inhibitory activity ofTaraxacum ohwianum, Korean Journal of Plant Resources, 23, Supplement1p88-88.
- National Institute of Biological Resources(NIBR), (2011), National list of species of Korea, National Institute of Biological Resources, Incheon, Korea, p375-376.
- National Institute of Biological Resources(NIBR), (2013), Species Korea., http://www.nibr.go.kr/species/home/main.jsp(citedbyMarch2,2016).
- Park, JE, Chang, YH, An, JU, Yoon, HS, Hong, KP, (2014), Effect of several priming treatment on seed germination ofTaraxacum coreanumNakai, Korean Journal of Horticultural Science and Technology, 32, Supplement2p208-208.
-
Phartyal, SS, Thapliyal, RC, Nayal, JS, Raeat, MMS, Joshi, G, (2003), The influences of temperatures on seed germination rate in Himalayan elm(Ulmus wallichiana), Seed Science and Technology, 31, p83-93.
[https://doi.org/10.15258/sst.2003.31.1.09]

- Raisi, A, Kalat, SMN, Darban, ARS, (2013), The study effects of stratificaion, temperature and potassium nitrate on seed dormancy breakingFerula assa-foetida, World Applied Sciences Journal, 21, p379-383.
-
Schütz, K, Carle, R, Schieber, A, (2006), Taraxacum: A review on its phytochemical and pharmacological profile, Journal of Ethnopharmacology, 107, p313-323, 16950583.
[https://doi.org/10.1016/j.jep.2006.07.021]

-
Song, SC, Song, CK, Kim, JS, (2015), Characteristics of seedgermination and fruit forSageretia theain Jeju region, Korean Journal of Medicinal Crop Science, 23, p8-12.
[https://doi.org/10.7783/KJMCS.2015.23.1.8]

-
Sun, HY, Li, ZB, Liu, WX, Wang, XY, Zhang, TJ, Feng, ZJ, (2014), In vitroantibacterial activities of antibiotics and traditional Chinese medicinal herb extracts onEscherichia coliandStaphylococcus aureus, Asian Journal of Chemistry, 26, p298-302.
[https://doi.org/10.14233/ajchem.2014.16174]

-
Washitani, I., (1985), Germination-rate dependency on temperature ofGeranium carilinianumseeds, Journal of Experimental Botany, 36, p330-337.
[https://doi.org/10.1093/jxb/36.2.330]

- Yoon, ST, Lee, DJ, Kim, YH, (1999), The technology for increasing seed viability by priming treatment and plant growth regulators in medicinal plants, The Journal of the Korean Society of International Agriculture, 11, p85-95.