미생물 처리 발효 산삼배양근의 생리활성 변화
†Corresponding author: (Phone) +82-33-250-6411E-mail) cyyu@kangwon.ac.kr
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study examined the use of new bio-materials with enhanced value and functionality, which were derived from fermented wild ginseng cultures.
To examine the antioxidant activity associated with biological functions, radical scavenging analyses (2,2-diphenyl-1-picrylhydrazyl, DPPH and 2,2’-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid, ABTS) and superoxide dismutase (SOD)-like activity analyses were conducted. Furthermore, the total phenolic and flavonoid contents of wild ginseng fermented with microorganisms (Leuconostoc mesenteroides, Bacillus circulans, Bacillus licheniformis and B. subtilis subsp. inaquosorum) were evaluated to determine the antioxidant activity increment. Regarding ginseng fermented with B. licheniformis, values of 70.6 ± 1.4%, 44.3 ± 1.7%, and 88.4 ± 1.3% were measured using DPPH, ABTS, and SOD-like antioxdiant activity analyses, respectively. The total phenolic content in ginseng fermented with B. licheniformis was 184.5 ± 0.9 ㎍• GAE/㎖, and the total flavonoid contents was 108.5 ± 1.8 ㎍• QE/㎖ in ginseng fermented with L. mesenteroides.
Of the four types of lactic acid bacteria examined, the use of B. licheniformis to ferment ginseng resulted in greatest increase in antioxidant activity. Therefore, ginseng fermented by microorganisms might be used to produce functional bio-materials.
Keywords:
Panax ginseng C. A. Meyer, ABTS, DPPH, Microorganisms, SOD-Like Activity서 언
산삼은 두릅나무과에 속하는 다년생 초본으로서 인삼 (Panax ginseng C. A. Meyer)이 야생에서 자연적으로 발아하여 성장 한 삼을 말한다 (Shin et al., 2001). 약리효과에 대해서는 인 삼보다는 장뇌삼이, 장뇌삼보다는 산삼이 강하다고 알려져 있 고, 민간이나 임상에서 질병 치료에 직접 이용되고 있다 (Nam et al., 2012). 그러나 산삼이 생산량이 적고 가격이 비 싸기 때문에 산업적인 응용에는 많은 어려움이 있는 것으로 알려져 왔다 (Kim et al., 2012). 산삼은 당뇨, 암, 혈압, 간, 심장 질환 등에 효과적이고, 각종 성인병 예방과 신진대사 촉 진 작용을 하며, 인체 면역기능을 향상시켜주는 것으로 보고 되었다 (Hong et al., 2008). 여러 가지 약리작용 효과 중 면 역 활성 증가 효과에 대한 연구가 가장 많은 것으로 알려져 있다 (Shin, 2001).
산삼의 제한적 생산과 고가 비용 문제로 인해 생물공학적 기 법인 식물조직배양기술과 대용량 생물반응기 (bioreactor)를 이 용한 산삼배양근의 대량 증식 기술이 발달되었다. 산삼배양근 의 대량증식은 산삼 뿌리를 1.0㎎/ℓ 2,4-dichorophenoxyacetic acid (2,4-D)와 1.0㎎/ℓ kinetine를 첨가한 Murashige and Skoog (MS) 배지에 접종하여 캘러스를 유도한 후, 5㎎/ℓ indole-3-butyric acid (IBA)가 첨가된 Schenk and Hildebrandt (SH) 배지가 담긴 생물반응기를 이용하여 산삼 부정근 생산이 가능해졌다 (Lee, 2007). 이러한 생물공학 기법으로 배양된 산 삼은 유전적 조성도 안정적이고, 특이적 유효물질인 ginsenoside 생산 수율도 높은 것으로 보고되었다 (Shin et al., 2010). 산삼 배양근은 인삼과 비교하면 사포닌 및 Rh2, Rg3, Rb1, Rh1, Rg1, Rg2, Re, Rf 등 다양한 성분을 더 많이 함유하고 있어 서 화장품과 건강기능식품의 원료로 이용되고 있다 (Park et al., 2012).
현재 미생물 발효, 효소 이용, 유전자 조작 등을 통한 바이 오 신소재 물질의 제안이나 산업공정 개선에 바이오기술 (BT) 을 응용 하고자 하는 경향이 전 산업으로 확대되고 있다 (Koh and Kim, 2008). 미생물 발효의 이용성은 GRAS (Generally Recognized as Safe)로 인정받는 식품 내 미생물 을 통해 유용한 산업적 생물자원으로 탐색 및 분리, 개발 되 어 왔다 (Jang et al., 2012). 인삼의 경우, 순삼과 같은 생물 형태 외에도 건삼, 전통적 가공 인삼의 형태인 홍삼, 미생물을 접목시킨 발효 홍삼까지 다양한 소재 개발을 발전시키고 있다 (Park et al., 2006). 발효 홍삼은 ginsenosides가 장내 미생물 로 대사된 후, compound K 형태로 체내에 흡수되어 유효성 분의 체내 대사율을 높이는 기능성 소재로 개발되었다 (Akao et al., 1998). Aspergillus sp. 나 버섯 균사체를 이용한 인삼 발효물로부터 항알러지, 암세포 증식 억제, 항산화, 고지혈증 및 혈당 개선 등의 효과가 밝혀졌다 (Kim et al., 2010, 2011; Jeon et al., 2011). 미생물을 이용한 발효 개념이 인삼 의 기능성 소재 연구에 도입되면서 사포닌이 함유된 우수 제 품의 다양성이 증대되고 있다 (Kim, 2009).
생명체내 발생된 hydroxy radical (−OH), singlet oxygen (1O2) 같은 활성산소들은 생체막의 지질을 과산화시켜 생체막 을 변질시킴으로써 효소 불활성, 세포노화, 동맥경화, 당뇨병, 뇌졸중, 암 등의 질병을 유발시키므로, 이러한 생체내의 자유 라디칼 (free radical)의 생성을 억제하는 것이 질병예방과 치 료의 중요한 요소로 알려져 왔다 (Chung et al., 1998). 식물 기원 재료로부터 기능성 소재로서의 가능성을 탐색하는 방법 중 2,2-diphenyl-1-picrylhydrazyl (DPPH) 분석, 2,2’-azinobis- 3-ethylbenzothiazoline-6-sulfonic acid (ABTS) 분석, 아질 산염 소거능 및 superoxide dismutase (SOD) 유사활성 등이 가장 광범위하게 이용되고 있다 (Boo et al., 2009).
따라서 본 연구에서는 인삼 대체 소재로 주목받는 산삼배양 근의 부가가치 향상 및 기능성 증진을 위해 발효 산삼을 이용 한 바이오 신소재로서의 가능성을 검정해보고자 실시하였다. 이를 위하여 일차적으로 기능성 소재 증진에 이용되는 미생물 인 유산균 (Leuconostoc mesenteroides, Bacillus circulans, Bacillus licheniformis, Bacillus subtilis subsp. inaquosorum) 을 이용하여 실험하였다. 효능이 검증된 자연산 산삼 뿌리조 직을 무균상태로 기내도입 한 후 생물반응기를 통하여 배양한 산삼배양근에 미생물을 이용하여 발효처리한 후 다양한 생리 활성의 차이를 확인하였다.
재료 및 방법
1. 식물재료
실험에 사용된 식물재료는 양구에서 채취한 35년근 야생토종 산삼을 수세한 후 기내도입을 하였다. 증류수 1ℓ, SH (Schenk and Hildebrandt, 1972; Duchefa Biochemie, Haarlem, Netherlands) medium 3㎎/ℓ, sucrose 30 g/ℓ, indole-3- butyric acid (IBA, Duchefa Biochemie, Haarlem, Netherlands) 2㎎/ℓ 조성 배지에 plant agar (Duchefa Biochemie, Haarlem, Netherlands) 10 g/ℓ를 이용하여 만들어진 고체배지에 수세한 산삼을 얇게 잘라 넣어 부정근을 유도하였고, 유도된 부정근을 250㎖ 삼각플라스크에 0.5 - 1.0㎝로 잘라 접종하여 배양 증 식시킨 후, 생물반응기로 옮겨 7주간 대량증식 시킨 후 재료 로 사용하였다.
2. 공시균주
농업유전자원정보센터 (KACC)에서 분양받은 그람 양성균인 Leuconostoc mesenteroides (KACC 15744), Bacillus circulans (KACC 15822), Bacillus licheniformis (KACC 15823), Bacillus subtilis subsp. inaquosorum (KACC 17047)를 이용하 였고, L. mesenteroides, B. circulans, B. licheniformis, B. subtilis subsp. inaquosorum는 MB cell R2A broth (Kisanbio Co., Seoul, Korea, 0.5 g/ℓ yeast extract, 0.5 g/ℓ proteose peptone, 0.5 g/ℓ casamino acid, 0.5 g/ℓ dextrose, 0.5 g/ℓ soluble starch, 0.3 g/ℓ dipotassium phosphate, 0.05 g/ℓ magnesium sulfate, 0.3 g/ℓ sodium pyruvate, pH 7.2) 배지 에 배양하였다. 이들 미생물은 30℃에서 배양하여 실험에 사 용하였다.
3. 미생물 이용 산삼배양근 발효
산삼배양근 발효는 산삼배양근 생체 20 g을 250㎖ 삼각플 라스크에 넣은 후, 24시간 동안 OD 값 2.3 - 2.4로 30℃에서 전배양한 L. mesenteroides, B. circulans, B. licheniformis, B. subtilis subsp. inaquosorum 각 균주를 액체배지와 함께 첨가하여 130 rpm, 30℃에서 5일간 발효하였다.
4. 시료 추출
시료 추출은 Kim 등 (2008)에 의해 실시 된 방법을 변형 하여 수행하였다. 시료를 5일간 동결건조한 후 막자사발을 이 용해 곱게 분쇄하여 70% MeOH 용매로 3일간 상온에서 추 출한 후 여과하여 감압농축 (SB1200, EYELA, Tokyo Rikakikai Co., Tokyo, Japan)을 실시하였다. 완전하게 농축 된 플라스크에 100% MeOH 용매를 넣고 시료와 용매가 잘 섞일 때까지 vortexing한 후 15분간 초음파 추출하였다. 이후 4,000 rpm (HETTICH UNIVERSAL 32R, DJB Labcare Ltd., Buckinghamshire, England)에서 10분간 원심분리를 한 후 상등액을 취하여 0.2㎛ 필터에 filtering하여, 농축 후 농도 를 맞추어 시료 추출 용액으로 사용하였다.
5. DPPH radical 소거 활성
DPPH radical 소거 활성은 Blois (1958)에 의해 실시된 방법 을 변형하여 측정하였다. 시료 100㎕에 0.2mM DPPH 100㎕ (Sigma-Aldrich, St. Louis, MO, USA)를 혼합하여 상온, 암조 건에서 30분간 반응시킨 후, UV-VIS spectrophotometer (Multiskan FC Microplate Photometer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 517㎚에서 흡광도를 측정하였다. 각 시료 추출물의 DPPH radical 소거 활 성은 대조군에 대한 DPPH radical 소거능을 백분율로 나타내었 고, 소거 활성 양성대조군으로는 ascorbic acid (Amresco LLC, Solon, OH, USA)를 사용하였다.
6. ABTS radical 소거 활성
ABTS radical 소거 활성을 이용한 항산화 활성은 Re 등 (1999)에 의해 실시된 ABTS+ radical cation assay 방법을 변 형하여 측정하였다. 7 mM ABTS (Sigma-Aldrich, St. Louis, MO, USA)와 2.45 mM potassium persulfate (Daejung Chemical and Metal Co., Ltd., Siheung, Korea)를 1 : 1 비 율로 혼합하여 실온인 암소에서 24시간 방치 후 radical을 형 성시키고, UV-VIS spectrophotometer를 이용하여 732㎚에서 흡광도 값이 0.70 ± 0.02이 되게 phosphate buffer saline (PBS, pH 7.4)로 희석한 후, 희석용액 990㎕에 시료 10㎕ 를 가하여 10분간 반응시킨 후 흡광도를 측정하였다. 각 시료 추출물의 ABTS radical 소거 활성은 대조군에 대한 ABTS radical 소거능을 백분율로 나타내었고 소거 활성 양성대조군 으로는 ascorbic acid를 사용하였다.
7. SOD 유사 활성
SOD 유사 활성은 Marklund와 Marklund (1974)에 의해 실 시된 방법을 변형하여 측정하였다. 시료 40㎕에 Tris-HCl buffer (50 mM Tris + 10 mM EDTA, pH 8.5) 200㎕와 7.2 mM pyrogallol (Sigma-Aldrich, St. Louis, MO, USA) 10㎕ 가하여 25℃에서 10분간 반응시키고, 1 M HCl (Wako, Osaka, Japan) 10㎕를 가하여 반응을 정지한 후, UV-VIS spectrophotometer를 이용하여 420㎚에서 흡광도를 측정하였다. 각 시료 추출물의 SOD 유사 활성은 대조군에 대 한 SOD 유사 활성을 백분율로 나타내었고 소거 활성 양성대 조군으로는 ascorbic acid를 사용하였다.
8. 총 페놀 함량
총 페놀 함량은 Taga 등 (1984)에 의해 실시된 Folin- Ciocalteu 방법을 변형하여 측정하였다. 시료 13㎕ (10㎎/㎖) 에 Folin-Ciocalteu reagent (Sigma-Aldrich, St. Louis, MO, USA) 25㎕를 가하여 5분간 상온에서 안정화 하였다. 20% sodium carbonate (Junsei Chemical Co., Ltd., Tokyo, Japan) 200㎕를 가하고 30℃에 30분간 반응시킨 후, UV-VIS spectrophotometer를 이용하여 725㎚에서 흡광도를 측정하였다.
9. 총 플라보노이드 함량
총 플라보노이드 함량은 Moreno 등 (2000)의 방법을 변형 하여 측정하였다. 시료 100㎕ (10㎎/㎖)에 80% EtOH (Daejung Chemical and Metal Co., Ltd., Siheung, Korea) 900㎕을 혼합하여 희석한 시료 500㎕에 10% aluminium nitrate (Junsei Chemical Co., Ltd., Tokyo, Japan) 100㎕, 1M potassium acetate (Junsei Chemical Co., Ltd., Tokyo, Japan) 100㎕, 80% EtOH 4.3㎖를 차례로 가하고 40분간 상온에서 반응시킨 후 415㎚에서 흡광도를 측정하였다.
10. 통계처리
통계처리는 Statistical analysis system (SAS 9.2, SAS Institute Inc., Cary, NC, USA)을 이용하여 Duncan’s Multiple Range Test (DMRT)로 유의성을 검증하였고, 통계적 유의성을 5% 수준에서 분석하였다.
결과 및 고찰
1. DPPH radical 소거 활성
발효산삼배양근과 산삼배양근의 DPPH radical 소거 활성과 의 상관관계를 SAS program으로 분석한 결과, Fig. 1에서와 같이 유의성이 인정되는 것으로 나타났다. 산삼배양근과 미생 물 이용 발효 산삼배양근 처리구의 DPPH free radical 소거 활성은 1㎎/㎖ 농도에서 B. licheniformis가 70.6 ± 1.4%로 가 장 높은 활성을 나타내었으며, L. mesenteroides 47.1 ± 1.2%, B. circulans 40.1 ± 1.9%, B. subtilis subsp. inaquosorum 39.0 ± 0.2%, 산삼배양근 32.3 ± 2.4% 순으로 나타났다 (Fig. 1). 산삼, 산양삼 및 인삼 추출물의 DPPH radical 소거활성 비 교연구에서는 인삼이 16.7㎎/㎖로서 가장 낮은 항산화능을 나타냈다 (Jang et al., 2008). 발효 인삼 추출물별 항산화능 연구에서는 1㎎/㎖ 농도에서 33.98 - 48.68% 정도의 활성을 나타낸 것으로 보고되었다 (Doh et al., 2010). 산삼 배양근 추출물의 농도가 증가함에 따라 전자 공여능 측정 결과도 비 례적인 증가를 나타내었는데, 이는 본 연구결과에서도 이와 유 사한 농도 의존적 활성 증가를 보이는 것으로 확인되었다 (Park et al., 2012).
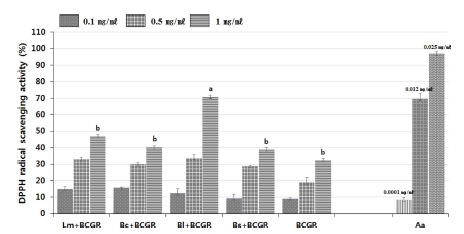
DPPH (2,2-diphenyl-1-picrylhydrazyl) radical scavenging activity of fermented BCGR (bioreactor cultured ginseng roots) using microorganisms.Mean values from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significantly different based on the DMRT (p < 0.05). Lm; L. mesenteroides, Bc; B. circulans, Bl; B. licheniformis, Bs; B. subtilis subsp. inaquosorum, Aa; Ascorbic acid. Sample concentration were 0.1, 0.5, 1㎎/㎖ and ascorbic acid was used positive control (concentration were 0.0001, 0.012, 0.025㎎/㎖).
2. ABTS radical 소거 활성
발효산삼배양근과 산삼배양근의 ABTS radical 소거 활성과 의 상관관계를 SAS program으로 분석한 결과, Fig. 2에서와 같이 유의성이 인정되는 것으로 나타났다. 산삼배양근과 미생 물 이용발효 산삼배양근 처리구의 ABTS radical 소거 활 성은 1㎎/㎖ 농도에서 B. licheniformis가 44.3 ± 1.7%로 가 장 높은 활성을 나타내었으며, L. mesenteroides 42.4 ± 1.1%, B. subtilis subsp. inaquosorum 40.3 ± 2.5%, B. circulans 37.5 ± 2.3% 산삼배양근 33.0 ± 1.3% 순으로 나타났다. 재배삼 과 장뇌삼의 추출물간 항산화력이 ABTS 소거능 방법을 이용 하여 측정한 결과가 보고되었다 (Joung et al., 2010). 이 보 고에서는 물 보다는 에탄올 추출물에서 더 높은 항산화력을 나타내었다. 또 재배삼보다는 장뇌삼 추출물에서 ABTS 소거 활성이 더 높은 것으로 보고되었고, 이는 Jang 등 (2008)의 연구결과와 일치하는 것으로 나타났다. 본 연구에서 DPPH와 ABTS 소거능 방법에 의한 샘플간의 항산화능 차이는 별로 크 지 않았으나, B. licheniformis로 발효된 산삼의 경우 DPPH에 서는 높은 항상화능을 보였으나, ABTS에서는 DPPH 결과와 비교하면 다소 낮은 항산화능으로 조사되었다. 이러한 결과는 ABTS가 과산화수소에 특이적으로 반응하여 나타나지만, DPPH는 더 넓은 활성산소종과의 반응 때문에 약간의 차이를 보인 것으로 사료된다.
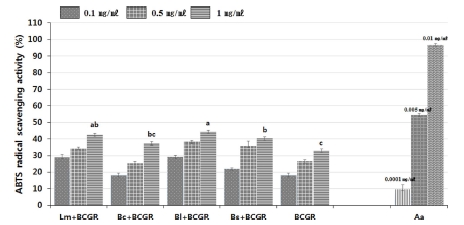
ABTS (2,2'-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid) radical scavenging activity of fermented BCGR (bioreactor cultured ginseng roots) using microorganisms.Mean values from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significantly different based on the DMRT (p < 0.05). Lm; L. mesenteroides, Bc; B. circulans, Bl; B. licheniformis, Bs; B. subtilis subsp. inaquosorum, Aa; Ascorbic acid. Sample concentration were 0.1, 0.5, 1㎎/㎖ and ascorbic acid was used positive control (concentration were 0.0001, 0.005, 0.01㎎/㎖).
3. SOD 유사 활성
산삼배양근과 미생물 이용 발효 산삼배양근 처리구의 SOD 유사활성은 SAS program으로 분석한 결과, Fig. 3에서와 같 이 유의성이 인정되는 것으로 나타났다. 10㎎/㎖ 농도에서 B. licheniformis가 88.4 ± 1.3%로 가장 높은 활성을 나타내었으며, L. mesenteroides 71.0 ± 3.6%, B. subtilis subsp. inaquosorum 68.8 ± 2.1%, B. circulans 52.7 ± 2.5%, 산삼배양근 49.9 ± 2.6% 순으로 나타났다 (Fig. 3). 이 같은 결과는 장뇌삼과 발효장뇌 삼 추출물의 SOD 유사활성 측정에서도 발효장뇌삼 추출물이 더 높은 항산화능을 나타낸 보고와 유사하게 나타났다 (Ye et al., 2010). 하지만, Ye 등 (2010)의 보고에서는 SOD 유사활 성이 가장 높은 발효장뇌삼 수치가 20.47% 정도로 나타났는 데, 본 연구의 발효 산삼배양근 활성 수치는 이보다 더 높게 측정되었다.
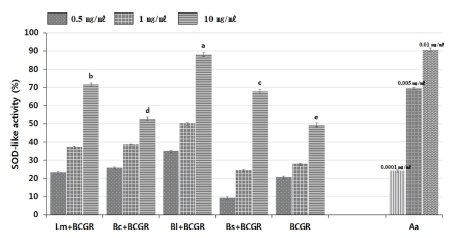
SOD-like activity of fermented BCGR (bioreactor cultured ginseng roots) using microorganisms.Mean values from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significantly different based on the DMRT (p < 0.05). Lm; L. mesenteroides, Bc; B. circulans, Bl; B. licheniformis, Bs; B. subtilis subsp. inaquosorum, Aa; Ascorbic acid. Sample concentration were 0.5, 1, 10㎎/㎖ and ascorbic acid was used positive control (concentration were 0.0001, 0.005, 0.01㎎/㎖).
4. 총 페놀 및 플라보노이드 함량 비교 분석
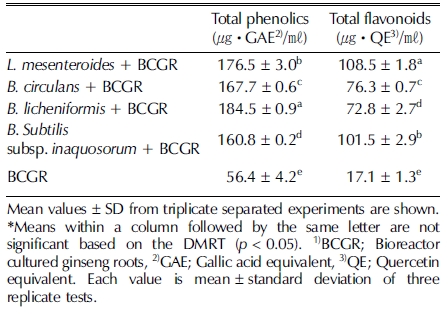
산삼배양근과 미생물 이용 발효 산삼배양근 처리구의 총 페놀 함량은 B. licheniformis로 발효시킨 산삼에서 184.5 ± 0.9㎍• GAE/㎖로 가장 높은 함량을 나타내었다. 페놀함량 높은 순서는 L. mesenteroides (176.5 ± 3.0 ㎍ • GAE/㎖), B. circulans (167.7 ± 0.6㎍• GAE/㎖), B. subtilis subsp. inaquosorum (160.8 ± 0.2㎍• GAE/㎖) 이와 같이 측정되었다. 대조구인 산삼배양근은 56.4 ± 4.2㎍• GAE/㎖로 측정되어서, 유산균으로 발효시킨 산삼보다 총 페놀 함량이 현저히 낮 은 것으로 나타났다 (Table 1). 산삼배양근과 발효 산삼배 양근의 총 플라보노이드 함량 차이는 L. mesenteroides에서 108.5 ± 1.8㎍• QE/㎖로 가장 높은 함량을 나타내었으며, Bacillus subtilis subsp. inaquosorum 101.5 ± 2.9㎍• QE/㎖, B. circulans 76.3 ± 0.7㎍• QE/㎖, B. licheniformis 72.8 ± 2.7㎍• QE/㎖, 산삼배양근 17.1 ± 1.3㎍• QE/㎖ 순으로 나타 났다.
식물에서 페놀 화합물은 시료 변색에 주된 영향을 미치는 인 자이며, 함량이 많을수록 항산화 활성이 높다고 알려져 있다 (Duval and Shetty, 2001). 페놀성 화합물은 항콜레스테롤, 정 장, 항암 및 항산화 작용을 하여 체내의 radical로부터 조직을 보호하여 생리적 효율성을 높이는 것으로 알려져 있다 (Lee et al., 2005). Lee (2014)는 인삼의 A. oryzae과 S. cerevisiae를 이용하여 인삼발효 처리 시 3일 5일, 7일 발효기간이 증가할 수록 총 페놀 함량이 최대 143.37㎎/㎖까지 나타난다고 보고 하였고, 본 연구에서도 발효처리를 통하여 총 페놀 함량이 184.5 ± 0.9㎍• GAE/㎖ 정도까지 증가하는 것을 확인하였다. 이는 발효 균주 선택에 따라서 총 페놀 함량의 차이가 나타나 는 것으로 사료되며, 발효균주의 선택이 산삼배양근의 총 페 놀 함량 증진에 중요한 요인으로 여겨진다.
플라보노이드류는 화학구조에 따라 flavonols, flavones, catechins, isoflavones 등으로 구분되고, 물과 에탄올에 대한 용 해도가 다른 성질을 가지고 있는 polyphenolic substance이다. 이들 플라보노이드류의 구조적 차이는 과산화 지질 생성 억제 같은 생화학적 활성에 영향을 미치는 것으로 알려져 있다 (Middleton and Kandaswami, 1994). Lee 등 (2004)이 보고 한 인삼뿌리와 백삼의 총 폴리페놀 함량이 0.61 - 4.46㎎/g이 라 보고하였는데, 이에 반해 산삼 배양근 추출물의 총 폴리페 놀 함량은 더 높은 수치를 나타냈다 (Park et al., 2009). 하 지만, 본 연구에서는 앞선 연구결과와 비교하여 볼 때, 훨씬 더 높은 함량을 나타내는 것으로 조사되었다. 특히, L. mesenteroides와 B. subtilis subsp. inaquosorum로 발효 처리 한 산삼배양근 추출물의 경우 모두 100㎍• QE/㎖ 이상의 총 플라보노이드 함량이 측정된 것으로 보아, 이 두 가지 미생물 은 다른 미생물과는 다르게 총 플라보노이드 함량을 높이는 중요한 역할을 하는 균주로 사료된다.
미생물을 이용한 발효공법은 총 페놀과 총 플라보노이드 함 량을 증진시키는 등 일반산삼배양근의 항산화 활성을 증진시 켰으며, 일반산삼 배양근의 기능성 향상을 극대화시킬 수 있 는 원천적인 가공방법이라고 사료된다. 최근 연구 결과에서도 Bacillus 균주별로 발효한 꾸지뽕 열매에서 총 페놀 함량은 35.67 - 46.37%, 총 플라보노이드 함량은 12.34 - 25.97% 증가 하였고 (Kang et al., 2011), Lactobacillus 균에 의한 발효더 덕에서도 총 페놀 1.9배, 총 플라보노이드 3.3배 증가된 보고 가 있다 (Jung et al., 2012).
본 연구 결과에 따라, 실험재료에 사용된 미생물 균주 이용 발효 산삼배양근의 항산화력 증진은 대조구인 산삼배양근에 비해 높다고 인정되어, 산삼배양근의 기능성 소재 연구에 중 요한 요소가 될 수 있을 것으로 판단된다. 또한 이러한 기능 성이 높은 미생물 이용 발효 산삼배양근은 산업적 활용이 가 능하므로, 식품가공, 건강기능식품 및 화장품 등의 원료로 다 양하게 이용될 수 있을 것으로 사료된다.
감사의 글
본 연구는 산업통산자원부와 한국산업기술진흥원 경제협력 권산업육성사업(과제번호: R0004026)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Akao, T, Kanaoka, M, Kobashi, K, (1998), Appearance of compound K, a major metabolite of ginsenoside Rb1 by intestinal bacteria, in rat plasma after oral administration: Measurement of compound K by enzyme immunoassay, Biological and Pharmaceutical Bulletin, 21, p245-249, 9556154.
[https://doi.org/10.1248/bpb.21.245]

-
Blois, MS, (1958), Antioxidant determinations by the use of a stable free radical, Nature, 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Boo, HO, Lee, HH, Lee, JW, Hwang, SJ, Park, SU, (2009), Different of total phenolics and flavonoids, radical scavenging activities and nitrite scavenging effects ofMomordica charantiaL. according to cultivars, Korean Journal of Medicinal Crop Science, 17, p15-20.
- Chung, IM, Kim, KH, Ahn, JK, (1998), Screening of Korean medicinal and food plants with antioxidant activity, Korean Journal of Medicinal Crop Science, 6, p311-322.
- Doh, ES, Chang, JP, Lee, KH, Seong, NS, (2010), Ginsenoside change and antioxidation activity of fermented ginseng, Korean Journal of Medicinal Crop Science, 18, p255-265.
-
Duval, B, Shetty, K, (2001), The stimulation of phenolics and antioxidant activity in pea(Pisum sativum) elicited by genetically transformed anise root extract, Journal of Food Biochemistry, 25, p361-377.
[https://doi.org/10.1111/j.1745-4514.2001.tb00746.x]

- Hong, MH, Lim, HK, Park, JE, Jun, NJ, Lee, YJ, Cho, MJ, Kim, SM, (2008), The antihypertensive and vasodilating effects of adventitious root extracts of wild ginseng, Journal of the Korean Society for Applied Biological Chemistry, 51, p102-107.
-
Jang, HY, Park, HS, Kwon, KR, Rhim, TJ, (2008), A study on the comparison of antioxidant effects among wild ginseng,cultivated wild ginseng, and cultivated ginseng extracts, Journal of Pharmacopuncture, 11, p67-78.
[https://doi.org/10.3831/KPI.2008.11.3.067]

-
Jang, IT, Kang, MG, Yi, SH, Lim, SI, Kim, HR, Ahn, BH, Lee, JS, (2012), Physiological functionality of Nuruk, Makgeolli and Cheonggukjang made with fungi and bacteria isolated from Korean traditional fermented foods, The Korean Journal of Mycology, 40, p164-173.
[https://doi.org/10.4489/KJM.2012.40.3.164]

- Jeon, JM, Choi, SK, Kim, YJ, Jang, SJ, Cheon, JW, Lee, HS, (2011), Antioxidant and antiaging effect of ginseng berry extract fermented by lactic acid bacteria, Journal of the Society of Cosmetic Scientists of Korea, 37, p75-81.
- Joung, EM, Hwang, IG, Lee, MK, Cho, SK, Chung, BH, Jo, SJ, Lee, SH, Lee, JS, Jeong, HS, (2010), Ginsenoside compositions and antioxidant activity of cultured and mountain ginseng, Journal of Agriculture and Life Science, 44, p61-67.
-
Jung, LS, Yoon, WB, Park, SJ, Park, DS, Ahn, JH, (2012), Evaluation of physicochemical properties and biological activities of steamed and fermented Deodeok(Codonopsis lanceolata), Korean Journal of Food Science and Technology, 44, p135-139.
[https://doi.org/10.9721/KJFST.2012.44.1.135]

-
Kang, DH, Kim, JW, Youn, KS, (2011), Antioxidant activities of extract from fermented mulberry(Cudrania tricuspidata) fruit and inhibitory actions on elastase and tyrosinase, Korean Journal of Food Preservation, 18, p236-243.
[https://doi.org/10.11002/kjfp.2011.18.2.236]

-
Kim, EL, Kim, CS, Lee, HY, Lee, HR, Kim, EY, Yoon, MC, Shin, SS, (2012), Mountain cultivated ginseng water boiled extract decreases blood glucose level and improves lipid metabolism in maledb/dbmice, Korean Journal of Herbology, 27, p69-75.
[https://doi.org/10.6116/kjh.2012.27.2.69]

- Kim, GS, Hyun, DY, Kim, YO, Lee, SW, Kim, YC, Lee, SE, Son, YD, Lee, MJ, Park, CB, Park, HK, Cha, SW, Song, KS, (2008), Extraction and preprocessing methods for ginsenosides analysis ofPanax ginsengC. A. Meyer, Korean Journal of Medicinal Crop Science, 16, p446-454.
-
Kim, HO, Park, MJ, Han, JS, (2011), Effects of fermented red ginseng supplementation on blood glucose and insulin resistance in type 2 diabetic patients, Journal of the Korean Society of Food Science and Nutrition, 40, p696-703.
[https://doi.org/10.3746/jkfn.2011.40.5.696]

-
Kim, HY, Joung, EM, Hwang, IG, Jeong, JH, Yu, KW, Lee, J, Jeong, HS, (2010), Effect of fermented ginseng extract by mushroom mycelia on antiproliferation of cancer cells, Journal of the Korean Society of Food Science and Nutrition, 39, p36-41.
[https://doi.org/10.3746/jkfn.2010.39.1.036]

- Kim, YJ, (2009), Evaluation of antioxidant activity and thermal stability of plant polyphenols, Biomaterials Research, 13, p30-36.
- Koh, YS, Kim, HH, (2008), Biotechnology to widen the practical area, Samsung Economic Research Institute, Seoul, Korea, 652, p1-10.
- Lee, MK, (2014), Antioxidative activity and ginsenoside change of the extract of fermented ginseng(Panax ginsengC. A. Meyer) byA. oryzaeKCCM60241 andS. cerevisiaeKCCM50549, Master Thesis, Joongbu University, p11-13.
- Lee, SE, Lee, SW, Bang, JK, Yu, YJ, Seong, NS, (2004), Antioxidant activities of leaf, stem and root ofPanax ginsengC. A. Meyer, Korean Journal of Medicinal Crop Science, 12, p237-242.
- Lee, SO, Lee, HJ, Yu, MH, Im, HG, Lee, IS., (2005), Total polyphenol contents and antioxidant activities of methanol extracts from vegetables produced in Ullung island, Korean Journal of Food Science and Technology, 37, p233-240.
- Lee, YW, (2007), Mass production of wild ginseng(Panax ginsengC. A. Meyer) roots in a bioreactor and enhancement of ginsenoside contents using an elicitor, methyl jasmonate, Ph. D. Thesis, Seoul National University, p57-68.
-
Marklund, S, Marklund, G, (1974), Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase, European Journal of Biochemistry, 47, p469-474, 4215654.
[https://doi.org/10.1111/j.1432-1033.1974.tb03714.x]

- Middleton, EJ, Kandaswami, C, (1994), Potential health promoting properties of citrus flavonoids, Food Technology, 48, p115-119.
-
Moreno, MIN, Isla, MI, Sampietro, AR, Vattuone, MA, (2000), Comparison of the free radical-scavenging activity of propolis from several regions of Argentina, Journal of Ethnopharmacology, 71, p109-114, 10904153.
[https://doi.org/10.1016/S0378-8741(99)00189-0]

-
Nam, S, Rhee, YK, Hong, HD, Lee, YC, Kim, YC, Shin, KS, Cho, CW, (2012), Immuno-modulatory activity of the crude polysaccharide from wild ginseng adventitious root, The Korean Journal of Food and Nutrition, 25, p755-761.
[https://doi.org/10.9799/ksfan.2012.25.4.755]

-
Park, JC, Cha, JY, Lee, CH, Doh, ES, Kang, IH, Cho, YS, (2009), Biological activities and chemical characteristics ofMonascusfermented Korean red ginseng, Journal of Life Sciences, 19, p1553-1561.
[https://doi.org/10.5352/JLS.2009.19.11.1553]

-
Park, S, Kim, DH, Paek, NS, Kim, SS, (2006), Preparation and quality characteristics of the fermentation product of ginseng by lactic acid bacteria(FGL), Journal of Ginseng Research, 30, p88-94.
[https://doi.org/10.5142/JGR.2006.30.2.088]

-
Park, SJ, Yoo, SM, Kim, YE, (2012), Nutritional characteristics and screening of biological activity of cultured wild ginseng roots, Korean Journal of Food and Nutrition, 25, p729-736.
[https://doi.org/10.9799/ksfan.2012.25.4.729]

-
Re, R, Pellegrini, N, Proteggente, A, Pannala, A, Yang, M, Rice-Evans, C, (1999), Antioxidant activity applying an improved ABTS radical cation decolorization assay, Free Radical Biology and Medicine, 26, p1231-1237, 10381194.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Schenk, RU, Hildebrandt, AC, (1972), Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures, Canadian Jounal of Botany, 50, p199-204.
[https://doi.org/10.1139/b72-026]

- Shin, CS, Lee, DH, Kim, SH, Shin, MH, Jeong, CH, Shim, KH, (2010), Ginsenoside contents and antioxidative activities from red ginseng treated with high hydrostatic pressure, Journal of Agriculture and Life Science, 44, p133-140.
- Shin, MH, (2001), Study of mountain ginseng adventitious culture and application, Journal of the Society of Cosmetic Scientists of Korea, 27, p45-56.
- Shin, SS, Kim, KC, Choi, YH, Lee, YT, Eom, HS, Kim, CS, (2001), Critic standardization and objectivity of mountain grown ginseng, Journal of Dongeui Oriental Medicine, 5, p107-114.
-
Taga, MS, Miller, EE, Pratt, DE, (1984), Chia seeds as asource of natural lipid antioxidants, Journal of the American Oil Chemists’ Society, 61, p928-931.
[https://doi.org/10.1007/BF02542169]

- Ye, EJ, Kim, SJ, Nam, HS, Park, EM, Bae, MJ, (2010), Physiological evaluation of Korean mountain ginseng and Korean mountain ginseng leaf tea, Journal of the KoreanSociety of Food Culture, 25, p350-356.