아로니아 저온 초음파 추출물의 항비만 활성 증진
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study represents the first report that the anti-obesity activity of ethanol extracts of Aronia melanocarpa can be enhanced through ultrasonification at a frequency of 120 ㎑ at 60°C (UE).
The amounts of cyanidin-3-O-galactose (cya-gal), a major anthocyanin in A. melanocarpa were higher by up to 402.4 ㎎/100 g, as compared with 221.4 ㎎/100 g and 322.1 ㎎/100 g, for hot water at 100°C and 70% ethanol at 80°C respectively. This result should cause the higher antioxidant activities of the UE than extract of hot water and ethanol in DPPH free radical scavenging. It was confirmed that the high antioxidant activity of UE could play an important role in inhibiting the production of proteins related to adipocyte differentiation, such as peroxisome proliferator activated receptor-γ (PPAR-γ) and sterol regulatory element binding protein 1 (SREBP1).
Ultrasonification at a frequency of 120 ㎑ at 60°C should result in better anti-obesity activity than that observed using other processes. It was also observed for the first time that the anti-obesity activity of A. melanocarpa was associated with its antioxidant activity, possibly due to the higher elution of intact cya-gal, owing to efficient low temperature ultrasonification extraction. These results could also be applied to improve other biological activities of medicinal herbs that contain many types of heat-labile bioactive substances.
Keywords:
Aronia melanocarpa, Anti-Obesity, Ultasonification Extraction서 언
비만은 에너지의 섭취에 비해 소비량이 낮아 체내의 지방이 과도하게 축적되는 것으로 다양한 합병증을 유발하여 그 위험 성이 부각되고 있다. 비만은 간기능의 이상과 지방간, 염증, 내 분비 장애, 고혈압, 고지혈증, 심혈관계질환, 2형 당뇨병 등의 각 종 대사 질환의 주요 원인으로 꼽히고 있다 (Attie and Scherer, 2009; Lowell and Spiegelman, 2000; Barstard et al., 2006). 이러한 비만의 심각성으로 인하여 비만에 대한 치 료제는 전 세계 시장에서 주목을 받고 있으나, 치료제에 대한 부작용으로 구토, 두통, 불면증, 뇌졸중, 심근경색 같은 질환을 유발하는 사례가 알려진 바 있다 (Yoo, 2008). 현재 부작용을 최소화 할 수 있는 방법으로 천연물을 이용한 치료제의 개발 에 심혈을 기울이고 있다 (Rayalam et al., 2008).
비만은 병리학적 관점에서 지방세포의 과다증식에 의한 것 으로 알려져 있다. 지방조직은 adipokines이라고 하는 인자들 을 분비하여 glucose 대사, 식욕, 염증 등을 조절하는 역할을 하는데, 이러한 지방세포가 과도하게 증식하게 되면 세포 내 지방이 축적됨에 따라 각종 질환의 원인이 된다 (Spielgelman and Enerback, 2006). 이러한 이유로 지방세포의 증식과 분화 를 억제하는 작용은 비만치료제를 개발함에 있어 핵심적인 전 략일 수 있다 (Rosen and Spiegelman, 2006). 또한 비만 세 포는 분화과정에 있어 C/EBP, PPAR-γ, SREBP1 등의 전사인 자들의 발현이 증가하며 발현된 전사인자는 지방세포 분화에 관여하여 비만의 주요한 원인이 된다 (Kim and Park, 2002; Horton et al., 2002).
비만은 활성산소와도 밀접한 관련이 있는데, 전지방세포는 지방세포로 분화할 시에 NOX (NADPH oxidase) 등의 산화 효소의 발현이 증가하여 활성산소종을 생성하게 된다 (Lee et al., 2009). 이때 발생한 활성산소종은 비만을 비롯 체내 각 종 질환을 유발시킬 수 있다 (Valko et al., 2007).
아로니아 (Aronia melanocarpa Elliot)는 장미과에 속하는 베리류로서 북아메리카에서 자생하는 것으로 알려져 있다 (Tanaka and Tanaka, 2001). 아로니아에는 뛰어난 항산화 효 과로 잘 알려진 안토시아닌을 비롯하여 그 외에 플라보노이드 성분이 기타 다른 천연물들에 비해 다량 함유되어 있어, 항산 화를 비롯하여 항암, 위 보호, 항염증, 면역효능 및 향장, 항 당뇨, 항비만 등의 다양한 생리활성 효과가 있다고 보고된 바 있다 (Slimestad et al., 2005; Li and Jeong, 2015; Ohgami et al., 2005; Kim et al., 2014). 아로니아의 이러한 생리활성 효과를 참고하여, 현대사회에 가장 큰 건강문제로 대두된 비 만에 대한 아로니아의 억제효과를 확인하였으며, 저온 초음파 공정을 도입하여 활성의 증진을 돕고자 하였다.
초음파 처리는 높은 진동에너지와 함께 발생하는 공동현상 (cavitation)으로 인하여 발생한 운동에너지가 추출을 더욱 용 이하게 하여 아로니아의 활성물질인 안토시아닌의 용출에 도 움을 줄 수 있으며 (Chung et al., 2000), 저온 추출은 고온 에서 파괴되기 쉬운 안토시아닌 성분 손실을 보완해 주기 때 문에 (Huh et al., 2008), 초음파 저온 추출법을 도입하여 안 토시아닌의 파괴를 최소화하고자 하였다. 아로니아에 함유된 cyanidin-3-O-galactoside (cya-gal)를 비롯한 안토시아닌은 항 산화 효과는 물론 항비만 효능에 대한 연구 결과가 있어 (Wang et al., 1997; Jayaprakasam et al., 2006), 아로니아 속 안토시아닌의 용출량을 극대화 한다면 아로니아 추출물의 항산화효과를 증진시킬 수 있고 이로 인해 항비만 효능 역시 증진시킬 수 있을 것으로 사료되어 본 연구를 진행하였다.
재료 및 방법
1. 추출물 제조
실험에 사용된 아로니아 (Aronia melanocarpa Elliot) 열매 는 2015년도 산 충북 단양군 농업기술센터로부터 지원받아 사 용하였다. 아로니아 시료는 70% 에탄올 가열 추출, 초음파 전 처리 70% 에탄올, 열수 추출 방법으로 각각 수직 환류냉각기 가 설치되어 있는 둥근바닥 플라스크를 사용하여 실험을 진행 하였다. 70% 에탄올 추출은 아로니아 100 g을 80℃에서 1ℓ 의 70% 에탄올을 용매로 하여 24시간 추출하였으며 (EE), 초 음파 전처리는 70% 에탄올을 침지해 1시간 동안 120㎑의 초음파 (AUG-R3-900, ASIA ULTRASONIC Co. Ltd., Bucheon, Korea)로 전처리한 후, 이 액을 60℃, 6시간 동안 추출하였다 (UE). 아로니아의 안토시아닌 성분은 기존의 80℃ 추출법을 이용할 경우, 성분의 파괴와 활성의 저감이 예상되 고 (Huh et al., 2008), 초음파를 이용한 추출방법은 성분의 수율을 높일 수 있는 방법으로 보고되었기에 (d’Alessandro et al., 2012), 본 연구는 저온 추출을 진행함과 동시에 초음파 공정을 도입하여 추출 효율 및 활성의 유지 및 증가를 확인 하고자 안토시아닌 파괴 최소의 한계 온도인 60℃로 하여 추 출을 진행하였다. 열수 추출은 상기 추출방법들과 동일하게 진 행하며 용매는 물을 사용하고 100℃, 24시간 조건에서 추출을 진행하였다 (WE). 각각의 추출물은 추출 후에 감압여과기를 사용하여 여과하고, 회전식 감압농축기 (EYELA N-1000, Tokyo Rikakikai Co., Tokyo, Japan)로 충분히 농축한 뒤, 동 결건조기 (PVTFA 10AT, ILSHINBioBase, Dongducheon, Korea)에 3일 간 동결건조하여 파우더 형태로 제조하여 실험에 사용하였다.
2. 아로니아 추출물 중 안토시아닌 함량 측정
아로니아 함유 안토시아닌인 cyanidin-3-O-galactoside (cyagal) 의 함량은 고성능 액체크로마토그래피 (HPLC)를 이용하여 측정하였으며, 아로니아 열수, 70% 에탄올, 초음파 70% 에탄 올 추출물과 지표 물질로 cya-gal (Polyphenols, Sandnes, Norway)을 측정하여 비교 분석하였다 (Brunlich et al., 2013). 본 실험에 사용된 HPLC (U-3000, Thermo Fisher Scientific, Waltham, MA, USA)는 Jupiter 5u C18 3000A (150 × 4.6㎜) 컬럼을 사용하였다. 이동상 용매는 (A); HCOOH-H2O (1 : 9), (B); HCOOH-MeOH-H2O (1 : 5 : 4)의 비율로 하여 (A) 100%에서 시간은 0 - 2분, (A) 30%, (B) 70%에서 2 - 20분 구간, (B) 100%에서 20 - 22분 구간 그리고 (A) 100%에서 22 - 24분 구간을 측정하였다. HPLC를 측정하 기 전 시료는 0.45㎛ 필터를 이용해 여과 하였으며, 유속은 0.8㎖/min으로 설정하였고, 칼럼의 온도는 30℃로 유지하였다. HPLC의 크로마토그램은 520㎚의 파장에서 측정하여 비교분 석하였으며, 측정하여 얻은 크로마토그램의 area를 이용해 각 추출물에 대한 standard인 cya-gal의 함량을 구하였다.
3. 각 추출물의 항산화능 측정
아로니아 추출물의 항산화효능 평가는 DPPH (α,α-diphenyl- β-picrylhydrazyl) free radical 소거 활성으로 확인하였으며, Dietz등의 방법을 참고하여 실험을 진행하였다 (Dietz et al., 2005). 아로니아 추출물을 농도 별로 96 well plate에 150㎕ 만큼 넣고, 0.1 mM의 DPPH 용액을 150㎕ 넣어 혼합시킨 후에 상온에서 30분 동안 빛을 차단하여 방치한 후 microplate reader로 517㎚ 파장에서 흡광도를 측정하여 DPPH radical scavenging activity (%)로 나타내어 확인하였다.
4. 각 추출물들의 지방 세포 분화도 측정
지방분화도 측정은 3T3-L1 지방전구세포를 사용하여 실험을 진행하였다. 분화의 유도는 관련 선행연구를 참고하여 실험을 진행하였다 (Lee et al., 2011). 지방전구세포 3T3-L1은 DMEM 배지를 사용하여 10% calf serum과 1%의 penicinlin을 첨가하여 6 well plate에 1× 105 cells/well 세포수 만큼 넣어 5% CO2 incubator에서 5일 동안 배양하였다. 배양 후 0.25mM의 3-isobutyl-1-methylxanthine (IBMX, Sigma-Aldrich, St. Louis, MO, USA)와 1㎍/㎖의 insulin 그리고 1μM의 dexamethasone이 함유 된 배지로 교체하여 2일 동안 다시 분 화를 유도하였다. 2일 후 1㎍/㎖의 insulin을 포함하는 DMEM배지로 갈아주고 2일 더 배양한 뒤 어떠한 것도 함유 되지 않은 DMEM배지로 갈아 4일 동안 다시 배양하여 지방 세포의 분화를 유도하였다.
지방세포의 분화도를 확인하기 위하여 Oil red O 염색방법 을 진행하였으며, 기존 연구를 참고하여 실험을 진행하였다 (Park et al., 2013). 분화 시킨 3T3-L1 지방전구세포에서 배 지를 제거하고 세척한 다음 10% formaldehyde로 세포를 고 정시킨 후 PBS로 세척하였다. 세척 후에 Oil red O 용액으로 30분 동안 염색을 진행하고 30분 뒤 증류수로 세척하고 건조 시킨 뒤에 100% isopropyl alcohol로 Oil red O로 염색된 지방구를 용해하고 510㎚ 파장에서 흡광도를 측정하였다.
5. 지방세포분화 관련 단백질 발현량 측정
지방세포 유전자 조절 부위와 상호작용하여 지방세포 분화 를 촉진시키는 PPAR-γ (peroxisome proliferator activated receptor-γ)와 해당 PPAR-γ를 조절하는 SREBP1 (sterol regulatory element binding protein 1)의 발현은 western blot 을 통해 확인하였다 (Choi et al., 2015; Camp et al., 2002). 지방전구세포 3T3-L1이 분주 된 6 well plate에 아로 니아 샘플을 농도에 따라 처리하였다. 처리하여 3일 동안 배 양한 3T3-L1 세포를 PBS로 세척한 뒤에 RIPA buffer를 사 용하여 균질화 하였다. 그 뒤 10% sodium dodecyl sulfate (SDS)-PAGE에 분리하고 PVDF membrane으로 단백질을 전 이시켰다. 그 후에 5% skin milk를 처리하고 비특이적 단백질 에 blocking 한 후에 1차 항체 (PPAR-γ, SREBP1)를 4℃에 서 12시간 반응시킨 후에 HRP (horseradish peroxidase)가 중합된 2차 항체를 반응시켰다. 그 뒤 immuno-positive bands 는 enhanced chemiluminescent와 chemiluminescent detection system을 통해 현상하였다.
6. 각 추출물 식이 마우스의 체중 변화
In vivo 실험을 통해 아로니아 추출물의 항비만 효과를 확인 하고자 하였다. 5주령의 C57BL/6N 수컷 mouse를 1주일 동 안의 적응 기간을 거친 후 일반 사료만 먹인 대조식이와 비만 유도를 위한 고지방식이를 투여하고 고지방식이에 아로니아 추출물을 4주 간 경구투여 하였다. 시험 기간 동안 mouse의 체중을 측정하여 기록하여, 체중확인 및 체중변화에 대한 주 차별 증가율과 최초 0주 차와 3주 차에 대한 증가율을 확인하 였다 (Yoo et al., 2015).
7. 통계처리
모든 실험의 데이터 통계처리는 3회 반복하였으며, 실험값의 통계는 SAS (Statistical Analysis System 9.2, SAS Institute Inc., Cary, NC, USA) 프로그램을 통하여 평균값을 구하여 처 리하였다. 처리구간의 최소 유의 수준의 차는 p < 0.05로 통계 처리 하였다.
결과 및 고찰
1. 추출 공정별 안토시아닌 함량 확인
각 공정별로 추출된 아로니아 (Aronia melanocarpa Elliot) 추출물의 HPLC chromatogram은 Fig. 1에서 확인하였으며, 각 peak를 분석해 공정별 cya-gal의 함량을 Table 1에 나타내었다. 아로니아에 함유된 안토시아닌 cyanidin은 cya-gal 외에도 cyanidin-3-O-arabinoside, xyloside, glucoside이 함유 되어있으 나, 약 2,000㎎/100 g (dw)의 cyanidin 중 cya-gal의 함량이 약 1,300㎎/100 g으로 65% 이상을 차지한 반면 그 외 cyanidin은 상대적으로 그 함량이 적어 활성에 대한 영향이 적 을 것으로 사료되어, cya-gal의 함량을 확인하였다 (Oszmiaski and Wojdylo, 2005).
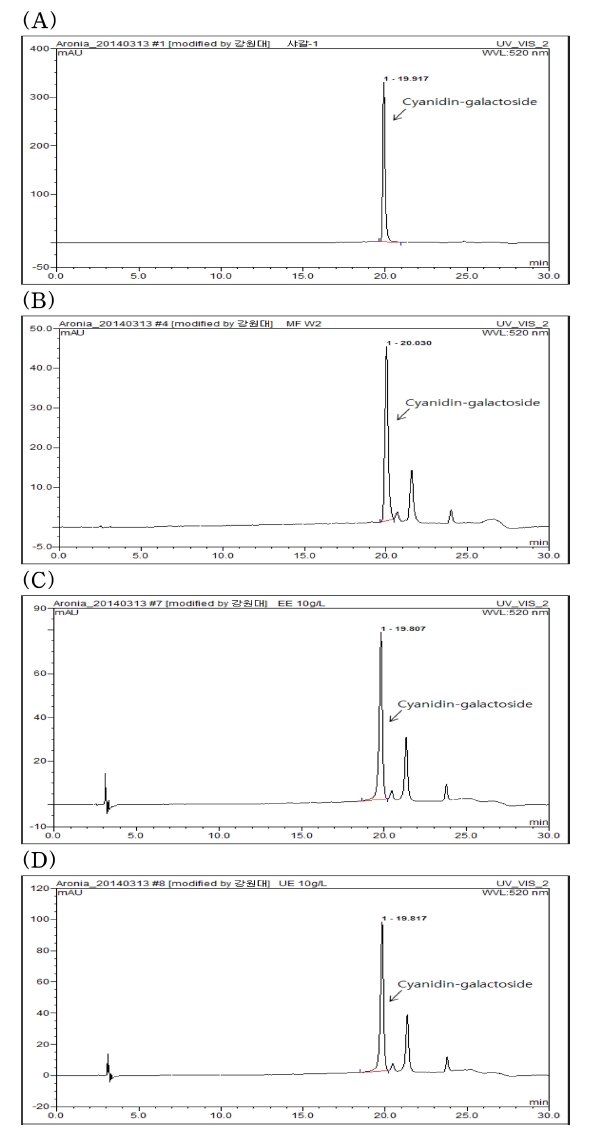
Comparison of HPLC chromatograms of the extracts from different extraction processes.(A); cyanidin-3-O-galactoside, (B); Hot water extraction at 100℃ (WE), (C); 70% Ethanol extraction at 80℃ (EE), (D); 70% Ethanol extraction with ultrasonic process at 120 ㎑ and 60℃ (UE).

Cyanidin-3-O-galactoside contents of the extracts of Aronia melanocarpa Elliot from several different extraction processes.
열수 추출물은 221.4㎎/100 g, 70% 에탄올 추출물은 322.1㎎/100 g, 초음파 70% 에탄올 추출물은 402.4㎎/100 g 으로 열수 추출 보다는 에탄올 추출물에서 cya-gal의 용출이 용이하며, 초음파 처리시 용출량이 증진됨을 확인할 수 있다. 이와 같은 결과는 초음파의 장점인 진동에너지로 인하여 추출 의 효율을 증진시킬 수 있는 기존의 연구를 검증하였으며 (Chung et al., 2000), 초음파 추출로 용출량이 증진된 안토시 아닌 cya-gal에 대한 항산화 및 항비만 활성의 증진을 확인하 고자 하였다 (Fig. 1, Table 1).
2. 공정별 추출물의 항산화 활성 비교
상기에서 언급한 활성산소종 (ROS)과 비만의 상관관계에 따 라 추가적으로 추출물별 아로니아 추출물의 항산화 활성을 DPPH 자유라디칼 소거능으로 확인하였다 (Fig. 2). 모든 시료 에서 농도의존적으로 활성이 증가하였으며, 열수 추출은 가장 높은 농도에서 62.56%, 에탄올 추출물은 67.63%, 초음파 전 처리한 추출물은 70.81%의 소거활성을 보였다. 이와 같은 결 과는 양성대조군인 ascorbic acid의 89.03% 보다 다소 낮은 수치이다. 그러나, 동일 농도의 안토시아닌 고함량 검정콩에서 항산화효능이 60% 이하로 보고된 결과와 비교하면 (Kim et al., 2011), 아로니아의 높은 항산화 효과를 확인할 수 있다. 또한, 추출방법 중에서 초음파 70% 에탄올 추출이 아로니아 를 추출함에 있어 항산화 활성을 높일 수 있는 추출방법이 될 수 있을 것으로 보인다. 항산화 효과에 대해 잘 알려진 안토 시아닌 중 하나인 cya-gal의 함량이 초음파 처리로 인해 증진 되었으며 (Wang et al., 1997), 증진된 cya-gal로 인하여 아로 니아 추출물의 항산화 효과 또한 높아진 것으로 사료된다 (Fig. 2).
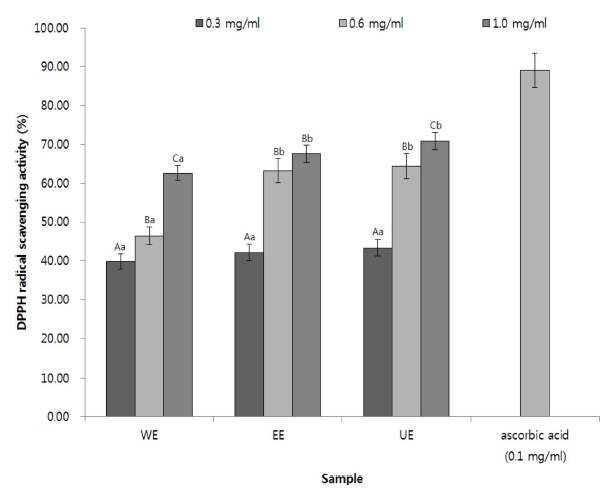
DPPH radical scavenging activities of the extracts from different extraction processes.*Means within a column followed by the same letter are not significantly different based on the DMRT (p < 0.05). Mean with difference letter (A - C) within same sample are significantly different and mean with difference letter (a-c) within same concentration are significantly different. WE; Hot water extraction at 100℃, EE; 70% Ethanol extraction at 80℃, UE; 70% Ethanol extraction with ultrasonic process at 120 ㎑ and 60℃.
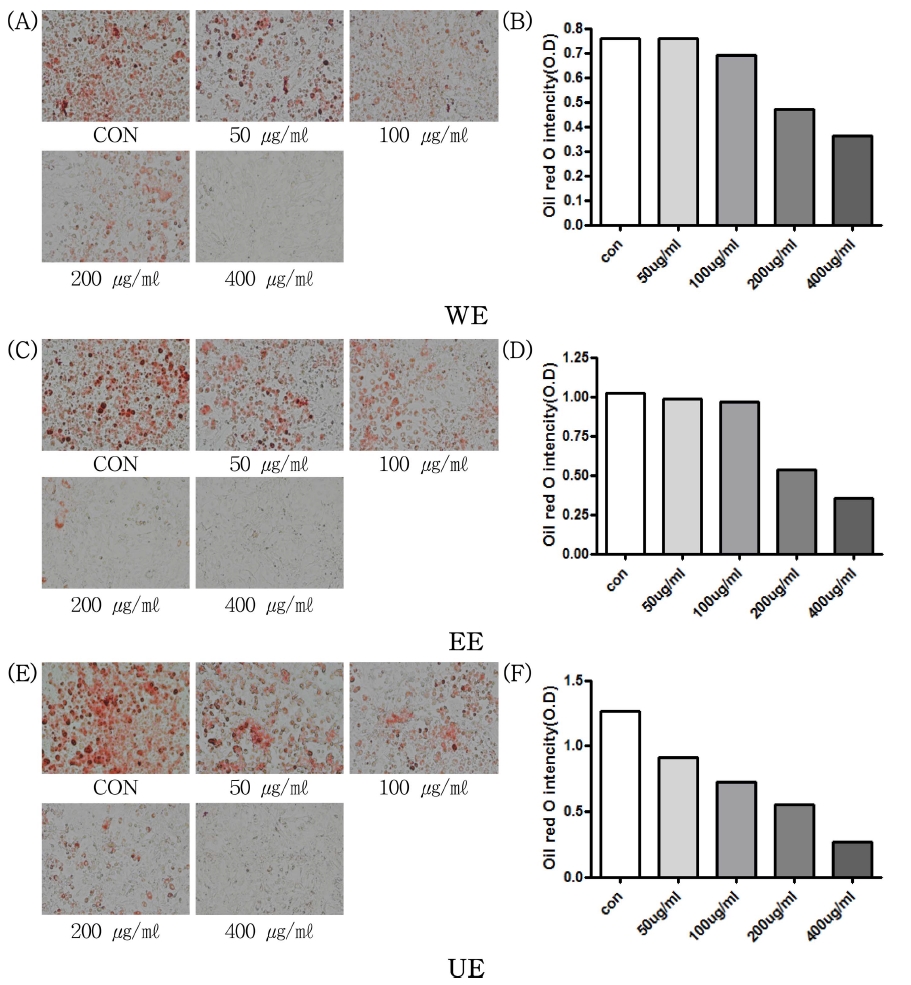
3. 아로니아 추출물의 지방전구세포의 분화도 비교
추출 방법별 아로니아 추출물의 지방분화억제에 대한 효능 을 확인하기 위하여 Oil red O 염색법을 통해 지방전구세포 3T3-L1에 대한 분화억제도를 확인하였으며, 염색된 지방세포 사진과 그에 따른 흡광도를 확인한 결과 (Fig. 3) 모든 시료에 서 농도의존적으로 지방세포 분화억제 효과를 나타남을 확인 할 수 있었다. 추출방법 중에서는 가장 높은 농도에서 열수 추출물의 억제 효과가 가장 낮았으며, 초음파 전처리한 70% 에탄올 추출물에서 다른 추출물에 비해 가장 좋은 지방세포 분화 억제 효과를 나타내었다. 상기의 결과를 통해 지방세포 분화 억제에는 아로니아 추출물 중 초음파 전처리 공정이 가장 적합할 것으로 보여진다. 전지방세포가 지방세포로 분화할 때 활성산소를 생성한다는 기존의 연구를 참고하면, 상기의 항산화 활성 결과와 지방전구세포 3T3-L1의 분화도 확인은 기존 연구 결과 (Lee et al., 2009)와 매우 밀접한 연관이 있음을 알 수 있 다 (Fig. 3).
4. 공정별 추출물의 지방세포 분화조절 단백질 발현량 비교
지방분화세포 3T3-L1의 지방세포분화 조절인자 PPAR-γ와 SREBP1에 대한 아로니아 추출물의 억제 효능을 확인하였다 (Fig. 4).
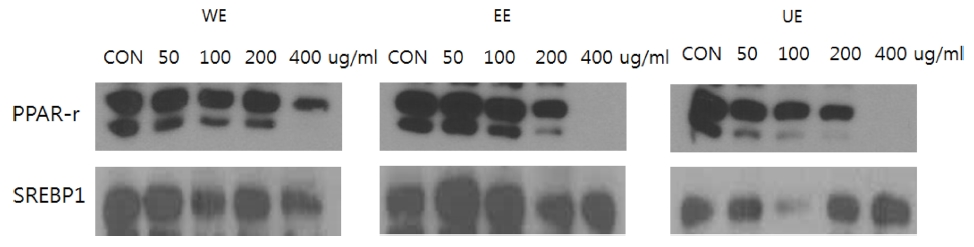
Effects of the extracts from different extraction processes on the expression of the adipocytes differentiation related proteins, PPAR-γ and SREBP1.WE; Hot water extraction at 100℃, EE; 70% Ethanol extraction at 80℃, UE; 70% Ethanol extraction with ultrasonic process at 120 ㎑ and 60℃.
해당인자들은 지방세포분화에 도움을 주는 인자로서, 이들 의 단백질 발현량을 살펴보면 PPAR-γ은 모든 시료에서 농도 의존적으로 발현량이 줄어들었으나, 400㎍/㎖의 농도에서는 모두 발현되지 않은 것을 확인하였다. 이와 같은 결과는 400㎍/㎖에서 독성으로 인하여 발현이 되지 않은 것으로 사 료되며, PPAR-γ의 억제는 200㎍/㎖에서 가장 효과가 좋을 것으로 판단된다.
SREBP1의 경우에는 열수와 70% 에탄올은 고농도에서 그 억제효과를 나타내었으며, 초음파 70% 에탄올 추출물은 보다 낮은 농도인 100㎍/㎖에서 SREBP1의 억제 효과가 가장 좋 은 것을 확인하였다. 상기의 결과를 보면, 아로니아 추출물 중 에서 초음파 전처리한 70% 에탄올 추출물에서 그 억제 효과 가 가장 높게 나타났다.
이와 같은 결과는 안토시아닌의 PPAR-γ와 SREBP1의 발현 을 억제효과에 대한 기존의 연구를 확인하였을 때 (Kao et al., 2009; Hwang et al., 2011), 초음파 추출로 인해 안토시 아닌의 용출량이 증가하였으며, 이로 인해 PPAR-γ와 SREBP1 의 억제효능이 증진된 것으로 볼 수 있으나, 특정 농도이상에 서는 오히려 그 효능이 감소한 것으로 보아 해당 부분에 대해 추가적인 연구가 필요할 것으로 예상된다 (Fig. 4).
5. 저온 초음파 추출물 식이 마우스의 체중 변화
In vitro 결과에서 가장 효과가 좋을 것으로 판단되는 초음 파 아로니아 70% 에탄올 추출물을 4주 간 mouse에 경구 투 여하여 체중변화를 관찰하였으며, 최초 0주차에 대한 체중 및 체중의 증가율을 확인하여 매주 변화율을 관찰하였다 (Fig. 5, Table 2).
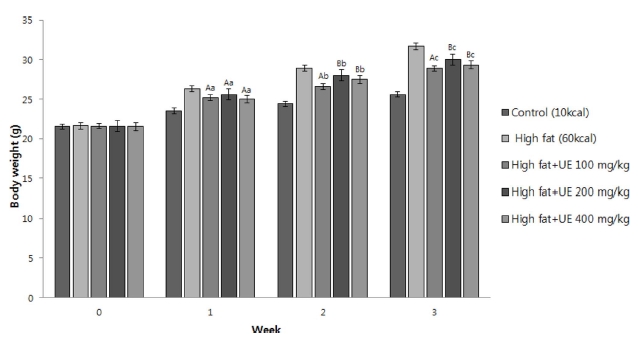
The changes of the body weight of the mouse fed with the extract from ultrasonification extraction process.*Means within a column followed by the same letter are not significantly different based on the DMRT (p < 0.05). Mean with difference letter (A - C) within same time are significantly different and mean with difference letter (a - c) within same concentration are significantly different. UE; 70% Ethanol extraction with ultrasonic process at 120 ㎑ and 60℃.

Increase rate of the body weights of the mouse fed with the extracts from ultrasonification extraction process (UE).
고지방식이에서 아로니아 추출물을 먹였을 때, 매주 체중이 증가한 것을 확인할 수 있는데, 시간이 지남에 따라 100㎎/㎏ 에서 체중의 증가가 가장 적은 것을 확인할 수 있다 (Fig. 5). 대부분 주차가 거듭 될수록 체중 증가율은 감소하는 것을 알 수 있으며, 대조식이에 비해 고지방식이에서 0 - 3주 동안 모 든 주차에서 체중증가율이 더 높은 것을 확인할 수 있다 (Table 2). 고지방식이에 아로니아 추출물을 농도별로 확인한 결과 2주 차에서는 100㎎/㎏을 섭취한 군에서 체중증가율이 눈에 띄게 줄어든 것을 볼 수 있으나, 3주 차에서는 체중 증 가율이 다시 증가하는 것을 확인할 수 있었다. 200㎎/㎏ 및 400㎎/㎏에서는 2주 차의 100㎎/㎏보다 좋은 효과는 보이 지 않았으나, 주차 별로 체중 증가량이 계속해서 감소하는 경 향을 보였다. 총 0 - 3주 간 증가율을 보면, 100㎎/㎏에서 33.98%로 200㎎/㎏의 39.02%, 400㎎/㎏의 36.17% 보다도 낮은 증가율을 보여 100㎎/㎏의 농도가 비만 유도 mouse에 서 항비만 효능이 가장 좋을 것으로 사료된다. 이와 같은 결과 를 통해 아로니아 추출물의 체중감소 효과를 확인하였으며, 특 히 초음파 처리 아로니아 추출물이 비만억제에 더 높은 효능 이 있을 것으로 사료된다 (Fig. 5, Table 2).
본 연구에서는 아로니아 추출물을 이용하여, 새롭게 대두되 고 있는 비만억제 효능을 가진 천연물 소재로서의 가능성을 확인하였다. 항산화와 지방 분화에 대한 연구를 참고하여 항 산화 물질인 아로니아 함유 안토시아닌 cya-gal의 함량과 항 산화 효능을 확인하였으며, 저온 초음파 추출에서 cya-gal 함 량 증가 및 항산화 효능의 증진을 확인할 수 있었다. 지방세 포 분화도 측정 및 각 지방 세포 분화 전사인자 중 지방세포 유전자 조절 부위와 상호작용하여 지방세포 분화를 촉진시키 는 PPAR-γ와 PPAR-γ를 조절하는 SREBP1의 단백질 발현량 을 확인한 결과 아로니아 추출물의 지방억제 효과를 입증하였 으며, 추출물 중에서는 저온 초음파 전처리 추출물의 효능이 가장 좋은 것을 확인할 수 있었다.
최종적으로 in vivo 실험에서 시간에 따른 체중 증가율이 저 온 초음파 추출물에서 가장 좋은 감소효과를 보여, 저온 초음 파 처리 아로니아 추출물의 항비만 효능의 증진을 확인할 수 있었다. 상기의 결과는 저온 초음파 처리를 통해 증진된 안토 시아닌 cya-gal의 함량으로 인하여, 항산화에 대한 효능이 증 진 되었고 더 나아가 항비만에 대한 효능의 증진을 가져온 것 으로 사료된다. 다만, 아로니아에 함유 된 안토시아닌이 cyagal외에도 많은 cyanidin류가 함유되어있는데, 해당 안토시아 닌들의 활성과 관련하여 각 안토시아닌들의 synergy효과를 기 대해볼 수 있으므로, 추가적인 연구가 필요하다.
이와 같은 결과로 항산화와 비만에 대한 선행 연구결과를 재차 확인할 수 있었으며, 저온 초음파 추출의 장점인 성분 물질의 용출량 증대와 고온에서의 파괴를 막는 장점을 모두 활용하여 아로니아의 항산화 및 항비만 활성을 증진시킨 점 에서 높은 활용가치가 있을 것으로 사료된다. 상기와 같은 결과를 통해 건강식품으로서 아로니아의 상품성을 높이고 다 이어트 식품으로서 그 가치를 더 높일 수 있을 것으로 전망 된다.
감사의 글
본 연구는 단양아로니아 영농조합법인의 지원에 의하여 이 루어진 결과로 이에 감사드립니다.
References
- Attie, AD, Scherer, PE, Adipocyte metabolism and obesity, The Journal of Lipid Research, (2009), 50, p395-399.
- Barstard, JP, Maachi, M, Lagathu, C, Kim, MJ, Caron, M, Vidal, H, Capeau, J, Feve, B, Recent advances in the relationship between obesity, inflammation and insulin resistance, European Cytokine Network, (2006), 7, p4-12.
- Brunlich, M, Slimestad, R, Wangensteen, H, Brede, C, Malterud, KE, Barsett, H, Extracts, anthocyanins and procyanidins fromAronia melanocarpaas radical scavengers and enzyme inhibitors, Nutrients, (2013), 5, p663-678.
-
Camp, HS, Ren, D, Leff, T, Adipogenesis and fat-cell function in obesity and diabetes, Trends in Molecular Medicine, (2002), 8, p442-447.
[https://doi.org/10.1016/s1471-4914(02)02396-1]

-
Choi, HM, Moon, SO, Lee, HH, Lee, HD, Inhibitory effect of by Ojeok-san lipid accumulation in high fat dietinduced obesity mice and 3T3-L1 adipocytes, The Korea Journal of Herbology, (2015), 30, p121-128.
[https://doi.org/10.6116/kjh.2015.30.4.121.]

- Chung, KW, Kim, WI, Hong, IK, Park, KA, Ultrasonic energy effects on squalene extraction from amaranth seed, Applied Chemistry, (2000), 4, p149-152.
- d’Alessandro, LG, Kriaa, K, Nikov, I, Dimitrov, K, Ultrasound assisted extraction of polyphenols from black chokeberry, Separation and Purification Technology, (2012), 93, p42-47.
-
Dietz, BM, Kang, YH, Liu, G, Eggler, AL, Yao, P, Chadwick, LR, Pauli, GF, Farnsworth, NR, Mesecar, AD, van Breemen, RB, Bolton, JL, Xanthohumol isolated fromHumulus lupulusinhibits menadione-induced DNA damage through induction of quinone reductase, Chemical Research in Toxicology, (2005), 18, p1296-1305.
[https://doi.org/10.1021/tx050058x]

-
Horton, JD, Goldstein, JL, Brown, MS, SREBPs Transcriptional mediators of lipid homeostasis, Cold Spring Harbor Symposia on Quantitative Biology, (2002), 67, p491-498.
[https://doi.org/10.1101/sqb.2002.67.491]

- Huh, EJ, Shin, HK, Choi, SY, Kwon, OG, Lee, YR, Thermosusceptible developmental stage in anthocyanin accumulation and color response to high temperature in red chrysanthemum cultivars, Korean Journal of Horticultural Science and Technology, (2008), 26, p357-361.
-
Hwang, YP, Choi, JH, Han, EH, Kim, HG, Wee, JH, Jung, KO, Jung, KH, Kwon, KI, Jeong, TC, Chung, YC, Jeong, HG, Purple sweet potato anthocyanins attenuate hepatic lipid accumulation through activating adenosine monophosphateactivated protein kinase in human HepG2 cells and obese mice, Nutrition Research, (2011), 31, p896-906.
[https://doi.org/10.1016/j.nutres.2011.09.026]

-
Jayaprakasam, B, Olson, LK, Schutzki, RE, Tai, MH, Nair, MG, Amelioration of obesity and glucose intolerance in high-fat-fed C57BL/6 mice by anthocyanins and ursolic acid in Cornelian cherry(Cornus mas), Journal of Agricultural and Food Chemistry, (2006), 54, p243-248.
[https://doi.org/10.1021/jf0520342]

- Kao, ES, Tseng, TH, Lee, HJ, Chan, KC, Wang, CJ, Anthocyanin extracted fromHibiscusattenuate oxidized LDLmediated foam cell formation involving regulation of CD36 gene, Chemico-Biological Interactions, (2009), 179, p212-218.
-
Kim, HG, Kim, GW, Oh, H, Yoo, SY, Kim, YO, Oh, MS, Influence of roasting on the antioxidant activity of small black soybean(Glycine maxL. Merrill), Food Science and Technology, (2011), 44, p992-998.
[https://doi.org/10.1016/j.lwt.2010.12.011]

- Kim, JB, Park, JY, Molecular insights into fat cell differentiation and functional roles of adipocytokines, Journal of Korean Society of Endocrinology, (2002), 17, p1-9.
-
Kim, NY, Kim, JH, Choi, GP, Lee, HY, Comparison of anti-skin wrinkle activities ofAronia melanocarpaextracts by extraction methods, Korean Journal of Medicinal Crop Science, (2014), 22, p217-222.
[https://doi.org/10.7783/kjmcs.2014.22.3.217]

- Lee, MK, Liu, Q, Hwang, BY, Kim, SY, Lee, JH, Inhibitory effect of eggplant extract on adipocyte differentiation in 3T3-L1 cells, Yakhak Hoeji, (2011), 55, p309-313.
-
Lee, OH, Kwon, YI, Hong, HD, Park, CS, Lee, BY, Kim, YC, Production of reactive oxygen species and changes in antioxidant enzyme acitvities during differentiation of 3T3-L1 adipocyte, Journal of the Korean Society for Applied Biological Chemistry, (2009), 52, p70-75.
[https://doi.org/10.3839/jksabc.2009.012]

-
Li, H, Jeong, JM, Antioxidant activities of various berries ethanolic extract, Korean Journal of Medicinal Crop Science, (2015), 23, p49-56.
[https://doi.org/10.7783/kjmcs.2015.23.1.49]

-
Lowell, BB, Spiegelman, BM, Towards a molecular understanding of adaptive thermogenesis, Nature, (2000), 404, p652-660.
[https://doi.org/10.1038/35007527]

-
Ohgami, K, Ilieva, I, Shiratori, K, Koyama, Y, Jin, XH, Yoshida, K, Kase, S, Kitaichi, N, Suzuki, Y, Tanaka, T, Ohno, S, Anti-inflammatory effect of aronia extract on rat endotoxininduced uveitis, Investigative Ophthalmology and Visual Science, (2005), 46, p275-281.
[https://doi.org/10.1167/iovs.04-0715]

- Oszmiaski, J, Wojdylo, A, Aronia melanocarpaphenolics and their antioxidant activity, European Food Research and Technology, (2005), 221, p809-813.
-
Park, SJ, Choi, JH, Jung, YS, Yu, MH, Inhibitory effect of Rumex crispus L. fraction on adipocyte differentiation in 3T3-L1 cells, Korean Journal of Food Science and Technology, (2013), 45, p90-96.
[https://doi.org/10.9721/kjfst.2013.45.1.90]

-
Rayalam, S, Della-Fera, MA, Baile, CA, Phytochemicals and regulation of the adipocyte life cycle, The Journal of Nutritional Biochemistry, (2008), 19, p717-726.
[https://doi.org/10.1016/j.jnutbio.2007.12.007]

-
Rosen, ED, Spiegelman, BM, Adipocytes as regulators of energy balance and glucose homeostasis, Nature, (2006), 444, p847-853.
[https://doi.org/10.1038/nature05483]

-
Slimestad, R, Torskangerpoll, K, Nateland, HS, Johannessen, T, Giske, NH, Flavonoids from black chokeberries,Aronia melanocarpa, Journal of Food Composition and Analysis, (2005), 18, p61-68.
[https://doi.org/10.1016/j.jfca.2003.12.003]

- Spielgelman, BM, Enerback, S, The adipocyte A multifunctional cell, Cell Metabolism, (2006), 4, p425-427.
-
Tanaka, T, Tanaka, A, Chemical components and characteristics of black chokeberry, Journal of the Japanese Society for Food Science and Technology, (2001), 48, p606-610.
[https://doi.org/10.3136/nskkk.48.606]

-
Valko, M, Libfritz, D, Moncol, J, Cronin, MTD, Mazur, M, Telser, J, Free radicals and antioxidants in normal physiological functions and human disease, The International Journal of Biochemistry and Cell Biology, (2007), 39, p44-84.
[https://doi.org/10.1016/j.biocel.2006.07.001]

-
Wang, H, Cao, G, Prior, RL, Oxygen radical absorbing capacity of anthocyanins, Journal of Agricultural and Food Chemistry, (1997), 45, p304-309.
[https://doi.org/10.1021/jf960421t]

- Yoo, JS, Ku, JR, Yoon, KH, Jo, JH, Jang, DH, Jung, YS, Kim, JH, Kim, BC, Seok, HJ, Yoon, MC, Roh, JS, Shin, SS, Comparison of Gangji-hwan-1,2,3,4 and combination of Gangjihwan- 1 and Gamisoche-hwan in the reducing effects of body weight in a high fat diet-fed obese mice, Journal of Society of Korean Medicine for Obesity Research, (2015), 15, p9-23.
- Yoo, SJ, Pharmacological treatment of obesity, Journal of Korean Endocrin Society, (2008), 23, p223-233.