
인지능 개선 효과 증진을 위한 백삼 추출물 조제 연구
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
The study was conducted to elucidate the extraction conditions under which white ginseng has cognition-improving efficacy.
Extracts from white ginseng under different solvent and temperature conditions were analyzed for ginsenoside content and inhibitory effect on N-methyl-D-aspartate (NMDA) receptor and acetylcholinesterase. The total ginsenoside contents and amounts of ginsenoside Rb1 plus ginsenoside Rg1 from the 1st extracts (prepared with EtOH/H2O as solvent) were higher than those from the 2nd extracts (extracted with H2O after the 1st EtOH/H2O extraction). The contents in the 1st and 2nd extracts produced at 80°C were also higher than those obtained at 50°C. Samples from the 1st extraction at 80°C indicated higher inhibitory activities on NMDA receptors-whose excessive activation is thought to mediate the calcium-dependent neurotoxicity associated with several neurodegenerative diseases-than those from the 2nd extraction. Among the samples prepared at varying temperatures, the extract prepared at 50°C showed the highest suppression activity on NMDA receptors. Note, however, that the extracts from the 2nd extraction at 50°C inhibited acetylcholinesterase-whose inhibition could be a therapeutic strategy for neurodegenerative diseases with cognitive deficits and memory malfunction-more effectively than those from the 1st extraction.
To enhance the cognition-improving activity of white ginseng extract, it is suggested that the extracts be utilized after being combined the 1st extracts (made with EtOH/H2O solvent) and the 2nd extracts (prepared with H2O) at low temperature.
Keywords:
Panax ginseng, Acetylcholinesterase, Cognition, Extraction, N-methyl-D-aspartate Receptor서 언
오랜 세월 인삼 (Panax ginseng C. A. Meyer)은 식품이나 한약재로 이용되어 왔으며 최근에 보고된 연구결과에 의하면 수삼이나 백삼 등이 항당뇨 효과 (Kim et al., 1989), 항염증 효과 (Hyun et al., 2009; Kim et al., 2015b), 항산화활성 (Jeon et al., 2005; Choi et al., 2006), 암세포에 대한 독성 (Jung et al., 2000), 간보호효과 (Seong et al., 2005) 등 다 양한 생리활성을 가지며 부작용이 없는 것 (Kim et al., 2015a)으로 확인된다.
이 뿐만 아니라, 여러 연구자들에 의해 인삼이 신경보호효 과 (Lee et al., 2011), 중추신경계 면역력 증가 및 염증반응 조절효과 (Sung et al., 2004), acetylcholinesterase 저해활성 (Lee et al., 2008)을 가지며 인삼 성분인 진세노사이드 Rb1과 Rg1이 실험동물에서 부분적으로 학습향상효과를 보인다는 연 구결과 (Mook-Jung et al., 2001)가 보고되었고, 인삼이 허혈 로 유도한 흰쥐의 신경손실 및 학습과 기억 손상에 대해 보호 효과를 가진다는 연구 (Kim, 2007)가 보고되어 인삼의 중추신 경계 기능개선 효과를 증명해주고 있다. 이러한 인삼의 중추신 경계에 미치는 유익한 효과는 사람을 대상으로 한 연구에서도 확인 되었는데, Kennedy 등 (2002)은 Ginkgo biloba·ginseng 복합제의 단회 투여에 의한 인지기능개선 효과를 보고하였고, Reay 등 (2010)은 인체에서 Panax ginseng (G115)의 작업기 억능력 개선 효과를 보고한 바 있다.
그러므로 이처럼 국내외적으로 보고된 인삼의 유용한 효능 을 이용하여 건강기능식품으로 개발한다면 국민건강 증진, 농 가소득 향상 뿐 만아니라 산업 활성화 등과 같은 다양한 측면 에서 긍정적인 효과를 기대할 수 있을 것이다.
한편, 근래에 들어 인삼을 증숙 가공한 홍삼은 건강기능식 품원료로서 면역력증진, 피로회복, 기억력 개선, 혈행 개선, 항 산화 효과, 갱년기 여성건강 개선 등 다양한 기능성을 인정받 고 있지만, 가공되지 않은 인삼 (백삼, 수삼 등)에 대해서는 면역력증진, 피로회복에 국한하여 기능성이 인정되어 있는 실 정이다.
따라서, 본 연구에서는 국내외적으로 연구된 인삼의 중추신 경계, 기억력 개선 등과 관련된 효능을 건강기능식품 기능성 원료로 개발하기 위한 예비단계로서 몇 가지 추출 조건에 따 라 추출된 인삼 추출물의 진세노사이드 함량, 기억력개선 또 는 인지능개선과 관련되는 분석지표인 N-methyl-D-aspartate (NMDA) 수용체 저해활성 및 아세틸콜린에스테라제 저해활성 을 평가함으로써 기능성이 우수한 인삼 추출물 제조 방법을 제시하고자 하였다.
인삼 추출물 조제에 있어서는 건강기능식품제조에 사용이 가능한 용매로서 EtOH과 H2O를 사용하여, 먼저 일정 온도에 서 EtOH과 H2O의 혼합 비율별로 추출물을 제조하여 1차 추 출물로 하였고, 1차 추출 후의 잔사에 남아 있을 수 있는 성 분을 최대한 추출하여 활용하기 위해 H2O로서 2차 추출물을 조제하였다. 또한, 온도를 정한 후 얻어진 용매별 추출물들에 대한 진세노사이드 성분 및 활성분석을 통해 용매 조건을 설 정하고, 설정한 용매 조건에서 다시 여러 온도 조건에서의 추 출물을 조제하였으며, 마지막으로 정해진 온도 조건에서 여러 가지 EtOH과 H2O의 혼합용매 조건으로 다시 추출물을 조제 하여 진세노사이드 함량과 활성을 분석함으로써 인지기능을 보유하는 인삼 추출물 조제과정을 완성하고자 하였다.
재료 및 방법
1. 실험재료
실험에 사용된 인삼 시료 (Panax ginseng C. A. Meyer)는 충북 보은군 임학용 농가에서 키운 4년근 수삼을 충북인삼농 협이 2013년 9월 24일 채굴 및 수매한 후 세척, 박피 및 건 조과정을 거쳐 피부백삼 형태로 가공한 것이었다 (Table. 1, 2). 추출물조제를 위해 표피잔사와 뇌두를 제외한 인삼 시료를 조사된 피부백삼과 미삼의 비율 (72.7 : 21.7)로 칭량하여 세절 한 후 사용하였다.
2. 용매 비율별 인삼 추출물의 조제
앞에서 설명한 바와 같이 세절한 백삼 시료 약 316 g을 10배량의 90%, 70%, 50%, 30%, 0% EtOH (Daehan Ethanol Life, Seoul, Korea)으로 pyrex flask, 냉각관 및 맨 틀 (Mtops, Misung Scientific Co., Ltd., Yangju, Korea)로 조립한 환류추출장치를 이용하여 80℃에서 3시간 추출하고 여 과하였으며 여과 후 남은 시료 잔여물은 다시 동일 용매를 사 용하여 추출 및 여과를 4차례 반복하였다. 최종적으로 남은 시 료 잔여물은 H2O를 가해 추출 및 여과하기를 2차례 반복하였 다. 이렇게 얻어진 4차례 반복 추출된 EtOH 비율별 추출물을 합한 것 (이하 85℃ 1차 추출물)과 2차례 반복 추출된 H2O 추출물을 합한 것 (이하 85℃ 2차 추출물)은 감압 농축 (Eyela N-1200B, Tokyo Rikakikai Co., Ltd., Tokyo, Japan) 및 동결 건조 (PVTFD 50R, IlshinBioBase Co., Ltd., Dongducheon, Korea)로 각각 용매 또는 수분을 제거하고 진세노사이드 함량 분석 및 NMDA receptor 결합 저해능 분석에 사용하였다.
그리고, 대조 추출물로 사용하기 위해 전통적인 한약 달임 과 같은 방식으로 백삼시료를 10배량의 H2O로 100℃에서 3 시간 3회 반복하여 끓여서 조제한 것을 모두 합한 것을 여과 하고 용매를 제거하였다.
한편, 진세노사이드 함량을 분석하기 위해서는 조제된 인삼 추출물 일정량을 70% 메탄올 (Merck KGaA, Darmstadt, Germany)에 녹인 후 필터로 여과하고 HaloRP-amide 컬럼 (4.6 × 150㎜, 2.7㎛, Wilmington, DE, USA)을 이용하여 50 ℃에서 HPLC (Agilent 1100, Agilent Technologies Inc., Santa Clara, CA, USA)로 진세노사이드 함량을 분석하였다. HPLC 분석에 사용된 용매는 아세토나이트릴 (Merck KGaA, Darmstadt, Germany) 및 H2O를 혼합해서 사 용했으며 유속은 0.5 - 0.8 ㎖/min으로 설정하였다. 분석 대상 진세노사이드는 Rg1, Re, Rf, Rb1, Rg2, Rh1, Rc, Rb2, Rb3, Rd이었으며 진세노사이드 표준물질은 ChromaDex사 (Irvine, CA, USA)의 것을 사용하였으며, 모든 표준물질은 1H-NMR을 측정하여 비교 확인하였다.
3. 온도 조건별 인삼 추출물 조제
인삼 약 254 g을 칭량하여 중량의 10배에 해당하는 70% EtOH을 가해 pyrex flask, 냉각관 및 heater로 조립한 환류추출 장치를 이용하여 온도별 (상온, 50℃, 60℃, 70℃, 80℃, 90℃, 100℃)로 3시간씩 4회 반복 추출 및 여과하였다. 4회 반복 및 여과한 추출액을 합한 것 (이하 각 온도별 70% EtOH 추출 물)은 감압농축장치를 이용해 용매를 제거하였고 용매 제거 후 남은 수분과 H2O 추출물은 동결건조로 제거하였다. 얻어진 각 온도별 70% EtOH 추출물의 진세노사이드 함량 분석은 앞서 언급한 인삼추출물의 분석과 동일한 방법으로 수행하였다.
4. 저온에서의 인삼 추출물 조제
추출 온도를 50℃로 고정한 환류추출장치에서 세절한 백삼 시료 약 254 g을 10배량의 90%, 70%, 50%, 30%, 0% EtOH로 각각 4차례 추출 및 여과하는 과정을 반복하여 합한 후 농축하였으며 이를 저온 (또는 50℃) 1차 추출물로 하였으 며, 각 추출액을 여과하고 남은 잔사를 동량의 H2O로 2회 반 복 추출 및 여과하여 합한 후 농축함으로써 저온 (또는 50℃) 2차 추출물을 조제하였다. 각 추출액의 용매 제거에는 감압농 축기를 사용하였고 남은 수분은 동결 건조하여 최종 추출물을 얻었다. 얻어진 저온 1차 추출물 및 저온 2차 추출물의 진세 노사이드 함량은 위에서 언급한 것과 동일한 방법으로 분석하 였으며 저온에서 추출한 1차 추출물 (5개) 및 2차 추출물 (5개)을 아세틸콜린에스테라제 저해능 분석에 사용하였다.
5. 용매 조건 및 온도 조건별 인삼 추출물의 세포독성 분석
용매 비율별 인삼 추출물 및 온도 조건별 인삼 추출물의 세 포에 대한 독성을 확인하기 위한 실험을 수행하였다. 먼저, fetal bovine serum (FBS, Gibco, Carlsbad, CA, USA)이 없는 RPMI 배지 (Gibco, Carlsbad, CA, USA)에 PC12 cells (1 × 105 cells/well)을 96 well plate에 분주하였다. 24시 간 동안 37℃, 5% CO2 배양기에서 배양한 후 배양액을 모두 제거하였으며 새로운 배지 [RPMI (Gibco, Carlsbad, CA, USA) + 1% penicillin (Sigma-Aldrich Co., St Louis, MO, USA), streptomycin (Sigma-Aldrich Co., St Louis, MO, USA)] 100㎕를 각각의 well에 넣은 후 최종 농도 50㎍/㎖ 이 되게 준비한 시료 20 ㎕을 첨가하여 24시간동안 배양하였 다. 상온에서 녹인 CellTiter 96 aqueous solution reagent (Promega Co., Ltd., Madison, WI, USA) 20㎕를 well에 각각 첨가하여 2시간 동안 배양기에서 반응시킨 후 Multiskan GO (Thermo Fisher Scientific Inc., Waltham, MA, USA)에 서 490㎚의 파장으로 흡광도를 측정하였다.
6. 용매 조건 및 온도 조건별 인삼 추출물의 NMDA receptor 결합 저해능 분석
용매 비율별 인삼 추출물 및 온도 조건별 인삼 추출물의 NMDA receptor 결합 저해능을 측정을 위해 랫드에서 적출한 대뇌피질을 4℃에서 균질화하여 최종 1㎎ 단백질을 멤브레 인에 얇게 편 후, 4℃에서 60분간 5nM의 [3H]CGP39653 (DuPont NEN, Boston, MA, USA)과 5mM Tris-Hcl (pH 7.7) (Sigma-Aldrich Co., St Louis, MO, USA), 10mM EDTA-Tris (Gibco, Carlsbad, CA, USA)에 최종농도가 50㎍/㎖이 되도록 녹인 인삼추출물 시료를 동시에 처리하여 반응시키고, 100 μM 의 L-glutamine (Gibco, Carlsbad, CA, USA)을 첨가하여 비특 이적 결합을 막았다. 반응 후 즉시 진공을 사용하여 글라스 섬 유 필터 (Whatman GF/B glass fiber filters, Whatman Co., Maidstone, UK)로 걸러준 후 필터를 아이스-콜드 배양 버퍼로 2 - 3회 세척 후 필터를 건조하여 Topcount NXT™ (Packard Bioscience Co., Meriden, CT, USA)로 방사선량을 측정하였다.
7. 저온에서 조제된 인삼추출물의 acetylcholinesterase 저해능 분석
50℃에서 EtOH 비율별로 추출된 1차 추출물 및 남은 잔사에 대해 H2O로 추출한 2차 추출물의 인지능 개선 효과를 확인하 기 위해 아세틸콜린에스테라아제 저해능을 분석하였다. 먼저, 96 well black plate (SPL Life Science Co., Ltd., Pocheon, Korea)에 Amplex Red acetylcholine/acetylcholinesterase assay kit (Invitrogen, Carlsbad, CA, USA)의 5 × 반응 버퍼를 H2O (3차 증류수), 시료를 첨가하여 1 × 반응 버퍼로 제조하여 웰에 100㎕씩 첨가하였다. 여기에 200㎕의 Amplex red reagent stock solution (Invitrogen, Carlsbad, CA, USA), 100㎕의 HRP conjugate solution (Invitrogen, Carlsbad, CA, USA), 100㎕의 choline oxidase stock solution (Invitrogen, Carlsbad, CA, USA), 10㎕의 acetylcholine stock solution (Invitrogen, Carlsbad, CA, USA), 9.59㎖의 1 × reaction buffer로 구성된 혼합액 100㎕를 첨가하여 빛이 없는 상온에서 30분간 반응시 킨 후 Infinity F200 PRO (Tecan Group Ltd., Mnnedorf, Switzerland)를 사용하여 형광을 측정 (excitation 530㎚, emission 590)하였다. 위에서 언급한 저온 1차 추출물들 (5개) 및 저온 2차 추출물 (5개) 각각에 대해 3회 반복하여 acetylcholinesterase 저해능 분석을 수행하였다.
8. 통계처리
활성과 관련 실험결과 (n = 2)는 mean ± standard error로 나 타내었고, Student’s t-test에 의해 유효성을 분석하였으며 control과 비교하여 p < 0.05 이상인 것을 통계학적으로 유의성 이 있는 것으로 인정하였다.
결과 및 고찰
1. 용매 비율별 인삼 추출물의 수율 및 진세노사이드 함량 분석 결과
각 용매 비율별 추출물을 조제하여 수율과 진세노사이드 함 량을 확인하고 그 결과를 Table 3에 나타내었다.
먼저, 수율에 있어서는 EtOH와 H2O를 비율별 (EtOH: H2O = 90 : 10, 70 : 30, 50 : 50, 30 : 70, 0 : 100)로 1차 추출한 추출물들은 14.8 - 50.4%의 수율을 나타내었으며, 1차 추출물 의 잔사들에 대해 각각 H2O로 2차 추출하여 얻어진 추출물들 은 2.4 - 12.2%의 수율을 나타내는 것으로 나타나 EtOH를 혼 합한 용매로 추출한 추출물들이 그 잔사에 대해 다시 추출한 추출물보다는 높은 수율을 나타냄을 알 수 있었다. 또, 용매 조건별로 추출한 1차 추출물 중에서는 H2O만으로 추출하였을 때 가장 높은 수율을 나타내었고, 그 잔사들에 대해 2차로 H2O로 추출한 추출물 중에서는 90% EtOH 추출잔사에 대해 2차로 추출한 추출물의 수율이 가장 높았다. 하지만, 수율에 있어서는 대조 추출물로서 전통적인 한약추출과 유사한 방법 으로 추출하여 얻어진 추출물의 수율이 55.2%로서 1차 및 2 차 용매 조건별 추출물들보다 더 높았다.
한편, 각 용매 비율별 추출물 및 그 잔사로부터 2차 추출로 얻어진 H2O 추출물들에 대해 진세노사이드 함량을 분석한 결 과, 추출물 g당 총 진세노사이드 함량은 1차 추출물에서 24.1 - 91.5㎎/g의 함량을 보였고, EtOH 비율별 1차 추출물의 잔사 에 대해 H2O로 2차 추출한 추출물들의 g당 총 진세노사이드 함량은 0.8 - 39.6㎎/g를 나타내었다. 1차 추출물 중에서는 90% EtOH 1차 추출물이 가장 높은 수치를 나타냈었으며, 2차 추출물 중에서는 1차 H2O 추출 후 남은 잔사에 대해 2차 H2O로 추출한 추출물이 가장 높았다. 대조 추출물은 21.9㎎/ g의 g 당 총 진세노사이드 함량을 보여 비교적 낮은 수치를 나타냄을 확인하였다. 또한, 이들 추출물 g당 Rb1 + Rg1 함량 을 살펴보았을 때, 1차 추출물들이 9.4 - 32.8㎎/g 2차 추출물 들이 0.8 - 14.2㎎/g를 나타내었다.
총 추출물에 대한 진세노사이드 함량은 1차 추출물들에서 3,847 - 4,691㎎이었고, 2차 추출물들은 15 - 308㎎으로 나타 났으며, 총 추출물에 대한 Rb1 + Rg1 함량은 1차 추출물에서 1,445 - 1,717 ㎎, 2차 추출물에서 15 - 111㎎을 나타내었다. 이러한 결과에 의하면 총 추출물에 대한 총 진세노사이드 함 량과 Rb1 + Rg1 함량은 70% EtOH로 추출한 1차 추출물이 각각 4,691㎎ 및 1,717㎎로 가장 높았는데 이는 대조 추출 물의 총 진세노사이드 함량인 3,826㎎ 및 Rb1 + Rg1 함량인 1,377㎎보다 높은 결과였다.
그런데, 인삼의 건강기능성 원료로 활용하기 위한 규격 기 준인 Rb1 + Rg1 함량을 기준으로 활용성이 높은 용매 비율별 추출 조건을 선정하는 것이 매우 중요하므로 분석된 수율 및 진세노사이드 함량은 각 EtOH 비율별 총 추출물 중에서의 총 진세노사이드 함량 및 Rb1 + Rg1 함량을 산출하고 가장 높은 수치를 나타내는 용매 조건으로 인삼의 추출물을 조제하는 것 이 바람직할 것으로 사료되었다. 따라서, 위 실험된 결과 중에 서 80℃에서 얻어진 인삼 추출물의 경우, 총 추출물에 대한 총 진세노사이드 함량과 Rb1 + Rg1 함량이 가장 높았던 70% EtOH로 1차 추출물의 활용성이 좋을 것으로 사료되었다.
2. 온도 조건별 인삼 추출물의 수율 및 진세노사이드 함량 분석 결과
위에서 언급된 실험결과에 따라 총 진세노사이드 함량 및 Rb1 + Rg1 함량이 가장 높았던 70% EtOH을 용매 조건으로 고정하고 여러 가지 온도 조건 (상온, 50, 60, 70, 80, 90, 100℃)에서 추출물을 조제한 후 수율, 단위 g당 진세노사이드 함량 및 총 추출물에 대한 진세노사이드 함량을 분석하였으며 그 결과는 Table 4에 나타내었다.
70% EtOH로 상온, 50℃, 60℃, 70℃, 80℃, 90℃ 및 100℃ 에서 추출한 추출물들의 수율은 8.8 - 22.5%로 나타나 70℃에서 추출한 추출물이 가장 높은 수율을 나타내었고, 단위 g 당 총 진세노사이드 함량은 각각 45.1 - 63.4 ㎎/g의 결과를, 그리고 단위 g 당 Rb1 + Rg1 함량은 17.1 - 24.2㎎/g의 결과를 보였 는데 100℃에서 추출할 경우 단위 g 당 총 진세노사이드 함 량과 단위 g 당 Rb1 + Rg1 함량이 가장 높았다.
한편, 각 온도 조건별로 얻어진 총 추출물에 대한 총 진세 노사이드 함량과 Rb1 + Rg1 함량에 있어서는 각각 1,042 - 3,537㎎ 및 387 - 1,348㎎의 함량을 나타내었으며, 총 추출물 에 대한 총 진세노사이드 함량과 Rb1 + Rg1 함량도 100℃에 서 추출한 추출물이 가장 높은 함량을 나타내었다. 하지만, 인 삼 중의 malonyl ginsenoside는 가열에 의해 malonyl 기가 소 실되며, C-20 위치의 당 결합은 산에 약하여 인삼의 가열추출 시 인삼에 존재하는 유기산류와 반응하여 가수분해 되기 쉬워 (Shin et al., 2001) 인삼 고유의 성분을 유지시킨 추출물을 제 조하기 위해서는 온도설정이 매우 중요하다고 사료되었다.
3. 저온에서 조제된 인삼 추출물의 수율 및 진세노사이드 함량 분석 결과
위 실험결과에서 80℃로 고정된 온도 조건에서 EtOH 비율 별로 추출된 1차 인삼 추출물과 2차 인삼 추출물 그리고 70% EtOH로 온도별로 추출된 인삼 추출물에 대한 NMDA 수용체 저해활성에 대한 실험결과로부터 인삼 추출물은 저온에서 70% EtOH로 추출하였을 때, 가장 우수한 NMDA 수용체에 대한 저해활성을 보였기에 온도 조건을 50℃로 고정한 후 EtOH 비 율별로 추출물을 조제하였고, 이들에 대한 아세틸콜린에스테라 제 저해활성을 분석하였다.
먼저, 저온에서 EtOH 비율별로 얻어진 각 추출물의 수율은 Table 5에 나타낸 바와 같이 EtOH 비율별로 추출된 1차 추 출물은 10.9 - 51.4%의 수율을 보였고, 2차 추출물은 1.0 - 11.5%의 수율을 나타내었다. 한편, 50℃의 온도 조건에서 인삼 추출물 단위 g당 총 진세노사이드 함량은 1차 추출물에서 19.0 - 79.7㎎/g이었으며 2차 추출물에서는 1.1 - 37.7㎎/g이 었다. 단위 g당 Rb1 + Rg1의 함량은 1차 추출물에서 6.3 - 28.0㎎/g이었으며 2차 추출물에서는 0.7 - 11.8 ㎎/g로 나타났다.
한편, 1차 추출로 얻어진 각 총 추출물에 대한 총 진세노사 이드 함량은 2,210 - 3,282㎎이었으며 30% EtOH 추출물이 가장 높은 수치를 보였고, 2차 추출물에서는 7 - 45㎎으로 나 타났고 90% EtOH 추출 후의 잔사에 대한 H2O 추출물이 가 장 높았다. 저온에서 얻어진 각 EtOH 비율별 총 추출물에서 총 Rb1 + Rg1의 함량은 1차 추출물에서 776 - 1,238㎎으로 나타났고 이중 30% EtOH 추출물이 가장 높은 수치를 보였으 며, 2차 추출물에서는 5 - 170㎎로 나타났으며 이중 90% EtOH 추출 후의 잔사에 대한 H2O 추출물이 가장 높았다.
온도를 50℃로 고정한 조건에서 단위 g당 진세노사이드 함 량이나 총 추출물의 진세노사이드 함량은 80℃에서 추출된 인 삼추출물의 각 함량과 다소 차이가 있는 것으로 확인되어 건 강기능식품으로 제조 시에 종합적으로 검토되어야 할 사항이 라고 사료되었다.
4. 용매 조건 및 온도 조건별 인삼 추출물의 세포독성 분석 결과
위에서 언급한 용매 비율별 1차 및 2차 추출물, 대조 추출 물과 온도 조건별 추출물을 최종 농도 50㎍/㎖의 조건에서 PC12 세포에 대한 세포독성을 실험하였다 (Table. 3, 4). 그 결과, Fig. 1에 나타낸 바와 같이 용매 비율별 추출물 12개는 88.3 - 101.8%의 세포증식율을 보였는데, 70% EtOH로 1차 추 출한 추출물이 101.8%로 가장 우수하였다. 또한, Fig. 2에 나 타내었듯이 온도 조건별 추출물은 92.8 - 101.1%의 세포증식율 을 나타내었는데 60℃에서 70% EtOH로 추출한 추출물이 101.1%로 가장 높은 수치를 나타내었다. 용매 조건별 및 온도 조건별 추출물은 대부분의 추출물이 PC12 세포에 대해 우수 한 증식효과가 있음을 알 수 있었다.
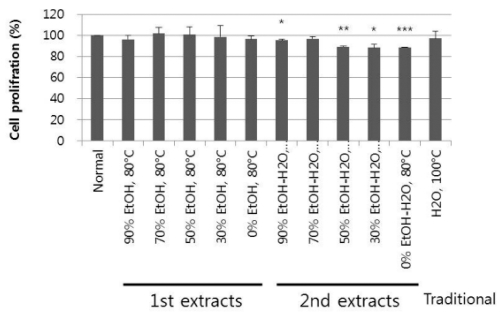
Cell proliferation on PC12 of ginseng extracts (50㎍/㎖) prepared at different solvent conditions.Normal means distilled water. 1st extracts prepared at 80℃ included five samples extracted with 90% EtOH, 70% EtOH, 50% EtOH, 30% EtOH and 0% EtOH, respectively. Five 2nd extracts were obtained at 80℃ are 90% EtOH-H2O, 80℃, 70% EtOH-H2O, 80℃ , 50% EtOH-H2O, 80℃ , 30% EtOH-H2O, 80℃ , 0% EtOH-H2O, 80℃ which are extracted with H2O after extraction with 90%, 70%, 50%, 30% and 0% EtOH, respectively. Traditional means the sample extracted with H2O at 100℃. Statistical analysis were conducted by Student’s t-test (n= 2). Significant differences with normal were designated as *p < 0.05, **p < 0.01 and ***p < 0.001.
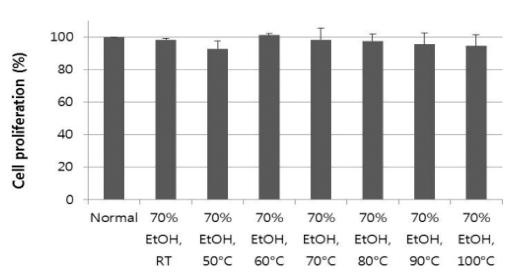
Cell proliferation on PC12 of ginseng extracts (50㎍/㎖) prepared at several temperatures.Normal means distilled water. 70% EtOH, RT named the sample extracted at room temperature, 70% EtOH, 50℃ did the sample extracted at 50℃, 70% EtOH, 60℃ did the sample extracted at 60℃, 70% EtOH, 70℃ did the sample extracted at 70℃, 70% EtOH, 80℃ did the sample extracted at 80℃, 70% EtOH, 90℃ did the sample extracted at 90℃, 70% EtOH, 100℃ did the sample extracted at 100℃ with 70% EtOH, respectively. Statistical analysis were conducted by Student’s t-test (n = 2).
5. 용매 조건별 및 온도 조건별 인삼 추출물의 NMDA 수용체 결합저해능 분석 결과
NMDA 수용체의 과도한 활성화는 glutamate 독성과 신경사 멸과 관련되며 이것이 알츠하이머병과 같은 신경퇴행과 관련 된 여러 질환에서 관찰된다는 보고 (Chen et al., 1992)가 있 어 80℃에서 추출된 EtOH 비율별 1차, 2차 추출물 및 대조추 출물, 그리고 온도 조건에 따른 70% EtOH 추출물을 재료로 하여 최종 농도 50㎍/㎖의 조건에서 NMDA 수용체에 대한 결합저해능을 분석하였으며 (Table. 3, 4), 그 결과를 Fig. 3 및 Fig. 4에 나타내었다.
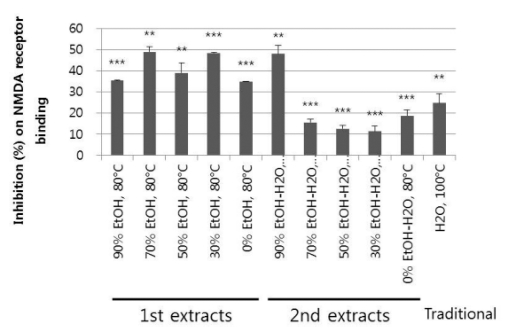
Inhibition on NMDA receptor binding of ginseng extracts (50㎍/㎖) prepared at different solvents.Normal means distilled water. 1st extracts prepared at 80℃ include five samples extracted with 90% EtOH, 70% EtOH, 50% EtOH, 30% EtOH and 0% EtOH, respectively. Five 2nd extracts obtained at 80℃ are 90% EtOH-H2O, 80℃, 70% EtOH-H2O, 80℃, 50% EtOH-H2O, 80℃, 30% EtOHH2O, 80℃, 0% EtOH-H2O, 80℃ which are extracted with H2O after extraction with 90%, 70%, 50%, 30% and 0% EtOH, respectively. Traditional means the sample extracted with H2O at 100℃. Statistical analysis were conducted by Student’s t-test (n = 2). **Indicate significant difference at p < 0.01 compared with control. ***Indicate significant difference at p < 0.001 compared with control.
EtOH 비율별 추출물에서는 1차 추출물이 34.9 ± 0.1 - 49.0 ± 2.5%, 2차 추출물이 11.2 ± 2.5 - 48.0 ± 4.2%의 NMDA 수용 체에 대한 저해활성을 보여 1차 EtOH 추출물이 2차 H2O 추 출물 보다 대체적으로 우수한 저해활성을 보였다. 1차 추출물 중에서는 70% EtOH 추출물, 30% EtOH 추출물, 2차 추출 물 중에서는 90% EtOH 추출 후 잔사에 대한 H2O 추출물이 48% 이상의 매우 우수한 저해활성을 보였다 (Fig. 3).
온도 조건별 70% EtOH 추출물에 있어서는 37.5 ± 4.6 - 52.1 ± 1.7%의 NMDA 수용체 저해활성을 확인할 수 있었으며 상온, 50℃ 및 60℃에서 추출된 추출물이 각각 49.5 ± 0.6%, 52.1 ± 1.7% 및 50.1 ± 2.5%의 유의하고 우수한 NMDA 수용 체 저해활성을 보였으므로 NMDA 수용체에 대해서는 70℃이 상의 고온보다는 60℃이하의 저온에서 추출된 추출물이 더 우 수한 저해활성을 나타내는 것으로 확인되었다 (Fig. 4).
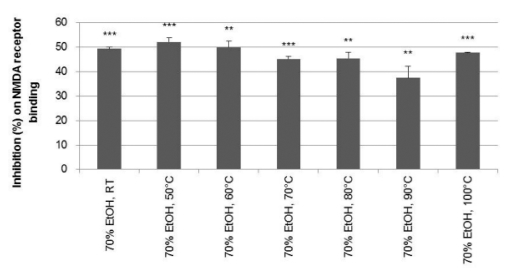
Inhibition on NMDA receptor binding of ginseng extracts (50㎍/㎖) prepared at different temperatures.70% EtOH, RT means the sample extracted at room temperature, 70% EtOH, 40℃ means the sample extracted at 50℃, 70% EtOH, 60℃ means the sample extracted at 60℃, 70% EtOH, 70℃ means the sample extracted at 70℃, 70% EtOH, 80℃ means the sample extracted at 80℃, 70% EtOH-H2O, 90℃ means the sample extracted at 90℃, 70% EtOH-H2O, 100℃ means the sample extracted at 100℃ with 70% EtOH, respectively. Statistical analysis were conducted by Student’s t-test (n = 2). Significant differences with normal were designated as *p < 0.05, **p < 0.01 and ***p < 0.001.
보고에 의하면 인삼에 함유된 여러 종의 진세노사이드 중에 서 ginsenoside Rb1은 허혈로부터 해마를 보호하며 (Lim et al., 1997), ginsenoside Rb1는 glutamate로 유도한 신경독성으 로부터 피질신경세포를 보호하는 것으로 알려져 있다 (Kim et al., 1998). 또한, Radad 등 (2004)은 가공되지 않은 인삼의 주요성분인 ginsenoside Rb1과 Rg1이 세포배양실험에서 부분 적이지만 신경보호 작용을 가진다고 보고한 바 있다. 이러한 보고들을 고려하여 Table 3, 4의 인삼 추출물의 ginsenoside Rb1과 Rg1의 함량 및 Fig. 3와 Fig. 4의 NMDA 수용체에 대한 저해효과를 비교하였을 때, ginsenoside Rb1과 Rg1의 함량이 높은 인삼 추출물일지라도 반드시 NMDA 수용체에 대해 우수한 저해효과를 나타내지는 않음을 알 수 있으므로 이들 2가지 진세노사이드 외의 다른 성분이 작용할 가능성이 있을 것으로 사료된다. 한편, 가공된 홍삼의 주요성분인 ginsenoside Rg3는 배양된 세포에서 NMDA 수용체에 대한 저해효과를 통해 신경보호작용을 할 것 이라는 보고가 있었고 (Kim et al., 2002), ginsenoside Rh2도 Rg3와는 다른 기전 에 의해 NMDA 수용체에 대한 저해효과를 나타내는 것으로 보고된 바 있다 (Lee et al., 2006).
6. 저온에서 조제된 인삼 추출물의 acetylcholinesterase 저해능 분석 결과
전뇌의 콜린성 신경세포는 뇌에서 다른 신경전달물질을 조 절하는 중요한 역할을 하는 데 (Giacobini, 2003), 알츠하이머 병에서는 인지 및 행동기능에 관여하며 전뇌의 콜린성 신경세 포의 손실과 아세틸콜린의 감소가 보고되어 있고 (Perry et al., 1978), 뇌의 아세틸콜린 활성은 콜린에스테라제에 의해 가 수분해되어 종결되므로 이들 효소에 대한 저해물질의 개발 필 요하다 (Greig et al., 2005).
이와 관련하여 본 연구에서 조제한 각 인삼 추출물을 인지 능과 관련된 지표물질인 아세틸콜린에스테라제에 대한 저해활 성을 분석한 결과, Fig. 5에 나타낸 바와 같이 최종농도 50 ㎍/㎖의 조건에서 4.1 ± 0.2 - 13.4 ± 0.9%의 아세틸콜린에스테 라제 저해활성을 나타내는 것으로 확인되어 인삼 추출물들이 대체적으로 아세틸콜린에스테라제에 대해 저해효과가 높지 않 았으나, 70% EtOH 추출 후의 H2O 추출물과 50% EtOH 추 출 후의 H2O 추출물은 각각 13.4 ± 0.9% 및 13.1 ± 0.6%의 유의한 저해활성을 보여 다른 인삼 추출물들에 비해 비교적 우 수한 효과를 나타낸 것을 확인할 수 있었다. 한편, 저온에서 추 출된 인삼 추출물들의 진세노사이드 함량을 분석한 Table 3의 결과를 살펴보면 아세틸콜린에스테라제 저해활성이 우수하였던 70% EtOH 추출 후의 H2O 추출물과 50% EtOH 추출 후의 H2O 추출물은 다른 추출물들에 비해 ㎎당 total ginsenoside 함 량, Rb1 + Rg1 함량 및 PD/PT에서도 낮은 수치를 보였으며, 개별 ginsenoside 함량에서도 매우 낮은 수치를 보인 것을 알 수 있었다. 따라서, 이들 두 가지 저온 추출물이 아세틸콜린에 스테라제 저해효과를 보인 것은 본 연구에서 분석된 진세노사 이드 외의 다른 성분에 기인할 것으로 사료되었다.
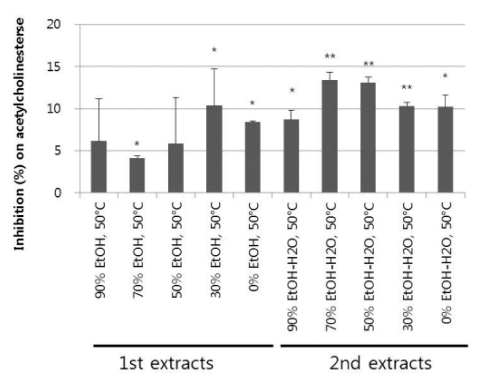
Suppressive effect on acetylcholinesterase of ginseng extracts 50 ㎍/㎖ prepared with different solvents at 50℃.1st extracts prepared at 50℃ includes five samples extracted with 90% EtOH, 70% EtOH, 50% EtOH, 30% EtOH and 0% EtOH, respectively. Five 2nd extracts obtained at 50℃ include 90% EtOHH2O, 50℃, 70% EtOH-H2O, 50℃, 50% EtOH-H2O, 50℃, 30% EtOH-H2O, 50℃, 0% EtOH-H2O, 50℃ which are extracted with H2O after extraction with 90%, 70%, 50%, 30% and 0% EtOH, respectively. Statistical analysis were conducted by Student’s t-test (n = 2). Significant differences with normal were designated as *p < 0.05, **p < 0.01 and ***p < 0.001.
이상의 실험결과를 종합할 때, 인삼 (백삼)으로 부터 인지능 개선 효과 상승을 기대할 수 있는 추출물의 제조 조건으로는 NMDA 수용체에 대한 저해능이 우수한 60℃이하의 저온에 서, 총 진세노사이드 함량과 Rb1 + Rg1 함량이 높은 EtOH 을 사용한 1차 추출물과 아세틸콜린에스테라제 저해능에서 우 수한 활성을 보여준 70% 또는 50% EtOH 추출물 잔사에서 추출한 2차 (H2O) 추출물을 혼합하여 사용하는 방법이 적절 할 것으로 사료되었으며, 이러한 조합은 알츠하이머 질환치료 를 위해 NMDA 수용체 저해물질과 아세틸콜린에스테라제 저 해물질을 조합하는 최근의 경향 (Lopes et al., 2013)을 고려 하여도 타당한 것으로 사료되었다.
감사의 글
본 연구는 농촌진흥청 시험연구사업(사업번호: PJ00983501) 의 연구비 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Chen, HSV, Pellegrini, JW, Aggarwal, SK, Lei, SZ, Warach, S, Jensen, FE, Lipton, SA, Open-channel block of N-methyl-Daspartate( NMDA) responses by memantine Therapeutic advantage against NMDA receptor-mediated neurotoxicity, Journal of Neuroscience, (1992), 12, p4427-4436.
[https://doi.org/10.1523/jneurosci.12-11-04427.1992]

- Choi, CS, Kim, KI, Hong, HD, Choi, SY, Lee, YC, Kim, KT, Rho, JH, Kim, SS, Kim, YC, Phenolic acid composition and antioxidative activity of white ginseng(Panax ginsengC A Meyer), Journal of Ginseng Research, (2006), 30, p22-30.
- Giacobini, E, Cholinergic function and Alzheimer’s disease, International Journal of Geriatric Psychiatry, (2003), 18, pS1-S5.
-
Greig, NH, Utsuki, T, Ingram, DK, Wang, Y, Pepeu, G, Scali, C, Yu, QS, Mamczarz, J, Hollyoway, HW, Giordano, T, Chen, D, Furukawa, K, Sambamurti, K, Brossi, A, Lahiri, DK, Selective butyrylcholinesterase inhibition elevates brain acetylcholine, augments learning and lowers Alzheimer ß- amyloid peptide in rodent, Proceedings of the National Academy of Sciences of the United States of America, (2005), 102, p17213-17218.
[https://doi.org/10.1073/pnas.0508575102]

- Hyun, MS, Hur, JM, Shin, YS, Song, BJ, Mun, YJ, Woo, WH, Comparison study of white ginseng, red ginseng, and fermented red ginseng on the protective effect of LPS-induced inflammation in RAW 2647, Journal of Applied Biological Chemistry, (2009), 52, p21-27.
- Jeon, BH, Seong, GS, Chun, SG, Sung, JH, Chang, CC, Antioxidative effects of white ginseng and red ginseng on liver of high fat diet-treated mice, Journal of Ginseng Research, (2005), 29, p138-144.
- Jung, NP, Song, SO, Choi, SU, Cytotoxicity of white and red ginseng against cancer cells and their effects on the cell cycle, Journal of Ginseng Research, (2000), 24, p183-187.
-
Kennedy, DO, Scholey, AB, Wesnes, KA, Modulation of cognition and mood following administration of single doses of Ginkgo biloba, ginseng, and a ginkgo/ginseng combination to healthy young adults, Physiology and Behavior, (2002), 75, p739-751.
[https://doi.org/10.1016/s0031-9384(02)00665-0]

- Kim, DH, Xu, YH, Kim, YC, Bang, KH, Kim, JU, Cha, SW, He, ZM, He, Y, Jang, IB, Zhang, LX, Clinical study on food safety evaluation ofPanax ginseng, Korean Journal of Medicinal Crop Science, (2015a), 23, p185-189.
-
Kim, S, Ahn, K, Oh, TH, Nah, SY, Rhim, H, Inhibitory effect of ginsenosides on NMDA receptor-mediated signals in rat hippocampal neurons, Biochemical and Biophysical Research Communications, (2002), 296, p247-254.
[https://doi.org/10.1016/s0006-291x(02)00870-7]

- Kim, SM, Jeon, YJ, Sim, HJ, Lee, YE, Protective effect of fresh ginseng Kkakdugi against LPS-induced inflammation in RAW 264.7 macrophages, Journal of the Korean Society of Food Culture, (2015b), 30, p197-205.
- Kim, US, Koh, HK, Kang, SK, Study of the effects of different products of ginseng radix aqua-acupuncture on the alloxan-induced diabetic rats, The Acupuncture, (1989), 6, p1-13.
- Kim, YC, Kim, SR, Markelonis, GJ, Oh, TH, Ginsenoside Rb1 and Rg3 protect cultured rat cortical cells from glutamate-induced neurodegeneration, Journnal of Neuroscience Research, (1998), 53, p426-432.
- Kim, YO, Effects of ginseng radix on the ischemia-induced 4-vessel occlusion and cognitive impairments in the rat, Journal of Ginseng Research, (2007), 31, p44-50.
-
Lee, E, Kim, S, Chung, KC, Choo, MK, Kim, DH, Nam, G, Rhim, H, 20(S)-ginsenoside Rh2, a newly identified active ingredient of ginseng, inhibits NMDA receptors in cultured rat hippocampal neurons, European Journal of Pharmacology, (2006), 536, p69-77.
[https://doi.org/10.1016/j.ejphar.2006.02.038]

- Lee, MR, Sun, BS, Gu, LJ, Wang, CY, Mo, EK, Yang, SA, Ly, SY, Sung, CK, Effect of white ginseng and red ginseng extract on learning performance and acetylcholinesterase activity inhibition, Journal of Ginseng Research, (2008), 32, p341-346.
- Lee, SE, Shim, IS, Kim, GS, Yim, SV, Park, HJ, Shim, HS, Ye, MS, Kim, SY, The neuroprotective effect of white ginseng(Panax ginsengC A Meyer) on the trimetyltin(TMT)- induced memory deficit rats, Korean Journal of Medicinal Crop Science, (2011), 19, p456-463.
-
Lim, JH, Wen, TC, Matsuda, S, Tanaka, J, Maeda, N, Peng, H, Aburaya, J, Ishihara, K, Sakanaka, M, Protection of ischemic hippocampal neurons by ginsenoside Rb1, a main ingredient of ginseng root, Neuroscience Research, (1997), 28, p191-200.
[https://doi.org/10.1016/s0168-0102(97)00041-2]

-
Lopes, JP, Tarozzo, G, Reggiani, A, Piomelli, D, Cavalli, A, Galantamine potentiates the neuroprotective effect of memantine against NMDA-induced excitotoxicity, Brain and Behavior, (2013), 3, p67-74.
[https://doi.org/10.1002/brb3.118]

-
Mook-Jung, I, Hong, HS, Boo, JH, Lee, KH, Yun, SH, Cheong, MY, Joo, I, Huh, K, Jung, MW, Ginsenoside Rb1 and Rg1 improve spartial learning and increase hippocampal synaptophysin level in mice, Journal of Neuroscience Research, (2001), 63, p509-515.
[https://doi.org/10.1002/jnr.1045]

-
Perry, EK, Perry, RH, Blessed, G, Tomlinson, BE, Changes in brain cholinesterases in senile dementia of Alzheimer type, Neuropathology and Applied Neurobiology, (1978), 4, p273-277.
[https://doi.org/10.1111/j.1365-2990.1978.tb00545.x]

-
Radad, K, Gille, G, Moldzio, R, Saito, H, Rausch, WD, Ginsenosides Rb1 and Rg1 effects on mesencephalic dopaminergic cells stressed with glutamate, Brain Research, (2004), 1021, p41-53.
[https://doi.org/10.1016/j.brainres.2004.06.030]

-
Reay, JL, Scholey, AB, Kennedy, DO, Panax ginseng(G115):improves aspects of working memory performance and subjective ratings of calmness in healthy young adults, Human Psychopharmacology Clinical and Experimental, (2010), 25, p462-471.
[https://doi.org/10.1002/hup.1138]

- Seong, GS, Chun, SG, Chang, CC, Hepatoprotective effects of white and red ginseng extracts on acetaminopheninduced hepatotoxicity in mice, Journal of Ginseng Research, (2005), 29, p131-137.
- Shin, JY, Choi, EH, Wee, JJ, The differnce of ginsenoside compositions according to the conditions of extraction and fractionation of crude ginseng saponins, Korean Journal of Food Science and Technology, (2001), 33, p282-287.
- Sung, JH, Choi, DH, Kim, DH, Chun, BG, Choi, SH, White ginseng saponin upregulated the production of TNF-α, IL-1β, and NO in primary cultures of mixed glial cells, Journal of Ginseng Research, (2004), 28, p120-126.
