
황기 지상부 다당체의 면역 및 백신보조 효과
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
In recent years, adjuvants have received increasing attention owing to the development of purified subunit and synthetic vaccines which are poor immunogens and require additional adjuvants to evoke an immune response. Therefore, immunologic adjuvants have been developed and tested. Plant polysaccharides have been recognized as effective biological response modifiers with low toxicity.
In this study, the polysaccharide from the aboveground part of Astragalus membranaceus Bunge containing immunomodulating arabino-3,6-galactan was evaluated for its hemolytic activity and adjuvant potential in the specific cellular and humoral immune responses to ovalbumin. The polysaccharide from the aboveground part of Astragalus membranaceus Bunge was co-immunized with the purified Vi capsular polysaccharide of Salmonella typhi vaccine in mice. The polysaccharide from the aboveground part of Astragalus membranaceus Bunge did not induce any hemolytic activity or side effects at doses up to 500㎍/㎖. The concanavalin A-, lipopolysaccharide-, and ovalbumin-induced splenocyte proliferation and serum ovalbumin-specific IgG, IgG1 and IgG2b antibody titers in immunized mice were significantly enhanced by AMA. Pharmacological data revealed that the polysaccharide from the aboveground part of Astragalus membranaceus Bunge increased antigen-specific antibody levels in immunized mice. The polysaccharide from the aboveground part of Astragalus membranaceus Bunge-adjuvanted purified Vi capsular polysaccharide of Salmonella typhi vaccine improved the proliferation of splenocytes and macrophages as well as stimulated cytokine production.
These results suggest that the polysaccharide from the aboveground part of Astragalus membranaceus Bunge-adjuvanted vaccines enhanced humoral and cellular immunity and that the polysaccharide from the aboveground part of Astragalus membranaceus Bunge is a safe and efficacious adjuvant candidate suitable for use in prophylactic and therapeutic vaccines.
Keywords:
Astragalus membranaceus Bunge, Aboveground, Polysaccharide, Vaccine, Adjuvant서 언
백신화 기술 (vaccination)은 감염성 질환에 대하여 효과적 이고 가치 있는 기술이며 병원균 노출에 대한 예방차원의 기 술로 적용될 수 있다. 백신은 살아있지만 감염이 일어나지 않 도록 조정된 병원균이나 불활성하거나 사멸시킨 병원균, 또는 불활성화된 독소 등을 면역반응을 활성화 시킬 수 있는 항원 으로 사용하고 있고 (Sohn et al., 2004) 이러한 백신은 보조 제를 병용투여함으로서 백신 항원의 면역반응을 향상시키거나 가속화하고 장기간 유지시켜주어 성공적인 면역반응을 유도할 수 있다 (Storni et al., 2005). 백신보조제 (adjuvant) 개발 요 건은 백신 접종 시 보조제를 혼합 처리함에 따라 역반응의 위 험과 균형을 유지하여야 하며 항원, 백신 투여 대상종, 조절경 로, 부작용의 가능성을 제고하고 체류기간이 길고 안정하며 생 체분해가 가능하도록 하여야 하고 생산단가가 저렴하며 스스 로 면역반응을 최소화 하거나 유도하지 않고 면역반응을 촉진 해야 한다 (Edelman, 1980).
수많은 백신보조제가 발견되어 실험적으로 사용되었으나 거 의 대부분의 소재가 단지 항체반응만을 촉진시키는 효과만이 존재하거나 독성과 부작용을 나타내어 실제 임상에는 사용하 지 못하고 있다 (Aucouturier et al., 2001). 백신보조제 중 Freund's complete adjuvant는 가장 강력한 잠재적 백신 보조 효과를 가지고 있으며 세포성 면역과 체액성 면역 모두에서 지속적으로 면역반응을 유도하는 것으로 알려져 있으나 (Freund et al., 1937) 인간에게 사용하기에는 지나치게 높은 독성과 부작용을 나타낸다. 현재 면역보조제로 사용되어지고 있는 Quillaja saponaria의 껍질 물추출액 QuiA와 여기에서 순수하게 분리된 사포닌인 QS-21은 IL-2와 IFN-γ를 유도하고 IgG2a 아형의 항체 생성을 유도하며, 강력한 세포독성 T세포 (cytolytic T lymphocyte, CTL) 유도능을 지님으로써 HIV-1, cytomegalovirus와 Toxoplasma gondii의 공식적인 백신 보조 제로 사용되어지고 있다 (Kensil and Kammer, 1998; Skene and Sutton, 2006). 하지만 QS-21을 함유하는 백신을 접종받 은 대상자들에게 주사부위의 통증과 연화효과가 단기간 일어 나며 바람직하지 않은 hemolytic effect가 나타남에 따라 HIV virus와 암과 같은 생명을 위협하는 질병 이외에 인간을 대상 으로 하는 백신보조제의 사용이 제한되고 있다 (Janeway, 1992). 미국 FDA에 의해 유일하게 인간의 백신보조제로 허가 되어 있는 알루미늄염은 주로 Al(OH)3 또는 AlPO4 형태로 사용되는데 일반적으로 단백질 항원을 흡착하여 천천히 방출 함으로서 면역증강효과를 나타내는 것으로 생각되나 알러지 반응을 유발하고 신경독성도 있는 것으로 추정되고 있으며 또 한 항체가 매개된 체액성 면역반응은 강하게 유도하나 세포성 면역반응은 거의 유도하지 못하며 (HogenEsch, 2002), 세포독 성 T세포 (cytolytic T lymphocyte, CTL)의 분화와 활성을 오히려 저해하고 접종 부위에 강한 염증반응을 유도하는 단점 이 있다 (Schirmbeck et al., 1994).
천연에서 유래한 다당체는 면역시스템에 영향을 미치는 거 대분자로서 면역조절제로서의 잠재성을 가지고 있어 광범위한 임상적 적용이 이루어지고 있다. 식물에 존재하는 대부분의 다 당체들은 독성이 낮고 면역조절 능력이 있는 다른 박테리아의 다당체나 합성물질들이 나타내는 심각한 부작용을 일으키지 않을 뿐 아니라 신체의 항상성 (homeostasis)을 유지시키고 면 역계 내 분비계, 신경계 및 순환계에 조절 역할을 담당하는 biological response modifier (BRM)로서 작용할 수 있다 (Schepetkin and Quinn, 2006).
최근 많은 연구에서 자연계에 존재하는 다당체가 세포성 면 역과 체액성 면역 모두에서 항원과 백신에 대한 면역보조효과 를 나타내어 백신에 대한 보조제의 선택에 있어 기존의 알루 미늄염을 대체할 수 있는 소재가 될 수 있음이 확인되고 있다 (Kong et al., 2004; da Silva et al., 2009). 특히 식물에 포 함되어진 다당류는 백신보조제로서 세포성 면역 뿐만 아니라 체액성 면역을 안전하게 유도할 수 있으며 내약성 및 제조의 용이성이 확보되어 있고 비교적 저가의 재료로부터 공급 가능 하여 암과 감염균에 대한 백신에 광범위하게 사용이 가능하다 는 장점을 가지고 있다 (Petrovsky, 2006).
황기 (Astragalus membranaceus Bunge)는 콩과에 속하는 다년생 초본으로 뿌리를 생약으로 이용하고 있으며 이들의 약 리적 활성 성분은 saponin과 polysaccharide인 것으로 알려져 있다. 이들의 뿌리에는 면역조절 활성을 가진 astragalosides I- Ⅴ, isoastragalosides I-V 및 soyasaponin과 같은 많은 양의 triterpene saponin이 포함되어져 있는 것으로 보고되고 있으며 (Yesilada et al., 2005) 이들 황기에 포함되어진 사포닌이 mice에서 ovalbumin에 유도되는 IgG1과 IgG2b 면역반응을 상승시키는 백신보조효과를 확인하였고 (Yang et al., 2005) 닭에서 뉴캐슬병 (newcastle disease) 백신의 항체반응을 향상 시키는 것이 보고된 바 있다 (Kong et al., 2004). 또한 Yoshida 등 (1997)은 황기의 물 추출물이 C3H/HeN mice의 대식세포에서 IL-6와 TNF 생산을 증가시킨다고 보고하였으며 Sun 등 (1996)은 황기에 포함되어진 사포닌이 ConA로 활성화 된 T lymphocytes에서 Ca2+이 양이 증가시킬 수 있다고 보고 함으로써 황기 지하부의 성분이 면역세포 활성화에 필요한 cytokine 생산을 촉진 시킬 수 있는 것을 확인하였다.
황기 지하부로부터 분리되어진 polysaccharide는 astragalactan 으로 macrophage의 기능 활성화 (Lee and Jeon, 2005), tumor necrosis factor의 생산, lymphokine activated killer를 유도에 의 한 항암활성 (Cho and Leung, 2007a), 면역조절 및 면역력 회복에 대한 효과를 나타내며 분리되어진 F3 fraction이 면역 조절효과에 효능을 나타냄을 보고하였다 (Cho and Leung, 2007b).
전통적으로 약용으로 사용되어온 황기의 지하부 뿐만 아니 라 지상부에도 약리적 효능이 있는 것이 입증되고 있는데 면 역 활성이 감소한 mice에서 황기 지상부에 포함되어진 플라보 노이드 성분이 LAK (lymphokine activated killer) 세포의 활 성을 증대시키고 T cell을 활성화하여 면역능을 증가시킨다고 하였으며 (Jiao et al., 1999). 또한 황기의 지상부에는 지하부 보다 flavonoid가 더 높은 수준으로 나타난다고 보고되고 있다 (Kim et al., 2012).F1
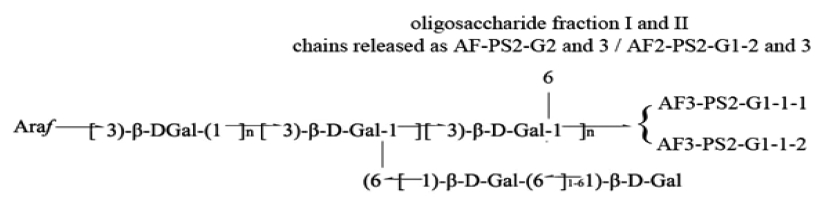
Polysaccharide fraction purified from the aboveground parts of Astragalus membranaceus (AMA) containing gut mucosal immune active arabino 3,6-galactans molecule, AMA-1-b-PS2 (Lim et al., 2016).
또한 본 연구팀의 기존 연구에서 황기 지상부 다당체 (AMA) 처리에 의한 장관 Peyer’s patch를 매개로 하는 골수 세포 증식 유도 뿐만 아니라 이들이 분비하는 cytokine이 전 신면역계의 활성화를 유도한다는 것과 (Choi et al., 2014) 황 기 지상부 다당체에서 분리한 장관면역 활성 다당체 AMA-1- b-PS2가 345,000 Da의 분자량을 가지며 3-linked galactose 구조와 3,6 branch galactose의 당쇄구조가 교호적으로 존재 하며 galactose가 풍부한 oligosaccharide가 연결되어 있는 arabino-3,6-galactan 임을 인지한 바 있다 (Lim et al., 2016).
최근 백신의 용도 및 활용이 감염성 질환에만 제한적으로 사용되는 것이 아니라 암과 자가면역질환과 같은 난치성 질환 으로 넓혀지고 있어 백신 개발의 중요성이 높아지고 있고 이 에 따라 adjuvant의 개발에 대한 필요성도 높아지고 있다. 따 라서 본 연구에서 면역증가효과 높고 면역조절제로 반응이 높 은 황기 지상부 다당체가 면역조절제 및 백신보조효과를 나타 낼 수 있을 것으로 예측되어 ovalumin에 의해서 면역유도된 ICR mice에서 황기의 지상부의 열수 추출물로부터 분리한 다 당체 분획의 면역보조효과를 검정하고 ICR mice를 대상으로 장티프스에 대한 typhoid vaccine (purified Vi capsular polysaccharide of Salmonella typhi)을 적용하고 황기 지상부 다당체를 병용 처리함으로써 백신보조효과를 검정하였다.
재료 및 방법
1. 실험동물
6주령의 암컷 ICR 생쥐를 대한 바이오 링크 (Daehan Biolink Co., Ltd., Eumseong, Korea)에서 2013년 6월 4일에 입수하여 SPF 실험동물실내 사육실에서 온도 23 ± 3℃, 상대 습도 50 ± 20%를 유지하여 자동 명암 사이클 시스템에서 사 육하며 실험에 사용하였다. 동물실험은 실험동물 관리규정을 준수하였으며 대구가톨릭대학교 동물실험윤리위원회의 승인을 받아 진행하였다 (승인번호: 13-CRO-001).
2. 시약
3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), Griess reagent, RBC lysing buffer, concanavalin A (ConA), lipopolysaccharide (LPS), RPMI1640 배지, Hank’s balanced salt solution (HBSS), rabbit anti-mouse IgG peroxidase conjugate는 시그마사 (Sigma-Aldrich Co., St. Louis, MO, USA)에서 구입하여 사용하였으며 goat antimouse IgG1, IgG2a, IgG2b peroxidase conjugate는 Southern Biotechnology Associates사 (Birmingham, AL, USA)에서, cytokine (IL-4, IFN-γ, TNF-α, total IgG) detecting ELISA kits는 R&D Systems (Minneapolis, MN, USA)에서 구입하여 사용하였고 fetal bovine serum (FBS), phophate buffer salin (PBS), penicillin, streptomycin, Dulbecco’s modified Eagle's medium (DMEM)은 Gibco BRL사 (Grand Island, NY, USA)에서 구입하여 사용하였다. QuilA (Superfos Biosector, Vedbaek, Denmark), alhydrogel adjuvant 2% (Alum, InvivoGen, San Diego, CA, USA)를 백신보조 활성 대조구 로 상용 장티프스 예방백신인 typhoid vaccine (purified Vi capsular polysaccharide of Salmonella typhi, Zerotyph inj., Boryung biopharma Co., Ltd., Seoul, Korea)을 사용하여 백 신보조효과를 검정하였다.
3. 황기 지상부로부터 다당체의 제조
황기 (Astragalus membranaceus Bunge) 지상부는 정선군 농업기술센터 포장에 재배되어 있는 3 년생 막협황기의 지상 부를 채취 하여 사용하였으며 (2012. 7. 23) 다당체를 얻기 위하여 지상부 1㎏에 대해 20배 부피의 증류수를 첨가하여 2회 가열 추출하고 추출액을 합하여 여과 및 감압농축하고 농 축된 양의 5배의 에탄올을 첨가하여 침전시키고 남은 침전물 을 대상으로 4℃에서 30분간 7,000 rpm으로 원심 분리하여 상 층액과 잔사로 분리하였다. 잔사를 다시 동결 건조하여 다당 체 분획을 획득하였다 (AMA, 19.42 g, 수율; 1.942%).
황기 지상부 다당체에는 QAE-Sepharose FF (HCO3, Pharmacia, Uppsala, Sweden) column에 ammonium bicarbonate (NH4HCO3) 용액을 농도별로 용출시켜 얻은 획분과 이 획분 을 다시 Sephacryl S-200 (1.7 × 82㎝, Pharmacia, Uppsala, Sweden)에서 gel filtration chromatography를 행하여 얻은 장관 면역 활성 다당체 AMA-1-b-PS2가 0.13% 수준으로 포함되어 져 있으며 (Choi et al., 2014) AMA-1-b-PS2는 arabino-3,6- galactan과 oligosaccharide가 복합적으로 구성된 다당체로 확 인되었다 (Lim et al., 2016).
4. 황기 지상부 다당체의 hemolytic activity 측정
황기 지상부 다당체의 hemolytic activity 측정은 토끼 (Newzealand rabbit, Daehan Biolink Co., Ltd., Eumseong, Korea)으로부터 BD VacutainerTM (NH 143 I. U., Belliver Industrial Estate, Plymouth, England)를 이용하여 혈액을 채 취하여 사용하였다. 혈액 7㎖을 saline solution (0.89% w/v NaCl, pyrogen free)으로 세척하고 원심분리 (180 × g, 5 min) 하여 saline solution이 0.5%가 되도록 cell suspension pellet 을 제조하고 cell suspension pellet 0.5 ㎖에 황기 지상부 다 당체 solution 각 0.5㎖ (5, 10, 25, 50, 100, 250, 500, 1,000㎍/㎖)를 첨가하고 37℃에서 30분간 반응 한 후 다시 원심 분리 (70 × g, 10 min)하고 상층액을 취하여 free hemoglobulin 의 양을 UV-VIS spectrophotometer (412㎚, UV-1650, Shimadzu, Kyoto, Japan)를 이용하여 검정하였다. 대조구로 saline solution은 최소 hemolytic control로 사용하고 멸균수를 최대 hemolytic control로 사용하여 saline control에 대한 각 처리구의 hemolytic 비율을 계산하였다.
5. 황기 지상부 다당체의 면역증강 활성 검정
면역반응 유도는 6주령의 ICR mice를 8군으로 나누고 각 군은 5마리로 구성하였다. 각 군은 OVA (ovalbumin) 100㎍/㎖ 단독, OVA 100㎍/㎖ + aluminum hydroxide gel (Alum, 200㎍), OVA 100㎍/㎖ + QuilA (10, 20㎍), 100㎍/㎖의 OVA과 황기 지상부 다당체 solution (50, 100, 200㎍/㎖)의 병용처리로 나누어 실험시작 1일차와 15일차에 2회 면역반응을 유도하였다. Saline 만을 단독 처리한 실험동 물을 대조구로 사용하였으며 각 처리구에서 면역반응 유도는 2주 후에 발현하였고 2주 후에 splenocyte proliferation 및 ovalbumin 특히 항체를 측정하였다.
각 처리군에서의 면역 유도된 mice를 대상으로 splenocyte proliferation 측정은 무균상태에서 HBSS를 첨가하여 면역유도 된 mice의 비장을 적출하고 steel mesh를 통과시켜 균질화된 세포 suspension을 얻었고 여기에 다시 ammonium chloride (0.8%, w/v)를 처리하여 erythrocyte를 분해시켰다. 얻어진 세포 부유물을 원심분리 (380 × g, 4℃, 10 min)하였고 형성된 pellet 을 PBS로 3회 세척하고 complete medium {RPMI1640 배지 에 12 mM HEPES (pH 7.1), 0.05 mM 2-mercaptoethanol, 100 IU/㎖ penicillin, 100 g/㎖ streptomycin, 10% FBS}에 재 현탁하였다.
세포 수 검정은 trypan blue dye exclusion법을 이용하여 hemocytometer로 측정하였고 splenocyte proliferation 측정은 splenocyte를 96 well flat bottom microtiter plate의 4 - 5 개의 well에 초기배양하고 다시 100㎕ complete medium에서 세포수 가 5 × 106 cell/well까지 배양하였다. ConA (final concentration 5㎍/㎖), LPS (final concentration 10㎍/㎖), OVA (final concentration 10㎍/㎖)를 배지에 첨가하여 최종 부피가 200㎕ 가 되도록 조정하였다. Plate를 다시 37℃에서 5% CO2 조건으 로 배양하고 68시간 후에 50㎕의 MTT solution을 (2㎎/㎖) 각각의 well에 첨가하여 처리하고 다시 각 well에 200㎕의 DMSO working solution (192㎕ DMSO + 8㎕ 1 N HCl) 를 첨가하고 ELISA reader (VICTORTMX3, PerkinElmer, Waltham, MA, USA)를 이용하여 570㎚에서 흡광도를 측정하 였고 얻어진 흡광도를 이용하여 stimulation idex (SI)를 산출 하였다.
OVA-specific serum antibody response 검정 (IgG, IgG1, IgG2b antibody levels)은 혈액에서의 rabbit anti-mouse IgG peroxidase conjugate와 goat anti-mouse IgG1 and IgG2b peroxidase conjugate를 이용하고 간접적 ELISA 분석을 수행 하여 검정하였다.
Well에 100㎕의 OVA solution (50㎍/㎖ IgG, 25㎍/㎖ IgG1, 50㎍/㎖ IgG2b antibodies, 50mM carbonate-bicarbonate buffer, pH 9.6)이 코팅된 microtiter plate를 4℃에서 24시간 보관한 후 각 well을 0.05% (v/v) Tween 20이 첨가된 PBS 로 3회 세척하고 5% FBS/PBS로 이용하여 37℃에서 1시간 동안 blocking 시켰다. 세척 후에 100㎕의 희석된 serum sample 또는 control에 0.5% FBS/PBS를 well에 첨가한 후 plate를 다시 37℃에서 1시간 동안 배양하고 다시 3회 세척하 였다. IgG, IgG1 및 IgG2b에 대한 horseradish peroxidaseconjugated antibody를 well에 첨가하고 37℃에서 1시간 동안 배양하고 세척 후에 peroxidase activity를 측정하였다.
Peroxidase activity는 100㎕의 substrate solution (25㎖ 의 0.1M citrate-phosphate buffer, pH 5.0에 10㎎ Ophenylenediamine과 37.5㎕의 30% H2O2를 첨가)을 각 well 첨가하고 plate를 다시 37℃에서 10분간 배양하고 다시 각 well 당 2 N H2SO4를 50㎕를 첨가하여 반응을 종료한 후 ELISA reader (VICTORTMX3, PerkinElmer, Waltham, MA, USA)를 이용하여 490㎚에서 흡광도를 측정하여 산출하였다.
6. 황기 지상부 다당체의 백신 보조재화 (adjuvant) 활성 검정
장티프스에 대한 typhoid vaccine (purified Vi capsular polysaccharide of Salmonella typhi)은 균 전체가 아닌 항체 형성에 관여하는 Vi 항원만을 고순도로 정제하여 제조한 polysaccharide 백신으로 부작용이 적고 단 1회의 접종으로 항 체가 신속히 생성되며 항체가 장기적으로 지속되는 장티프스 예방백신이다.
동물모델을 이용하여 황기 지상부 다당체를 백신과 병용 처 리하여 면역반응을 유도하고 황기 지상부 다당체의 백신보조 효능을 평가하였다. 6주령의 암컷 ICR 생쥐를 1주일간 순화 시킨 다음 모두 6개의 군으로 나누어 PBS만 투여한 정상대조 군 (saline), 백신만 단독으로 투여한 대조군 (Vac), 백신과 3 단계의 농도로 황기 지상부 다당체를 함께 투여 한 군 (Vac + AMA) 및 백신과 백신보조제 양성대조물질 aluminium hydroxide gel을 함께 투여한 군 (Vac + Alum)으로 분리하여 실험에 사용하였다.
백신은 마우스 한 마리당 5㎍으로, 황기 지상부 다당체는 마우스 당 각각 50, 100, 200㎍, Alum은 200㎍을 1일 (첫 번째 주입), 15일 (두번째 주입)에 2회 복강 투여하여 항체 생 성을 유도하였으며 대조군은 동일량의 PBS를 투여하였다. 첫 번째 주입 이후 15일간 적응기간을 거친 후 booster 효과를 위하여 동량을 주입하였다. 두 번째 주입 2주 후에 마우스의 복대정맥에서 혈액 약 3㎖를 채취하여 SST튜브에 넣어 15 분간 원심 분리하여 혈청을 얻은 뒤 −70℃에 보관하면서 시 료로 사용하였다.
백신과 황기 지상부 다당체의 병용처리를 통해 면역반응이 유도된 mice를 희생하여 비장세포를 분리하고 RBC lysing buffer로 적혈구를 제거 하였다. LPS나 ConA를 처리하지 않고 complete medium 만 첨가한 무처리 (RPMI1640)와 ConA (final concentration 5㎍/㎖) 및 LPS (final concentration 10㎍/㎖)를 처리하여 비장세포 증식을 유도하였다. 비장세포의 배양 및 처리 증식률 검정은 황기 지상부 다당체의 면역증강 활성 검정에서와 동일한 방법으로 진행하였으며 각 처리구마 다 MTT assay 이후 ELISA reader를 이용하여 570㎚에서 흡광도를 측정한 결과를 비교하였다.
면역반응이 유도된 마우스로부터 분리한 splenocyte (5 × 106 cell/well)를 ConA (4㎍/㎖)가 첨가된 24 well plate 에서 5% CO2, 37℃로 배양하고 48시간 후에 원심분리 (1,000 × g, 10 min)하고 상층액을 대상으로 ELISA kit를 이용 하여 IFN-γ 및 IL-4의 수준을 측정하였다.
2회 (1일과 15일) 복강 투여하여 항체 생성을 유도한 마우스 를 대상으로 혈액을 채취하였고 혈액에서의 antigen specific IgG antibody response 검정은 enzyme linked immunosorbent assay (ELISA)를 이용하였다.
Well 당 0.2㎍ (2.0㎍/㎖, 0.1㎖/well in 50mM carbonatebicarbonate buffer, pH 9.6)의 antigen이 코팅되어 있는 microtiter plate를 4℃에서 24시간 보관한 후 각 well을 0.1% (v/v) Tween 20이 첨가된 PBS로 3회 세척하고 5% FBS/ PBS로 이용하여 37℃에서 1시간 동안 blocking 시켰다. 세척 후에 5% FBS/PBS 100㎕로 희석된 혈액시료를 well에 첨가 한 후 plate를 다시 37℃에서 1시간 동안 배양한 후 다시 3 회 세척하였다. 1/1000로 희석된 peroxidase conjugate와 goat anti-mouse IgG 100㎕를 첨가하고 1시간 후에 각 well 당 100㎕의 tetramethyl benzidine (TMB) substrate solution (0.2㎎/㎖ TMB, 50㎕ 30% H2O2, 10㎖ 0.1㏖/ℓ citrate, 0.2㏖/ℓ phosphate buffer, pH = 5.2)을 첨가하고 다시 상온 에서 약 10분간 배양하고 50㎕ 2㏖/ℓ의 H2SO4를 첨가하여 반응을 종결하였다. 흡광도 (optical density)를 ELISA reader (VICTORTMX3, PerkinElmer, Waltham, MA, USA)를 이용하 여 450㎚에서 측정하였다.
7. 황기 지상부 다당체 처리가 대식세포 증식, nitric oxide 및 TNF-α 생산에 미치는 영향
Murine macrophage cell (RAW 264.7)에 대한 황기 지상 부 다당체를 처리하고 MTT assay를 실시하여 세포 활성화 정도를 비교하고 cytokinine인 TNF-α 생산에 미치는 영향을 조사하였다. 대식세포는 mouse macrophage 종류의 배양세포 RAW 264.7세포를 사용하였으며, 2 - 3일 마다 계대를 실시하 였으며 5% dimethylsulfoxide (DMSO)를 혼합한 배양액에 희 석 시킨 세포를 동용 바이알에 넣어 액체질소에 보관하였다. 배양은 RAW 264.7 세포를 10% FBS, 100 U/㎖ penicillin, 100㎍/㎖ streptomycin를 함유하는 DMEM에서 5% CO2, 37℃로 배양하였다.
세포 증식률 측정은 RAW 264.7 세포를 96 well plate에서 각각 2 × 105 cells/well로 분주하고 황기 지상부 다당체를 다양 한 농도 (50, 100, 200㎍/㎖)로 saline으로 희석하여 첨가 하 고 5% CO2, 37℃로 배양하였다. 시험물질 처리 24시간 이후 MTT assay를 실시하여 570㎚에서 흡광도를 측정하여 대식 세포 증식률을 검정하였으며 배양한 상층액은 수집하여 Griess reagent로 nitric oxide의 양을 측정하였고 TNF-α의 농도를 ELISA법으로 측정하였다.
8. 통계처리
모든 실험결과들은 평균치 ±표준편차 (means ± SD)로 나타 내었으며 각 실험군 간의 통계학적 분석은 statistical analysis system (SAS v9.2, SAS Institute Inc., Cary, NC, USA)을 이용하여 One-way analysis of variance (ANOVA)와 Student's t-test를 실시한 후 유의성을 p < 0.05, p < 0.01, p < 0.001의 수준에서 각각 검증하였다.
결과 및 고찰
1. 황기 지상부 다당체의 hemolytic acitivity 측정 (독성 검정)
토끼 적혈구 세포에 대한 황기 (Astragalus membranaceus Bunge) 지상부의 다당체 (AMA)의 hemolytic activity를 측정 한 결과, 농도 500㎍/㎖ 처리에서 약 0.01%의 활성을 나타내 었고 그 이하의 농도 (2.5 - 250㎍/㎖)에서는 hemolytic activity를 나타내지 않았다 (Table 1). 반면 동일한 조건에서 일 반적으로 백신 보조제로 사용하고 있는 QuilA의 경우 HD50의 값이 약 18.56 ± 0.26㎍/㎖로 나타나 높은 hemolytic activity 를 나타내었다 (자료 미제시).
황기 지상부 다당체의 독성을 검정하기 위해 생후 5주령의 C3H/He의 암컷 마우스를 대상으로 1주 1회 2주까지 5,000㎎/㎏/day농도로 복강 내 강제 경구투여 한 후 14일 동 안 관찰한 결과 실험기간 중 시험군에서 사망동물은 관찰되지 않았으며 황기 지상부 추출물 투여에 의한 독성증상과 특이적 임상소견도 나타나지 않았다 (자료 미제시). 이러한 결과는 황 기지상부로부터 분리된 장관면역 활성 다당체의 단회경구 투 여 독성시험 (Choi et al., 2014), 염색체 이상시험, 소핵시험, 미생물 복귀돌연변이 독성 시험 등의 유전독성 시험 (Park et al., 2014), 90일 반복경구투여 독성 시험에서 독성을 나타내지 않았다는 보고와 유사하였다 (Park et al., 2013).
분자생물학과 유전공학이 기술적으로 진보에 의해 면역원성 을 가진 항원에 대해 정확히 확인할 수 있다 하더라도 대부분 의 백신은 적절한 면역반응을 자극할 수 있는 보조제의 역할 을 필요로 하며 (Barr et al., 2006) 효과적인 백신보조제는 특정 항원에 대하여 체액성 면역 및 세포성 면역 반응을 상승 시킬 수 있어야 하면서도 고려하지 않아도 될 정도로 독성 영 향이 적어야 한다고 한다 (Marciani, 2003).
Quil21은 qullaic acid에 한 개의 분지형 trisaccharide와 한 개의 비분지형 tetrasaccharide가 부착되어 있고 dimer 형태의 fatty acyl group이 tetrasaccharide의 첫 번째 당에 ester 결합 을 하고 있는 형태이며 여기에 존재하는 fatty acids가 saponin 과 생체막의 cholesterol 사이의 반응성을 높이고 산화적 손상 을 유발하여 hemolysis를 일으켜 독성을 나타낸다고 보고하였 다 (Jacobsen et al., 1996).
반면 황기 지상부의 다당체는 백신보조제로 사용할 수 있을 정도의 낮은 hemolytic activity를 나타내었는데 이러한 것은 황기 지상부 다당체가 galactosyl residue와 arabinosyl residue 가 풍부하게 존재하는 arabinogalactan 계열의 다당체로 구성 되어 있다고 보고한 결과 (Choi et al., 2014)와 구두치 (Tinospora cordifolia)로부터 분리된 arabinogalactan이 쥐 (rat) 뇌조직에서 철을 매개로 하는 지질과산화에 대하여 생체 막을 보호할 수 있다고 보고 (Subramanian et al., 2002)한 결과를 통하여 황기 지상부 다당체 구조는 생체막에서 지질 과산화를 유발할 수 있는 치환기가 존재하지 않고 활성산소에 의한 생체막손상을 방어할 수 있어 독성이 없이 안정하게 사 용할 수 있는 백신보조제로 생각되어진다.
2. 황기 지상부 다당체의 면역증강 활성 검정
황기 지상부 다당체의 세포성 면역반응 (cellular immune respone) 여부를 평가하기 위해 OVA (ovalbumin)으로 면역 유 도된 mice를 대상으로 하여 mitogen (ConA; concanavalin A, LPS; lipopolysaccharide)과 OVA에 의해 자극되는 splenocyte의 증식에 영향을 미치는 황기 지상부 다당체의 효과를 검정한 결 과 OVA/AMA (50, 100㎍)로 면역 유도한 것과 OVA/QuilA (10, 20㎍)로 면역 유도한 이후 mitogen (ConA나 LPS)과 OVA에 의해 자극되어지는 splenocyte 증식 지수가 OVA 단독 으로 면역유도하고 mitogen과 OVA로 자극된 splenocyte 증식 지수보다 높게 나타났다 (Fig. 2).
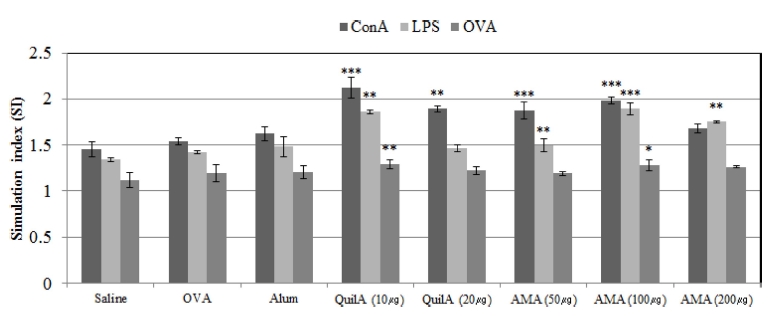
Effect of polysaccharides from aboveground parts of Astragalus membranaceus (AMA) on mitogen- and OVA-stimulated splenocyte proliferation in vivo.Groups of five male ICR mice were immunized with OVA 100㎍ alone or with OVA 100㎍ dissolved in saline containing Alum (200㎍), QuilA (10 and 20㎍) or AMA (10, 20, 50, 100 or 200㎍) on day 1 and 15. Splenocytes were prepared 2 weeks after the last immunization and cultured with ConA, LPS, or OVA or RPMI1640 for 72 h. Splenocyte proliferation was measured by the MTT method as described in the text, and shown as a stimulation index. Mean values ± SD from triplicate separated experiments are shown. Significant differences with OVA groups were designated as *p < 0.05, **p < 0.01 and ***p < 0.001.
OVA로 면역을 유도한 mice에서 OVA에 의해 자극되어지는 splenocyte의 증식은 황기 지상부 다당체 OVA/AMA 100㎍, OVA/QuilA 10㎍의 처리에서 명확하게 증가한 반면 OVA 단 독이나 OVA/Alum으로 면역 유도한 것에서는 명확한 차이를 관찰할 수 없었다 (Fig. 2). 이러한 결과를 통하여 황기 지상 부 다당체는 OVA로 면역 유도된 mice에서 잠재적으로 T세포 및 B세포의 활성을 명확히 증대시킬 수 있음을 확인하였다.
Mice에서 OVA에 대한 면역반응의 유도에 있어 황기 지상부 다당체의 체액성 면역반응 유도 (humoral immune response) 효과를 검정하기 위해 최종 면역반응 2주 후 혈청에서의 OVA specific IgG, IgG1, IgG2b 항체의 수준을 ELISA로 검정한 결 과 OVA로 면역 유도한 mice의 혈청에서의 IgG 및 IgG1 항 체 수준은 Alum, QuilA를 10㎍과 20㎍ 수준으로 처리하는 경우 증가하였고 황기 지상부 다당체를 100㎍과 200㎍를 처리하는 경우 대조군 (OVA 단독) 보다 높은 수준으로 증 가하였다. IgG 및 IgG1 발현 항체 수준이 Alum, QuilA (10㎍, 20㎍)를 처리한 경우와 황기 지상부 다당체 (100㎍, 200㎍)를 처리한 경우와 유사한 수준으로 발현되었으므로 황 기 지상부 다당체의 처리에 의해서도 Alum, QuilA의 처리에서 처럼 면역보조효과가 획득되어질 수 있음을 확인하였다 (Fig. 3).
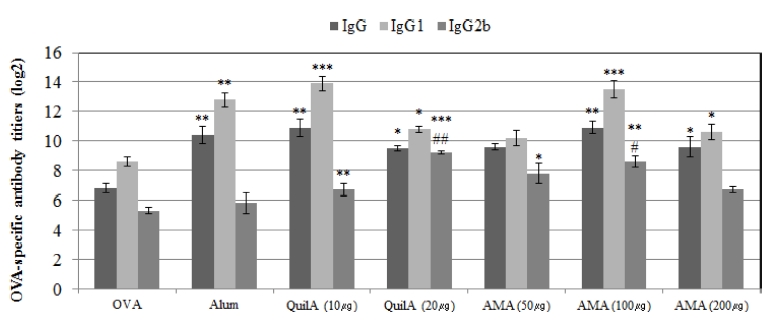
Effect of polysaccharides from aboveground parts of Astragalus membranaceus (AMA) on OVA-specific IgG, IgG1 and IgG2b antibody.Groups of five male ICR mice were immunized with OVA 100㎍ alone or with OVA 100㎍ dissolved in saline containing Alum (200㎍), QuilA (10 and 20㎍) or AMS (50, 100 or 200㎍) on day 1 and 15. Sera were collected 2 weeks after the last immunization. OVA-specific IgG, IgG1 and IgG2b antibodies in the sera were measured by an indirect ELISA as described in the text. Mean values ± SD from triplicate separated experiments are shown. Significant differences with OVA groups were designated as *p < 0.05, **p < 0.01 and ***p < 0.001; those with OVA/ Alum groups as #p < 0.05 and ##p < 0.01.
IgG2b 항체의 수준에서는 황기 지상부 다당체 (50㎍, 100㎍)나 QuilA로 면역 유도한 mice 처리군이 대조군 보다 높은 수준으로 검정되어지는 것을 확인하였으며 이러한 결과 는 Alum을 처리한 군보다 높은 수준을 나타내었다. 또한 IgG2b 항체의 수준은 황기 지상부 다당체 농도별 처리와 QuilA 처리 간에 차이가 없었고 Alum을 처리한 군과 OVA 단독처리군 사이에 큰 차이를 나타내지 않았다. 이러한 결과 를 통해 면역반응 유도에 있어 IgG 및 IgG1 발현 항체 수준 이 황기 지상부 다당체나 QuilA에 의해 증대되어질 수 있음 을 확인한 반면 Alum의 경우 항체 발현을 증가시키는 효과를 확인할 수 없었다 (Fig. 3).
이러한 결과를 통하여 황기 지상부 다당체는 OVA로 면역 반응이 유도된 mice에서 혈청의 항체 형성을 명확히 증가시킬 수 있는 면역 보조효과가 확인되었다. 그리하여 황기 지상부 다당체는 최적화된 농도에서 IgG1, IgG2b 항체의 수준 향상 과 깊이 연관되어져 있는 Th1 및 Th2 면역세포의 반응을 조 절할 수 있을 것으로 생각된다.
지난 수년 동안 수백 가지의 서로 다른 활성 소재들이 백신 보조제로서 조사되었지만 보조제로서의 효율성 부족, 국소적 이거나 전신성의 독성, 제조의 어려움, 불안정성, 비용 및 수 익성에 의해 실제 임상적으로 승인되거나 적용되지 못하였다 (Aguilar and Rodriguez, 2007).
이전 연구에서 쇠무릎 (Achyranthes bidentata) 뿌리, 북시호 (Bupleurum chinense), 감초 (Glycyrrhiza uralensis), 죽절 인삼 (Panax notoginseng), 돌외 (Gynostemma pentaphyllum), 도라 지 (Platycodon grandiflorum) 등 에서 분리된 사포닌이 마우스 에서 OVA에 대한 세포성 및 체액성 면역반응에 있어 잠재적 인 백신보조효과를 가지는 것으로 보고되었다 (Sun, 2006a, b; Sun and Pan, 2006; Sun et al., 2004; Xie et al., 2008; Sun and Zheng, 2005). 하지만 비록 이러한 사포닌이 hemolytic activity와 독성이 QuilA보다 낮다할지라도 대부분의 사포닌 성분은 여전히 어느 정도의 hemolytic activity를 나타 낸다. 사포닌은 주사와 같은 비경구적 투여를 하는 경우 높은 백신보조효과를 나타내나 경구 투여하는 경우에는 백신보조효 과가 약해지거나 사라지게 된다고 보고 하였는데 (Sun et al., 2009) 대부분 다당체는 비경구적 투여 또는 경구적 투여에 상 관없이 유사한 약리적 효과를 나타낸다.
본 연구를 통하여 황기 지상부 다당체는 비장세포의 증식과 항원 특이적 항체 생성을 증대 시킬 수 있는 것이 확인됨으로 써 세포성 면역 또는 체액성 면역반응을 향상시킬 수 있는 면 역보조제로의 활용이 가능할 것으로 생각된다.
3. 백신에 의해 면역 유도된 mice에서 황기 지상부 다당체 병용처리가 비장세포 증식에 미치는 효과
장티프스에 대한 예방백신 (purified Vi capsular polysaccharide of Salmonella typhi)과 기존 백신보조제인 Alum 또는 황기 지 상부 다당체를 농도별 (50, 100, 200㎍/mouse)를 복강주사로 병용처리하고 무처리 (RPMI1640) 및 ConA 또는 LPS를 처리 하여 비장세포 증식을 유도하고 증식률을 흡광도로 조사한 결 과 백신만 단독으로 투여한 대조군 (Vac)의 경우 RPMI, ConA, LPS 처리 모두에서 정상대조군 (saline) 보다 낮은 수 준으로 비장세포 증식율이 높아진 것을 확인하였다. 또한 백 신과 황기 지상부 다당체를 농도별로 함께 투여한 군 (Vac + AMA)의 경우 비장세포의 증식률을 농도 의존적으로 명확하게 증가하는 결과를 나타낸 반면 백신과 백신보조제 양 성대조물질 aluminium hydroxide gel을 함께 투여한 군 (Vac +Alum)의 경우 백신만 단독으로 투여한 대조군 (Vac) 보다 오히려 비장세포의 증식률이 낮아지는 경향을 나타내었다 (Table 2).

Effect of polysaccharides from aboveground parts of Astragalus membranaceus (AMA) on splenocyte proliferation in typhoid vaccine-immunised mice.
또한 ConA를 처리하여 비장세포의 증식을 유도한 경우 백 신만 단독으로 투여한 대조군 (Vac) 및 황기 지상부 다당체를 농도별로 함께 투여한 군 (Vac + AMA) 모두가 정상대조군 (saline)이나 백신과 백신보조제 양성대조물질 aluminium hydroxide gel을 함께 투여한 군 (Vac + Alum) 보다 명확히 높은 증식률을 나타내었지만 LPS를 처리한 경우 정상대조군 (saline)과 백신과 백신보조제 양성대조물질 aluminium hydroxide gel을 함께 투여한 군 (Vac + Alum), 백신만 단독 으로 투여한 대조군 (Vac)사이에는 큰 차이를 나타내지 않았 다 (Table 2).
4. 백신에 의해 면역 유도된 마우스에서 황기 지상부 다당체 병용처리가 antigen specific antibody 반응에 미치는 효과
정상대조군 (saline), 백신만 단독으로 투여한 대조군 (Vac), 백신과 황기 지상부 다당체를 농도별로 함께 투여한 군 (Vac + AMA), 백신과 백신보조제 양성대조물질 aluminium hydroxide gel을 함께 투여한 군 (Vac + Alum)으로 나누어 2 회에 거쳐 복강 주사를 통하여 면역반응이 유도된 마우스를 대상으로 두 번째 주입 2주 후에 혈액을 채취하고 채취한 혈 액으로부터 Vi capsular polysaccharide of Salmonella typhi antigen에 의해 유도되는 항체 반응을 total IgG의 함량으로 검정한 결과 정상대조군 (saline)에 비하여 백신만 단독으로 투 여한 대조군 (Vac)이 보다 높은 IgG 수준을 나타내었다.
또한 황기 지상부 다당체를 농도별로 함께 투여한 군 (Vac +AMA)의 경우 모든 농도에서 total IgG의 함량이 백신만 단 독으로 투여한 대조군 (Vac)보다 명확히 높아지는 결과를 나 타내었으며 백신에 황기 지상부 다당체의 농도별로 처리한 경 우 마우스 당 황기 지상부 다당체 200 ㎍을 백신과 함께 접 종한 경우에서 가장 높은 수준으로 증가하였고 이러한 것은 백신과 백신보조제 양성대조물질 aluminium hydroxide gel을 200㎍ 수준으로 함께 투여한 군 (Vac + Alum)의 total IgG 함량과 유사한 수준 (p < 0.01)이었다 (Fig. 4).
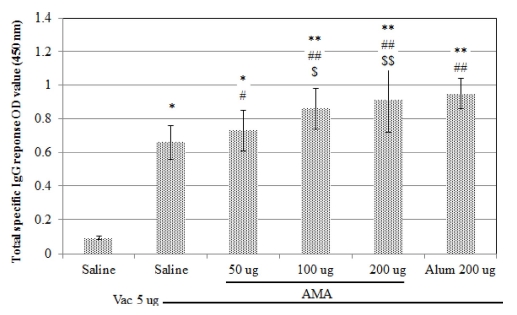
Polysaccharides from aboveground parts of Astragalus membranaceus (AMA) enhances the humoral responses on Vi capsular polysaccharide of Salmonella typhi antigen.Female ICR mice were immunised twice intramuscularly at a 15 days interval with 5㎍ vaccine alone or plus AMA (50, 100 or 200㎍) or Alum (200㎍) each mouse. Blood samples were collected 2 weeks after the second immunisation. The antibody total IgG against Vi capsular polysaccharide of Salmonella typhi antigen of the second immunisation. The values are presented as means ± SD (n = 3). Significant differences with saline groups were designated as *p < 0.05 and **p < 0.01; those with vaccine only groups (Vac) as #p < 0.05 and ##p < 0.01; those vaccine plus aluminium hydroxide gel group (Vac + Alum), $p < 0.05 and $$p < 0.01.
백신보조제의 효과는 백신과의 병용 접종 시 백신을 단독으 로 접종하는 경우 보다 IgG의 수준의 명확히 증가하는 것으 로 증명되는데 Udani 등 (2010)에 의하면 폐렴구균을 대상으 로 백신과 arabinogalactan을 병용하여 접종하는 경우 접종 후 51일과 72일 경과, 모두에서 2개의 항체 서브타입 (18C, 23F) 에 대한 IgG의 항체 반응이 위약군 보다 통계적으로 유의하 게 증가한다고 보고하였다.
본 연구결과를 통하여 인간의 장티프스에 대한 예방백신 (purified Vi capsular polysaccharide of Salmonella typhi)과 황기 지상부 다당체를 병용처리하는 경우 혈액에서 Salmonella typhi antigen specific antibody의 IgG 발현 수준을 증가시키 고 체액성 면역반응을 향상시킬 수 있음을 확인하였으며 동일 한 백신에 백신보조제로 aluminium hydroxide gel을 200㎍ 수준으로 처리한 수준의 체액성 면역 반응의 유도를 황기 지 상부 다당체를 200㎍ 수준으로 처리함으로서 유사한 효과를 얻을 수 있음을 확인함으로써 황기지상부로부터 분리한 다당 체가 효과적으로 aluminium hydroxide gel을 대체할 수 있는 소재임을 증명하였다.
5. 백신에 의해 면역 유도된 마우스에서 황기 지상부 다당체 병용처리가 비장세포에서 IFN-γ와 IL-4 분비에 미치는 효과
장티프스에 대한 예방백신 (purified Vi capsular polysaccharide of Salmonella typhi)과 기존 백신보조제인 Alum 또는 황기 지상 부 다당체를 농도별 (50, 100, 200 ㎍/mouse)를 복강주사로 병용 처리가 비장세포에서의 cytokine인 IFN-γ와 IL-4 분비능에 미치 는 영향을 살펴 본 결과 정상대조군 (saline)과 비교하여 백신 만 단독으로 투여한 대조군 (Vac)에서의 IFN-γ의 농도는 더 낮은 분비능을 나타내었다. 그러나 백신과 황기 지상부 다당 체를 농도별로 함께 투여한 군 (Vac + AMA)의 경우 정상대조 군 (saline)이나 백신과 백신보조제 양성대조물질 aluminium hydroxide gel을 함께 투여한 군 (Vac + Alum) 보다 더 높은 IFN-γ 분비능을 나타내는 것을 확인하였다. IL-4의 경우는 백 신만 단독으로 투여한 대조군 (Vac)에서 보다 백신과 황기 지 상부 다당체를 농도별로 함께 투여한 군 (Vac + AMA)과 백신 과 백신보조제 양성대조물질 aluminium hydroxide gel을 함께 투여한 군 (Vac + Alum)에서 더 높은 분비능을 나타내었다 (Table 3).

Effect of polysaccharides from aboveground parts of Astragalus membranaceus (AMA) on cyokine secretion of splenocyte in typhoid vaccine-immunised mice.
생체내에서 일반적 백신보조제로서의 활용은 항원의 자극에 대하여 Th1 및 Th2 면역 반응 모두를 유도할 수 있어야 하 며 Th1 및 Th2 면역 반응 프로파일은 그들이 생산하는 특정 cytokine에 의해 특정지어진다. 세포성 면역반응을 유도하는 것 과 연관되어 있는 Th1 면역 반응은 IL-2, TNF-α, IFN-γ의 생산에 의해 특정지어지고 IgG2a, IgGb 그리고 IgG3의 생산 이 향상되어지는 반면 B cell의 증식과 분화를 촉진하여 체액 성 면역반응을 유도하는 Th2 반응은 IL-2, IL-5, IL-10의 생 산에 특정화 되고 IgG1, IgA의 생산을 향상시킨다.
백신과 황기 지상부 다당체를 함께 투여하는 경우 IFN-γ와 같은 Th1 면역반응 cytokine의 생산을 농도별로 증가시켰으며 이러한 것은 백신만을 단독으로 처리하거나 백신에 aluminium hydroxide gel을 함께 투여하는 경우 보다 높은 면역반응을 유도하였다. 또한 백신과 황기 지상부 다당체를 함께 투여하 는 경우 IL-4와 같은 Th2 면역반응 cytokine의 생산이 농도 별로 증가하였고 백신만을 단독으로 투여하는 경우보다는 높 게 나타났다.
이러한 결과를 통하여 typhoid 백신으로 면역을 유도한 마 우스에서 황기 지상부 다당체는 Th1 및 Th2 cytokine의 분비 능을 모두 향상시키는 반면 aluminium hydroxide gel은 Th2 cytokine의 분비능 만을 향상시키는 것을 알 수 있었다.
6. 황기 지상부 다당체 처리가 대식세포 증식 및 TNF-α 생 산에 미치는 영향
Murine macrophage cell, RAW 264.7 2 × 105 cells/well에 황기 지상부 다당체를 농도별로 처리하고 배양한 후 MTT assay를 실시하여 대식 세포증식 정도를 비교하고 대식세포에 서 분비하는 cytokinine인 TNF-α의 함량을 ELISA 분석을 통 해 확인한 결과 대식 세포의 증식에 있어서 LPS가 존재하지 않은 상태에서도 황기 지상부 다당체의 농도별 (50, 100, 200㎍/㎖) 처리에 따라 각각 12.4, 21.2, 28.3%의 증식 비율 의 향상을 나타내어 정상대조군 (saline)에 대비하여 미약하지 만 유의적인 증식효능을 나타내었다.
대식세포에서 황기 지상부 다당체의 농도별 (50, 100, 200㎍/㎖) 처리 후, nitric oxide 생성량을 측정한 결과 정상 대조군 (saline)의 nitric oxide 생성량이 0.25 ± 0.05 μM로 나 타난 반면 황기 지상부 다당체 50, 100, 200㎍/㎖ 처리 시 nitric oxide 생성량이 각각 5.26 ± 0.54, 7.75 ± 0.84, 9.83 ± 2.13 μM을 나타내어 황기 지상부 다당체 처리에 의해 대식세 포의 증식과 함께 활성화 지표인 nitric oxide 함량도 현저하 게 증가 되는 것을 확인하였다 (Table 4).

Effect of polysaccharides from aboveground parts of Astragalus membranaceus (AMA) on proliferation and TNF-α in macrophage.
TNF-α의 함량에 있어서도 정상대조군 (saline)의 경우 206.3 ± 33.8 pg/㎖ 인데 반하여 황기 지상부 다당체를 농도별로 처 리한 경우 50㎍/㎖를 처리한 경우 429.6 ± 22.4 pg/㎖으로 2 배 증가하였으며, 100㎍/㎖과 200㎍/㎖를 처리한 경우 각각 566.2 ± 29.3, 654.3 ± 28.3 pg/㎖ 으로 TNF-α 분비능이 증가 하였다 (Table 4).
Suárez 등 (2006)에 의하면 광합성 담수 녹조류인 Chlorella pyrenoidosa에서 분리된 arabinogalactan의 면역증강 활성은 그 들의 분자량에 기인하며 높은 분자량의 다당체는 면역증강 활 성이 존재하나 낮은 분자량의 다당체는 면역증강 활성을 가지 지 못한다고 하였고, Tao 등 (2007)은 arabinogalactan의 활성 은 그들의 화학적 구조뿐만 아니라 사슬 구성에 의해 좌우된다 고 보고하였다. 또한 Xie 등 (2007)은 쑥 국화 (Tanacetum vulgare)로부터 분리된 151 kDa 분자량을 가진 Type II의 arabinogalactan이 활성산소 (reactive oxygen species, ROS)와 nitric oxide (NO), TNF-α 생성능을 증대시켜 J774.A1 murine macrophages를 활성화시킨다고 보고하였다.
따라서 황기 지상부 다당체에 분자량 345 kDa이며 3- linked galactose 구조와 3,6 branch galactose의 당쇄구조가 교호적으로 존재하며 galactose가 풍부한 oligosaccharide가 연 결되어 있는 arabino-3,6-galactan인 AMA-1-b-PS2를 포함하고 있다는 보고 (Lim et al., 2016)와 이상의 결과를 통하여 황 기 지상부 다당체가 큰 분자량을 가지고 그들의 사슬 구성에 의해 농도의존적으로 대식세포의 증식, nitric oxide 함량의 증 대, T 세포의 활성지표인 TNF-α 분비능을 증가시킬 수 있고 전체적인 면역증강 및 백신보조 효과를 나타낼 수 있음을 나 타낸다고 하겠다.
이상의 결과를 통하여 arabino-3,6-galactan인 AMA-1-b-PS2 를 포함하는 황기 지상부 다당체는 면역보조 효과뿐만 아니라 Vi capsular polysaccharide of Salmonella typhi antigen에 대한 명확한 백신보조효과를 포함하고 있고 Vi capsular polysaccharide of Salmonella typhi 백신에 대한 체액성 면역 및 세포를 매개로 하는 면역 반응을 유도할 수 있음을 확인하 였다. 황기 지상부 다당체는 백신 보조효과를 나타내지만 부 작용 및 단점을 가지고 있는 기존의 백신 보조제 aluminium hydroxide gel를 동일 농도에서 효과적으로 대체할 수 있는 소재가 될 수 있으며 안전하고 효과적으로 사용할 수 있는 백 신보조제로 활용이 기대되어 진다.
감사의 글
본 연구는 2015년도 강원대학교 대학회계 학술연구조성비( 관리번호: 201510102)와 산업통상자원부 산업기술연구기반조 성사업(과제번호: PJR0004048)의 연구비 지원에 의해 이루어 진 결과로 이에 감사드립니다.
References
-
Aguilar, JC, Rodriguez, EG, Vaccine adjuvants revisited, Vaccine, (2007), 25, p3752-3762.
[https://doi.org/10.1016/j.vaccine.2007.01.111]

-
Aucouturier, J, Dupuis, L, Ganne, V, Adjuvants designed for veterinary and human vaccines, Vaccine, (2001), 19, p2666-2672.
[https://doi.org/10.1016/s0264-410x(00)00498-9]

-
Barr, TA, Carlring, J, Heath, AW, Co-stimulatory agonists as immunological adjuvants, Vaccine, (2006), 24, p3399-3407.
[https://doi.org/10.1016/j.vaccine.2006.02.022]

- Cho, WCS, Leung, KN, in vitroand in vivo antitumor effects ofAstragalus membranaceus, Cancer Letters, (2007a), 252, p43-54.
- Cho, WCS, Leung, KN, in vitroand in vivo immunomodulating and immunorestorative effects ofAstragalus membranaceus, Journal of Ethnopharmacology, (2007b), 113, p132-141.
- Choi, RN, Park, YC, Lee, JS, Kim, JW, Kim, JB, Cheoi, YS, Kim, KK, Lee, JG, Yu, CY, Kim, SH, Chung, IM, Kim, JK, Lim, JD, Isolation of polysaccharides modulating intestinal immune system and single oral dose toxicity test inAstragalus membranaceusaboveground parts, Korean Journalof Medicinal Crop Science, (2014), 22, p276-288.
-
da Silva, BP, de Medeiros Silva, G, Parente, JP, Chemical properties and adjuvant activity of a galactoglucomannan fromAcrocomia aculeata, Carbohydrate Polymer, (2009), 75, p380-384.
[https://doi.org/10.1016/j.carbpol.2008.09.031]

- Edelman, R, Vaccine adjuvants, Reviews of Infectious Diseases, (1980), 2, p370-383.
-
Freund, J, Casals, J, Hosmer, EP, Sensitization and antibody formation after injection of tubercle bacilli and paraffin oil, Experimental Biology and Medicine, (1937), 37, p509-513.
[https://doi.org/10.3181/00379727-37-9625]

-
HogenEsch, H, Mechanisms of stimulation of the immune response by aluminum adjuvants, Vaccine, (2002), 20, pS34-S39.
[https://doi.org/10.1016/s0264-410x(02)00169-x]

-
Jacobsen, NE, Fairbrother, WJ, Kensil, CR, Lim, A, Wheeler, DA, Powell, MF, Structure of the saponin adjuvant QS-21 and its base-catalyzed isomerization product by 1H and natural abundance 13C NMR spectroscopy, Carbohydrate Research, (1996), 280, p1-14.
[https://doi.org/10.1016/0008-6215(95)00278-2]

-
Janeway, CA Jr, The immune system evolved to discriminate infectious nonself from noninfectious self, Immunology Today, (1992), 13, p11-16.
[https://doi.org/10.1016/0167-5699(92)90198-g]

- Jiao, Y, Wen, J, Yu, X, Influence of flavonoid ofAstragalus membranaceus’sstem and leaves on the function of cell mediated immunity in mice, Chinese Journal of Integrated Traditional and Western Medicine, (1999), 9, p356-358.
-
Kensil, CR, Kammer, R, QS-21: A water-soluble triterpene glycoside adjuvant, Expert Opinion on Investigational Drugs, (1998), 7, p1475-1482.
[https://doi.org/10.1517/13543784.7.9.1475]

-
Kim, SH, Jun, YM, Lim, JJ, Kim, SH, Chung, IM, Kim, EH, Variation of astrogalosides contents in cultivatedAstragalus membranaceus, Korean Journal of Medicinal Crop Science, (2012), 20, p372-380.
[https://doi.org/10.7783/kjmcs.2012.20.5.372]

-
Kong, XF, Hu, YL, Rui, R, Wang, DY, Li, XR, Effects of Chinese herbal medicinal ingredients on peripheral lymphocyte proliferation and serum antibody titer after vaccination in chicken, International Immunopharmacology, (2004), 4, p975-982.
[https://doi.org/10.1016/j.intimp.2004.03.008]

-
Lee, KY, Jeon, YJ, Macrophage activation by polysaccharide isolated fromAstragalus membranaceus, International Immunopharmacology, (2005), 5, p1225-1233.
[https://doi.org/10.1016/j.intimp.2005.02.020]

- Lim, JD, Yu, CY, Kim, SH, Chung, IM, Structural characterization of an intestinal immune system-modulatingarabino-3,6-galactan-like polysaccharide from the aboveground part ofAstragalus membranaceus(Bunge), Carbohydrate Polymers, (2016), 136, p1265-1272.
-
Marciani, DJ, Vaccine adjuvants Role and mechanisms of action in vaccine immunogenicity, Drug Discovery Today, (2003), 8, p934-943.
[https://doi.org/10.1016/s1359-6446(03)02864-2]

- Park, YC, Kim, MH, Kim, JW, Kim, JB, Lee, JG, Yu, CY, Kim, SH, Chung, IM, Kim, JK, Choi, RN, Lim, JD, Genotoxicity study of polysaccharide fractions fromAstragalusmembranceus's aerial rats, Toxicology Research, (2014), 30, p131-138.
-
Park, YC, Lee, JS, Kim, DY, Son, HY, Lee, JW, Cheoi, YS, Kim, KK, Yu, CY, Chung, IM, Im, MH, Lee, KJ, Choi, RN, Shim, HS, Lim, JD, A 90 day repeated dose-oral toxicity study of extracts fromAstragalus membranaceus-aboveground parts in rats, Korean Journal of Medicinal Crop Science, (2013), 21, p474-485.
[https://doi.org/10.7783/kjmcs.2013.21.6.474]

-
Petrovsky, N, Novel human polysaccharide adjuvants with dual Th1 and Th2 potentiating activity, Vaccine, (2006), 24, pS26-S29.
[https://doi.org/10.1016/j.vaccine.2005.01.107]

-
Schepetkin, IA, Quinn, MT, Botanical polysaccharides Macrophage immunomodulation and therapeutic potential, International Immunopharmacology, (2006), 6, p317-333.
[https://doi.org/10.1016/j.intimp.2005.10.005]

- Schirmbeck, R, Melber, K, Kuhrber, A, Janowicz, ZA, Reimann, J, Immunization with soluble hepatitis B virus surface protein elicits murine H-2 class I-restricted CD8+cytotoxic T lymphocyte responses in vivo, The Journal of Immunology, (1994), 152, p1110-1119.
- Skene, CD, Sutton, P, Saponin-adjuvanted particulate vaccines for clinical use, Methods, (2006), 0, p53-59.
-
Sohn, ES, Son, EW, Pyo, SK, A current research insight into function and development of adjuvants, Immune Network, (2004), 4, p131-142.
[https://doi.org/10.4110/in.2004.4.3.131]

-
Storni, T, Kndig, TM, Senti, G, Johansen, P, Immunity in response to particulate antigen-delivery systems, Advanced Drug Delivery Review, (2005), 57, p333-355.
[https://doi.org/10.1016/j.addr.2004.09.008]

-
Subramanian, M, Chintalwar, GJ, Chattopadhyay, S, Antioxidant properties of a Tinospora cordifolia polysaccharide against iron-mediated lipid damage and ?-ray induced protein damage, Redox Report, (2002), 7, p137-143.
[https://doi.org/10.1179/135100002125000370]

- Sun, CW, Ceng, QH, Sun, XX, An, G, Zhan, S, Effects ofAstragalussaponins on Ca2+-activated K+channels of mouse T lymphocytes, Journal of Norman Bethune University of Medical Science, (1996), 2, p125-126.
- Sun, HX, Pan, HJ, Immunological adjuvant effect of Glycyrrhiza uralensis saponins on the immune responses to ovalbumin in mice, Vaccine, (2006), 4, p1914-1920.
-
Sun, HX, Zheng, QF, Haemolytic activities and adjuvant effect ofGynostemma pentaphyllumsaponins on the immune responses to ovalbumin in mice, Phytotherapy Research, (2005), 19, p895-900.
[https://doi.org/10.1002/ptr.1754]

-
Sun, HX, Xie, Y, Ye, YP, Advances in saponin-based adjuvants, Vaccine, (2009), 27, p1787-1796.
[https://doi.org/10.1016/j.vaccine.2009.01.091]

-
Sun, HX, Ye, YP, Pan, HJ, Pan, YJ, Adjuvant effect ofPanax notoginsengsaponins on the immune responses to ovalbumin in mice, Vaccine, (2004), 22, p3882-3889.
[https://doi.org/10.1016/j.vaccine.2004.04.012]

- Sun, HX, Adjuvant effect of Achyranthes bidentata saponins on specific antibody and cellular response to ovalbumin in mice, Vaccine, (2006a), 24, p3432-3439.
- Sun, HX, Haemolytic activities and adjuvant effect ofBupleurum chinensesaponins on the immune responses to ovalbumin in mice, Vaccine, (2006b), 24, p1324-1331.
- Suárez, ER, Syvitski, R, Kralovec, JA, Noseda, MD, Barrow, CJ, Ewart, HS, Lumsden, MD, Grindley, TB, Immunostmulatory polysaccharides from Chlorella pyrenoidosa A new galactofuranan Measurement of molecular weight and molecular weight dispersion by DOSY NMR, Biomacromolecules, (2006), 7, p2368-2376.
-
Tao, YZ, Zhang, LN, Yan, F, Wu, XJ, Chain conformation of water-insoluble hyperbranched polysaccharide from fungus, Biomacromolecules, (2007), 8, p2321-2328.
[https://doi.org/10.1021/bm070335+]

-
Udani, JK, Singh, BB, Barrett, ML, Singh, VJ, Proprietary arabinogalactan extract increases antibody response to the pneumonia vaccine A randomized, double blind, placebocontrolled, pilot study in healthy volunteers, Nutrition Journal, (2010), 9, p32-36.
[https://doi.org/10.1186/1475-2891-9-32]

- Xie, G, Schepetkin, IA, Quinn, MT, Immunomodulatory activity of acidic polysaccharides isolated form Tanacetum vulgare, L, International Immunopharmacology, (2007), 7, p1639-1650.
-
Xie, Y, Pan, HJ, Sun, HX, Li, D, A promising balanced Th1 and Th2 directing immunological adjuvant, saponins from the root of Platycodon grandiflorum, Vaccine, (2008), 26, p3937-3945.
[https://doi.org/10.1016/j.vaccine.2008.01.061]

-
Yang, ZG, Sun, HX, Fang, WH, Haemolytic activities and adjuvant effect ofAstragalus membranaceussaponins (AMS) on the immune responses to ovalbumin in mice, Vaccine, (2005), 23, p5196-5203.
[https://doi.org/10.1016/j.vaccine.2005.06.016]

- Yesilada, E, Bedir, E, al, I, Takaishi, Y, Ohmoto, Y, Effects of triterpene saponins fromAstragalusspecies onin vitrocytokine release, Journal of Ethnopharmacology, (2005), 96, p71-77.
-
Yoshida, Y, Wang, MQ, Liu, JN, Shan, BE, Yamashita, U, Immunomodulating activity of Chinese medicinal herbs andOldenlandia diffusain particular, International Journal ofImmunopharmacology, (1997), 19, p359-370.
[https://doi.org/10.1016/s0192-0561(97)00076-3]
