황백추출물 및 분획물의 Nitric Oxide 생성 억제 효과 및 Elastase 억제 효과
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
To date, the anti-wrinkle efficacy of phellodendri cortex has not been defined. In this study, we investigated the nitric oxide (NO) production and elastase inhibitory activities of 80% methanol extract of Phellodendri cortex and its ethyl acetate fraction.
We prepared 80% methanol extract, and its fractions from phellodendri cortex. The treatment of RAW 264.7 cell with 25μg/ml 80% methanol extract and ethyl acetate fraction resulted in no toxicity. We conducted assays of nitric oxide (NO) production and elastase inhibition. In the NO production assay, the ethyl acetate fraction showed an inhibitory effect approximately 17 times stronger than the 80% methanol extract. In elastase inhibitory assay, the ethyl acetate fraction also showed a stronger effect than the 80% methanol extract. In order to standardize the extract and fraction, we used TLC to separate the extract and observed the plate under UV light. We confirmed that the known pharmacological ingredients berberine, and palmatine in the 80% methanol extract and the ethyl acetate fraction.
These results indicated that phellodendri cortex extract and its ethyl acetate fraction produced strong inhibitory effect on elastase and NO production.
Keywords:
Phellodendri Cortex, Anti-Inflammation, Berberine, Elastase Inhibitory Effect, Palmatine서 언
황백 (Phellodendron amurense Ruprecht)은 운향과 (Rutaceae) 에 속하는 낙엽활엽교목인 황백나무 껍질을 벗긴 수피를 말려 약용으로 사용하는 것으로서, 우리나라 전 지역을 비롯한 중 국, 일본에 분포하여 자생되고 있다 (Lee, 1993). 황백은 신라 시대에 처음으로 사용된 것으로 보고되어 있으며 한국의 전통 한약재로서 해독, 해열, 황달, 설사, 요도관 및 피부 감염증, 무릎과 발의 통증에 폭넓게 사용되어 왔다. 또한 여러 연구에 의해 황백나무의 피부 melanin 생합성 저해 활성 (Lee et al., 2007), 지방분해 활성 (Kim et al., 2003)이 보고되었으며, 구 강균 (Kwak, 2004)에 대한 저해 효과가 확인된 바 있다. 약 리 성분으로 berberine, palmatine, jatrorrhizine, phellodendrine, menisperine, candicine, magnoflorine 등 여러 종류의 alkaloid 를 함유하고 있으며 대표적인 주성분은 berberine으로 이와 같 은 유효성분들의 분리에 대한 연구는 여러 차례 이루어진 바 있다 (Kim et al., 2013a, b).
Berberine은 황백뿐만 아니라 황련 (Coptis rhizoma)에도 다 량 함유되어 있고 항염증작용 (Kuo et al., 2004), 항고지혈작 용 (Kong et al., 2008) 등의 약리활성과 항균작용 (Creasey, 1979;Ikram, 1975), 전염증성 cytokines의 생성 저해 (Chung et al., 2010), NF-B, Bcl-2 및 ICAM-1의 활성 억제 (Affuso et al., 2010), 암세포 생장 억제 (Tan et al., 2011) 등 다양 한 효과가 알려져 있다. 또다른 주요 성분인 palmatine은 monoamine oxidase 저해 (Lee et al., 1999b), hyperglycemic 저해 (Semwal et al., 2010) 등이 보고된 바 있다.
현재까지 황백나무 추출물과 약리성분 berberine, palmatine 에 대한 생리활성 연구는 다양하게 보고되어왔으며, 특히 염 증 억제 활성에 관련된 보고가 다양하게 이루어진 바 있으나, 황백 추출물과 분획물에 대한 주름 억제 효과 연구는 미비한 상태이다. 따라서 본 연구는 황백나무에 이미 알려진 염증 억 제 활성과 더불어 새로운 기능성 소재로 활용하기 위한 연구 의 일환으로 황백을 이용하였다. 황백을 80% methanol 추출 한 뒤, ethyl acetate 용매 분획하여 염증 억제 활성을 나타내 는 것으로 알려진 지표 물질 berberine 및 palmatine과 그 활 성을 비교하였고 TLC를 통하여 황백 추출물과 분획물에서 지 표 물질의 존재를 확인하였다. 또한 주름 억제 관련 생리활성 을 확인하기 위해 elastase 저해 활성을 분석하였으며 이러한 활성과 berberine, palmatine의 상관관계를 분석하였다.
재료 및 방법
1. 실험 재료
본 실험에서 사용한 황백 (Phellodendron amurense Ruprecht) 은 강원도 영월군에서 채집된 국내산 황백을 2015년 5월경에 제천한방약초에서 구매하였다. 구매한 황백은 DNA를 추출하 여 ITS (internal transcribed spacer) 영역에 대해 PCR 후, 마크로젠을 통한 염기서열 분석을 하였고 NCBI (National Center for Biotechnology Information, 미국국립생물정보센터) 에서 확인하였으며, 표품은 음지에서 상온 보관하며 본 실험 의 재료로 사용하였다.
2. 기기 및 시약
추출 및 분획 과정에 용매 methanol, ethyl acetate (Daejung Chemicals and Metals Co., Ltd., Siheung, Korea) 를 사용하였고 heating mantle (MS-IM609, Misung Scientific Co., Ltd., Yangju, Korea), rotatory vacuum evaporator (400 series, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)를 이용하였 으며, 동결 건조기 (Sam Won Industry, Seoul, Korea)로 동결 건조하였다. 분석을 위해 silica gel TLC plate (20 × 20㎝ silica gel 60 F254, Aluminium plate, Merck, Darmstadt, Germany)와 UV lamp (Vilber Lourmat, Marne-la-valee, France)를 사용하였고 세포 배양을 위해 FBS, penicillinstreptomycin, DMEM (Dulbecco’s modified Eagle’s medium) 은 Invitrogen (Carlsbad, CA, USA)에서 구입하였으며, 세포 실험은 lipopolysaccharide (Sigma-Aldrich Co., St. Louis, MO, USA), ez-cytox (Biomax Co., Ltd., Seoul, Korea), nitric oxide detection kit (iNtRON Biotechnology, Inc., Sungnam, Korea)을 사용하였다. 활성 실험을 위해 pancreatic elastase, oleanolic acid는 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하였고 multi-plate reader (Paradigm, Houston, TX, USA)를 사용하였으며, berberine chloride hydrate, palmatine chloride hydrate은 Sigma-Aldrich (St. Louis, MO, USA)에서 구매하여 지표물질로 사용하였다. TLC 분석에 대 조군으로 사용하기 위해 berberine과 palmatine은 methanol에 녹여 각각 1,000 ppm의 농도로 5㎖씩 제조하였고 활성 실험 을 위해 각각 methanol에 녹여 250 μM의 농도로 2㎖씩 제 조하였으며, 이를 1/2 씩 희석하여 농도별 시료를 제조해 본 실험에 사용하였다.
3. 추출 및 분획
황백 500 g에 80% methanol 5ℓ (1 : 10)를 넣고 수직으 로 환류냉각장치를 부착시킨 heating mantle을 이용하여 2시 간동안 80℃에서 가열 추출하였으며, 이 과정을 4 회 반복하 였다. 각 추출물은 여과지 Whatman No. 2 (Whatman Co., Maidstone, England)로 여과한 다음 rotatory vacuum evaporator 로 감압농축한 후 동결 건조하여 분말로 제조하였다. 분말화된 추출물은 무게를 측정하여 이를 %로 나타내어 추출물의 수율 로 표시하였다. 이 추출물 분말을 증류수로 현탁시켜 용매별 극성 차이를 이용하여 용매 분획을 실시하였다. Ethyl acetate 을 1 : 1 (v/v)의 비율로 혼합한 후 상하층으로 분리된 층 가 운데 상층을 분리해 낸 다음 하층을 다시 분획하는 동일한 과 정을 10회 이상 수행하였다. 분획하여 얻어낸 상층은 rotatory vacuum evaporator로 감압농축한 후 동결 건조하여 분말로 제 조하였다. 이를 각각 용매 methanol에 녹여 80% methanol 추 출물과 ethyl acetate 분획물 시료를 제조하였으며 일정 농도로 희석하여 TLC 분석 및 세포독성, 항염증, 주름 억제 효과 측 정을 위해 사용하였다.
4. 세포 배양
마우스의 대식세포주인 RAW264.7은 한국세포주은행 (Korean Cell Line Bank, KCLB, Seoul, Korea)에서 분양 받았으며, 세포배양을 위해 10% FBS와 1% penicillinstreptomycin을 포함하는 DMEM 배지를 사용하였다. 세포는 37℃, 5% CO2 조건에서 배양하였다.
5. Thin layer chromatography 전개
Silica gel TLC plate는 형광물질이 도포되어 있어 UV 조 사 시 강한 형광을 내는 제품을 사용하였다. 통상 적정 농도 의 시료는 0.5㎕ (per spot)의 양으로 실험하였으며, 전개용매 는 표준생약 품목별 해설서 (Lee, 2012)를 참고하여 nbutanol, water, acetate acid (7 : 2 : 1 v/v/v)의 조건으로 실온 에서 상승법으로 전개하여 건조한 후, TLC 상에 전개된 spot 의 존재 및 위치 확인에는 UV lamp로 365㎚의 파장에서 확 인하였다. 이때 확인한 spot은 Rf 값을 계산하였다.
6. 세포 생존율 측정
세포생존율은 water-soluble tetrazolium salt (WST-1) 방법 을 사용하여 측정하였다 (Ranke et al., 2004). RAW264.7은 DMEM배지를 이용하여 5 × 104 cells/㎖로 조절한 후 24 well tissue culture plate에 접종하고, 5% CO2 incubator에서 24시간 전 배양하였다. 세포에 1㎍/㎖의 lipopolysaccharide (LPS)를 처리하고 24시간 뒤에 일정 농도의 시료를 처리하여 24시간 배양하였다. 시료 처리 후 ez-cytox 시약이 든 배지로 교체하여 2시간 동안 반응시킨 후 multi-plate reader를 이용하 여 450㎚에서 흡광도를 측정하였다. 측정값은 3회 반복 실험 의 평균값으로 나타내었다.
7. Nitric Oxide 억제율 측정
Nitrite oxide (NO)의 농도는 Green 등 (1982)의 방법을 이 용한 nitric oxide detection kit를 이용하여 측정하였다. RAW 264.7 cell은 DMEM 배지를 이용하여 5 × 104 cells/㎖로 조절 한 후 24 well tissue culture plate에 접종하고, 5% CO2 incubator에서 24시간 전 배양하였다. 세포에 1㎍/㎖의 LPS 를 처리하고 24시간 뒤에 일정 농도의 시료를 처리하여 24 시간 배양하였다. 배양액의 상층액을 얻은 후 griess 시약과 반응 시킨 후 multi-plate reader를 이용하여 540㎚에서 흡광 도를 측정하여 NO 생성 억제율은 1 mM nitrite standard solution을 기준으로 하여 백분율로 표현하였다.
8. Elastase 저해 활성 측정
Elastase 저해 활성은 Cannell 등 (1988)의 방법에 따라 측 정하였다. Elastase (EC 3.4.4.7)는 동물 결합 조직의 불용성 탄성 섬유 단백질인 elastin을 분해할 수 있는 효소로서 (Lee et al., 1999a) 췌장 추출물에서 처음 발견되었으며 (Yoon et al., 2002) 미생물 (Manach et al., 1998;Rice-Evans et al., 1996)과 고등식물 (Kraunsoe et al., 1996) 등에서도 발견되었 다. Elastase는 피부 탄력성에 관련된 elastin을 분해시켜 collagen과 이루어진 피부의 진피조직의 그물망 구조결합을 끊 어줌으로 주름생성의 주원인 효소로 알려져 있다. 그러므로 피 부노화의 주원인 중의 하나인 elastase의 활성을 저하시킴으로 써 피부노화를 억제할 수 있다 (DeWitt et al., 1981). 일정 농도로 희석한 각 시료 0.5㎖에 50 mM의 Tris-HCl buffer (pH 8.6)에 녹인 2.5 U/㎖ porcine pancrease elastase 0.5㎖ 와 50 mM의 Tris-HCl buffer에 0.5㎎/㎖ N-succinyl-(LAla) 3-p-nitroanilide를 녹인 기질액 1㎖를 첨가하여 22℃에서 5분간 반응 후 기질로부터 생성되는 p-nitroanilide의 생성량을 410㎚에서 측정하였다. 이를 시료용액의 첨가구와 무첨가구 의 흡광도 감소율을 백분율 (%)로 표시하여 elastase 활성 저 해율로 나타내었으며, 대조군으로는 oleanolic acid를 사용하여 황백 추출물 및 분획물과 비교하였다. Elastase 활성 1 unit은 분당 1 μ㏖의 p-nitroanilide을 생성하는 elastase의 효소의 양 으로 하였으며 저해 활성은 다음의 식으로부터 계산하였다.
Elastase inhibitory activity (%)= (1 - B/A) × 100
- A: Elastase inhibitory activity without sample
- B: Elastase inhibitory activity with sample
9. 통계 처리
모든 측정값은 3회 이상 반복 실험한 결과의 평균값과 표준 편차 (means ± SD)로 표시하였고, 각 실험군 간의 통계학적 분석은 windows용 SPSS (Statistical Pakage for Social Science, version 12.0, SPSS Inc., Chicago, IL, USA)을 이 용하였다. 각 군 간의 측정치 비교는 One-way analysis of variance (ANOVA)를 시행한 후 Duncan’s Multiple Range Test (DMRT)로 유의성을 p < 0.05에서 의미를 부여하였다.
결과 및 고찰
1. 고형분 수율
황백을 80% methanol을 이용하여 가열 추출한 결과, 황백 500 g 기준 동결 건조 분말 중량은 83.6 g이었고 수율 16.7% 로 나타났다. 이 중 ethyl acetate로 분획하여 얻은 분획물의 동결 건조 분말 중량은 46.0 g으로 9.2%의 수율을 나타내었다 (Table. 1).
2. Thin layer chromatography 분석
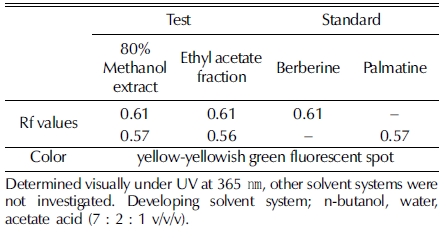
Silica gel TLC plate 상에서 전개된 황백 추출물 및 분획 물과 지표 물질 berberine, palmatine의 이동에 따른 고유수치 (Rf 값)를 UV 365㎚ 파장에서 육안 관찰한 결과는 Fig. 1과 같다. 추출물과 분획물 모두 형광 노란색–청록색의 spot이 관 찰되었고, 추출물의 경우 2개 spot의 Rf 값은 각 0.61과 0.57 이었으며, 분획물의 경우 형광 노란색–청록색을 띠는 2 개 spot의 Rf 값은 각 0.61과 0.56으로 확인되었다. 대조 시료인 지표 물질 berberine과 palmatine은 형광 노란색–청록색을 띠 는 spot으로 각각의 Rf 값은 0.61, 0.57으로 나타났으며, 이는 황백 추출물 및 분획물에서 관찰된 각 2개의 spot과 색상이 일치하고 Rf 값이 유사한 것으로 확인되었다. 이를 통해 황백 추출물 및 분획물에서 지표 물질 berberine과 palmatine이 모 두 함유되어 있음을 확인하였으며, 두 지표 물질은 용매 methanol과 ethyl acetate에 의해 용출 가능한 물질임이 확인되 었다 (Table. 2).
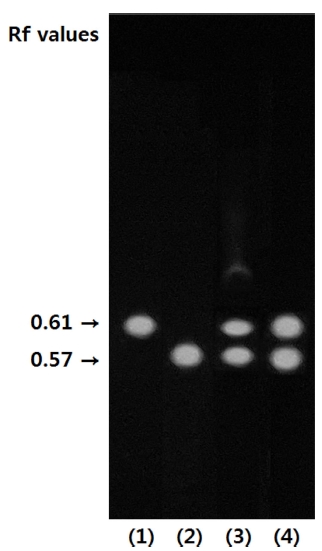
Berberine and palmatine of spots by TLC analysis of extract and fraction of phellodendri cortex.1)berberine, 2)palmatine, 3)80% methanol extract, 4)ethyl acetate fraction.
3. 세포 생존율
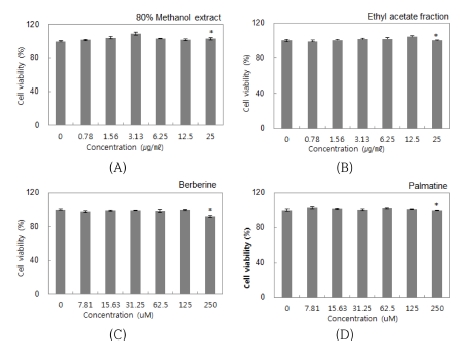
마우스 대식세포인 RAW264.7에 대한 세포독성을 알아보 기 위하여 황백 추출물 및 분획물과 지표 물질 berberine, palmatine을 각각 농도별 (0 - 25 ㎍/㎖, 0 - 250 μM)로 처리한 후, WST assay를 수행하였다. 황백 추출물을 처리한 경우 25㎍/㎖의 농도에서 103.25%의 세포 생존율을 보임으로써 세포독성이 없는 것으로 확인되었고 (Fig. 2A), 분획물을 처리 한 경우 25㎍/㎖의 농도에서 100.11%의 세포 생존율을 보였 다 (Fig. 2B). 지표 물질 berberine을 처리한 경우 125 μM의 농도까지 세포 독성이 없었고 250 μM의 농도에서 91.64%의 세포 생존율을 보임으로써 세포생존율의 소폭의 감소가 관찰 되었다. (Fig. 2C). Palmatine을 처리한 경우 250 μM의 농도 에서 99.57%의 세포 생존율을 보임으로써 세포 독성이 없는 것으로 확인되었다 (Fig. 2D). 이와 같은 결과로 황백 추출물 및 분획물은 최대 25㎍/㎖, 지표물질 berberine 및 palmatine은 최대 250 μM의 농도까지 모든 활성 효과 실험을 진행하였다.
4. Nitric oxide 생성 억제
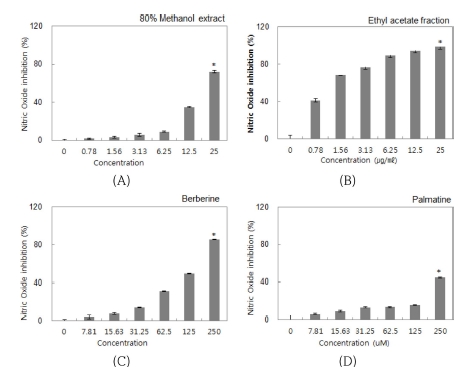
황백 추출물 및 분획물과 지표 물질 berberine, palmatine이 각각 마우스 대식세포주인 RAW264.7에서 LPS 처리에 의한 NO 생성에 미치는 영향을 검토하기 위해 황백 추출물 및 분 획물과 지표 물질 berberine, palmatine을 각각 농도별 (0 - 25㎍/㎖, 0 - 250 μM)로 처리한 후, NO assay를 수행하였다. NO는 생체 내에서 혈압조절, 혈소판응집, 신호전달 등 다양한 작용을 하는 것으로 알려져 있으며, 특히 pro-inflammatory cytokine이나 LPS는 면역세포에 작용하여 L-arginine으로부터 inducible nitric oxide synthase (iNOS)의 작용에 의해 NO의 생성을 증가시킨다. 과도한 NO의 생성은 만성염증에 관련이 있으며 iNOS 활성조절을 통하여 만성염증을 조절하기 위해 선택적 NO 생합성 억제제 개발에 많은 연구가 이루어지고 있 다 (Sharma et al., 2007;Korhonen et al., 2005). 세포주에 LPS 처리 후 생성되는 NO에 대해 황백 추출물 및 분획물과 지표 물질 시료 처리에 의한 억제 활성을 분석하여 Fig. 3에 나타내었다. RAW264.7 세포주에 LPS 단독 처리는 NO의 생 성 억제율이 낮은 것을 확인 할 수 있었으며, LPS에 의해 증 가한 NO가 황백 추출물 및 분획물과 지표 물질 시료 처리에 의해 감소하는 것을 확인하였다. 추출물 처리 시료의 경우 0.78 - 50㎍/㎖의 농도 범위에서 NO의 생성 저해 효과가 점 차 증가하는 것을 확인할 수 있었으며 17.88㎍/㎖ 처리 시 NO 생성을 약 50% 저해하는 것으로 나타났다 (Fig. 3A). 분 획물 처리 시료의 경우 0.78 - 25㎍/㎖의 농도 범위에서 NO 의 생성 저해 효과가 농도가 증가함에 따라 상승하는 것을 확 인할 수 있었으며, 1.04㎍/㎖ 처리 시 NO 생성을 약 50% 저해하는 것으로 나타났다 (Fig 3B). 이는 분획물의 NO 생성 저해 효과가 추출물보다 약 17배 우수하다는 것을 확인할 수 있었다. Berberine 처리 시료의 경우 7.81 - 250 μM 농도 범위 에서 NO의 생성 저해 효과가 농도의존적으로 증가하는 것을 확인할 수 있었으며, 137.22 μM 처리 시 NO 생성을 약 50% 저해하는 것으로 나타났다 (Fig. 3C). Palmatine 처리 시 료의 경우 250 μM 처리 시 NO 생성을 약 44.53% 저해하는 것으로 분석되어 NO 생성 억제는 berberine이 더 우수한 것 으로 나타났다 (Fig. 3D). 이러한 지표 물질 berberine과 palmatine의 염증 억제 효과는 Küpeli 등 (2002)에서 보고된 바 있다. 따라서 황백 추출물과 분획물을 처리했을 시 NO 생 성 억제 효과가 뛰어나며, 이는 황백이 berberine과 palmatine 을 주요 약리 성분으로 함유하고 있으므로 NO 생성 억제에 유효한 효과를 나타낸 것으로 판단된다. 또한, 황백 분획물이 추출물보다 NO 생성 억제 효과가 뛰어난 것은 berberine이나 palmatine과 같은 유효 물질이 용매 ethyl acetate을 이용한 분 획 과정을 통해 분획물에 더욱 높은 함량으로 포함되어 있기 때문으로 사료되며, 이러한 연구보고와 본 실험의 결과를 바 탕으로 황백의 항염증 기능성 소재 개발의 가능성을 확인 할 수 있었다.
5. Elastase 저해 활성
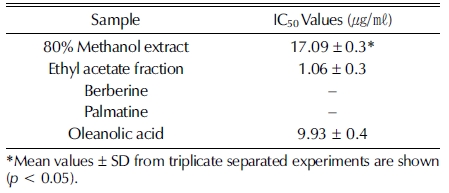
피부의 주름과 연관이 있는 elastase 저해 효과를 조사한 결 과는 Fig. 4와 Table 3과 같다. 황백 methanol 추출물의 경우 0.78 - 25㎍/㎖의 농도 범위에서 elastase 저해 활성이 농도의 존적으로 증가하는 것을 확인할 수 있었으며 17.09㎍/㎖ 처 리 시 약 50% 저해하는 것으로 나타났다 (Fig. 4A). 노화 억 제 관련 생리활성 물질을 탐색한 연구에서도 황백 methanol 추출물의 elastase 저해 효과가 보고된 바 있으며 (Yu et al., 2005), 각종 약용 식물을 이용한 주름 개선 기능성 소재로의 연구가 지속적으로 이루어지고 있다 (Cho et al., 2011;Jung et al., 2014). 황백 ethyl acetate 분획물의 경우 0.78 - 25㎍/㎖의 농도 범위에서 elastase 저해 활성이 증가하는 것 이 확인되었고 1.06㎍/㎖ 처리 시 약 50% 저해하는 것으로 나타났으며, 이는 추출물보다 약 16배 우수한 저해 효과로 확 인되었다 (Fig. 4B). 특히, 대조군 oleanolic acid를 9.93㎍/㎖ 처리했을 때 약 50% 저해하는 효과보다 분획물의 저해 효 과가 약 9배 높은 것으로 확인되었다 (Fig. 4E). 지표 물질 berberine과 palmatine은 각 7.81 - 250 μM의 농도 범위에서 elastase 저해 활성 실험을 진행하였으나, berberine의 경우 250 μM의 농도에서 14.61%의 저해 효과로 매우 낮은 효과를 보였으며, palmatine의 경우 250 μM의 농도에서 44.53%의 elastase 저해 효과를 나타내어 berberine보다는 비교적 높은 효과임이 확인되었다 (Fig. 4C, D). 그러나, 이와 같은 결과는 황백 추출물과 분획물의 우수한 elastase 저해 효과에 비해 매우 낮은 효과로 황백의 주요 약리 성분인 berberine과 palmatine이 이 효능에 대한 주요한 원인이 아닐 것으로 판단 되며, 두 지표 물질 이외에 추가적으로 elastase 저해 효능을 갖는 유효 물질이 있을 것으로 사료된다. 또한, 이 유효 물질 은 ethyl acetate 분획 과정을 통해 분획되어지는 물질로 황백 ethyl acetate 분획물이 methanol 추출물보다 우수한 elatase 저해 효능을 나타내는데 기여하였을 것으로 여겨지며, 이는 황 백이 주름 개선 기능성 소재로 긍정적인 가능성이 있음을 확 인할 수 있었다.
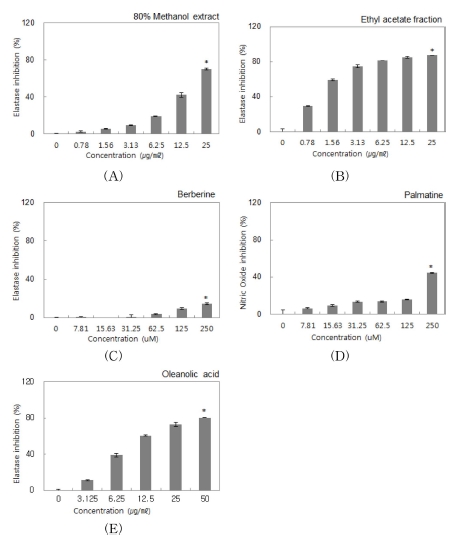
Elastase inhibitions of extract, fraction, berberine, palmatine and oleanolic acid.*Mean values ± SD from triplicate separated experiments are shown (p < 0.05).
References
-
Affuso, F, Mercurio, V, Fazio, C, Fazio, S, (2010), Cardiovascular and metabolic effects of berberine, World Journal of Cardiology, 2, p71-77, 21160701.
[https://doi.org/10.4330/wjc.v2.i4.71]

-
Cannell, RJ, Kellam, SJ, Owsianka, AM, Walker, JM, (1988), Results of a large scale screen of microalgae for the production of protease inhibitors, Planta Medica, 54, p10-14, 3375330.
[https://doi.org/10.1055/s-2006-962319]

-
Cho, EA, Cho, EH, Choi, SJ, Park, KH, Kim, SY, Jeong, YJ, Ku, CS, Ha, BJ, Jang, DI, Chae, HJ, (2011), Screening of antiwrinkle resource from herbal medicinal extracts and stability test of its cosmetic products, Korean Journal of Medicinal Crop, 19, p126-135.
[https://doi.org/10.7783/KJMCS.2011.19.2.126]

-
Chung, SR, Choi, MW, Park, ID, Kim, KH, (2010), Effect of berberine on the proinflammatory cytokines production in mice, Journal of Life Science, 20, p1276-1280.
[https://doi.org/10.5352/JLS.2010.20.8.1276]

-
Creasey, WA, (1979), Biochemical effects of berberine, Biochemical Pharmacology, 28, p1081-1084, 444265.
[https://doi.org/10.1016/0006-2952(79)90308-3]

- DeWitt, DL, Rollins, TE, Day, JS, Gauger, JA, Smith, WL, (1981), Orientation of the active site and antigenic determinants of prostaglandin endoperoxide of synthase in the endoplasmic reticulum, Journal of Biological Chemistry, 256, p10375-10382, 6169719.
-
Green, LC, Wagner, DA, Glogowski, J, Skipper, PL, Wishnok, JS, Tannenbaum, SR, (1982), Analysis of nitrate, nitrite, and[15N] nitrate in biological fluids, Analytical Biochemistry, 126, p131-138, 7181105.
[https://doi.org/10.1016/0003-2697(82)90118-X]

-
Ikram, M., (1975), A review on the chemical and pharmacological aspects of genusBerberis, Planta Medica, 28, p353-358, 1208684.
[https://doi.org/10.1055/s-0028-1097869]

-
Jung, HK, Jang, JH, Ko, JH, Kang, BM, Yeo, JH, Cho, JH, Cho, HW, Bean, CG, Kim, SC, Jung, WS, (2014), Whitening and anti-wrinkle effects of Korean nativeDendrobium moniliformemethanol extract, Korean Journal of Medicinal Crop, 22, p331-338.
[https://doi.org/10.7783/KJMCS.2014.22.5.331]

-
Kim, JB, Shin, WS, Kwon, YI, Bang, BH, (2013), a Isolation andpurification of antibacterial components in cortex phellodendri, The Korean Journal of Food and Nutrition, 26, p547-552.
[https://doi.org/10.9799/ksfan.2013.26.3.547]

- Kim, KH, Ahn, SC, Lee, MS, Kweon, OS, Oh, WK, Kim, MS, Sohn, CB, Ahn, JS, (2003), Adipocyte differentiation inhibitor isolated from the barks ofPhellodendron amurense, Korean Journal of Food Science and Technology, 35, p503-509.
-
Kim, YH, Choi, JE, Hong, JY, Jo, CW, Lee, JM, Kim, SJ, (2013), b A new compound isolation and structure analysis formPhellodendron amurensefruit extract, Journal of the Korean Wood Science and Technology, 41, p269-275.
[https://doi.org/10.5658/WOOD.2013.41.4.269]

-
Kong, WJ, Wei, J, Zuo, ZY, Wang, YM, Song, DQ, You, XF, Zhao, LX, Pan, HN, Jiang, JD, (2008), Combination of simvastatin with berberine improves the lipid-lowering efficacy, Metabolism, 57, p1029-1037, 18640378.
[https://doi.org/10.1016/j.metabol.2008.01.037]

-
Korhonen, R, Lahti, A, Kankaanranta, H, Moilanen, E, (2005), Nitric oxide production and signaling in inflammation, Current Drug Targets-Inflammation and Allergy, 4, p471-479, 16101524.
[https://doi.org/10.2174/1568010054526359]

-
Kraunsoe, JAE, Claridge, TDW, Lowe, G, (1996), Inhibition ofhuman leukocyte and porcine pancreatic elastase by homologuesof bovine pancreatic trypsin inhibitor, Biochemistry, 35, p9090-9096, 8703913.
[https://doi.org/10.1021/bi953013b]

-
Kuo, CL, Chi, CW, Liu, TY, (2004), The anti-inflammatory potential of berberinein vitroandin vivo, Cancer Letters, 203, p127-137, 14732220.
[https://doi.org/10.1016/j.canlet.2003.09.002]

-
Küpeli, E, Koşar, M, Yeşilada, E, Başer, KHC, Baser, C, (2002), A comparative study on the anti-inflammatory, antinociceptive and antipyretic effects of isoquinoline alkaloids from the roots of TurkishBerberisspecies, Life Sciences, 72, p645-657, 12467905.
[https://doi.org/10.1016/S0024-3205(02)02200-2]

- Kwak, DJ, (2004), Antibacterial activities of Phellodendri cortex ontheStreptococcus mutans, Journal of Korean Society for HygienicScience, 10, p99-107.
- Lee, CB, (1993), Illustrated flora of Korea, Hyangmunsa, Seoul, Korea, p488.
- Lee, GH, (2012), Introduction of reference medicinal plant materials, Ministry of Food and Drug Safety, p80-83.
- Lee, JG, Choi, JY, Oh, JS, Jung, HW, Choi, EH, Lee, HS, Kim, JA, Chang, TS, Son, JK, Lee, SH, (2007), Isolation of melanin biosynthesis inhibitory compounds from the phellodendri cortex, Korean Journal of Pharmacognosy, 38, p387-393.
-
Lee, KK, Kim, JH, Cho, JJ, Choi, JD, (1999), a Inhibitory effects of 150 plant extracts on elastase activity and their antiinflammatory effects, International Journal of Cosmetic Science, 21, p71-82, 18505532.
[https://doi.org/10.1046/j.1467-2494.1999.181638.x]

-
Lee, SS, Kim, YH, Lee, MK, (1999), b Inhibition of monoamine oxidase by palmatine, Archives of Pharmacal Research, 22, p529-531, 10549584.
[https://doi.org/10.1007/BF02979165]

-
Manach, C, Morand, C, Crespy, V, Demigne, C, Texier, O, Regerat, F, Remesy, C, (1998), Quercetin is recovered in human plasma as conjugated derivatives which retain antioxidant properties, FEBS Letters, 426, p331-336, 9600261.
[https://doi.org/10.1016/S0014-5793(98)00367-6]

-
Ranke, J, Mölter, K, Stock, F, Bottin-Weber, U, Poczobutt, J, Hoffmann, J, Ondruschka, B, Filser, J, Jastorff, B, (2004), Biological effects of imidazolium ionic liquids with varying chain lengths in acuteVibrio fischeriand WST-1 cell viability assays, Ecotoxicology and Environmental Safety, 58, p396-404, 15223265.
[https://doi.org/10.1016/S0147-6513(03)00105-2]

-
Rice-Evans, CA, Miller, NJ, Paganga, G, (1996), Structureantioxidant activity relationships of flavonoids and phenolic acid, Free Radical Biology and Medicine, 20, p933-956, 8743980.
[https://doi.org/10.1016/0891-5849(95)02227-9]

-
Semwal, DK, Rawat, U, Semwal, R, Singh, R, Singh, GJP, (2010), Anti-hyperglycemic effect of 11-hydroxypalmatine, a palmatine derivative fromStephania glabratubers, Journal of Asian Natural Products Research, 12, p99-105, 20390750.
[https://doi.org/10.1080/10286020903117325]

-
Sharma, JN, Al-Omran, A, Parvathy, SS, (2007), Role ofnitric oxide in inflammatory diseases, Inflammopharmacology, 15, p252-259, 18236016.
[https://doi.org/10.1007/s10787-007-0013-x]

-
Tan, W, Lu, J, Huang, M, Li, Y, Chen, M, Wu, G, Gong, J, Zhong, Z, Xu, Z, Dang, Y, Guo, J, Chen, X, Wang, Y, (2011), Anti-cancer natural products isolated from Chinese medicinal herbs, Chinese Medicine, 6, p27-27, 21777476.
[https://doi.org/10.1186/1749-8546-6-27]

- Yoon, I, Cho, JY, Kuk, JH, Wee, JH, Jang, MY, Ahn, TH, Park, KH, (2002), Identification and activity of antioxidative compounds fromRubus coreanumfruit, Korean Journal of Food Science and Technology, 34, p898-904.
- Yu, HE, Dela Paz, LMM, Bea, YJ, Lee, DH, Park, JS, Kwak, HS, Kim, HK, Lee, JS, (2005), Screening and extraction condition of antiaging bioactive substances from medicinalplants., Journal of the Korean Society of Food Science andNutrition, 34, p1136-1142.