발광플라즈마 처리에 의한 들깨 부위별 항산화 및 Tyrosinase 저해 활성 효과
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The light emitting plasma (LEP) has recently attracted attention as a novel artificial light source for plant growth and functional component enhancement. We investigated the effects of LEP on whitening and antioxidant activities of the plant parts of perilla.
Previously germianted seeds of perilla were cultivated under different light conditions (fluoresce lamp, LED red, blue, white, green, and LEP) in a culture room for 2 months. Parts of perilla were harvested and extracted in 70% EtOH. The extracts were used to detect total phenolic contents, total flavonoid contents, 2,2-diphenyl-1-picrylhydrazyl (DPPH), 2,2’-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (ABTS), reducing power and tyrosinase inhibition activity as indicators of biological activity. Biological activity was highest in seedlings grown under LEP. The total phenolic content was highest in the stems and the total flavonoid content was highest in the roots of perilla exposed to LEP. The DPPH and ABTS radical activity in all the parts of perilla exposed to LEP were higher by approximately three-fold compared to that in the control (fluoresce lamp). The reducing power values of perilla significantly increased after treatment with LEP. In addition, all the extract of perilla plants exposed to LEP promoted the tyrosinase inhibitory activity. These results suggest that LEP can be an important artificial light source for enhancement of biological activity.
LEP could promote whitening and antioxidant activity of perilla.
Keywords:
Perilla frutescens, Antioxidant, Light Emitting Diode, Light Emitting Plasma, Tyrosinase Inhibition Activity서 언
과거의 농업은 1차 산업으로 불리며 단순히 식량을 보급하 는 산업으로 알려졌지만 최근 작물의 다양한 기능성을 증대시 키는 기술을 융복합한 고부가가치 산업인 6차 산업이 대두되 고 있다. 이로 인하여 작물의 품질과 기능성을 높여 고부가가 치 작물을 생산할 수 있는 다양한 부가적 환경스트레스 처리 기술이 발달되고 있다. 환경스트레스 처리 기술 중 광 환경의 조절은 기능성 물질 함량 증대를 위한 가장 효과적인 방법으 로 알려져 있다 (Pérez Balibrea et al., 2008).
작물 재배 시 빛의 세기 및 조도는 식물체 내에서 기능성 성분인 이차 대사산물의 생산 증진과 생리적 변화에 크게 영 향을 주기 때문에 아주 중요하다 (Kopsell and Sams, 2013). 식물은 광에 민감하여 식물의 종에 따라 생육특성이나 유효성 분 함량 증진에 적합한 광질이 다르며, 특히 적색광, 청색광, UV-A (320 - 500㎚), UV-B (280 - 320㎚)는 호르몬 신호과 정의 직접도, 강도에 따라 생리학적 반응 촉발 및 방지하는 중요 역할을 수행한다 (Choi, 2015). 광질은 식물체에서 잎 형태, 생장, 엽록소 합성에 영향을 미치며, 광파장에 따라 식 물 발아, 생장 및 기능성 성분의 함량이 다르게 나타난다 (Wongnok et al., 2008;Choi, 2015). 광환경 조절에 따라 백 수오의 유효성분이 증대되거나 (Seong et al., 2015a), 인삼의 생육양상 및 진세노사이드 함량이 변화되는 (Jang et al., 2016) 등 연구결과가 많이 보고되어졌다.
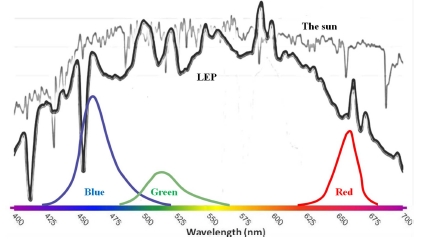
식물공장에서는 태양광을 대신할 광원으로 형광등, 메탈할 로겐램프, 발광다이오드 (LED, light emitting diode) 등을 사 용하여 식물재배를 실시하게 되었으며, 식물의 생장이 광합성 에 의해 이루어지는 점을 주목하여 광합성에 필요한 빛의 파 장을 가하여 식물의 생장 및 기능성을 증가, 촉진시키는 방법 을 도입하였다 (Lee, 2013). 현재 식물생산용 인공광원으로는 LED가 가장 많이 사용되고 있지만, 최근에 자연에 존재하고 있는 태양광의 파장과 가장 가까운 인공광원으로써 발광플라즈 마 (LEP, light emitting plasma)가 각광을 받고 있다 (Fig. 1). LEP는 고체상태의 고밀도 광원으로 전력을 주파수 출력으로 전화하고 소자의 내용물을 플라즈마 상태로 기화시켜서 강력 한 백색광을 내는 발광 원리를 가지고 있다. LED는 적색광 (600 - 700㎚), 청색광 (400 - 500㎚)으로 단일파장이지만, LEP는 적색부터 청색까지의 가시광선 파장을 모두 포함한 스 펙트럼이다. 또한 기존 인공광원 대비 발열이 적고 에너지 효 율과 광 강도가 높으며, 무게는 가볍고, 소형으로 약 50,000시 간을 사용할 만큼 수명이 길다 (Choi, 2015). 기존의 식물공 장에서 사용되고 있는 LED는 LEP 보다는 소비전력량이 높고 (Lee, 2013), 초기 설치비용이 높아 경제성을 맞추기 어려움이 있으며, 형광등 (fluorescent lamp)은 발광효율이 낮아 광포화 점이 높은 작물에는 적합하지 않은 것으로 알려져 있다 (Park et al., 2012). LEP에 대한 연구는 부족한 실정이며, 상추 생육 에 미치는 효과 (Lee, 2013), 황기 생육 및 지표성분인 calycosin과 formonetine 증대 (Choi, 2015)에 관한 연구가 보 고되어져있다.
들깨 (Perilla frutescens L.)는 꿀풀과 일년생 초본으로 한 국, 중국, 일본 등 동아시아 지역에서 재배되고 있으며 (Choung, 2005), 수집지역별로 경장, 마디 수, 주당 분지 수, 화방군수, 화방군장 개화 일수 등 농업적 형질이 다르게 나타 난다 (Seong et al., 2015b). 들깨는 예부터 유료작물로서 미 네랄이 풍부하게 함유되어 있고 특히 필수지방산인 오메가 3 계와 불포화지방산인 리놀렌산의 함유가 높아 다양한 약리효 능을 가지고 있다 (Park et al., 2000;Lee et al., 2004). 또 한 수집지역별로 다양한 종류의 폴리페놀화합물이 들깨에서 분석되었으며, 특히 폴리페놀류 중 한국에서 수집한 들깨는 caffeic acid 3-O-glucoside, rosmarinic acid, luteolin 등의 함량이 높았으며 (Ha et al., 2012;Lee et al., 2013), 중 국과 일본에서 수집한 들깨는 syringic acid, benzoic acid, myrioetin, hesperetin 등의 함량이 높은 것으로 보고되었다 (Seong et al., 2015b). 우리나라에서는 들깨의 잎과 종자를 모 두 식용으로 하고 있어서 농가재배 소득을 향상시켜주는 고소 득 작물 중에 하나이다.
본 연구는 고부가가치 작물을 생산할 수 있는 환경조건인 인공광원의 기능을 확인하고자, 다양한 인공광원을 처리하여 들깨의 생리활성 효능 및 tyrosinase 저해 활성을 검증하고자 한다. 또한 들깨의 유효성분을 극대화 시킬 수 있는 인공광원 을 식물공장에 도입시킬 수 있는 기초자료로 이용하고자 연구 하였다.
재료 및 방법
1. 식물재료
본 연구에 사용된 식물재료는 새엽실들깨 (Perilla frutescens L.)로 멸균한 상토에 파종한 후 광조건을 달리하여 2개월 동안 재배한 뒤에 부위별 수확하였다. 이후 샘플을 건 조하여 분말상태로 만든 후 추출 재료로 사용하였다. 재배조 건은 온도 25.0 ± 3.0℃, 습도 65.0 ± 2.0%를 유지하는 식물배 양실에서 광주기는 16시간 광/8시간 암 조건에서 재배하였다. 재배 시 사용한 광조건은 형광등 (1,700 lux, 23.8 μ㏖/㎡·s, PPF), LED 적색광 (650 ㎚, 28.7 μ㏖/㎡·s, PPF), LED 청 색광 (450㎚, 7.3 μ㏖/㎡·s, PPF), LED 백색광 (470㎚, 49.8 μ㏖/㎡·s, PPF), LED 녹색광 (510㎚, 24.9 μ㏖/㎡·s, PPF), LEP (33.7 μ㏖/㎡·s, PPF, Sunshine 400, Stray Light Optical Technologies, Inc., Scottsburg, IN, USA)로 6개 조 건으로 실험을 수행하였다.
2. 추출 및 농축
인공광원 처리한 들깨를 부위별로 나누어 60℃의 건조기 (VS-1202D4N, VISION SCIENTIFIC Co., Ltd., Daejeon, Korea)에서 샘플의 수분 함량이 5% 이내로 되도록 3일 이상 건조하였다. 건조된 샘플을 막자사발을 이용해 곱게 분쇄하여 70% EtOH (Ethanol, Daejung Chemicals and Metals Co., Ltd., Siheung, Korea) 용매로 3일간 상온에서 추출하였다. 이후 필터페이퍼 (MN020250, HYUNDAI Micro Co., Ltd., Seoul, Korea)에 여과하여 감압농축 (SB1200, EYELA, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)을 실시하였다. 완 전하게 농축된 플라스크에 70% EtOH 용매를 다시 넣고 시 료와 용매가 모두 녹을 때까지 30분 이상 초음파 추출한 후 0.2㎛ 필터 (Minisart SRP15 Syringe Filters, Sartorius Stedim Biotech Co., Goettingen, Germany)에 여과하여, 농도 를 정량하였다.
3. 총 폴리페놀 함량
인공광원 처리한 들깨의 부위별 총 폴리페놀화합물 함량은 Folin-Ciocalteu reagent가 알칼리 조건에서 추출물의 polyphenol성 화합물에 의해 환원된 결과 노란색에서 몰리브 덴 청색으로 발색하는 것을 원리로 Folin-Ciocalteu assay (Singleton and Rossi, 1965)를 이용하여 수행하였다. 인공광원 처리한 들깨 추출물 1.0㎎/㎖에 50㎕의 Folin-Ciocalteu reagent (Sigma-Aldrich Co., St. Louis, MO, USA)를 넣고 섞 어 준 후, 5분 후에 20% sodium carbonate (Junsei Chemical Co., Ltd., Tokyo, Japan) 300㎕를 넣고 섞어주었다. 15분 후 에 증류수 1㎖을 넣은 후 725㎚에서 흡광도를 측정하였다. 표준물질로 gallic acid를 사용하였으며, 검량선을 작성하여 총 폴리페놀화합물 함량을 분석하였다.
4. 총 플라보노이드 함량
인공광원 처리한 들깨의 부위별 총 플라보노이드 함량은 Moreno 등 (2000)의 방법을 변형하여 측정하였다. 시료 100㎕ (10㎎/㎖)에 80% EtOH (Daejung Chemicals and Metals Co., Ltd., Siheung, Korea) 900㎕을 혼합하여 희석한 시료 500㎕에 10% aluminium nitrate (Junsei Chemical Co., Ltd., Tokyo, Japan) 100㎕, 1M potassium acetate (Junsei Chemical Co., Ltd., Tokyo, Japan) 100㎕, 80% EtOH 4.3㎖를 차례로 가하고 40분간 상온에서 반응시킨 후 415㎚ 에서 흡광도를 측정하였다. 표준물질로 quercetin을 사용하였 으며, 검량선을 작성하여 총 플라보노이드 함량을 분석하였다.
5. DPPH radical 소거 활성
인공광원 처리한 들깨의 부위별 DPPH radical 소거 활성은 Blois (1958)의 방법을 변형하여 측정하였다. 각 농도별 시료 100㎕에 0.15 mM DPPH (2,2-diphenyl-1-picrylhydrazyl, Sigma-Aldrich Co., St. Louis, MO, USA) 100㎕를 혼합 하여 상온, 암조건에서 30분간 반응시킨 후, UV-VIS spectrophotometer (Multiskan FC Microplate Photometer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용 하여 517㎚에서 흡광도를 측정하였다. 각 시료 추출물의 DPPH radical 소거 활성은 대조군에 대한 DPPH radical을 50% 소거시키는 추출물의 최소 농도를 RC50 (㎍/㎖)로 나타 내었고, 양성대조군으로는 ascorbic acid (Amresco LLC, Solon, OH, USA)를 사용하였다.
6. ABTS radical 소거 활성
인공광원 처리한 들깨의 부위별 ABTS radical 소거 활성은 Re 등 (1999)에 의해 실시된 ABTS+ radical cation assay 방 법을 변형하여 측정하였다. 7.4 mM ABTS (2,2'-azino-bis-3- ethylbenzothiazoline-6-sulfonic acid, Sigma-Aldrich, St. Louis, MO, USA)와 2.6 mM potassium persulfate (Daejung Chemicals and Metals Co., Ltd., Siheung, Korea)를 1 : 1 비 율로 혼합하여 실온인 암소에서 24시간 방치 후 radical을 형 성시키고, UV-VIS spectrophotometer를 이용하여 732㎚에서 흡광도 값이 0.70 (± 0.03)이 되게 phosphate saline (PBS, pH 7.4)로 희석한 후, 희석용액 990㎕에 시료 10㎕를 가하 여 10분간 반응시킨 후 흡광도를 측정하였다. 각 시료 추출물 의 ABTS radical 소거 활성은 대조군에 대한 ABTS radical 을 50% 소거시키는 추출물의 최소 농도를 RC50 (㎍/㎖)로 나타내었고, 양성대조군으로는 ascorbic acid를 사용하였다.
7. 환원력
인공광원 처리한 들깨의 부위별 환원력 (reducing power)은 Oyaizu (1986)의 방법을 변형하여 측정하였다. 100% methanol 추출물 (1㎎/㎖) 30, 60, 90㎕에 0.2M sodium phosphate buffer (pH 6.6) 500㎕, 1% potassium ferricyanide 500㎕ 를 각각 혼합하여 50℃에서 20분 동안 반응시킨 후, 2.5㎖의 10% trichloroacetic acid를 가하였다. 위 반응액을 1,000 rpm 에서 10분간 원심분리하고, 상층액 500㎕에 증류수 500㎕, 1% ferric chloride 100㎕를 첨가하여 혼합한 반응액의 흡광 도 값을 740㎚에서 측정하였다. 반응액은 Fe3+과 Fe2+ 간의 변형에 의하여 청록색을 나타내며 흡광도 값이 클수록 높은 환원력을 나타낸다.
8. Tyrosinase 저해활성
인공광원 처리한 들깨의 부위별 tyrosinase 저해 활성은 Bernard와 Berthon (2000)의 방법을 변형하여 측정하였다. 기 질 L-dopa (3,4 dihydroxy-L-phehylalanine, Sigma-Aldrich Co., St. Louis, MO, USA) 8.3 mM와 tyrosinase (Sigma- Aldrich Co., St. Louis, MO, USA) 125 U/㎖로 각각 준비하 였다. 96-well plate에 L-dopa와 시료액을 첨가하여 혼합한 후 tyrosinase를 첨가하고 37℃, 암조건 하에서 30분간 반응시켜 micro-plate reader 490㎚에서 흡광도를 측정하였다. 양성 대 조군으로는 kojic acid를 사용하였다.
저해율 (%) = (A- B)/A× 100
- A: 시료를 첨가하지 않았을 때의 흡광도
- B: 시료를 첨가하였을 때의 흡광도
9. 통계처리
모든 데이터는 최소 3반복 수행하여 평균 ±표준편차로 나 타냈으며, 통계처리는 종합 소프트웨어 CROPSTAT v7.2 (International Rice Research Institute, Los Banos, Philippines) 와 분석도구인 Agricultural research (Integrative Solutions LLC., Grosse Pointe Woods, MJ, USA)를 사용하였다. 변이 분석은 completely randomized design (CRD)인 Tukey’s honest significant difference (HSD)로 유의성을 검증하였고, 통계적 유의성을 5% 수준에서 분석하였다.
결과 및 고찰
1. 총 폴리페놀 함량 비교 분석
식물의 폴리페놀 화합물이 많을수록 식물을 섭취 시 체내의 활성산소로부터 조직을 보호하고 항암, 항균, 항산화 활성이 높다고 보고되어져있다 (Duval and Shetty, 2001;Lee et al., 2005). 다양한 인공광원을 처리한 들깨 (Perilla frutescens L.) 부위별 총 폴리페놀 함량을 분석한 결과, 잎, 줄기, 뿌리 전체 부위에서 LEP를 처리하였을 때 총 폴리페놀 함량이 높 았으며, 특히 들깨의 줄기 부위에서 53.1 ± 0.5㎎·GAE/g으로 가장 높은 함량을 보였다 (Fig. 2). 청색광과 UV-A 파장 영 역을 포함하고 있는 LEP를 이용하여 재배한 연구에서도 황기 의 총 폴리페놀 함량이 36.0㎎·GAE/g으로 가장 높은 결과를 나타냈고 (Choi, 2015), 청색광을 처리한 시간이 지날수록 메 밀 새싹의 총 폴리페놀 함량이 점차적으로 증가하는 결과를 나타냈다 (Lee, 2013). LED 청색광의 파장 영역을 포함하고 있는 LEP 파장의 기능은 식물의 생리활성을 증진시키는 LED 청색광의 기능과 유사함을 보인 것으로 사료된다.
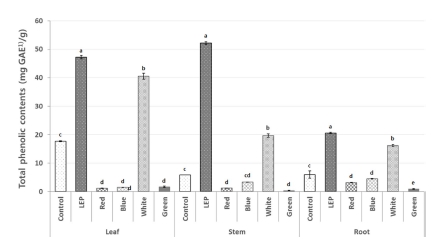
Total phenolic contents of different parts of perilla treated with different light condition.1)GAE; Gallic acid equivalents. Each value is means ± standard deviation of three replicate tests. The data were statistically analyzed using Tukey’s honest significant difference (HSD), and differences were assessed to be significant at 5% level of probability (p < 0.05).
들깨 부위별 추출물의 총 폴리페놀 함량은 인공광원별로 다 르게 나타났다. 들깨 잎에서는 적색광을 처리하였을 때 1.2 ± 0.1㎎·GAE/g으로 가장 낮은 결과를 나타냈고 청색광 (1.5 ± 0.1㎎·GAE/g), 녹색광 (1.7 ± 0.2㎎·GAE/g), 형광등 (17.7 ± 0.2㎎·GAE/g), 백색광 (40.5 ± 1.1㎎·GAE/g), LEP (47.2 ± 0.6㎎·GAE/g) 순으로 높은 함량을 보였다. 줄기에서는 녹색 광을 처리했을 때 0.39 ± 0.1㎎·GAE/g으로 가장 낮은 결과를 나타냈고, 적색광 (1.27 ± 0.1㎎·GAE/g), 청색광 (3.37 ± 0.1㎎· GAE/g), 형광등 (5.85 ± 0.01㎎·GAE/g), 백색광 (19.71 ± 0.5㎎ ·GAE/g), LEP (52.13 ± 0.5㎎·GAE/g) 순으로 높은 함량을 보 였다. 뿌리에서는 녹색광을 처리했을 때 0.95 ± 0.1㎎·GAE/g 으로 가장 낮은 결과를 나타냈고, 적색광 (3.19 ± 0.1㎎·GAE/ g), 청색광 (4.5 ± 0.1 ㎎·GAE/g), 형광등 (6.00 ± 1.3㎎·GAE/ g), 백색광 (16.14 ± 0.4㎎·GAE/g), LEP (20.61 ± 0.3㎎·GAE /g) 순으로 높은 함량을 보였다 (Fig. 2).
2. 총 플라보노이드 함량 비교 분석
다양한 인공광원을 처리한 들깨 부위별 총 플라보노이드 함 량을 분석한 결과, 잎, 줄기, 뿌리 전체 부위에서 LEP를 처리 하였을 때 총 플라보노이드 함량이 높았다. 특히 총 플라보노 이드 함량은 LEP 처리한 들깨의 뿌리 추출물에서 2.3 ± 0.0㎎·QE/g으로 가장 높은 함량을 보였으며, LED 적색광과 청색광 처리 시 들깨의 뿌리에 총 플라보노이드 함량이 높은 것으로 나타났다 (Fig. 3). 이는 들깨 수확 시 영양분이 뿌리 로 저장된 것으로 사료되며 LED 청색광 처리 시 뿌리의 생 리활성이 증진되는 Seong 등 (2015a)의 연구와 비슷한 결과 를 나타냈다. 또한 LEP 광처리를 한 황기의 뿌리에서도 지표 성분 isoflavone 유도체인 formononetin은 형광등보다 1.7배 증가되었으며, calycosin은 47.2배 증가한 결과와 일치하였다 (Choi, 2015).
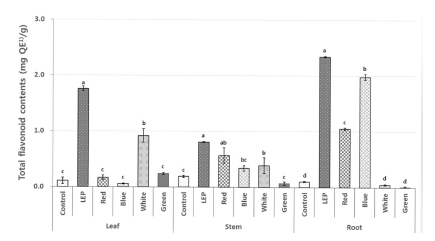
Total flavonoid contents of different parts of perilla treated with different light condition.1)QE; Quercetin equivalents. Each value is means ± standard deviation of three replicate tests. The data were statistically analyzed using Tukey’s honest significant difference (HSD), and differences were assessed to be significant at 5% level of probability (p < 0.05).
들깨 부위별 추출물의 총 플라보노이드 함량은 인공광원별로 다르게 나타났다. 들깨 잎에서는 청색광을 처리했을 때 0.1 ± 0.0㎎·QE/g으로 가장 낮은 결과를 나타냈고, 형광등 (0.1 ± 0.1㎎·QE/g), 적색광 (0.2 ± 0.0㎎·QE/g), 녹색광 (0.2 ± 0.0㎎ ·QE/g), 백색광 (0.9 ± 0.1㎎·QE/g), LEP (1.8 ± 0.0㎎·QE/g) 순 으로 높은 함량을 보였다. 줄기에서는 녹색광을 처리했을 때 0.1 ± 0.0㎎·QE/g으로 가장 낮은 결과를 나타냈고, 형광등 (0.2 ± 0.0㎎·QE/g), 청색광 (0.3 ± 0.1㎎·QE/g), 백색광 (0.4 ± 0.1㎎ ·QE/g), 적색광 (0.6 ± 0.1㎎·QE/g), LEP (0.8 ± 0.0㎎·QE/g) 순으로 높은 함량을 보였다. 뿌리에서는 녹색광을 처리했을 때 0.0 ± 0.1㎎·QE/g으로 가장 낮은 결과를 나타냈고, 백색광 (0.1 ± 0.1㎎·QE/g), 형광등 (0.1 ± 0.0㎎·QE/g), 적색광 (1.1 ± 0.0㎎ ·QE/g), 청색광 (2.0 ± 0.1㎎·QE/g), LEP (2.3 ± 0.0㎎·QE/g) 순 으로 높은 함량을 보였다 (Fig. 3).
3. DPPH 및 ABTS radical 소거 활성 비교 분석
Radical은 활성산소로 체내에 쌓이면 주름, 색소침착 등 노 화 현상이 생긴다. 이런 활성산소 생산을 억제하기 위해 항산 기능을 평가하는 연구가 가장 많이 이루어져 있고, 대표적인 실험방법인 DPPH와 ABTS로 각 시약으로 만들어내는 활성산 소를 소거하는 정도를 확인하여 항산화 활성을 검정할 수 있 다 (Blois, 1958;Re et al., 1999).
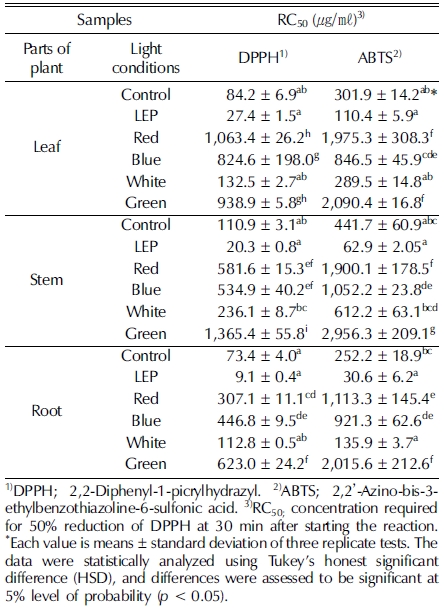
다양한 인공광원을 처리한 들깨 부위별 DPPH radical 소거 활성과 ABTS radical 소거 활성은 RC50 값으로 나타내어 비 교하였으며, 그 결과는 비슷한 경향을 나타냈다. DPPH와 ABTS radical 소거능은 들깨 부위별로만 봤을 때는 비슷한 수준으로 뿌리, 잎, 줄기 순으로 높았으며, 인공광원별로는 LEP, 형광등, 백색광, 청색광, 적색광, 녹색광 순으로 활성이 높은 것으로 나타냈다. 특히 LEP를 처리한 들깨의 뿌리 추출 물이 DPPH radical 소거 활성은 9.1 ± 0.4㎍/㎖이고, ABTS radical 소거활성은 30.6 ± 6.2㎍/㎖로 가장 높았다. 다른 인공 광원 LED를 처리한 들깨 부위별 항산화력을 평가한 결과 인 공광원을 처리하지 않은 대조구보다 오히려 항산화력이 떨어 지는 것을 확인할 수 있었다 (Table 1). 이는 Choi (2015)가 연구한 황기의 DPPH radical 소거 활성과 비슷한 결과를 보 였으며, LEP 처리 시 가장 높은 활성을 나타냈고 LED 녹색 광 처리 시 가장 낮은 활성을 나타냈다.
4. 환원력 비교 분석
다양한 인공광원을 처리한 들깨 부위별 환원력을 검정한 결 과, 들깨의 잎, 줄기, 뿌리에서 대조군인 형광등을 처리한 들 깨보다 LEP를 처리한 들깨에서 가장 높은 환원력을 나타났다. 다른 LED 광원을 처리한 들깨는 형광등 처리와 비교 했을 때 환원력이 떨어지는 것을 확인할 수 있었다 (Fig. 4).
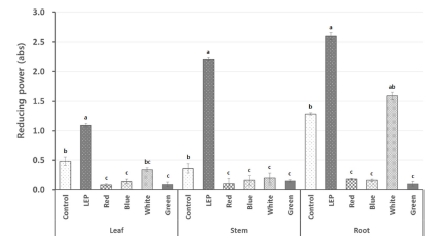
Reducing power from different parts of perilla treated with different light condition.Each value is means ± standard deviation of three replicate tests. The data were statistically analyzed using Tukey’s honest significant difference (HSD), and differences were assessed to be significant at 5% level of probability (p < 0.05).
들깨 부위별 환원력 비교 분석 결과, 잎에서는 LEP 광 처리 시 1.1 ± 0.0 abs로 가장 높은 환원력을 보였으며, 형광등 (0.5 ± 0.1 abs), 백색광 (0.3 ± 0.0 abs), 청색광 (0.1 ± 0.0 abs), 녹색광 (0.1 ± 0.0 abs), 적색광 (0.1 ± 0.0 abs) 순으로 낮은 함 량을 보였다. 줄기에서는 LEP 광 처리 시 2.2 ± 0.0로 가장 높은 흡광도 (absorbance, abs)값을 보였고, 형광등 (0.3 ± 0.1 abs), 백색광 (0.2 ± 0.1 abs), 청색광 (0.2 ± 0.1 abs), 녹색광 (0.2 ± 0.1 abs), 적색광 (0.1 ± 0.1 abs) 순으로 낮은 값을 보였 다. 뿌리에서는 다른 부위에 비해 환원력이 높았으며 형광등 (1.3 ± 0.0 abs)와 비교했을 때 LEP (2.6 ± 0.1 abs)와 백색광 (1.59 ± 0.1 abs) 처리 시 환원력이 높아졌으며 적색광 (0.2 ± 0.0 abs), 청색광 (0.2 ± 0.0 abs), 녹색광 (0.1 ± 0.0) 처 리 시 환원력이 낮아졌다 (Fig. 4).
5. Tyrosinase 저해활성 비교 분석
다양한 인공광원을 처리한 들깨 부위별 tyrosinase 저해활성 결과 농도가 증가함에 따라 tyrosinase 저해활성이 증가되었으 며, LEP 광 처리 시 가장 높은 저해활성을 나타났다 (Fig. 5). 개암풀 (Kim et al., 2010), 골쇄보 (Tan and Lim, 2015), 아 스포델루스 (Petrillo et al., 2016), 흰목이버섯 (Lee et al., 2016) 등 다양한 식물과 균류에서 폴리페놀과 플라보노이드 함량이 높을수록 항산화 성분이 증대하여 색소 침착을 완화시 킨다는 연구결과가 많이 보고되어져있다. 또한 LEP 광처리를 한 황기의 뿌리는 플라보노이드 성분이 증가되었고, 이에 따 라 tyrosinase 저해활성도 LED를 처리한 것보다 2배 이상 높 았다 (Choi, 2015). 반면에 LED와 LEP 환경조건을 조성하여 수중산호 Acropora formosa와 Stylophora pistillata를 증식한 결과 PSII최대 양자 수율의 평균값은 LEP 처리구에서 수중산 호 두 종 모두 높은 함량을 나타냈지만, 생장률과 단백질 함 량은 LED 처리구에서 두 종 모두 높은 결과를 나타냈다. 또 한 표준식생지수 (NDVI)는 종별로 상이한 결과를 나타냈다. 이는 본 연구진이 사용한 LED와 LEP 파장이 다르고, 수중산 호 종별 광 이용력이 달라 생육결과가 상이하게 나타난 것으 로 사료된다 (Rocha et al., 2013).
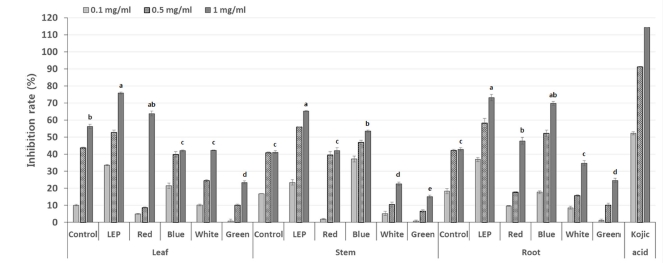
The inhibition rate of tyrosinase activity from different parts of perilla treated with different light condition.Each value is means ± standard deviation of three replicate tests. The data were statistically analyzed using Tukey’s honest significant difference (HSD), and differences were assessed to be significant at 5% level of probability (p < 0.05).
들깨 부위별 tyrosinase 저해 활성 비교 분석 결과 잎에서는 추출물의 농도가 1㎎/㎖ 일 때 대조구인 형광등 (56.2 ± 1.3%) 보다 LEP (75.8 ± 0.6%), 적색광 (42.0 ± 0.5%)로 높게 나타났으며 백색광 (42.2 ± 0.2%), 청색광 (42 ± 0.5%), 녹색광 (23.5 ± 0.8%) 순으로 대조구보다 낮은 tyrosinase 저해활성 을 보였다. 줄기의 추출물의 농도가 1㎎/㎖ 일 때 형광등 (41.2 ± 0.8%)와 비교하였을 때 LEP (65.2 ± 0.4%), 청색광 (53.5 ± 0.7%), 적색광 (42.1 ± 1.7%) 처리 시 tyrosinase 저해 활성이 높게 나타났으며 백색광 (22.6 ± 1.0%), 녹색광 (15.2 ± 0.9%) 처리 시 tyrosinase 저해활성이 낮게 나타났다. 뿌리의 추출물의 농도가 1㎎/㎖ 일 때 형광등 (42.8 ± 0.9%)과 비교 하였을 때 LEP (73.2 ± 1.9%), 청색광 (69.8 ± 1.2%), 적색광 (47.8 ± 2.0%) 처리 시 tyrosinase 저해활성이 높게 나타났으며 백색광 (34.7 ± 1.5%), 녹색광 (24.6 ± 1.2%) 처리 시 tyrosinase 저해활성이 낮게 나타났다 (Fig. 5).
본 연구 결과, LEP를 처리한 들깨에서 총 폴리페놀과 플라 보노이드 함량, DPPH와 ABTS 라디컬 소거능, 환원력, tyrosinase 저해 활성 결과가 다른 인공광원 (형광등, LED 적 색광, 청색광, 백색광, 녹색광)을 처리하였을 때보다 높은 항 산화 활성을 나타내는 것을 확인하였다.
식물은 생육특성이나 유효성분 함량 증진에 적합한 광질, 광 파장이 있다. LEP는 태양광과 가장 유사한 인공광원으로 UVA, UV-B 뿐만 아니라 극소량의 적외선 또한 포함되어 있어 식물생육에 필요한 새로운 인공광원으로 괄목할만한 가치가 있다. 결론적으로 LEP 인공광원을 이용하여 멸종위기 식물, 노지재배가 어려운 식물, 식물공장 산업 등 다양한 방면으로 폭넓게 활용할 수 있을 것으로 사료된다.
감사의 글
본 연구는 2015년도 강원대학교 학술연구조성비(과제번호 :12050131)로 수행된 연구결과로 이에 감사드리며, 부분적으로 강원대학교 한방바이오연구소의 지원을 받아 연구하였습니다.
References
-
Bernard, P, Berthon, JY, (2000), Resveratrol: An original mechanism on tyrosinase inhibition, International Journal of Cosmetic Science, 22, p219-226, 18503477.
[https://doi.org/10.1046/j.1467-2494.2000.00019.x]

-
Blois, MS, (1958), Antioxidant determinations by the use of a stable free radical, Nature, 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Choi, JH, (2015), Growth characteristics, physiological activities and gene expression related flavonoid biosynthesis by artificial light sources treatment inAstragalus membranaceus, Master Thesis, Kangwon National University, Korea, p20-39.
- Choung, MG, (2005), Comparison of major characteristics between seed perilla and vegetable perilla, Korean Journal of Crop Science, 50, p171-174.
-
Duval, B, Shetty, K, (2001), The stimulation of phenolics and antioxidant activity in pea(Pisum sativum) elicited by genetically transformed anise root extract, Journal of Food Biochemistry, 25, p361-377.
[https://doi.org/10.1111/j.1745-4514.2001.tb00746.x]

-
Ha, TH, Lee, JH, Lee, MH, Lee, BW, Kwon, HS, Park, CH, Shim, KB, Kim, HT, Baek, IY, Jang, DS, (2012), Isolation and identification of phenolic compounds from the seeds ofPerilla frutescensL. and their inhibitory activities against α- glucosidase and aldose reductase, Food Chemistry, 135, p1397-1403, 22953872.
[https://doi.org/10.1016/j.foodchem.2012.05.104]

-
Jang, IB, Yu, J, Kweon, KB, Suh, SJ, (2016), Effect of controlled light environment on the growth and ginsenoside content ofPanax ginsengC. A. Meyer, Korean Journal of Medicinal Crop Science, 24, p277-283.
[https://doi.org/10.7783/KJMCS.2016.24.4.277]

-
Kim, JY, Oh, KY, Kim, JY, Ryu, HW, Jeong, TS, Park, KH, (2010), Polyphenols displaying tyrosinase inhibition from the seed ofPsoralea corylifolia, Journal of the Korean Society for Applied Biological Chemistry, 53, p427-432.
[https://doi.org/10.3839/jksabc.2010.066]

-
Kopsell, DA, Sams, CE, (2013), Increases in shoot tissue pigments, glucosinolates, and mineral elements in sprouting broccoli after exposure to short-duration blue light from light emitting diodes, Journal of the American Society for Horticultural Science, 138, p31-37.
[https://doi.org/10.21273/JASHS.138.1.31]

- Lee, CO, Li, CH, Lim, JD, Yu, CY, (2004), Regenerationability in germplasms ofPerilla frutescens. Korean Journal ofMedicinal, Crop Science, 12, p500-507.
- Lee, HJ, (2013), Effects of artificial light sources on the growthand quality of butterhead lettuce., Master Thesis, University ofSeoul, Korea, p19-40.
-
Lee, JH, Park, KH, Lee, MH, Kim, HT, Seo, WD, Kim, JY, Baek, IY, Jang, DS, Ha, TJ, (2013), Identification, characterisation,and quantification of phenolic compounds in the antioxidant activity-containing fraction from the seeds of Korean perilla (Perilla frutescens) cultivars, Food Chemistry, 136, p843-852, 23122135.
[https://doi.org/10.1016/j.foodchem.2012.08.057]

-
Lee, KH, Park, HS, Yoon, IJ, Shin, YB, Baik, YC, Kooh, DH, Kim, SK, Jung, HK, Sim, MO, Cho, HW, Jung, WS, Kim, MS, (2016), Whitening and anti-wrinkle effects ofTremella fuciformisextracts, Korean Journal of Medicinal Crop Science, 24, p38-46.
[https://doi.org/10.7783/KJMCS.2016.24.1.38]

- Lee, SO, Lee, HJ, Yu, MH, Im, HG, Lee, IS., (2005), Total polyphenol contents and antioxidant activities of methanol extracts from vegetables produced in Ullung island, Korean Journal of Food Science and Technology, 37, p233-240.
-
Moreno, MIN, Isla, MI, Sampietro, AR, Vattuone, MA, (2000), Comparison of the free radical-scavenging activityof propolis from several regions of Argentina, Journal of Ethnopharmacology, 71, p109-114, 10904153.
[https://doi.org/10.1016/S0378-8741(99)00189-0]

-
Oyaizu, M., (1986), Studies on products of browning reactions: Antioxidative activities of products of browning reaction prepared from glucosamine, Japanese Journal of Nutrition, 44, p307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Park, JE, Park, YG, Jeong, BR, Hwang, SJ, (2012), Growth and anthocyanin content of lettuce as affected by artificial light source and photoperiod in a closed-type plant production system, Korean Journal of Horticultural Science and Technology, 30, p673-679.
[https://doi.org/10.7235/hort.2012.12020]

- Park, WK, Park, BH, Park, YH, (2000), Encyclopedia of food and food science, Shinkang Publisher, Seoul, Korea, p234.
-
Pérez Balibrea, S, Moreno, DA, García Viguera, C, (2008), Influence of light on health-promoting phytochemicals of broccoli sprouts, Journal of the Science of Food and Agriculture, 88, p904-910.
[https://doi.org/10.1002/jsfa.3169]

-
Petrillo, AD, González-Paramás, AM, Era, B, Medda, R, Pintus, F, Santos-Buelga, C, Fais, A, (2016), Tyrosinase inhibition and antioxidant properties ofAsphodelus microcarpusextracts, BMC Complementary and Alternative Medicine, 16, p453-453, 27829416.
[https://doi.org/10.1186/s12906-016-1442-0]

-
Re, R, Pellegrini, N, Proteggente, A, Pannala, A, Yang, M, RiceEvans, C., (1999), Antioxidant activity applying an improved ABTS radical cation decolorization assay, Free Radical Biologyand Medicine, 26, p1231-1237, 10381194.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Rocha, RJM, Pimentel, T, Serôdio, J, Rosa, R, Calado, R, (2013), Comparative performance of light emitting plasma(LEP) and light emitting diode(LED) in ex situ aquaculture of scleractinian corals, Aquaculture, 402, p38-45.
[https://doi.org/10.1016/j.aquaculture.2013.03.028]

- Seong, ES, Hwang, IS, Choi, JH, Lee, JG, Yoo, JH, Ahn, YS, Park, CB, Yu, CY, (2015), a Enhanced biomass and biological activity of ‘Hasuo’(Polygonum multiflorumThunberg) grown under LED light, Australian Journal of Crop Science, 9, p168-174.
-
Seong, ES, Seo, EW, Chung, IM, Kim, MJ, Kim, HY, Yoo, JH, Choi, JH, Kim, NJ, Yu, CY, (2015), b Growth characteristics and phenol compounds analysis of collectedPerilla frutescensresources from China and Japan, Korean Journal of Medicinal Crop Science, 23, p132-137.
[https://doi.org/10.7783/KJMCS.2015.23.2.132]

- Singleton, VL, Rossi, JA, (1965), Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents, American Journal of Enology and Viticulture, 16, p144-158.
-
Tan, JBL, Lim, YY, (2015), Antioxidant and tyrosinase inhibition activity of the fertile fronds and rhizomes of three differentDrynariaspecies, BMC Research Notes, 8, p468-468, 26395256.
[https://doi.org/10.1186/s13104-015-1414-3]

-
Wongnok, A, Piluek, C, Techasilpitak, T, Tantivivat, S, (2008), Effects of light emitting diodes on micropropagation ofPhalaenopsisorchids, Acta Horticulturae, (788), p149-156.
[https://doi.org/10.17660/ActaHortic.2008.788.18]