마우스 정모세포주에서 스티렌에 대한 삼백초 에탄올 추출물의 보호 효과
†Corresponding author: (Phone) +82-43-871-5783E-mail) khd0303@rda.go.kr
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was performed to evaluate the protective effect of Saururus chinensis ethanol extract (SCE) against styrene toxicity in mouse spermatocyte cells [GC-2spd (ts) cell line].
Cytotoxicity in mouse spermatocyte cells was measured using 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay. Generation of reactive oxygen species (ROS) was determined using 2’,7’-dichlorodihydrofluorescein diacetate (DCF-DA) assay. Semi-quantitative reverse transcription polymerase chain reaction (RT-PCR) and western blotting were performed to quantify the mRNA and protein expression levels, resepectiviely, of stress or apoptosis-related genes including p21, p53, heat shock protein 70 (Hsp70), heat shock protein 90 (Hsp90), Bax, Bcl-2, and caspase-3. The results of the MTT assay showed that 50 μg/ml SCE did not affect cell viability. ROS generation in mouse spermatocyte cells increased by treatment with 100 μM styrene, and decreased by co-treatment with SCE. SCE repressed the mRNA expression of stress-related genes, which increased by styrene treatment. In addition, SCE inhibited the apoptosis of mouse spermatocyte cells by ameliorating mRNA and protein levels of apoptotic genes that were altered by styrene treatment.
These results suggest that SCE may alleviate styrene toxicity in mouse spermatocyte cells by reducing ROS stress and regulating genes related to styrene toxicity.
Keywords:
Saururus chinensis, Apoptosis, Reproductive Toxicity, Spermatocyte, Styrene서 언
일명 환경호르몬이라고 불리는 내분비 장애물질 (endocrine disrupting chemicals, EDCs)은 화학구조가 생체호르몬과 유사 하여 내분비계를 가진 모든 생물에서 호르몬의 합성, 분비, 체 내수송, 결합, 작용 또는 분해에 개입하여 생식기능의 이상, 성 비균형의 파괴, 호르몬 분비의 불균형, 면역기능 저해, 신경계 마비, 간독성, 폐기능 저하, 유방암 및 전립선암 증가 등의 다 양한 질환을 초래하는 것으로 알려져 있다 (Degen and Bolt, 2000;Guillette et al., 1995;Kim et al., 2005). 그 중 스티 렌 (styrene)은 투명한 용기로 주로 사용되며, 폴리스티렌에 거 품을 넣은 스티로폼은 컵라면 용기를 비롯한 보온용기나 충격 흡수용으로 광범위하게 사용되고 있다. 새집증후군의 주된 원 인의 하나로 지목되고 있기도 한 스티렌은 합성수지, 합성고 무, 섬유 강화 플라스틱 제조 등 너무나 다양한 용도로 사용 되고 있기 때문에 지속적인 노출 감시와 방지 등 다양한 예방 대책과 더불어 스티렌의 사용을 줄이고 노출에 대항하여 인체 를 보호해 줄 방어물질 탐색 연구가 필요한 실정이다.
삼백초 [Saururus chinensis (Lour.) Baill]는 예로부터 해독 하는 힘이 강해 급성식중독이나 농약중독 등에 효과가 있는 것으로 알려져 있으며, 최근 연구에 따르면 카드뮴과 같은 중 금속 독성에 대한 방어 효능이 있는 것으로 밝혀졌으므로 (Lee et al., 2001;Park et al., 2004), 유력한 후보물질이라 할 수 있다.
지금까지 스티렌이 사람 및 실험동물에 미치는 영향에 대하 여 연구되어 왔고, 특히 생식기관 독성에 관한 연구들은 많이 있었지만 (Han et al., 2007;Lindbohm, 1993;Teramoto and Horiguchi, 1981), 이런 독성을 개선해줄 수 있는 물질에 대한 연구는 많이 미흡한 실정이다. 따라서 본 연구는 마우스 의 수컷 정모세포주를 가지고, 스티렌이 생식세포에 미치는 영 향과 그에 대한 삼백초의 생식세포 보호 효과를 밝히고자 시 행하였다.
재료 및 방법
1. 세포주 배양
본 연구에 사용한 마우스 정모세포주 (spermatocyte cell line) GC-2spd (ts)는 American Type Culture Collection (ATCC, Rockvile, MD, USA)에서 구입하였다. 세포주는 10% fetal bovine serum (FBS, HyClone Laboratories Inc., Logan, UT, USA)과 100 units/㎖ penicillin과 100㎍/㎖ streptomycin이 포함된 Dulbecco’s modified Eagle’s medium (DMEM, high glucose, HyClone Laboratories Inc., Logan, UT, USA) 배양액으로 배양하였으며, 37℃, 5% CO2 조건 (MCO-2OAIC, Sanyo Electric Co., Ltd., Osaka, Japan)을 유지하였다.
2. 추출물 제조
실험에 사용된 삼백초 [Saururus chinensis (Lour.) Baill] 시료는 한국생약협회에서 구입하였다. 구입한 시료는 1㎤ 크 기로 절단하고 70% ethanol에 담가 80℃ 조건에서 3번 환류 추출 후 농축하고 동결건조하여 분말화하고, DMSO/PBS을 50/50로 혼합한 용액에 100㎎/㎖ 농도로 용해하여 실험에 사 용하였다.
3. 세포 생존율 측정
마우스 정모세포주 GC-2spd (ts)에서 시료에 의한 세포생존 율 변화를 측정하기 위하여 3-(4,5-dimethylthiazol-2-yl)-2,5- diphenyltetrazolium bromide (MTT) 분석법을 이용하였고, 실 험방법은 Mosmann (1983)과 Han 등 (2016)의 방법을 변형 하여 사용하였다. 96-well plate에 37℃, 5% CO2 조건에서 배양한 세포를 5 × 103 cells/well의 농도로 분주하였다. 세포를 배양기에서 24시간 동안 안정화시킨 후 스티렌 (100 μM)과 삼백초 에탄올 추출물 (10, 25, 50, 100㎍/㎖)을 처리하였고, 추출물 용매 처리구 (vehicle)에는 DMSO를 0.05%로 처리하 였다. 24시간 37℃, 5% CO2 조건에서 더 배양하고 MTT 시 약을 0.5㎎/㎖로 3시간 처리하였다. 배지를 버리고, 생성된 formazan을 DMSO로 녹여 microplate reader (BIO-TEK, Winooski, VT, USA)를 이용하여 540㎚에서 흡광도를 측정 하였다.
4. 활성산소 (reactive oxygen species, ROS) 생성량 측정
마우스 정모세포주 GC-2spd (ts)의 세포내 산화적 손상 보 호 효과를 측정하기 위하여 2’,7’-dichlorohydrofluorescein diacetate (DCF-DA, Sigma-Aldrich Co., St. Louis, MO, USA) assay를 하였다. GC-2spd (ts) 세포를 96-well plate에 5 × 103 cells/well의 농도로 분주하여 24시간 동안 세포를 안정 화시켰다. 스티렌 (100 μM), 삼백초 에탄올 추출물 (10, 25, 50㎍/㎖), vitamin C (100 μM) 및 추출물 용매 (vehicle, DMSO 0.025%)를 각각 전처리하고 24시간 배양 후 serumfree media에 20 μM DCF-DA와 0.25 mM probenecid를 혼합 하여 5% CO2, 37℃ incubator에서 40분간 처리하고, Krebs- Henseleit buffer (KHB)로 교체하여 incubator에서 1시간 동안 반응시킨 뒤 microplate reader (BIO-TEK, Winooski, VT, USA)를 이용하여 형광도 (exitation 485㎚ / emission 535㎚) 를 측정하였다.
5. Semi-quantitative reverse transcription polymerase chain reaction (RT-PCR)
마우스 정모세포 유전자들의 발현 정도를 조사하기 위해 스 티렌 (100 μM), 삼백초 에탄올 추출물 (10, 25, 50㎍/㎖)을 30분 동안 처리하여 배양한 세포로부터 Trizol reagent를 처리 하여 total RNA를 추출하고 역전사 kit (Mbi Fermentas, Hanover, MD, USA)를 이용하여 cDNA를 제조한 다음, 동량 의 cDNA를 PCR로 증폭시켰다. 유전자 증폭을 위한 primer sequences를 Table 1에 나타내었다. 1% agarose gel에서 전기 영동하고, ethidium bromide (Et-Br) 로 염색한 뒤 UV 상에 서 관찰하여 분석하였다.
6. 단백질 발현 분석
Western blotting을 이용하여 마우스 정모세포의 세포사멸 관 련 단백질 (Bax, Bcl-2, caspase-3)의 발현 정도를 확인하였다. 스티렌 (100 μM), 삼백초 에탄올 추출물 (10, 25, 50㎍/㎖) 을 24시간 동안 처리하여 배양한 세포를 RIPA cell lysis buffer을 이용하여 용해시키고, 13,000 rpm으로 4℃에서 20분 간 원심분리하여 단백질만 포함하고 있는 상층액을 얻었다. 정 량한 단백질 20㎍을 10% SDS-PAGE에 전기 영동시킨 후 polyvinylidene difluoride (PVDF) membrane으로 옮겨 Bax, Bcl-2, caspase-3, β-actin에 대한 1차 항체와 반응시킨 후 2차 항체인 horseradish peroxidase-conjugated anti-rabbit 또는 anti-mouse IgG를 반응시키고 enhanced chemiluminescence (ECL) detection reagents (West-Zol Plus, iNtRON, Seoul, Korea)를 사용하여 단백질의 발현정도를 확인하였다.
7. 통계 처리
모든 실험은 3번 이상 반복 측정하여 평균 ±표준편차 (means ± SD)로 표기하였으며, 처리간 유의성은 Statistical Package for Social Science 통계 패키지 프로그램 (18.0, SPSS Inc., Chicago, IL, USA)으로 Student’s t-test로 검정하 여 p-value 값이 0.05 미만일 때 통계적으로 유의하다고 판정 하였다.
결과 및 고찰
1. 마우스 정모세포주에서 스티렌과 삼백초 추출물의 처리농 도 결정
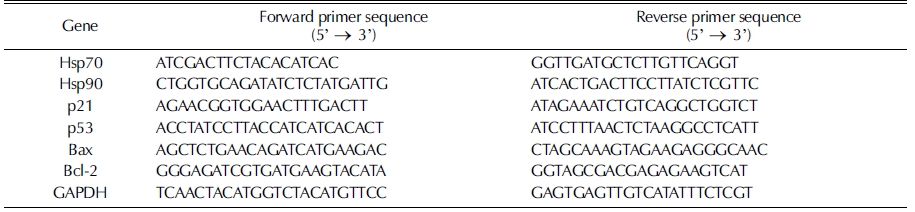
GC-2spd (ts) 세포에서 스티렌과 삼백초 에탄올 추출물의 처리농도를 결정하기 위해 MTT assay를 수행하였다. MTT assay는 MTT 물질이 살아있는 세포의 미토콘드리아에 존재하 는 succinate dehydrogenase와 반응하여 나타나는 색의 변화로 서 미토콘드리아의 활성을 통해 세포 생존율을 측정할 수 있는 방법이다 (Elingold et al., 2008;Lee et al., 2009;Mosmann, 1983). 스티렌과 삼백초 에탄올 추출물의 GC-2spd (ts) 세포생 존율을 측정한 결과는 Fig. 1과 같다. 예비실험을 통해 GC- 2spd (ts) 세포에서 스티렌은 100 μM까지 세포생존율에 영향 을 미치지 않음을 확인하였다. GC-2spd (ts) 세포에 스티렌 100 μM과 함께 삼백초 에탄올 추출물을 농도별로 처리한 결 과, 10, 25, 50㎍/㎖까지는 스티렌만을 처리한 대조군과 세포 생존율에 큰 차이를 보이지 않았다. 하지만 100㎍/㎖의 삼백 초 에탄올 추출물을 처리했을 때 대조군에 비해 약 30%의 세 포사멸율을 나타내어 50㎍/㎖을 삼백초 에탄올 추출물의 최 대 처리농도로 설정하였다.
Effect of styrene and Saururus chinensis ethanol extract (SCE) on cell viability in GC-2spd (ts) cells.GC-2spd (ts) spermatocytes viability was measured by MTT assay. Data are representative of three independent experiments as means ± SD. Statistical differences (**p < 0.01) compared to cell cultures stimulated with styrene in the absence of Saururus chinensis ethanol extract are indicated.
2. 스티렌에 의한 활성산소종 생성에 삼백초 추출물이 미치 는 영향 확인
대부분의 활성산소종 (reactive oxygen species, ROS)들은 세포에 손상을 줄 수 있으며 세포의 항상성을 변화시켜 세포 생존율에 큰 영향을 끼치는 것으로 알려져 있다 (Abdollahi et al., 2014;Song and Lee, 2015). 또한, 세포내 생성된 ROS 는 비형광을 나타내는 DCF-DA를 산화시켜 형광물질인 DCF 로 전환시키는데 이렇게 전환된 형광물질의 양은 세포내 형성 된 ROS의 양으로 간주되고 있다 (Wang and Joseph, 1999).
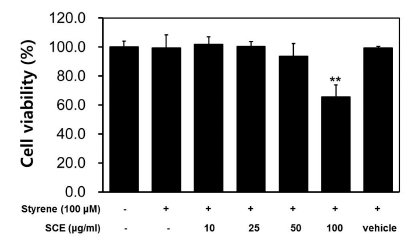
본 연구에서는 GC-2spd (ts) 세포에서 스티렌에 의한 활성 산소종 (ROS) 증가에 삼백초 에탄올 추출물이 미치는 영향을 확인하기 위해 DCF-DA assay를 실시하였다. 그 결과, 스티렌 100 μM를 처리한 처리구에서는 대조구 대비 약 2배 이상 증 가한 DCF formation을 보였지만, 스티렌 100 μM와 삼백초 에탄올 추출물을 농도별로 처리하였을 때는 농도 의존적으로 ROS가 감소하는 것을 확인할 수 있었다. 특히, 스티렌과 천연 항산화 물질인 vitamin C를 동시에 처리한 처리구에서는 약 30% 정도의 ROS 감소 효과를 보였는데, 삼백초 에탄올 추출 물 50㎍/㎖ 처리구에서는 vitamin C 처리구보다 높은 ROS 감소 결과를 나타내었다. 이에 따라 삼백초 에탄올 추출물은 우 수한 ROS 생성 억제 효과를 가지는 것으로 보여진다 (Fig. 2). 이러한 삼백초 에탄올 추출물의 세포내 ROS 생성 억제능은 스티렌에 의해 유도될 것으로 예상되는 세포 내 손상을 억제 하는 한 요인으로 생각할 수 있다.
Effects of SCE on reactive oxygen species (ROS) generation in GC-2spd (ts) cells.ROS generation was monitored by measuring DCF fluorescence. The Data are representative of three independent experiments as means ± SD. Statistical differences (**p < 0.01) compared to cell cultures stimulated with styrene in the absence of Saururus chinensis ethanol extract are indicated.
3. 스티렌에 의한 유전자 발현에 삼백초 추출물이 미치는 영향 확인
스티렌에 의해 유발되는 세포 독성에 삼백초 에탄올 추출물 이 미치는 영향을 확인하기 위해, 스트레스 또는 세포사멸 관 련 유전자들의 발현을 semi-quantitative RT-PCR (reverse transcription polymerase chain reaction)로 확인하였다. Semiquantitative RT-PCR은 RNA로 역전사 효소를 이용하여 cDNA를 만들고, 만들어진 cDNA를 중합효소연쇄반응으로 증 폭하여 유전자 발현을 확인할 수 있는 방법이다. 앞선 실험에 서 스티렌은 GC-2spd (ts) 세포 내 ROS를 증가시키고, 그 증가폭을 삼백초 에탄올 추출물이 농도 의존적으로 감소시킨 다는 것을 확인하였다.
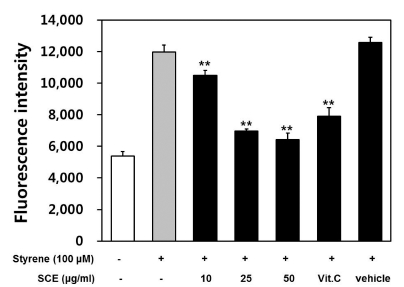
ROS 스트레스가 전사인자인 p53을 통해 p21 유전자의 발 현을 증가시키면, 늘어난 p21 단백질은 세포분열을 억제하고 세포노화를 유도하는 것으로 알려져 있다 (Pant et al., 2012). 또한 주로 p21 유전자는 p53에 의해서 발현이 유도되지만, p53과는 독립적인 활성경로도 보고되고 있다. 따라서 스티렌 이 처리된 GC-2spd (ts) 세포에서 삼백초 에탄올 추출물에 의 한 p21과 p53 유전자 발현 양상 변화를 확인하였다. 그 결과, p53 유전자의 발현 양상은 삼백초 에탄올 추출물의 농도증가 에 따라 큰 차이를 보이지 않았다 (Fig. 3B). 하지만 p21 유 전자의 발현은 삼백초 에탄올 추출물의 농도증가에 따라 유의 한 감소를 보였다 (Fig. 3A). 이는 삼백초 에탄올 추출물이 GC-2spd (ts) 세포에서 스티렌에 의해 증가된 p21 유전자의 발현을 억제함으로서 스티렌에 의한 세포 독성을 억제하는 것 으로 판단할 수 있다. 또한 삼백초 에탄올 추출물이 p53 유전 자 발현에는 영향을 주지 않았으므로 p53와 독립적인 경로로 p21 유전자의 발현에 영향을 미치는 것으로 생각할 수 있다.
Effects of SCE on the expression of stress-related or apoptosis-related genes in GC-2spd (ts) cells.RT-PCR was performed to confirm mRNA expression of stressrelated or apoptosis-related genes (p21, p53, hsp70, hsp90, Bax, Bcl-2). The band intensity of the genes was measured by densitometry, normalized to GAPDH and presented as the means ± SD (n = 3). Statistical differences (**p < 0.01) compared to cell cultures stimulated with styrene in the absence of Saururus chinensis ethanol extract are indicated.
그와 함께 대표적인 스트레스 관련 유전자인 Hsp70, Hsp90 유전자의 발현 변화도 확인해보았다. 열충격 단백질 (heat shock protein, HSP)은 온도가 갑자기 상승했을 때 세포에서 합성되어지는 단백질로 생각되었으나, 고온 이외에도 여러 가 지 다양한 자극, 스트레스에 의해 발현이 증가하여 세포사멸 의 여러 기작에 광범위하게 관여하여 억제하는 것으로 알려져 있다 (Wang et al., 2014). 따라서 세포 내 스트레스 정도를 가늠하는 지표로 열충격 단백질의 발현 정도를 활용할 수 있 다. 스티렌이 처리된 GC-2spd (ts) 세포에서 삼백초 에탄올 추출물에 의한 Hsp70과 Hsp90 유전자 발현 양상 변화을 확 인해 본 결과, Hsp70, Hsp90 유전자 모두 스티렌 100 μM 처리시 대조군에 비해 발현이 급격히 증가하였으며 이에 삼백 초 에탄올 추출물을 농도별 (10, 25, 50㎍/㎖)로 처리하자 점 차적으로 발현이 감소했다.
Hsp90 유전자는 스티렌 처리군 대비 삼백초 10㎍/㎖ 농도 부터 농도 의존적으로 유의한 감소를 보였으며, 마찬가지로 Hsp70 유전자도 10㎍/㎖ 농도부터 감소했지만 50㎍/㎖ 에서 유의적인 차이를 보였다 (Fig. 3C, 3D). 이와 같은 결과는 GC-2spd (ts) 세포에서 삼백초 에탄올 추출물이 스티렌으로 유 도된 스트레스를 줄여주는데 효과가 있음을 의미한다고 할 수 있다.
세포사멸 관련 인자들의 유전자 발현 변화도 확인하였다. 세 포사멸 유도는 Bax (세포사멸유도인자)와 Bcl-2 (세포사멸억 제인자)의 비율 (Bax/Bcl-2) 증가로 인해 이들 사이의 균형이 깨어지게 되어 세포사멸이 유발되는 것으로 알려져 있다 (Donovan and Cotter, 2004; Rossé et al., 1998). 따라서 스 티렌으로 유도된 GC-2spd (ts) 세포에서 삼백초 에탄올 추출 물에 의한 Bcl-2과 Bax 유전자 발현 양상 변화를 확인하였다. 그 결과, 삼백초 에탄올 추출물은 스티렌에 의해 늘어난 Bax 유전자 발현을 농도 의존적으로 억제하였으며 스티렌에 의해 줄어든 Bcl-2 유전자 발현은 농도 의존적으로 촉진시켰다 (Fig. 3E, 3F). 스티렌에 의한 Bcl-2 유전자 발현 변화가 Bax 만큼 크지 않은 것으로 보아 스티렌이 초기에는 Bcl-2 유전자 보다는 Bax 유전자에 크게 영향을 미치는 것을 알 수 있었다. 이러한 결과는 스티렌에 의해 유도된 세포사멸이 삼백초 에탄 올 추출물에 의해 억제됨을 의미한다고 할 수 있다.
4. 스티렌에 의한 단백질 발현에 삼백초 추출물이 미치는 영향 확인
일반적인 세포사멸 기작은 caspase라 불리는 단백질 분해효 소에 의해 세포 내 단백질이 분해되면서 신호가 전달되는 일 련의 과정으로 여러 종류의 caspase들이 세포사멸에 관여하며, 그 중 caspase-3가 최종적으로 활성화되어 세포사멸을 유도하 고, Bax와 Bcl-2의 비율 (Bax/Bcl-2)의 증가가 caspase-3의 활성화에 중요한 역할을 하는 것으로 알려져 있다 (Alnemri, 1997;Li et al., 1997).
이에 따라 본 연구에서는 단백질 수준에서 세포사멸 관련 단백질 (Bax, Bcl-2, caspase-3)의 증감을 확인하고자 western blotting을 진행하였다. 그 결과, GC-2spd (ts) 세포에 스티렌 100 μM 처리 시, Bax의 발현은 증진되고 Bcl-2의 발현은 억 제되어 Bax/Bcl-2 비율이 증가하고, 삼백초 에탄올 추출물을 처리하면 농도 의존적으로 Bax의 발현은 억제되고 Bcl-2의 발 현은 증진되어 Bax/Bcl-2 비율이 감소하는 것을 확인하였다 (Fig. 4A). 스티렌은 mRNA와 마찬가지로 단백질 수준에서도 Bcl-2보다는 Bax의 발현에 영향을 주어 Bax/Bcl-2 비율을 증 가시키고, 삼백초 에탄올 추출물도 Bcl-2보다는 Bax의 발현에 영향을 주어 Bax/Bcl-2 비율을 감소시켰다 (Fig. 3E, 3F, 4A). 이러한 결과는 스티렌과 삼백초 에탄올 추출물이 Bcl-2 유전자보다는 Bax 유전자에 주로 영향을 미치기 때문이라고 판단할 수 있다. 또한 스티렌 처리에 의해 caspase-3가 증가하 지만, 삼백초 에탄올 추출물을 농도별로 처리하면 25㎍/㎖ 이 상에서 농도 의존적으로 caspase-3가 감소하는 것을 확인하 였다. 특히 50㎍/㎖ 농도 이상에서 caspase-3가 현저히 감소 하였다 (Fig. 4B).
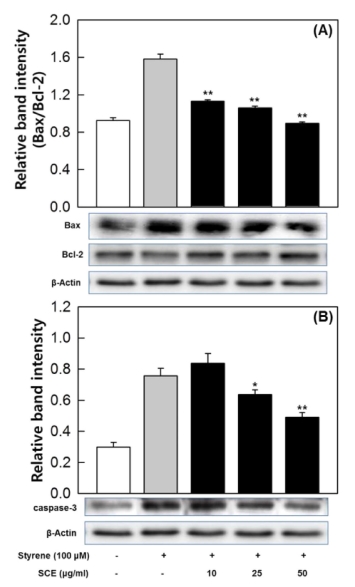
Effects of SCE on the expression of apoptosis-related proteins in GC-2spd (ts) cells.Western blottings for the proteins (Bax, Bcl-2, caspase-3) associated with apoptosis were performed on the lysates of GC-2spd (ts) spermatocytes. The levels of β-actin were used as an internal standard in quantification of Bax, Bcl-2, and caspase-3. Statistical differences (*p < 0.05, **p < 0.01) compared to cell cultures stimulated with styrene in the absence of Saururus chinensis ethanol extract are indicated.
실험결과를 종합해보면 GC-2spd (ts) 세포에서 스티렌 100 μM 처리시 Bax 발현의 증진과 Bcl-2 발현의 감소로 Bax/Bcl-2 비율이 증가되고, 그로 인해 caspase-3가 증가하여 세포사멸이 유도되며, 삼백초 에탄올 추출물은 스티렌에 의한 Bax와 Bcl-2의 발현 변화를 저해하여 Bax/Bcl-2 비율을 감소 시키고, 그로 인해 caspase-3가 감소되어 세포사멸을 억제하는 것으로 판단된다.
지금까지 스티렌이 사람 및 실험동물의 생식기관에 미치는 영향에 대한 연구들은 있었지만 (Han et al., 2007;Lindbohm, 1993;Teramoto and Horiguchi, 1981), 이런 독성을 개선해줄 수 있는 물질에 대한 연구는 전무한 실정이므로 본 연구에서 는 스티렌이 마우스 수컷 정모세포에 미치는 영향과 그에 대 한 삼백초의 정모세포 보호 효과를 확인하였다. 마우스 정모 세포에서 스티렌은 ROS를 증가시켜 산화 스트레스를 유발하 며, 세포노화 또는 세포사멸 기작을 활성화시킨다는 결과를 관 련 유전자들의 mRNA, 단백질 발현 변화를 통해 확인하였다. 이와 같은 실험결과는 다른 내분비 장애물질인 비스페놀A에 의한 이전 연구내용과 일치하였다 (Kim et al., 2015). 그리고 삼백초 에탄올 추출물은 스티렌에 의해 증가된 ROS를 농도 의존적으로 감소시켰으며, 스티렌에 의한 유전자들의 발현 변 화를 저해하였다. 특히 스티렌에 의해 증가된 Bax/Bcl-2 비율 과 caspase-3를 삼백초 에탄올 추출물이 감소시켜 세포사멸을 억제하였다. 결과적으로 삼백초 에탄올 추출물은 스티렌에 의 한 세포 독성을 억제하여 마우스 정모세포를 보호하는 효과를 보였다. 좀 더 심도 있는 연구를 위해서는 스티렌에 대해 정 모세포 보호 활성을 가지는 삼백초 유래 물질을 탐색하고, 그 물질의 세포사멸 억제 기작 작용점을 찾는 연구와 함께 in vivo 연구도 중요하다고 하겠다.
감사의 글
본 연구는 농촌진흥청 연구사업(세부과제번호: PJ00938502) 의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Abdollahi, M, Moridani, MY, Aruoma, OI, Mostafalou, S, (2014), Oxidative stress in aging., Oxidative Medicine and Cellular Longevity, Hindawi Publishing Corporation, 2014, p876834, (cited by 2017 Jan 23).
[https://doi.org/10.1155/2014/876834]

-
Alnemri, ES, (1997), Mammalian cell death protease: A family of highly conserved aspartate specific cysteine proteases, Journal of Cellular Biochemistry, 64, p33-42, 9015752.
[https://doi.org/10.1002/(SICI)1097-4644(199701)64:1<33::AID-JCB6>3.0.CO;2-0]

-
Degen, GH, Bolt, HM, (2000), Endocrine disruptors: Update on xenoestrogens, International Archives of Occupational and Environmental Health, 73, p433-441, 11057411.
[https://doi.org/10.1007/s004200000163]

- Donovan, M, Cotter, TG, (2004), Control of mitochondrial integrity by Bcl-2 family members and caspase-independent cell death. Biochimica et Biophysica Acta(BBA)-, Molecular Cell Research, 1644, p133-147, 14996498.
-
Elingold, I, Isollabella, MP, Casanova, MB, Celentano, AM, Pérez, C, Cabrera, JL, Diez, RA, Dubin, M, (2008), Mitochondrial toxicity and antioxidant activity of a prenylated flavonoidisolated fromDalea elegans, Chemico-Biological Interactions, 171, p294-305, 18078919.
[https://doi.org/10.1016/j.cbi.2007.10.005]

- Guillette, LJ Jr, Crain, DA, Rooney, AA, Pickford, DB, (1995), Organization versus activation: The role of endocrinedisrupting contanminants(EDCs) during embryonic development in wildlife, Environmental Health Perspectives, 103, Supplement 7p157-164, 8593864.
-
Han, HM, Kwon, YS, Kim, MJ, (2016), Antioxidant and antiproliferative activity of extracts from water chestnut(Trapa japonicaFlerow), Korean Journal of Medicinal Crop Science, 24, p14-20.
[https://doi.org/10.7783/KJMCS.2016.24.1.14]

-
Han, JH, Choi, CS, Kim, MY, Chun, YJ, (2007), Differential gene expression by styrene in rat reproductive tissue, Journal of Toxicology and Environmental Health, Part A, 70, p1259-1263, 17654243.
[https://doi.org/10.1080/15287390701434414]

-
Kim, HD, Sohn, SH, Kim, JS, Lee, HJ, Park, CG, Ahn, YS, Lee, SW, Kim, YO, (2015), Protective effect ofPanax ginsengethanol extracts against bisphenol A(BPA) in mouse male germ cells, Korean Journal of Medicinal Crop Science, 23, p138-143.
[https://doi.org/10.7783/KJMCS.2015.23.2.138]

- Kim, JH, Kim, JK, Do, BR, Lee, CJ, Yoon, YD, (2005), Evaluation of bisphenol a induced apoptosis in sertoli cell-lines, Development and Reproduction, 9, p115-121.
- Lee, HS, Koo, YC, Lee, KW, (2009), Suppressive activity of extract ofTermialia chebulaRetz. on hepatic fibrosis, Korean Journal of Food Science and Technology, 41, p597-601.
- Lee, JH, You, IS, Lee, KN, Ji, JO, Han, DS, Shin, MK, Jeong, SI, Oh, HJ, Back, SH, (2001), The protective effects of the extract ofSaururus chinesisagainst cadmium induced cytotoxicity(II), Journal of Toxicology and Public Health, 17, p173-180.
-
Li, P, Nijhawan, D, Budihardjo, I, Srinivasula, SM, Ahmad, M, Alnemri, ES, Wang, X, (1997), Cytochrome c and dATPdependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade, Cell, 91, p479-489, 9390557.
[https://doi.org/10.1016/S0092-8674(00)80434-1]

- Lindbohm, ML, (1993), Effects of styrene on the reproductive health of women: A review, IARC Scientific Publications, 127, p163-169, 8070863.
-
Mosmann, T., (1983), Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays, Journal of Immunological Methods, 65, p55-63, 6606682.
[https://doi.org/10.1016/0022-1759(83)90303-4]

-
Pant, V, Quintás-Cardama, A, Lozano, G, (2012), The p53 pathway in hematopoiesis: Lessons from mouse models, implications for humans, Blood, 120, p5118-5127, 23018641.
[https://doi.org/10.1182/blood-2012-05-356014]

- Park, SJ, Yoo, HJ, Choi, HS, Seo, BY, Yang, SH, Kim, YH, Jeong, JY, Lee, KN, (2004), Effects ofSaururus chinensisBaill extracts on anticancer activity and cadmium induced cytotoxicity, Korean Journal of Oriental Preventive Medical Society, 8, p81-98.
-
Rossé, T, Olivier, R, Monney, L, Rager, M, Conus, S, Fellay, I, Jansen, B, Borner, C, (1998), Bcl-2 prolongs cell survival after Bax-induced release of cytochromec, Nature, 391, p496-499, 9461218.
[https://doi.org/10.1038/35160]

-
Song, JH, Lee, SR, (2015), Anti-oxidant and inhibitory activityon NO production of extract and its fractions fromRosadavuricaPall. leaves, Korean Journal of Medicinal Crop Science, 23, p20-26.
[https://doi.org/10.7783/KJMCS.2015.23.1.20]

-
Teramoto, K, Horiguchi, S, (1981), Distribution, elimination and retention of styrene in rats, The Journal of Toxicological Sciences, 6, p13-18, 7265326.
[https://doi.org/10.2131/jts.6.13]

-
Wang, H, Joseph, JA, (1999), Quantifying cellular oxidativestress by dichlorofluorescein assay using microplate reader, Free Radical Biology and Medicine, 27, p612-616, 10490282.
[https://doi.org/10.1016/S0891-5849(99)00107-0]

-
Wang, X, Chen, M, Zhou, J, Zhang, X, (2014), HSP27, 70 and 90, anti-apoptotic proteins, in clinical cancer therapy, (Review) International Journal of Oncology, 45, p18-30, 24789222.
[https://doi.org/10.3892/ijo.2014.2399]