석화의 캘러스 유도 및 메틸 자스모네이트 처리에 의한 항염증 활성 증진
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Callus cultivation has the advantage of producing a large amount of tissue of a plant in a laboratory regardless of the environment, for extracting an active substance. In the present study, callus formation was induced in the leaves of the succulent plant Adenium obesum (Forssk.) Roem & Schult. After callus cultivation, anti-inflammatory activity tests were conducted, because leaves and stems of A. obesum have been reported to possess biological activity.
In order to induce callus formation, various concentrations of plant growth factors, such as kinetin, naphthaleneacetic acid (NAA), 6-benzyladenine (BA), and indole-3-acetic acid (IAA) were added to MS solid medium. The maximum callus proliferation was induced by mixed medium consisting of NAA (2㎎/ ℓ ) and BA (1㎎/ ℓ ). In addition, an elicitor was added to the medium under optimal conditions for initiating suspension culture. After suspension culturing, the activities of the callus extracts were compared and analyzed. The cytotoxicity and anti-inflammatory activity tests revealed that the anti-inflammatory activity of the callus extract and the content of phenolic compounds were elevated after treatment of the callus culture with the elicitior.
A. obesum callus might be considered as potential source of biologically active anti-inflammatory material.
Keywords:
Adenium obesum (Forssk.) Roem & Schult, Anti-Inflammatory Activity, Callus Induction, Elicitation, Elicitor, Polyphenol, Suspension Culture서 언
석화 [사막의 장미, Adenium obesum (Forssk.) Roem & Schult, A. obesum]는 협죽도과에 속하는 쌍떡잎식물이며 아열 대기후 지역인 남부 아프리카와 아라비아 반도에서 자생하며 학명은 최초로 발견된 장소인 예멘의 ‘Aden (아덴)’에서 유래 되었다고 한다 (Hossain et al., 2014). 석화는 사막이나 수분 이 적고 건조한 날씨의 지역에서 생존하기 위해 줄기와 잎에 많은 양의 수분을 저장하고 있는 다육식물이다 (Dimmitt and Hanson, 1991).
현재까지 석화에 관한 연구로는 잎과 줄기 등 식물체에 포 함된 성분인 cardiac glycosides, pregnanes 등이 항암효과를 나타내는 것으로 보고된 바 있다 (Yamauchi and Abe, 1990). 석화의 잎과 줄기, 꽃의 에탄올 추출물에 사람의 피부 암세포를 억제하는 항암 성분이 포함되어 있음을 확인하였으 며 (Hoffmann and Cole, 1977) 석화 줄기 껍질 메탄올 추출 물이 박테리아에 대한 항균활성을 가진다는 연구 결과가 확인 되고 있어 (Tijjani et al., 2011) 석화를 다양한 생리활성을 가지는 소재로서 활용할 수 있을 것으로 기대된다.
유효성분을 가진 석화를 산업적으로 얻기 위해서는 균일한 품질을 가진 식물체 확보가 필요하지만, 석화는 열대 및 아열 대 지역 외에서는 안정적인 식물 수확이 어려운 상황이다. 이 에 따라 지역, 온도, 재배조건 등 생육환경에 관계없이 석화를 대량으로 생산하기 위한 방안으로 식물체 조직배양을 이용할 수 있다.
식물조직배양은 체세포 유도, 대량증식 및 형질전환식물체 개발 등에 이용 되었으며 (Brown and Thorpe, 1995), 식물조 직으로부터의 세포 배양은 식물의 유효물질의 생산성 향상에 큰 기여를 하는 미래지향적인 기술이다 (Hussain et al., 2013). 특히 캘러스 배양은 우기에는 잎이 있지만 낮은 온도 에 약하여 생육이 저하되며 건기에는 낙엽이 지고 휴면에 들 어가는 석화의 종 특성을 벗어나서 환경에 관계없이 기내에서 식물의 캘러스를 대량으로 생산하여 유효물질을 얻을 수 있는 이점이 있다 (Dimmitt and Hanson, 1991). 또한 모종 식물체 와 달리 캘러스는 주로 다당류로 이루어진 1 차 세포벽을 가 진 구조로 되어있으므로 효율적으로 다당류를 얻을 수 있는 원료이다 (Talmadge et al., 1973).
하지만 지금까지는 식물 조직배양 기술을 이용하여 석화의 캘러스를 유도하고 배양하는 방법에 대한 연구나, 세포 유래 천 연물질의 효능에 대한 연구는 미미한 실정이다 (Chukwujekwu et al., 2002). 석화의 캘러스 유도 및 배양을 위한 배지의 조 성과 이에 필요한 식물 성장 호르몬에 대한 연구가 진행되지 않았지만 일반적으로 캘러스 배양을 위해서는 생장조절제인 cytokinin과 auxin류의 호르몬이 매우 중요하다. Cytokinin류 는 식물의 세포 분열을 촉진하고 옥신과 작용하여 조직 배 양 시 캘러스 발생을 촉진시키는 것으로 알려져 있으며 6- benzylaminopurine (BA), 6-furfurylamino purin (kinetin) 등의 종류가 있다 (Kang, 2008; Kim and Lee, 2012). 이 중 BA 는 식물체 내에서 생합성 되는 식물 호르몬으로서 조직 배양 시 화학적으로 안정성을 나타내는 것으로 알려져 있다. 옥신의 종류에는 indole-3-acetic acid (IAA), 1-naphthaleneacetic acid (NAA), 2,4-dichlorophenoxyacetic acid (2,4-D) 등의 종류가 있으며 체세포 배의 생장을 억제하거나 캘러스 형성을 유도하 는 것으로 알려져 있다 (Back, 2001). 이에 따라 본 실험에서 는 다양한 농도의 생장조절제를 첨가하여 석화 캘러스 분열 및 배양에 이용하였다.
외부 스트레스로 인한 식물의 방어 반응에 따라 생성되는 물질을 피토알렉신 (phytoalexin)이라 한다. 이러한 화합물은 이차대사산물로서 항생물질과 같은 역할을 하며 인체에 생리 활성 물질로 작용한다. 이들 물질의 생성을 유도하는 화합물 혹은 자극들을 elicitor 라고 하는데 (Takayama et al., 1977; Back, 2001), elicitor로 사용되는 대표적인 물질인 methyl jasmonate (MeJA)는 막 지질에 존재하는 리놀렌산으로부터 유 래하는 식물 신호전달분자로 곤충, 균류, 병원체에 대한 식물 방어를 활성화시키는 물질로 알려져 있다 (Farmer and Ryan, 1990). 이러한 elitior를 캘러스 현탁 배양액에 접종하여 배양 한다면 이차대사산물의 생성을 유도하여 피부미용에 대한 효 능 및 활성이 좋은 물질을 축적한 캘러스 배양액을 얻을 수 있을 것으로 사료된다.
이에 본 연구에서는 석화의 잎으로부터 캘러스 분열을 유도 함으로써 캘러스 분열, 증식의 최적 배지 조성을 확인하였다. 또한 최적 조건의 배지 조성으로 현탁 배양한 후 캘러스를 80% methyl alcohol (MeOH) 용매로 추출하여 해당 추출물 의 세포독성 평가 및 항염 활성테스트를 진행하였다. 그리고 이차대사산물을 증대시키기 위한 방법으로 MeJA를 elicitor로 적용하여 이차대사산물 양의 증대 및 항염 효능의 증진을 확 인하였다.
재료 및 방법
1. 실험재료
실험에 사용한 석화 [Adenium obesum (Forssk.) Roem & Schult]는 심폴 ( www.simpol.co.kr )과 꽃씨몰 ( www. flowerseedmall. com )에서 2014년 10월 10일과 2014년 12월 15일에 구입 하였으며, 지상부의 길이가 약 10㎝인 모종을 구입하여 10℃ 이상, 16 h 동안 광 처리, 8 h 동안 암 처리 조건에서 생육 시키면서 꽃을 피우기 전의 어린 잎을 채취하여 배양에 사용 하였다.
2. 조직 살균 및 절편체 치상
잎에 묻은 흙을 흐르는 물에 세척한 후 70% 에탄올 (Daejung Chemicals and Metals Co., Ltd., Siheung, Korea) 에서 1 분 동안 1 차 살균하였다. 멸균한 증류수에서 3 회 정도 세척한 뒤 1% sodium hypochlorite (NaOCl, Daejung Chemicals and Metals Co., Ltd., Siheung, Korea)에서 20 분 동안 2 차 살균 후 증류수로 3 회 반복 세척한다. 살균된 잎 조직을 1㎠ 크기로 자른 뒤 Table 1과 같은 조성의 5가 지 조건배지 위에 치상하였다.
3. 캘러스 분열 유도 및 현탁 배양
살균된 잎 조직으로부터 석화 캘러스를 유도하기 위해 MS (Duchefa Biochemie, Haarlem, Netherlands) 배지에 2 - 3% sucrose와 0.4% gelrite (Duchefa Biochemie, Haarlem, Netherlands)를 첨가하였고, Table 1과 같이 서로 다른 농도의 kinetin (Sigma-Aldrich Co., St. Louis, MO, USA), NAA (Sigma-Aldrich Co., St. Louis, MO, USA), BA (Sigma- Aldrich Co., St. Louis, MO, USA)와 IAA (Sigma-Aldrich Co., St. Louis, MO, USA)를 식물성장 조절제로 사용하였다. 배지의 pH는 5.55 - 5.59 범위 안으로 조정하였으며 25℃ 식물 배양기 (JSCC-250 CP, JS Research Inc., Gongju, Korea)에 서 암처리 하여 캘러스를 유도하였다.
유도된 석화 캘러스를 2 주 간격으로 4 회 이상 계대 배양 하여 세포를 증식시킨 후 8 주 후부터는 4 주 간격으로 계대 배양하여 체세포를 유도하였다. 현탁 배양은 최적배지로 선정 한 NAA (2㎎/ℓ)와 BA (1㎎/ℓ)를 첨가한 MS 기본 배양 액 (pH 5.5) 250㎖를 함유한 500㎖의 플라스크에 캘러스 1 g을 접종하였고, 멸균된 알루미늄 호일로 밀봉한 후 교반기 (VS-203DX-4, VISION SCIENTIFIC Co., Ltd., Daejeon, Korea)에서 120 rpm의 속도로 배양하였다.
배양실 온도를 20.0 ± 3.0℃로 조정하였고, 14 시간 동안 광 처리, 10 시간 동안 암 처리로 광주기를 조절하여 1 - 2 주 동안 1 차 배양하였다. 그 후 동일한 배양 조건에서 상기 현 탁 배지를 250㎖로 1 차 증량 하였고, 캘러스증식 속도에 맞 춰 현탁 배지 250㎖를 2 차 증량 진행하며 총 4 - 6 주간 실시하였다.
배지 조성에 따른 캘러스 생장률 측정은 현탁 배양한 세포를 Whatman filter paper (Whatman Co., Maidstone, England)로 여과하여 배양액과 분리한 후, 건조오븐을 사용하여 65℃에서 3 일 동안 세포를 건조하여 건조중량 값을 측정 및 비교하였다.
Elicitor 처리가 개체 생장에 미치는 영향을 확인하기 위해 석화 캘러스를 250㎖ 현탁 배양액에 접종할 때 100 μM MeJA (Sigma-Aldrich Co., St. Louis, MO, USA)를 1% 처 리 하였고 이 후 기존 현탁 배양 조건과 동일한 조건에서 배 양하였다. 1 차 증량과 2 차 증량 시에도 상기 동일한 양의 elicitor를 적용하였다.
4. 캘러스 추출물 시료제조
현탁 배양 종료 후 배양액과 캘러스를 분리하여 80% (w/v) 메탄올 (Daejung Chemicals and Metals Co., Ltd., Siheung, Korea)에 1% (w/w) 함량으로 48 h 동안 침지 추출하였다. 추 출액을 Whatman filter paper로 여과한 후, 50℃에서 rotary vacuum evaporator (NVC-2200, EYELA, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)를 이용하여 농축하였다. 해당 농축액 을 동결건조기 (Sam Won Industry, Seoul, Korea) 로 건조하 여 파우더로 제조 하였고, 이를 dimethyl sulfoxide (DMSO, Sigma-Aldrich Co., St. Louis, MO, USA)에 농도 별로 녹여 항염증 활성 측정 실험의 시료로 사용하였다.
5. 세포 독성 및 항염증 활성 측정
항염 활성 측정에 앞서, 세포독성 평가 실험을 실시하였다. 염증 악화 등과 같은 자극 없이 면역 활성 효과 여부를 확인 하기 위해 대식세포 (RAW 264.7)에 대한 독성을 측정하였다. WST (water soluble tetrazolium salt) 분석법은 세포의 증 식이나 세포 생존율을 측정하는 실험법으로 세포 내의 mitochondrial dehydrogenase 활성을 측정함으로써 세포의 생 존을 확인할 수 있다 (Hoper, 1997). 수용성의 tetrazolium salt (WST-1)는 살아있는 세포와 반응하여 발색물질인 오렌지 색 수용성의 formazan을 생성하며, 이를 흡광도로 측정하여 세포의 생존율을 확인할 수 있다. 세포 RAW 264.7를 96 well plate에 1 × 105 cells/well 씩 분주하였으며, 정확하게 동일 한 양을 분주하기 위해 hemacytometer (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였다.
석화 캘러스 80% 메탄올 추출물과 elicitor (MeJA) 처리한 석화 캘러스 80% 메탄올 추출물 시료를 RAW 264.7 세포가 분주된 well에 처리 하고 24 h 동안 배양하였다. EZ-cytox cell viability assay kit (WST reagent, US Biomax, Inc., Derwood, MD, USA)를 사용하여 반응시키고, microplate spectrophotometer (Synergy HT, BIO-TEK, Winooski, VT, USA)를 이용하여 450㎚에서 흡광도를 측정하였다. 시료 추 출물의 세포생존율은 시료를 처리하지 않은 음성대조군에 대 한 세포생존율을 백분율로 나타내었고, 양성대조군으로는 dexamethasone (Sigma-Aldrich Co., St. Louis, MO, USA) 을 사용하였다.
염증유발 물질인 LPS (lipopolysaccharide, Sigma-Aldrich Co., St. Louis, MO, USA)로 세포를 자극시키면 활성화된 pathway를 통해 inducible nitric oxide synthase (iNOS), cyclooxygenase-2 (COX-2)가 발현되어 과량의 NO가 생성되 어 염증을 일으킨다 (Lee et al., 2011). 이에 따라 NO 생성 억제율을 분석함으로써 항염증 효능을 측정하고자 하였다. 생 성된 NO는 세포배양액에 중에 NO2-의 형태로 존재하며 함량은 nitric oxide detection kit (NO kit, iNtRON Biotechnology, Inc., Sungnam, Korea)를 이용하여 측정하였다. 두 가지 추출 물 파우더 시료를 약 100㎎/㎖ 함량으로 DMSO에 용해시킨 후 100㎍/㎖ 농도로 희석하였다. 이를 LPS 1.0㎍/㎖ 와 세 포 RAW 264.7에 처리하여 24 h 동안 배양하였다. 배양액 중 100㎕를 취한 후, NO kit의 N1 buffer 50㎕를 첨가하여 10 min 동안 방치하고, 이어 N2 buffer 50㎕를 첨가하여 10 min 동안 방치한 후, 540㎚에서 흡광도를 측정하였다. NO2-는 nitrite를 표준용액으로 측정하였다. 항염 효과가 있는 것으로 알려진 dexamethasone을 양성대조군으로 설정하였다.
6. 페놀성 화합물 함량 측정
캘러스 추출물의 총 페놀성 화합물 함량 측정은 Folin- Denis법 (Folin and Denis, 1912)을 응용하여 실시하였다. (+)-catechin hydrate (Sigma-Aldrich Co., St. Louis, MO, USA)를 0.002 - 0.2㎎/㎖ 의 범위내의 농도로 제조하여 표준 시약으로 이용하였고, 각 시료에 2% sodium carbonate (Sigma-Aldrich Co., St. Louis, MO, USA) 와 50% Folin- Ciocalteu (Sigma-Aldrich Co., St. Louis, MO, USA) 시약을 첨가하여 0.002 - 0.2㎎/㎖ 의 범위내의 농도로 제조하여 실험 군으로 이용하였다. 표준물질과 시료 모두 microplate spectrophotometer 를 이용하여 750㎚ 파장에서 흡광도를 측 정하였고, 표준 곡선을 작성하였다.
추출시료 1㎖에 50% 메탄올 8㎖ 첨가하여 초음파추출기 로 1 h 동안 추출한 후 50% 메탄올을 사용하여 10㎖로 정 용하였다. 이 추출물을 0.20㎛ syringe filter (Corning Inc, New York, NY, USA)를 사용하여 여과시킨 후 검액으로 사 용하였다. 검액 100㎕를 2% sodium carbonate 2㎖ 와 혼 합 한 후 용액에 50% Folin-Ciocalteu 시약 100㎕ 를 첨가 하고 약 20 - 25℃에서 30 min 반응시킨 이후 microplate spectrophotometer를 사용하여 파장 750㎚에서 폴리페놀 함 량을 측정하였다.
7. 통계처리
모든 분석 값은 3 회 반복실험을 통하여 결과 값을 도출하 여 평균값과 표준 편차 (means ± SD)로 나타내었다. Windows 용 SPSS (Statistical Pakage for the Social Science, version 12.0, SPSS Inc., Chicago, IL, USA)를 이용하여 통계처리 하였고, One-way analysis of variance (ANOVA)를 시행한 후 Student's t-test로 통계처리의 유의성을 검정하였다.
결 과
1. 캘러스 유도 및 배양의 최적 배지 조성
캘러스 분열 유도에서 배지의 조성은 매우 중요하며, 식물 성장 호르몬은 가장 중요한 성분이다. 캘러스 유도용 배지는 높은 농도의 ammonium, nitrate, 및 potassium 등이 포함된 MS 배지를 사용하였다 (Back, 2001). 일반적으로 식물 배양에 는 단일 종류의 cytokinin과 auxin을 필요로 하지 않으며 식 물의 배양조직에 따라 필요한 생장조절물질이 다르고 이것은 배양 식물체내의 내생 호르몬의 양과 큰 관계가 있기 때문에 (Lisowska and Wysokinska, 2000) 본 연구에서는 배지의 조 성과 농도를 다르게 하여 (A. obesum)의 캘러스 분열 상태를 관찰하였다. 그 결과 치상된 잎 절편체는 2 주 후 육안으로 구분 될 정도로 분열 정도의 차이가 크게 나타났다 (Fig. 1).

Callus induction by different medium types in A. obesum after two weeks.A; IAA 0.1㎎/ ℓ + kinetin 0.2㎎/ ℓ (M1 medium), B; IAA 0.2㎎/ ℓ + kinetin 0.3㎎/ ℓ (M2 medium), C; IAA 0.3㎎/ ℓ + kinetin 0.4㎎/ ℓ (M3 medium), D; NAA 0.5㎎/ ℓ + BA 0.5㎎/ ℓ (M4 medium), E; NAA 1.0㎎/ ℓ + BA 2.0㎎/ ℓ (M5 medium), F; NAA 2.0㎎/ ℓ + BA 1.0㎎/ ℓ (M6 medium).
IAA와 kinetin 이 첨가된 배지에서는 캘러스 유도가 거의 발생하지 않았고, 두드러지게 활발한 캘러스 증식이 관찰된 배 지는 NAA 와 BA의 혼합배지였으며 특히 캘러스 성장이 두 드러진 배지의 조성은 2.0㎎/ℓ NAA와 1.0㎎/ℓ BA를 혼 합첨가 한 M6 배지였고, 건조 무게는 37 ± 0.84㎎으로 나타 났다. 이러한 결과를 바탕으로 NAA와 BA의 함량이 높은 배 지에서 캘러스 분열 유도 및 증식이 활발한 것으로 판단할 수 있었다. 배양 기간에 따라서는 6 주가 지난 후 가장 비대하게 증식한 캘러스를 확인 할 수 있었고 (Fig. 2), 배지 조성에 따 른 정확한 캘러스 성장률 비교는 Table 2에 나타내었다. 따라 서 이하의 캘러스 배양에는 2.0㎎/ℓ의 NAA와 1.0㎎/ℓ의 BA를 혼합한 배지를 사용했으며 현탁 배양 역시 상동의 배지 조성으로 진행하였다.
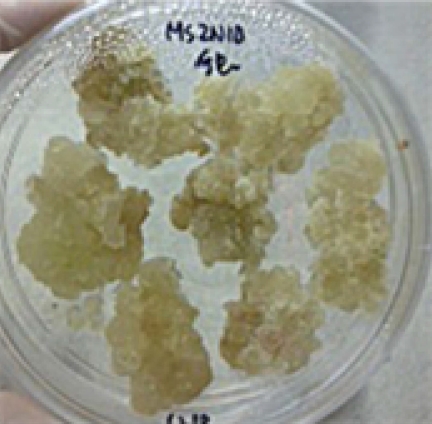
Callus formation from leaf explant of A. obesum on MS medium containing NAA 2.0㎎/ ℓ and BA 1.0㎎/ ℓ (M6 type) after 6 weeks.
2. 세포독성 및 항염증 활성 측정
대식세포인 RAW 264.7 세포에 대한 석화 캘러스 메탄올 추출물의 세포독성 농도를 확인하기 위하여 WST 분석을 수 행하였다. 캘러스 메탄올 추출물과 elicitor를 처리한 캘러스의 메탄올 추출물 모두 최고농도 100㎍/㎖이하의 농도에서 세포 독성을 나타내지 않았다. 따라서 각 시료는 해당 농도 범위 내 에서 석화 캘러스 추출물의 항염 효능을 측정하였다 (Fig. 3).
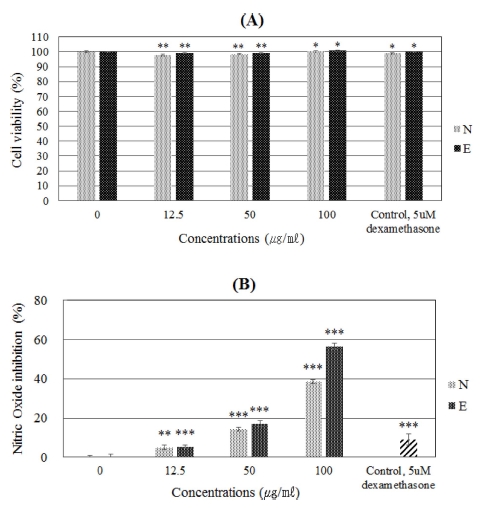
Effect of A. obesum concentration on the cell viability and inhibition of nitric oxide of RAW 264.7 cell.(A); cell viability, (B); NO inhibition, N; callus extract, E; elicitor treated callus extract, Control; 5 μM dexamethasone. Data points and bar represent arithmetic means ± SD (n = 3). ***p < 0.01, **p < 0.05, *p < 0.5 as compared to the untreated group (blank).
두 가지 시료 모두 농도 별 NO 생성 억제율이 증가하여 100㎍/㎖ 농도에서 항염 효능이 가장 크게 나타났고, 이는 양 성대조군인 dexamethasone과 비교 하였을 때 더 높은 효과를 나타내었다 (Fig. 3).
자세히 결과를 살펴보면 elicitor를 처리하지 않고 기본 배양 한 캘러스의 80% 메탄올 추출물을 12.5㎍/㎖ 농도로 세포에 처리하였을 때, 5.02 ± 1.25% NO 생성 억제율을 보인 반면에 100 μM의 MeJA를 1% 처리한 캘러스의 80% 메탄올 추출물 을 12.5㎍/㎖ 농도로 세포에 처리하였을 때 5.32 ± 1.00%의 NO 생성 억제율을 나타내어 저농도의 elicitor 처리의 경우에 NO 생성 억제율은 elicitor 처리 유무에 따른 시료간의 큰 차 이를 나타내지 않았다.
반면 기본 배양한 캘러스 추출물을 50㎍/㎖ 농도로 세포 에 처리 하였을 때 NO 생성 억제율은 14.36 ± 2.34% 이며, elicitor 처리한 캘러스 추출물을 50㎍/㎖ 처리하였을 때, NO 생성 억제율은 17.08 ± 1.56%을 나타내었다. 또한 기본 배양한 캘러스 추출물을 100㎍/㎖ 처리 하였을 때 NO 생성 억제율 은 38.69 ± 0.40% 이며, elicitor를 처리한 캘러스 추출물을 100 ㎍/㎖ 처리한 결과 역시 56.47 ± 1.47%를 나타내어 5 μM 수준으로 처리한 dexamethasone의 억제율인 14.67 ± 3.23% 보다 높은 항염 효능을 나타내었다 (Fig. 3).
이러한 실험 결과는 농도에 따른 석화 캘러스 추출물의 항 염 효능을 보여주며 elicitation 하지 않고 배양한 캘러스 보다 elicitor를 처리하여 배양한 캘러스의 항염 효과가 더 우수한 것을 확인할 수 있었다.
3. 페놀성 화합물 함량 측정
식물의 2 차 대사산물인 페놀성 화합물은 flavonoid, catechin, tannin 등을 포함하며 항산화 작용, 항염 작용, 혈중 지질 저하 작용 등의 약리활성을 갖는 것으로 알려져 있다 (Ahn et al., 2015). 또한 페놀성 화합물에 기인한 항염 효능 을 연구한 문헌에 따르면 인삼에 함유된 페놀성 화합물의 항 염증 효과가 확인되었고 (Gong et al., 2009), 올리브오일의 페놀성 화합물이 항염 효능을 나타낸다는 실험 결과가 밝혀진 바 있다 (Miles et al., 2005). 이에 따라 본 실험에서도 석화 캘러스 추출물의 항염 효능이 페놀성 화합물에 의한 결과임을 확인하기 위해서 페놀성 화합물 함량을 측정하였고, 항염 효 능의 결과와 비교 하였으며 항염 활성을 확인한 실험과 마찬 가지로 기본 배양한 캘러스의 80% 메탄올 추출물과 MeJA를 처리하여 배양한 캘러스의 80% 메탄올 추출물의 폴리페놀 함 량을 측정 하였다.
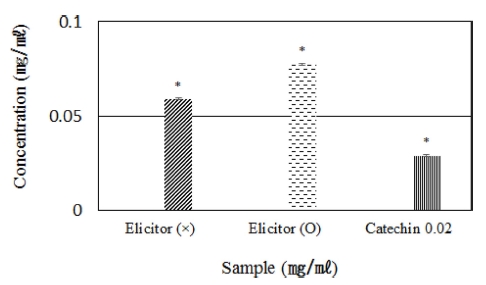
대조군인 기본 배양한 캘러스 추출물의 페놀성 화합물 함량 은 0.059 ± 0.0005㎍/㎖였고, elicitor로 MeJA를 처리하여 배 양한 캘러스 추출물은 0.077 ± 0.0003㎍/㎖ 농도의 폴리페놀 을 포함하는 것으로 확인 되었다 (Fig. 4). 이러한 결과는 앞 서 확인한 항염 효능의 차이와 일치하며 캘러스 추출물의 항 염 효능이 폴리페놀에 의한 결과임을 유추할 수 있었다.
고 찰
다육종 식물인 석화 [Adenium obesum (Forssk.) Roem & Schult]의 잎으로부터 캘러스를 유도 하였고 이를 배양하기 적 합한 배지 조성을 연구하였다. 캘러스 유도 및 배양은 다양한 농도의 kinetin과 NAA, BA, IAA 호르몬과 2 - 3% sucrose 를 첨가한 MS 고체 배지를 이용하였다. 배지의 pH는 5.55 - 5.59범위 안으로 정하였고 25℃ 식물배양기에서 암상태로 캘 러스 분열을 유도 하였다. 그 결과 NAA (2㎎/ℓ) + BA (1㎎/ℓ)를 첨가한 혼합배지에서 가장 많은 캘러스 분열과 증 식이 발생하는 것을 확인하였다. 이러한 캘러스를 80% MeOH 용매로 추출하여 추출물을 제조 하였고, 이에 대한 세 포독성 및 항염 효능을 확인하였다. 또한 elicitor의 이차대사 산물 증진에 따른 생리활성 효과 증대를 확인하기 위해 캘러 스 배양 과정에 MeJA를 처리하여 배양하였고, 이러한 캘러스 추출물의 세포독성 및 NO생성 억제율이 기존 캘러스의 항염 효능보다 크다는 결과를 확인할 수 있었다. 또한 본 연구를 통해 추출물의 페놀성 화합물 함량을 확인하고 참고 문헌에 따라 캘러스 추출물의 항염 효능이 폴리페놀에 의한 결과임을 판단할 수 있었다. 더불어 elicitor를 처리한 캘러스 추출물이 더 높은 함량의 페놀성 화합물을 함유하는 것으로 나타났다.
이상의 연구 결과들은 석화의 잎 조직을 이용하여 항염 효 능을 가진 물질을 축적한 캘러스 유도 및 대량배양이 가능할 것임을 나타낸다.
감사의 글
본 연구는 한국산업기술진흥원 경제협력권산업육성사업(과 제번호: R0002899)의 지원으로 수행한 연구결과로 이에 감사 드립니다.
References
-
Ahn, HY, Choe, DJ, Kim, BK, Lee, JH, Cho, YS, Bioactive materials and antioxidant properties of fermented rice-bran extract, Journal of Life Science, (2015), 25, p1014-1020.
[https://doi.org/10.5352/jls.2015.25.9.1014]

- Back, GY, Plant tissue culture technology, (2001), Hyangmunsa, Seoul, Korea, p59-288.
- Brown, DCW, Thorpe, TA, Crop improvement through tissue culture, World Journal of Microbiology and Biotechnology, (1995), 11, p409-415.
-
Chukwujekwu, JC, Fennell, CW, van Staden, J, Optimisation of the tissue culture protocol for the endangered Aloe polyphylla, South African Journal of Botany, (2002), 68, p424-429.
[https://doi.org/10.1016/s0254-6299(15)30368-9]

- Dimmitt, MA, Hanson, C, The genus Adenium in cultivation part 1: A obesum and A multiflorum, Cactus and Succulent Journal, (1991), 63, p223-225.
-
Farmer, EE, Ryan, CA, Interplant communication Airborne methyl jasmonate induces synthesis of proteinase inhibitors in plant leaves, Proceedings of the National Academy of Sciences, (1990), 87, p7713-7716.
[https://doi.org/10.1073/pnas.87.19.7713]

- Folin, O, Denis, W, On phosphotungstic-phosphomolybdic compounds as color reagents, Journal of Biological Chemistry, (1912), 12, p239-243.
- Gong, HY, Lee, YC, Choi, SY, Neuroprotective and anti-inflammatory effects of phenolic compounds in Panax ginseng CA Meyer, Journal of Ginseng Research, (2009), 33, p111-114.
-
Hoffmann, JJ, Cole, JR, Phytochemical investigation of Adenium obesum Forskal(Apocynaceae): Isolation and identification of cytotoxic agents, Journal of Pharmaceutical Sciences, (1977), 66, p1336-1338.
[https://doi.org/10.1002/jps.2600660935]

- Hoper, J, Spectrophotometric in vivo determination of local mitochondrial metabolism by use of a tetrazolium salt, Physiological Measurement, (1997), 18, p61-66.
- Hossain, MA, Alabri THA, Al-Musalami AHS, Akhtar, S, Said, S, Evaluation of in vitro antioxidant potential of different polarities stem crude extracts by different extraction methods of Adenium obesum, Journal of Coastal Life Medicine, (2014), 2, p699-703.
- Hussain, J, Manan, S, Ahmad, R, Ahmed, T, Shah, MM, Biotechnilogies used in genetic transformation of Triticum aestivum A mini overview, FUUAST Journal of Biology, (2013), 3, p105-109.
- Kang, YH, Encyclopedia of life science, (2008), Life Science, Seoul. Korea, p110-130.
- Kim, MU, Lee, SY, Induction and cultivation of cal lusfrom Aloe vera L, Food Engineering Progress, (2012), 16, p226-232.
-
Lee, SE, Lee, JH, Kim, JK, Kim, GS, Kim, YO, Soe, JS, Choi, JH, Lee, ES, Noh, HJ, Kim, SY, Anti-inflammatory activity of medicinal plant extracts, Korean Journal ofMedicinal Crop Science, (2011), 19, p217-226.
[https://doi.org/10.7783/kjmcs.2011.19.4.217]

- Lisowska, K, Wysokinska, H, In vitro propagation of Catalpa ovata G Don, Plant Cell Tissue and Organ Culture, (2000), 60, p171-176.
-
Miles, EA, Zoubouli, P, Calder, PC, Phil, D, Differential anti-inflammatory effects of phenolic compoundsfrom extra virgin olive oil identified in human whole blood cultures, Nutrition, (2005), 21, p389-394.
[https://doi.org/10.1016/j.nut.2004.06.031]

-
Takayama, S, Misawa, M, Ko, K, Misato, T, Effect of cullural conditions on the growth of Agrostemma githago cells in suspension culture and the concomitant production of an anti-plant virus substance, Physiologia Plantarum, (1977), 41, p313-320.
[https://doi.org/10.1111/j.1399-3054.1977.tb04889.x]

-
Talmadge, KW, Keegstra, K, Bauer, WD, Albersheim, P, The structure of plant cell walls I The macromolecular components of the walls of suspension-cultured sycamore cells with a detailed analysis of the pectic polysaccharides, Plant Physiology, (1973), 51, p158-173.
[https://doi.org/10.1104/pp.51.1.158]

- Tijjani, A, Sallau, MS, Sunus, I, Synergistic activity of methanolic extract of Adenium obesum(Apocynaceae) stem-bark and oxytetracycline against some clinical bacterial isolates, Bayero Journal of Pure and Applied Sciences, (2011), 4, p79-82.
-
Yamauchi, T, Abe, F, Cardiac glycosides and pregnanes from Adenium obesum(studies on the constituents of Adenium I), Chemical and Pharmaceutical Bulletin, (1990), 38, p669-672.
[https://doi.org/10.1248/cpb.38.669]