
발아녹미와 노루궁뎅이 버섯 균사체를 이용한 생물전환 약용 신소재의 항산화 활성 및 NO 생성 억제 효능
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Hericium erinaceus is considered a functional food and potential medicinal source. The present study was conducted to examine the potential antioxidant and anti-inflammatory activities of carried out with water and ethanol extracts of Hericium erinaceus grown on germinated green rice (HEGR-W and HEGR-E, respectively) and the water and ethanol extracts of germinated green rice (GR-W and GR-E, respectively) as potential medicinal resources or antioxidant and anti-inflammatory agents.
The total phenolic and flavonoid contents, DPPH, and ABTS activity, reducing power, DNA protective activity, cell viability, and NO production were investigated. The total phenolic and flavonoid contents were highest in HEGR-E (66.53 ± 2.40 ㎎·GAE/100 g and 82.12 ± 7.10 ㎎·CE/100 g respectively). HEGR-E exhibited high DPPH (44.70 ± 1.28%) and, ABTS (44.70 ± 1.28%) activity and reducing power (0.219). HEGR and GR extracts showed protective activity against DNA damage. The cytotoxicity of HEGR and GR in RAW264.7 cells and LPS-induced RAW264.7 cells was low. HEGR-E and GR-W exhibited anti-inflammatory effects through a 28% inhibition of NO production in LPS-induced RAW264.7 cells.
These results suggested that the extracts of Hericium erinaceus grown on germinated green rice could be a potential medicinal material with natural antioxidant and NO inhibitory properties.
Keywords:
Hericium erinaceus, Antioxidant, DNA Protection, DPPH, Green Rice, NO서 언
최근 건강에 대한 관심 증대 등으로 건강과 관련된 의약품, 건강보조식품 및 건강기능성 식품의 수요 증가와 더불어 이들 의 소재를 천연 원료인 약용식물로부터 얻으려는 연구가 증가 하고 있으며 (Kim et al., 2010a) 또한 버섯 균사체 및 미생 물을 촉매로 이용한 생물 전환 공정은 최근 식품, 제약, 화학 산업에서 요구되는 고부가가치 신소재 생산에 널리 응용되고 있다 (Tsegaye, 2015). 또한 경제성장과 식생활의 서구화로 인 해 비만, 당뇨, 고혈압 및 심장질환 등 다양한 성인병의 발생 율이 높아지고 있다.
Hydroxyl radicals (OH·), superoxide anions (O2-), hydrogen peroxide (H2O2), singlet oxygen (1O2) 등의 ROS는 정상적인 세포 내 필요한 에너지 생산을 위한 생화학적인 산화과정에서 생성되며 세포분화, 유전자의 발현, 사이토카인에 대한 반응 정도를 포함한 다양한 생물학적 과정과 연관되어있다 (Rhee, 2006). 이러한 ROS는 불안정하고 산화력이 높아 생체 물질과 쉽게 반응하기 때문에 인체 내에서 ROS의 생성과 제거반응 간에 불균형을 초래하게 되어 ROS가 과량으로 존재하게 되 면 산화적 스트레스 (oxidative stress)를 유발하게 되며, 이러 한 산화적 스트레스는 지질과산화를 유도하고, 단백질, 세포막 및 DNA 등을 손상시켜 세포의 노화와 변형을 유도함으로써 뇌졸중, 암, 동맥경화, 알츠하이머병, 파킨슨 병 등 다양한 질 병을 유발하게 된다 (Jeong et al., 2008).
염증반응은 생체나 조직에 물리적 작용이나 화학적 물질, 세 균 감염 등의 어떠한 기질적 변화를 가져오는 자극에 대한 방 어기능으로 정상적인 회복을 위한 반응이며 정상적인 염증반응 은 시간이 지남에 따라 염증 촉진성 매개체 (pro-inflammatory mediators)의 생성은 감소되고, 항염증성 매개체 (antiinflammatory mediators)는 증가됨으로써 스스로 염증반응이 제한되는 조절과정을 가지고 있다 (Tizard, 1986). 초기 염증 반응에 반응하는 면역세포 중 대식세포는 LPS나 IFN-γ, IL- 1β, IL-6, TNF-α등의 염증 촉진성 사이토카인의 자극에 노출 됨으로써 활성화된다 (Xie et al., 1993).
활성화된 대식세포는 염증 촉진성 사이토카인 이외에 iNOS (inducible nitric oxide synthase) 및 COX-2 (cyclooxygenase- 2)와 같은 효소의 발현을 통해 NO (nitric oxide) 및 PGE2 (prostaglandin E2)와 같은 다양한 염증매개 분자들을 생성하게 되고 (Nathan, 1992), 이들 매개체들의 과도한 생성은 다양한 만성염증성 질환의 발병에 기여하고 있는 것으로 알려져 있다. 특히 NOS에 의해 L-arginine에서 생성되는 NO는 평활근의 이완을 통한 혈관 등의 이완, 혈소판 응집억제, 신경전달, 면 역조절 등의 중요한 기능을 가지고 있으나 과도한 NO의 생성 은 염증반응을 촉진하고 염증매개체의 생합성을 촉진함으로써 염증을 심화시켜 조직 손상, 유전자 변이 및 신경 손상을 일 으킨다 (Hippeli and Elstner, 1999). 따라서 NO 생성억제 등 염증성 매개체들의 생성을 억제하는 천연화합물의 발견은 보 다 부작용이 적은 항염증 치료제 개발을 위한 방편으로 관심 을 끌고 있다.
최근 기능성 식품에 대한 관심이 높아지면서 쌀도 다양한 종류의 쌀이 관심이 높아지고 있으며 유색미의 소비량도 높아 지고 있다. 녹미, 적미 등을 포함한 유색미는 백미보다 안토시 아닌계 색소를 많이 함유하고 있으므로 유색미들은 일반 백미 보다 높은 항산화 기능 및 생리활성을 가지고 있다고 보고되 었다 (Choi et al., 1996, 2004; Kim et al., 1998; Nam et al., 2003).
버섯은 예로부터 식용 및 약용으로 널리 이용되어 왔으며 버섯의 항암작용, 생체기능 조절 및 뇌졸중 등 성인병에 대한 예방과 개선 효과가 보고됨에 따라 버섯에 대한 관심은 더욱 높아지게 되었다. 겉보리 영지버섯 (Seo et al., 2017)과 노루 궁뎅이 버섯 (Hericium erinaceus) (Kim et al., 2013)의 항 산화 및 항염증 효능, 상황버섯 (An et al., 2009)의 면역력 강화, 능이버섯 추출물의 신경보호 효과 (Lee et al., 2011) 등 버섯의 생리활성 기능에 대하여 보고되고 있다. 노루궁뎅 이 버섯 (Hericium erinaceus)은 산호버섯과에 속하는 버섯으 로 하얀색의 다육질 균류로 다당류, 단백질, 렉틴, 헤리세논, 에리나콜, 에리나신 및 테르페노이드와 같은 성분의 생물학적 활성이 연구되어 보고 되었고 (Kim et al., 2013) 또한 노루 궁뎅이 버섯에서 치매치료제로 가능한 물질이 분리되었으며, 항암효과를 가진 성분 등 다양한 생리활성물질이 있는 것으로 보고되었다 (Kawagishi et al., 1996).
따라서 본 연구에서는 기능성 식품으로 관심이 높은 유색미 중에서 우리 고유의 토종 쌀인 발아 녹미와 노루버섯 균사체 를 이용하여 배양한 발아녹미 노루궁뎅이 버섯의 열수 추출물 및 70% 에탄올 추출물의 항산화 및 NO 억제 효능을 평가하 여 생물전환 약용 신소재로서의 기능성을 제시하고자 수행하 였다.
재료 및 방법
1. 실험재료 및 시약
Folin-Ciocalteau's phenol reagent, gallic acid, (+)-catechin, sodium nitrite, 1,1-diphenyl-2-picryl hydrazyl (DPPH), 2,2'-azinobis (3-ethylbenzothiazoline-6-sulfonic acid) (ABTS), potassium persulfate, tyrosinase, ferrozine, potassium ferricyanide, sodium carbonate 등은 Sigma-Aldrich (St. Louis, MO, USA)에서 구 입하였고, 1-(4,5-methylthiazol-2-yl)-3,5-diphenyl formazan (MTT), 5,5'-dimethyl pyrroline-1-oxide (DMPO)는 Duchefa Biochemie (Haarlem, Netherlands)에서 구입하였다. DNA loading dyes와 pBR322 DNA는 Fermentas (Waltham, MA, USA)에서 구입하였고, Dulbecco's modified Eagle's medium (DMEM), streptomycin (100 g/㎖), penicillin (100 IU/㎖) 그 리고 fetal bovine serum (FBS)는 WelGENE (Gyeongsan, Korea)에서 구입하여 사용하였다.
2. 시료 추출물 제조
발아녹미 노루궁뎅이 버섯 (Hericium erinaceus) 열수 추출 물 (HEGR-W)과 70% 에탄올 추출 (HEGR-E) 및 발아녹미 열수 추출물 (HR-W)과 70% 에탄올 추출물 (HR-E)은 다음과 같이 제조하였다.
노루궁뎅이 버섯 균사체를 Φ8 cork borer로 조각을 내어 potato dextrose broth로 제조한 액체배지 300㎖에 5 - 6 조각 을 접종하여 진탕 배양기에서 24℃ 에서 6 주 배양 하였다. 액체 배양한 노루궁뎅이 버섯 균사체를 균질화 하여 물을 첨 가하여 autoclave 한 발아녹미에 1/10 비율로 첨가한 후, 25℃, 습도 70% 배양기에서 4 주간 배양 하였다. 발효된 발아녹미 노루궁뎅이 버섯을 발아녹미와 함께 회수하여 열풍건조기에서 2 - 3 일간 건조 시켰다.
건조된 시료무게의 20 배의 증류수를 첨가하여 환류추출기 (C-WB6, Changshin Science, Seoul, Korea)를 사용하여 85℃, 2 시간씩 3 회 반복 열수 추출 및 70% 에탄올 추출을 진행 하였다. 발아녹미 열수 추출과 발아녹미 70% 에탄올 추출도 동일한 방법으로 추출하였다. 얻어진 추출액을 여과하고 rotary evaporator (RV10D, IKA, Staufen, Germany)로 농축한 후 동결 건조하여 분말 형태로 –20℃에 보관하여 사용하였다.
3. 총 폴리페놀 화합물 함량 측정
총 폴리페놀 화합물 성 화합물 함량을 측정하기 위해 Folin- Ciocalteu's 방법을 이용하였고 (Wang et al., 1994) standard 로 gallic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였으며, 증류수를 이용해 농도별로 희석하여 표준곡선 을 구했다 (y = 0.0032x + 0.0368, R2= 0.9974).
시료 추출물 10㎎/㎖의 40㎕와 Folin-Ciocalteu phenol reagent을 1 N 농도로 용해한 용액 20㎕, 20%의 Na2CO3 60㎕를 혼합하였다. 호일을 씌워서 30 분간 반응을 시킨 후 ELISA reader (16039400, Tecan, Männedorf, Switzerland) 를 이용해 700㎚에서 흡광도를 측정하여 표준곡선을 이용 해 함량 값을 구하였다.
4. 총 플라보노이드 화합물 함량 측정
총 플라보노이드 화합물 함량의 측정은 Nieva 등 (2000)의 방법으로 측정하였다. Standard인 catechin (Sigma-Aldrich Co., St. Louis, MO, USA)를 농도 별로 희석하여 표준곡선을 구했다 (y = 0.0017x + 0.0403, R2= 0.9908). 시료 추출물을 25㎕을 분주 한 후 125㎕의 증류수로 희석한다. 다음은 5% NaNO₂8㎕를 첨가한 후, 5 분간 상온에서 반응시켜준다. 그 후 10% aluminum chloride 15㎕를 넣고, 6 분간 반응 후 1M NaOH 50㎕와 27㎕의 증류수를 첨가하여 혼합한 후 ELISA reader (16039400, Tecan, Männedorf, Switzerland)를 이용해 510㎚에서 흡광도를 측정하였다. 그 후, 표준곡선을 이용하여 총 플라보노이드 함량 값을 측정하였다.
5. DPPH 라디칼 소거능 측정
DPPH radical scavenging activity는 Blois (1958)의 실험방 법을 변형하여 진행하였다. Standard인 BHT 용액(butylated hydroxytoluene)은 메탄올로 희석하여 농도별로 (0.25, 0.5, 1.0, 2.0, 4.0㎎/㎖) 제조하고, 시료 추출물도 증류수 및 에탄 올 70%를 이용하여 농도별로 각각 1㎖씩 제조하였다. 96 well plate에 농도별로 제작한 시료 및 standard를 80㎕씩 3 번 분주한 후, 0.2 mM 농도의 DPPH를 80㎕씩 추가로 분주 하여 foil로 감싸준 뒤 실온에서 30 분간 방치한 후, ELISA reader (16039400, Tecan, Männedorf, Switzerland)를 이용해 517㎚에서 흡광도를 측정하였다.
6. ABTS 라디칼 소거능 측정
ABTS 라디칼 소거능은 Jeong 등 (2015)의 방법을 변형하 여 측정하였다. 증류수에 용해한 7 mM의 ABTS와 2.45 mM 의 potassium persulphate를 혼합한 후, ABTS radical 발생을 위해 암실상태에서 12 - 16 시간 방치하였다. 혼합한 ABTS solution을 734㎚에서 OD값이 0.70 ± 0.02 이 되도록 0.01M PBS (pH 7.4)로 희석하였다. 시료 추출물과 standard인 ascorbic acid을 0.25, 0.5, 1.0, 2.0, 4.0㎎/㎖로 용해한 용액 0.2㎖와 ABTS 용액 0.8 ㎖을 가하여 혼합 한 후, 5 분간 실온에서 정치한 후, ELISA reader (16039400, Tecan, Männedorf, Switzerland)를 이용해 734㎚에서 흡광도를 측정 하였다.
7. 환원력 (reducing power) 측정
Dutta 등 (2012)의 실험 방법을 인용하여 환원력 측정 실험 을 진행하였다. 시료 추출물과 standard인 ascorbic acid를 각 각의 농도 0.25, 0.5, 1.0, 2.0, 4.0㎎/㎖으로 제작하였다. Control로 증류수를 준비하였고, e-tube에 각각 500㎕씩 분주 하고 0.2M PBS (pH 6.6)를 각 e-tube에 500㎕씩, potassium ferricyanide 10㎎/㎖ 500㎕를 분주 한 뒤, 50℃ water bath (HB10D, IKA, Staufen, Germany)에서 20 분간 반응 시킨 후, 새로운 e-tube에 1 ㎖씩 옮겨준 뒤, 100㎎/㎖ TCA 500㎕씩 분주 하였다. 원심분리기 (368826, Beckman Coulter Inc., Brea, CA, USA)에서 10 분간 돌린 뒤, 상층액 을 500㎕씩 새 e-tube에 옮겼다. 추가로 증류수 500㎕씩, FeCl3 100㎕씩 각각 분주 후 96 well plate에 150㎕씩 분 주 한 뒤, ELISA reader (16039400, Tecan, Männedorf, Switzerland)를 이용해로 700㎚ 에서 흡광도를 측정하였다.
8. DNA 보호능 측정
활성산소에 의한 DNA 손상의 보호능 측정은 Tian와 Hua (2005)의 실험방법을 이용하여 진행하였다. Plasmid pBR DNA (0.5㎍/㎖) 1 ㎕에 FeSO4 (0.08 mM) 3㎕, 증류수 3㎕, 30% H2O2 (v/v) 4㎕, 그리고 농도별로 희석한 시료 추출물을 2㎕씩 첨가하였다. 이 혼합물을 37℃ water bath (HB10D, IKA, Staufen, Germany)에서 1 시간 동안 반응 시 켰다. 그 후에 6x DNA loading dye 2㎕씩 첨가 한 후, agarose gel에서 상온 100 V에 30 분간 전기영동 하였다. DNA 밴드는 agarose gel에 포함된 ethidium bromide에 의해 염색되어 측정이 가능하였다. DNA 밴드는 ChemiDoc (10016025, Bio-Rad, Hercules, CA, USA)을 이용하여 측정 하였다.
9. 세포 배양 (RAW264.7)
RAW264.7 세포를 유지하기 위해 DEME 배지를 사용하였 고, 배지에 10% FBS (fetal bovine serum, Gibco BRL, Gaithersburg, MD, USA)와 1% penicillin이 포함된 용액을 사용하여 37℃, 5% CO₂incubator에서 배양하였다.
10. 세포 생존률 측정
추출물의 세포독성은 3-(4,5-dimethyl-2-thiazolyl)-2,5- diphenyl- 2H-tetrazolium bromide (MTT)를 이용한 방법에 의해 측정하 였다. 배양된 RAW264.7 세포를 5 × 104 cells/well 의 농도로 분주하여 24 시간 배양하여 안정화시킨 후, 농도 별로 희석한 시료를 처리하여 24 시간 동안 배양하였다. 각 세포에 알맞은 배지로 2㎎/㎖의 농도로 제조한 MTT용액을 각 well에 50㎕씩 가하고, 37℃, 5% CO₂조건에서 2 시간 동안 반응 시켰다. 배지를 제거한 후, 각 well에 150㎕의 DMSO를 첨 가하여 생성된 formazan 결정을 용해시켜 ELISA reader (16039400, Tecan, Männedorf, Switzerland)를 이용해 570㎚ 에서 흡광도를 측정하여 세포 생존율을 산출하였다.
11. NO (nitric oxide) 생성량 측정
NO 생성량 측정 실험은 Griess 반응을 이용하여 세포 배양 상측액의 NO 생성량을 측정하였다 (Wadsworth, 1999). 배양 된 RAW264.7 세포를 5 × 104 cells/well 의 농도로 분주하여 37℃, 5% CO₂조건에서 24 시간 배양하여 안정화시킨 후, 농 도별로 희석한 시료와 LPS (1㎍/㎖)를 첨가하여 24 시간 더 배양하였다. 그 후, plate에 상측 액을 80㎕씩 새로운 96 well plate로 옮겨준 뒤 Griess 시약을 80㎕씩 분주하여 10 분간 상온 반응 시킨다. 그 다음 ELISA reader (16039400, Tecan, Männedorf, Switzerland)를 이용해 540㎚에서 흡광도 를 측정하여 NO 발생량을 측정하였다.
12. 통계처리
각 실험에서 얻어진 결과는 평균 ± 표준편차로 나타내었다. 통계처리는 GraphPad Prism 5.0 (GraphPad Software Inc., La Jolla, CA, USA)로 분석한 후, 분석결과는 일원분산분석 (One-way ANOVA)에 의한 Duncan 검정을 실시하여 p < 0.05 유의수준에서 Ducan’s Multiple Range Test (DMRT)로 유의적 차이를 검증하였다.
결과 및 고찰
1. 총 폴리페놀 화합물 및 플라보 노이드 함량
생물 전환을 통한 약용신소재를 개발하기 위하여 발아녹미 에 노루버섯 균사제를 배양한 HEGR과 GR의 총 페놀성 화합 물 과 플라보노이드 함량은 Table 1과 같으며 HEGR-E (66.53㎎) 및 HEGR-W (24.38㎎) 추출물의 총 페놀성 화합 물 함량은 GR-E (53.14㎎) 와 GR-W (14.67㎎)의 총 페놀 성 화합물 함량보다 모두 높게 나타났다 (Table 1). 총 플라보 노이드 함량도 GR-E (49.57㎎) 및 GR-W (7.35㎎) 보다 HEGR-E (82.12㎎) 및 HEGR-W (19.73㎎) 추출물에서 더 높은 것으로 나타났다. 즉 총 페놀성 화합물 함량과 총 플라 보노이드 함량은 HEGR 추출물이 GR 추출물보다 높았으며 특히 HEGR-E 추출물이 총 폴리페놀성 화합물과 총 플라보노 이드 함량이 높은 것으로 나타났다.

Total phenolic and flavonoid contents of Hericium erinaceus grown on green rice, green rice, and Hericium erinaceus.
식물에 널리 분포되어 있는 플라보노이드 성분 역시 항산화 능을 비롯한 여러 생리활성 기능이 최근 많은 연구에서 밝혀 지고 있다 (Heim et al., 2002). 천연 폴리페놀 화합물은 가 장 많은 phytochemicals로써 oxidative stress와 관련된 질환의 예방과 치료에 대한 치료후보제로 또 생체 내에서 생성되는 ROS를 제거 하는 천연항산화물로서 많은 관심을 받고 있다. 식이성 폴리페놀성 화합물을 많이 섭취하는 경우 암, 심혈관 질환, 신경변성 질환과 염증 등 여러 질병의 위험을 감소시킨 다고 하였다 (Vauzour et al., 2010). 또한 채소, 과일, 약용식 물, 미세조류, 곡류, 야생화 등 식물들에 함유된 천연 폴리페 놀성 화합물은 중요한 생리활성을 지니고 있으며 (Guo, 2012), 플라보노이도 폴리페놀성 화합물 과 함께 과일, 채소, 음료 등에 함유된 2 차 식품 대사산물로서 강한 항산화 활성 을 가지고 있는 phytochemicals로 항암, 항고혈압, 항염증, 항 균, 항산화 및 항노화 작용 등 여러 생리적 작용을 지니고 있 어 현재 기능성식품 및 의약품 신소재로서 널리 사용되고 있다 (Alan et al., 2000).
본 연구에서 약용작물 신소재로 개발하기 위하여 발아녹미에 노루궁뎅이 버섯 (Hericium erinaceus) 균사체를 배양하여 생 물전환 한 HEGR 추출물의 총 페놀성 화합물 함량과 총 플라 보노이드 함량은 GR 추출물보다 높았다.
2. DPPH 라디칼 소거능 측정
HEGR과 GR 추출물의 DPPH 라디칼 소거능과 IC50 값을 측정한 결과는 table 2에 나타나 있다. DPPH 라디칼 소거능은 추출물 2㎎/㎖에서 HEGR-E 추출물이 44.70%로 가장 높게 나타났으며 다음은 GR-E 추출물이 42.98%로 높게 나타났다. 이는 ascorbic acid (2㎎/㎖)의 DPPH 라디칼 소거능 (90.42%)의 49.4% (HEGR-E), 47.5% (GR-E)에 해당되며 DPPH 라디칼 소거능의 IC50 값은 HEGR-E와 GR-E 추출물 이 각 각 2.89㎎/㎖와 2.58㎎/㎖으로 낮은 농도에서 DPPH 라디칼 소거능을 나타냈다. 유색미 연구에서 Park 등 (2015)은 DPPH 라디칼 소거 활성에서 흑진주가 활성이 가장 높았고, 다음으로 건강흑미와 신토흑미가 높은 활성을 나타내었으며 폴리페놀 함량이 높은 진주, 신토흑미가 항산화 활성이 높은 것으로 나타났다고 보고 하였다.

DPPH radical scavenging activity and IC50 value of Hericium erinaceus grown on germinated green riceand green rice.
Kim 등 (2010b)은 주요 품종별 현미와 백미의 70% 에탄올 추출물에 대한 DPPH radical 소거능 (1㎎/㎖)은 현미일 경우 홍진주벼와 흑광벼가 88.79, 77.23%로 높았으며 모든 품종의 백미에서는 12.71 - 20.82%로 측정되었다. 또한 Oki 등 (2002) 은 흑미의 메탄올 추출물이 백미의 메탄올 추출물보다 DPPH radical을 이용한 측정에서 높은 활성을 나타내었다고 보고하 였으며, Choi 등 (2004)은 유색미의 DPPH 라디칼 소거능은 일반미와 비교하였을 때 3 - 7 배 우수한 활성을 보였으며 유 색미는 BHT의 항산화능이 82 - 90%인데 반하여 일반미는 23%정도라고 하였다. 또한 노루궁뎅이 버섯의 DPPH 라디칼 소거능은 열수 추출물 0.1, 0.5, 1, 2, 3㎎/㎖에서 대조군으로 사용한 합성 항산화제인 BHT 보다는 낮은 소거 활성을 보이 나 전체적 농도로 보았을 때 60% 이상의 DPPH 라디칼 소거 활성을 보였다고 하였다 (Kim et al., 2013).
DPPH radical 소거능은 식물 추출물과 식품의 항산화능력 을 측정하는 대표적 방법으로 DPPH radical은 phenolic compound와 같이 수소나 전자를 제공해주는 전자공여체와 반 응하면 전자나 hydrogen radical을 받아 phenoxy radical을 생성하게 되어 안정한 분자로 전환하여 환원될 때 탈색이 되 는 특성을 가지고 있다 (Jung et al., 2008). 이 방법은 짙은 자색의 DPPH의 짙은 자색이 탈색되는 정도에 따라 물질의 항산화능을 나타내는 방법으로 비교적 간단하여 여러 시료로 부터 항산화 활성을 탐색할 때 유용하다. 본 연구에서 노루궁 뎅이 균사체를 이용해서 생물 전환하여 약용 신소재로 개발한 HEGR 에탄올 추출물의 DPPH 라디칼 소거능은 44.7%로 가 장 높았으며 동시에 낮은 IC50 값을 나타냈다.
3. ABTS 라디칼 소거능 측정
ABTS 라디칼 소거능은 Fig. 1과 같으며 HEGR와 GR의 ABTS 라디칼 소거능은 열수 추출물보다 에탄올 추출물의 소 거능이 높게 나타났다. 특히 2.0 - 4.0㎎/㎖의 농도에서 HEGR-E와 GR-E 추출물의 ABTS 라디칼 소거능은 각 각 97.71%, 99.43%로 높은 소거능을 보였으며 이는 ascorbic acid (0.25㎎/㎖)의 97.74% 소거능과 비슷한 라디칼 소거능이다.
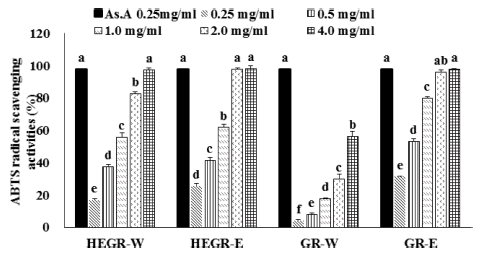
ABTS radical scavenging activity of Hericium erinaceus grown on germinated green rice and germinated green rice compared with ascorbic acid as a positive control.HEGR-W; Water extract of Hericium erinaceus grown on green rice, HEGR-E; Ethanol extract of Hericium erinaceus grown on green rice, GR-W; Water extract of green rice, GR-E; Ethanol extract of green rice. The result was statistically analyzed by One-way ANOVA and posthoc Duncan Multiple Range Test (DMRT). The different letters indicate a significant difference for each extract with control (p < 0.05).
여러 연구에서도 유색미의 유리 라디칼 소거능이 높았다고 보고 하였다. Park 등 (2015)의 유색미 연구에서 ABTS 라디 칼 소거능은 흑진주가 가장높았고 그 다음으로, 흑신토흑미, 신농흑찰 순이었고 적미 중에서는 홍진주와 적진주가 각각 높 았다고 했으며 Seo 등 (2008)은 흑미 메탄올 추출물의 총 항 산화력, 환원력 등이 백미, 현미, 적색미, 거대배아미에서 높았 다고 보고 하였다. ABTS radical 소거능은 DPPH 방법과 함께 항산화 활성을 측정하는데 많이 이용되며 ABTS를 peroxidase, H2O2와의 반응에 의해 생성된 활성 양이온인 ABTS+가 시료 중의 항산화성 물질에 의해 제거될 때 일어나는 탈색반응을 이용하여 물질의 항산화 능력을 측정하는 방법으로 고유의 청 록색의 변화를 흡광도 값으로 나타내어 추출물의 ABTS+ 라 디칼 소거 활성을 측정할 수 있다 (Jeong et al., 2015).
본 연구에서 노루궁뎅이 버섯을 이용하여 생물전환을 한 HEGR 추출물의 ABTS 라디칼 소거능은 4.0㎎/㎖농도에서 ascorbic acid (0.25㎎/㎖)의 ABTS radical 소거능과 거의 비 슷하였으며 이는 노루궁뎅이 균사체를 이용해서 생물 전환하 여 약용 신소재로 개발한 HEGR의 항산화성이 매우 높음을 시사한다.
4. 환원력 측정
HEGR과 GR의 Fe3+ 금속이온을 환원시키는 환원력을 700㎚에서 흡광도를 측정하여 나타내었으며 측정한 결과를 항산화제인 ascorbic acid의 환원력과 비교하여 Fig. 2에 나타 내었다. HEGR과 GR의 환원력도 열수 추출물보다 에탄올 추 출물이 높았으며 HEGR-E 추출물 농도 0.25, 0.5, 1.0, 2.0, 4.0㎎/㎖에서 측정한 흡광도는 0.07, 0.08, 0.11, 0.15, 0.22 로 HEGR-E는 농도 의존적으로 금속이온을 환원하는 환원력 이 증가하였으며 GR-E 보다 환원력이 높게 나타났다.
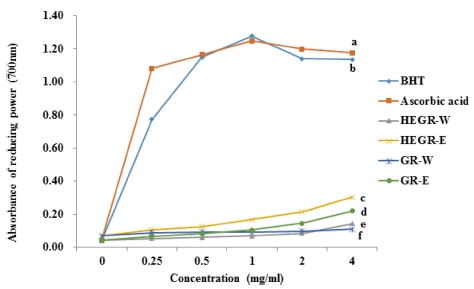
Reducing power of Hericium erinaceus grown on germinated green rice and germinated green rice compared with ascorbic acid and butyl hydroxy toluene (BHT) as positive control.HEGR-W; Water extract of Hericium erinaceus grown on green rice, HEGR-E; Ethanol extract of Hericium erinaceus grown on green rice, GR-W; Water extract of green rice, GRE; Ethanol extract of green rice. The result was statistically analyzed by One-way ANOVA and posthoc Duncan Multiple Range Test (DMRT). The different letters indicate a significant difference for each extract with control (p < 0.05).
환원력 평가는 ferric-ferricyanide (Fe3+)를 ferrous (Fe2+)로 전환하는 환원력을 흡광도 값으로 나타낸 것으로서 Fe3+의 감 소는 시료 등에 함유된 총 페놀성 화합물 화합물로부터 수소 원자를 공여 받음으로써 일어나며 철 이온을 Fe3+에서 Fe2+로 환원시키는 강도가 클수록 발색의 정도가 증가하는 원리를 이 용하여 측정하였다 (Yildirim et al., 2001). 32 종의 유색미 항산화 활성 연구에서 유색미의 환원력은 일반미보다 높았으 며 유색미의 색소체 함량과 환원력은 정의 상관관계가 있다고 보고하였다 (Nam et al., 2003). 또한 유색미 등의 항산화 활 성에 대한 연구에서 DPPH 라디칼 소거능은 80% 에탄올로 추출한 유색미가루가 백미가루의 4.77 - 9.33 배 높았고, ABTS 라디칼 소거능은 2.59 - 6.06 배 높았으며, 환원력은 2.34 - 7.73 배 높았다고 보고하였으며 (Park et al., 2015), 항산화성 분과 항산화력 간의 상관관계 분석에서 현미의 경우 항산화 성분인 총 페놀성 화합물 성분과 DPPH 라디칼 소거능 (R2 = 0.8311), ABTS 라디칼 소거능 (R2= 0.9897) 및 환원력 (R2 = 0.9901) 그리고 플라보노이드 성분과 DPPH 라디칼 소거능 (R2= 0.7624), ABTS 라디칼 소거능 (R2= 0.9620) 및 환원력 (R2= 0.9855)간에는 상당한 상관성을 나타낸다고 보고 하였다 (Kim et al., 2010b).
본 연구에서 HEGR-E 추출물은 0.25, 0.5, 1.0, 2.0, 4.0㎎/㎖로 추출물의 농도가 증가할수록 700㎚에서 흡광도 로 측정한 환원력도 0.108, 0.126, 0.168, 0.216, 0.304 로 농 도 의존적으로 증가하였다. 환원력은 HEGR-E, HEGR-W, GR-E, GR-W 추출물 중에서 HEGR-E 추출물의 환원력이 더 높게 나타났으나 각 각의 시료 간 통계적으로 유의적인 차이 를 보이지는 않았다.
5. 산화적 스트레스에 의한 DNA 손상 억제 효과
산화적 스트레스에 의한 DNA의 손상을 억제하는 효과는 Fig. 3에 나타나 있다. 산화스트레스 상태에서 superoxide anion (O2-), hydrogen peroxide (H2O2), hydroxyl radical (•OH) 같은 고농도의 ROS 는 생체 분자에 손상을 일으켜 결 국 지방 과산화, 단백질 산화, DNA 손상 등을 야기한다 (Rhee, 2006). DNA 손상 억제 활성은 FeCl2 (ferric chloride)로 인한 산화적 스트레스와 FeSO4 (ferrous sulfate) 와 H2O2의 Fenton 반응에 의한 산화적 스트레스를 이용하여 시료의 DNA 손상 억제 활성을 평가하였으며 자유 라디칼로 유도된 pBR322 plasmid DNA 손상은 in vitro plasmid DNA breaks system을 통하여 평가하였다.
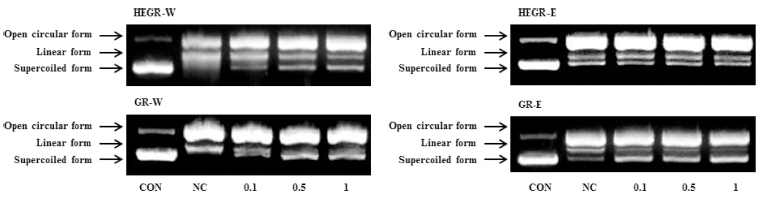
Protection activity of Hericium erinaceus grown on germinated green rice and germinated green rice on oxidative plasmid DNA damage.HEGR-W; Water extract of Hericium erinaceus grown on green rice, HEGR-E; Ethanol extract of Hericium erinaceus grown on green rice, GR-W; Water extract of green rice, GR-E; Ethanol extract of green rice. Agarose gel electrophoretic patterns of plasmid DNA breaks by OH (hydroxyl radical) generated from a fenton reaction in the presence of the water and ethanol extracts. Con; plasmid DNA control, NC; Negative control (0.08 mM FeSO4 and 30% H2O2 treatment). 0.1, 0.5, 1.0㎎/㎖ concentrations, extract treatment in the presence of FeSO4 and H2O2, respectively.
HEGR과 GR의 산화적 스트레스에 의한 DNA의 손상을 억 제하는 효과 Fig.3에서와 같이 negative control (0.08 mM FeSO4 and 30% H2O2 treatment)과 비교하였을 때 FeSO4에 의해 야기된 산화적 스트레스에 의한 DNA 손상 억제 활성은 HEGR와 GR 추출물 모두에서 나타났으나 free radical 소거능 과 환원력처럼 DNA의 산화적 손상 보호효과는 크게 나타나 지는 않았으나 추출물 0.1, 0.5, 1.0㎎/㎖에서 농도 의존적으 로 억제 활성을 보였다.
6. MTT assay에 의한 세포 생존율 측정
MTT를 이용하여 GR와 HEGR 추출물이 세포 생존율에 대 한 효과를 측정하였다 (Fig. 4). HEGR-W 및 HRGR-E 추출 물을 10㎍/㎖, 25㎍/㎖, 50㎍/㎖를 RAW264.7 cell에 처리 하였을 때 세포 생존율은 농도 의존적으로 감소하였으나 GR 추출물을 50㎍/㎖에서 생존율은 GR-W 추출물에서 82.8%, GR-E 추출물에서 93.0%의 생존율을 나타냈다. 또한 GR-W 및 GR-E 추출물을 RAW264.7 cell에 처리하였을 때 50㎍/㎖에서 GR-W 추출물 84.9%, GR-E 추출물은 93.9% 이상의 생존율을 나타냈다. 따라서 HEGR 및 GR 추출물은 50㎍/㎖ 이하로 처리하였을 때 세포 독성은 낮은 것으로 나 타났다.
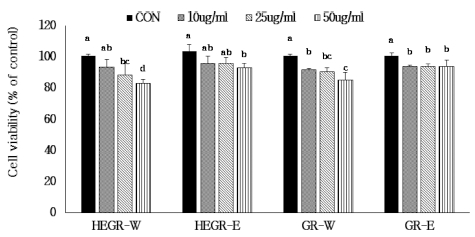
Effect of Hericium erinaceus grown on germinated green rice and germinated green rice on viability of RAW264.7 cells.HEGR-W; Water extract of Hericium erinaceus grown on green rice, HEGR-E; Ethanol extract of Hericium erinaceus grown on green rice, GRW; Water extract of green rice, GR-E; Ethanol extract of green rice. The result was statistically analyzed by One-way ANOVA and post-hoc Duncan Multiple Range Test (DMRT). The different letters indicate a significant difference for each extract with control (p < 0.05).
또한 MTT assay를 이용하여 HEGR 및 GR 추출물이 LPS (1㎍/㎖)로 유도된 RAW264.7 cell에서 세포 독성을 나 타내는지 확인하기 위하여 세포생존율을 측정하였다 (Fig. 5). 1㎍/㎖ LPS로 처리한 RAW264.7 cell에서 세포 생존율은 유 의적으로 (p < 0.05) 감소하였으나 HEGR와 GR 추출물을 10㎍/㎖, 25㎍/㎖, 50㎍/㎖ 농도로 처리했을 때 세포 생존 율은 LPS 처리군과 비교 시 거의 같거나 약간 증가하는 것으 로 나타났으며 특히 HEGR 에탄올 추출물을 처리했을 때 세 포 생존율은 18.4 - 21.8% 증가한 것으로 나타났다. 즉 RAW264.7 cell과 LPS로 유도된 RAW264.7 cell에서 HEGR 과 GR 추출물의 세포 독성은 낮은 것으로 나타났다.
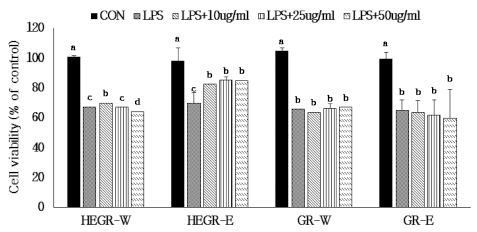
Effect of Hericium erinaceus grown on germinated green rice and germinated green rice on viability of LPS-stimulated RAW264.7 cells.HEGR-W; Water extract of Hericium erinaceus grown on green rice, HEGR-E; Ethanol extract of Hericium erinaceus grown on green rice, GR-W; Water extract of green rice, GRE; Ethanol extract of green rice. The result was statistically analyzed by One-way ANOVA and posthoc Duncan Multiple Range Test (DMRT). The different letters indicate a significant difference for each extract with control (p < 0.05).
7. Nitric oxide 생성 저해효과
GR 추출물이 LPS로 유도된 RAW264.7 cell에서 NO 생성 억제 활성에 대한 결과는 Fig. 6에 나타나 있다. ROS 등의 자유 라디칼에 의하여 생체 내의 세포 손상은 염증성 질환과 밀접한 관계를 있다 (Jin et al., 2010). 대식세포 (macrophage) 인 RAW264.7 cell에 내독소의 하나인 LPS를 처리했을 때 염 증성 proinfammatory cytokine을 증가하면서 NO 및 PGE2 등의 염증매개물질을 분비가 증가한다 (Kim et al., 2014). 따 라서 LPS로 유도된 RAW264.7 cell에서 생산하는 NO 생성 억제 효과를 측정하기 위하여 각 추출물을 처리한 후 시료의 NO 생성 억제 효과를 평가하였다.
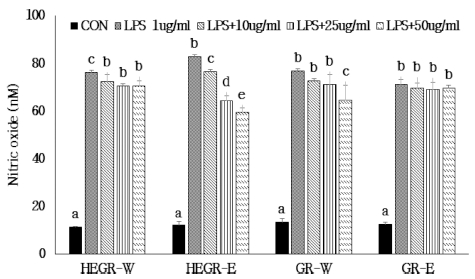
Effect of Hericium erinaceus grown on germinated green rice and germinated green riceon NO production by LPS-stimulated RAW264.7 cells.HEGR-W; Water extract of Hericium erinaceus grown on green rice, HEGR-E; Ethanol extract of Hericium erinaceus grown on green rice, GR-W; Water extract of green rice, GR-E; Ethanol extract of green rice. The result was statistically analyzed by One-way ANOVA and post-hoc Duncan Multiple Range Test (DMRT). The different letters indicate a significant difference for each extract with control (p < 0.05).
Fig. 6에서와 같이 HEGR-W와 HEGR-E 추출물을 10, 25, 50㎍/㎖으로 처리했을 때 LPS로 유도된 RAW264.7 cell에서 NO 생성 억제 활성이 나타냈다 (p < 0.05). 특히 HEGR-E 추 출물은 LPS 처리 시 세포 독성은 크게 나타나지 않았으나 NO 생성은 농도 의존적으로 억제되는 것으로 나타났고 또한 50㎍/㎖ HEGR-E 추출물을 처리했을 때 LPS로 유도된 RAW264.7 cell의 NO 생성량 보다 28.1%가 억제되는 것으로 나타났다. 또한 GR 추출물의 NO 생성 억제 효과는 GR-E 추출물에서는 유의적인 감소를 보이지 않았으나 GR-W 추출 물에서는 농도 의존적으로 NO 생성 억제 활성이 나타났으나 세포 생존율이 감소하였다. 즉 LPS로 유도된 RAW264.7 cell 에서 NO 생성 억제 활성은 HEGR-E 추출물이 가장 효과가 큰 것으로 나타냈으며 또한 세포 독성도 거의 없는 것으로 나 타났다. Nitric oxide는 감염부위에서 면역 활성화된 대식세포 에 의해 생성되는 것으로서 다양한 조직에서 신경전달, 혈관확 장 및 면역조절에서 중요한 역할을 담당 (Soe et al., 2009) 하고 있다.
따라서 HEGR-E 추출물과 같이 NO 생성저해활성이 높은 추출물은 감염반응과 질환의 치료 및 예방을 위한 약용 신소 재로의 활용가능성을 제시하고 있다고 사료된다.
본 연구에서는 생물전환을 통하여 약용 신소재를 개발하기 위하여 발아녹미 (GR)에 노루궁뎅이 버섯 (HE) 균사체를 처 리하여 배양한 발아녹미 노루궁뎅이 버섯을 70% 에탄올과 열 수로 추출한 HEGR 추출물의 항산화 및 항염증 효과를 GR 추출물과 비교 평가하였다.
HEGR 추출물의 총 페놀성 화합물 함량과 총 플라보노이드 함량이 GR 추출물에서 보다 높게 나타났으며 특히 HEGR-E 추출물 (66.53 ± 2.40㎎·GAE/100 g)에서 가장 많이 함유한 것 으로 나타났다. DPPH 라디칼 소거능도 추출물 농도 2㎎/㎖ 에서 HEGR-E (44.70 ± 1.28%)와 GR-E추출물 (42.98 ± 1.38%)의 소거능이 높게 나타났으며 ABTS 라디칼 소거능은 HEGR-E와 GR-E 추출물에서 HEGR-W와 GR-W 추출물보다 높게 나타났으며 HEGR-E와 GR-E 추출물 2.0㎎/㎖이상의 농도에서는 대조군인 ascorbic acid의 라디칼 소거능과 비슷한 소거능을 보였으며 특히 HEGR-E 추출물의 소거능이 가장 높 은 것으로 나타났다. 또한 모든 추출물의 환원력은 농도 의존 적으로 증가하였으며 특히 HEGR-E 추출물은 환원력이 높게 나타났다. 산화적 스트레스에 의한 DNA의 손상을 억제하는 효과는 HEGR과 GR 추출물에서 DNA 손상을 억제하는 활성 이 있는 것으로 나타났으나 라디칼 소거능 처럼 큰 효과를 보 이지 않았다. RAW264.7 cell과 LPS 처리한 RAW264.7 cell 에서 HEGR 및 GR 추출물 (10 - 50㎍/㎖)의 세포독성은 낮 게 나타났으며 LPS로 유도된 RAW264.7 cell에서 생산하는 NO 생성 억제 활성은 HEGR-E 추출물이 가장 효과가 큰 것 으로 나타났다.
이상의 결과를 통해 생물전환을 통한 약용 신소재 탐색하기 위하여 발아녹미에 노루궁뎅이 버섯의 균사체를 접종하여 배 양한 HEGR 추출물은 높은 항산화 활성과 항염증 효과를 나 타냈으며 특히 HEGR-E 추출물의 활성이 높게 나타났다. 이 러한 결과들은 HEGR 추출물이 약용신소재로서 기능성 식의 약품 후보제로서 가능성이 있음을 시사하고 있다. 향후 HEGR 의 유효 성분 분석과 항산화 및 항염증 작용 기전에 대한 연 구가 이루어져야 할 것으로 사료된다.
감사의 글
본 연구는 농촌진흥청 연구사업(과제번호: PJ011335032017) 의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
- Alan, C, Jennifer, B, Azlina, AA, Amanda, JS, Helena, SR, Gareth, IJ, Christine, AE, Michael, EL, Antioxidant flavonols from fruits, vegetables and beverages Measurements and bioavailability, Biological Research, (2000), 33, p79-88.
- An, CS, Choi, SY, Jin, HL, Jeon, YH, Hur, SJ, Kim, IH, Park, GD, Jeoung, YJ, Lim, BO, Immunomodulatory effects of Phellinus linteus extracts on liver damage induced by carbon tetrachloride in rats, Korean Journal of Medicinal Crop Science, (2009), 17, p217-222.
- Choi, SP, Kang, MY, Nam, SH, Inhibitory activity of the extracts from the pigmented rice brans on inflammatory reactions, Journal of the Korean Society for Applied Biological Chemistry, (2004), 47, p222-227.
- Choi, SW, Nam, SH, Choi, HC, Antioxidative acticity of ethanolic extracts of rice bran, Food and Biotechnology, (1996), 5, p305-309.
-
Dutta, AK, Gope, PS, Banik, S, Makhnoon, S, Siddiquee, MA, Kabir, Y, Antioxidant properties of ten high yielding rice varieties of Bangladesh, Asian Pacific Journal of Tropical Biomedicine, (2012), 2, pS99-S103.
[https://doi.org/10.1016/s2221-1691(12)60137-3]

- Guo, YJ, Deng, GF, Xu, XR, Wu, S, Li, S, Xia, EQ, Li, F, Chen, F, Ling, WH, Li, HB, Antioxidant capacities, phenolic compounds and polysaccharide contents of 49 edible macrofungi, Food and Function, (2012), p1195-1205.
- Heim, KE, Tagliaferro, AR, Bobilya, DJ, Flavonoid antioxidants Chemistry, metabolism and structure-activity relationships, The Journal of Nutritional Biochemistry, (2002), 3, p572-584.
-
Hippeli, S, Elstner, EF, Inhibition of biochemical model reactions for inflammatory processes by plant extracts A review on recent developments, Free Radical Research, (1999), 31, pS81-S87.
[https://doi.org/10.1080/10715769900301361]

- Jeong, EJ, Sung, SH, Kim, J, Kim, SH, Kim, YC, Rhus verniciflua stokes attenuates glutamate-induced neurotoxicity in primary cultures of rat cortical cells, Natural Product Sciences, (2008), 14, p156-160.
-
Jeong, SJ, Kim, KH, Yook, HS, Whitening and antioxidant activities of solvent extracts from hot-air dried Allium hookeri, Journal of the Korean Society of Food Science and Nutrition, (2015), 44, p832-839.
[https://doi.org/10.3746/jkfn.2015.44.6.832]

- Jin, JH, Kim, JS, Kang, SS, Son, KH, Chang, HW, Kim, HP, Anti-inflammatory and anti-arthritic activity of total flavonoids of the roots of Sophora flavescens, Journal of Ethnopharmacology, (2010), 27, p589-595.
- Jung, MJ, Yin, Y, Heo, SI, Wang, MH, Antioxidant and anticancer activities of extract from Artemisia capillaries, Korean Journal of Pharmacognosy, (2008), 39, p194-198.
- Kawagishi, H, Shimada, A, Hosokawa, S, Mori, H, Sakamoto, H, Ishiguro, Y, Sakemi, S, Bordner, J, Kojima, N, Furukawa, S, Erinacines, EFG, stimulators of nerve growth factor(NGF)-synthesis, from the mycelia of Hericium erinaceum, Tetrahedron Letters, (1996), 37, p7399-7402.
-
Kim, BW, Kim, JI, Kim, HR, Byun, DS, Antiinflammatory effect of an ethyl acetate fraction from Myagropsis yendoi on lipopolysaccharides-stimulated RAW264.7 cells, The Korean Society of Fisheries and Aquatic Science, (2014), 47, p527-536.
[https://doi.org/10.5657/kfas.2014.0527]

- Kim, DE, Choi, KO, Kang, WS, Lim, JD, Ko, SH, Up-to-date food processing technologies for herbal medicine, Korean Journal of Medicinal Crop Science, (2010a), 18, supplement 2p93-102.
-
Kim, DH, Park, SR, Debnath, T, Hasnat, MDA, Pervin, M, Lim, BO, Evaluation of the antioxidant activity and anti-inflammatory effect of hericium erinaceus water extracts, Korean Journal of Medicinal Crop Science, (2013), 21, p112-117.
[https://doi.org/10.7783/kjmcs.2013.21.2.112]

- Kim, DJ, Oh, SK, Yoon, MR, Chun, AR, Hong, HC, Lee, JS, Kim, YK, Antioxidant compounds and antioxidant activities of the 70% ethanol extracts from brown and milled rice by cultivar, Journal of the Korean Society of Food Science and Nutrition, (2010b), 39, p467-473.
- Kim, YD, Ha, KY, Lee, KB, Shin, HT, Cho, SY, Varietal variation of anthocyanin content and physicochemical properties in colored rice, Korean Journal of Breeding Science, (1998), 30, p305-308.
-
Lee, SJ, Kim, EK, Oh, HJ, Kwon, HJ, Hwang, JW, Moon, SH, Jeon, BT, Park, PJ, Lim, BO, Free radical scavenging activity and protective effect against H2O2-induced stress in neuronal cells of enzymatic extracts from Sarcodon aspratus, Korean Journal of Medicinal Crop Science, (2011), 19, p77-82.
[https://doi.org/10.7783/kjmcs.2011.19.2.077]

- Nam, SH, Chang, SM, Kang, MY, Varietal difference in antioxidative activity of ethanolic extracts from colored rice bran, Journal of the Korean Society of Agricultural Chemistry and Biotechnology, (2003), 46, p16-22.
-
Nathan, C, Nitric oxide as a secretory product of mammalian cells, The FASEB Journal, (1992), 6, p3051-3064.
[https://doi.org/10.1096/fasebj.6.12.1381691]

- Nieva Moreno, MI, Isla, MI, Sampietro, AR, Vattuone, MA, Comparison of the free radical-scavenging activity of propolis from several regions of Argentina, Journal of Ethnopharmacology, (2000), 71, p109-114.
-
Oki, T, Masuda, M, Kobayashi, M, Nishiba, Y, Furuta, S, Suda, I, Sato, T, Polymeric procyanidins as radicalscavenging components in red-hulled rice, Journal of Agriculture and Food Chemistry, (2002), 50, p7524-7529.
[https://doi.org/10.1021/jf025841z]

- Park, JH, Quality, antioxidative properties of popped brown and pigmented waxy rice for making 'Ssalyeotgangjeong'. Master Thesis, (2015), Chonnam National University, p1-76.
- Rhee, SG, H2O2, a necessary evil for cell signaling, Science, (2006), 312, p1882-1883.
-
Seo, KH, Kim, YH, Lee, YM, Ghosh, M, Park, KM, Park, DH, Kim, JS, Lim, BO, Evaluation of anti-oxidant and anti-inflammatory activities of Ganoderma iucidum cultured on hulled barley, Korean Journal of Medicinal Crop Science, (2017), 25, p29-36.
[https://doi.org/10.7783/kjmcs.2017.25.1.29]

-
Seo, SJ, Choi, Y, Lee, SM, Kong, S, Lee, J, Antioxidant activities and antioxidant compounds of some specialty rices, Journal of the Korean Society of Food Science and Nutrition, (2008), 37, p129-135.
[https://doi.org/10.3746/jkfn.2008.37.2.129]

- Soe, JS, Lee, TH, Lee, SM, Lee, SE, Seong, NS, Kim, J, Inhibitory effects of methanolic extracts of medicinal plants on nitric oxide production in activated macrophage RAW264.7 cells, Korean Journal of Medicinal Crop Science, (2009), 17, p173-178.
-
Tian, B, Hua, Y, Concentration-dependence of prooxidant and antioxidant effects of aloin and aloe-emodin on DNA, Food Chemistry, (2005), 91, p413-418.
[https://doi.org/10.1016/j.foodchem.2004.06.018]

- Tizard, IR, Immunology An introduction inflammation, (1986), 2th ed, Saunders College Publishing, New York. NY, USA, p423-441.
- Tsegaye, Z, Growing of oyster mushrooms using agricultural residues at Ethiopian biodiversity institute Addis Ababa, Ethiopia, Academia Journal of Microbiology Research, (2015), 3, p14-21.
-
Vauzour, D, Rodriguez-Mateos, A, Corona, G, Oruna-Concha, MJ, Spencer, JPE, Polyphenols and human health Prevention of disease and mechanisms of action, Nutrients, (2010), 2, p1106-1131.
[https://doi.org/10.3390/nu2111106]

-
Wadsworth, TL, Koop, DR, Effects of the wine polyphenolics quercetin and resveratrol on pro-inflammatory cytokine expression in RAW264.7 macrophages, Biochemical Pharmacology, (1999), 57, p941-949.
[https://doi.org/10.1016/s0006-2952(99)00002-7]

- Wang, XJ, Sun, H, Liu, ZS, Quantitative analysis of 6,7-dimethylesculetin and capillarisine in Artemisia capillaris thunb. and prescriptions containing the crude drug, China Journal of Chinese Materia Medica, (1994), 19, p667-670.
- Xie, QW, Whisnant, R, Nathan, C, Promoter of the mouse gene encoding calcium-independent nitric oxide synthase confers inducibility by interferon γ and bacterial lipopolysaccharide, Journal of Experimental Medicine, (1993), 177, p1779-1784.
- Yildirim, A, Mavi, A, Kara, AA, Determination of antioxidant and antimicrobial activities of Rumex crispus L extracts, Journal of Agricultural and Food Chemistry, (2001), 49, p4083-4089.