H2O2로 유도된 C6 신경교세포의 세포사멸에 대한 감초 추출물과 감초 활성물질의 보호효과
†Corresponding author: +82-43-871-5759+82-51-510-2837 ptman123@korea.kr ejcho@pusan.ac.kr
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Glycyrrhiza uralensis Radix (GR) is a crude drugs used in Asian countries that has been reported to prevent the progression of neurodegenerative diseases such as Alzheimer’s disease. The present study examined whether GR and its active compounds, glycyrrhizic acid (GA) and isoliquiritigenin (IL), exerted protective effects on H2O2-induced oxidative damage in C6 glial cells.
We exposed C6 glial cells to hydrogen peroxide (H2O2) for 24 h and investigated the cellular response to GR and its active compounds by evaluating cell viability, reactivie oxygen species (ROS) production, and apoptosis-related protein expression. GR successfully mitigated the reduced cell viability and ROS production induced by H2O2 in C6 glial cells, IL and GA significantly increased the cell viability and decreased ROS production. In addition, IL and GA down-regulated apoptotic Baxdependent caspase-3 activation, but each compound exerted different mechanisms, i.e., IL dose-dependently decreased ROS production and, GA up-regulated anti-apoptotic Bcl-2 expression.
These results demonstrated that GR and its active components, IL and GA, exhibit potential for use as natural neurodegenerative agents for the modulation of apoptosis in C6 glial cells.
Keywords:
Glycyrrhiza uralensis, Apoptosis, C6 Glial Cell, Glycyrrhizic Acid, Isoliquiritigenin, Oxidative Stress서 언
전 세계적으로 평균 수명이 연장됨에 따라 신경퇴행성 질환 의 발병율이 증가하고 있으며, 신경퇴행성 질환의 대부분을 차 지하고 있는 알츠하이머 질환 (Alzheimer’s disease, AD)은 amyloid beta protein의 축적, 산화적 스트레스 (oxidative stress)로 인한 신경세포 기능 장애, 뇌신경세포 사멸 등의 원 인으로 인해 발병하는 것으로 보고되었으며, 이는 인지능력 및 기억력 손상 등의 증상을 나타낸다 (Finkel and Holbrook, 2000; Hardy and Selkoe, 2002; Smith et al., 2000).
AD의 다양한 발병원인 중 산화적 스트레스는 과량의 활성산 소종 (reactive oxygen species, ROS)의 생성으로 인해 체내 산화/항산화 체계의 불균형이 초래되어 발생하는 것으로, ROS 의 일종인 hydroxyl radical (•OH), superoxide radical (O2−), hydrogen peroxide (H2O2) 등이 DNA, 단백질, 지질, 탄수화물 등의 체내 구성요소를 파괴시켜 염증반응 (inflammation), 세포 사멸 (apoptosis) 등을 일으키며, 특히 뇌에서 과다한 ROS의 생성으로 인한 뇌신경세포의 사멸은 인지능력 및 기억력 손상 의 대표적인 원인으로 알려져 있다 (Finkel and Holbrook, 2000; Warner, 1994). 뿐만 아니라 뇌의 신경교세포 (glial cell) 는 뇌신경세포의 기능을 유지하는데 중요한 역할을 하는데, 신 경교세포에서 ROS의 축적은 신경세포의 기능 손상 및 세포사 로 인한 세포독성을 유발하게 된다 (de Bernardo et al., 2004; Qian et al., 2005). 그러므로, 신경교세포의 보호는 신경퇴행성 질환의 예방 및 치료 요소로써 작용한다.
인지능력 및 기억력 개선을 위한 다양한 치료제가 개발되었 으나, 구역질, 구토 등의 체내 부작용이 보고됨에 따라 섭취 시 독성과 부작용이 적은 천연물 및 식품 유래 소재에 대한 연구가 활발히 이루어지고 있다 (Giacobini, 2000; Lim et al., 2001). 특히 항산화 활성을 지닌 Ginkgo biloba, curcumin 등의 천연물 소재는 산화적 손상 시 ROS의 독성에 대한 보호 작용, ROS 생성 시 중간 대사물의 제거 및 변환 등을 통해 손상된 뇌신경세포를 보호하는 것이 밝혀짐에 따라, 인지능력 및 기억력 개선 소재로써의 관심이 증가하고 있다 (Lim et al., 2001; Oyama et al., 1996; Sen, 1995).
감초 (Glycyrrhiza uralensis Radix)는 콩과 (Legumiosae)의 다년생 초본으로 예로부터 진해, 염증, 약물 중독 등을 치료하 기 위해 한방에서 널리 사용되어 왔으며, 최근에는 항산화, 항 암, 항바이러스, 간 보호 등의 효능이 보고되었다 (Gong et al., 2015; Jung et al., 2015; Park et al., 2011; Um et al., 2009; Yang et al., 2013). 이전 연구에 의하면, 감초는 AD의 원인 중 하나인 acetylcholinesterase 효소를 저해시킬 뿐만 아니라, AD 동물 모델에서 인지능력 개선 효과를 나타 내어 AD 예방 가능성을 보여주었다 (Ahn et al., 2006; Um et al., 2013). 또한, 감초의 활성물질에는 단맛을 내는 주요 성분인 glycyrrhizic acid (GA) 등의 glycyrrhizin 계열 화합 물과 liquiritin, liquiritigenin, isoliquiritigenin (IL) 등의 flavonoids 및 isoflavonoids 계열의 항산화 활성이 우수한 성 분을 함유하는 것으로 알려져 있다 (Asl and Hosseinzadeh, 2008; Um et al., 2009).
그러나, 감초 및 감초 활성물질의 신경교세포에서 세포사멸 에 대한 보호 효과 관련 연구는 부족한 실정이다. 따라서 본 연구에서 H2O2로 산화적 손상을 통해 세포사멸을 유도한 신 경교세포에 있어서 감초 및 감초 활성물질의 신경세포의 보호 효과 및 작용기전에 대해 살펴보고자 한다.
재료 및 방법
1. 시료
실험에 사용된 감초 (Glycyrrhiza uralensis Radix)는 제천 에서 재배 증식된 2 년생 감초를 2014년 11월 28일에 채종하 였다. 식물체 일부는 정확한 동정을 위해 표본으로 제작 후, 한국약용자원표본관 (KMRH)에 검증표본으로 보관하고 있다. 감초 뿌리 886 g을 세척 및 건조였으며 건조된 505 g의 감초 뿌리를 50% 에탄올로 실온에서 침전 72 시간 후 추출하여 얻은 5.5 g의 감초 추출물 (수율 1.09%)을 실험에 사용하였다 (Han et al., 2013). 감초의 활성물질인 isoliquiritigenin (IL, 순도 98.00% 이상)과 glycyrrhizic acid (GA, 순도 90.00% 이상)는 Sigma-Aldrich (St. Louis, MO, USA)에서 구매하여 실험에 사용하였다.
2. 세포 종류 및 시약
C6 신경교세포는 한국세포주은행 (KCLB, Korea Cell Line Bank, Seoul, Korea)에서 분양 받아 실험에 사용하였으며, 배 양을 위해 필요한 100 units/㎖의 penicillin streptomycin, 10% fetal bovine serum (FBS), Dulbecco’s modified Eagle medium (DMEM), trypsin-ethylenediaminetetraacetic acid (EDTA) 시약은 WelGENE (Gyeongsan, Korea)에서 구입하여 사용하였다. 산화적 스트레스를 유발하기 위한 H2O2는 Junsei Chemical (Tokyo, Japan)사의 제품을, 세포 생존율과 ROS 소 거능 측정을 위해 사용한 3-(4,5-dimethylthiazol-2-yl)-2,5- diphenyltetrazolium bromide (MTT)는 Bio Basic (Markham, Canada)사에서, dimethyl sulfoxide (DMSO)는 Bio Pure (Burlington, Ontario, Canada)사에서, dichlorofluorescein diacetate (DCF-DA)는 Sigma-Aldrich (St. Louis, MO, USA)사 제품을 구매하여 사용하였다. RIPA cell lysis buffer 는 Elpis Biotech (Daejeon, Korea)에서 구입하였고, 1 차 항 체로 사용한 Bcl-2-associated X protein (Bax), B-cell lymphoma-2 (Bcl-2)는 Santa Cruz Biotechnology (Dallas, TX, USA)에서, caspase 3와 2 차 항체로 사용한 anti-rabbit IgG HRP-linked antibody는 Cell Signaling Technology (Danvers, MA, USA)에서 구입하여 사용하였다.
3. 세포 배양
실험에 사용한 신경교세포는 10%의 FBS와 1%의 penicillin streptomycin이 포함된 DMEM 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다. 배양된 세포는 2 - 3일 마다 배양액 을 바꾸어 주었으며, 세포 분화가 최대에 도달하였을 때 phosphate buffered saline (PBS, pH 7.4)로 세포를 세척 후, 0.05% trypsin과 0.02% EDTA 혼합액으로 부착된 세포를 분 리하여 원심 분리를 통해 집적 시켰다. 집적된 세포는 피펫을 이용하여 세포가 골고루 분산되도록 잘 혼합하여 계대 배양하 면서 실험에 사용하였다.
4. 세포 생존율 측정
Confluence 상태가 된 신경교세포를 96 well plate에 well 당 5 × 104 cells/㎖로 seeding하여 37℃에서 4 시간 배양 후, 세포가 잘 부착되면 시료를 각각의 농도별로 처리하여 37℃에 서 2 시간 배양하였다. 그 뒤, 산화적 스트레스를 유발하기 위 하여 300 μM의 H2O2를 처리하여 배양하였다. 24 시간 뒤, 5㎎/㎖의 MTT solution을 각 well에 주입하여 4 시간 배양 후 생성된 보라색의 formazan 결정을 DMSO에 녹여 540㎚ 에서 흡광도를 측정하였다 (Mosmann, 1983).
5. ROS 소거능 측정
신경교세포가 confluence 상태가 되면 96 well black plate 에 well당 5 × 104 cells/㎖로 seeding하여 37℃에서 4 시간 배 양하여 세포가 잘 부착되면, 시료를 각각의 농도별로 처리하여 2 시간 배양 후 1 mM의 H2O2를 처리하여 배양하였다. 24 시 간 뒤, DCF-DA reagent (10 μM)를 각 well에 주입 후, ROS 생성량을 확인하기 위해 FLUOstar OPTIMA (BMG labtech., Ortenberg, Germany) excitation-480㎚, emission-535㎚를 이 용하여 형광을 측정 후 정량하였다 (Marchesi et al., 1999).
6. Western Blot Analysis
단백질 발현을 확인하기 위하여 신경교세포를 harvest한 뒤, RIPA buffer를 첨가하여 4℃에서 1 시간 동안 반응시킨 후, 12,000 rpm에서 30 분간 원심 분리하여 상층액의 단백질을 분리하였다. 분리한 단백질은 단백질 정량 시약인 Bio-Rad protein assay kit을 이용하여 정량하고, Laemmli sample buffer (Bio-Rad, Hercules, CA, USA)와 혼합하여 실험에 사 용하였다. 동량의 sample을 10% sodium dodecyl sulphate (SDS)-polyacrylamide gel을 이용하여 전기영동으로 분리한 후, polyvinylidene difluoride (PVDF) membrane에 transfer하여 5% skim milk에서 1 시간 동안 blocking 하였다. 1 차 항 체를 처리하여 4℃에서 overnight 반응시킨 후, 2 차 항체와 상온에서 1 시간 반응 시켰다. 이후 PBS-T로 세척 후 enhanced chemiluminescence (ECL) solution과 반응시킨 후 Chemiliuminescence image system (Davinch-ChemiTM, Davinchi-K, Seoul, Korea)을 이용하여 특정 단백질의 발현을 확인하였다.
7. 통계분석
모든 실험 결과는 평균 ± 표준편차 (means ± SD)로 나타내 었으며, 통계 프로그램인 Statistical Package for the Social Sciences (version 12.0, SPSS Inc., Chicago, IL, USA)를 이용하여 분산분석 (ANOVA)으로 각 실험군 간의 차이를 Duncan’s Multiple Range Test (DMRT)를 이용하여 p < 0.05 수준에서 각 군의 유의성을 검정하였다.
결과 및 고찰
체내에서 과잉 생성되는 H2O2는 세포 독성을 일으킬 뿐만 아니라, 산화적 손상을 일으키는 •OH 등으로 전환되며, 체내 여러 조직 및 기관에 산화적 스트레스를 일으킨다 (Oda et al., 2010). 특히, 뇌는 다른 조직에 비해서 산화적 손상에 대 해 매우 민감하며, 뇌신경세포에 H2O2와 같은 ROS가 작용 시 지질과산화, 염증반응, 세포사멸 등을 통한 생리학적, 병리 학적 문제를 일으켜 신경퇴행성 질환의 원인이 되는 것으로 보고되어 있다 (Behl et al., 1994; Desagher et al., 1996).
본 연구에서는, 감초 (Glycyrrhiza uralensis Radix) 추출물 과 감초의 활성성분이 H2O2로 유발시킨 신경교세포에서의 산 화적 손상에 대한 보호 효과에 대해 살펴보았다.
감초 추출물의 신경세포 보호 효과를 살펴보기 위해 MTT reduction assay를 이용하여 세포 생존율을 측정한 결과 (Fig. 1), H2O2를 처리하여 산화적 스트레스를 유도한 대조군 의 경우, 아무것도 처리하지 않은 정상군에 비해 59.39%로 감 소함으로써 H2O2에 의한 산화적 손상이 관찰되었다. 반면, 감 초를 5, 10, 25㎍/㎖의 농도로 각각 처리했을 경우, H2O2만 을 처리한 control군에 비해 유의적으로 높은 수치를 나타내어 산화적 손상에 대한 신경세포 보호 효과를 확인하였다. 감초 50% EtOH 추출물을 처리하여 세포 실험을 진행한 이전 연구 에서 50㎍/㎖의 농도에서 세포 독성이 없는 것으로 보고되 었으며 (Han et al., 2013), 사전 연구를 통해 C6 신경교세포 에 감초 추출물을 농도별로 처리하여 세포 생존율에 영향을 미치지 않는 최대 농도를 확인 후 실험을 진행하였다 (Data not shown). 농도 유의적 차이를 보고자 5, 10, 25㎍/㎖의 농도로 실험을 진행하였으며, 그 결과 감초 추출물의 세포 생 존율은 농도 의존적이지는 않으나 세포 보호 효과에 대한 통 계적 유의성이 있는 것으로 확인되었다.
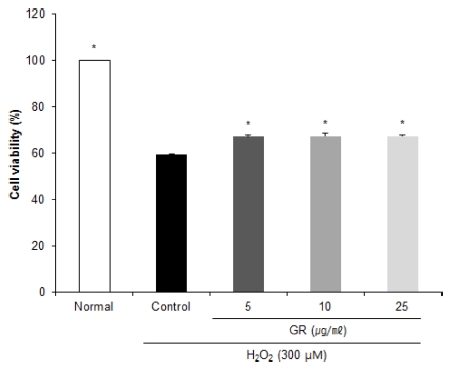
Effects of ethanol extract from Glycyrrhizae uralensis Radix (GR) on cell viability of C6 glial cells treated with H2O2.Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
DCF-DA assay는 세포 내 ROS의 존재 시 DCFH와 반응 하여 형광물질로 전환되는 원리를 이용한 방법으로, cellular system에서 ROS 소거능 측정에 널리 사용되는 방법이다 (Jang and Surh, 2001; Marchesi et al., 1999). DCF-DA assay를 통해 감초 추출물의 ROS 소거능을 살펴 본 결과, H2O2를 1 mM의 농도로 신경교세포에 처리하였을 때 시간이 지남에 따라 ROS 생성율이 증가함을 확인하였다 (Fig. 2A). H2O2 만을 처리한 control군의 ROS 생성율을 100%라고 하였 을 때, 아무것도 처리하지 않은 normal군은 74.88%의 수치를 나타내어 control군이 산화적 손상으로 인해 ROS 생성율이 증 가함을 확인하였다 (Fig. 2B). 반면 감초 추출물을 농도별로 처리한 결과, 5㎍/㎖와 10㎍/㎖의 농도에서 control군에 비 해 유의적으로 낮은 수치를 나타내었으며, 농도 유의적이지는 않으나 산화적 손상 시 ROS 생성의 감소를 통해 신경세포에 서 산화적 손상에 대한 보호 효과를 나타냄을 확인하였다. 이 전 연구에 의하면 Fe3+-EDTA/H2O2계에서 생성된 ROS가 50% 감소되는데 필요한 감초 추출물의 농도는 1㎍/㎖로써, 감초 추출물은 낮은 농도에서 우수한 ROS 소거능을 나타내 었다 (Han et al., 2013). 따라서 감초 추출물은 저농도에서 산화적 손상에 대한 보호 효과가 우수한 것으로 생각되며 고 농도에서의 보호 효과와 관련한 보다 깊은 연구가 수행되어야 할 것으로 사료된다.
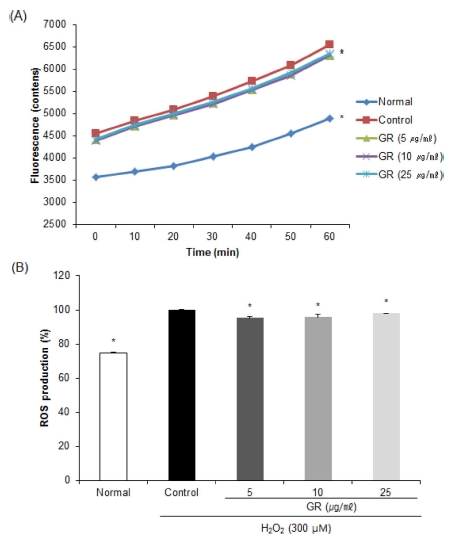
Effects of ethanol extract from Glycyrrhizae uralensis Radix (GR) on level of reactive oxygen species in C6 glial cell treated with H2O2.Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
감초의 신경세포 보호 효과 관련 작용 기전을 구체적으로 확인하기 위해, 감초의 대표적인 활성성분인 glycyrrhizic acid (GA)와 isoliquiritigenin (IL)의 신경세포 보호 효과를 확인하 였다. 사전 연구에서 감초 추출물 중의 활성성분 함량을 HPLC를 통해 측정한 결과, IL은 0.32 ± 0.01 g/㎏ (0.0003%), GA는 31.22 ± 0.76 g/㎏ (0.03%)의 함량을 나타내어, 감초 추 출물 25㎍/㎖에는 IL의 함량이 0.0075㎍, GA의 함량이 0.75㎍ 함유되어 있음을 확인하였다. 따라서 1 μM의 IL의 함 량이 각각 0.26㎍/㎖, GA의 경우 0.84㎍/㎖임을 미루어 보 았을 때, 감초 추출물 25㎍/㎖에는 IL이 약 0.03 μM, GA가 0.89 μM (약 1 μM)의 함량을 나타냄을 알 수 있었다. 따라서 IL과 GA의 최소 농도로 1 μM의 농도를 설정하였으며, IL과 GA를 처리하여 신경교세포에 세포 독성이 나타나지 않은 10 μM의 농도를 최대 농도로 설정하여 (Data not shown, Kao et al., 2009; Yang et al., 2013), 신경세포 보호 효과에 대한 연구를 진행하였다.
H2O2로 산화적 손상을 유도한 신경교세포에 감초 활성물질 을 처리하여 세포 생존율을 측정한 결과 (Fig. 3), control군의 경우 49.62%의 낮은 세포 생존율을 나타내었으나, IL과 GA 를 1, 5, 10 μM의 농도로 각각 처리 시 농도 유의적으로 세 포 생존율의 수치가 증가하였으며, 특히 GA를 10 μM의 농도 로 처리 시 68.37%의 높은 수치를 나타내어 H2O2로 손상을 유도한 신경교세포에서의 보호 효과를 확인하였다.
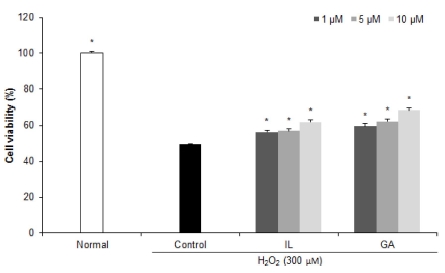
Effects of isoliquiritigenin (IL) and glycyrrhizic acid (GA) on cell viability of C6 glial cells treated with H2O2.Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
활성물질의 ROS 소거 활성을 확인한 결과 (Fig. 4), 감초 활성물질을 농도별로 처리했을 때 GA에 비해 IL을 처리한 군 에서 농도 의존적으로 ROS 생성이 감소함을 확인하였으며, 특히 IL을 10 μM의 농도로 처리한 경우 83.04%의 가장 낮은 수치를 나타내어 IL의 우수한 ROS 소거 활성을 확인하였다. 이 전 연구에 의하면, amyloid beta, glutamate, 6-hydroxydopamine 등으로 산화적 손상 및 세포사멸을 유도한 뇌신경세포에서 감 초로부터 분리한 IL은 ROS 및 nitric oxide 생성 억제를 통 한 항산화 활성 증가로 인해 신경세포 보호 효과를 나타낸 것 으로 보고되었다 (Hwang and chun, 2012; Lee et al., 2012; Yang et al., 2012). 따라서 감초 활성물질 중 isoflavonoids 계열의 IL이 ROS 소거 활성을 통해 신경세포를 보호하는 것으로 사료된다.
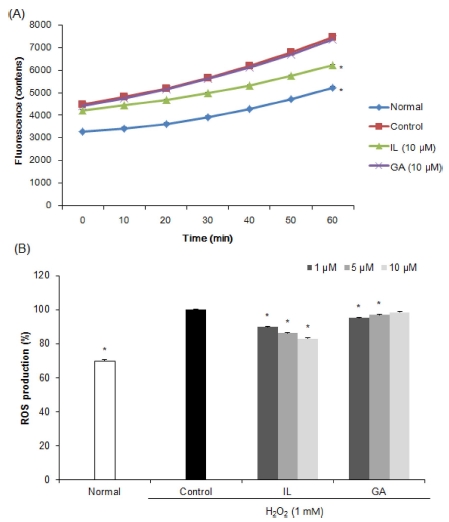
Effects of isoliquiritigenin (IL) and glycyrrhizic acid (GA) on level of reactive oxygen species in C6 glial cell treated with H2O2.Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
뇌에서 과다한 ROS의 생성은 산화적 손상 뿐만 아니라, Bcl family와 caspase pathway의 발현의 조절을 통해 뇌 신 경세포 사멸이 일어나며, 이는 인지능력 및 기억력 손상으로 이어져 신경퇴행성질환의 원인이 된다 (Whittemore et al., 1995). 세포사멸에 관여하는 Bcl family의 주요 인자 중 하나 인 Bax 단백질은 세포사멸을 촉진하는 인자로써, 세포의 손상 을 받을 시 증가하며 이는 cytochrome c를 방출하여 caspase pathway를 활성화시켜 세포사멸을 일으키는 반면 Bcl-2는 항 세포사멸 인자로써 세포사멸에 대한 보호 기전으로 작용한다 (Oltvai et al., 1993). 세포사멸에 관여하는 단백질인 Bax와 Bcl-2의 발현을 확인한 결과 (Fig. 5), H2O2만을 처리한 control 군의 경우 아무것도 처리하지 않은 normal군에 비해 유의적으 로 Bax 발현의 증가와 Bcl-2 발현의 감소를 확인하였다. 그러 나 IL과 GA를 10 μM의 농도로 처리했을 경우, Bax 발현의 감소와 Bcl-2 발현의 증가를 나타내어 감초 활성성분인 IL과 GA의 세포사멸에 대한 보호 효과를 확인하였다. 특히 IL을 처 리한 군에 비해 GA를 처리한 군에서 우수한 세포사멸에 대한 보호 활성을 나타내었다.
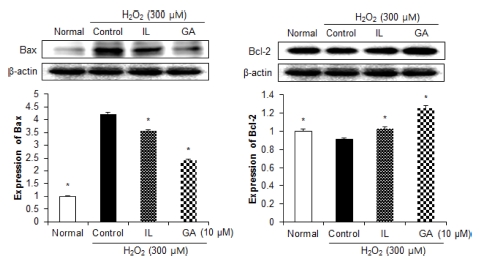
Effects of 10 μM isoliquiritigenin (IL) and glycyrrhizic acid (GA) on Bax and Bcl-2 protein expressions in C6 glial cell treated with H2O2.β- actin was used as a loading control. Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
뇌신경세포 손상으로 인한 세포사멸 과정은, Bax 발현으로 인한 cytochrome c 발현의 증가는 caspase family의 일종인 caspase 9을 cleaved의 형태로 활성화시키고, 이는 caspase 3 를 활성화시켜 세포사멸을 일으킨다 (Vila and Przedborski, 2003). 세포사멸에 대한 보호 작용 기전을 확인하기 위해 caspase 3의 발현을 확인한 결과 (Fig. 6), 아무것도 처리하지 않은 normal군에 비해 산화적 손상을 유도한 control군에서 caspase 3의 활성이 증가하였으나, 감초 활성물질을 처리 시 control군에 비해 유의적으로 낮은 발현을 나타내어 세포사멸에 대한 보호 효과를 확인하였다. 또한, IL을 처리한 군에 비해 GA를 처리한 군에서 더 낮은 발현을 나타냄을 확인하였다. 이 전의 연구에서 세포사멸을 유도한 신경세포에 GA (12.5 μM) 를 처리하였을 경우 Bax/Bcl-2 및 cleaved caspase3의 조절을 통해 세포사멸에 대한 신경세포 보호 효과를 나타내어 본 연 구와 유사한 결과를 나타내었으며 (Wang et al., 2014), 산화적 손상을 받은 신경세포에 GA (25 μM)의 처리는 extracellular signal-regulated kinase pathway 조절을 통한 항 세포사멸 활 성을 나타내어 GA는 신경세포에서의 세포사멸에 대한 보호 효과가 우수한 것으로 사료된다 (Teng et al., 2014). 뿐만 아 니라, 산화적 손상을 유도한 신경세포에 IL을 50 μM의 농도 로 처리하였을 시 Bcl-2/Bax 발현 조절을 통한 항 세포사멸 작용을 통한 신경세포 보호 효과를 확인하였다 (Yang et al., 2013).
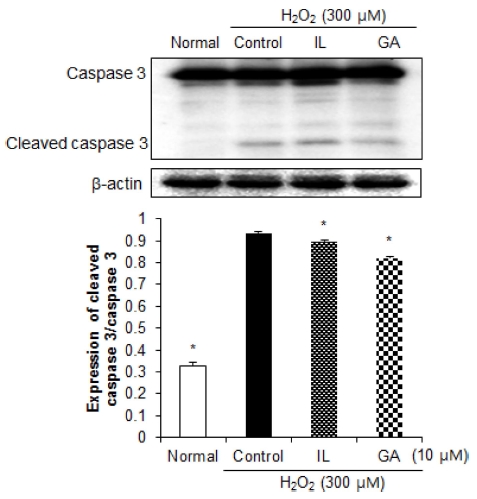
Effects of 10 μM isoliquiritigenin (IL) and glycyrrhizic acid (GA) on caspase 3 protein expressions in C6 glial cell treated with H2O2.β-actin was used as a loading control. Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
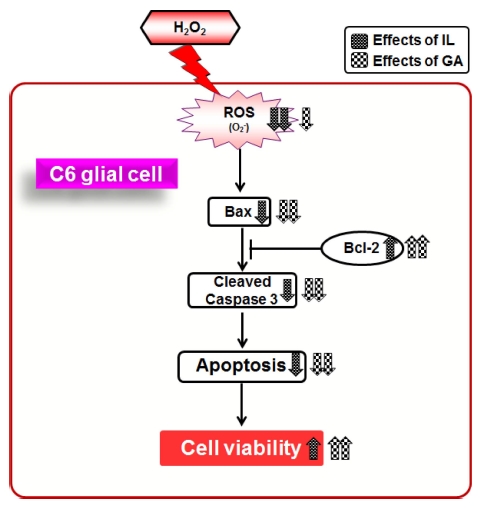
본 연구결과로부터, 감초가 H2O2로 인한 산화적 손상으로 유도되는 신경교세포의 세포사멸에 대한 보호 효과가 입증되 었다. 또한, 감초의 활성성분은 H2O2에 의해 감소된 신경교세 포의 생존율과 세포사 촉진 단백질인 Bax에 의존적으로 활성 화되는 caspase 3의 활성화를 서로 다른 작용기전에 의해 개 선하였다 (Fig. 7). IL는 농도 의존적으로 산화적 스트레스의 생성을 감소시켰으며, GA은 세포사멸 관련 단백질인 Bax와 Bcl-2의 발현 조절을 통해 H2O2에 의한 세포사멸로부터 신경 교세포를 보호하였다. 따라서, 감초와 감초의 활성성분은 신경 교세포의 세포사멸 억제활성을 통해 천연 신경 퇴행성 치료제 로써의 개발 가능성이 전망된다.
감사의 글
본 연구는 농촌진흥청 차세대바이오그린21사업(과제번호: PJ011869012017)의 연구비 지원에 의해 이루어진 결과로 이 에 감사드립니다.
References
-
Ahn, J, Um, M, Choi, W, Kim, S, Ha, T, Protective effects of Glycyrrhiza uralensis Fisch. on the cognitive deficits caused by β-amyloid peptide 25-35 in young mice, Biogerontology, (2006), 7, p239-247.
[https://doi.org/10.1007/s10522-006-9023-0]

-
Asl, MN, Hosseinzadeh, H, Review of pharmacological effects of Glycyrrhiza sp. and its bioactive compounds, Phytotherapy Research, (2008), 22, p709-724.
[https://doi.org/10.1002/ptr.2362]

- Behl, C, Davis, JB, Lesley, R, Schubert, D, Hydrogen peroxide mediates amyloid β protein toxicity, Cell, (1994), 7, p817-827.
-
de Bernardo, S, Canals, S, Casarejos, MJ, Solano, RM, Menendez, J, Mena, MA, Role of extracellular signal-regulated protein kinase in neuronal cell death induced by glutathione depletion in neuron/glia mesencephalic cultures, Journal of Neurochemistry, (2004), 91, p667-682.
[https://doi.org/10.1111/j.1471-4159.2004.02744.x]

-
Desagher, S, Glowinski, J, Premont, J, Astrocytes protect neurons from hydrogen peroxide toxicity, The Journal of Neuroscience, (1996), 16, p2553-2562.
[https://doi.org/10.1523/jneurosci.16-08-02553.1996]

-
Finkel, T, Holbrook, NJ, Oxidants, oxidative stress and the biology of ageing, Nature, (2000), 408, p239-247.
[https://doi.org/10.1038/35041687]

- Giacobini, E, Cholinesterase inhibitors stabilize Alzheimer's disease, Annals of the New York Academy of Sciences, (2000), 920, p321-327.
-
Gong, H, Zhang, BK, Yan, M, Fang, PF, Li, HD, Hu, CP, Yang, Y, Cao, P, Jiang, P, Fan, XR, A protective mechanism of licorice(Glycyrrhiza uralensis): Isoliquiritigenin stimulates detoxification system via Nrf2 activation, Journal of Ethnopharmacology, (2015), 162, p134-139.
[https://doi.org/10.1016/j.jep.2014.12.043]

-
Han, SB, Gu, HA, Kim, SJ, Kim, HJ, Kwon, SS, Kim, HS, Jeon, SH, Hwang, JP, Park, SN, Comparative study on antioxidative activity of Glycyrrhiza uralensis and Glycyrrhiza glabra extracts by country of origin, Journal of the Society of Cosmetic Scientists of Korea, (2013), 39, p1-8.
[https://doi.org/10.15230/scsk.2013.39.1.001]

-
Hardy, J, Selkoe, DJ, The amyloid hypothesis of Alzheimer's disease Progress and problems on the road to therapeutics, Science, (2002), 297, p353-356.
[https://doi.org/10.1126/science.1072994]

- Hwang, CK, Chun, HS, Isoliquiritigenin isolated from licorice Glycyrrhiza uralensis prevents 6-hydroxydopamineinduced apoptosis in dopaminergic neurons, Bioscience Biotechnology and Biochemistry, (2012), 76, p536-543.
- Jang, JH, Surh, YJ, Protective effects of resveratrol on hydrogen peroxide-induced apoptosis in rat pheochromocytoma (PC12):cells, Mutation Research, (2001), 96, p181-190.
-
Jung, JC, Lee, YH, Kim, SH, Kim, KJ, Kim, KM, Oh, S, Jung, YS, Hepatoprotective effect of licorice, the root of Glycyrrhiza uralensis Fischer, in alcohol-induced fatty liver disease, BMC Complementary and Alternative Medicine, (2015), 16, p1-10.
[https://doi.org/10.1186/s12906-016-0997-0]

-
Kao, TC, Shyu, MH, Yen, GC, Neuroprotective effects of glycyrrhizic acid and 18?-glycyrrhetinic acid in PC12 cells via modulation of the PI3K/Akt pathway, Journal of Agricultural and Food Chemistry, (2009), 57, p754-761.
[https://doi.org/10.1021/jf802864k]

-
Lee, HK, Yang, EJ, Kim, JY, Song, KS, Seong, YH, Inhibitory effects of glycyrrhizae radix and its active component, isoliquiritigenin, on A?(25-35)-induced neurotoxicity in cultured rat cortical neurons, Archives of Pharmacal Research, (2012), 35, p897-904.
[https://doi.org/10.1007/s12272-012-0515-y]

-
Lim, GP, Chu, T, Yang, F, Beech, W, Frautschy, SA, Cole, GM, The curry spice curcumin reduces oxidative damage and amyloid pathology in an Alzheimer transgenic mouse, The Journal of Neuroscience, (2001), 21, p8370-8377.
[https://doi.org/10.1523/jneurosci.21-21-08370.2001]

-
Marchesi, E, Rota, C, Fann, YC, Chignell, CF, Mason, RP, Photoreduction of the fluorescent dye 2′-7′- dichlorofluorescein A spin trapping and direct electron spin resonance study with implications for oxidative stress measurements, Free Radical Biology and Medicine, (1999), 26, p148-161.
[https://doi.org/10.1016/s0891-5849(98)00174-9]

-
Mosmann, T, Rapid colorimetric assay for cellular growth and survival Application to proliferation and cytotoxicity assays, Journal of Immunological Methods, (1983), 65, p55-63.
[https://doi.org/10.1016/0022-1759(83)90303-4]

- Oda, A, Tamaoka A and Araki, W, Oxidative stress upregulates presenilin 1 in lipid rafts in neuronal cells, Journal of Neuroscience Research, (2010), 88, p1137-1145.
- Oltvai, ZN, Milliman, CL, Korsmeyer, SJ, Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programed cell death, Cell, (1993), 74, p609-619.
-
Oyama, Y, Chikahisa, L, Ueha, T, Kanemaru, K, Noda, K, Ginkgo biloba extract protects brain neurons against oxidative stress induced by hydrogen peroxide, Brain Research, (1996), 712, p349-352.
[https://doi.org/10.1016/0006-8993(95)01440-3]

-
Park, JH, Wu, Q, Yoo, KH, Yong, HI, Cho, SM, Chung, IS, Baek, NI, Cytotoxic effect of flavonoids from the roots of Glycyrrhiza uralensis on human cancer cell lines, Journal of Applied Biological Chemistry, (2011), 54, p67-70.
[https://doi.org/10.3839/jabc.2011.012]

-
Qian, Y, Zheng, Y, Ramos, KS, Tiffany-Castiglioni, E, GRP78 compartmentalized redistribution in Pb-treated glia Role of GRP78 in lead-induced oxidative stress, Neuro Toxicology, (2005), 26, p267-275.
[https://doi.org/10.1016/j.neuro.2004.09.002]

- Sen, CK, Oxygen toxicity and antioxidants State of the art, Indian Journal of Physiology and Pharmacology, (1995), 39, p177-196.
- Smith, MA, Rottkamp, CA, Nunomura, A, Raina, AK, Perry, G, Oxidative stress in Alzheimer's disease, Biochimica et Biophysica Acta, (2000), 1502, p139-144.
-
Teng, L, Kou, C, Lu, C, Xu, J, Xie, J, Lu, J, Liu, Y, Wang, Z, Wang, D, Involvement of the ERK pathway in the protective effects of glycyrrhizic acid against the MPP+-induced apoptosis of dopaminergic neuronal cells, International Journal of Molecular Medicine, (2014), 34, p742-748.
[https://doi.org/10.3892/ijmm.2014.1830]

-
Um, MY, Ha, TY, Seong, KS, Kim, YS, In vitro screening of the acetylcholinesterase inhibition, antioxidant activity, and neuronal cell protective effect of medicinal plant extracts, Korean Journal of Food Preservation, (2013), 20, p840-845.
[https://doi.org/10.11002/kjfp.2013.20.6.840]

- Um, YR, Shim, KS, Lee, JH, Park, HY, Ma, JY, Quantitative analysis of glycyrrhizic acid in fermented glycyrrhizae radix by HPLC, Korean Journal of Oriental Medicine, (2009), 15, p85-89.
-
Vila, M, Przedborski, S, Targeting programmed cell death in neurodegenerative diseases, Natures Reviews Neuroscience, (2003), 4, p365-375.
[https://doi.org/10.1038/nrn1100]

-
Wang, D, Guo, TQ, Wang, ZY, Lu, JH, Liu, DP, Meng, QF, Xie, J, Zhang, XL, Liu, Y, Teng, LS, ERKs and mitochondria-related pathways are essential for glycyrrhizic acidmediated neuroprotection against glutamate-induced toxicity in differentiated PC12 cells, Brazilian Journal of Medical and Biological Research, (2014), 47, p773-779.
[https://doi.org/10.1590/1414-431x20143760]

-
Warner, HR, Superoxide dismutase, aging, and degenerative disease, Free Radical Biology and Medicine, (1994), 17, p249-258.
[https://doi.org/10.1016/0891-5849(94)90080-9]

-
Whittemore, ER, Loo, DT, Watt, JA, Cotman, CW, A detailed analysis of hydrogen peroxide-induced cell death in primary neuronal culture, Neuroscience, (1995), 67, p921-932.
[https://doi.org/10.1016/0306-4522(95)00108-u]

-
Yang, EJ, Min, JS, Ku, HY, Choi, HS, Park, MK, Kim, MK, Song, KS, Lee, DS, Isoliquiritigenin isolated from Glycyrrhiza uralensis protects neuronal cells against glutamateinduced mitochondrial dysfunction, Biochemical and Biophysical Research Communications, (2012), 421, p658-664.
[https://doi.org/10.1016/j.bbrc.2012.04.053]

-
Yang, EJ, Park, GH, Song, KS, Neuroprotective effects of liquiritigenin isolated from licorice roots on glutamateinduced apoptosis in hippocampal neuronal cells, Neuro Toxicology, (2013), 39, p114-123.
[https://doi.org/10.1016/j.neuro.2013.08.012]