
인동덩굴로부터 분리된 Cynaroside이 Doxorubicin으로 유도된 인간 근위세뇨관 HK-2 세포의 괴사에 미치는 저해 효과
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Cynaroside is a flavone, a flavonoid-like compound, known by different names (luteoloside and cinaroside). It is commonly found in Lonicera japonica Thunb., Chrysanthemum moriflium, and Angelica keiskei. The process of cell death has been classified as necrosis and apoptosis. Necrosis refers to unregulated cell death induced by a chemotherapeutic agent. Doxorubicin is an anthracycline anti-cancer drug used to treat acute leukemia, cancer, and lymphoma. However, it induces nephrotoxicity including tubular damage. Therefore, we investigated the protective effect of cynaroside against doxorubicin-induced necrosis in HK-2 cells.
To confirm the beneficial effect of cynaroside on doxorubicin-induced necrosis, HK-2 cells, a human proximal tubule epithelial cell line were treated with 10 μM doxorubicin and 80 μM cynaroside. Doxorubicin treatment resulted in increased DNA fragmentation, caspase-3 activity and mitochondria hyperactivation during cell necrosis. However, pretreatment with 80 μM cynaroside attenuated DNA fragmentation, caspase-3 activity and mitochondria hyperactivation induced by 10 μM doxorubicin in HK-2 cells.
These results indicated that pretreatment with cynaroside ameliorated doxorubicin-induced necrosis in HK-2 cells. Therefore, cynaroside be used as a therapeutic agent for improving doxorubicin-induced nephrotoxicity. However, further studies are required to evaluated the toxicity of cynaroside treatment in animals and to determine its protective effect against doxorubicininduced nephrotoxicity in an animal model.
Keywords:
Lonicara japonica Thunb., Cynaroside, Doxorubicin, Necrosis, Nephrotoxicity서 언
Doxorubicin은 인체에서 발생되는 다양한 암에 사용하는 치 료제들 중 하나로 알려져 있지만 투여했을 때 부정맥이나 심 근독성 또는 신장독성과 같은 부작용 일으킨다고 알려져 있다 (Octavia et al., 2012; Yoon et al., 2012). 이는 adriamycin 으로도 알려져 있으며, 암세포에서 두 가지 기작을 유도하는 데, 첫 번째로 DNA 사이에 삽입되어 DNA합성을 방해하고, 두 번째로 topoisomerase-2에 의한 DNA 수리를 방해할 뿐만 아니라 세포 내부에 free radical을 생성해 암세포 내에서 산 화스트레스 (oxidative stress) 증가시키고 세포죽음을 유도 한 다 (Thorn et al., 2011).
암환자의 수는 매년 증가되고 있으며, 항암 치료를 위해 다 양한 약물이 사용되고 있지만 항암효과를 가진 항암제들은 대 부분 심장독성, 신장독성과 같은 심각한 부작용을 나타낸다고 알려져 있다 (Dranitsaris et al., 2011, Lëibundgut et al., 2007). Doxorubicin도 마찬가지로 심장독성, 위장병, 탈모와 같 은 부작용이 수반 된다 (Tacar et al., 2013). 앞서 언급한 이 유 때문에 현재 자연에서 얻을 수 있는 천연분리물질 또는 천 연추출물을 이용해 항암에 관련된 여러 연구가 수행되고 있으 며 (Choi et al., 2014; Han et al., 2016; Yang et al., 2015), 더 나아가 항암제의 부작용을 줄이면서 항암효능을 증 가시킬 수 있는 천연분리물질의 탐색과 연구가 필요하다.
Caspase-3는 intact form (32 kDa)으로 inactivation 상태를 유지하고 있지만 자극을 받으면 Asp28/Ser29와 Asp175/Ser176사이 가 절단되면서 activation 상태로 바뀌게 된다 (Nikoletopoulou et al., 2013). 이는 apoptosis나 necrosis 동안에 poly (ADPribose) polymerase-1 (PARP-1)를 절단해 DNA 수리 과정을 억제하며 세포죽음을 유도할 뿐만 아니라 여러 세포에서 세포 죽음에 관련된 중요 마커로 사용되고 있다 (Ko and Lee, 2015; Los et al., 2002; Yoon et al., 2017).
Cynaroside는 luteolin-7-O-glucoside, luteoloside, glucoluteolin 등 여러 가지 이름으로 알려져 있으며, 여러 약용식물에서 발견 되는 흔한 flavonoid 성분으로 신선초 (Angelica keiskei)와 인 동덩굴 (Lonicera japonica Thunb.)에서 분리되어 효능이 알 려져 있다 (Park et al., 2002; Wen et al., 2015). 현재 이 천연분리물질에 대해 항산화활성, 지질단백질 산화 억제와 같은 연구가 진행되어 있다 (Sun et al., 2011). 하지만 cynaroside 같은 천연분리물질이 현재 흔히 사용되고 있는 항 암제들에 의한 부작용 (신장독성과 심근독성)을 억제할 수 있 는지에 대한 연구가 수행되지 않았다.
이에 따라 인간 근위세뇨관에서 유래된 세포주인 HK-2 세 포 (human kidney proximal tubule cell)를 이용하고, doxorubicin을 처리해 신장독성을 유발시킨 뒤 cynaroside를 처리하여 in vitro 수준에서 천연분리물질의 신장독성 억제 효 과가 나타나는지 조사해보고자 하였다.
재료 및 방법
1. 실험 재료
실험에 사용한 인동덩굴 (Lonicera japonica Thunb.)의 전 초에서 분리된 cynaroside (5373-11-5)는 Chengdu Biopurify Phytochemicals Ltd. (Chengdu, China)에서 파우더 형태로 구 입하여 사용하였다. Doxorubicin (Sigma-Aldrich Co., St Louis, MO, USA)은 1% dimethyl sulfoxide (DMSO)에 완 전히 녹인 후 차광상태로 냉동보관 하고 실험에 사용하였다.
2. 세포배양
HK-2 세포 (human kidney proximal tubule cell)는 한국세 포주은행 (KCLB, Seoul, Korea)으로부터 분양받아 사용하였 으며, PRMI 1640 (Thermo Fisher Scienrific Inc., Waltham, MA, USA) 배지에 10% fetal bovine serum (Thermo Fisher Scienrific Inc., Waltham, MA, USA)과 1% penicilin/ streptomycin을 첨가하여 사용하였고 37℃, 5% CO2 조건에서 배양하였다.
3. 세포생존율 분석
세포의 생존율은 CellTiter 96® aqueous one solution cell proliferation assay (Promega Co., Madison, WI, USA)를 이 용하고 제조사에서 제공한 protocol에 따라 실험을 진행했다. 세포를 96 well plate에 1 × 105 cells/㎖ 농도가 되도록 분주 한 뒤 37℃, 5% CO2 배양기에서 배양하였다. cynaroside를 여러 농도로 24 시간 동안 처리 후 HK-2 세포에 대한 천연 분리물질의 독성을 확인하였다.
같은 농도로 cynaroside를 1 시간 동안 전 처리하고 10 μM doxorubicin을 처리한 뒤 24 시간동안 배양하였다. 그 후 키트 에서 제공한 MTS 시약 20㎕를 넣고 2 시간 동안 배양한 뒤 microplate reader infinite® 200 PRO (TECAN, Männedorf, Switzerland)를 이용해 490㎚에서 흡광도를 측정하였으며, 세 포생존율은 비처리군에 대한 생존율을 %로 표시하였다.
4. Tunel 염색
Tunel 염색은 DeadEnd™ fluorometric TUNEL system (Promega Co., Madison, WI, USA)을 사용하였고 키트에서 제 공된 protocol에 따라 수행했다. 세포를 12 well plate에서 cover slip 상에 2 × 105 cells/㎖ 농도가 되도록 분주한 뒤, 37℃, 5% CO2 배양기에서 세포를 배양하였다. 세포는 80㎕ cynaroside를 1 시간 동안 전 처리한 뒤 10 μM doxorubicin 을 처리하고 24 시간동안 배양하였다. 그 후 10% neutralized buffered formalin (NBF)으로 4℃에서 20 분 동안 세포를 고 정하였고, phosphate buffered saline (PBS)로 2 번 wash 해 주었다. 다음 세포를 0.2% triton X-100 in PBS 용액으로 5 분간 투과화 시킨 뒤 PBS로 2 번 세척 하였다. Cover slip 상에 남겨진 액체가 없도록 물기를 모두 제거하고 키트에서 제공한 equilibration buffer를 5 분간 처리하였으며 100㎕ rTdT incubation buffer를 처리하고 37℃에서 한 시간 동안 배양하였다. 그 후 2 × SSC buffer를 동안 처리하고, PBS로 2 번 씻은 뒤 Prolong™ gold antifade mountant with DAPI (Thermo Fisher Scienrific Inc., Waltham, MA, USA)로 mount하고 Epi-fluorescence microscope (Carl Zeiss, Oberkochen, Germany)를 이용해 관찰하였다.
5. 단백질 분석
HK-2 세포는 PBS로 세척한 뒤 Pierce™ protease and phosphatase inhibitor mini tablets (Thermo Fisher Scienrific Inc., Waltham, MA, USA)가 포함된 RIPA cell lysis buffer 2 (Enzo Biochem, Inc., Farmingdale, NY, USA)로 1 시간 동안 용해하였다. 세포용해액은 원심분리기로 4℃, 13,000 × g 조건에서 10 분간 원심분리 하였고, 단백질 농도를 bradford assay를 이용하여 측정하였다. 총 20㎍의 단백질 샘플을 SDS-PAGE로 분리하였고, 분리된 SDS-PAGE 겔은 thermo scientific pierce G2 fast blotter (Thermo Fisher Scienrific Inc., Waltham, MA, USA)를 사용하여 PVDF (polyvinylidene fluoride) membrane (GE healthcare life sciences, Chicago, IL, USA)으로 이동시켰다. Membrane은 5% skim milk가 포 함된 tris buffered saline + 0.05% tween-20으로 blocking 한 후 1 차 항체를 반응시키고 anti-rabbit과 anti-mouse 2 차 항 체를 이용하여 D-Plus™ ECL femto system (Donginbio Inc., Daegu, Korea)에 의해 단백질을 탐지하였다.
1 차 항체와 2 차 항체는 Cell Signaling Technology (Danvers, MA, USA)사의 제품인 anti-rabbit igG HRP-linked antibody (#7074), anti-mouse lgG HRP-linked antibody (#7076), PARP (#9532), caspase-3 (#9662), GAPDH (#8884S)를 사용하였다.
6. Caspase-3 활성 분석
Caspase-3 colorimetric detection kit (Enzo Biochem Inc., Farmingdale, NY, USA)를 이용해 실험을 수행하였다. 단백질 분석 방법에서 사용한 방법과 동일하게 세포를 용해하였으며, 총 20㎍의 단백질을 사용해 제조사가 제공한 protocol에 따 라 실험을 수행했다.
7. FACS 분석
FACS를 이용한 분석에는 annexin V-FITC apoptosis detection kit (Enzo Biochem Inc., Farthingale, NY, USA)를 사용했다. 세포에 약물 처리 후 유도되는 necrosis의 비율을 구하기 위해 .제조사에서 제공한 protocol에 따라 Annexin VFITC와 PI 시약으로 염색시켰으며, necrosis중 과활성화되는 미토콘드리아의 활성을 측정하기 위해 JC-1 Dye (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 실험 을 진행하였고 세포는 CytoFLEX (Beckman clulter Inc., Brea, CA, USA)를 이용해 분석하였다.
8. 통계처리
통계처리는 평균 ±표준편차 (means ± SD)로 나타내었고, 그 룹 간 유의성을 검정하기 위해 SPSS (Statistical Package for Social Science Inc., Chicago, IL, USA) 통계 프로그램을 이 용하였다. 일원변량분석 (One-way ANOVA)을 실시하였으며, 유의성이 있는 경우 p < 0.05 수준에서, Duncan’s Multiple Range Test (DMRT)와 Tukey post-hoc test를 실시하였다.
결과 및 고찰
1. Cynaroside의 HK-2 세포 보호효과
Cynaroside의 HK-2 세포에 대한 세포독성과 10 μM doxorubicin으로 유도되는 세포사멸에 대한 세포보호효과를 확 인하기 위해 인간 근위세뇨관 세포주인 HK-2 세포를 배양하 여 세포생존율을 MTS assay법으로 측정하였다. Cynaroside를 여러 농도 (10, 20, 40 and 80 μM)로 HK-2 세포에 24 시간 동안 처리하였다. 그 결과 cynaroside에 의한 세포독성은 나타 나지 않았다. 하지만 10 μM 농도부터 정상대조군에 비해 세 포의 증식이 증가한 것으로 확인되었다 (Fig. 1A).
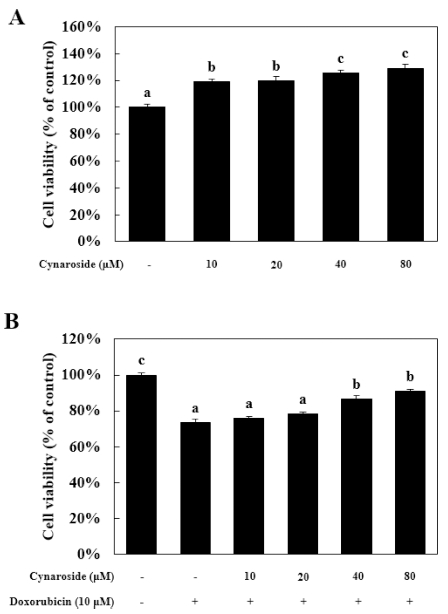
Cynaroside prevents doxorubicin-induced necrosis in HK-2 cells.(A); HK-2 cells were treated with cynaroside for various concentration, (B); after pretreatment with cynaroside for various concentration. HK-2 cells were treated with 10 μM doxorubicin for 24 h. Cell viability was measured by MTS assay. Data represent the means ± SD (n = 3). Different letters are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
다음으로 cynaroside를 농도 의존적으로 1 시간 동안 전 처 리하고 10 μM doxorubicin을 HK-2 세포에 24 시간 동안 처 리했을 때 doxorubicin 단독처리군은 정상대조군에 비하여 생 존율이 73.6 ± 2.0%로 감소되었으며 80 μM cynaroside 처리 군은 90.9 ± 1.0%로 회복되었다 (Fig. 1B).
Doxorubicn은 여러 암세포에 10 μM 농도로 처리되었을 때 항암효과가 가장 크게 나타났으며, 세포괴사의 특징인 DNA 단편화와 caspase-3 단백질 활성도가 증가하는 것으로 알려져 있을 뿐만 아니라 (Arif et al., 2013; Kopp et al., 2012; Lüpertz et al., 2008), HK-2 세포 (human proximal tubule cell)에 대한 세포독성을 나타내는 것으로 알려져 있다 (Finn et al., 2002). 따라서 cynaroside 단독처리는 HK-2 세포에 대 해 80 μM 농도까지 세포독성을 나타내지 않았지만 HK-2 세 포내에서 세포주기를 조절하는 여러 인자에 어떠한 영향을 미 치는지 추가적인 실험이 필요하다고 사료된다. 이러한 결과를 바탕으로 doxorubicn에 의한 세포사 억제 효과를 확인해본 결 과, doxorubicin 처리에 의한 세포독성은 40 μM cynaroside를 처리했을 때 doxorubicin 단독처리 군에 비교하여 세포생존율 이 크게 회복되었다. 종합하면 cynaroside는 doxorubicin으로 유도된 세포사로부터 세포생존율을 회복시켜 신장세포보호 효 과가 있음을 확인하였지만 정확히 어떠한 기전에 영향을 미치 는지 확인하기 위해 추가실험을 진행하였다.
2. Cynaroside의 HK-2 세포 necrosis 억제효과
Cynaroside가 doxorubicin에 의해 유도된 necrosis의 억제 비율을 알아보기 위해 annexinV-PI 염색을 통해 flow cytometry에서 측정하였다. 10 μM doxorubicin을 처리하였을 때 necrosis 비율이 77.33%까지 증가하였으나 80 μM cynaroside를 전 처리 29.92%까지 감소되었다 (Fig. 2A). 뿐 만 아니라 10 μM doxorubicin 처리 시 증가되는 미토콘드리 아 활성은 정상의 red signal이 59.78%인 반면 92.18%까지 높아졌고 80 μM cynaroside 전 처리 시 69.84%까지 감소되 었다 (Fig. 2B).
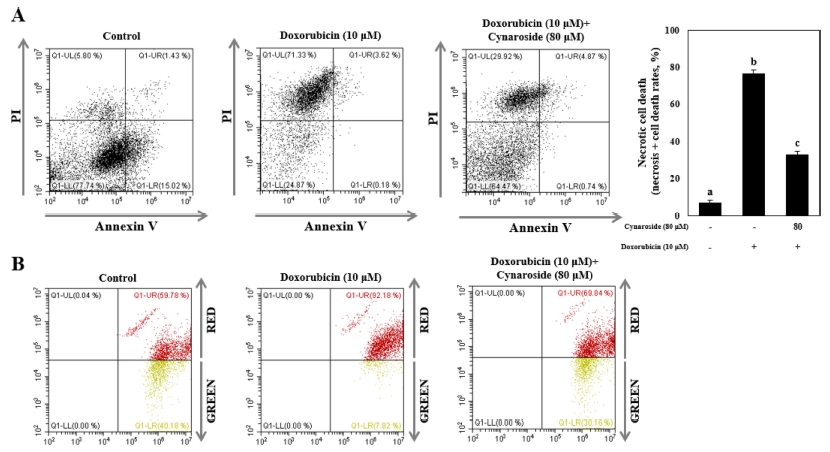
Cynaroside ameliorates doxorubicin-induced necrotic cell death and mitochondria hyperactivation in HK-2 cells.After pretreatment with 80 μM cynaroside for 1 h, HK-2 cells were treated with 10 μM doxorubicin for 24 h. (A) Annexin V and propidium iodide staining and (B) JC- 1 staining were analyzed by flow cytometry. Representative images were taken from at least three independent experiments.
미토콘드리아의 활성은 doxorubicn처리에 의해 necrosis로 진행되면서 과활성화 된다고 알려져 있다 (Shin et al., 2015). 이에 근거하여 실험을 진행하였을 때, 본 실험에서도 doxorubicn에 의한 신장세포괴사와 미토콘드리아 과활성이 증 가되는 것을 확인하였으며, 80 μM cynaroside에 의해 차단되 는 결과로 보아 necrosis를 유도하는 단백질인 PARP1 또는 caspase-3 단백질 활성을 억제할 것으로 생각된다. 종합하자면 10 μM doxorubicin 처리에 의해 증가된 HK-2 세포의 necrosis와 미토콘드리아의 과활성은 80 μM cynaroside 전 처 리에 의해 감소되었다. 하지만 cynaroside가 doxorubicin에 의 한 necrosis를 억제하는 기전과 어떤 신호전달경로를 통해 미 토콘드리아의 과활성을 억제하는지 추가적인 실험이 필요할 것이라고 생각되었으며 necrosis로 진행되는 과정 중에 나타나 는 DNA 단편화와 necrosis에 관여하는 단백질의 발현량을 조 사하였다.
3. Cynaroside의 doxorubicin에 의한 caspase-3 활성 억제 효과
Necrosis에 관여하는 인자인 caspase-3와 PARP의 단백질 발 현량을 확인하기 위해 western blot을 진행하였다. 10 μM doxorubicin을 24 시간동안 처리했을 때 caspase-3와 PARP의 cleaved form이 증가하였고 80 μM cynaroside 전 처리에 의 해 감소되었다 (Fig. 3A). 이어서 caspase-3 활성도를 측정하 기 위해 caspase-3 activity assay를 진행하였다. 앞선 결과와 마찬가지로 10 μM doxorubicin 처리에 의해 비처리군 대비 138 ± 8.9%까지 증가하였지만 80 μM cynaroside 전 처리에 의해 106 ± 2.2%로 감소되었다 (Fig. 3B).
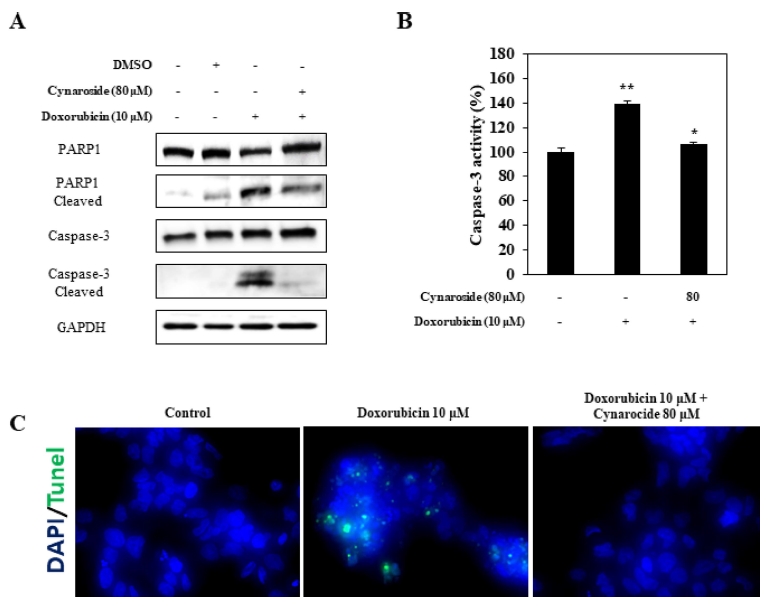
Cynaroside reduces doxorubicin-induced upregulation of caspase-3 activation and expression, DNA fragmentation in HK-2 cells.After pretreatment with 80 μM cynaroside for 1 h, HK-2 cells were treated with 10 μM doxorubicin for 24 h. (A - B); cell extracts were subjected to protein analysis using western blot analysis and caspase-3 activity assay. (C); HK-2 cell visualized by tunel assay. Data represent the means ± SEM of three independent experiments. **p < 0.05 vs. control, *p < 0.05 vs. 10 μM doxorubicin. Representative images were taken from at least three independent experiments.
마지막으로 DNA 단편화를 측정하기 위해 TUNEL 염색을 실시하였다. 10 μM doxorubicin 처리시 tunel positive signal 이 증가할 뿐만 아니라 세포의 형태가 변화되었지만 이는 80 μM cynaroside 전 처리에 의해 정상에 가깝게 차단되었다 (Fig. 3C). 결과를 종합하면 10 μM doxorubicin 처리는 HK-2 세포에서 caspase-3 단백질의 발현량과 활성화, DNA 단편화를 유도하지만 80 μM cynaroside 전 처리에 의해 차단되었다. 앞 서 언급한대로 10 μM doxorubicn은 세포괴사 과정 중 DNA 단편화와 caspase-3 단백질 활성화를 일으키는 것으로 알려져 있으며 (Fink and Cookson, 2005), 지금까지 결과를 종합해 봤을 때 cynaroside는 doxorubicn에 의해 유도된 세포괴사를 억제하는 것으로 보아 세포수준에서 신장독성보호효과를 가지 고 있다고 생각한다. 하지만 doxorubicin에 의해 유도되는 oxidative stress (산화스트레스)와 necrosis에 작용하는 단백질 들의 발현량 또는 활성도와 신장독성을 억제할 수 있는지를 doxorubicin 유도 동물 모델 (in vivo model)에서 확인하는 추가연구가 필요하다고 생각된다.
감사의 글
본 연구는 보건복지부 한국 토종자원의 한약재기반구축사 업의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Arif, IS, Hooper, CL, Greco, F, Williams, AC, Boateng, SY, Increasing doxorubicin activity against breast cancer cells using PPARγ-ligands and by exploiting circadian rhythms, British Journal of Pharmacology, (2013), 169, p1178-1188.
[https://doi.org/10.1111/bph.12202]

-
Choi, SR, Kim, MJ, Ahn, MS, Song, EJ, Seo, SY, Choi, MK, Kim, YS, Choi, DG, Song, YJ, Cytotoxicity of extracts from Korean pepper(Capsicum annuum L) by extraction solvents and plant parts, Korean Journal of Medicinal Crop Science, (2014), 22, p369-377.
[https://doi.org/10.7783/kjmcs.2014.22.5.369]

-
Dranitsaris, G, Truter, I, Lubbe, MS, Amir, E, Evans, W, Advances in cancer therapeutics and patient access to new drugs, PharmacoEconomics, (2011), 29, p213-224.
[https://doi.org/10.2165/11584210-000000000-00000]

-
Fink, SL, Cookson, BT, Apoptosis, pyroptosis, and necrosis Mechanistic description of dead and dying eukarytic cells, Infection and Immunity, (2005), 73, p1907-1916.
[https://doi.org/10.1128/iai.73.4.1907-1916.2005]

-
Finn, GJ, Kenealy, E, Creaven, BS, Egan, DA, In vitro cytotoxic potential and mechanism of action of selected coumarins, using human renal cell lines, Cancer Letters, (2002), 183, p61-68.
[https://doi.org/10.1016/s0304-3835(02)00102-7]

-
Han, HM, Kwon, YS, Kim, MJ, Antioxidant and antiproliferative activity of extracts from water chestnut(Trapa japonica Flerow), Korean Journal of Medicinal Crop Science, (2016), 24, p14-20.
[https://doi.org/10.7783/kjmcs.2016.24.1.14]

- Ko, WC, Lee, SR, Effect of immature Citrus sunki peel extract on neuronal cell death, Korean Journal of Medicinal Crop Science, (2015), 3, p144-149.
- Kopp, F, Oak, PS, Wagner, E, Roidl, A, miR-200c sensitizes breast cancer cells to doxorubicin treatment by decreasing TrkB and Bmi1 expression, Plos One, (2012), p, p1-17.
-
Leibundgut, G, Pfisterer, M, Brunner-La Rocca, HP, Drug treatment of chronic heart failure in the elderly, Drugs and Aging, (2007), 24, p991-1006.
[https://doi.org/10.2165/00002512-200724120-00003]

-
Los, M, Mozoluk, M, Ferrari, D, Stepczynska, A, Stroh, C, Renz, A, Herceg, Z, Wang, ZQ, Schulze-Osthoff, K, Activation and caspase-mediated inhibition of PARP A molecular switch between fibroblast necrosis and apoptosis in death receptor signaling, Molecular Biology of the Cell, (2002), 13, p978-988.
[https://doi.org/10.1091/mbc.01-05-0272]

- Lüpertz, R, Chovolou, Y, Unfried, K, Kampkötter, A, Wätjen, W, Kahl, R, The forkhead trascription factor FOXO4 sensitizes cancer cells to doxorubicn-mediated cytotoxicity, Carcinogenesis, (2008), 29, p2045-2052.
- Nikoletopoulou, V, Markaki, M, Palikaras, K, Tavernarakis, N, Crosstalk between apoptosis, necrosis and autophagy, Biochimica et Biophysica Acta, (2013), 1833, p3448-3459.
-
Octavia, Y, Tocchetti, CG, Gabrielson, KL, Janssens, S, Crijns, HJ, Moens, AL, Doxorubicin-induced cardiomyopathy; From molecular mechanisms to therapeutic strategies, Journal of Molecular and Cellular Cardiology, (2012), 52, p1213-1225.
[https://doi.org/10.1016/j.yjmcc.2012.03.006]

-
Park, JC, Park, JG, Kim, HJ, Hur, JM, Lee, Jh, Sung, NJ, Chung, SK, Choi, JW, Effects of extract from Angelica keiskei and its component, cynaroside, on the hepatic bromobenzenemetabolizing enzyme system in rats, Phytotherapy Research, (2002), 16, p24-27.
[https://doi.org/10.1002/ptr.783]

-
Shin, HJ, Kwon, HK, Lee, JH, Gui, X, Achek, A, Kim, JH, Choi, S, Doxorubicin-induced necrosis is mediated by poly(ADP-ribose) polymerase 1(PARP1):but is independent of p53, Scientific reports, (2015), 5, p15798.
[https://doi.org/10.1038/srep15798]

-
Sun, X, Sun, SG, Wang, M, Xiao, J, Sun, XB, Protective effects of cynaroside against H2O2-induced apoptosis in H9c2 cardiomyoblasts, Journal of Cellular Biochemistry, (2011), 112, p2019-2029.
[https://doi.org/10.1002/jcb.23121]

-
Tacar, O, Sriamornsak, P, Dass, CR, Doxorubicin An update on anticancer molecular action, toxicity and novel drug delivery systems, Journal of Pharmacy and Pharmacology, (2013), 65, p157-170.
[https://doi.org/10.1111/j.2042-7158.2012.01567.x]

- Thorn, CF, Oshiro, C, Marsh, S, Hernandez-Boussard, T, Mcleod, H, Klein, TE, Altman, RB, Doxorubicin pathways Pharmacodynamics and adverse effects, Pharmacogenet Genomics, (2011), 21, p440-446.
- Wen, HU, Ting, G, Jiang, WJ, Dong, GL, Chen, DW, Yang, SL, Li, HR, Effects of ultrahigh pressure extraction on yield and antioxidant activity of chlorogenic acid and cynaroside extracted from flower bubs of Lonicera japonica, Chiness Journal of Natural Medicines, (2015), 13, p445-453.
-
Yang, J, Kwon, YS, Lim, JD, Yu, CY, Kim, MJ, Antioxidant and anticancer properties of the extracts from Lepisorus thunbergianus(Kaulf) Ching, Korean Journal of Medicinal Crop Science, (2015), 23, p324-333.
[https://doi.org/10.7783/kjmcs.2015.23.4.324]

- Yoon, GA, Chae, SY, Kim, KH, Synergistic anticancer activity on mouse sarcoma by mixture of doxorubicin and water extract of Albizzia julibrissin, Cancer Prevention Research, (2012), 17, p239-243.
-
Yoon, JH, Sohn, SH, Lee, EY, Kim, GS, Lee, SE, Lee, DY, Seo, KH, Lee, SW, Kim, HD, Protective effect of Saururus chinensis ethanol extract against styrene in mouse spermatocyte cell line, Korean Journal of Medicinal Crop Science, (2017), 25, p45-51.
[https://doi.org/10.7783/kjmcs.2017.25.1.45]
