
독활 에탄올 추출물의 대장암 세포에서 Cyclin D1 단백질 분해 유도를 통한 세포 생육 억제활성
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, we evaluated the anti-cancer activity and potential molecular mechanism of 70% ethanol extracts of the root of Aralia cordata var. continentalis (Kitagawa) Y. C. Chu (RAc-E70) against human colorectal cancer cells.
RAc-E70 suppressed the proliferation of the human colorectal cancer cell lines, HCT116 and SW480. Although RAc-E70 reduction cyclin D1 expression at the protein and mRNA levels, RAc-E70-induced reduction in cyclin D1 protein level occurred more dramatically than that of cyclin D1 mRNA. The RAc-E70-induced downregulation of cyclin D1 expression was attenuated in the presence of MG132. Additionally, RAc-E70 reduced HA-cyclin D1 levels in HCT116 cells transfected with HA-tagged wild type-cyclin D1 expression vector. RAc-E70-mediated cyclin D1 degradation was blocked in the presence of LiCl, a GSK3β inhibitorbut, but not PD98059, an ERK1/2 inhibitor and SB203580, a p38 inhibitor. Furthermore, RAc-E70 phosphorylated cyclin D1 at threonine-286 (T286), and LiCl-induced GSK3β inhibition reduced the RAc-E70-mediated phosphorylation of cyclin D1 at T286.
Our results suggested that RAc-E70 may downregulate cyclin D1 expression as a potential anti-cancer target through GSK3β-dependent cyclin D1 degradation. Based on these findings, RAc-E70 maybe a potential candidate for the development of chemopreventive or therapeutic agents for human colorectal cancer.
Keywords:
Aralia continentalis, Anticancer Activity, Cancer Chemoprevention, Cell Proliferation, Cyclin D1, Human Colorectal Cancer서 언
암은 전 세계적으로 삶을 위협하는 주요한 요인 중 하나로, 2012년 암 발병 환자 수는 약 1,400 만 명, 암으로 인한 사 망자수는 약 800 만 명을 차지하였다 (Jung et al., 2017). 2014년 기준으로 한국에서 대장암 발병률은 갑상선 암, 위암 에 이어 3 번째로 높고, 대장암으로 인한 사망률은 폐암, 간암, 위암에 이어 4 번째로 높다고 보고되었다 (Jung et al., 2017). 현재까지 대장암에 대한 항암제와 치료기술의 상당한 발전에도 불구하고 여전히 대장암의 발병률과 이로 인한 사망 률은 지속적으로 증가하고 있는 추세이다. 그리하여 대장암의 발병률과 이로 인한 사망률을 줄이기 위해 화학적 암 예방이 중요시되고 있고, 천연물을 활용한 항암제 개발이 대두되고 있 다 (Wang et al., 2012).
전 세계적으로 현존하는 암 치료의 대안으로 천연물을 활용 한 보완대체의학에 대한 관심이 증가하고 있으며, 보완대체의 학은 암을 포함한 다양한 질병의 90% 정도에 응용되고 있다 고 보고되고 있다 (Kessler et al., 2001; Park et al., 2008). 특히 한국, 미국 및 유럽은 약용식물을 활용한 한의학적 암 치료에 대한 관심이 증가하고 있고, 실제로 많은 암환자에게 한의학적 암 치료의 응용이 증가되고 있는 추세이다 (Dobos et al., 2005; Park et al., 2008).
독활 [Aralia cordata var. continentalis (Kitagawa) Y.C.Chu] 은 두릅나무과 (Araliaceae)에 속하는 다년생 식물로 땅두릅 또 는 풀두릅이라고 하며, 한약명은 독활 또는 독요초로 독활의 뿌 리를 사용한다 (Han, 2005). 독활은 혈압강화작용 (Yang et al., 2008), 항염증작용 (Park et al., 2005), 항균작용 (Jeong et al., 2006), 항산화 및 항혈소판 작용 (Yang et al., 2008) 등에 효능이 있다고 보고되고 있다. 또한 독활은 다양한 암세포에 대 한 항암활성이 있다고 보고되었다 (Park and Kim, 1995).
따라서 본 연구에서는, 향후 한의학에서 많이 이용되고 있 는 독활을 활용한 대장암의 항암치료에 대한 기초자료를 제공 하기 위해 대장암세포에 대한 항암활성과 그 기전을 구명하고 자 하였다.
재료 및 방법
1. 실험재료
대장암 세포의 배양을 위해 사용된 배지인 Dulbecco’s modified Eagle’s medium (DMEM)/F-12 1 : 1 modified medium (DMEM/F-12)는 Lonza (Morristown, NJ, USA)에 서 구매하였다. 특이적 효소 억제제인 PD98059, SB203580, LiCl 및 MG132와 대장암 세포의 생육억제효능을 평가하기 위 한 3-(4,5-dimethylthizaol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT)는 Sigma-Aldrich (St. Louis, MO, USA)사에서 구매 하였다. 그리고 western blot 분석을 위한 항체인 cyclin D1, phospho-cyclin D1 (Thr286), HA-tag 및 β-actin은 Cell Signaling Technology (Danvers, MA, USA)에서 구매되었다.
2. 추출물 제조
본 연구에서 사용된 한약재 시료인 독활 [Aralia cordata var. continentalis (Kitagawa) Y.C.Chu]은 경상북도 경산시에 위치한 한약재 전문회사인 휴먼허브에서 구매되었고, 추가적으 로 안동대학교 생약자원학과 구진숙 교수에 의해 동정되었다.
파쇄된 독활 10 g에 70% 에탄올 200 ㎖을 첨가하여 상온 에서 교반하면서 48 시간 동안 추출하였다. 추출 후 filter paper (No. 2, Whatman Co., Maidstone, England)로 여과, 40℃ 이하의 중탕에서 감압 환류 냉각장치 (N-1110S, EYELA, Tokyo, Japan)로 농축, 그리고 동결건조를 실시하였 다. 모든 시료는 실험 전까지 –80℃ 냉동 보관하였으며, 추출물 은 dimethyl sulfoxide (DMSO)에 용해하여 실험에 사용하였다.
3. 세포 생육 억제활성 측정
본 연구에서 사용된 대장암 세포주인 HCT116과 SW480은 한국세포주은행에서 구매되었고, 세포는 10% fatal bovine serum (FBS), 100 U/㎖ penicillin and 100㎍/㎖ streptomycin 이 포함된 DMEM/F-12 배지로 37℃에서 5% CO2 하에서 유 지하였다. 시료처리를 위해 독활의 70% 에탄올 추출물 (RAc- E70)은 DMSO로 용해하였고, 대조구는 DMSO를 0.1%를 초 과하지 않는 범위에서 사용하였다. 대장암세포인 HCT116과 SW480의 증식억제는 MTT assay로 측정하였다.
대장암 세포인 HCT116과 SW480을 96 well plate에서 well 당 1 × 105 cells로 24 시간 배양한 후, RAc-E70를 농도 별로 24 시간 동안 처리하였다. 24 시간 후 각 well에 MTT (1㎎/㎖) 용액 50㎕씩 첨가하여 2 시간 동안 다시 배양시킨 후, well 바닥에 형성된 formazan이 흩어지지 않게 상등액을 제거하고 DMSO를 100㎕ 첨가하여 천천히 녹인 후 UV/ Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 540㎚에서 흡광 도를 측정하였다.
4. SDS-PAGE 및 western blot 분석
RAc-E70이 처리된 세포에서 단백질을 추출하기 위해서 세 포를 1 × phosphate-buffered saline (PBS)로 3 회 세척한 후, protease inhibitor cocktail (Sigma-Aldrich Co., St. Louis, MO, USA)과 phosphatase inhibitor cocktail (Sigma-Aldrich Co., St. Louis, MO, USA)이 포함된 radioimmunoprecipitation assay (RIPA) buffer (Boston Bio Products, Ashland, MA, USA)를 4℃에서 30 분간 처리하여 lysis시켜 단백질을 얻었다. Bicinchoninic acid (BCA) protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 단백질 정량 후, 동일량의 단백질 을 12% SDS-acrylamide에 loading하고 PVDF membrane (Bio-Rad, Hercules, CA, USA)에 이동시킨 후 5% non-fat dry milk로 상온에서 1 시간 동안 blocking하였다. 1 시간 후, 1 차 항체를 5% non-fat dry milk에 용해시켜 4℃에서 14 시간 동안 반응시킨 후 membrane을 0.05% tween-20이 포함 된 tris-buffered saline (TBS-T)로 5 분간 3 회 세척하였다. 그 후 2 차 항체는 5% non-fat dry milk에 용해시켜 membrane에 상온에서 1 시간 처리하였고, TBS-T로 5 분간 3 회 세척 후 membrane은 ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)를 이 용하여 단백질을 확인하였다.
5. Reverse transcriptase-polymerase chain reaction (RTPCR)
Total RNA 추출은 RAc-E70이 처리된 HCT116과 SW480 세포로부터 RNeasy Mini kit (QIAGEN GmbH., Hilden, Germany)를 이용하여 수행되었고, cDNA는 1㎍의 total RNA를 Verso cDNA kit (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 제조되었다. PCR은 PCR master mix kit (Promega Co., Madison, WI, USA)를 이용 하여 수행되었고, 사용된 primer는 Table 1과 같다.
6. Transient transfection
HA-tagged wild type cyclin D1 construct의 transient transfection은 PolyJet DNA transfection reagent (SignaGen Laboratories, Rockville, MD, USA)를 이용하여 수행되었다. 6 well plate에 배양된 HCT116 세포에 1㎍ construct와 PolyJet DNA transfection reagent가 희석된 plasmid mixture 를 처리하여 24 시간 동안 배양시켜 실험에 사용하였다.
7. 통계분석
모든 결과는 3 회 반복 측정 후 평균 ±표준편차로 나타내 었고, 처리간 유의성은 Student’s t-test로 검증하여 p-value 값 이 0.05 미만일 때 통계적으로 유의하다고 판정하였다 (Microsoft Exel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
1. 독활 에탄올 추출물의 대장암세포의 생육 억제와 cyclin D1 단백질 수준 감소 유도 활성
독활 [Aralia cordata var. continentalis (Kitagawa) Y.C.Chu]의 70% 에탄올 추출물 (RAc-E70)을 이용하여 대장 암 세포주인 HCT116과 SW480 세포생육 억제활성을 측정하 기 위해 MTT assay를 수행하였다. RAc-E70은 HCT116과 SW480세포의 생육을 유의적으로 각각 25㎍/㎖에서 16.4%와 19.6%, 50㎍/㎖에서 50.0%와 50.4% 그리고 100㎍/㎖에서 87.8%와 84.0% 억제하였다 (Fig. 1A, B).
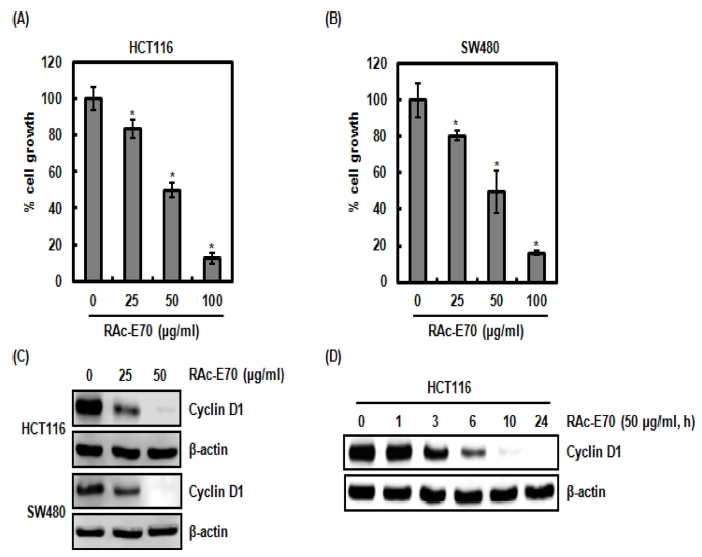
Effect of RAc-E70 on the cell growth and cyclin D1 protein level in human colorectal cancer cells.(A), (B); HCT116 and SW480 cells were plated overnight and then treated with RAc-E70 at the indicated concentrations for 24 hours. Cell growth was measured using MTT assay. *p < 0.05 compared to cell without RAc- E70. (C); HCT116 and SW480 cells were plated overnight and then treated with RAc-E70 at the indicated concentrations for 24 hours. Cell lysates were subjected to SDS-PAGE and the western blot was performed using antibody against cyclin D1. Actin was used as internal control for western blot analysis. (D); HCT116 cells were treated with RAc-E70 (50 ㎍/㎖) for the indicated times. Cell lysates were subjected to SDS-PAGE and the western blot was performed using antibody against cyclin D1. β-actin was used as internal control for western blot analysis.
Cyclin D1은 다양한 암에서 발암유전자로 알려져 있으며, cyclin-dependent kinase (CDK) 4/6와 복합체를 형성하여 retinoblastoma protein을 인산화 시켜 세포주기 중 G1/S기로 의 transition을 활성화하여 암세포에서 비정상적인 세포생육을 유도한다고 보고되고 있다 (Gopalakrishnan et al., 2014). 게 다가, cyclin D1 단백질의 과 발현은 대장암을 포함한 다양한 암 발생과 밀접한 관련이 있는 것으로 알려져 있다 (Qin et al., 2015). 그리하여, RAc-E70이 cyclin D1 단백질 수준을 감소시키는지 확인하기 위해, RAc-E70이 처리된 HCT116과 SW480 세포에서 western blot을 이용하여 cyclin D1 단백질 을 확인하였다. 그 결과 RAc-E70은 유의적으로 HCT116과 SW480에서 cyclin D1 단백질의 수준을 감소시켰다 (Fig. 1C). 또한 RAc-E70은 처리 후 3 시간부터 cyclin D1 단백질 수준을 감소시켰다 (Fig. 1D).
2. 독활 에탄올 추출물의 cyclin D1 단백질 분해 유도활성
RAc-E70에 의해 유도되는 cyclin D1 단백질 수준 감소가 cyclin D1의 전사조절에 기인한 것인지 확인하기 위해 RAc- E70이 처리된 HCT116과 SW480 세포에서 RT-PCR을 이용하 여 cyclin D1 mRNA 발현을 확인하였다. 그 결과, RAc-E70 은 25㎍/㎖에서는 HCT116 세포의 cyclin D1 mRNA 발현 변화가 없었으나, 50㎍/㎖ 농도에서는 감소 되었다 (Fig. 2A). 그러나 SW480 세포에서는 RAc-E70에 의해 유도되는 cyclin D1 mRNA 발현감소가 나타나지 않았다 (Fig. 2A). 본 결과는 RAc-E70에 의해 유도되는 cyclin D1 단백질 수준 감 소는 단백질 분해에 기인하는 것으로 판단된다.
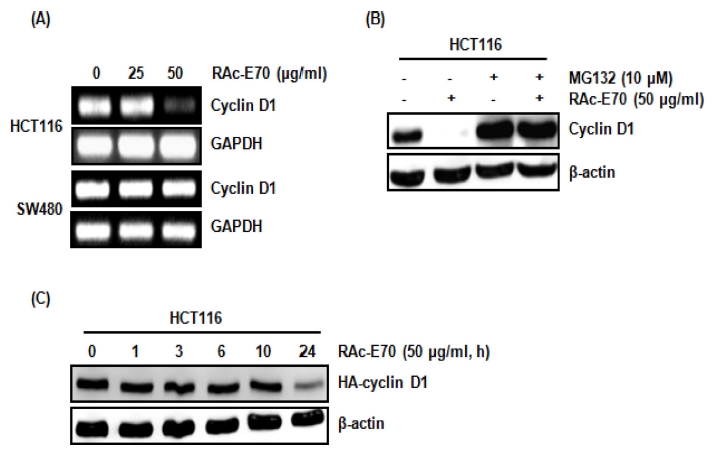
Effect of RAc-E70 on the expression of cyclin D1 mRNA and cyclin D1 degradation in human colorectal cancer cells.(A); HCT116 and SW480 cells were plated overnight and then treated with RAc-E70 at the indicated concentrations for 24 hours. For RT-PCR analysis of the gene expression of cyclin D1, total RNA was prepared. GAPDH was used as internal control for RP-PCR. (B); HCT116 cells were pretreated with MG132 at the indicated concentration for 2 hours, and then cotreated with RAc-E70 (50㎍/㎖) for 6 hours. Cell lysates were subjected to SDSPAGE and the western blot was performed using antibody against cyclin D1. β-actin was used as internal control for western blot analysis. (C); HCT116 cells were transfected with HA-tagged wild type cyclin D1 construct for 24 h, and then treated with RAc-E70 (50 ㎍/㎖) for the indicated times. Cell lysates were subjected to SDSPAGE and the western blot was performed using antibody against HA-tag. β-actin was used as internal control for western blot analysis.
비록 cyclin D1 단백질의 과대발현은 대장암을 비롯한 다양 한 암에서 나타나는 공통적인 현상이지만, cyclin D1 단백질 의 과대발현은 오직 cyclin D1 유전자의 과대발현에 기인하지 않는다고 보고되고 있다. 실제적으로 대장암에서 cyclin D1 유 전자의 과대발현과 단백질의 과대발현의 비율은 각각 2.5%와 55%를 차지하는 것으로 알려져 있다 (Musgrove et al., 2011). 이것은 cyclin D1 단백질의 과대발현은 암세포에서 단 백질 분해 기전의 결함에 기인한다는 것을 의미한다 (Gillett et al., 1994; Russell et al., 1999).
다양한 항암물질이 암세포에서 cyclin D1 단백질 분해를 통 해 암세포 증식 억제를 유도하기 때문에 cyclin D1 단백질 분해는 항암제 개발에 중요한 분자 타깃으로 여겨지고 있다 (Alao et al., 2004, 2006; Langenfeld et al., 1997). 따라서 RAc-E70이 cyclin D1 단백질 분해를 유도하는지 확인하기 위 해, HCT116 세포에 단백질 분해효소 억제제인 MG132를 2 시간 전처리하고 50㎍/㎖ 농도의 RAc-E70을 6 시간 동안 처리 후 western blot을 이용하여 cyclin D1 단백질을 확인하 였다. 그 결과, MG132가 처리된 세포에서는 RAc-E70에 의 해 유도되는 cyclin D1 단백질의 감소가 억제되었다 (Fig. 2B). 또한, RAc-E70에 의해 유도되는 cyclin D1 단백질 분해 를 재 증명하기 위해, HCT116세포에 HA-tagged wild type cyclin D1 construct를 transfection하고 RAc-E70을 처리한 결 과, RAc-E70은 HA-cyclin D1의 수준을 감소시켰다 (Fig. 2C). 본 결과로 RAc-E70에 유도되는 cyclin D1 단백질의 수 준감소는 cyclin D1 단백질 분해에 기인하는 것으로 판단된다.
3. 독활 에탄올 추출물의 GSK3β 유도 cyclin D1의 threonine-286 (Thr286) 인산화 의존성 cyclin D1 단백질 분해유도 활성
다양한 kinase 중, ERK1/2, p38 그리고 GSK3β는 cyclin D1 단백질 분해 유도와 밀접한 관련이 있다고 보고되고 있다 (Diehl et al., 1998; Okabe et al., 2006; Thoms et al., 2007). 그리하여 RAc-E70에 의해 유도되는 cyclin D1 단백질 분해와 관련된 kinase를 규명하기 위해, HCT116 세포에 ERK1/2 억제제인 PD98059, p38 억제제인 SB203580 그리고 GSK3β 억제제인 LiCl를 각각 2 시간 동안 전처리 후, RAc- E70을 6 시간 동안 처리하고 western blot을 이용하여 cyclin D1 단백질 수준을 확인하였다. 그 결과, PD98059와 SB203580 이 처리된 HCT116 세포에서는 RAc-E70에 의해 유도되는 cyclin D1 단백질의 수준감소가 나타났으나 (Fig. 3A, B), LiCl이 처리된 HCT116 세포에서는 RAc-E70에 의해 유도되 는 cyclin D1 단백질의 수준감소가 억제되었다 (Fig. 3C). 본 결과는 RAc-E70에 의해 유도되는 cyclin D1 단백질 분해는 GSK3β 의존성이라는 것을 의미한다.
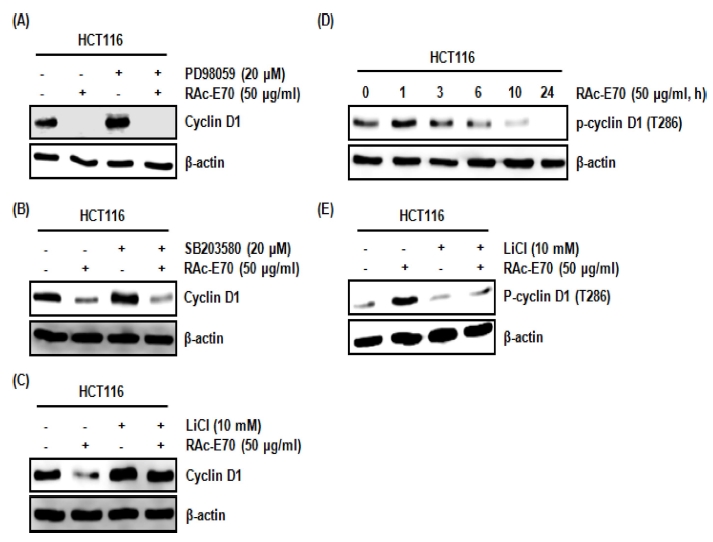
Determination of the upstream kinases involved in RAc-E70 mediated cyclin D1 degradation in human colorectal cancer cells.(A-C); HCT116 cells were pretreated with PD98059 (20 μM) as an ERK1/2 inhibitor, SB203580 (20 μM) as a p38 inhibitor or LiCl (10 mM) as a GSK3β inhibitor for 2 hours, and then co-treated with RAc-E70 (50㎍/㎖) for 6 hours. Cell lysates were subjected to SDS-PAGE and the western blot was performed using antibody against cyclin D1. β-actin was used as internal control for western blot analysis. (D); HCT116 cells were treated with RAc-E70 (50㎍/㎖) for the indicated times. Cell lysates were subjected to SDS-PAGE and the western blot was performed using antibody against phospho-cyclin D1 (Thr286). β-actin was used as internal control for western blot analysis. (E); HCT116 cells were pretreated with LiCl (10 mM) as a GSK3β inhibitor for 2 hours, and then co-treated with RAc-E70 (50㎍/㎖) for 1 hour. Cell lysates were subjected to SDSPAGE and the western blot was performed using antibody against phospho-cyclin D1 (Thr286). β-actin was used as internal control for western blot analysis.
GSK3β 의존성 cyclin D1 단백질 분해는 cyclin D1의 Thr286의 인산화와 밀접한 관련이 있다고 알려져 있기 때문에 (Alao, 2007), RAc-E70의 cyclin D1 Thr286 인산화와 LiCl 에 의한 GSK3β 억제의 RAc-E70 유도 cyclin D1 Thr286 인산화에 대한 영향을 평가하였다. 그 결과, RAc-E70은 처리 1 시간에 cyclin D1의 Thr286을 인산화 시켰고 (Fig. 3D), LiCl에 의한 GSK3β 억제는 RAc-E70 유도 cyclin D1의 Thr286 인산화를 억제하였다 (Fig. 3E). 본 결과는 RAc-E70 유도 cyclin D1 단백질의 분해는 GSK3β 의존성 cyclin D1 Thr286의 인산화와 밀접한 관련이 있다는 것을 의미한다.
이상의 연구 결과로 미루어 볼 때, 독활 에탄올 추출물은 GSK3β 의존성 cyclin D1 Thr286의 인산화를 유도하여 cyclin D1 단백질의 분해를 유도하고, 이것은 대장암세포의 생 육억제와 관련이 있는 것으로 판단된다. 또한, 본 결과는 항암 을 위한 대체보완의학 소재로 독활의 활용이 가능할 것으로 판단된다.
감사의 글
본 연구는 한국연구재단 이공분야 기초연구사업 지역대학우 수과학자 지원사업(NRF-2016R1D1A3B03931713)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Alao, JP, Lam, EWF, Ali, S, Buluwela, L, Bordogna, W, Lockey, P, Varshochi, R, Stavropoulou, AV, Coombes, RC, Vigushin, DM, Histone deacetylase inhibitor trichostatin A represses estrogen receptor α-dependent transcription and promotes proteasomal degradation of cyclin D1 in human breast carcinoma cell lines, Clinical Cancer Research, (2004), 10, p8094-8104.
[https://doi.org/10.1158/1078-0432.ccr-04-1023]

- Alao, JP, Stavropoulou, AV, Lam, EW, Coombes, RC, Vigushin, DM, Histone deacetylase inhibitor, trichostatin A induces ubiquitin-dependent cyclin D1 degradation in MCF-7 breast cancer cells, Molecular Cancer, (2006), 5, p8-18.
-
Alao, JP, The regulation of cyclin D1 degradation Roles in cancer development and the potential for therapeutic invention, Molecular Cancer, (2007), 6, p24-39.
[https://doi.org/10.1186/1476-4598-6-24]

- Diehl, JA, Cheng, M, Roussel, MF, Sherr, CJ, Glycogen synthase kinase-3β regulates cyclin D1 proteolysis and subcellular localization, Genes and Development, (1998), 12, p3499-3511.
- Dobos, GJ, Tan, L, Cohen, MH, McIntyre, M, Bauer, R, Li, X, Bensoussan, A, Are national quality standards for traditional Chinese herbal medicine sufficient?: Current governmental regulations for traditional Chinese herbal medicine in certain Western countries and China as the Eastern origin country, Complementary Therapies in Medicine, (2005), 13, p183-190.
- Gillett, C, Fantl, V, Smith, R, Fisher, C, Bartek, J, Dickson, C, Barnes, D, Peters, G, Amplification and overexpression of cyclin D1 in breast cancer detected by immunohistochemical staining, Cancer Research, (1994), 54, p1812-1817.
-
Gopalakrishnan, N, Saravanakumar, M, Madankumar, P, Thiyagu, M, Devaraj, H, Colocalization of β-catenin with Notch intracellular domain in colon cancer A possible role of Notch1 signaling in activation of cyclin D1-mediated cell proliferation, Molecular and Cellular Biochemistry, (2014), 396, p281-293.
[https://doi.org/10.1007/s11010-014-2163-7]

- Han, WS, Isolation of the antimicrobial compounds from Aralia cordata Thunb. extract, Korean Journal of Medicinal Crop Science, (2005), 13, p182-185.
- Jeong, SI, Han, WS, Yun, YH, Kim, KJ, Continentalic acid from Aralia continentalis shows activity against methicilinresistant Staphylococcus aureus, Phytotherapy Research, (2006), 20, p511-514.
-
Jung, KW, Won, YJ, Oh, CM, Kon, HJ, Lee, DH, Lee, KH, Cancer statistics in Korea Incidence, mortality, survival, and prevalence in 2014, Cancer Research and Treatment, (2017), 49, p292-305.
[https://doi.org/10.4143/crt.2017.118]

-
Kessler, RC, Davis, RB, Foster, DF, Van Rompay, MI, Walters, EE, Wilkey, SA, Kaptchuk, TJ, Eisenberg, DM, Long-term trends in the use of complementary and alternative medical therapies in the United States, Annals of Internal Medicine, (2001), 135, p262-268.
[https://doi.org/10.7326/0003-4819-135-4-200108210-00011]

-
Langenfeld, J, Kiyokawa, H, Sekula, D, Boyle, J, Dmitrovsky, E, Posttranslational regulation of cyclin D1 by retinoic acid A chemoprevention mechanism, Proceedings of the National Academy of Sciences of the United States of America, (1997), 94, p12070-12074.
[https://doi.org/10.1073/pnas.94.22.12070]

-
Musgrove, EA, Caldon, CE, Barraclough, J, Stone, A, Sutherland, RL, Cyclin D as a therapeutic target in cancer, Nature Reviews Cancer, (2011), 11, p558-572.
[https://doi.org/10.1038/nrc3090]

- Okabe, H, Lee, SH, Phuchareon, J, Albertson, DG, McCormick, F, Tetsu, O, A critical role for FBXW8 and MAPK in cyclin D1 degradation and cancer cell proliferation, PloS One, (2006), p, p1-12.
- Park, BK, Lee, JH, Cho, CK, Shin, HK, Eom, SK, Yoo, HS, Systemic review of clinical studies about oriental medical treatment of cancer in Korea, Journal of Korean Journal of Oriental Internal Medicine, (2008), 29, p1061-1074.
-
Park, HJ, Hong, MS, Lee, JS, Leem, KH, Kim, CJ, Kim, JW, Lim, S, Effects of Aralia continentalis on hyperalgesia with peripheral inflammation, Phytotherapy Research, (2005), 19, p511-513.
[https://doi.org/10.1002/ptr.1693]

- Park, SH, Kim, J, Cytotoxic polyacetylenes from Aralia cordata, Archives of Pharmacal Research, (1995), 39, p681-688.
-
Qin, A, Yu, Q, Gao, Y, Tan, J, Huang, H, Qiao, Z, Qian, W, Inhibition of STAT3/cyclin D1 pathway promotes chemotherapeutic sensitivity of colorectal caner, Biochemical and Biophysical Research Communications, (2015), 457, p681-687.
[https://doi.org/10.1016/j.bbrc.2015.01.048]

-
Russell, A, Thompson, MA, Hendley, J, Trute, L, Armes, J, Germain, D, Cyclin D1 and D3 associate with the SCF complex and are coordinately elevated in breast cancer, Oncogene, (1999), 18, p1983-1991.
[https://doi.org/10.1038/sj.onc.1202511]

-
Thoms, HC, Dunlop, MG, Stark, LA, p38-mediated inactivation of cyclin D1/cyclin-dependent kinase 4 stimulates nucleolar translocation of RelA and apoptosis in colorectal cancer cells, Cancer Research, (2007), 67, p1660-1669.
[https://doi.org/10.1158/0008-5472.can-06-1038]

- Wang, H, Khor, TO, Shu, L, Su, Z, Fuentes, F, Lee, JH, Kong, ANT, Plants against cancer A review on natural phytochemicals in preventing and treating cancers and their druggability, Anti-Cancer Agents in Medicinal Chemistry, (2012), 12, p1281-1305.
-
Yang, SA, Im, NK, Jhee, KH, Lee, IS, Effects of Aralia continentalis Kitagawa on antiplatelet and antioxidative activities, Journal of Life Science, (2008), 18, p357-362.
[https://doi.org/10.5352/jls.2008.18.3.357]

