
지방분화가 유도된 3T3-L1 세포와 고지방식이로 유도된 마우스에서 보리순 물추출물의 항비만 효과
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
An imbalance in energy intake and expenditure can cause obesity, which is a major risk factor for chronic diseases such as heart disease, type 2 diabetes, insulin resistance, cancers and hyperlipidemia.
In this study, we evaluated the anti-obesity effects of a water extract from the young leaves of barley sprout (BS) in 3T3-L1 cells and in high-fat diet (HFD)-induced obese mice (HF). Lipid accumulation measurement indicates that BS markedly inhibited adipogenesis by reducing lipid droplet production in a dose-dependent manner. Furthermore, the mRNA expression of adipogenic transcription factors peroxisome proliferator-activated receptor-γ and fatty acid synthetase, CCAAT/enhancer binding protein-α and fatty acid binding protein 4 in 3T3-L1 cells was significantly inhibited by BS treatment. In an in vivo test, the BSadministered group of HFD-induced mice showed less body weight gain, and lower liver and epididymal white adipose tissue weights. The BS-treated mice showed decreased serum levels of leptin and lipids compared to untreated HFD mice and the levels of adiponectin and the HDL-cholesterol/total cholesterol ratio increased. These results indicate that BS inhibits body fat accumulation by reducing the mRNA expression of lipogenesis transcription factors and increasing serum adipokine concentration in in vitro and in vivo tests.
BS reduced high fat diet-induced weight gain and had a positive effect on dyslipidemia.
Keywords:
Hordeum vulgare L., Adipogenesis, C/EBPα, FAS, Lipogenesis, PPARγ, C/EBPα서 언
비만은 체내에 필요한 에너지보다 과다 섭취하거나 섭취된 에너지보다 적게 소비함에 따라 발생하는 인체 내의 에너지 불 균형의 상태를 말한다. 비만의 원인은 호르몬의 변화, 유전, 정 신 건강 문제, 사회경제적 요인 등이 복합적으로 관여되어 있 으며, 고지혈증, 심혈관계 질환, 제 2 형 당뇨병, 각종 암과 같은 만성질환의 발병원인으로 간주된다 (Jung et al., 2014; Seo et al., 2017).
지방전구세포의 증식과 분화는 지방세포의 과형성과 지방축 적을 초래하며, 이는 지방세포 비대를 유도한다 (Yang et al., 2008). 즉, 단순한 식사조절로는 지방세포의 과형성, 비대를 억 제할 수 없으므로 비만의 억제와 근본적 치료를 위해서는 지 방세포의 분화를 조절하는 것이 지방축적을 억제할 수 있는 중요한 방법이다 (Nagai et al., 2014).
지방세포 분화 (adipogenesis) 과정에 관여하는 중요한 전사 인자로는 peroxisome proliferator activated receptor γ (PPARγ) 와 CCAAT-enhancer-binding protein α (C/EBPα)가 있다 (Roncari et al., 1981; Yang et al., 2008). 이러한 전사인자들 의 발현은 지방합성과 관련된 유전자 발현을 조절함으로써, 지 방 조직 내의 지방산 생성을 증가시키고 중성지방을 합성하여 지방축적을 초래한다 (Rosen and Macdougald, 2006). 그러므 로, 지방분화 조절 위해서는 C/EBPα, PPARγ 발현을 조절하 는 것이 중요하다.
천연 식물 소재들은 다양한 활성을 가진 파이토케미칼과 같 은 다양한 화합물을 가지고 있으며 이를 규명하여 생리활성 소재로서의 활용을 높이고자 많은 연구들이 진행되고 있다 (Kim et al., 2016). 최근 연구에 따르면 아선약 (Acacia catechu) 추출물이 3T3-L1 세포에서 지방축적 및 triglyceride 의 축적을 억제하였고 (Kim et al., 2016), 상엽추출물이 3T3-L1세포에서 PPARγ의 발현을 억제함에 따라 세포내 지방 축적을 감소시켜 비만환자에게 효과적인 처방 소재로 활용 가 능성에 대해 제시하였다 (Kown, 2016). 또한 이외에도 천연소 재를 비만치료소재로 발굴하기 위한 다양한 연구들이 진행되 었으며 그 중 보리 (Hordeum vulgare L.) 잎은 여러 연구에 의하여 다양한 생리활성 물질이 풍부하게 들어있다고 보고되 어 있다. 특히 정백미의 10 배 이상의 식이섬유를 가지고 있 으며, 강력한 항산화제인 SOD, 비타민 C, 비타민 E, β- carotene, 미네랄 등 각종 영양소가 균형 있게 함유되어 있다 (Kim et al., 2006). 이 때문에 최적의 영양 보조 식품으로 알려져 있어 보리순 소재를 활용한 제품이 시중에 차, 음료, 환 등 다양한 제형으로 판매되고 있다. 보리순은 β-glucan을 다량 함유하고 있어 고콜레스테롤혈증 개선에 효과적이며 (Newman et al., 1989; Mclntosh et al., 1991; German et al., 1996; Behall et al., 2004), streptozotocin으로 유도한 당 뇨쥐에서는 혈당을 저하시키는 것으로 보고되었다 (Son et al., 2016). 또한, Kim 과 Kim (2015)은 보리순의 에탄올 추출물 이 염증성매개체 및 사이토카인 생성을 억제함에 따라 항염증 효과가 있다고 보고하였으나, 보리순 물 추출물에 대한 비만 관련 연구는 미흡한 실정이다.
따라서, 본 연구에서는 보리순 물 추출물의 항비만 효과를 검증하기 위해, 마우스 유래 3T3-L1 세포에서 지방합성과 관 련된 유전자 발현을 측정하여 보리순의 분화유도 억제에 관한 연구를 수행하였다. 또한 고지방식이로 유도한 비만 동물모델 에서 보리순 추출물에 따른 지방 축적 및 혈장 내 지방질 함 량과 당에 미치는 효능을 조사하였다.
재료 및 방법
1. 시료추출 및 제조
실험에 사용한 보리 (Hordeum vulgare L.)순은 ㈜새뜸원 (Yeonggwang, Korea)에서 구입하여 시료로 사용하였다. 보리 순의 물추출물을 획득하기 위하여 보리순 분말 100 g의 1ℓ 증류수를 첨가하여 105℃ 온도에 3 시간 동안 3 회 가열하여 추출한 뒤 여과하여 불순물을 제거하였다. 추출한 시료는 동결 건조 시킨 후 (PVTFD20R, Ilshin Biobase Co., Dongducheon, Korea) 28.8%의 회수율을 얻어 실험 시료 (BS)로 사용하였다.
2. 세포배양 및 분화유도
실험에 사용한 마우스 지방전구세포는 American Type Culture Collection (ATCC, Manassas, VA, USA)에서 구입하 였고, 10% new born calf serum (NBCS, Invitrogen Co., Carlsbad, CA, USA)과 100 unit/㎖ penicillin, 100㎍/㎖ streptomycin (Invitrogen Co., Carlsbad, CA, USA)이 함유된 DMEM (Invitrogen Co., Carlsbad, CA, USA)배지를 사용하 여 37℃, 5% CO2의 조건의 incubator에서 배양하였다. 세포 가 confluence 상태가 되면 10% FBS-DMEM에 0.5mM 3- isobutyle-1-methylxanthine, 0.25mM dexamethasone, 10㎍/㎖ insulin이 첨가된 배지를 처리하여 분화유도를 2 일간 한 뒤, 다시 2 일간 10% FBS-DMEM에 10㎍/㎖ insulin이 첨가된 배지로 교체해주었다. 그 후 2 일 간격으로 10% FBSDMEM 배지로 교체해주었으며, 보리순 물추출물 (BS)의 처리 는 분화유도 시점부터 같이 처리하였다 (Sim et al., 2014).
3. 세포독성 실험
본 실험에 사용한 BS가 지방세포에 독성을 나타내는지를 측 정하기 위하여 MTS assay를 수행 하였다. 3T3-L1 preadipocyte를 96 well plate에 5 × 103 cells/well로 분주하였 으며, BS를 농도별로 (0, 31.25, 62.5, 125, 250, 500, 1,000㎍/㎖) 처리하여 48 시간 동안 배양하였다. 그 후의 각 각 MTS 용해액을 첨가한 후 37℃에서 4 시간 배양한 후 ELISA microplate reader (Infinite 200 pro, TECAN GmbH, Männedorf, Switzerland)를 이용하여 490㎚에서 흡광 도를 측정하였다 (Seo et al., 2017).
4. Oil-red O 염색
분화가 완료된 지방세포를 Oil red O staining kit (Sciencell, Carlsbad, CA, USA)를 이용하여 kit의 사용설명에 따라 염색하였으며, 완료된 세포는 세척 한 다음 광학현미경 (TS100, Nikon, Tokyo, Japan)으로 관찰하였다 (Sim et al., 2015).
5. 지방관련 유전자 Real-time PCR 분석
Total RNA는 배양한 3T3-L1 지방전구세포를 TRIzol reagent (Invitrogen Co., Carlsbad, CA, USA)를 이용하여 mRNA를 분리한 뒤 cDNA로 합성하여 Real-time PCR기기 (ABI7500, Applied Biosystem, Foster, CA, USA)를 이용하 여 PCR을 수행하였으며 (Sim et al., 2015), 실험에 사용한 유전자의 primer sequencing 정보는 Table 1에 나타내었다.
6. 동물모델 설정 및 디자인
실험동물은 6 주령 수컷 C57BL/6 마우스를 샘타코 (SAMTAKO, Osan, Korea)로부터 구입하였다. 마우스는 1 주 간 일반식이로 순화시킨 후 난괴법으로 분류하였다. 정상식이 군 (ND)과 고지방식이군 (HF)으로 나누어서 사육한 뒤, HF군 은 난괴법에 의하여 HF, BS 100㎎/㎏, BS 300㎎/㎏, BS 500㎎/㎏ 투여군으로 6 마리씩 나누어 6 주간 사육하였다. 동 물 사육 기간 동안 항온 (22 ± 2℃), 항습 (50 ± 5%), 12 시간 간격 (08:00 - 20:00)의 광주기로 일정한 조건을 유지하였다. 동 물은 폴리카보네이트 사육상자에 3 마리씩 분리하여 사육하였다.
본 실험에 사용한 고지방 식이 (60% kcal from fat)는 샘 타코 (SAMTAKO, Osan, Korea)로부터 구입하여서 제공하였 으며, 음수와 식이는 자유급식 하였고, 체중은 주 1 회 같은 시각에 측정하였으며, 식이섭취량은 매일 동일한시각에 공급 량에서 잔량을 감하여 측정하였다.
7. 혈청 및 장기 채취
실험이 끝난 실험동물은 희생 전 12 시간 동안 절식시킨 후 안와정맥채혈을 통해 혈액을 채취한 뒤 900 × g (4℃)에서 15 분간 원심 분리하여 혈청을 분리하였다. 실험동물의 장기 조직은 혈액채취 후 적출하여 PBS 용액으로 수차례 헹군 후 표면의 수분을 제거하여 칭량하였으며, 액체질소로 급냉시켜 –70℃에 보관하였다.
8. 혈청 생화학 지표 분석 및 adipokine 측정
혈청 중의 지질함량은 생화학 분석기 (FUJI DRI-CHEM 4000i, Fujifilm Co., Tokyo, Japan)를 사용하여 측정 하였다. 혈청 adipokine (leptin, adiponectin) 및 insulin, glucose 함 량 측정은 Multiplex detection kit (Bio-Rad, Hercules, CA, USA) 및 Luminex 200 Labmap system (Bio-Rad, Hercules, CA, USA)을 사용하였으며, 데이터분석은 Bio-Plex manager soft ware version 5.0 (Bio-Rad, Hercules, CA, USA)를 이 용하여 수행하였다.
9. 지방조직 세포의 형태학적 분석
지방조직의 형태학적 관찰은 적출한 지방조직 일부를 10% formaldehyde 용액에 24 시간 고정한 다음, hematoxylin and eosin (H and E) 염색을 실시하였고, 광학현미경 (TS100, Nikon, Tyoko, Japan)으로 200 배 배율로 관찰하였다.
10. 통계처리
모든 실험 결과는 평균 ±표준편차 (means ± SD)로 나타내 었으며, SPSS (18.0, Statistical Package for Social Science, SPSS Inc., Chicago, IL, USA)를 이용하여 일원변량분석 (One-way ANOVA)을 실시한 후 유의성 검증은 95% 수준에 서 세포실험은 Student’s t-test로 동물실험은 Duncan’s Multiple Range Test (DMRT)로 실시하였다.
결과 및 고찰
1. BS가 지방분화 및 지방구 형성에 미치는 영향
보리 (Hordeum vulgare L.) 순 물추출물 (BS)은 모든 농도 에서 독성이 나타나지 않아 125, 250, 500, 1,000㎍/㎖ 의 농 도로 모든 실험을 진행하였다 (Fig. 1). BS가 지방분화에 미치 는 영향을 알아보기 위해 Oil red O와 세포 내 triglyceride 함 량을 측정하였다. 그 결과 BS를 처리하지 않고 분화를 유도하 였을 때 지방구가 활발하게 형성되었으나, BS을 처리하였을 경 우에는 농도 의존적으로 지방구의 형성이 현저하게 감소되었다 (Fig. 2).F3F4
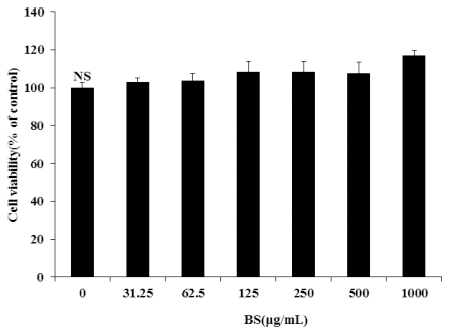
Effects of cell viability on BS of preadipocyte.The values are expressed as the means ± SD and significantly different between groups according to Student's t-test. NS; Not significantly.
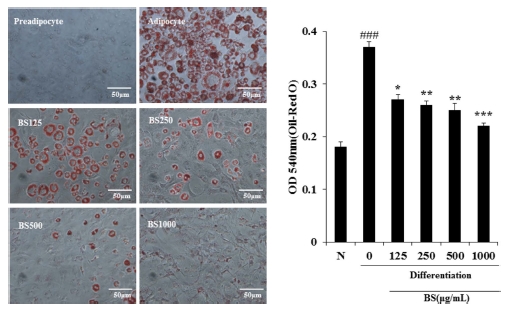
Effects of BS on lipid droplet accumulation of differentiated 3T3-L1.The values are expressed as the means ± SD and significantly different between groups according to Student’s t-test. *p < 0.05, **p < 0.01, ***p < 0.001 BS treated group versus adipocyte, ###p < 0.05 preadipocyte versus adipocyte. N; preadipocyte.
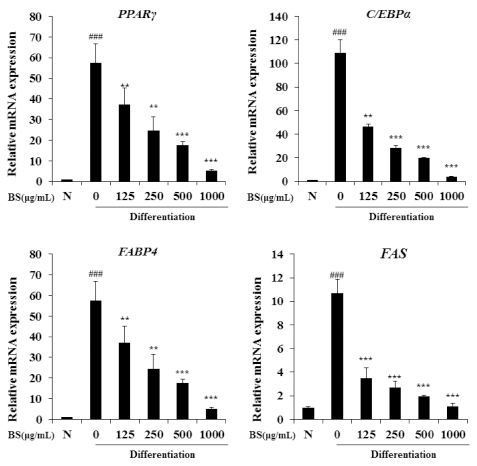
Effects of BS on adipogenic transcription factors and adipocyte expressed genes expression of differentiated 3T3-L1.The values are expressed as the means ± SD and significantly different between groups according to Student’s t-test. **p < 0.01, ***p < 0.001 BS treated group versus adipocyte, ###p < 0.05 preadipocyte versus adipocyte. N; preadipocyte.
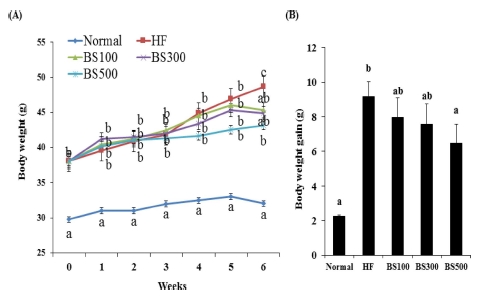
Effects of BS on body weight (A) and body weight gain (B) in mice fed a high-fat-diet.The values are expressed as the means ± SD. *Means not sharing a common letters (a-c) are significantly different between groups based on One-way ANOVA with Duncan’s Multiple Range post hoc Test at p < 0.05. Normal; normal diet, HF; High-fat diet, BS100; high-fat diet and adminstrated with barley sprout water extract (100㎎/ ㎏), BS300; high-fat diet and adminstrated with barley sprout water extract (300㎎/㎏), BS500; high-fat diet and adminstrated with barley sprout water extract (500㎎/㎏).
지방구는 triglyceride와 cholesterol ester의 축적 형성되며, 이렇게 형성된 지방구는 phospholipid monolayer와 관련 단백 질에 둘러싸여 있는 비활성 소낭으로서 precursor fibroblast에 서부터 지방세포로의 분화과정에서 나타난다. 과도한 지방구 는 비만을 유도할 뿐만 아니라 대사성 질환 유발에 관련성이 크기 때문에, 지방구 형성의 억제는 비만을 치료하고 억제하 는데 중요하다 (Yoon et al., 2010). 따라서, 본 실험에서 BS 가 지방구의 형성을 억제함에 따라 비만 억제에 크게 기여할 것으로 사료된다.
2. BS가 지방분화 관련 유전자 발현에 미치는 영향
지방분화에서 C/EBPα 와 PPARγ가 서로 상호작용하며 분 화과정에 직접적으로 영향을 미치게 된다. C/EBPα 와 PPARγ 의 발현은 백색지방세포에서 나타나는 지방구 생성 및 triglyceride의 축적과 함께 지방세포의 비대 및 생성을 초래하 며, 또한 FABP4, FAS 등과 같은 지방합성 관련 유전자의 발 현을 조절한다 (Choi et al., 2015). 따라서, C/EBPα 와 PPARγ의 발현을 억제 하는 것은 비만을 치료하는데 가장 핵 심적인 유전자 이다. 먼저 C/EBPα 와 PPARγ의 발현 정도를 Real-time PCR로 확인한 결과 Fig. 3에 나타난 바와 같이 분 화를 유발하였을 경우, PPARγ, C/EBPα 의 발현이 현저하게 증가하였지만 BS 처리에 의하여 농도 의존적인 감소가 유발 되었다. 또한, FABP4 및 FAS 경우에도 Fig. 3에서와 같이 BS 처리에 의하여 현저하게 감소하였음을 확인하였다. 따라서, BS 는 분화가 유도된 3T3-L1 세포에서 C/EBPα 와 PPARγ 발현 을 조절하여 지방구 생성을 억제함에 따라 비만치료에 효과적 일 것으로 사료된다.
3. BS가 비만 동물모델에서 체중변화에 미치는 영향
고지방식이와 함께 BS를 경구투여 한 후 실험동물의 체중 변화는 Fig. 2와 같다. 고지방식이 섭취군은 정상식이군에 비 해 유의적으로 체중증가가 유도되었으며, BS 섭취군에서는 고 지방식에 의해 증가된 체중이 6 주차에 유의적으로 감소하였 으며, 특히 BS 500㎎/㎏ 섭취군에서는 체중 증가량이 유의적 으로 감소하였다. 그러나 BS는 식이섭취량에는 유의적인 영향 을 미치지 않았다. BS섭취는 고지방식이로 유도된 비만 모델 에서 체중을 감소시킴에 따라 비만치료에 긍정적인 영향을 미 칠 것으로 사료된다.
4. BS가 비만 동물모델에서 간 및 부고환지방에 미치는 영향
고지방식이 섭취는 간 및 지방조직에 중성지질 및 콜레스테 롤 등의 축적을 일으켜 간 중량을 증가시킨다. 본 실험 결과 에서 간 무게 및 부고환 지방의 무게는 고지방 식이의 영향으 로 HF군이 normal군에 비하여 유의적으로 증가하였으며, 이 는 고지방식이에 의해 간 및 지방조직 내에 콜레스테롤 및 중 성지질 등이 축적 된 것으로 사료된다. 또한 지방조직의 중량 증가는 지방이 축적되어 그 함량이 증가할수록 대사성 질환 위험 역시 증가 된다고 알려져 있다.
본 실험에서 BS의 섭취는 고지방식이로 인한 간 무게 및 지방조직 무게 증가를 억제하였다 (Fig. 5). 따라서 보리순의 섭취에 따라서는 간 무게 및 지방조직의 중량이 감소함에 따 라 대사성 질환 위험 역시 감소시킬 것으로 사료된다.
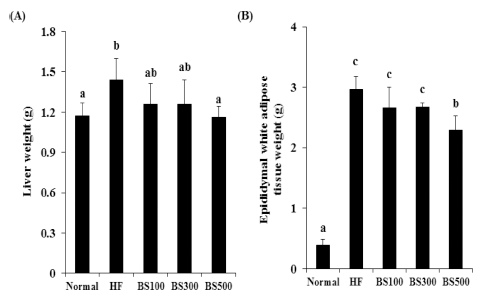
Effects of BS on liver weight (A) and epididymal white adipose tissue weights (B) in mice fed a highfat- diet.The values are expressed as the means ± SD. *Means not sharing a common letters (a-c) are significantly different between groups based on Oneway ANOVA with Duncan’s Multiple Range post hoc Test at p < 0.05. Normal; normal diet, HF; High-fat diet, BS100; high-fat diet and adminstrated with barley sprout water extract (100㎎/㎏), BS300; highfat diet and adminstrated with barley sprout water extract (300㎎/㎏), BS500; high-fat diet and adminstrated with barley sprout water extract (500㎎/㎏).
5. BS가 비만 동물모델에서 혈중 지질함량에 미치는 영향
보리순의 혈액내의 지질 농도 분석 결과는 Table 2에 나타 내었다. 혈청 내 triglyceride (TG)함량은 고지방식이에 의해 가장 큰 영향을 받는데 고지방식이만을 섭취한 HF군에 비해 BS 300㎎/㎏, BS 500㎎/㎏ 섭취군 에서 혈청 TG 함량이 유의적으로 감소하였다. High density lipoprotein cholesterol (HDL-C)은 혈중의 동맥경화를 유발시키는 저분자 콜레스테롤 을 간으로 이동시켜 제거하는 좋은 콜레스테롤로 알려져 있다 (Sim et al., 2014).
본 연구에서는, HDL-C의 함량은 HF군과 시료 섭취군에서 는 유의적인 차이를 보이지는 않았지만, HDL-C/total cholesterol ratio (HTR)의 경우 물질 섭취 군이 정상수준까지 개선됨을 알 수 있었다. 이는 BS섭취가 전체 콜레스테롤 중 HDL-C의 비율을 증가함으로써 BS 추출물 섭취가 혈중 콜레 스테롤 농도 개선에 도움을 줄 수 있을 것으로 사료된다. 결 과적으로 BS의 섭취는 HTR의 비율을 높이고, TG함량을 낮 춤으로서 고지방식이로 유도된 고지혈증 개선에 효능이 있는 것으로 판단된다.
6. BS가 비만 동물모델에서 혈중 혈당 및 인슐린, leptin, adiponectin 함량에 미치는 영향
장기간의 고지방섭취는 혈당 상승을 유도하여 결국 인슐린 저항성을 일으킨다. 인체는 식사 후에 혈당이 올라가면 췌장 에서 인슐린을 분비하여 혈당을 내리게 하지만, 체지방의 과 다 축적되면, 인슐린 저항성에 의한 고인슐린증이 장시간 지 속된다. Leptin은 지방조직에서 만들어져 음식섭취 및 에너지 균형조절에 작용하는 대사호르몬으로서, leptin은 음식섭취에 따라 지방량이 증가하여 leptin 농도가 증가하게 된다. 그러나 비만인에게는 대사이상으로 인슐린과 leptin에 대한 저항성이 나타나 leptin과 인슐린에 대한 감수성이 떨어지게 된다. Leptin과 인슐린의 감수성의 감소는 결국 고혈당상태를 유지 시켜 제 2 형 당뇨병을 유발한다. Adiponectin 역시 지방세포 에서 분비되는 adipokine으로, 에너지 대사에 관여하는 인자로 알려져 있다. Adiponectin 혈중 수치는 정상인에 비해 비만 환자에서 감소한다고 알려져 있다. 따라서 고지방식이를 제공 한 마우스에서 BS 투여에 의한 혈중 인슐린 및 leptin, adiponectin 농도에 미치는 영향을 실험하였다.
Normal군에 비해 HF군에서 혈당, leptin, 인슐린의 함량이 유의적으로 증가했으며, adiponectin의 함량은 유의적으로 감 소하였다. BS의 섭취시 인슐린 농도가 농도 의존적으로 감소 하였으며, leptin은 BS 섭취군에서 모두 유의적으로 감소하였 다. 이로 인해 혈중 혈당 역시 감소하였다. 반면 adiponectin 은 BS섭취에 의해 유의적으로 증가하였다 (Fig. 6). 따라서, 본 결과는 BS의 섭취는 adipokine 및 혈당, 인슐린 농도를 개선함에 따라 비만으로 인한 대사성 질환을 개선할 것으로 사료된다.
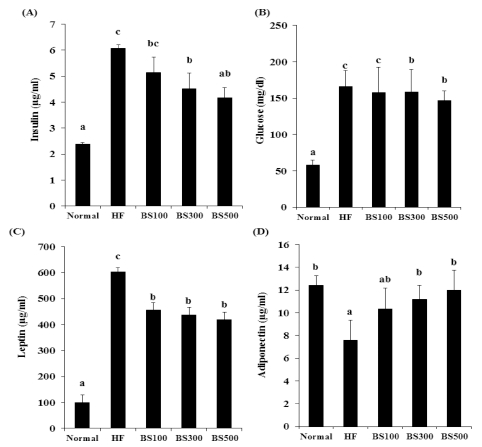
Effects of BS on serum glucose (A) insulin (B) leptin (C) and adiponectin (D) in mice fed a high-fat-diet.The values are expressed as the means ± SD. *Means not sharing a common letters (a-c) are significantly different between groups based on One-way ANOVA with Duncan’s Multiple Range post hoc Test at p < 0.05. Normal; normal diet, HF; High-fat diet, BS100; High-fat diet and adminstrated with barley sprout water extract (100㎎/㎏), BS300; high-fat diet and adminstrated with barley sprout water extract (300㎎/㎏), BS500; high-fat diet and adminstrated with barley sprout water extract (500㎎/㎏).
7. 비만 동물모델에서 간 및 지방조직의 병리학적 조직검사
H&E 염색을 통하여 간조직 및 white adipose tissue 에 속 하는 부고환지방의 형태를 관찰한 결과는 Fig. 7과 Fig. 8 에 나타내었다. Normal 군에 비하여 HF군의 간조직에서는 정상 군에 비하여 많은 지방구가 관찰되었으며, 모든 물질 섭취군 에서는 지방구가 감소한 것을 볼 수 있었다. 또한, HF군은 normal 군에 비하여 지방세포의 크기가 커진 반면 물질 섭취 군 에서는 농도 의존적으로 지방세포의 크기가 감소하였다. 이 를 통하여 물추출물의 섭취는 간 조직내 지방조직의 지방축적 을 효과적으로 개선할 것으로 사료된다.
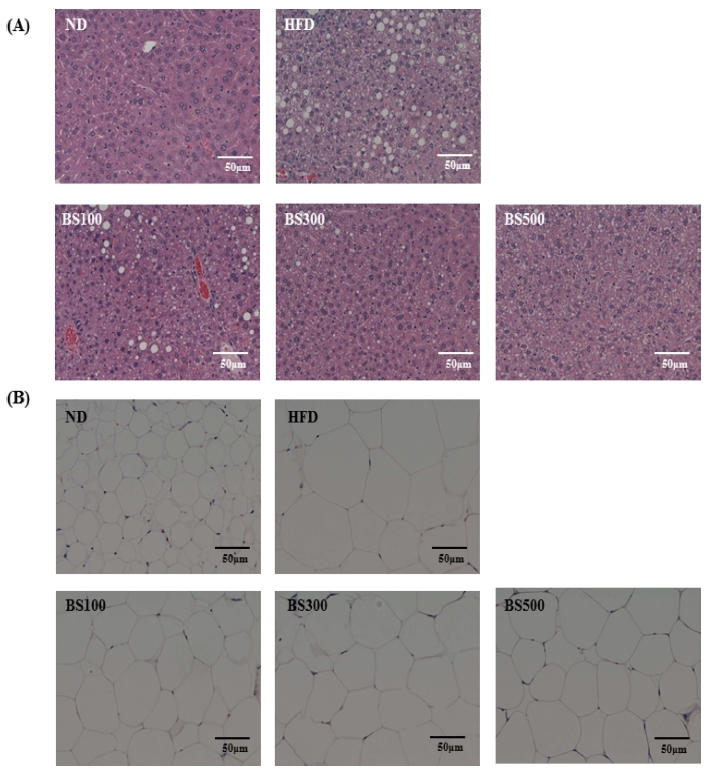
Effects of BS on hepatic fat accumulation (A) and size of adipocyte (B) in mice fed a high-fat-diet (200X).Normal; normal diet, HF; High-fat diet, BS100; high-fat diet and adminstrated with barley sprout water extract (100㎎/㎏), BS300; high-fat diet and adminstrated with barley sprout water extract (300㎎/㎏), BS500; high-fat diet and adminstrated with barley sprout water extract (500㎎/㎏).
감사의 글
본 연구는 농림수산식품부 기술사업화지원사업(과제번호: 814002-03-1-HD020)의 지원에 의해 이루어진 결과로 이에 감 사드립니다.
References
-
K.M. Behall, D.J. Scholfield, J. Hallfrisch, Lipids significantly reduced by diets containing barley in moderately hypercholesterolemic men., J. Am. Coll. Nutr, (2004), 23, p55-62.
[https://doi.org/10.1080/07315724.2004.10719343]

-
S.I. Choi, H. Kwak, J.Y. Kim, J.G. Choi, J.H. Lee, Antiadipogenic effects of Salvia plebeia R. Br. extracts by extraction conditions in 3T3-L1 preadipocytes., Hanguk Yakyong Changmul Hakhoe Chi, (2015), 23, p245-252.
[https://doi.org/10.7783/kjmcs.2015.23.3.245]

-
B.J. German, R. Xu, R. Walzem, J.E. Kinsella, B. Knuckles, M. Nakamura, W.H. Yokoyama, Effects of dietary fats and barley fiber on total cholesterol and lipoprotein cholesterol distribution in plasma of hamsters., Nutr. Res, (1996), 16, p1239-1249.
[https://doi.org/10.1016/0271-5317(96)00127-3]

-
H.A. Jung, H.J. Jung, H.Y. Jeong, H.J. Kwon, M.Y. Ali, J.S. Choi, Phlorotannins isolated from the edible brown alga Ecklonia stolonifera exert anti-adipogenic activity on 3T3-L1 adipocytes by downregulating C/EBPIα and PPARγ., Fitoterapia, (2014), 92, p260-269.
[https://doi.org/10.1016/j.fitote.2013.12.003]

- D.C. Kim, D.W. Kim, S.D. Lee, M.J. In, Preparation of barley leaf powder tea and its quality characteristics., Journal of the Korean Society of Food Science and Nutrition, (2006), 35, p734-737.
-
D.G. Kim, M.J. Kang, H.W. Suh, O.O. Kwon, J.H. Shin, Effect of Acacia catechu extract on 3T3-L1 preadipocyte differentiation., Journal of the Korean Society of Food Science and Nutrition, (2016), 45, p1107-1113.
[https://doi.org/10.3746/jkfn.2016.45.8.1107]

-
M.K. Kim, D.Y. Kim, Anti-inflammatory effect of barley leaf ethanol extract in LPS-stimulated RAW264.7 macrophage., Korean Journal of Food Preservation, (2015), 22, p735-743.
[https://doi.org/10.11002/kjfp.2015.22.5.735]

- O.J. Kown, Anti-adipogenic effect of mori follium extract in 3T3-L1 cells., Korean Journal of Herbology, (2016), 31, p47-53.
- G.H. Mclntosh, J. Whyte, R. McArthur, P.J. Nestel, Barley and wheat foods: Influence on plasma cholesterol concentrations in hypercholesterolemic men., Am. J. Clin. Nutr, (1991), 53, p1205-1209.
-
H. Nagai, T. Tanaka, T. Goto, T. Kusudo, N. Takahashi, T. Kawada, Phenolic compounds from leaves of Casimiroa edulis showed adipogenesis activity., Biosci. Biotechnol. Biochem, (2014), 78, p296-300.
[https://doi.org/10.1080/09168451.2014.877821]

- R.K. Newman, C.W. Newman, H. Graham, The hypocholesterolemic function of barley I -glucans., Cereal Foods World, (1989), 34, p883-886.
-
D.A. Roncari, D.C. Lau, S. Kindler, Exaggerated replication in culture of adipocyte precursors from massively obese persons., Metabolism, (1981), 30, p425-427.
[https://doi.org/10.1016/0026-0495(81)90174-8]

-
E.D. Rosen, O.A. Macdougald, Adipocyte differentiation from the inside out., Nat. Rev. Mol. Cell Biol, (2006), 7, p885-896.
[https://doi.org/10.1038/nrm2066]

-
K.H. Seo, Y.H. Kim, Y.M. Lee, M. Ghosh, K.M. Park, D.H. Park, J.S. Kim, B.O. Lim, Evaluation of anti-oxidant and anti-inflammatory activities of Ganoderma lucidum cultured on hulled barley., Hanguk Yakyong Changmul Hakhoe Chi, (2017), 25, p29-36.
[https://doi.org/10.7783/kjmcs.2017.25.1.29]

-
M.O. Sim, J.R. Ham, H.I. Lee, K.I. Seo, M.K. Lee, Longterm supplementation of umbelliferone and 4-methylumbelliferone alleviates high-fat diet induced hypertriglyceridemia and hyperglycemia in mice., Chem. Biol. Interact, (2014), 216, p9-16.
[https://doi.org/10.1016/j.cbi.2014.03.003]

-
M.O. Sim, H.I. Lee, J.R. Ham, K.I. Seo, M.K. Lee, Longterm supplementation of esculetin ameliorates hepatosteatosis and insulin resistance partly by activating AdipoR2-AMPK pathway in diet-induced obese mice., J. Funct. Foods, (2015), 15, p160-171.
[https://doi.org/10.1016/j.jff.2015.03.014]

-
H.K. Son, Y.M. Lee, Y.H. Park, J.J. Lee, Effect of young barley leaf powder on glucose control in the diabetic rats., Korean Journal of Community Living Science, (2016), 27, p19-29.
[https://doi.org/10.7856/kjcls.2016.27.1.19]

-
J.Y. Yang, M.A. Della-Fera, S. Rayalam, S. Ambati, D.L. Hartzell, J.H. Park, C.A. Baile, Enhanced inhibition of adipogenesis and induction of apoptosis in 3T3-L1 adipocytes with combinations of resveratrol and quercetin., Life Sci, (2008), 82, p1032-1039.
[https://doi.org/10.1016/j.lfs.2008.03.003]

- T.S. Yoon, Y.Y. Sung, J.Y. Jang, W.K. Yang, Y. Ji, H.K. Kim, Anti-obesity activity of extract from Saussurea lappa., Hanguk Yakyong Changmul Hakhoe Chi, (2010), 18, p151-156.
