운목향 70% 에탄올 추출물의 항염증 및 면역조절에 대한 효과
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This present study was conducted to evaluate the anti-inflammatory and immune regulatory effects of Aucklandia lappa Decne (AL)..
We measured cytotoxicity, nitric oxide (NO) content, mRNA expression (iNOS, IL-1α, IL-1β, and TNF-α), protein expression (iNOS, COX-2, and IκB-α) and phagocytic activity in RAW264.7 cells. Male BALB/c mice were fed 100 ㎎/㎏ AL (Aucklandia lappa Decneon 70% ethanol extract) and 250 ㎎/㎏ AL for 4 weeks; thereafter, we observed B/T or CD4+ /CD8+ lymphocyte subpopulation change, and expression patterns of CD4+ and CD8+ lymphocytes by immunohistochemical staining in mouse splenocytes and/or thymocytes. To determine the experimental concentration of AL, cell viability was measured by MTT assay and tested at 12.5 μg/ml or less. AL inhibited the levels of NO, lymphokine production (IL-1β, and TNF-α), and mRNA (iNOS, IL-1α, IL-1β, and TNF-α) and protein (iNOS, and COX-2) expression. Additionally, the levels of IκB-α, phagocytic activity, and splenic and thymic T lymphocytes, especially TH and TC cells were significantly increased in AL administered mice. The immuno-reactive density of CD4+ and CD8+ lymphocytes was stronger in AL groups than in the normal group. AL stimulated NO, iNOS, and COX-2, and regulated IL-1α, IL-1β, TNF-α, and IκB-α in macrophages treated with LPS (lipopolysaccharide). In addition, AL increased the phagocytic activity of macrophages and the immunity of mouse T (TH, and TC) cells.
These results suggested that AL might show anti-inflammatory activity via the suppression of various inflammatory markers and immuno-regulatory activity.
Keywords:
Aucklandia lappa Decne, Anti-inflammatory Activity, Nitric Oxide, Phagocytic Activity, Protein Expression서 언
운목향 (Aucklandia lappa Decne)은 목향의 이명으로서 국 화과에 속한 다년생 초본인 당목향, 청목향, 토목향 뿌리에서 기원하며 성미는 무독 (無毒), 신고 (辛苦), 온 (溫)하고 작용 부위는 간 (肝), 비 (脾), 폐 (肺)로 알려져 있으며 한의학에서 는 설사, 구토, 호흡기 질병 치료 등에 한약재로서 널리 사용 되고 있다 (Jeon et al., 2005). 운목향은 sesquiterpene 계통을 약 1-2% 함유하고 있고 sesquiterpene lactone계 화합물인 costunolide, dehydrocostuslactone, alanatolactone, isoalantolactone, saussurealactone, polyene alcohols, lignan, alkaloid 및 tannin (Kang et al., 1999) 등이 함유된 것으로 보고되고 있다. Costunolide는 항염증 작용 (Pae et al., 2007), iNOS의 생성 억제작용 (Matsuda et al., 2003), dehydrocostuslactone은 CDK2 활성저해 (Admas, 2001), 조직암의 세포증식억제 (Bocca et al., 2004)를 유도함으로써 항암작용 등 약리작용이 있음이 보고되었다.
염증과 면역은 매우 깊은 관련이 있다. 염증은 감염 및 상 처, 면역 등의 외부자극에 의해 유도되는 과정으로 신체 방어 기전 중 하나이며 손상 부위를 복구시키는 역할도 한다. 외부 자극이 가해지면 대식세포가 활성화되어 염증매개물질을 분비 하고 세균이나 바이러스 등을 인지하여 탐식작용 (phagocytosis) 을 일으켜 제거하는 면역의 과정에서 염증도 일어난다 (Yee et al., 2000). 이러한 염증은 세균, 바이러스 등의 병원성 물 질 등을 처리하여 손상된 세포를 회복하고 재생하는 보호기능 으로 결코 나쁘지 않으며 염증성 질환의 치료에서 염증 반응 의 제어는 대단히 중요하다 (Chao et al., 2000).
Mukaida 등 (1996)은 염증의 외부 자극원 중의 하나인 lipopolysaccharide (LPS)는 macrophage와 같은 염증성 세포 의 활성을 증대시키고 이로 인해 활성화된 macrophage는 IL- 6, IL-1β, TNF-α와 같은 염증성 사이토카인을 증가시킨다고 하였다.
또한, Jang 등 (2016)은 염증반응이 일어나면 inducible nitric oxide synthase (iNOS)에 의해 NO와 cyclooxygenase- 2 (COX-2)에 의해 prostaglandin E2 (PGE2) 등과 같은 염증 매개물질을 생성하게 되는데 이러한 매개물들에 의해 cytokine, chemokine, growth factor의 합성을 조절하는 transcription factor인 NF-κB가 활성을 띄게 되면 IκB-α가 proteasome에 의해 분해되어 핵 안으로 들어가 염증과 관련된 사이토카인 발현을 조절하여 염증을 유도하는 역할을 하는 것으로 알려져 있다.
면역계는 각종 병원체 등 이물질로부터 생체 내부 환경을 방어하는 생체방어체계인 면역세포 중 특히 T세포는 helper T (CD4+), cytotoxic T (CD8+)세포로 구분되며 면역에서의 기억 능력을 가지고 B세포에 관여하여 항체 생성에 도움을 줄 뿐 만 아니라 세포성면역에 주된 역할을 하는데, Lucey 등 (1996)은 TH세포는 pro-inflammatory cytokine (IL-2, IL-12, IFN-γ, TNF-α 등)을 생산하는 TH1 type과 anti-inflammatory cytokine (IL-4, IL-6, IL-8, TGF-β 등)을 분비하는 TH2 type 으로 구분이 된다.
TH세포는 TH1과 TH2가 균형을 이룬 면역학적 항상성을 유지 하여야 건강한 신체를 지속할 수 있으나 TH1 type의 proinflammatory mediator의 기능이 TH2 type의 anti-inflammatory mediator의 기능에 비해 상대적으로 강화되어 균형이 깨져 면 역반응의 제어가 불가능하게 되면 염증성 질환이 발병하게 된다. 이렇듯 염증과 면역은 신체에서 매우 깊은 상관관계를 지니고 있다 (Holdsworth et al., 1999).
본 연구에서는 운목향에 대한 항염증 효과와 면역조절에 미 치는 영향을 살펴보기 위해 항염증 관련 실험은 대식세포의 세포증식반응, LPS로 유도된 NO 생성 억제능, 염증 관련 lymphokine (IL-1β, TNF-α) 분비 억제능, RT-PCR 및 western blotting을 통한 mRNA 및 단백질 발현 등을 확인하 였으며, 면역 관련 실험은 대식세포주 탐식활성능, in vivo에 서 B·T림프구의 아집단 변화, 비장의 T세포에 존재하는 CD4+ 와 CD8+ T cells의 면역조직화학적 염색법을 수행하였다.
재료 및 방법
실험에 사용된 운목향 (Aucklandia lappa Decne)은 울산 광명당 제약에서 구입하여 파쇄한 후 약리작용을 나타내는 유 효 성분이 정유 성분을 함유하고 있어 70% 에탄올을 시료중량 10 배 양을 넣고 초음파 (Branson Ultrasonics Co., Danbury, CT, USA)로 추출 (30℃, 2 시간)하였다. 이 추출물을 감압 여 과한 후 동결 건조한 분말 (AL)은 4℃에서 보관, 동물실험 시 에는 증류수로, 세포실험 시에는 phosphate buffered saline (PBS)로 녹여 사용하였다.
1. 실험 재료
실험에 사용된 운목향 (Aucklandia lappa Decne)은 울산 광명당 제약에서 구입하여 파쇄한 후 약리작용을 나타내는 유 효 성분이 정유 성분을 함유하고 있어 70% 에탄올을 시료중량 10 배 양을 넣고 초음파 (Branson Ultrasonics Co., Danbury, CT, USA)로 추출 (30℃, 2 시간)하였다. 이 추출물을 감압 여 과한 후 동결 건조한 분말 (AL)은 4℃에서 보관, 동물실험 시 에는 증류수로, 세포실험 시에는 phosphate buffered saline (PBS)로 녹여 사용하였다.
2. 세포주 및 실험동물
한국 세포주은행에서 분양받은 RAW264.7 세포주는 DMEM 배지 (+10% FBS)로 CO2 배양기 (37℃, 5% CO2)에 서 배양하였다. 실험동물은 4 주령의 수컷 BALB/c 생쥐를 다 물사이언스 (주)에서 구입·사육 (온도 22 ± 2℃, 습도 55 ± 10%, light/dark 12 시간)하였으며, 일주일간 적응시킨 후 고형사료와 물을 자유로이 섭취시키며 (동물실험승인번호: WS2016-004), 동물실험은 우석대학교 동물실험윤리위원회 (WSIACUC: Woosuk University Institutional Animal Care and Use Committees) 지침에 의해 수행하였다.
3. 세포생존율 (MTT assay)
RAW264.7 세포주 3 × 104 cells/well에 AL (3.125 -50㎍/㎖) 을 첨가하고 1 시간 배양 후 LPS (1㎍/㎖)를 처리하여 배양 (24 시간, 37℃)하였다. 배양종료 4 시간 전에 MTT [3-(4,5- dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] 용액 (5㎎/㎖ in PBS)을 20㎕/well 처리, 4 시간 후 10% SDS (+ 0.01 N HCl) 100㎕를 가하여 18 시간 빛을 차단하며 반 응시켰다. Microplate reader (Molecular Devices LLC., Sunnyvale, CA, USA)로 각 well 흡광도를 570㎚에서 측정 하였다.
4. 대식세포의 NO 측정
RAW264.7 세포주 8×105cells/well에 AL (3.125 -12.5㎍/㎖) 을 1 시간 동안 처리한 후, LPS (1㎍/㎖)를 처리, 배양 (24 시 간, 37℃)하였다. 배양 상등액과 griess reagent를 1 : 1의 비 율로 혼합, 차광 (실온, 10 분) 후 microplate reader로 540㎚에서 측정하였고, 표준물질은 sodium nitrite를 사용하였 다 (Adams and Hamilton, 1984).
5. RT (reverse transcription) PCR
RAW264.7 세포주 (3 × 106 cells/well)에 AL을 농도별로 첨 가하여 1 시간 배양 후 LPS (1㎍/㎖)를 처리하여 배양 (24 시간)한 다음 total RNA를 RNAiso plus (Takara Bio Inc., Otsu, Japan)를 이용하였으며 제조회사의 방법에 준하여 분리 하였다 (Peirson and Butler, 2007).
cDNA는 RNA to cDNA EcoDry Premix (Clontech Laboratories Inc., CA, USA)를 이용하여 합성하였으며, EmeraldAmp GT PCR Master Mix (Takara Bio Inc., Otsu, Japan)를 사용하여 PCR 기기 (Dice, Takara Bio Inc., Otsu, Japan)에서 30 cycles동안 증폭하였다. 각각의 cycle은 denaturation (94℃, 10 초)시킨 후, annealing (55 - 57.3℃, 30 초), extension (72℃, 30 초)시켰다. PCR product는 Loading STAR (DYNEBIO Inc., Seongnam, Korea)로 염색 하여 1% agarose gel에서 전기영동하고 UV transilluminator (OPTIMA Inc., Tokyo, Japan)로 관찰하였다.
PCR에 사용된 primer (GenoTech Corp., Daejeon, Korea) 는 다음과 같다; iNOS sense, 5’-CAG ATC GAG CCC TGG AAG AC-3’; iNOS anti-sense, 5’-CTG GTC CAT GCA GAC AAC CT–3’; IL-1α sense, 5’-GCA GCC TTA TTT CGG GAG TC-3’; IL-1α anti-sense, 5’-GGC TCC ACT AGG GTT TGC TC-3’; IL-1β sense, 5’-ACG GAC CCC AAA AGA TGA AG-3’; IL-1β anti-sense, 5’-TGA TAC TGC CTG CCT GAA GC-3’; TNF-α sense, 5’-TAG CCC ACG TCG TAG CAA AC-3’; TNF-α anti-sense, 5’- TCC CTT GAA GAG AAC CTG GG-3’.
6. Cytokines (IL-1β, TNF-α) 측정
IL-1β 측정은 RAW264.7 세포주를 6 well plate에 2 × 106 cells/well로 분주하고 AL을 농도별로 처리한 후 1 시간 뒤 LPS (lipopolysaccharide)를 1㎍/㎖처리하였으며, 24 시간 배양 후 상층액 수거하여 sandwich ELISA (enzyme-linked immunosorbent assay) 방법으로 (Enavall and Perlmann, 1972) cytokine을 450㎚에서 흡광도 측정하였다. TNF-α 측정 은 IL-1β 방법에 준하였다.
7. 단백질 분리 및 웨스턴 블로팅
RAW264.7 세포주를 2 × 106 cells/well에 농도별 AL을 처리 하여 1 시간 배양한 후, LPS (1㎍/㎖)를 처리하고 24 시간 배양하였다. 각 세포를 취하여 RIPA buffer (+1% protease inhibitor cocktail) 500㎕로 lysis시킨 후 원심분리 (15,000 rpm, 15 분)하여 단백질을 추출하였으며, Bradford법 (Bradford, 1976)을 이용해 단백질 정량 후 well 당 25㎍의 단백질을 7.5% acrylamide gel에 loading하여 SDS-PAGE를 시행하였다.
전기영동 후 단백질을 0.2㎛ PVDF membrane (Merck Millipore, Billerica, MA, USA)에 1 시간 transfer 한 다음 5% skim milk로 상온에서 1 시간 blocking하였다. 그 후 희 석된 항체 (iNOS, COX-2, IκB-α)를 overnight 반응시켜, TBST (0.05% Tween 20 in TBS)로 세척 (4 회) 후 goat anti-rabbit (or mouse) IgG-HRP 항체 (Santa Cruz Biotechnology Inc., Dallas, TX, USA)를 반응 (상온, 1 시간) 시켰다. 이를 TBST로 세척 (4 회)한 후 membrane을 ECL (enhanced chemiluminescence)법을 이용해 화상 이미지 분석 시스템 (Fusion Solo S, Vilber Lourmat, Collegien, France) 으로 분석하였다.
8. 탐식작용 활성 측정
RAW 264.7 세포를 96 well에 5 × 105 cells/well으로 분주 한 후 AL을 농도별 처리한 후, LPS (1㎍/㎖)를 처리하고 24 시간 배양하여 탐식능을 측정하기 위해 zymosan입자를 옵 소닌화 (FBS 사용)시켜 CytoselectTM 96 well phagocytosis assay (zymosan substrate) kit (Cell Biolabs Inc., San Diego. CA, USA)를 이용하여 대식세포 탐식능을 microplate reader (Molecular Devices, LLC., Sunnyvale, CA, USA)로 흡광도 405㎚에서 측정하였다.
9. 비장 및 흉선림프구 아집단 측정
5 주령의 BALB/c mouse에 AL 100㎎/㎏ (AL 100), AL 250 ㎎/㎏ (AL 250)을 4 주간 경구투여 하여 경추 탈구시킨 후 비장과 흉선을 적출하여 비장 및 흉선세포를 PBS에 부유 시켜 1 × 106 cells/㎖로 조정된 세포 부유액에 PE/FITC conjugated-anti B220 및 Thy1 monoclonal antibody (Sigma- Aldrich Co., St. Louis, MO, USA)와 PE-anti CD4/FITCanti CD8 monoclonal antibody (Sigma-Aldrich Co., St. Louis, MO, USA)를 1 : 30 dilution으로 이중 염색반응 (4℃, 30 분)시키고 flow cytometer (Beckman Coulter Inc., Brea, CA, USA) (excitation: 488㎚, emission: 525㎚/FITC, 575㎚/PE)를 이용하여 림프구 아집단을 측정하였다 (Shortman and Backson, 1974).
10. 면역조직화학적 염색
면역 관련 인자들의 형태학적 변화를 관찰하기 위하여 절취 한 비장은 일반적인 방법에 의하여 탈수와 투명화 과정을 거 쳐 파라핀 포매 후 paraffin 조직 절편을 (7㎛) 제작하여 면 역조직화학염색 하였다.
비장에서 CD4, CD8의 발현을 관찰하기 위해 비장 조직 절 편을 0.1M phosphate buffer (PB)로 세척한 후 0.3% H2O2 를 처리하고 1% normal goat serum과 0.3% Triton X-100 을 1 시간 처리하였다. CD4 (1 : 100 dilution)와 CD8 (1 : 50 dilution) 항체 (Sigma-Aldrich Co., St. Louis, MO, USA)를 조직 절편에 떨어뜨린 후 실온에서 12 시간 반응 후 0.1M PB로 실온에서 세척 (15 분, 2 회)하였다.
Biotinylated anti-rabbit (or goat or mouse) IgG (Vector Laboratories Inc., Burlingame, CA, USA)는 1 : 200으로 희 석하여 반응 (실온, 1 시간)시켰으며 다시 0.1 M PB로 수세 (15 분, 2 회)과정을 거친 후 peroxidase가 표지된 ABC (avidin biotin complex) 용액에 반응 (실온, 1 시간)시켰다. 다시 0.1 M PB로 수세 (15 분, 2 회)하고 나서 0.1M PB 에 3-3’ diaminobenzidine를 녹인 용액에서 5 분간 반응시킨 후 H2O2 (final 0.005%)를 첨가하여 5 분간 발색반응을 관찰 하였다. 반응이 끝난 다음 다시 0.1M PB로 여러 차례 수세 하여 탈수와 투명화를 거친 후 permount로 봉입하여 광학현 미경으로 관찰하였다.
11. 통계처리
본 실험에서 결과는 평균 ±표준편차 (Mean ± SD)로 표시하 였고, 통계처리는 SPSS (Statistical Package for Social Science, version 19.0, SPSS Inc., Chicago, IL, USA) package를 이용하여 그룹 간의 통계적 유의성을 Duncan’s Multiple Range Test (DMRT)로 실시하였다. 유의성은 p < 0.05 수준에서 판단하였다.
결 과
1. 대식세포 (RAW264.7 세포주) 생존율에 미치는 효과
항염증 효과 확인을 위한 실험 적정 농도를 구하기 위해 먼 저 Hansen 등 (1989)의 방법에 따라 RAW264.7 세포에 대한 세포독성을 MTT법을 이용하여 측정하였다.
RAW264.7 세포주에 운목향 (Aucklandia lappa Decne) 70% 에탄올 추출물 (AL)을 3.125 - 50㎍/㎖의 농도로 처리 후 세포 생존율을 측정하였다. Fig. 1에서 AL은 저농도에서 LPS (1㎍/㎖)로 유도된 RAW264.7 세포주에서 세포독성이 나타나지 않았다. 12.5㎍/㎖ 농도 이하는 거의 같거나 약간 증가하는 것으로 큰 영향이 없었으며, 25㎍/㎖ 이상 농도에서 부터는 유의적으로 세포독성이 있어 항염증 효과 관련 실험은 LPS로 유도된 RAW264.7 세포주에서 AL 추출물의 세포 독 성이 없는 12.5㎍/㎖ 이하의 농도 (Lee and Kim, 2015)로 진행하였다.
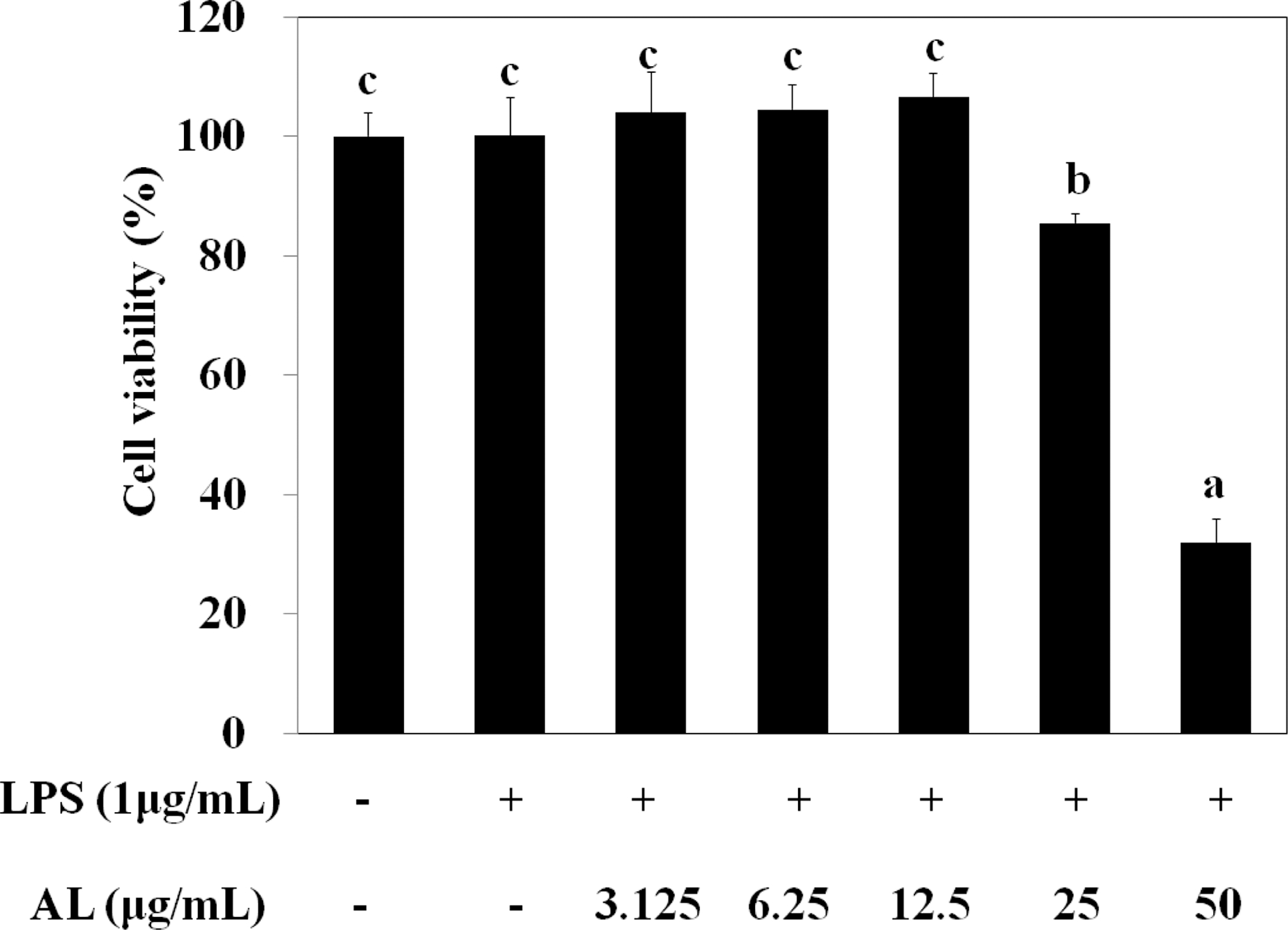
Effect of AL on the cell viability in cultured RAW264.7 cells.AL (3.125 - 50㎍/㎖) were treated with cultured RAW264.7 cells, and incubated for 24 hours. The cells assayed by MTT method. Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
2. NO 생성 억제에 미치는 효과
Endotoxin의 일종인 LPS를 대식세포주인 RAW264.7 세포 에 가하면 전염증성 사이토카인이 증가하여 NO, PGE2 등의 염증 매개물질의 분비가 증가한다 (Kim et al., 2014). 또한 생체 내의 free radical에 의한 세포 손상은 염증과 밀접한 관 계가 있다 (Jin et al., 2010).
LPS로 유도된 RAW264.7 cell에서 NO 생성은 AL추출물에 의해 생성억제가 되는지를 살펴보기 위하여 AL추출물을 3.125 - 12.5㎍/㎖로 처리한 후 NO 생성 억제 효과를 확인하 였다 (Fig. 2).
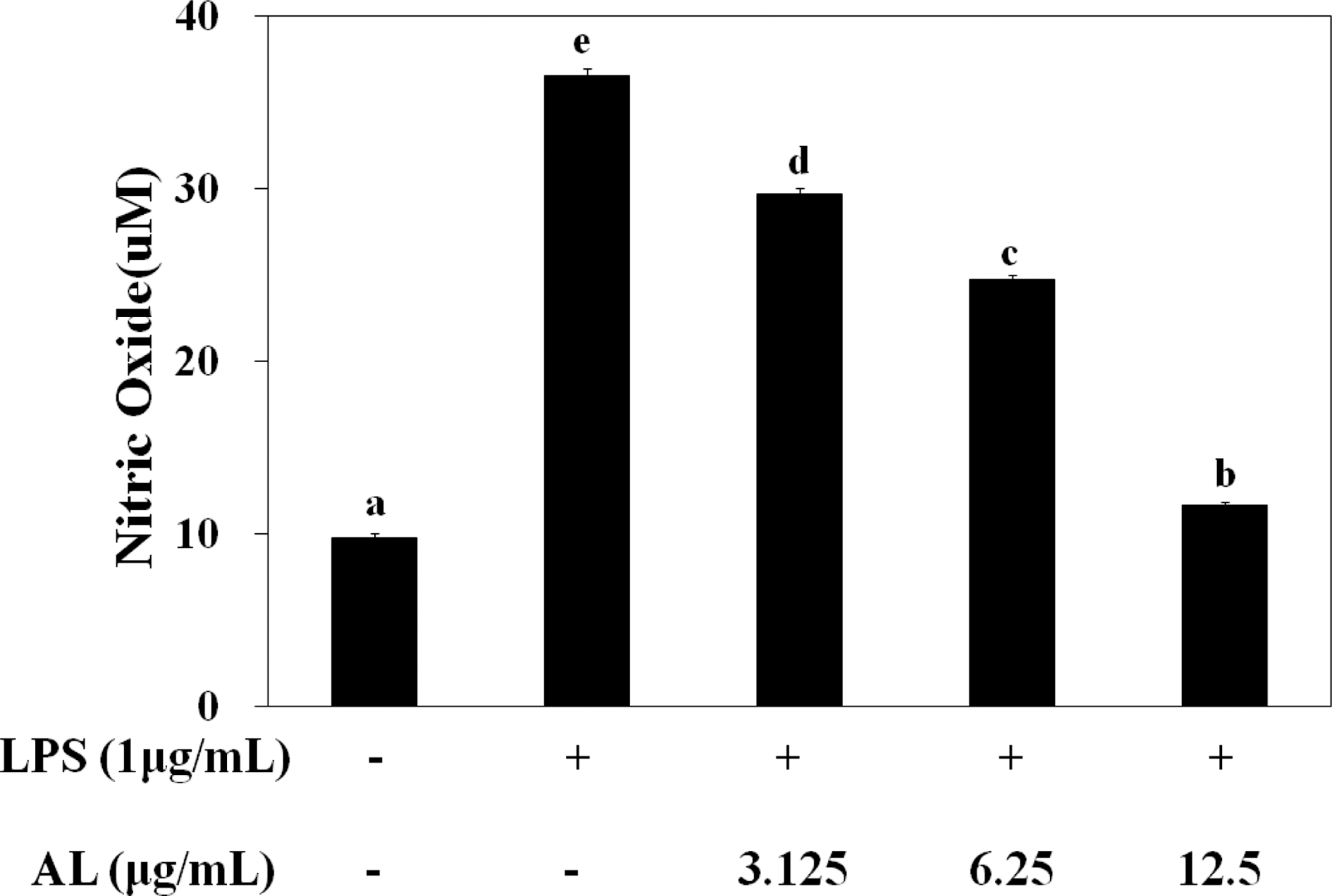
Effect of AL on the nitric oxide production in RAW264.7 cells.Cells were pre-incubated for 1 hour with AL at 3.125 - 12.5㎍/㎖ and then stimulated for 24 hours with 1㎍/㎖ of LPS. The 24 hours conditioned media were collected for NO assay. Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
LPS 처리되지 않은 정상군 (normal)에 비해 LPS 처리된 대조군 (control)에서 2.7 배 많은 NO를 생성하였다. AL 각 농도별로 29.7, 24.7, 11.6 μM의 NO 생성을 나타내어 NO 생성을 농도 의존적으로 억제하는 것을 확인하였다. Soe 등 (2009)은 NO가 감염부위의 활성화된 대식세포에서 면역조절, 혈관확장, 신경전달 등의 역할이 있다고 보고하였다. 따라서 AL에 의한 NO 생성 억제능은 항염증작용에 조절 역할을 할 수 있다고 사료된다.
3. 염증 관련 cytokines (iNOS, IL-1α, -1β 및 TNF-α) mRNA 발현 효과
Shih 등 (2010)은 염증 매개물질인 NO는 iNOS로부터 만들 어져 염증반응을 촉진하고, Ryu 등 (2003)은 LPS에 의해 자 극되어 활성화된 iNOS가 NO를 생성하여 염증반응 매개 역할 을 하는 것으로 보고하였다. 또한 LPS 자극에 활성화된 대식 세포는 염증 매개 물질인 IL-1α, -1β, -6, TNF-α 등의 전염 증성 사이토카인을 생산한다 (Horwood et al., 2006).
따라서 본 실험에서는 LPS로 자극된 대식세포주인 RAW264.7 세포에 AL을 가하여 염증관련 사이토카인 (iNOS, IL-1α,-1β 및 TNF-α)의 mRNA 발현을 확인하였다 (Fig. 3). iNOS mRNA 발현에서 LPS 자극을 시킨 대조군은 정상군에 비하여 발현량이 약 10 배 증가되었고 AL을 처리함에 따라 농도 의존적으로 발현이 억제되었다 [Fig. 3(A)].
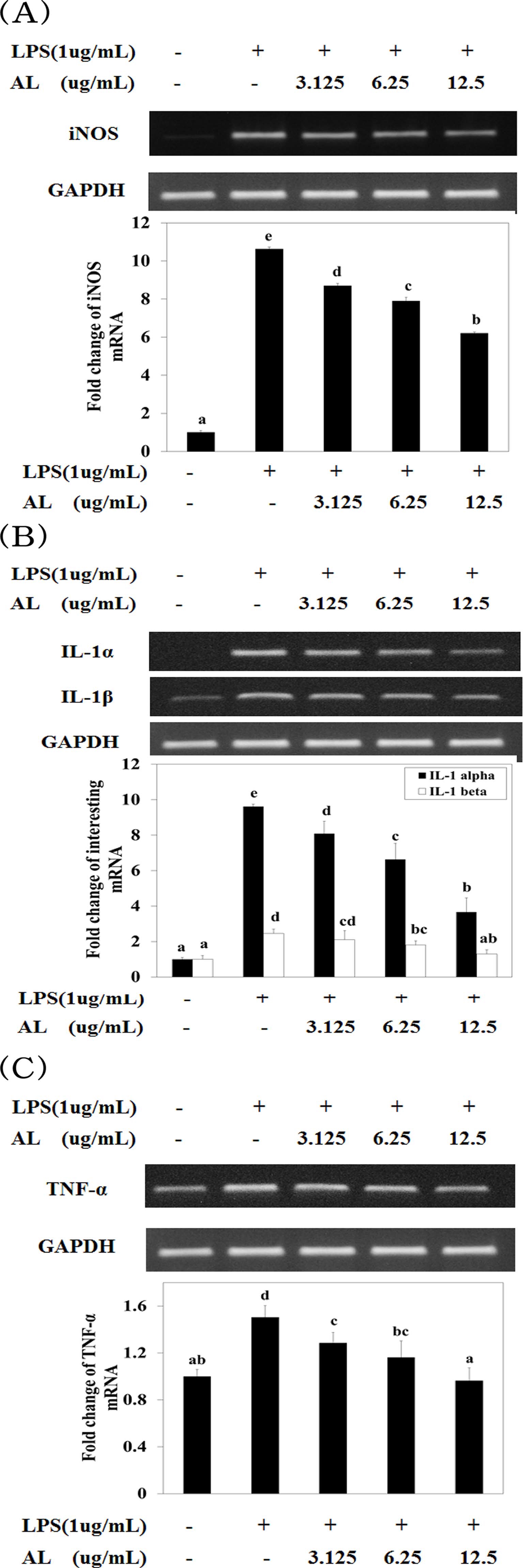
Effect of AL on iNOS (A), IL-1α,-1β (B), TNF-α (C) gene expression by LPS treated RAW264.7 cells.RAW264.7 cells were pre-incubated for 1 hour with AL at 3.125 - 12.5㎍/㎖ and then stimulated for 24 hours with 1㎍/㎖ of LPS. Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
IL-1α 및 IL-1β mRNA발현에서 IL-1α는 LPS 자극을 시킨 대조군에서 LPS 자극을 시키지 않은 정상군에 비하여 발현량 이 약 9.6 배 증가되었고 AL을 처리함에 따라 농도 의존적으 로 발현이 억제되었다. IL-1β에서 LPS 자극을 시킨 대조군은 LPS 자극을 시키지 않은 정상군에 비하여 발현량이 약 2.4 배 증가되었고 AL을 처리함에 따라 농도 의존적으로 발현이 억제되었다 [Fig. 3(B)].
TNF-α mRNA발현에서 LPS 자극을 시킨 대조군은 LPS 자 극을 시키지 않은 정상군에 비하여 발현량이 약 1.5 배 증가 되었고 AL을 처리함에 따라 농도 의존적으로 발현이 억제되 었다 [Fig. 3(C)].
4. 염증관련 cytokines (IL-1β, TNF-α) 분비 억제 효과
위의 염증 관련 cytokines (iNOS, IL-1α, -1β 및 TNF-α)의 mRNA 발현양상을 확인 (Fig. 3)한 후, 실제 생성된 IL-1β, TNF-α의 분비량을 ELISA (enzyme linked immunosorbent assay)법으로 측정한 결과는 Fig. 4와 같다.
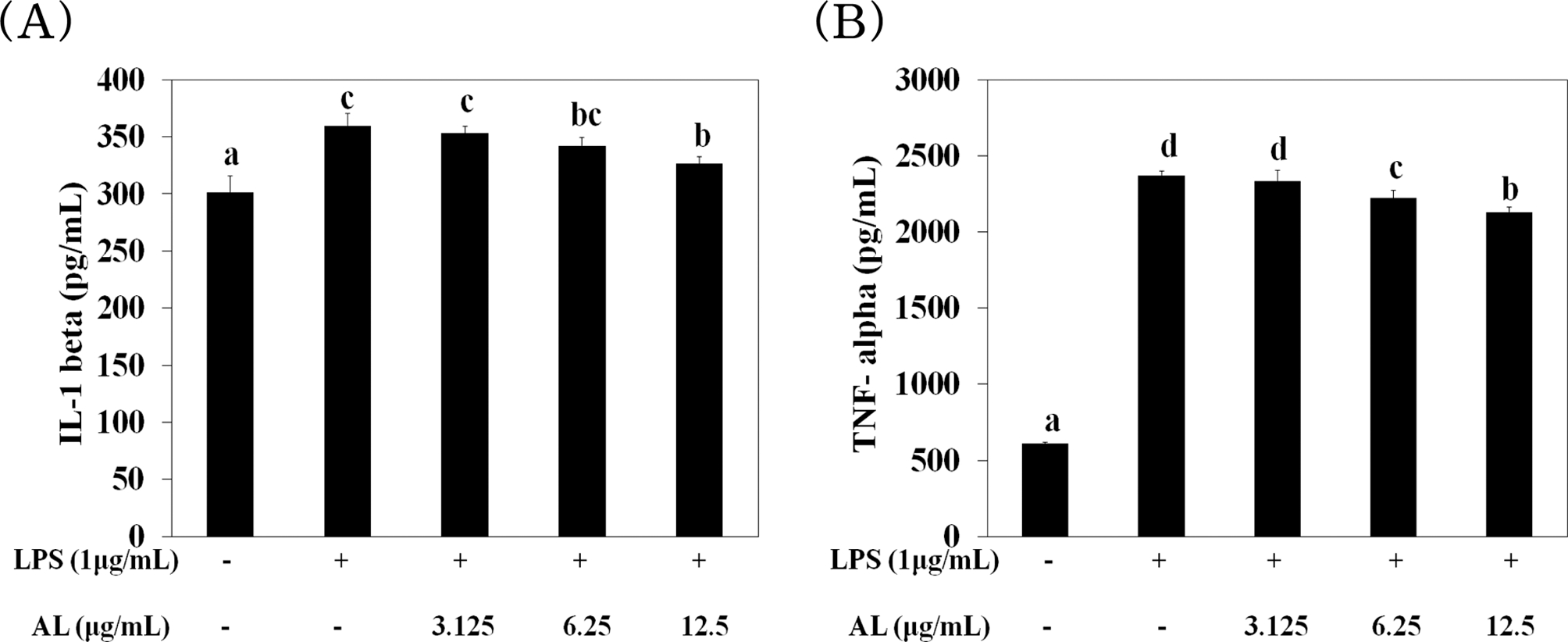
Effect of AL on the IL-1β (A), TNF-α (B) production by RAW264.7 cells.Cells were pre-incubated for 1 hour with AL at 3.125 - 12.5㎍/㎖ and then stimulated for 24 hours with 1㎍/㎖ of LPS. Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
LPS 처리된 RAW264.7 세포에서 AL에 의한 IL-1β, TNF- α 억제 효과를 확인한 결과 IL-1β의 경우 LPS 처리된 대조군 이 359.65 pg/㎖로 정상군에 비해 약 1.2 배 높은 IL-1β를 생성하였으며 AL 처리군 각각 352.89, 342.14, 326.51 pg/㎖ 로 대조군에 비해 유의적으로 감소하였다 [Fig. 4(A)].
TNF-α의 경우 LPS 처리된 대조군이 2,372.79 pg/㎖로 정상 군에 비해 TNF-α의 생성을 약 3.8 배 증가시켰으며 AL 처 리군에서는 각각 2,336.2, 2,222.12, 2,129.82 pg/㎖로 대조군 에 비해 농도 의존적으로 낮아짐을 확인하였다 [Fig. 4(B)].
따라서 염증의 자극원인 LPS는 대식세포와 같은 염증성 세 포의 활성을 증가시키고 활성화된 대식세포는 IL-6, IL-1β, TNF-α와 같은 염증성 사이토카인을 증가 시킨다 (Mukaida et al., 1996). TNF-α는 LPS 자극시의 주요 신호전달분자로서 염 증성 병변과정에서 증가되며 대식세포에서 분비되는 TNF-α는 만성 염증과 관련이 있다 (Delgado et al., 2003)는 보고와 같이 LPS 처리된 RAW264.7 세포에서의 증가된 사이토카인 (IL-1β, TNF-α)은 AL을 가하여 농도 의존적으로 억제시킴으 로써 항염증 작용에 관여하고 있음을 확인하였다.
5. 염증관련 단백질 (iNOS, COX-2, IκB-α) 발현 효과
염증반응이 일어나면 iNOS에 의해 NO를 생성하는 것처럼 COX-2가 활성화하면 PGE2 등과 같은 염증 매개물질을 생성 하며 (Seibert et al., 1994), COX-2는 대식세포와 같은 염증 세포에서 상처, 감염 등 외부의 자극에 의해 유도되며 종양 생성에 관여하고 염증 상태로 만드는 과정에서 중추적인 역할 을 한다 (Needleman and Isakson, 1997). 그러므로 COX-2 를 억제하는 물질은 부작용을 최소화 시킨 항염증 제제로 사 용될 수 있다 (Kurumbail et al., 2001). 이런 매개물질들은 사이토카인, 케모카인, 성장인자의 합성을 조절하는 transcription factor인 NF-κB가 활성을 띄게 하여 IκB-α가 proteasome에 의해 분해되어 핵 안으로 들어가 염증과 관련된 사이토카인 발현을 조절하여 염증을 유도하는 역할을 하는 것 으로 알려져 있다 (Lee et al., 2007).
염증반응 시 발현되는 단백질인 iNOS, COX-2, IκB-α 발현 을 웨스턴 블로팅하여 측정한 결과는 Fig. 5와 같다. iNOS에 서 LPS로 유도된 대조군은 정상군에 비하여 발현량이 약 3 배 증가되었고 AL을 처리함에 따라 농도 의존적으로 발현이 억제되는 것을 확인하였다 [Fig. 5(A)].
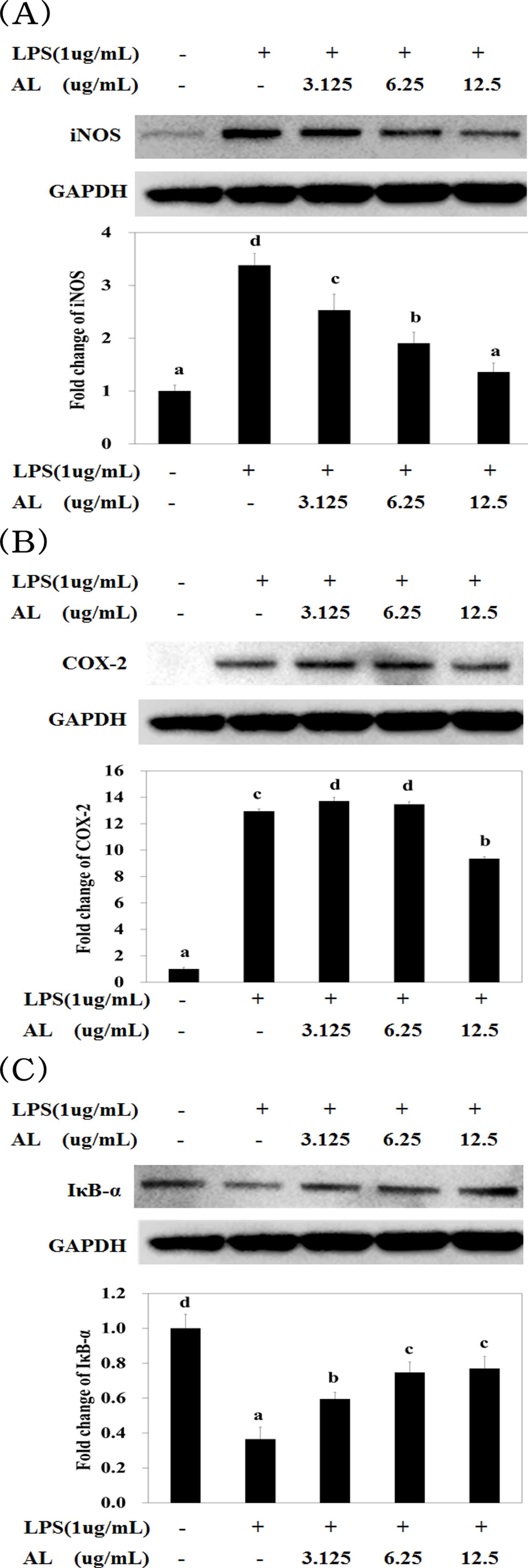
Effect of AL on the expression of iNOS (A), COX-2 (B), IκB-α (C) by LPS treated RAW264.7 cells.RAW264.7 cells were pre-incubated for 1 hour with AL at concentrations ranging from 3.125 to 12.5㎍/㎖ and then stimulated for 24 hours with 15㎍/㎖ of LPS. Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
COX-2에서 LPS로 유도된 대조군은 정상군에 비하여 발현 량이 약 12 배 증가되었으며, AL 6.25㎍/㎖ 까지는 대조군 과 큰 차이를 보이지 않았으나 12.5㎍/㎖에서 발현이 억제되 는 것을 확인하였다 [Fig. 5(B)]. 대식세포 (RAW264.7 세포 주) 생존율에 미치는 결과는 세포독성이 없는 12.5㎍/㎖ 농도 까지만 실험이 진행되어서 억제 효과가 농도 의존적이지 않고 특정농도에서만 억제 효과가 관찰되는 기작에 대해서는 구체 적인 검증이 필요할 것으로 사료된다.
IκB-α에서 LPS로 유도된 대조군은 정상군에 비해 약 3 배 정도 감소하였으며, AL을 처리함에 따라 농도 의존적으로 발 현이 증가되었음을 확인하였다 [Fig. 5(C)].
LPS는 NF-κB를 활성화하여 전염증성 사이토카인을 분비한 다. AL의 NF-κB 활성에 미치는 영향을 확인하기 위해 LPS 로 자극한 대식세포에 AL을 처리하고 IκB-α의 분해 정도를 실험하였다. 세포질에서 자극이 없는 상태에서는 NF-κB와 IκB 는 결합하여 존재한다. 활성화 시킬 수 있는 자극이 가해지면 IκB-α가 분해되고 NF-κB는 핵으로 이동하여 다양한 사이토카 인을 생성함으로써 NF-κB 활성은 IκB-α의 분해에 의존하게 된다 (Kim et al., 2007). Fig. 5(C)와 같이 AL은 LPS에 의 한 IκB-α의 분해를 억제 (즉 NF-κB의 활성을 억제)하여 COX-2 및 iNOS 발현을 억제함으로써 PGE2와 NO의 생성이 억제되어 항염증 효과를 나타낸다 (Kim et al., 2003)는 보고 와 매우 유사한 결과임을 확인하였다.
6. 대식세포주의 탐식활성에 미치는 효과
염증매개물질 및 염증관련 사이토카인의 과잉 생산은 과도 한 면역반응을 야기함으로써 면역질환 (Dinarello, 2018) 및 인체질환에 영향을 끼친다고 볼 수 있으므로 염증 매개분자를 억제하는 물질에 대한 연구가 진행되고 있다 (Calixo et al., 2004).
본 연구에서는 면역반응에 관련된 물질과 세포 중 대식세포 기원의 RAW264.7에 zymosan particle을 사용하여 대식세포가 식작용을 쉽게 할 수 있도록 옵소닌화 후 대식세포주 탐식능 에 대한 AL의 영향을 측정하였다.
대식세포주인 RAW264.7를 사용하여 zymosan입자를 옵소 닌화시켜 탐식능을 측정한 결과 zymosan만을 처리한 대조군 을 100%로 비교하였을 때 정상군이 54.81%로서 정상군에 비 해 유의적으로 증가하였다. AL 6.25㎍/㎖까지는 대조군과 큰 차이가 없었으며 12.5㎍/㎖처리군에서 121.08%로 대조군에 비해 탐식 활성이 유의적으로 증가하였다 (Fig. 6). 이로써 AL은 선천적 면역에 관여하는 대식세포의 탐식 활성을 농도 의존적으로 증가시키는 것을 확인하였다.
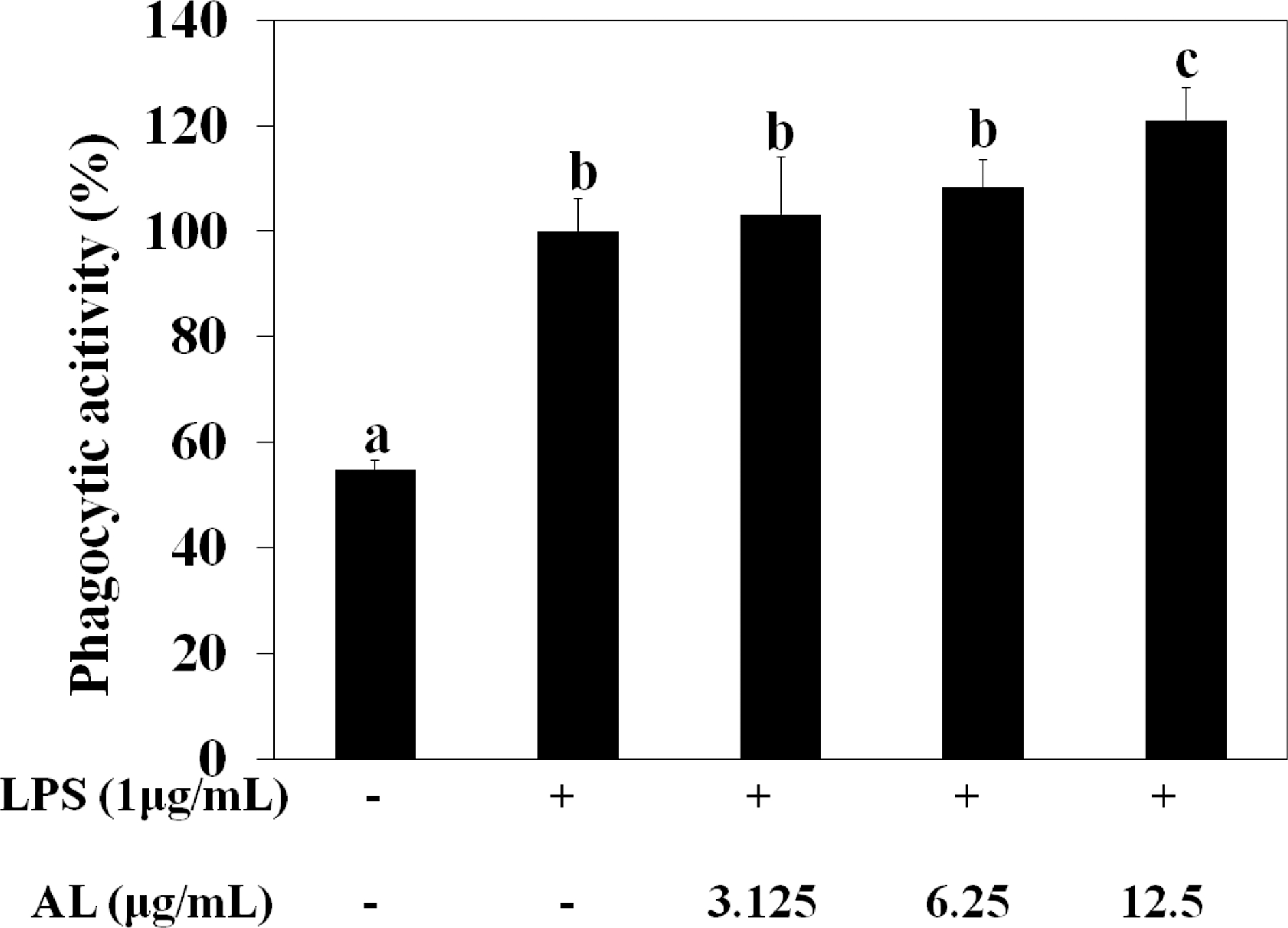
Effect of AL on the phagocytosis in RAW264.7 cells.AL (3.125 - 12.5 ㎍/㎖) were treated with cultured RAW264.7 cells, and incubated for 24 hours. Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the DMRT (p < 0.05).
7. 면역세포 아집단에 미치는 효과
탐식 활성능 측정에 이어 면역세포로 가장 중요한 역할을 하는 T림프구와 B림프구 활성에 대해 연구를 진행하였다. 체 액성 면역에는 B림프구가 항체를 분비하여 감염된 세균을 제 거하는 기능을 보여주며 세포성 면역은 흉선에서 유래한 T림 프구가 항원을 인지하여 림포카인을 분비하거나 직접 감염된 세포를 죽인다 (Leon and Ardavin, 2008)는 보고가 있다. 또 한, T림프구는 백혈구의 일종으로서 주로 면역이나 알레르기 와 관련이 있으며 세포성 면역을 담당하는 세포이다 (Clerici and Shearer, 1994).
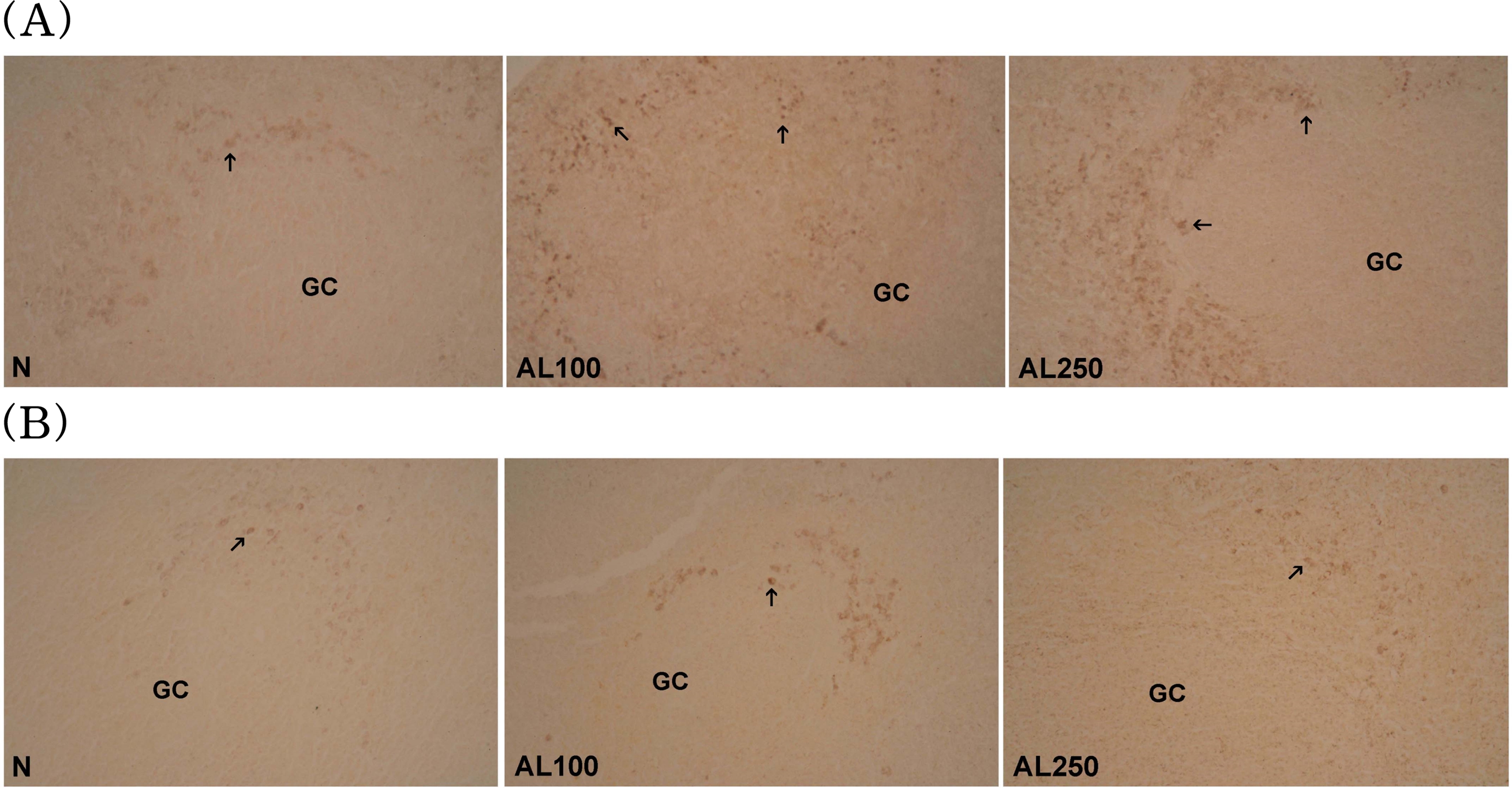
본 연구에서는 AL을 경구 투여하여 도움 T세포 (TH)와 세 포독성 T세포 (TC)에 관하여 연구를 진행하였다. 비장 및 흉 선의 면역세포 아집단 측정 결과, 비장의 B세포는 정상군 대 비 AL 투여군에서 감소하였으나, T세포는 정상군에 비해 AL 100, AL 250에서 약 10% 증가하였다. T세포의 TH세포에서 AL 100 군은 약 7%, AL 250 군은 약 12% 증가하였으며 TC세포에서 AL 100 군은 약 16%, AL 250 군은 약 33% 증가하였다. 또한 흉선의 TH세포에서 AL 투여군에서 증가하 였으나 유의성은 없었으며 TC세포에서 AL 100 군은 약 52%, AL 250 군은 약 81% 증가됨으로써 비장의 T세포와 흉선세포의 TC가 정상군에 비해 유의성 있게 증가되었음을 확 인할 수 있었다 (Table 1).

1. Effects of AL on the lymphocytes subpopulation change in mouse splenocytes and thymocytes in vivo.
이는 AL을 경구 투여한 마우스의 비장과 흉선의 면역에 관 여하는 T세포 중 TH, TC세포가 증가하여 면역 조절에 도움을 줄 수 있을 것으로 사료된다.
8. CD4+/CD8+ T 림프구의 면역조직화학적 변화
Flow cytometer로 면역 관련 세포수를 측정한 후 상응하는 면 역 관련 인자들의 형태학적 변화를 관찰하기 위하여 비장 T세 포에 CD4+, CD8+의 단클론 항체를 처리해서 면역조직화학적으 로 염색하여 확인하였다.
비장에서의 CD4+, CD8+ T세포의 염색반응은 정상군에 비 하여 AL 투여군에서 더 강한 면역염색 반응을 나타내었다. 이 결과로 보아 AL의 투여가 비장의 T림프구 (TH/TC cells)의 활 성을 증가시켜 비장 내에서 면역력 향상에 도움이 된 것으로 추측되며 (Fig. 7), 결론적으로 AL이 비장 및 흉선 세포의 T 림프구의 활성을 증가시킴으로써 면역증강 활성에 도움이 될 것이라고 사료된다.
고 찰
염증은 조직에 상처나 세균 감염 등의 물리적 작용이나 화 학적 자극이 일어날 때 그 손상부위를 재생하려는 신체 방어 기전 (Lee et al., 2000)이다. 그러나 지속적 또는 과도한 염 증반응은 점막손상을 촉진하고 통증, 발열, 관절염, 암 등 각 종 만성 질환의 원인이 되므로 염증 매개물질을 조절할 수 있 는 방법은 염증 질환 치료에 매우 중요하다 (Cheon et al., 2009).
Shih 등 (2010)은 염증 매개물질로 작용하는 NO 과생성은 L-arginine으로부터 iNOS에 의해 만들어지고 부종, 혈관 투과 성 등 염증 반응을 촉진시키며, 염증 매개물질 생합성을 촉진, 염증 심화, 세포 매개성 면역반응에 관여하는 것으로 알려져 있다. NO를 생성하는 효소인 NOS 중 염증반응 시 유도되어 장시간 다량의 NO를 생성하는 iNOS는 대식세포에서 LPS의 자극에 의해 활성을 띄게 되며 활성화된 iNOS가 NO를 생성 하여 염증반응에 매개 역할을 하게 된다 (Ryu et al., 2003).
NO와 iNOS의 발현 증가와 염증반응 및 관련 조직 손상에 대한 보고 (Tezuka et al., 2001)가 있으며, 이는 염증 매개물 질 및 염증 관련 사이토카인의 과잉 생산은 과도한 면역반응 을 야기함으로써 각종 인체질환에 영향을 미치므로 염증 매개 물질을 억제하는 연구가 활발히 진행되고 있다.
본 연구에서는 RAW264.7 세포주를 사용하여 AL의 염증성 매개물질 억제를 통한 항염증과 면역조절 효과를 평가하기 위 해 세포 생존율을 확인하여 독성이 없는 12.5㎍/㎖ 이하로 AL을 처리한 결과 농도 의존적으로 NO 생성을 억제하고 있 음을 확인하였다 (Fig. 2).
또한 유전자와 단백질 발현 실험에서 NO와 iNOS와의 관련 성은 LPS에 의해 증가된 iNOS가 AL처리에 의해 억제되었다. 이것은 LPS로 자극된 대식세포주에서 운목향 (Aucklandia lappa Decne) 의 주성분과의 복합체가 iNOS 발현 억제, NO 생성 억제 (Matsuda et al., 2003)를 한다는 보고와 같다.
LPS 자극에 활성화된 대식세포는 염증매개 물질인 IL-1α, -1β, -6, TNF-α 등의 pro-inflammatory cytokine을 생산하게 된다 (Horwood et al., 2006). IL-1의 경우는 염증반응 매개 하는 IL-1α와 IL-1β의 두 가지가 있는데, 소량에서는 T, B세 포를 활성화하며, 염증세포를 자극하지만 IL-1이 과량 만들어 질 때 호르몬으로 작용되어 발열, 급성기 반응 (acute phase response)등이 나타나고, TNF-α는 주로 급성염증반응에 관여 하며, 면역세포를 조절하고 LPS 반응의 주요 매개체로서 염 증성 병변과정에서는 발현이 증가되는데 대식세포에서 분비되 는 TNF-α는 만성염증에도 관련이 있다 (Delgado et al., 2003).
RAW264.7 세포에서의 mRNA 발현 양상을 측정한 결과 IL-1α, IL-1β, TNF-α는 AL을 처리함에 따라 농도 의존적으로 억제되었으며, ELISA법으로 확인 결과 AL은 RAW264.7에서 염증 매개물질인 IL-1β와 TNF-α를 모두 억제하여 항염증에 관여하는 것으로 확인하였다 (Fig. 3, 4). 이 결과는 Pae 등 (2007)의 운목향 주성분 중 하나인 costunolide가 heme oxygenase-1로 자극된 RAW264.7에서 TNF-α와 IL-6 생성을 억제한다는 보고와 유사하였다.
COX는 arachidonic acid를 prostaglandin (PG)으로 전환하 는 효소로서 COX-1과 COX-2로 나뉜다. Seibert 등 (1994)은 COX-2가 염증 매개물질인 PGE2 생성에 관여하는 물질로 대 식세포와 같은 염증세포에서 상처, 감염 등 외부의 자극에 의 해 유도되며 PG합성을 증가시켜 종양의 세포사멸을 억제하고 종양생성에 관여하며 염증상태로 만드는 과정에서 중추적인 역할을 한다고 한다. 그러므로 COX-2를 억제하는 물질은 부 작용을 최소화시킨 항염증제로 사용될 수 있다 (Kurumbail et al., 2001). NF-κB는 염증반응, 면역체계 조절, 세포사, 세포증 식 등에 관여하는 단백질군으로 사이토카인, 케모카인, 접합분 자, 유도효소 등에 의해 조절되며 체내 거의 모든 생리반응에 연관된다 (Yamamoto and Gaynor, 2004).
NF-κB의 종류는 p50, p52, RelA (p65), RelB, c-Rel, v- Rel로, 이합체화 (dimerization), IκB (inhibitor of NF-κB)와 의 상호작용 등의 기능을 수행한다 (Yamamoto and Gaynor, 2004). 염증반응에서의 NF-κB는 p50과 p65로 구성되어 전사 인자로서 핵 안으로 들어가 iNOS, COX-2 등의 염증관련 매 개물질 및 염증관련 cytokine을 합성한다 (Majdalawieh and Ro, 2010). NF-κB 단백 이합체는 세포질 내에서 NF-κB 활 성화를 억제하는 inhibitor NF-κB (IκB-α) 단백과 결합하여 비활성 상태로 존재하게 되며, NF-κB 단백에 존재하는 RHD 에 의해 NF-κB와 IκB의 결합이 일어남으로써 NF-κB의 작용 이 억제된다 (Majdalawieh and Ro, 2010). 그러나 LPS 등을 처리하면 IκB kinase (IKK)에 의해 IκB가 인산화 되어 분해 가 되며 IκB-α와 분리된 NF-κB는 핵 내로 이동하게 되고, 특정 gene의 IκB site에 결합하여 전사인자로서 작용하게 된 다 (Mercurio et al., 1993).
본 연구에서 LPS처리에 의해 증가된 COX-2 발현이 AL에 의해 감소되었으며, IκB-α는 LPS로 감소된 대조군에 비해 AL 처리에 따라 농도 의존적으로 증가하여 정상으로 회복됨 을 확인하였다 [Fig. 5(C)]. 이 결과는 AL을 농도별로 처리하 여 IκB-α가 NF-κB와 결합하여 전사인자인 NF-κB의 핵내로의 이동을 억제하기 위해 COX-2와 iNOS 발현을 억제함으로써 PGE2와 NO의 생성을 억제하여 항염증 효과를 나타낸다는 결 과와 (Kim et al., 2003) Zheng 등 (2016)의 보고한 바와 같이 costunolide과 dehydrocostuslactone은 에탄올로 유발된 위궤양에서 COX-2, NF-κB, TNF-α 등의 염증매개인자를 억 제 조절한다는 결과와 유사하였다.
면역의 정의는 생체 내부 환경이 외부인자인 항원에 대해 방어하는 현상으로 체액성 면역은 B림프구가 항체를 분비하 여 감염된 세균을 제거하는 기능을 보여주며 세포성 면역은 흉선에서 유래한 T림프구가 항원을 인지하여 림포카인을 분 비하거나 직접 감염된 세포를 살해한다 (Leon and Ardavin, 2008). 또한 대식세포를 활성화시켜 식작용을 돕기도 한다. 따 라서 면역조절 효과를 살펴보기 위해 대식세포 탐식능, 비장 및 흉선세포의 아집단 변화, 비장 조직 내 CD4, CD8의 면역 조직화학염색을 수행하였다. 식작용이란 대식세포체가 이물 혹 은 박테리아 등을 자기 체내에 받아들여서 이것을 분해, 무해 화하는 작용을 말한다.
본 실험에서는 zymosan particle을 혈청을 사용하여 대식세 포가 식작용을 쉽게 할 수 있도록 옵소닌화 후 대식세포 탐식 능을 측정하였다. zymosan particle을 처리한 대조군에 비해 AL 처리군에서 농도 의존적으로 증가하였으며 대식세포가 AL 을 처리함에 따라 강한 탐식능을 보여 자기방어를 하는 것을 확인 할 수 있었다 (Fig. 6). 이는 Choi 등 (2002) 보고에서 운목향 주성분 중 하나인 costunolide가 HL-60 cells에서 분화 를 유도할 때 탐식작용과도 관련 있다는 결과와 유사하였다.
세포 면역에서 주된 역할을 하는 T세포 중 TH세포와 TC세 포에 관하여 연구를 진행하였다. 이들은 세포 표면에 있는 단 백질 분자에 의해 TH세포 (CD4+), TC세포 (CD8+)로 구분되 는데, TH세포는 B세포가 분화하여 항원-항체 반응을 원활히 할 수 있게 도와주고 B세포의 작용을 촉진하는 세포이며, TC 세포는 인체에 해로운 물질들을 직접 제거하고 체내의 암세포 도 제거하는 역할을 한다 (Miceli and Parnes, 1993).
따라서 비장 및 흉선 림프구의 아집단 측정에서 비장의 T세 포는 높은 농도를 투여함에 따라 증가하는 경향을 보였으며, TH에서보다는 TC에서 높아지는 것을 확인 할 수 있었다. 흉선 의 T세포 측정 결과 역시 TH, TC 모두 높아졌으나 TH보다는 TC에서 더 높아졌음을 확인 할 수 있었다 (Table 1). 비장의 T세포에 CD4, CD8의 면역조직화학염색 결과 AL투여군이 정 상군 대비 CD4, CD8에 면역반응을 나타내어 모두 강하게 염 색되어 비장세포의 T림프구의 활성을 증가시킴으로써 면역조 절 효과를 보인다 (Fig. 7).
따라서 운목향 추출물이 일부 염증 매개물질을 억제하여 항 염증 효과를 나타내어 염증성 질환의 치료에 영향을 줄 수 있 을 것으로 판단되며 인체의 면역조절 활성에도 효과가 있을 것 으로 추정되나 특정 염증성질환 및 면역조절 활성의 세밀한 기 전에 대해서는 향후 더 많은 연구가 필요할 것으로 사료된다.
References
-
D.O. Adams, T.A. Hamilton, The cell biology of macrophage activation., Annu. Rev. Immunol, (1984), 2, p283-318.
[https://doi.org/10.1146/annurev.immunol.2.1.283]

- P.D. Admas, Regulation of the retinoblastoma tumor suppressor protein by cyclin/cdks., Biochim. Biophys. Acta, (2001), 1471, p123-133.
-
C. Bocca, L. Gabriel, F. Bozzo, A. Miglietta, A sesquiterpene lactone, costunolide, interacts with microtubule protein and inhibits the growth of MCF-7 cells., Chem. Biol. Interact, (2004), 147, p79-86.
[https://doi.org/10.1016/j.cbi.2003.10.008]

-
M.M. Bradford, A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding., Anal. Biochem, (1976), 72, p248-254.
[https://doi.org/10.1006/abio.1976.9999]

- J.B. Calixto, M.M. Campos, M.F. Otuki, A.R.S. Santos, Anti-inflammatory compounds of plant origin. Part II: Modulation of pro-inflammatory cytokines, chemokines and adhesion molecules., Planta Med, (2004), 70, p93-103.
-
C.Y. Chao, S.L. Yeh, M.T. Lin, W.J. Chen, Effects of parenteral infusion with fish-oil or safflower-oil emulsion on hepatic lipids, plasma amino acids, and inflammatory mediators in septic rats., Nutrition, (2000), 16, p284-288.
[https://doi.org/10.1016/s0899-9007(99)00299-3]

- M.S. Cheon, T.S. Yoon, G. Choi, S.J. Kim, A.Y. Lee, B.C. Moon, B.K. Choo, H.K. Kim, Comparative study of extracts from Rhubarb on inflammatory activity in RAW264.7 cells., Hanguk Yakyong Changmul Hakhoe Chi, (2009), 17, p109-114.
-
J.H. Choi, B.R. Seo, S.H. Seo, K.T. Lee, J.H. Park, H.J. Park, J.W. Choi, Y. Itoh, K.I. Miyamoto, Costunolide induces differentiation of human leukemia HL-60 cells., Arch. Pharm. Res, (2002), 25, p480-484.
[https://doi.org/10.1007/bf02976606]

-
M. Clerici, G.M. Shearer, The Th1-Th2 hypothesis of HIV infection: New insights., Immunol. Today, (1994), 15, p575-581.
[https://doi.org/10.1016/0167-5699(94)90220-8]

-
A.V. Delgado, A.T. Mcmanus, J.P. Chambers, Production of tumor necrosis factor-alpha, interleukin 1-beta, interleukin 2, and interleukin 6 by rat leukocyte subpopulations after exposure to substance P., Neuropeptides, (2003), 37, p355-361.
[https://doi.org/10.1016/j.npep.2003.09.005]

-
C.A. Dinarello, Overview of the IL-1 family in innate inflammation and acquired immunity., Immunol. Rev, (2018), 281, p8-27.
[https://doi.org/10.1111/imr.12621]

- E. Enavall, P. Perlmann, Enzyme-linked immunosorbent assay, Elisa.3: Quantitation of specific antibodies of enzymelabelled anti-immunoglobulin in antigen-coated tubes., J. Immunol, (1972), 109, p129-135.
-
M.B. Hansen, S.E. Nielsen, K. Berg, Re-examination and further development of a precise and rapid dye method for measuring cell growth/cell kill., J. Immunol. Methods, (1989), 119, p203-210.
[https://doi.org/10.1016/0022-1759(89)90397-9]

-
S.R. Holdsworth, A.R. Kitching, P.G. Tipping, Th1 and Th2 T helper cell subsets affect patterns of injury and outcomes in glomerulonephritis., Kidney Int, (1999), 55, p1198-1216.
[https://doi.org/10.1046/j.1523-1755.1999.00369.x]

-
N.J. Horwood, T.H. Page, J.P. Mcdaid, C.D. Palmer, J. Campbell, T. Mahon, F.M. Brennan, D. Webster, B.M.J. Foxwell, Bruton’s tyrosine kinase is required for TLR2 and TLR4-induced TNF, but not IL-6, production., J. Immunol, (2006), 176, p3635-3641.
[https://doi.org/10.4049/jimmunol.176.6.3635]

-
J.H. Jang, H.K. Jung, J.H. Ko, M.O. Sim, K.W. Woo, T.M. Kim, K.H. Lee, B.K. Ahn, H.W. Cho, J.H. Cho, W.S. Jung, Anti-inflammatory effect of Sedum takesimense Nakai water extract in RAW264.7 Cells., Hanguk Yakyong Changmul Hakhoe Chi, (2016), 24, p228-236.
[https://doi.org/10.7783/kjmcs.2016.24.3.228]

- Y.J. Jeon, H.S. Lee, S.W. Yeon, J.H. Ko, K.M. An, S.W. Yu, J.H. Kang, B.Y. Hwang, T.Y. Kim, Inhibitory effects of dehydrocostuslactone isolated from Saussureae radix on CDK2 activity., Korean J. Pharmacogn, (2005), 36, p97-101.
-
J.H. Jin, J.S. Kim, S.S. Kang, K.H. Son, H.W. Chang, H.P. Kim, Anti-inflammatory and anti-arthritic activity of total flavonoids of the roots of Sophora flavescens., J. Ethnopharmacol, (2010), 127, p589-595.
[https://doi.org/10.1016/j.jep.2009.12.020]

- S.S. Kang, J.S. Kim, H.J. Chi, S.Y. Chang, K.W. Ha, Isolation and quantitative determination of costunolide from Saussurea root., Korean J. Pharmacogn, (1999), 30, p48-53.
-
B. Kim, J.I. Kim, H.R. Kim, D.S. Byun, Antiinflammatory effect of an ethyl acetate fraction from Myagropsis yendoi on lipopolysaccharides-stimulated RAW264.7 cells., Korean Journal of Fisheries and Aquatic Science, (2014), 47, p527-536.
[https://doi.org/10.5657/kfas.2014.0527]

- C.S. Kim, T. Kawada, B.S. Kim, I.S. Han, S.Y. Choe, T. Kurata, R. Yu, Capsaicin exhibits anti-inflammatory property by inhibiting II B-I degradation in LPS-stimulated peritoneal macrophages., Cell. Signal, (2003), 15, p299-306.
- D.Y. Kim, S.W. Jeong, H.C. Moon, S.J. Park, Water extract of flowers of magnolia denudata inhibits LPS-induced nitric oxide and pro-inflammatory cytokines production in murine peritoneal macrophage by inhibiting NF-I B activation., Dongui Saengli Byeongli Haghoeji, (2007), 21, p916-920.
-
R.G. Kurumbail, J.R. Kiefer, L.J. Marnett, Cyclooxygenase enzymes: Catalysis and inhibition., Curr. Opin. Struct. Biol, (2001), 11, p752-760.
[https://doi.org/10.1016/s0959-440x(01)00277-9]

-
S.G. Lee, M.M. Kim, Anti-inflammatory effect of scopoletin in RAW264.7 macrophages., J. Life Sci, (2015), 25, p1377-1383.
[https://doi.org/10.5352/jls.2015.25.12.1377]

- T.H. Lee, H.B. Kwak, H.H. Kim, Z.H. Lee, D.K. Chung, N.I. Baek, J. Kim, Methanol extracts of Stewartia koreana inhibit cyclooxygenase-2(COX-2) and inducible nitric oxide synthase(iNOS) gene expression by blocking NF-I B transactivation in LPS-activated RAW264.7 cells., Molecules and Cells, (2007), 23, p398-404.
- B. Leon, C. Ardavin, Monocyte-derived dendritic cells in innate and adaptive immunity., Immunol. Cell Biol, (2008), 86, p320-324.
-
D.R. Lucey, M. Clerici, G.M. Shearer, Type 1 and type 2 cytokine dysregulation in human infectious, neoplastic, and inflammatory diseases., Clin. Microbiol. Rev, (1996), 9, p532-562.
[https://doi.org/10.1128/cmr.9.4.532]

- A Majdalawieh, HS Ro, Regulation of IκBα Function and NF-κB signaling: AEBP1 is a novel proinflammatory mediator in macrophages., Mediators Inflammation, (2010).
- H. Matsuda, I. Toguchida, K. Ninomiya, T. Kageura, T. Morikawa, M. Yoshikawa, Effects of sesquiterpenes and amino acid-sesquiterpene conjugates from the roots of Saussurea lappa on inducible nitric oxide synthesis and heat shock protein in lipopolysaccharide activated macrophages., Bioorg. Med. Chem, (2003), 11, p709-715.
- F. Mercurio, J.A. Didonato, C. Rosette, M. Karin, p105 and p98 precursor proteins play an active role in NF-I B-mediated signal transduction., Genes Dev, (1993), 7, p705-718.
- M.C. Miceli, J.R. Parnes, The role of CD4 and CD8 in T cell activation and differentiation., Adv. Immunol, (1993), 53, p59-122.
- N. Mukaida, Y. Ishikawa, N. Lkeda, N. Fujioka, S. Watanabe, K. Kuno, K. Matsushima, Novel insight into molecular mechanism of endotoxin shock: Biochemical analysisof LPS receptor signaling in a cell-free system targeting NF-I B and regulation of cytokine production/action through I 2 integrin in vivo., J. Leukoc. Biol, (1996), 59, p145-151.
- P. Needleman, P.C. Isakson, The discovery and function of COX-2., J. Rheumatol. Suppl, (1997), 49, p6-8.
-
H.O. Pae, G.S. Jeong, H.S. Kim, W.H. Woo, H.Y. Rhew, H.S. Kim, D.H. Sohn, Y.C. Kim, H.T. Chung, Costunolide inhibits production of tumor necrosis factor-I and interleukin-6 by inducing heme oxygenase-1 in RAW264.7 macrophages., Inflamm. Res, (2007), 56, p520-526.
[https://doi.org/10.1007/s00011-007-7015-4]

- S.N. Peirson, J.N. Butler, RNA extraction from mammalian tissues., Circadian Rhythms. Methods in Molecular Biology, E. Rosato, New York, NY, USA, Humana Press, (2007), p315-327.
-
J.H. Ryu, H. Ahn, J.Y. Kim, Y.K. Kim, Inhibitory activity of plant extracts on nitric oxide synthesis in LPSactivated macrophages., Phytother. Res, (2003), 17, p485-489.
[https://doi.org/10.1002/ptr.1180]

-
K. Seibert, Y. Zhang, K. Leahy, S. Hauser, J. Masferrer, W. Perkins, L. Lee, P. Isakson, Pharmacological and biochemical demonstration of the role of cyclooxygenase 2 in inflammation and pain., Proc. Natl. Acad. Sci. USA, (1994), 91, p12013-12017.
[https://doi.org/10.1073/pnas.91.25.12013]

-
M.F. Shih, Y.D. Cheng, C.R. Shen, J.Y. Cherng, A molecular pharmacology study into the anti-inflammatory actions of Euphorbia hirta L. on the LPS-induced RAW264.7 cells through selective iNOS protein inhibition., J. Nat. Med, (2010), 64, p330-335.
[https://doi.org/10.1007/s11418-010-0417-6]

- K. Shortman, H. Backson, The differentiation of T lymphocytes. Part I: Proliferation kinetics and interrelationships of subpopulations of mouse thymus cells., Cell. Immunol, (1974), 12, p230-246.
- J.S. Soe, T.H. Lee, S.M. Lee, S.E. Lee, N.S. Seong, J. Kim, Inhibitory effects of methanolic extracts of medicinal plants on nitric oxide production in activated macrophage RAW264.7 cells., Hanguk Yakyong Changmul Hakhoe Chi, (2009), 17, p173-178.
-
Y. Tezuka, S. Irikawa, T. Kaneko, A.H. Banskota, T. Nagaoka, Q. Xiong, K. Hase, S. Kadota, Screening of Chinese herbal drug extracts for inhibitory activity on nitric oxide production and identification of an active compound ofZanthoxylum bugeanum., J. Ethnopharmacol, (2001), 77, p209-217.
[https://doi.org/10.1016/s0378-8741(01)00300-2]

- Y. Yamamoto, R.B. Gaynor, II B kinases: Key regulators of the NF-I B pathway., Trends Biochem. Sci, (2004), 29, p72-79.
- S.T. Yee, Y.R. Jeong, M.H. Ha, S.H. Kim, M.W. Byun, S.K. Jo, Induction of nitric oxide and TNF-I by herbal plant extract in mouse macrophages., Journal of Korean Society of Food Science and Nutrition, (2000), 29, p342-348.
-
H. Zheng, Y. Chen, J. Zhang, L. Wang, Z. Jin, H. Huang, S. Man, W. Gao, Evaluation of protective effects of costunolide and dehydrocostuslactone on ethanol-induced gastric ulcer in mice based on multi-pathway regulation., Chem. Biol. Interact, (2016), 250, p68-77.
[https://doi.org/10.1016/j.cbi.2016.03.003]