
동아시아 잇꽃 유전자원의 지방조성 및 항산화 분석
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
To obtain useful safflower resources for breeding and research of functional materials, the present study was conducted to determine fatty acid compositions and antioxidant activities of 281 safflower accessions collected from East Asia including South Korea..
Lipid contents and fatty acids compositions were evaluated using soxhlet extraction and gas chromatography, respectively. A antioxidant activities were analyzed using a spectrophotometer. The evaluation range of safflower accessions showed very wide variation. In terms of lipid contents, the China accessions were higher than the collection from other regions, whereas antioxidant activities did not differ among regions. The result of the principal component analysis showed that the first and second principal component cumulatively explained 90.6% of the total variation. In clustering the safflower accessions, the tree showed four major clades. Group II (16 accessions) was high in lipid content, oleic acid and linoleic acid, whereas group III (50 accessions) exhibited higher antioxidant activities than other groups.
It was recommended that the China collections be utilized as a useful resource for research on functional oil materials. These results provided valuable information for safflower breeders and researchers of functional food.
Keywords:
Carthamus tinctorius L., Antioxidant Activity, Fatty Acid, Lipid Content서 언
활성산소는 체내에서 염증, 피부노화, 암들을 유발하는 것으 로 인간의 노화와 질병발생의 원인이 된다 (Choi et al., 2016). 항산화 기능은 유해한 활성산소의 발생을 저해하거나 중화시켜 건강한 삶을 영위할 수 있는 역할을 한다. 항산화제 로 이용되어지는 대표적인 합성 항산화제로는 butylated hydroxyl-toluene (BHT), butylated hydroxyl anisole (BHA), 2-tert-butylhydroxyquinone (TBHQ) 등이 있다. 그러나 이와 같은 소재는 높은 항산화 효능은 있으나 고용량으로 장기간 사용 시 지질대사의 불균형과 암을 유발할 수 있다. 이를 보 완할 수 있는 천연물 항산화물질을 찾기 위하여 수종의 약용 식물에 대한 활성물질을 탐색하여 항산화활성이 높은 식물자 원을 보고하거나, 식품첨가제 등 다양한 소재로서 이용 가능 한 천연물 유래 항산화 성분에 대한 연구가 활발히 진행되고 있다 (Song et al., 2000; Choi and Lee, 2014; Song and Lee, 2015; Seo et al., 2016).
Farag 등 (1989)은 천연 향신료 정유성분을 추출하여 caraway > sage > cumin > rosemary > thyme > clove 순으로 항 산화 효능이 있음을 보고하였다. 리놀레산은 불포화지방산의 하나로, 인체 내에서 합성이 불가능하여 음식물을 통하여 보 충되어야만 하는 필수지방산이다.
불포화지방산은 면역에 관여하거나 혈액순환을 원활히 하는 것에 이르기까지 인간의 삶에 매우 중요한 영향을 미치며, 생 선, 아마종자, 콩기름, 카놀라유, 치아종자, 호박종자, 해바라기 종자, 면화종자 오일, 잎채소 등의 식품에 함유되어 있다 (Kim et al., 2010).
잇꽃 (Carthamus tinctorius L.)은 국화과에 속하는 일년생 초본으로 꽃잎을 ‘홍화’, 종자를 ‘홍화자’로 하여 생약으로 사 용하고 있다. 꽃에는 safflower yellow와 carthamin 등 색소물 질을 함유하고 있으며, 종자에는 여러 가지 지방산이 함유되 어 있다 (Kim et al., 1996). 일반적으로 재배되는 종은 C. tinctorius이며 야생종으로는 C. persicus (syn. C. lavescens), C. lanatus, C. oxyacanthus, C. palaestinus가 있고, 이들은 다양한 병충해의 저항성이나 내성을 가지고 있는 자원으로 알려져 있 다 (Kumar and Agrawal, 1989; Dajue and Mundel, 1996).
잇꽃종자 오일은 혈중 콜레스테롤 농도를 저하시키고, 동맥 경화 예방, 지방질 유도 인슐린 저항성 예방 효과 등이 있는 것으로 보고되어 건강기능성 소재로 관심받고 있으며 뿐만 아 니라 화장품 원료로서의 항산화 효과에 대한 연구결과도 다수 보고되어 있다 (Cox et al., 1995; Zhang et al., 1996; Espin et al., 2000; Prescha et al., 2014).
본 연구는 유용 지방성분 또는 천연항산화제로서 이용가치 가 높은 우수한 잇꽃 유전자원을 선발하고자 한국을 포함한 동아시아지역에서 수집한 잇꽃자원을 대상으로 종자의 지방조 성과 항산화 활성 평가를 하였으며, 그 결과를 공유하여 관련 연구의 기초자료로 제공하고자 하였다.
재료 및 방법
1 실험재료
동아시아 지역에서 수집된 잇꽃 (Carthamus tinctorius L.) 281 자원은 2015년 전북전주의 농업유전자원센터 시험포장에 서 증식하여 신선한 종자를 확보하였다 (Table 1).
잇꽃종자는 건조 및 마쇄하여, 지방조성 및 항산화 활성 실 험재료로 이용하였다. 항산화 활성실험을 위해 ASE 200 (Dionex, Sunnyvale, CA, USA)을 이용하여 75% 에탄올로 70 ℃, 1,500 압력에서 추출하였으며, Genevac HT-4X (Genevac Ltd., Ipswich, England)로 농축처리하였다.
2. 시약
지방조성 평가를 위한 헥산, 14% boron trifluoride-methanol (BF3-Methanol) 용액 및 항산화 활성 실험에 사용된 1,1- diphenyl-2-picryl-hydrazil (DPPH), L-ascorbic acid, 2,2'-azinobis (3-ethylbenzothiazoline-6-sulphonic acid) (ABTS), 6- hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox), Folin–Ciocalteu reagent, gallic acid 등은 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하였다.
3. 종자의 크기와 무게
잇꽃의 종자 길이와 폭은 캘리퍼스를 이용하여 ㎜단위로 실 측하였다. 종자무게 (천립중)는 실험용 저울을 이용하여 0.1 g 단위로 측정하였다.
4. 조지방 함량
조지방 함량을 측정하기 위하여 건조분쇄한 시료 1 g에 헥산 을 용매로 하여 SoxtecTM 2043 (FOSS Tecator AB, Hilleroed, Denmark)을 이용하여 분석하였다.
5. 지방산 조성
추출한 지방 50㎕를 튜브에 담고 0.5 N NaOH를 가한 후 80℃ 수욕상에서 10 분간 처리한 후, 14% BF3-methanol 용 액을 가하고 헥산과 water 용액을 넣는다. 처리한 용액을 원 심분리하여 상층액을 취한 후 황산나트륨 (Na2SO4)에 반응시 킨다. 다시 이를 여과시키고 상층액을 취하여 가스 크로마토 크래피 (QP2010Ultra, Shimadzu, Kyoto, Japan)를 이용하여 지방산 조성을 분석하였다.
6. DPPH 라디칼 소거능
DPPH 라디칼 소거능의 측정은 Piao 등 (2013) 방법을 이 용하였다. 농축기 (HT-4X, Genevac Ltd., Ipswich, England) 를 이용하여 75% 에탄올 잇꽃 추출물을 농축한 시료를 100 ppm으로 희석하여 DPPH 소거능 분석시료로 사용하였다.
희석액 100㎕와 75% EtOH 100㎕를 96 well plate의 각 각의 well에 분주하였고, 여기에 100% EtOH 150㎕와 150 μM DPPH를 150㎕을 혼합한 다음, 빛을 차단하여 30 분간 실온에서 반응시켰다. 반응시킨 후, ELISA reader (Epoch, BIO-TEK, Winooski, VT, USA)를 이용하여 517 ㎚ 에서 흡광도를 측정하였다. DPPH radical 소거능의 표준물질 은 L-ascorbic acid를 사용하였으며, 농도별 흡광도를 측정하여 표준검량식으로부터 당량을 계산하였다.
7. ABTS 양이온 소거능
ABTS 양이온 소거능의 측정은 Re 등 (1999)의 방법에 따 라 7 mM의 ABTS 용액에 potassium persulfate를 2.45 mM 을 용해시킨 다음, 12 시간 이상 냉장 보관하여 반응시킨 후 734㎚에서 0.7이 되도록 증류수로 조정한 ABTS 용액을 사 용하였다.
농축액을 500 ppm으로 희석하여 희석액 10㎕와 75% EtOH 10㎕를 96 well plate의 각각의 well에 분주하였으며, 여기에 75% EtOH 10㎕와 3 차 증류수 190㎕와 ABTS용 액을 190㎕씩 혼합한 다음, 빛을 차단하여 30 분간 실온에 서 반응시켰다.
반응시킨 후, ELISA reader (Epoch, BIO-TEK, Winooski, VT, USA)를 이용하여 734 ㎚에서 흡광도를 측정하였다. ABTS radical 소거능의 표준물질은 Trolox를 사용하였고 농도 별 흡광도를 측정하여, 표준검량식으로부터 당량을 계산하였다.
8. 총 polyphenol 함량 측정
총 polyphenol 함량은 Folin & Ciocalteu 방법을 변형하여 사용하였다 (Waterhouse, 2002). 잇꽃 농축액을 1,000 ppm로 희석하여 총 polyphenol 함량 측정의 분석시료로 이용하였다. 희석액 100㎕와 75% EtOH 100㎕를 96 well plate의 각각 의 well에 분주하였으며, 여기에 3 차 증류수 100㎕와 1 N Folin & Ciocalteu 시약 100㎕을 첨가하고 실온에서 3 분간 반응시켰다. 그 다음, 3 차 증류수 100㎕와 2% Na2CO3용액 100㎕를 추가로 첨가하여 30 분간 반응시킨 후, ELISA reader (Epoch, BIO-TEK, Winooski, VT, USA)를 사용하여 750㎚에서 흡광도를 측정하였다. 표준물질은 gallic acid를 사 용하였으며, 표준검량식으로부터 총 polyphenol 함량을 계산하 였다.
9. 통계처리
모든 실험의 결과는 평균 ±표준편차로 산출하였으며, 각 실 험치 간의 통계분석은 R Project (www.r-project.org, R i386 3.4.1, Vienna, Austria)를 이용하였으며, p < 0.05의 조건에서 값의 유의성을 인정하였다.
결 과
기능성 소재로 유용한 자원을 선발하고자 동아시아 4 개국 인 한국 (South Korea), 북한 (North Korea), 일본 및 중국 으로부터 수집한 281 자원의 잇꽃종자를 대상으로 크기와 천 립중, 지방성분과 항산화 활성평가를 실시하였다.
1. 종자의 크기와 무게
동아시아에서 수집된 잇꽃 (Carthamus tinctorius L.) 281 자원의 종자크기와 천립중은 Table 2와 같다. 종자길이와 폭 은 각각 5.8 - 8.5㎜, 3.4 - 5.5㎜로 분포하였으며, 평균은 각각 6.9㎜, 4.3㎜였다. 천립중의 경우, 평균 52.0 g였으며 27.0 - 83.2 g로 분포하였다.

Mean, standard deviation and range for seed characters, antioxidant activities and oil compositions of 281 safflower germplasm collected from East Asia.2
한국자원의 종자크기는 4.5㎜ × 6.5㎜이었으며 중국자원은 4.3㎜ × 6.9㎜, 일본자원은 4.2㎜ × 7.2㎜, 북한자원은 4.8㎜ × 7.0㎜의 크기였다. 국가별 종자의 길이와 폭에는 큰 차이가 없었으나, 중국 자원의 천립중이 30.7 - 83.2 g으로 변 이가 컸으며, 천립중 60 g이상인 자원은 전체자원 중 45 자원 으로 모두 중국자원들이었다.
2. 조지방 함량
조지방 함량의 평균은 22.1%였으며, 최소 12.5%, 최대 34.1%였다. 중국자원은 12.5 - 34.1%의 분포를 보였으며 평균 22.4%이었다. 한국자원은 15.0 - 23.3%, 평균 19.8%였다. 북 한자원은 17.6 - 25.9%, 평균 20.5%, 일본자원은 17.2 - 25.7%, 평균 20.9%였다. 한국과 북한을 합친 한반도 자원의 조지방 함량은 15.0 - 25.9%로 분포를 보였으며, 평균 19.9%를 함유하고 있었다. 조지방 함량이 30%이상 높은 자원은 9 자원 으로 전체자원의 3.2%였으며, 모두 중국자원이었다 (Table 2).
3. 지방산 조성
전체자원의 포화지방산 (palmitic와 stearic acid)과 불포화지 방산 (oleic, linoleic 및 linolenic acid)의 비율은 8.4%와 91.6%로 불포화지방산 함량이 높았다. 포화지방산의 평균함량 은 수집국가간의 차이는 거의 없었으며, 불포화지방산 중 oleic acid의 경우를 제외하고 linoleic acid와 linolenic acid의 경우 도 각 수집국가간의 평균값의 차이는 거의 없었다.
불포화지방산 중, 가장 함량이 높은 linoleic acid의 전체자 원의 평균은 78%였으며 43.6%- 82.0%의 분포로 변이가 컸다. 한국자원의 linoleic acid 평균은 79.6%였으며 76.4% - 81.4% 의 분포를 보였다. 전체자원 중 182 자원이 평균이상의 linoleic acid를 함유하는 자원이었으며, 한국 29 자원, 북한 5 자원, 일본 2 자원 및 중국 146 자원을 포함되었다.
Oleic acid의 경우, 전체자원 평균은 13.3%였으며 9.5% - 48.5%의 분포를 보였다. 중국자원의 평균함량은 13.3%였고, 평가자원 중 가장 높은 함량 (48.5%)을 가지는 자원이 포함되 어 있었다 (Table 2).
4. DPPH 라디컬 소거능
DPPH 라디컬 소거능을 평가한 결과, 전체자원 평균 4.6㎍·ASC·㎎−1의 활성을 가지고 있었으며, 중국자원에서 0.5 -14.3㎍·ASC·㎎−1로 변이가 컸고, 한국자원은 2.5 - 7.4㎍·ASC·㎎−1를 보였다 (Table 2). 동아시아 수집자원 중 DPPH 라디컬 소거능이 10㎍·ASC·㎎−1이상인 자원은 전체자 원 중 1.4%에 해당했으며 모두 중국자원이었다.
5. ABTS 활성
수집자원의 ABTS 활성은 전체 평균 72.2㎍·Trolox·㎎−1였 으며, 중국자원은 5.6 - 195.7㎍·Trolox·㎎−1로 변이가 컸고, 한 국자원은 44.0 - 109.7㎍·Trolox·㎎−1, 북한자원은 56.3 - 84.4 ㎍·Trolox·㎎−1로 활성을 보였고, 일본자원은 54.4 - 89.2 ㎍·Trolox·㎎−1로 분포하였다 (Table 2). ABTS 활성이 100 ㎍·Trolox·㎎−1이상 높은 자원은 25 자원 (8.9%) 였으며, 이중 한국수집 2 자원이 분포하였다. 또한, 20㎍·Trolox·㎎−1 이하 의 낮은 활성을 보인 자원은 4 자원 (1.4%) 은 모두 중국자 원이었다.
6. 총 polyphenol 함량
동아시아 수집자원의 총 polyphenol 함량은 평균 67.8㎍· GAE·㎎−1이었고, 전체자원은 21.0 - 197.0㎍·GAE·㎎−1의 범위 로 분포하였으며, 중국자원의 분포범위와 같았다. 한국 36.3 - 93.2㎍·GAE·㎎−1, 북한 60.6 - 100.5㎍·GAE·㎎−1, 일본 41.3 - 89.5㎍·GAE·㎎−1로 분포하였다 (Table 2). 전체자원 중 100㎍·GAE·㎎−1이상 높은 자원은 12 자원이었는데, 이중 북 한 1 자원이 포함되어 있었으며 나머지 11 자원은 중국자원들 이었다.
고 찰
동아시아 수집 잇꽃 (Carthamus tinctorius L.)종자의 천립 중은 27.0 - 83.2 g의 분포를 보였으며, 중국자원이 평균 53.7 g 으로 타국가 수집자원보다 높았으며, 천립중 변이폭도 컸다 (Table 2). 이는 중국의 경우, 넓은 국토의 다수 지역에서 잇 꽃이 재배되고 있어 수집자원 수가 많기 때문에 다양성이 높 은 것으로 추측된다.
한반도원산 잇꽃자원의 천립중은 27.0 - 56.1 g으로, Park (2003)이 보고한 잇꽃 백립중이 2.9 - 3.9 g인 것에 비해 종자무 게의 변이가 컸다. 종자의 무게차이가 생리학적 특성발현에 영 향을 미치는 요소이며 (Hoy and Gamble, 1987), Lim 등 (2012)은 종자무게가 무거운 잇꽃종자를 사용하여 재배할 경 우 작물의 발아 및 생육에 유리하나 유지생산에 있어서는 유 리한 형질이 아니라고 보고하였다. 본 연구의 결과에서, 종자 무게와 유지함량과는 정의상관을 보이고는 있으나 상관성이 높다고 해석하기는 어려우며, 선행연구와 유사한 결과로 사료 된다 (Table 3).

Pearson correlation coefficients for seed characters, total polyphenol, DPPH, ABTS and fatty acid compositions of 281 safflower germplasm of East Asia.
Carthamus 속 식물의 조지방 함량은 C. tinctorius가 29.2 - 34.0%, C. oxyacantha 20.0 - 30.8%, C. lanatus 15.3 - 20.8%의 범위로 함유하고 있다 (Mohammad et al., 2008). 본 연구의 동아시아 잇꽃자원 (C. tinctorius)의 경우, 조지방 함량은 전체적으로 12.5 - 34.1%였고, 이중 한반도원산 자원은 15.0 - 25.9%로 분포를 보였다 (Table 2). 일반적으로 잇꽃종자 는 6 - 8% palmitic acid, 2 - 3% stearic acid, 16 - 20% oleic acid, 71 - 75% linoleic acid로 조성되어 있다 (Velasco and Fernandez-Martinez, 2001). 지방산 조성은 식물성 오일 활용성을 결정하는 중요한 요소이며, 식물종에 따라 조성 변 이가 다양한 편이다.
잇꽃종자 오일은 식용 또는 산업용으로 이용이 증가함에 따 라 그 중요도도 높아지고 있다. 최근에는 고리놀레산 오일 또 는 고올레산 오일과 관련된 연구결과가 발표되고 있다. 고리 놀레산 오일의 경우는 다른 종류의 식물성 식이오일과 혼합하 여 영양소를 높이는데 이용되며, 고올레산 오일의 경우, 식물 성 연료의 이용성으로 연구되었으나, 새로운 고영양소 식이오 일 또는 가축의 사료, 식용색소, 약용 등 다양한 분야에서 그 가치가 증대되고 있다 (Liu et al., 2016).
동아시아 수집자원 중, IT300331 (중국)는 48.45%의 높은 oleic acid의 함량조성을 보였다. 이는 Sung 등 (2016), Knowles (1965) 및 Fernandez-Martinez 등 (1993)이 기보고 한 인도 및 파키스탄 수집자원들에 비해 함량이 높지 않았으 나, 기존에 알려져 있는 한반도에서 재배되고 있는 잇꽃의 oleic acid 함량조성보다 월등히 높았다. 한국재래종은 linoleic acid 함량이 높은 자원들이 대부분이기 때문에 IT300331와 같 은 자원은 고올레산 자원으로 국내 활용가능성이 높을 것으로 사료된다.
잇꽃종자는 기름을 짜고 남은 유박이나 불에 구운 것이라 해도 항산화 효능을 가지는 유용성분을 함유하고 있다는 것이 보고 (Choi et al., 2011) 되고 있고, 이들 항산화 성분은 N -feruloylserotonin이라는 것이 밝혀졌으며 기존에 항산화제로 많이 이용되었던 α-tocopherol과 비교에서도 높은 활성을 보여 새로운 천연항산화제로서의 가능성을 보였다 (Song et al., 2000).
본 연구의 동아시아 수집 잇꽃자원에서는 수집국가별 항산 화활성에 차이는 거의 없었으나, ABTS 활성 평가에서 중국자 원들이 5.6 - 195.7㎍·Trolox·㎎−1 로 변이가 컸다 (Table 2). 한반도원산 자원의 DPPH 소거능은 평균 4.4㎍·ASC·㎎−1 였 고, 2.5 - 7.4㎍·ASC·㎎−1 의 범위에 있었으며, ABTS 활성은 평균 71.2㎍·Trolox·㎎−1 이었고, 44.0 - 109.7㎍·Trolox·㎎−1 의 분포를 보였다. 총 polyphenol 함량은 평균 63.9㎍· GAE·㎎−1 이었고 36.3 - 100.5㎍·GAE·㎎−1로 분포하였다 (Table 2).
총 polyphenol 함량과 항산화 활성 간에 상관관계 있는 것 으로 보고하고 있으며 (Lee et al., 2005; Kim et al., 2010b; Choi et al., 2013), 본 연구에서도 이와 유사한 결과 를 얻을 수 있었다. 동아시아 수집 잇꽃자원의 평가항목별 상 호연관관계는 Fig. 1 및 Table 3과 같은 결과를 얻었다.
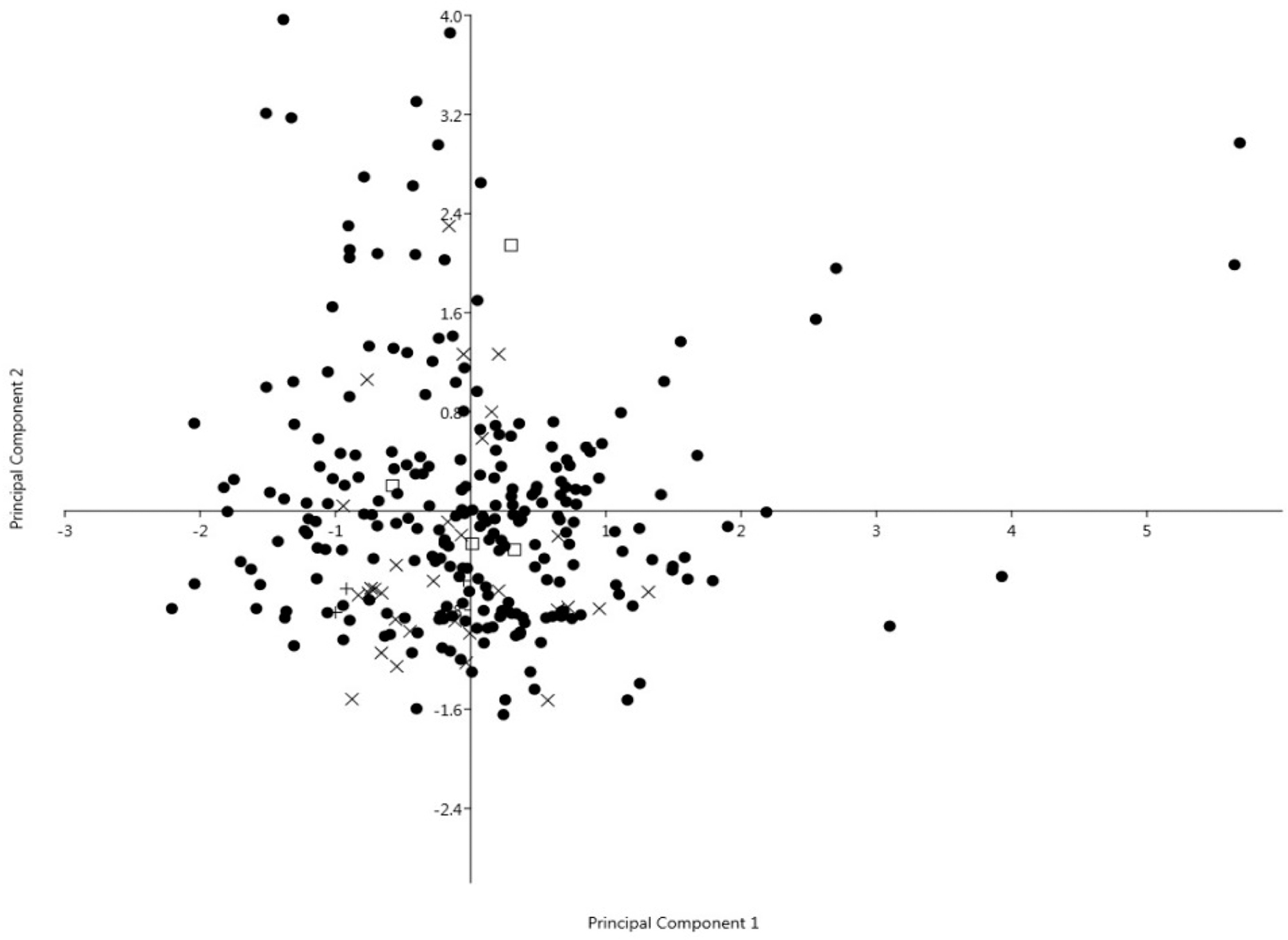
rojection of 281 accessions of safflower from different countries.•; accessions of China, +; accessions of Japan, ×; accessions of South Korea, and □ ; accessions of North Korea.
DPPH 라디컬 소거능은 ABTS 활성 (0.910**) 및 총 polyphenol 함량 (0.738**)과 높은 양의 상관관계 (p≤ 0.01) 를 보였으며, 이는 Pasko 등 (2009) 및 Sung 등 (2015)의 결과와 유사하였다. Linoleic acid는 oleic acid (−0.973**)와 강한 음의 상관관계를 보였으며, stearic acid (−0.181**)와도 음의 상관을 나타냈다. 수집 자원간의 변이값을 이용하여 주 성분 분석 (principal component analysis)한 결과, 제1 과 제 2 의 주성분들로서 전체 변이의 90.6%를 해석할 수 있었다. 제1 주성분 (PC1)으로 변이의 73.4%를 해석할 수 있었는데, 총 polyphenol 함량 및 ABTS 활성값의 기여도가 높았다 (Table 4).

Cumulative variances of first and second principal components and loadings of 12 characters on each principal component.
동아시아수집 잇꽃자원의 지방조성과 항산화 활성의 연관성 을 고려하여 4 그룹으로 자원을 구분할 수 있었다 (Fig. 2). 79 자원을 포함하는 그룹I 은 포화지방산의 평균함량이 다른 4 개 그룹보다 비교적 높은 자원들이었다. 그룹II 는 16 자원 을 포함하고 있었으며, 조지방 평균함량, 불포화지방산 중 oleic 및 linoleic acid 조성비율 그리고 종자의 평균길이가 다 른 그룹들에 비해 컸다. 그룹III 은 50 자원을 포함하였으며, 다른 그룹에 비해 높은 총 polyphenol 함량과 항산화 활성을 보였다. 그룹IV 는 일본수집 자원을 포함하여 136 자원이 분 포하였다 (Tabel 5).
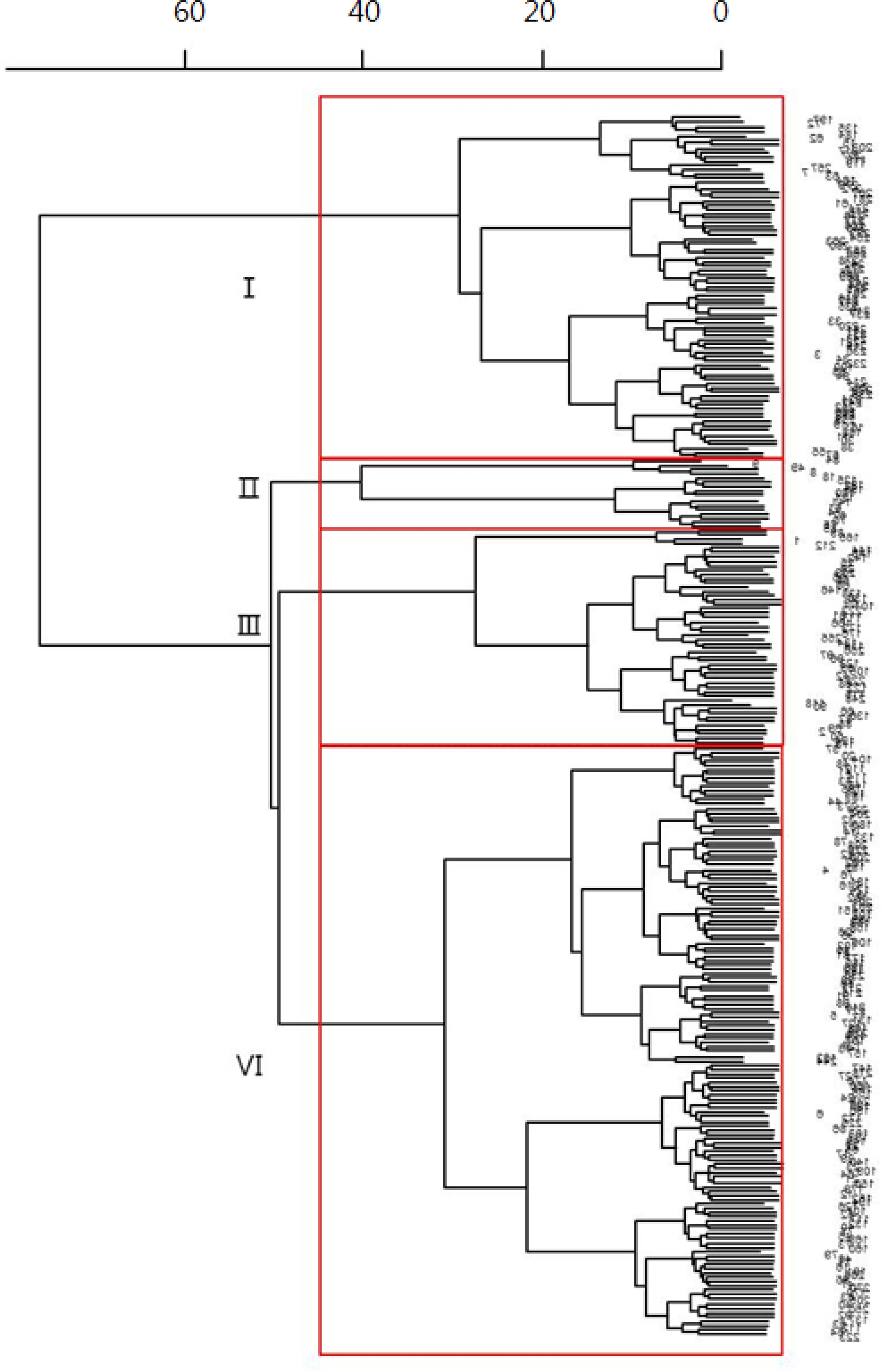
Clustering analysis of oil compositions, antioxidant activities, and seed characters in 281 safflower accessions collected from East Asia.
결과적으로, 잇꽃 수집자원들의 지방조성 및 항산화 활성에 있어서는 수집자원간에는 변이가 다양했다. 중국자원 중 oleic acid 함량이 높은 IT300331과 총 polyphenol 함량이 높은 K186161, IT305578 등은 국내 잇꽃 품종개발 또는 기능성 오일 연구의 소재로 활용 가능할 것으로 사료된다.
감사의 글
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구 개발사업(과제번호: PJ01249302)의 지원에 의해 이루어진 것 으로 이에 감사드립니다.
References
- C.H. Choi, H.D. Kim, E.B. Im, Reviews of research trends on safflower seed(Carthamus tinctorius L.)., Journal of Korean Medical Classics, (2011), 24, p63-90.
-
E.Y. Choi, S.I. Heo, Y.S. Kwon, M.J. Kim, Anti-oxidant activity and anti-inflammatory effects of Spiraea fritschiana Schneid extract., Hanguk Yakyong Changmul Hakhoe Chi, (2016), 24, p31-37.
[https://doi.org/10.7783/kjmcs.2016.24.1.31]

-
K.H. Choi, H.H. Nam, B.K. Choo, Effect of five Korean native Taraxacum on antioxidant activity and nitric oxide production inhibitory activity., Hanguk Yakyong Changmul Hakhoe Chi, (2013), 21, p191-196.
[https://doi.org/10.7783/kjmcs.2013.21.3.191]

-
W.Y. Choi, H.Y. Lee, Enhancement of antioxidant activities of Curcuma longa leaves by ultra high pressure extraction., Hanguk Yakyong Changmul Hakhoe Chi, (2014), 22, p121-126.
[https://doi.org/10.7783/kjmcs.2014.22.2.121]

- C. Cox, J. Mann, W. Sutherland, A. Chisholm, M. Skeaff, Effects of coconut oil, butter, and safflower oil on lipids and lipoproteins in persons with moderately elevated cholesterol levels., J. Lipid Res, (1995), 36, p1787-1795.
- L. Dajue, H.H. Mundel, Safflower. Carthamus tinctorius L.: Promoting the conservation and use of underutilized and neglected crops. 7. International Plant Genetic, Rome, Italy, Resources Institute, (1996), p20-21.
- J.C. Espin, C. Soler-Rivas, H.J. Wichers, Characterization of the total free radical scavenger capacity of vegetable oils and oil fractions using 2,2-diphenyl-1-picrylhydrazyl radical., J. Agric. Food Chem, (2000), 48, p648-656.
-
R.S. Farag, A.Z.M.A. Badei, G.S.A. El Baroty, Influence of thyme and clove essential oils on cottonseed oil oxidation., J. Am. Oil Chem. Soc, (1989), 66, p800-804.
[https://doi.org/10.1007/bf02653671]

- J. Fernandez-Martinez, M. Rio, A. Haro, Survey of safflower(Carthamus tinctorius L.) germplasm for variants in fatty acid composition and other seed characters., Euphytica, (1993), 69, p115-122.
-
D.J. Hoy, E.E. Gamble, Field performance in soybean with seeds of differing size and density., Crop Sci, (1987), 27, p121-126.
[https://doi.org/10.2135/cropsci1987.0011183x002700010030x]

- J.B. Kim, M.H. Cho, T.R. Hahn, Y.S. Paik, Efficient purification and chemical structure identification of carthamin from Carthamus tinctorius., Agricultural Chemistry and Biotechnology, (1996), 39, p501-505.
- S.M. Kim, Q.Y. Zhang, X.Z. Yu, S.T. Yoon, S.J. Ji, J.B. Kim, Fatty acids composition of foxtail millet(Setaria italic beauvois) seeds collected in South Korea., Hanguk Yakyong Changmul Hakhoe Chi, (2010), 18, p405-408.
- T.S. Kim, J.S. Kim, C.G. Park, S.I. Park, Y.W. Ju, M.H. Kang, Antioxidant activities of different Phyllanthus collection species extracts., Hanguk Yakyong Changmul Hakhoe Chi, (2010), 18, p201-207.
-
P.F. Knowles, Variability in oleic and linoleic acid contents of safflower oil., Econ. Bot, (1965), 19, p53-62.
[https://doi.org/10.1007/bf02971186]

- H. Kumar, R.K. Agrawal, ‘HUS 305’ a high-yielding safflower variety., Indian Farming, (1989), 39, p17-18.
- S.O. Lee, H.J. Lee, M.H. Yu, H.G. Im, I.S. Lee, Total polyphenol contents and antioxidant activities of methanol extracts from vegetables produced in ullung island., Korean J. Food Sci. Technol, (2005), 37, p233-240.
-
J.D. Lim, H.I. Park, T.J. An, J.J. Lim, S.H. Kim, B.R. Yoo, E.H. Kim, I.M. Chung, Effect of seed size on seed germination and growth characteristics in safflower(Carthamus tinctorius L.)., Hanguk Yakyong Changmul Hakhoe Chi, (2012), 20, p415-420.
[https://doi.org/10.7783/kjmcs.2012.20.6.415]

-
L. Liu, L.L. Guan, Y.X. Yang, A review of fatty acids and genetic characterization of safflower(Carthamus tinctorius L.) seed oil., World Journal of Traditional Chinese Medicine, (2016), 2, p48-52.
[https://doi.org/10.15806/j.issn.2311-8571.2016.0006]

- J.S. Park, Oil content and growth characteristics of collected safflower varieties., Korean Journal of Plant Resource, (2003), 16, p123-129.
- P. Pasko, H. Barton, P. Zagrodzki, S. Gorinstein, M. Folta, Z. Zachwieja, Anthocyanins, total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth., Food Chem, (2009), 115, p994-998.
-
X.M. Piao, E.K. Jang, J.W. Chung, G.A. Lee, H.S. Lee, J.S. Sung, Y.A. Jeon, J.R. Lee, Y.G. Kim, S.Y. Lee, Variation in antioxidant activity and polyphenol content in tomato stems and leaves., Plant Breed. Biotechnol, (2013), 1, p366-373.
[https://doi.org/10.9787/pbb.2013.1.4.366]

-
A. Prescha, M. Grajzer, M. Dedyk, H. Grageta, The antioxidant activity and oxidative stability of cold-pressed oils., J. Am. Oil Chem. Soc, (2014), 91, p1291-1301.
[https://doi.org/10.1007/s11746-014-2479-1]

-
R Re, N Pellegrini, A Proteggente, A Pannala, M Yang, Antioxidant activity applying an improved ABTS radical cation decolorization assay., Free Radic. Biol. Med, (1999), 26, p1231-1237.
[https://doi.org/10.1016/s0891-5849(98)00315-3]

-
M.R. Sabzalian, G. Saeidi, A. Mirlohi, Oil content and fatty acid composition in seeds of three safflower species., J. Am. Oil Chem. Soc, (2008), 85, p717-721.
[https://doi.org/10.1007/s11746-008-1254-6]

-
G.E. Seo, S.M. Kim, B.S. Pyo, S.A. Yang, Antioxidant activity and antimicrobial effect for foodborne pathogens from extract and fractions of Sanguisorba officinalis L., Hanguk Yakyong Changmul Hakhoe Chi, (2016), 24, p303-308.
[https://doi.org/10.7783/kjmcs.2016.24.4.303]

- J.C. Song, N.K. Park, H.S. Hur, M.H. Bang, N.I. Baek, Examination and isolation of natural antioxidants from Korean medicinal plants., Hanguk Yakyong Changmul Hakhoe Chi, (2000), 8, p94-101.
-
J.H. Song, S.R. Lee, Anti-oxidant and inhibitory activity on NO production of extract and its fractions from Rosa davurica Pall. leaves., Hanguk Yakyong Changmul Hakhoe Chi, (2015), 23, p20-26.
[https://doi.org/10.7783/kjmcs.2015.23.1.20]

-
J.S. Sung, H.C. Ko, O.S. Hur, S.G. Kim, J.R. Lee, B.P. Luitel, J.G. Gwag, H.J. Baek, K.Y. Ryu, Comparison in antioxidant activities and total polyphenol contents of safflower(Carthamus tinctorius L.) germplasm collection., Korean Journal of International Agriculture, (2015), 27, p381-392.
[https://doi.org/10.12719/ksia.2015.27.3.381]

-
J.S. Sung, H.C. Ko, S.G. Kim, J.R. Lee, B.P. Luitel, Y.H. Lee, Y.S. Jang, J.G. Gwag, H.J. Baek, K.Y. Ryu, Morphological and oil compositions in safflower(Carthamus tinctorius L.) germplasm of different geographical groups., Journal of Korean Society of International Agriculture, (2016), 28, p84-91.
[https://doi.org/10.12719/ksia.2016.28.1.84]

- L. Velasco, J.M. Fernandez-Martinez, JW Bergman, HH. Mundel, Proceedings of the 5 th international safflower conference: Breeding for oil quality in safflower, (2001), 5th International Safflower Conference, Williston. ND, USA, p133-137.
- A.L. Waterhouse, Current protocols in food analytical chemistry Determination of total phenolics, New York, NY, USA, John Wiley and Sons Inc., (2002), p1-4.
-
H.L. Zhang, A. Nagatsu, J. Sakakibara, Novel antioxidants from safflower(Carthamus tinctorius L.) oil cake., Chem. Pharm. Bull. (Tokyo), (1996), 44, p874-876.
[https://doi.org/10.1248/cpb.44.874]
