
한국 약용식물자원 추출물의 항알레르기 활성 평가 및 선발
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Allergic diseases like such as atopic dermatitis, asthma, and rhinitis have recently increased both domestically and globally. The present study was undertaken to select candidates with anti-allergic activity from plant resources..
Fifty-six plant extracts at 20μg/ml were screened against β-hexosaminidase production and interleukin (IL)-4 release in degranulated rat basophilic leukemia (RBL)-2H3 cells. The anti-allergy activity of three plant extracts selected from the preliminary screening experiment, Polygonatum sibiricum F. Delaroche (root), Pyrus pytifolia var. culta (Makino) Nakai (leaf), and Rehmannia glutinosa (Gaertn.) Libosch. ex Steud (root) were measured at concentrations of 2 - 250μg/ml in three cell lines as RBL-2H3, HaCaT and Jurkcat T cells. The assay showed the root extract of R. glutinosa to have an inhibitory activity of 4.2% - 28.6% on β-hexosaminidase production from IgE-sensitized RBL-2H3 cells. Each extract of P. sibiricum and R. glutinosa reduced IL-4 release in IgE-sensitized RBL-2H3 cells, respectively. The leaf extract of P. pyrifolia var. culta showed a significantly potent suppressive effect of 10.2% - 74.7% on the mRNA expression of tumor necrosis factor (TNF)-α in HaCaT cells sensitized with TNF-a and INF-g, and showed inhibitory effect of –8.6% - 90.9% on the mRNA expression of IL-2 in Jurkat T cells sensitized with PMA and A23187.
The results showed that the root of R. glutinosa and leaf of P. pyrifolia var. culta could be useful candidates as antiallergy materials.
Keywords:
Anti-allergic Effect, Degranulation, β-Hexosaminidase, Cytokine, Plant서 언
최근 서구화된 생활환경, 각종 화학물질 사용의 증가로 알 레르기 환자 수가 빠르게 증가하여 국내 알레르기 환자 수는 인구의 15 - 20% 정도인 6 백만 명 이상에 이르고 있다 (Jung and Park, 2011). 알레르기란 정상적인 면역계에서 과도 한 형태나 또는 비정상적인 형태로 일어나는 반응으로서 반응 의 기작과 발병시간에 따라 1 형, 2 형, 3 형, 4 형의 네 가 지 형태로 구분되며 알레르기는 보통 1 형 과민반응의 제한적 의미로 사용된다 (Pyo and Sohn. 2008). 대표적인 알레르기 질환으로는 알레르기성 비염, 결막염, 천식, 피부염 등이 있으 며, 알레르기를 유발시키는 항원으로는 음식, 집먼지 진드기, 꽃가루 등이 있다 (Park et al., 2011; Lee et al., 2012).
즉시형 과민반응 (anaphylaxis)은 제 1 형 반응이며, 비만세 포 등에서 일어나는 다양한 변화에 기인하고, 호염구와 더불 어 히스타민, 여러 사이토카인과 같은 염증성 매개물질의 분 비를 통해 알레르기 질환의 발명에서 중요한 역할을 한다 (Lyu et al., 2008; Jeong et al., 2013). 비만세포 (mast cells)는 골 수의 조상세포가 혈류에 이어 목적조직에 들어가서 성숙한 비 만세포가 되는 조혈세포인 데, IgE-매개 즉시형 과민반응과 알 레르기 질환 및 기생충, 세균에 대한 방어적 면역반응에서 중 요한 효과 세포이다.
활성화된 비만세포는 세 군의 물질을 분비하는 데 첫째는 히스타민, 세로토닌, 헤파린 및 콘드로이틴설페이트, 단백분해 효소, 주요 기초 단백질, 산 가수분해효소, 카텝신과 같은 미 리 형성된 화학매개물질과 단백질을, 둘째로 prostaglandins, leukotreines, 혈소판-활성화 인자 (platelet-activating factor, PAF)와 같은 지질매개물질을, 셋째로 tumor necrosis factor-α (TNF-α), transforming growth factor (TGF)-β, interleukin 2 (IL-2), interleukin 4 (IL-4) 등과 같은 성장인자나 cytokines 및 chemokines을 분비 한다 (Kawakami et al., 2009).
또한, 비만세포는 immunoglobulin E (IgE)에 대한 고친화 성의 수용체인 FcεRI를 통해 IgE으로 향하는 항원에 의해 자 극받아 염증성 매개물질과 염증성 지질 및 cytokines을 포함하 는 과립을 방출하며, β-hexosaminidase는 비만세포나 호염구의 히스타민이 저장된 과립 안에 저장되어 있다가 비만세포가 면 역적 활성을 일으켜 탈과립되어 분비되므로 탈과립의 지표로 이용된다 (Lee et al., 2007; Kawakami et al., 2009; Ban et al., 2012; Kang and Lee, 2012).
또한, 알레르기성 염증은 Th1/TH2 균형이 깨어지거나, TH2 림프구에 잠재된 면역반응의 유도에 의해 일어나므로 아토피 성 피부염과 천식을 가진 사람의 염증부위에 상당한 TH2 cells이 축적된다. TH2 cells은 TH2 cytokine으로 알려진 IL-4, IL-5, IL-10, IL-13을 생성하고 이러한 cytokines은 이들 질환 의 진행에서 중요한 인자로 작용하는데, IgE에 의존한 자극에 의해 사람의 호염구로부터 IL-4 및 IL-13의 분비는 알레르기 면역반응의 TH2 우세를 유지시키게 하는 것으로 보고되어 있 고, B cell 활성화와 isotype switching에서 중요한 역할을 하 며 결과적으로 IgE 항체의 생성을 일으킨다 (Lee et al., 2008; Wu et al., 2009).
HaCaT 세포는 피부 상피에 존재하는 keratinocyte로서 아토 피성 피부질환의 결정적인 개시자가 될 수 있고, 활성화된 kertinocyte는 TNF-α, IL-1, IL-6 등과 같은 물질들을 분비하 여 아토피 질환으로 진행하게 한다 (Choi et al., 2017). 한편, IL-2는 T세포 활성화와 증식에서 주요한 역할을 하므로 T세 포 매개 자가면역질환에서 치료 타겟이 된다 (Na et al., 2013).
한편, 알레르기 질환 치료를 위해 적은 양의 항원을 오랜 기 간 동안 환자에 투여하는 면역요법, 비만세포 활성화에 중요한 IgE 항체를 중화시키는 IgE 항체 투여법이 보고된 반면, 알레 르기 질환 치료를 위해 사용되는 스테로이드제 약물은 장기간 복용이 피부위축과 모세혈관 확장의 부작용이, 항히스타민제 약물은 졸음유발과 집중력 저하 등의 부작용이 유발된다 (Kim, 2010; Jung et al., 2013). 그러므로 부작용의 위험이 적으며 장기간 복용이 가능할 것으로 예상되는 천연물 유래의 항알레르기성 소재에 대한 연구가 필요한 실정이며, 지금까지 짚신나물 추출물의 알레르기 반응억제 효과, 황금 추출물의 항 천식 효과 등 천연식물에 알레르기 개선 소재 연구가 일부 이 루어져 있다 (Kim, 2010; Lim and Kim, 2012).
따라서 본 연구에서는 국내에서 자생되고 있는 천연식물자 원에 대해 항알레르기 효과를 측정하기 위해 비만세포와 유사 한 rat basophilic leukemia (RBL)-2H3 세포에서 탈과립 정 도를 확인할 수 있는 β-hexosaminidase 활성 및 IL-4 생성 정도를 분석하여 항알레르기 활성을 확인한 후 선발된 자원에 아토피성 피부질환 등의 완화에 효과를 나타내는 지를 확인하 고자 사람의 피부각질세포인 HaCaT 세포주에서 TNF-α와 Jurkat T세포주에서 IL-2의 생성정도를 분석하였다.
재료 및 방법
1. 실험재료
본 실험에 사용된 식물 추출물은 국립원예특작과학원 식물 추출물은행에서 제공받아 사용하였다. 식물의 산지, 추출된 식 물부위, 추출조건, 채취시기 등 자세한 시료정보는 Table 1에 명시하였다.
2. 시약
스크리닝 실험에 사용된 minimum essential medium (MEM), sodium pyruvate, antimycotic solution은 Welgene (Gyeongsan, Korea)으로부터, fetal bovine serum (FBS)는 Hyclone Laboratories (Logan, UT, USA)에서 구입하였다. Monoclonal anti-dinitrophenyl immunoglobulin E (DNPIgE), thiazolyl blue tetrazolium bromide (MTT), penicillinstreptomycin, dimethyl sulfoxide (DMSO), 4-(2-hydroxyethyl) piperazine-1-ethanesulfonic acid (HEPES), β-hexo substrate (4- methylumbelliferly-N-acetyl-β-D-glucosaminide in 0.05M sodium acetate buffer, pH 4.4), bovine serum albumin (BSA) 는 Sigma-Aldrich (St. Louis, MO, USA)에서, 2,4- dinitrophenyl-bovine serum albumin (DNP-BSA)는 Santa Cruz Biotechnology (Dallas, TX, USA)로부터, IL-4 rat ELISA kit는 Abcam (Cambridge, England)에서 구입하여 사 용하였다.
선발된 식물자원에 대한 활성실험에 사용된 substrate buffer (2 mM p-nitrophenyl-N-acetyl-β-D-glucosaminide in 0.1M sodium citrate, pH 4.5), phorbol 12-myristate 13-acetate (PMA) 및 A23187는 Sigma-Aldrich (St. Louis, MO, USA) 에서 구매하였으며 bovine serum albumin (BSA)는 UBS products (Cleveland, OH, USA)에서, DNP-BSA는 Alpha Diagnostic International (San Antonio, TX, USA)에서, DMEM 배양액, 1% 항생제, DNP-bovine serum albumin는 iNexus (Seongnam, Korea)에서 구입하여 사용하였다.
TNF-α와 interferone (INF)-γ는 R&D Systems (Minneapolis, MN, USA)에서, diethyl pyrocarbonate (DEPC) water는 Invitrogen (Carlsbad, CA, USA) 에서 구입하였다.
RNase, RNA, Accupower® RT PreMix 및 Accupower® PCR PreMix는 Bioneer (Daejeon, Korea) 제품을 사용하였고, forward primer와 reverse primer 및 glyceraldehyde 3-phosphate dehydrogenase (GAPDH)는 GenoTech (Daejeon, Korea)에서, DyNAmo SYBR Green qPCR kit는 Takara Bio (Otsu, Japan)에서, DNA Engine Opticon는 MJ Research (Deltona, FL, USA)에서 구입하였다.
RPMI 1640 배지는 iNexus (Seongnam, Korea)의 제품을 사용하였으며 그 외의 시약은 스크리닝 실험에서와 동일한 것 을 사용하였으며 일반시약은 특급시약을 구입하여 사용하였다.
3. 실험용 세포주 및 배양방법
스크리닝 실험 및 농도별 실험에는 rat basophilic leukemia (RBL-2H3) (KCLB NO. 22486), HaCaT (ATCC CRL-2404) 와 Jurkat T (ATCC PCS-800-011) 등의 세포주를 사용하였으 며, 이 중 RBL-2H3 세포는 1% penicillin-streptomycin 및 sodium pyruvate, 0.1% antimycotic solution, 10% heatinactivated FBS가 첨가된 MEM 배지에서 37℃, 5% CO2의 조건의 배양기 (Thermo Fisher Scientific Inc., Waltham, MA, USA)에서 배양하였다. RBL-2H3 세포 (1 × 105 cells/㎖) 는 96 well plate 또는 24 well plate에 분주하고 24 시간 배양한 후 실험하였다.
피부각질세포인 HaCaT 세포와 사람의 T세포인 Jurkat T세 포는 37℃, 5% CO2 조건의 CO2 배양기에서 소태아 혈청 (10%), 페니실린G (100 IU/㎖), 스트렙토마이신 (100㎍/㎖), 그리고 L-글루타민 (2 mM)을 첨가한 RPMI 1640 배지에서 배양하였다.
4. 56 종 식물 추출물의 세포독성 및 항알레르기 활성 평가
56 종 식물 추출물의 세포독성을 평가하기 위해 RBL-2H3 세포를 48 well plate에 1.25 × 105 cells/well이 되도록 분주한 후 37℃, 5% CO2 조건의 배양기에서 24 시간 배양하였다.
배지를 제거하고 식물 추출물을 각각 최종농도가 20㎍/㎖ 이 되도록 30 분간 처리한 후, 추출물을 제거하고 MTT 용액 250㎕을 넣고 37℃, 5% CO2 조건에서 1 시간 반응시켰다. MTT 용액을 제거한 후 생성된 formazan을 녹여내기 위해 1 : 1 비율로 된 DMSO와 에탄올 250㎕를 넣고 호일을 이용하 여 빛을 차단한 채 15 분간 잘 섞어주었다. 이 후 microplate reader (BIO-TEK, Winooski, VT, USA)를 이용하여 540 ㎚ 에서 흡광도를 측정하였다.
대상 식물 추출물 56 개의 항알레르기 활성을 평가하기 위 한 지표로서 비만세포에서의 β-hexosaminidase 방출량을 측정 하였다. RBL-2H3 세포를 48 well plate에 1.25 × 105 cells/ well이 되도록 분주한 후 37℃, 5% CO2의 조건에서 24 시간 배양하였다.
Tyrode’s buffer (135 mM NaCl, 5 mM KCl, 1.8 mM CaCl2, 1 mM MgCl2, 5.6 mM glucose, 20 mM HEPES, pH 7.4)로 2 회 세척 한 후 DNP-IgE (0.02㎍/㎖)를 처리하여 4 시간 동안 감작시켰다. Tyrode’s buffer로 2 회 세척한 후 각 시료의 최종농도가 20㎍/㎖이 되도록 30 분간 처리하고 DNP-BSA (0.04㎍/㎖)를 30 분간 처리하여 탈과립시키고 ice bath에서 10 분간 방치함으로써 반응을 종결시켰다.
β-Hexosaminidase의 방출 정도를 확인하기 위하여 상등액을 취해 vortex한 후 96 well plate에 상등액 50 ㎕와 2.4 mM β-hexo substrate (4-methylumbelliferly-N-acetyl-β-Dglucosaminide in 0.05 M sodium acetate buffer, pH 4.4) 50㎕를 넣고 37℃에서 1 시간 동안 반응시켰다.
0.1M glycine buffer (0.1M glycine, 1 mM MgCl2, 1 mM ZnCl2, pH 10.0) 175㎕를 넣어 반응을 종결시킨 후 microplate reader (BIO-TEK, Winooski, VT, USA)를 이용 하여 excitation 360㎚ 및 emission 460㎚의 조건에서 형광 도를 측정하였다.
대상 식물 추출물 56 개의 항알레르기 활성을 평가하기 위 해 탈과립된 비만세포에서 IL-4의 분비량을 측정하였다. RBL- 2H3 세포를 48 well plate에 1.25 × 105 cells/well이 되도록 분주한 후 37℃, 5% CO2의 조건에서 24 시간 배양하였다. 이후 Tyrode’s buffer (135 mM NaCl, 5 mM KCl, 1.8 mM CaCl2, 1 mM MgCl2, 5.6 mM glucose, 20 mM HEPES, pH 7.4)로 2 회 세척 한 후 0.02㎍/㎖ DNP-IgE를 처리하여 4 시간 동안 감작시켰다.
Tyrode’s buffer로 2 회 세척 후 시료 추출물의 최종농도가 20㎍/㎖이 되도록 30 분간 처리한 후 0.04㎍/㎖ DNP-BSA 를 30 분간 처리하여 탈과립시키고 ice bath에서 10 분간 방 치함으로써 반응을 종결시켰다.
반응이 종료된 시료 및 대조군의 상등액을 1,000 × g에서 10 분간 원심분리한 후 IL-4 rat ELISA kit를 사용하여 450㎚에서 흡광도를 측정하였다.
5. 선발된 식물추출물의 세포독성 및 항알레르기 활성 평가
단일농도에서의 1 차 활성탐색결과 선발된 3 종의 시료의 RBL-2H3 세포 (1 × 106 cell/㎖)을 96 well plate에 분주한 후 세포독성을 평가하기 위해 각 시료를 2, 10, 50, 250㎍/㎖로 24 시간 처리하고 MTT 분석법으로 세포독성을 확인하였다.
각 well에 최종 농도 0.1㎎/㎖의 MTT 용액을 100㎕씩 넣고 3 시간 동안 37℃, 5% CO2 조건에서 반응시켰다. 배양 액과 MTT 용액을 제거한 후, DMSO 200㎕를 첨가하여 형 성된 결정을 녹였으며 microplate reader를 이용하여 540㎚에 서 흡광도를 측정하였다.
선발된 3 종 시료의 세포독성은 human keratinocyte HaCaT cell (5 × 105 cell/㎖) 및 Jurkat T cell (5 × 105 cell/㎖)을 각각 48 well plate에 분주하고 하루 동안 37℃, 5% 이산화탄소 배양기에서 배양하였다. 각 well에 10% FBS 와 1% 항생제가 포함된 DMEM 배양액을 분주하여 배양한 후 시약을 처리하였으며 음성 대조군으로는 용매인 DMSO를 첨가하였다. 하루 동안 37℃, 5% 이산화탄소 배양기에서 배양 한 후, 세포의 성장 정도를 MTT 분석법으로 확인하였다. 48 well 배양용기의 각 well에 0.1% MTT 용액을 100 ㎕씩 넣고 3 시간 동안 37℃, 5% 이산화탄소 배양기에서 반응시켰다.
배양액과 MTT 용액을 제거한 후, DMSO 100㎕를 첨가하 여 형성된 결정을 녹인 후 microplate reader를 이용하여 540㎚에서 흡광도를 측정하였다.
선발된 3 종 추출물의 RBL-2H3 세포에서의 탈과립화에 대한 영향 분석하기 위해 탈과립의 바이오마커인 β-hexosaminidase 분비량을 측정하였다.
먼저 RBL-2H3 세포 (1 × 106 cell/㎖)을 24 well plate에 분주한 후 감작반응을 유도하기 위해 0.05㎍/㎖ 농도의 anti-DNP-IgE를 함유한 MEM 배지를 사용하여 24 시간 처리 하였다.
각 세포들은 Tyrode’s buffer (135 mM NaCl, 5 mM KCl, 1.8 mM CaCl2, 1.0 mM MgCl2, 5.6 mM glucose, 20 mM HEPES, pH 7.4)에 BSA 1㎎/㎖을 첨가하여 2 회 세척한 후, 각각의 선발시료를 농도별 (2, 10, 50, 250㎍/㎖)로 30 분 동안 반응시켰다. DNP-BSA를 최종 농도 0.1㎍/㎖를 처 리하여 2 시간 동안 반응시키고, 얼음위에서 10 분간 방치하 여 반응을 종결시켰다.
세포 배양액 50㎕를 96 well plate에 옮기고 substrate buffer (2 mM p-nitrophenyl-N-acetyl-β-D-glucosaminide, 0.1 M sodium citrate, pH 4.5) 50㎕를 혼합한 후, 37℃ 조건에 서 1 시간 반응시켰다. Stop solution (0.1 M Na2CO3/NaHCO3, pH 10.0) 200㎕를 첨가하여 반응을 종결시킨 후 microplate reader를 이용하여 405㎚에서 흡광도를 측정하였다.
RNA isolation을 위해 피부각질세포인 HaCaT 세포와 Jurkat T세포는 6 well plate에서 키운 세포 (1 × 105 cell/㎖)를 선발된 식물 추출물을 처리하여 배양시킨 후 세포 자극 유도를 위해 HaCaT 세포주에는 자극제로서 10 ng/㎖ TNF-α와 10 ng/㎖ INF-γ를 사용하여 TNF-α mRNA 분비량을 측정하였다.
Jurkat T세포에는 자극제로서 200 nM PMA와 1 μM A23187를 사용하여 log-phase에 해당하는 세포를 각각의 실험 에 맞게 12 well, 6 well 혹은 60㎜ dish에 분주하여 interleukin-2 (IL-2)의 생성량을 분석하였다.
RNA를 추출하기 위하여 chloroform을 첨가하여 20 - 30 초 vortex한 후 4℃에서 15,000 rpm으로 15 분간 원심분리 하였다. 상층액을 새 튜브에 옮긴 뒤, isopropanol을 동량을 넣고 10 분간 상온에 정치시킨 뒤 4℃에서 15,000 rpm으로 20 분간 원심분리 하였다. 상층액을 버리고 75% 에탄올 (in DEPC water)로 세척한 후 4℃에서 13,000 rpm으로 5 분간 원심분리를 한 후 상층액은 버리고, pellet을 DEPC water를 이용하여 녹였다. 이렇게 추출된 RNA는 −80℃에 보관하였다.
전체 RNA농도 측정은 RNase가 처리된 0.1% DEPC water로 용해시켜 UV spectrophotometer (Tecan, Mannedorf, Switzerland)로 260㎚/280㎚에서 흡광도를 측정하였다.
HaCaT 세포와 Jurkat T세포는 semiquantitative real time reverse transcription-polymerase chain reaction (RT-PCR) 방 법으로 역전사반응을 이용하여 mRNA에 대한 PCR 산물을 정량하였다. 역전사반응은 추출된 전체 RNA (1㎍)와 oligonucleotide dT primer (100 pmol)을 Accupower® RT PreMix tube에 혼합한 후, 반응 전체 용량을 20㎕로 하여 70℃에서 5 분 동안 전 처리하였다. cDNA합성은 42℃에서 1 시간 동안 반응시켰고, 역전사 효소를 불활성화 시키기 위해 80℃에서 15 분 동안 열처리하였다.
PCR 장치 (Life Technology Korea, Seoul, Korea)에서 Accupower® PCR PreMix tube에 역전사된 cDNA 1㎍과 forward primer와 reverse primer 각각 1 pmol을 사용하여 (total volume 20㎕) 중합 반응하였다.
중합반응 조건은 초기 94℃에서 5 분 동안 열처리하여 cDNA를 변성시킨 후 다음과 같이 시행하였다. Human의 primer TNF-α는 5’-GGC AGG TCT ACT TTG GAG TCA TTG C-3’ (sense), 5’-ACA TTC GAG GCT CCA GTG AAT TCG G-3’ (antisense), IL-2 (s 5′-CCG GAG AGG AGA CTT CAC AG-3’ as 5’-GGA AAT TGG GGT AGGAAGGA-3’) 그리고 GAPDH의 발현은 5’-CGG AG TCA ACG GAT TTG GTC GTA T-3’ (sense)와 5- AGCTTCTCCATGGTGGT GAAGAC-3’ (antisense)를 이용 하여 확인하였다. 증폭된 PCR products는 1%의 agarose gel 에서 전기영동하여 band의 정량을 ImageJ 1.44d를 사용하여 band를 정량화하였다.
실시간 정량 (real-time PCR)은 total RNA를 분리하고 cDNA를 합성한 후, DyNAmo SYBR Green qPCR kit와 DNA Engine Opticon을 이용하여 PCR 증폭을 수행하였다. cDNA 주형 및 각각의 특이적인 primer를 2× PCR master mix에 가하여 PCR 조건에 맞추어 반응을 수행하였다.
Human primer는 TNF-α (s 5’-CCT ACC AGA CCA AGG TCA AC-3’' as 5’-AGG GGG TAA TAA AGG GAT TG-3’), IL-2 (s 5’-CCG GAG AGG AGA CTT CAC AG-3’ as 5’-GGA AAT TGG GGT AGGAAGGA- 3’), GAPDH sense 5’-AAT GCA TCC TGC ACC ACC AA-3’ antisense 5’-GTA GCC ATA TTC ATT GTC ATA- 3'로 제작하였다. GAPDH로 정량화한 후, 처리군의 관심 있는 유전자의 mRNA 수준을 대조군과 비교하여 유전자 발현 증 가 정도는 다음의 등식을 이용하여 산출하였다.
△△CT= (CT,Target- CT,GAPDH) time x- (CT,Target- CT,GAPDH) time 0
time x: 임의의 시간
time 0: GAPDH로 정량한 값이 대조군에 대한 관심 있는 유전자 발현이 대조군 (CON)이 1 배가 되는 시간
6. 통계처리
모든 실험 결과는 평균 ±표준편차 (means ± SD)로 나타내 었으며 (n = 3), Microsoft excel의 Student’s t-test에 의해 유 의성을 검정하였다.
결 과
1. 식물 추출물 56 종의 항알러지 효과 스크리닝
일반적으로 세포 독성 평가를 위해 수행되어지는 MTT assay는 담황색의 수용성 기질인 MTT tetrazolium이 살아있는 세포 내의 미토콘드리아와 반응하여 암청색의 formazan을 형 성하는 원리를 이용한 실험으로 RBL-2H3 세포에 대한 56 종 의 식물 추출물의 독성 정도를 평가하기 위하여 MTT assay를 수행하였으며 그 결과는 Table 2 에 나타내었다.

Screening of Korean herbs on RBL-2H3 cell viability and the effects on β-hexosaminidase release and IL-4 secretion in RBL-2H3 cells sensitized with DNP-IgE and DNP-BSA.
실험된 56 종의 식물 추출물은 DMSO를 처리한 대조군과 비 교하였을 때 시료번호 25 [하수오, Fallopia multiflora (Thunb.) Haraldson, root]가 135.3 ± 16.7%로 가장 높은 수치를 나타내었 고 시료번호 28 (선이질풀, Geranium krameri Franch. & Sav., stem)이 101.4 ± 8.3%의 가장 낮은 세포증식율을 나타내었다. 따 라서, 실험된 56 종의 식물 추출물은 최종농도 20㎍/㎖ 수준에 서 모두 세포 독성을 나타내지 않는 것으로 확인되었다.
실험 결과, 56 종의 식물 추출물 중 최종농도 20㎍/㎖에 서 10% 이상의 저해효과를 나타낸 시료로는 시료번호 41 (층 층갈고리둥굴레, Polygonatum sibiricum F. Delaroche, root) 이 27.3 ± 5.6%, 시료번호 1 (복자기, Acer triflorum Kom., aerial part)이 22.1 ± 0.3%, 시료번호 44 [지황, Rehmannia glutinosa (Gaertn.) Libosch. ex Steud., root]가 16.8 ± 5.6%, 시 료번호 9 (쑥, Artemisia princeps Pamp., root)가 14.9±3.6%, 시료번호 45 (복분자, Rubus coreanus Miq., aerial part)가 13.5 ± 0.8%, 시료번호 42 [배나무, Pyrus pyrifolia var. culta (Makino) Nakai, leaf]가 12.9 ± 4.8%, 및 시료번호 5 [바디나 물, Angelica decursiva (Miq.) Franch. & Sav.]: 11.2 ± 7.7% 의 순으로 우수한 저해효과를 나타내었다 (Table 2).
한편, 알레르기 반응에서 트리거 (trigger)가 되는 비만세포 의 탈과립을 억제하는 물질은 제I 형 알레르기 반응을 억제할 수 있음을 시사하므로 항알레르기 소재로 사용이 가능할 것으 로 사료된다.
식물 추출물 56 종에 대한 IL-4 분비에 대한 저해효과를 최종농도가 20㎍/㎖인 조건에서 RBL-2H3 cell에서 분석하였 으며 그 결과는 Table 2에 나타낸 바와 같다.
실험에 사용된 식물 추출물 중 35 개의 시료가 25.5 ± 2.8% 에서 0.0 ± 4.8%까지의 IL-4 분비에 대한 저해효과를 나타내었 으며, 10% 이상의 저해효과를 나타낸 것으로는 시료번호 34 (인삼, Panax ginseng C. A. Meyer, leaf)가 25.5 ± 2.8%, 시 료번호 35 (인삼, P. ginseng, seed)가 25.5 ± 5.2%, 시료번호 39 (식방풍, Peucedanum japonicum Thunberg, root)이 24.6 ± 7.3%, 시료번호 37 (소엽, Perilla frutescens var. acuta Kudo, whole plant)이 24.4 ± 6.3%, 시료번호 43 (배나 무, P. pyrifolia var. culta, branch)이 24.0 ± 5.0%, 시료번호 38 (식방풍, Peucedanum japonicum Thunberg, aerial part)이 23.1 ± 3.4%, 시료번호 36 (인삼, P. ginseng, root)이 22.4 ± 3.8%, 시료번호 40 (반하, Pinellia ternata Breit, root) 이 17.6 ± 4.0%, 44 (지황, R glutinosa, root)이 15.6 ± 4.0%, 시료번호 41 (층층갈고리둥굴레, P. sibiricum F. Delaroche, root)이 15.1 ± 0.7% 그리고 시료번호 42 (배나무, P. pyrifolia var. culta, leaf)가 15.0 ± 8.3%의 순으로 11 개의 시료가 비 교적 우수한 것으로 확인되었다.
한편, 이렇게 최종농도 20㎍/㎖에서 스크리닝된 56 개의 식물 추출물 중에서 β-hexosaminidase 방출 저해효과 및 IL-4 분비에 대한 저해효과에서 모두 10% 이상으로 우수한 것은 시료번호 41 (층층갈고리둥굴레, P. sibiricum, root), 시료번호 42 (배나무, P. pyrifolia var. culta, leaf) 및 시료번호 44 (지 황, R. glutinosa, root)의 3 개 시료가 확인되었다.
따라서, 스크리닝 실험으로 우수한 항알레르기 활성을 가진 것으로 선발한 이들 3 종의 시료에 대해 처리농도별 또는 대 상세포를 달리하여 활성을 계속하여 분석하였다.
2. 선발된 식물 추출물 3 종의 항알러지 효과 분석
선발된 3 종의 식물추출물에 대하여 RBL-2H3 세포주에서 2, 10, 50, 250㎍/㎖에서의 세포증식율을 살펴본 결과는 Fig. 1에 나타내었다. 3 가지 식물추출물 중에서 시료번호 41 (층층갈고리둥굴레, P. sibiricum, root) 은 113.6 ± 2.7% - 155.9 ± 18.2%의 세포증식율을 농도의존적으로 나타내었고, 시 료번호 44 (지황, R. glutinosa, root) 는 2 - 50㎍/㎖에서는 111.0 ± 3.2% - 132.4 ± 14.3%의 수치를 나타내 농도-의존적으로 증가하였으나 250㎍/㎖에서는 72.0 ± 10.4%로 수치의 감소가 확인되었다.
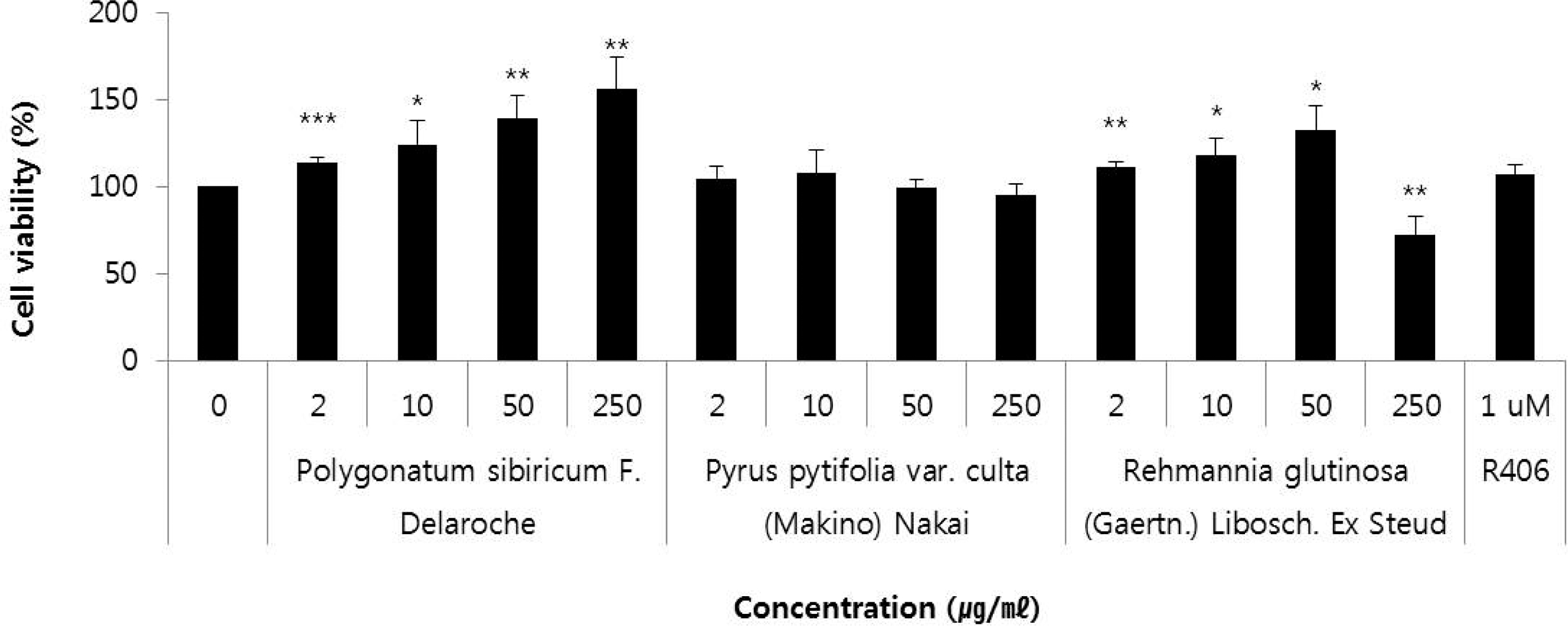
Effects of the extracts from Polygonatum sibiricum F. Delaroche (root), Pyrus pytifolia var. culta (Makino) Nakai (leaf), and Rehmannia glutinosa (Gaertn.) Libosch. ex Steud (root) on cell viability.PC (R406) was used as positive control. NC means negative control. Symbol indicates significance of the data; *p < 0.05 versus control, **p < 0.01 versus control, ***p < 0.001 versus control.
또한, β-hexosaminidase 방출에 대한 실험에서는 Fig. 2에 나타낸 바와 같이 3 가지 시료 중에서 시료번호 44 (지황, R. glutinosa, root) 가 2, 10, 50, 250㎍/㎖에서 각각 288.4 ± 18.0, 273.0 ± 27.7, 259.4 ± 16.0 및 215.0 ± 29.6%의 수치를 보여 각각 4.2%, 9.3%, 13.8% 및 28.6%의 저해율을 나타내 었으며, 처리농도-의존적이고 유의하게 활성을 저해하는 것을 알 수 있었다.
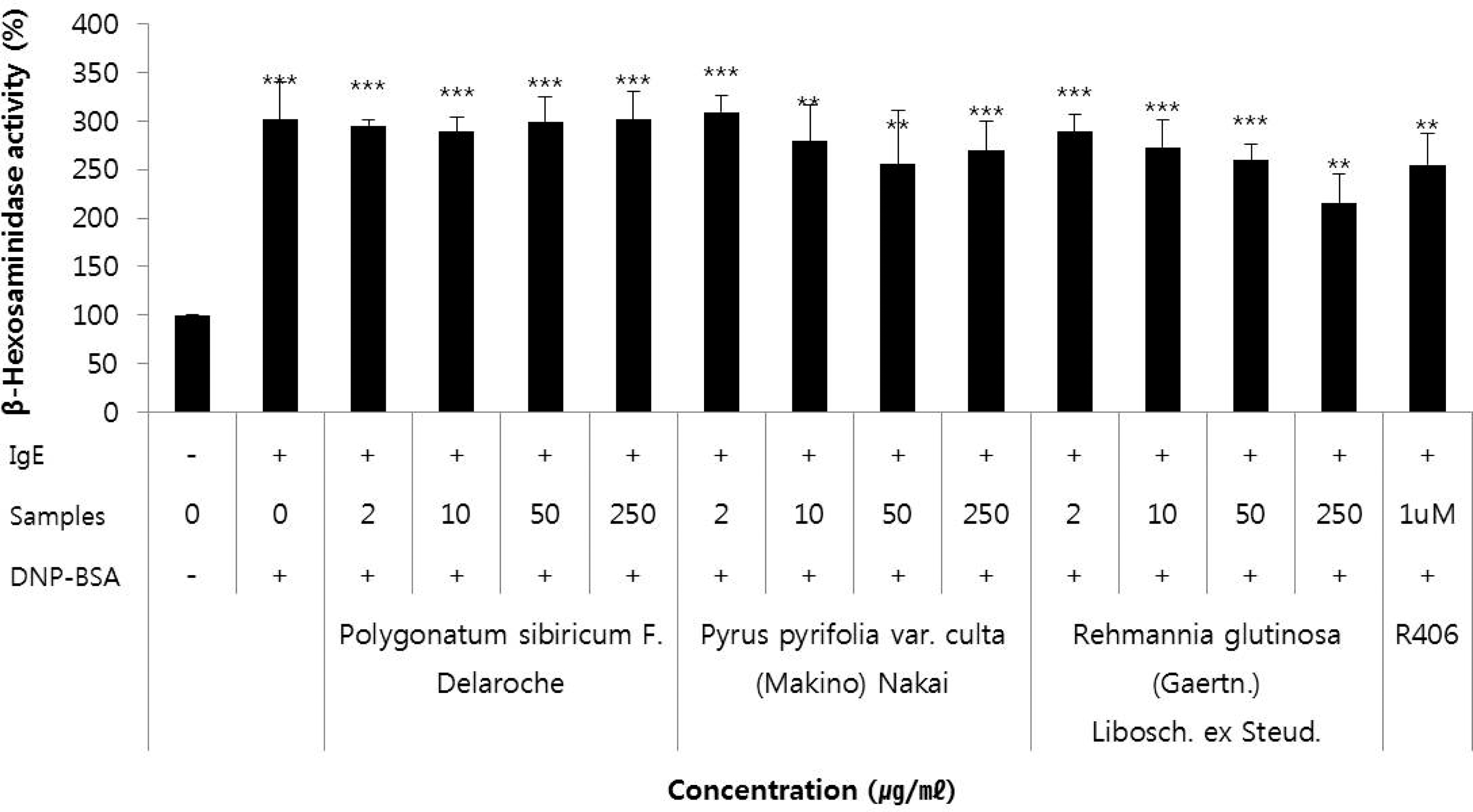
Effects of the extracts from Polygonatum sibiricum F. Delaroche (root), Pyrus pytifolia var. culta (Makino) Nakai (leaf), and Rehmannia glutinosa (Gaertn.) Libosch. ex Steud (root) on β-hexosaminidase release in RBL-2H3 cells.PC (R406) was used as positive control. NC means negative control. Symbol indicates significance of the data; *p < 0.05 versus control, **p < 0.01 versus control, ***p < 0.001 versus control.
이러한 수치는 양성대조물질로 사용한 R406 (1 μM)이 254.7 ± 31.9%의 β-hexosaminidase 활성을 보여 15.4%의 저 해효과를 보인 것을 감안할 때, 매우 우수한 효과임을 나타내 는 결과이다.
선발된 3 종 식물추출물에 대한 IL-4 방출 저해효과를 실험 한 결과, 시료번호 41 (층층갈고리둥굴레, P. sibiricum, root) 는 20, 10, 50㎍/㎖의 농도로 처리하였을 때 75.4, 22.1 및 8.0 pg/㎖의 IL-4를 분비하였으며, 시료번호 44 (지황, R. glutinosa, root)는 30.3, 22.6 및 14.9 pg/㎖의 IL-4를 분비한 것을 확인할 수 있어 농도-의존적으로 IL-4의 감소효과를 보 인 것을 알 수 있었다. 하지만, 시료번호 42 (배나무, P. pyrifolia var. culta, leaf)는 처리농도에 따른 IL-4 감소효과가 확인되지 않았다 (Fig. 3).
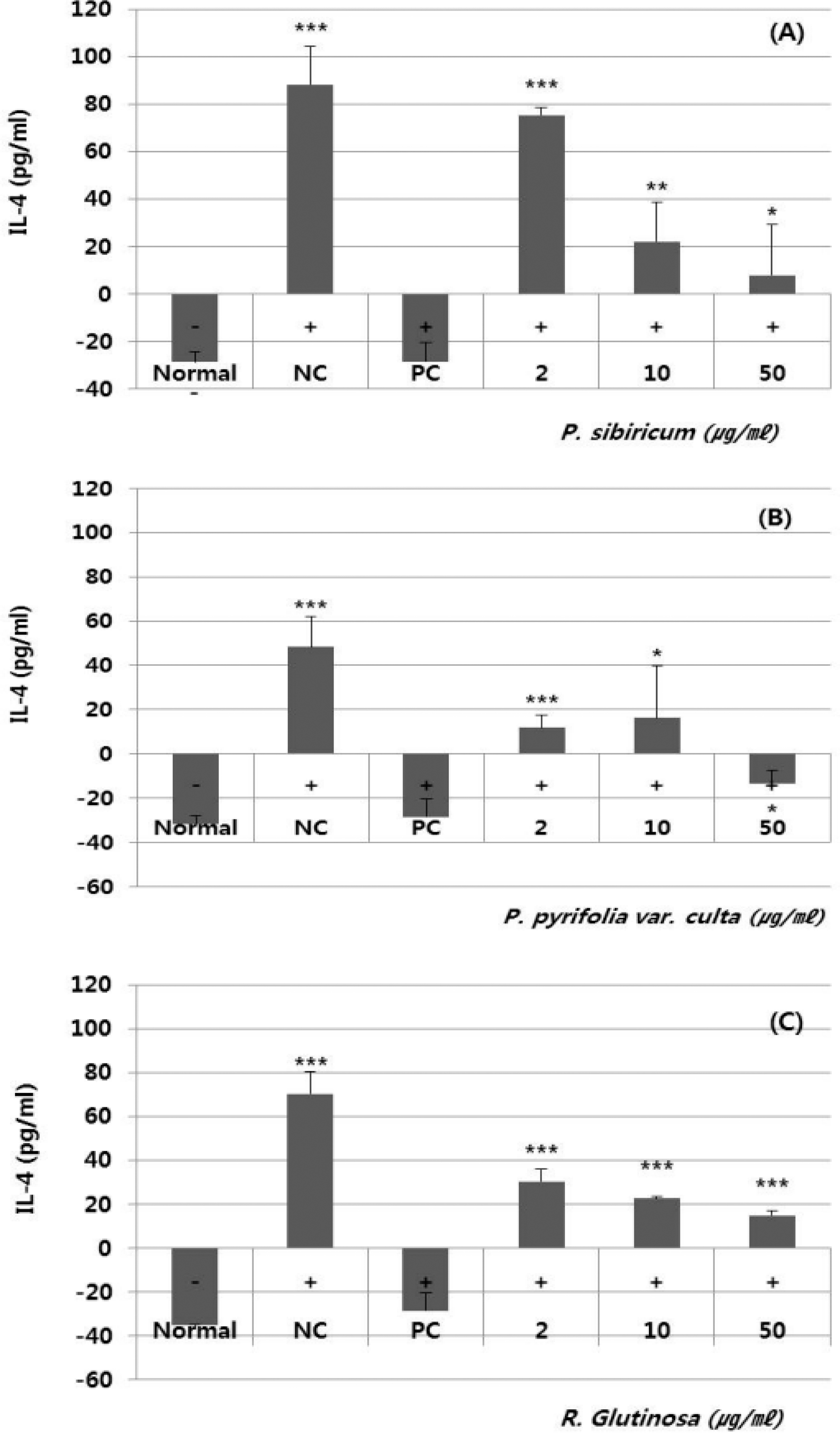
Effects of the extracts from Polygonatum sibiricum F. Delaroche (root, A), Pyrus pytifolia var. culta (Makino) Nakai (leaf, B), and Rehmannia glutinosa (Gaertn.) Libosch. ex Steud (root, C) on IL-4 production in RBL-2H3 cells.PC (R406) was used as positive control. NC means negative control. Symbol indicates significance of the data; *p < 0.05 versus control, **p < 0.01 versus control, ***p < 0.001 versus control.
실험결과, 시료번호 41 (층층갈고리둥굴레, P. sibiricum, root), 시료번호 42 (배나무, P. pyrifolia var. culta, leaf) 및 시 료번호 44 (지황, R. glutinosa, root)는 2 -250㎍/㎖의 농도에서 각각 91.8 ± 2.4%- 100.7 ± 3.6%, 96.9 ± 0.6%- 102.3 ± 2.4% 및 95.9 ± 2.8%에서 102.6 ± 2.4%의 수치를 나타내었으며 이는 각 추출물의 처리 농도 의존적으로 세포증식율이 감소하였으나 3 가지 시료 모두 비교적 독성이 낮은 것으로 사료되었다 (Fig. 4).
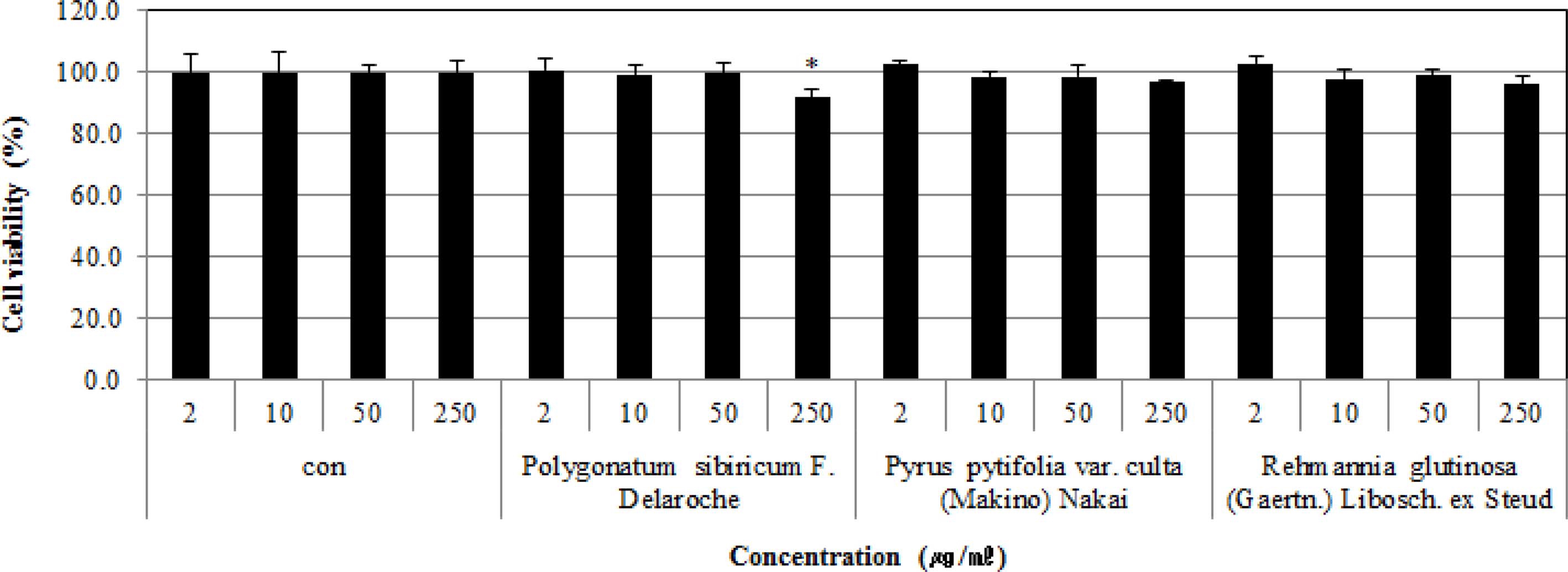
Effects of the extracts from Polygonatum sibiricum F. Delaroche (root), Pyrus pytifolia var. culta (Makino) Nakai (leaf), and Rehmannia glutinosa (Gaertn.) Libosch. ex Steud (root) on cell proliferation of HaCaT cells sensitized with TNFa and INF-g.Symbol indicates significance of the data; *p < 0.05 versus control, **p < 0.01 versus control, ***p < 0.001 versus control.
또한, 선발된 3 종 시료가 피부각질세포 (HaCaT)에서 TNF-α 및 INF-γ로 자극한 후 TNF-α의 mRNA 발현정도를 RT-PCR로 분석한 결과, 시료번호 41 (층층갈고리둥굴레, P. sibiricum, root)의 relative fold change가 각각 18.4 ± 1.4, 19.4 ± 1.4, 17.6 ± 2.1 및 9.6 ± 1.2로서 각각 10.3, 5.2, 14.1 및 53.0%의 저해효과를 나타내었다.
시료번호 42 (배나무, P. pyrifolia var. culta, leaf)는 19.6 ± 1.2, 18.1 ± 1.6, 13.7 ± 0.3 및 5.5 ± 2.6의 relative fold change를 나타내 각각 10.2, 17.0, 37.3 및 74.7%의 저해효과 를 나타내었고, 시료번호 44 (지황, R. glutinosa, root)는 19.6 ± 2.1, 18.4 ± 1.4, 22.3 ± 2.9 및 8.7 ± 1.5의 값을 나타내 각각 11.5, 17.0, −0.6 및 60.6%의 저해효과를 나타내었다.
이러한 결과 중에서 특히, 시료번호 42 (배나무, P. pyrifolia var. culta, leaf)는 농도-의존적으로 유의하게 감소하는 경향을 나타내었으며 이는 2, 10, 50, 250㎍/㎖에서 각각 10.2, 17.0, 37.3 및 74.7%의 감소효과를 나타내었다 (Fig. 5).
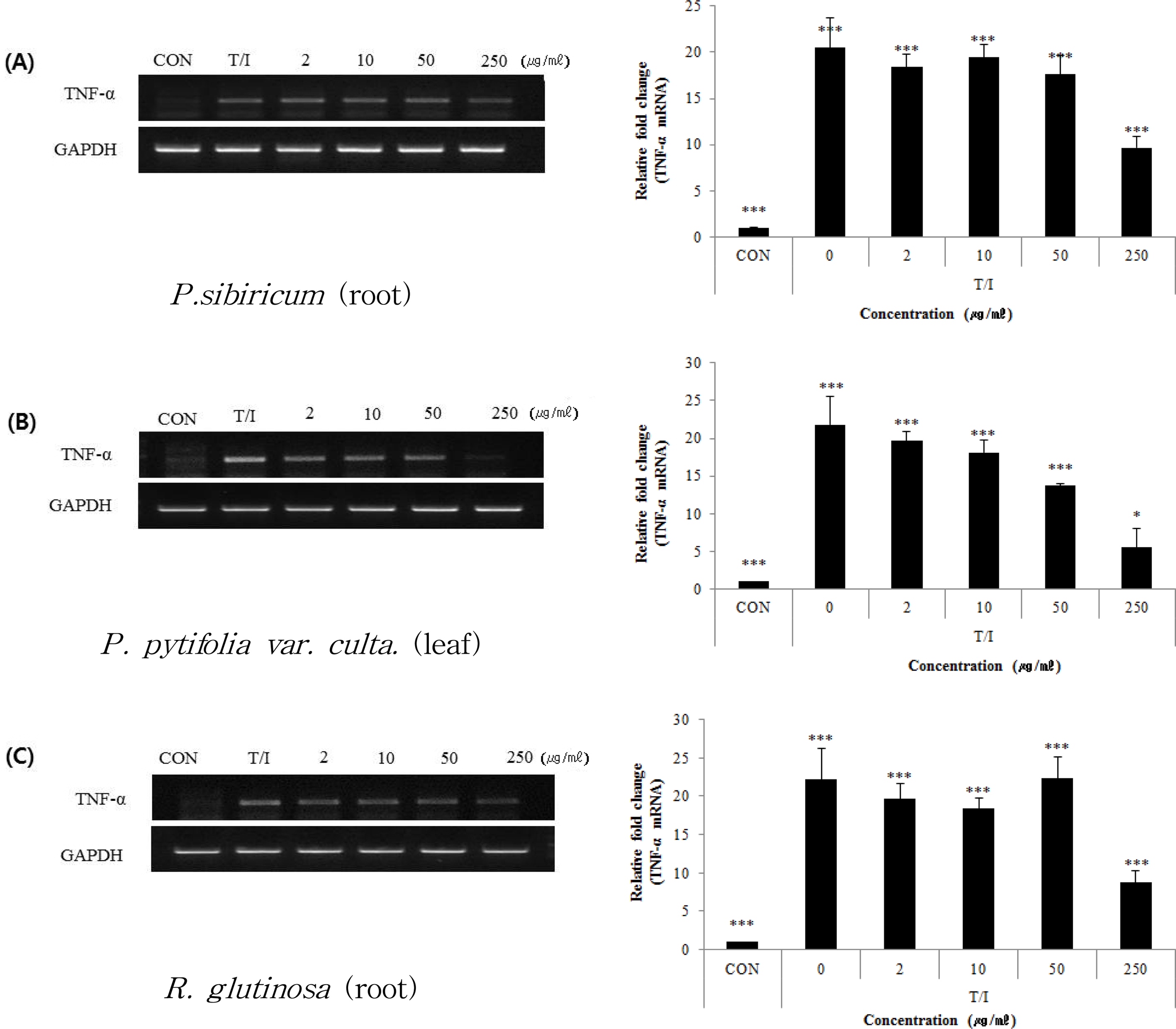
Effects of the extracts from Polygonatum sibiricum F. Delaroche (root, A), Pyrus pytifolia var. culta (Makino) Nakai (leaf, B), and Rehmannia glutinosa (Gaertn.) Libosch. ex Steud (root, C) on mRNA expression of TNF-α (b) of HaCaT cells sensitized with TNF-a and INF-g.Symbol indicates significance of the data; *p < 0.05 versus control, **p < 0.01 versus control, ***p < 0.001 versus control.
따라서, HaCaT에서 세포증식에 대한 효과와 TNF-α mRNA 발현 정도를 분석한 결과를 종합하면 3 가지 선발 식물 중에서 는 시료번호 42 (배나무, P. pyrifolia var. culta, leaf)가 가장 효과적으로 항알러지성 반응을 저해할 것으로 사료되었다.
본 연구에서는 선발된 3 종 시료가 사람의 T림프구세포인 Jurkat T cell에 대해 나타내는 세포증식율에 대한 영향을 확 인하기 위해 IL-2 발현정도를 실험하였다.
그 결과, 2 - 250 ㎍/㎖의 처리농도에서 3 가지 시료 모두 97.7 ± 1.9 - 105.0 ± 4.0%의 비교적 높은 수치를 나타내 Jurkat T cell에 대한 세포독성이 낮은 것으로 사료되었다 (Fig. 6).
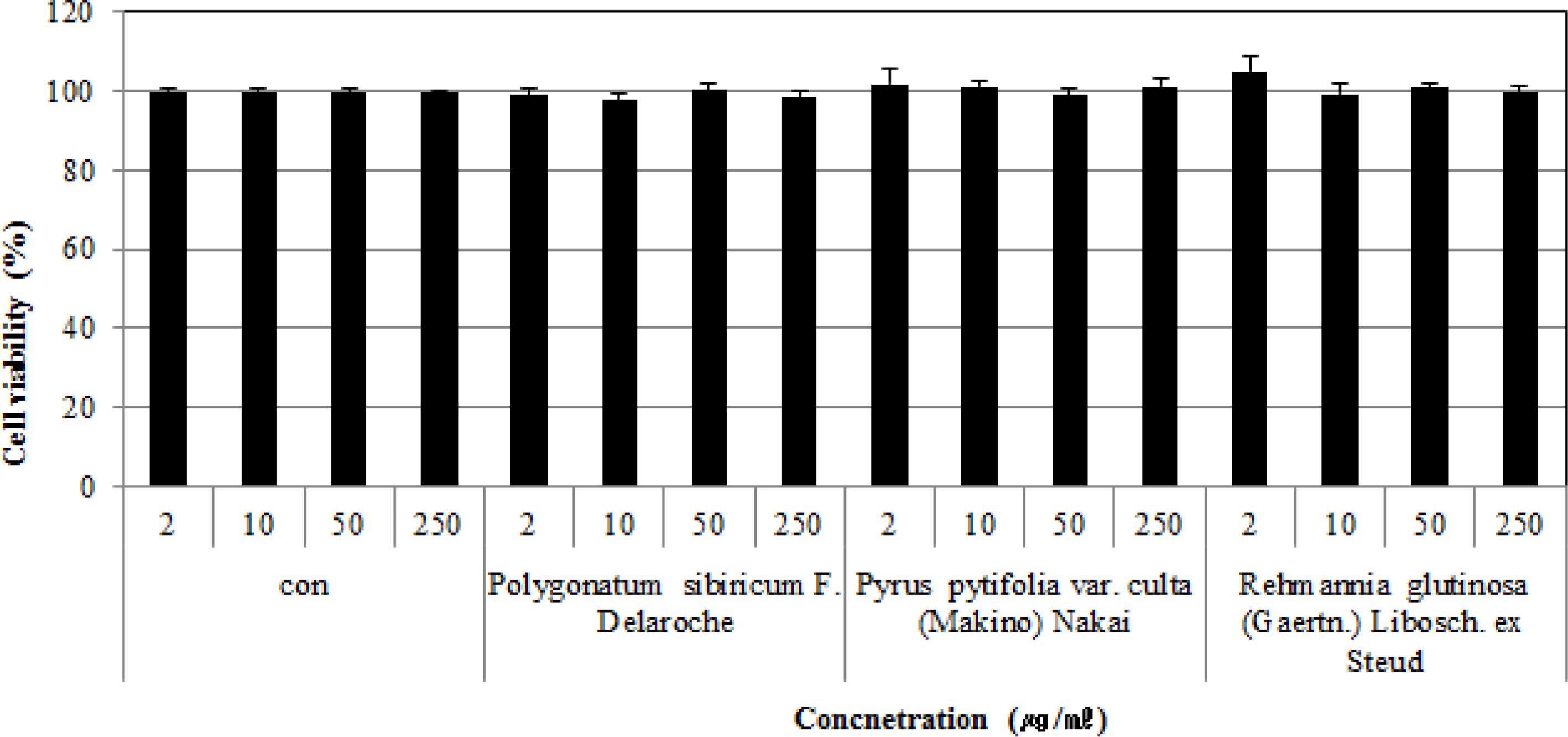
Effects of the extracts from Polygonatum sibiricum F. Delaroche (root), Pyrus pytifolia var. culta (Makino) Nakai (leaf), and Rehmannia glutinosa (Gaertn.) Libosch. ex Steud (root) on cell viability of Jurcat T cells sensitized with PMA and A23187.Symbol indicates significance of the data; *p < 0.05 versus control, **p < 0.01 versus control, ***p < 0.001 versus control.
Jurkat T세포에서의 항알러지 효과를 확인하기 위해 3 가지 시료 추출물을 각각 처리한 후 200 nM PMA와 1 μM A23187 로 자극하여 변화되는 IL-2mRNA 발현 정도를 측정하였다.
그 결과, 시료번호 41 (층층갈고리둥굴레, P. sibiricum, root) 의 relative fold change는 7,287.8 ± 616.8, 5,644.7 ± 740.8, 5,216 ± 245.8 및 2,501.8 ± 1,210.8로서 –12.8, 12.6, 19.3 및 61.3%의 저해효과를 나타내었다. 시료번호 42 (배나무, P. pyrifolia var. culta, leaf)의 경우는 7,015.0 ± 879.0, 5,281.7 ± 1,055.1, 3,081.0 ± 70.1 및 590.9 ± 13.7.8의 값을 보여 각각 –8.6, 18.2, 52.3 및 90.9%의 저해효과를 보였다.
또한, 시료번호 44 (지황, R. glutinosa, root)는 6,290.8 ± 251.6, 4,266.5 ± 1,934.3, 6,421.0 ± 1,230.7 및 132.3 ± 188.6 으로 나타나 각각 2.6, 34.0, 0.6 및 98.0%의 저해율을 보였 다. 이러한 결과를 살펴볼 때 시료번호 42 (배나무, P. pyrifolia var. culta, leaf)는 처리농도에 비례하여 IL-2 mRNA 발현이 감소한 것으로 확인되었다.
이와 같이 Jurkat T세포에서의 세포증식율 및 IL-2 mRNA 발현 감소 효과를 종합하여 볼 때 시료번호 42 (배나무, P. pyrifolia var. culta, leaf)가 가장 효과적으로 Jurkat T세포에 서의 과민반응을 완화하는 효과를 나타낼 것으로 사료되었다 (Fig. 7).
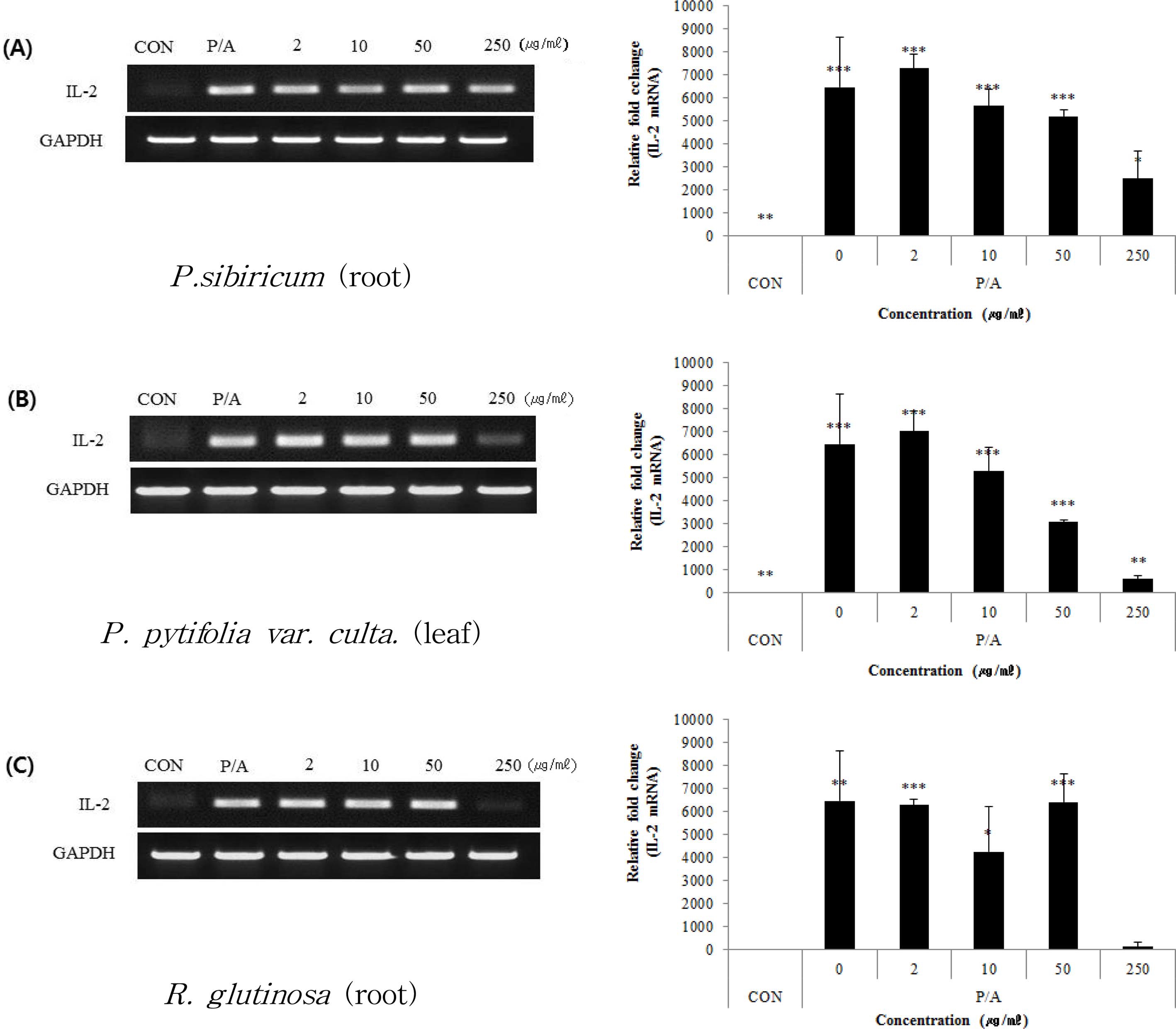
Effects of the extracts from Polygonatum sibiricum F. Delaroche (root, A), Pyrus pytifolia var. culta (Makino) Nakai (leaf, B), and Rehmannia glutinosa (Gaertn.) Libosch. ex Steud (root, C) on mRNA expression of IL-2 (b) of Jurcat T cells sensitized with PMA and A23187.Symbol indicates significance of the data; *p < 0.05 versus control, **p < 0.01 versus control, ***p < 0.001 versus control.
고 찰
본 연구는 먼저 랫드 호염성 류케미아 세포인 RBL-2H3 세 포주에서 항알레르기 활성을 가지는 식물자원을 탐색하기 위 해 수행하였다.
비만세포와 호염구는 IgE가 관련된 급성 알레르기 반응에서 중요한 효과 세포이고 특정 사이토카인을 생성하거나 또 다른 기전을 통해서 면역조절기능을 조절하는 데, 비만세포는 조직 에서 성숙하여 선천 및 획득면역 기전 모두에 의해 시작되는 다양한 수용체 매개 신호들에 노출되어 염증을 유발한다 (Wedmeyer et al., 2000; Brown et al., 2007).
비만세포가 발현하는 수용체인 FcεRI는 높은 친화력으로 immunoglobulin E (IgE) 항체와 결합하고 특정항원과의 세포 -결합 IgE 반응으로 사이토카인과 같은 다양한 지질매개체를 분비하게 되므로 비만세포는 급성 알레르기성 반응의 발현에 필수적인 것으로 생각되고 있다 (Williams and Galli, 2000).
알레르겐에 다시 노출되면 비만세포와 호염구에 대한 알레 르겐 특이적 IgE 결합 고친화성의 IgE 수용체 (FcεRI)의 교 차결합이 시작되며, 세포내 inositol (1,4,5)-triphosphate (IP3) 와 Ca2++ levels 증가로 이어지는 Syk tyrosine kinase와 phospholipase Cγ (PLCγ)의 자극이 이루어지고, 탈과립과 매 개물질의 분비가 일어나고, 비만세포 탈과립의 가장 결정적인 세포신호로서 세포질의 Ca2++ levels 증가가 관찰된다 (Nishida et al., 2005; Cheng et al., 2013).
TNF-α는 활성화된 비만세포에서 알러지 반응에 의해 방출 되는 사이토카인 중의 하나로서 발현되는 양을 통해서 알러지 반응의 정도를 예상할 수 있다 (Kim et al., 2011).
또한, 비만세포에서 유도된 히스타민, TNF-α, interleukin (IL-1β, IL-6) 같은 향염증성 사이토카인은 알레르기성 가려움 과 염증을 유발하여 피부질환의 발병에서 핵심적 역할을 하게 되므로 사람의 피부각질세포인 HaCaT cell에 대해 선발된 3 종 시료가 나타내는 세포독성 유무를 확인하기 위한 실험을 수행하였다 (Zeng et al., 2016).
한편, 다양한 기능을 통해 획득면역에 기여하는 T cell 중에 서 Th1, TH2, Tregs, Th17 등과 같은 effector subtype으로 분화되는 cluster of differentiation (CD)+ T 림프구는 염증반 응 자가면역 및 과민반응 등에도 기여하는 데, IL-2 발현은 T-cell antigen receptor (TCR)이 CD3 receptor를 거쳐 운반 되는 신호와 더불어 활성화된 신호경로에 의해 이루어진다.
생성된 IL-2는 다시 T cell 증식을 촉진하며 p21ras 경로의 활성화에 이어지는 여러 경로를 통해 IL-2 gene promoter를 활성화시키고 TCR 신호는 nuclear factor kappa-light chainenhancer of activated B cells (NF-κB)와 nuclear factor of activated T-cells (NFAT)의 핵으로 전위 등을 통해 IL-2의 발 현을 조절한다 (Xu et al., 2016).
본 연구에서 살펴본 바와 같이 56 개의 식물 추출물에 대 하여 탈과립화된 RBL-2H3 cell에서 IL-4 분비 저해, β- hexosaminidase 방출 저해 및 세포증식율을 분석함으로써 3 개의 식물 추출물 [시료번호 41 (층층갈고리둥굴레, P. sibiricum, root), 시료번호 42 (배나무, P. pyrifolia var. culta, leaf) 및 시료번호 44 (지황, R. glutinosa, root)]을 선발하였 고, 이들 3 종 시료를 RBL-2H3 세포, HaCaT 세포 및 Jurkat T세포에서 여러 농도로 처리한 후, 알레르기 관련 지표 (β-hexosaminidase 방출, IL-4 분비, TNF-α mRNA 발현, IL-2 mRNA 발현) 및 세포증식에 미치는 영향을 분석하였다.
그 결과, RBL-2H3 세포에서는 시료번호 44 (지황, R. glutinosa, root)의 처리농도-의존적으로 활성을 저해하는 것을 알 수 있었고 HaCaT 세포 및 Jurkat T 세포에서는 모두 시 료번호 42 (배나무, P. pyrifolia var. culta, leaf)가 가장 효과 적으로 항알러지 효과를 발휘하는 것으로 확인되었다.
이처럼 세포주에 따라 선발한 식물추출물의 효과가 다른 것은 각 시료가 효과를 발휘하는 target 세포의 차이에 따른 것으로 사료되는 바, 추후 보다 상세한 연구가 진행될 필요가 있다고 사료되었다.
감사의 글
본 연구는 농촌진흥청 연구사업(과제번호: PJ01193203)의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
- H.J. Ban, D.I. Park, K.H. Kang, Inhibitory effect of Artemisiae asiaticae herba on degranulation, production of cytokine, and FcI RI expression in RBL-2H3 cells., Dongui Saengli Byeongli Haghoeji, (2012), 26, p915-921.
-
J.M. Brown, T.M. Wilson, D.D. Metcalfe, The mast cell and allergic disease: Role in pathogenesis and implications for therapy., Clin. Exp. Allergy, (2007), 38, p4-18.
[https://doi.org/10.1111/j.1365-2222.2007.02886.x]

-
C. Cheng, D.S.W. Ng, T.K. Chan, S.P. Guan, W.E. Ho, A.H.M. Koh, J.S. Bian, H.Y.A. Lau, W.S.F. Wong, Anti-allergic action of anti-malarial drug artesunate in experimental mast cell-mediated anaphylactic models., Allergy, (2013), 68, p195-203.
[https://doi.org/10.1111/all.12077]

-
J.K. Choi, Y.H. Jang, S. Lee, S.R. Lee, Y.A. Choi, M. Jin, J.H. Choi, J.H. Park, P.H. Park, H. Choi, T.K. Kwon, D. Khang, S.H. Kim, Chrysin attenuates atopic dermatitis by suppressing inflammation of keratinocytes., Food Chem. Toxicol, (2017), 110, p142-150.
[https://doi.org/10.1016/j.fct.2017.10.025]

-
Y.J. Jeong, Y.J. Yang, S.C. Kang, Constituent alterations of Pueraiae radix and lacquer tree mixture extract and their anti-allergic effects., Korean Journal of Plant Research, (2013), 26, p103-110.
[https://doi.org/10.7732/kjpr.2013.26.1.103]

-
E.M. Jung, J.W. Kim, M.J. Park, S.S. Lee, D.H. Choi, J.B. Lee, E.B. Jeung, Inhibitory effect of extracts from Rbododendron Brachycarpum and Abies Koreana E. H. Wilson on degranulation and cytokine expression in RBL-2H3 cells., Journal of Korean Wood Science and Technology, (2013), 41, p551-558.
[https://doi.org/10.5658/wood.2013.41.6.551]

- J.K. Jung, Y.K. Park, Effect of modified- Okbyungpoongsan on mast cell-mediated allergic responses in RBL-2H3 mast cells., Korean Journal of Herbology, (2011), 26, p1-7.
-
K.H. Kang, S.Y. Lee, Inhibitory effect of Fagopyrum esculentum on degranulation and production of cytokine in RBL- 2H3 cells., Journal of Korean Oriental Medical Ophthalmology and Otolaryngology and Dermatology, (2012), 25, p1-12.
[https://doi.org/10.6114/jkood.2012.25.3.001]

-
T. Kawakami, T. Ando, M. Kimura, B.S. Wilson, Y. Kawakami, Mast cells in atopic dermatitis., Curr. Opin. Immunol, (2009), 21, p666-678.
[https://doi.org/10.1016/j.coi.2009.09.006]

-
Y.J. Kim, S.J. Park, T.J. Kim, Anti-allergic effects of nodakenin in IgE/Ag-induced type I hypersensitivity., J. Life Sci, (2011), 21, p1721-1725.
[https://doi.org/10.5352/jls.2011.21.12.1721]

- Y.M. Kim, The inhibitory effect of Agrimonia pilosa Ledeb extract on allergic reaction., Hanguk Yakyong Changmul Hakhoe Chi, (2010), 18, p398-404.
-
J.H. Lee, S.H. Mun, N.Y. Ko, J.W. Kim, D.K. Kim, J.D. Kim, E. Her, W.S. Choi, Roles of Src-family kinase isoforms, Lyn, Fyn, Fgr, and c-Src on degranulation in RBL-2H3 mast cells., J. Life Sci, (2007), 17, p350-355.
[https://doi.org/10.5352/jls.2007.17.3.350]

-
JS Lee, IS Kim, JH Kim, JS Kim, SH Kim, CY Yun, Suppressive effects of Houttuynia cordata Thunb (Saururaceae) extract on Th2 immune response., Journal of Ethnopharmacology, (2008), 117, p34-40.
[https://doi.org/10.1016/j.jep.2008.01.013]

-
Y.S. Lee, J.K. Han, Y.H. Kim, Anti-allergic effects of Gagam-YangGyeokSan on RBL-2H3 mast cells and OVA/alumsensitized mice., Journal of Korean Orient Pediatrics, (2012), 26, p10-23.
[https://doi.org/10.7778/jpkm.2012.26.4.010]

-
H.B. Lim, S.H. Kim, Antiasthmatic effects on Scutellaria baicalensis Georgi extracts against airway inflammation and hyperreponsiveness induced by diesel exhaust particles with ovalbumin sensitization., Hanguk Yakyong Changmul Hakhoe Chi, (2012), 20, p129-135.
[https://doi.org/10.7783/kjmcs.2012.20.2.129]

- J.H. Lyu, H.J. Yoon, S.H. Hong, W.S. Ko, Xanthium strumarium suppresses degranulation and pro-inflammatory cytokines secretion on the mast cells., Journal of Korean Oriental Medical Ophthalmology and Otolaryngology and Dermatology, (2008), 21, p82-93.
-
B.R. Na, H.R. Kim, M.S. Kwon, H.S. Lee, I. Piragyte, E.J. Choi, H.K. Choi, W.C. Han, S.H. Lee, C.D. Jun, Aplotaxene blocks T cell activation by modulation of protein kinase C-I,-dependent pathway., Food Chem. Toxicol, (2013), 62, p23-31.
[https://doi.org/10.1016/j.fct.2013.08.016]

- K. Nishida, S. Yamasaki, Y. Ito, K. Kabu, K. Hattori, T. Tezuka, H. Nishizumi, D. Kitamura, R. Goitsuka, R.S. Geha, T. Yamamoto, T. Yagi, T. Hirano, FcI RI-mediated mast cell degranulation requires calcium-independent microtubule-dependent translation of granules to the plasma membrane., J. Cell Biol, (2005), 170, p115-126.
- S.B. Park, K.H. Kang, H.J. Yoon, W.S. Ko, Inhibitory effect of Ulmus davidiana on I -hexosaminidase release and cytokine production in RBL-2H3 cells., Journal of Korean Oriental Medical Ophthalmology and Otolaryngology and Dermatology, (2011), 24, p86-95.
- S.N. Pyo, E.H. Sohn, Introduction to immunology, Seoul, Korea, Shinilbooks, (2008), p253-259.
-
J. Wedemeyer, M. Tsai, S.J. Galli, Roles of mast cells and basophils in innate and acquired immunity., Curr. Opin. Immunol, (2000), 12, p624-631.
[https://doi.org/10.1016/s0952-7915(00)00154-0]

-
C.M.M. Williams, S.J. Galli, The diverse potential effector and immunoregulatory roles of mast cells in allergic disease., J. Allergy Clin. Immunol, (2000), 105, p847-859.
[https://doi.org/10.1067/mai.2000.106485]

- H. Wu, H. Qi, D. Iwasaki, B. Zhu, Y. Shimoishi, Y. Murata, Y. Nakamura, JNK-dependent NFATc1 pathway positively regulates IL-13 gene expression induced by ( ?")-epigallocatechin -3-gallate in human basophilic KU812 cells., Free Radic. Biol. Med, (2009), 47, p1028-1038.
-
C. Xu, A.R. Wyman, M.A. Alaamery, S.A. Argueta, F.D. Ivey, J.A. Meyers, A. Lerner, T.H. Burdo, T. Connolly, C.S. Hoffman, T.C. Chiles, Anti-inflammatory effects of novel barbituric acid derivatives in T lymphocytes., Int. Immunopharmacol, (2016), 38, p223-232.
[https://doi.org/10.1016/j.intimp.2016.06.004]

-
H.R. Zeng, B. Wang, Z. Zhao, Q. Zhang, M.Y. Liang, Y.Q. Yao, K. Bian, W.R. Zhang, Effects of Viola yedoensis Makino anti-itching compound on degranulation and cytokine generation in RBL-2H3 mast cells., J. Ethnopharmacol, (2016), 189, p132-138.
[https://doi.org/10.1016/j.jep.2016.05.030]
