
Sprague-Dawley Rats을 이용한 결명자 물 추출물의 26주 반복 경구투여 독성시험 및 4주 회복시험
†Corresponding author: (Phone) +08-61-860-2873E-mail) thej01234@gmail.com
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Cassia tora L., an annual or perennial plant of the Fabaceae family, is traditional medicine with various biological activities, including anti-constipation and, anti-inflammation. Chemical compounds such as anthraquinone glycoside and naphthalene derivatives have been isolated from this plant. Cassia tora L. is a common contaminant of agricultural commodities, but is toxic to cattle and poultry.
To investigate the potential toxicity, Cassia tora L. aqueous extract (CO) was administered orally to rats for 26 weeks at 0 (control), 300, 1,500 and 3,000㎎/㎏/day (n = 10 for male rats for each dose). The positive control comprised animals orally administered anthraquinone 100㎎/㎏/day. There was no treatment-related mortality. An increase in the kidney weight was observed at 3,000㎎/㎏/day of CO and anthraquinone 100㎎/㎏/day. Macrophage infiltration in the colon was observed at CO 1,500 and 3,000㎎/㎏/day and anthraquinone 100㎎/㎏/day, but there were no significant toxicological changes in the incidence and severity of the finding.
The oral no-observed-adverse-effect level (NOAEL) of CO was 3,000㎎/㎏/day in male rats and no target organs were identified. In addition, 300㎎/㎏ was found to be the no-observed-effect level (NOEL) for systemic toxicity under the conditions of the study.
Keywords:
Cassia tora L., Herbal Medicine, Anthraquinone, Chronic Toxicity, NOEL (No Observed Effect Level)서 언
결명자 (Cassia tora L.)는 콩과 (Leguminosae)에 속하는 초본식물이며 아시아, 오스트레일리아, 아프리카를 포함해 전 세계적으로 흔히 분포되어 있는 식물이다 (Parson and Cuthbertson, 1992). 우리나라에서 사용되는 결명자 (決子, Cassiae semen)는 결명과 초결명 (Cassia obtusifolia L.)의 종 자를 칭하지만, 우리나라에선 초결명의 종자보다 결명의 종자 를 많이 사용한다고 알려져 있다 (Hong et al., 2012).
결명자는 anthraquinone 계열 화합물인 emodin과 alaternin, cassiaside, rubrofusarin 같은 여러 성분을 포함하고 있는 것으 로 알려져 있다 (Choi et al., 1994, 1996, 1997). 결명자에서 분리된 anthraquinone 계열 화합물인 aurantio-obtusin은 아낙 필라시스 모델에서 알레르기반응을 억제하는 것으로 알려져 있으며 (Kim et al., 2015), chrysophanol 과 physcion은 콜 레스테롤과 중성지방 수치를 감소시킨다 (Wei et al., 2012). 또한 결명자 물 추출물은 loperamide로 유도된 변비를 개선시 키고 (Nho et al., 2016), 항산화 효과 (Yen and Chung, 1999; Yen and Chuang, 2000)를 가지는 것으로 알려져 있으 며 에탄올추출물은 신경세포 보호효과 (Kim et al., 2007, 2009; Yi et al., 2016), 간 보호활성 (Luo et al., 2011), 고 지혈증 개선 효과 (Liu et al., 2009)에 대한 효능 연구가 진 행되고 있다.
예로부터 현재까지 결명자를 포함한 수많은 한약재들은 민 간요법으로 많이 이용되고 있다. 하지만 일부 한약재들은 잠 재적인 독성을 가지고 있어 고농도의 한약재추출물을 장기간 복용하는 경우 건강에 영향을 미칠 수 있으나 현재까지 독성 및 안전성에 대한 연구는 미흡한 실정이다 (Kim et al., 2008).
현재까지 황기, 향부자, 회향목, 상지, 원지 등 여러 자원식 물을 대상으로 하는 독성시험이 활발하게 진행되고 있으며 (Oh et al., 2006; Park et al., 2013; Han et al., 2013, 2015, 2016), 초결명자는 랫드사료에 5%의 비율로 혼합하여 공급하였을 경우 암수 모두 백혈구와 혈소판 증가, 빈혈 또는 골수 과다 형성이 관찰된다고 보고되어있지만 (Voss and Brennecke, 1991), 물 추출물을 5,000㎎/㎏의 농도로 단회 투여 독성시험을 했을 때 독성이 나타나지 않았다 (Ayodele et al., 2015).
석결명자 (Cassia occidentalis seed)는 볶거나 열수에 침지 하여 추출하지 않았을 때 마우스에서 아만성 독성 (subchronic toxicity)이 나타나는 것으로 알려져 있고 (Essa’a and Medoua, 2013), 물 추출물은 랫드에게 투여했을 때 2,000㎎/㎏의 농도에선 2 개월부터 체중감소가 나타나며, 1,300㎎/㎏의 농도로 5 개월 이상 반복투여 했을 때 대장에 서 흑색색소가 나타난다 (Nadai et al., 2003).
하지만 결명자 (Cassia tora L.)에 대한 일반독성 평가는 아직까지 이루어지지 않았으며, 이에대한 안전성 자료는 생리 및 약리학적 효능 이전에 더욱이 중요하다고 할 수 있다.
이에 따라 본 연구는 결명자 물 추출물의 안전성평가 일환 으로 26 주 반복 경구투여시 나타날 수 있는 독성의 질적, 양 적인 평가를 위해 “의약품 등의 독성시험관리기준 (식품의약 품안전처 고시 제 2014-136호)”에 따라 26 주 동안 경구투여 독성시험 및 4 주 회복 시험을 진행하였으며 결명자에 대한 일반 독성의 특성을 평가하였다.
재료 및 방법
1. 실험 재료, 추출물의 제조 및 투여
실험에 사용한 결명자 (Cassia tora L.)는 경상북도 영주시 에서 채취한 것으로 대림약초 (Jecheon, Korea)에서 구입한 뒤 동신대학교 한의과대학 정종길교수님의 식물학적 동정을 거쳐서 사용하였고 시료의 확증표본은 한약진흥재단 한약자원 본부에 보관하고 있다.
결명자는 멸균수로 수세한 뒤, 50℃ 온도에서 건조기를 이 용해 일주일간 건조하였다. 건조된 결명자는 믹서를 이용해 분 쇄하여, 증류수를 시료 무게의 10 배를 넣고 환류 냉각추출방 법을 통해 50℃ 조건에서 3 시간 동안 3 회 반복하여 추출하 였다. 추출물은 15㎝ fluted qualitative filter paper circles (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이 용하여 여과하고, 여과액을 동결 건조하여 시료를 phosphate buffered saline (PBS, pH 7.4)에 녹인 뒤 사용하였다.
동물은 실험군 당 10 마리씩을 배치하여 실험군을 분류하 였다. 정상대조군, 저농도 결명자 물추출물 투여군 (결명자 물 추출물, 300㎎/㎏), 중농도 결명자 물추출물 투여군 (결명자 물추출물, 1,500㎎/㎏), 고농도 결명자 물추출물 투여군 (결명 자 물추출물, 3,000㎎/㎏), 안트라퀴논군 (negative control, anthraquinone, 100㎎/㎏)으로 실험군을 분리하고 매일 오전에 경구투여용 존데를 부착한 일회용 주사기를 이용하여 26 주간 1 일 1 회 위 내에 경구 투여하였다.
2. 실험동물
본 실험은 동물보호법 (제정 1991년 5월 31일 법률 제 4379호, 일부개정 2015년 1월 20일 법률 제 13023호)에 근거 한 한약진흥재단 한약자원본부의 동물실험윤리위원회에 의해 승인되었으며 (승인번호: 2016-01-01), 의약품등의독성시험기 준 (식품의약품안전청 고시 제 2014-136호), 한약 (생약)제제 비임상시험기준 (식품의약품안전청 고시 제 B1-2014-3-014호) 와 새로운 식품원료의 안전성평가 시험기준 (식품의약품안전 청 고시 제 11-1470000-002515-01호)을 기준으로 하여 실험 을 진행하였다.
실험동물은 3 주령 수컷 SD (Sprague-Dawley) 랫드를 ㈜ 오리엔트바이오 (Seongnam, Korea)에서 구입하였다. 반입 시 동물의 외관검사를 실시하고, 전자저울로 체중을 측정하였다. 5 일간의 순화기간 중에 매일 1 회 사망, 야윔, 식욕부진, 거 식, 섭취량 및 음수량, 배설상태를 포함한 일반증상을 관찰하 였고, 순화기간 종료일에 체중을 측정하고 일반증상 및 체중 변화를 확인하여 동물의 건강상태를 평가하였으며 이상 동물 은 CO2 가스 마취 하에서 안락사 시켰다.
온도 20 ± 2℃, 습도 55 ± 5%, 12 시간 명암조건 및 조도 150 - 300 Lux로 설정한 뒤 사육하고 실험동물용 고형사료인 teklad global 18% protein rodent diet (2918C, Harlan Laboratories Inc., Indianapolis, IN, USA)와 장흥군 수돗물을 필터유수살균기로 여과 후 자외선을 조사하고 자유섭취 하였다.
3. 관찰 및 검사항목
식품의약품안전청의 의약품 등의 독성시험기준을 참고하여 모든 동물에 대해 1 일 1 회 야윔, 식욕부진, 거식, 섭취량 및 음수량, 배설상태를 포함한 일반증상을 관찰하고, 1 일 2 회 빈사 및 사망동물의 유무를 확인하였다. 본시험군은 26 주 간 관찰하고, 회복군은 30 주간 관찰하였다.
모든 동물에 대하여, 투여개시일 (투여전), 투여 개시 후 주 1 회 부검일에 체중을 측정하였다. 단, 부검일의 체중은 절식 을 실시하였으므로, 체중평가에서 제외하였다.
투여개시 전의 사료섭취량은 군 분리 일부터 투여 개시 일 까지 1 일간의 섭취량을 측정하였다. 7 일간의 섭취량을 측정 하여 1 일의 평균섭취량을 산출하였다. 사료섭취량은 사육상 자 별로 측정한 후 동물수당 섭취량을 산출하였다.
각 군당 5 마리에 대하여 투여 26 주 및 회복 4 주에 뇨 검사를 실시하였다. 신선뇨 (배설 후 약 3 시간 이내의 뇨)를 수거하여, 아래 항목들의 검사를 실시하였다. 신선뇨 채취 중 에는 투여 및 사료급여를 실시하지 않고, 음수는 자유롭게 섭 취하도록 하였다.
각 군당 5 마리에 대하여 부검 전 약 18 시간 이상 절식시 킨 후, 부검일에 isoflurane으로 마취하여 배대동맥으로부터 혈 액을 채취하였다.
혈액학적 검사는 채취한 혈액 약 1㎖을 BD Vacutainer™ glass blood collection tube with K3 EDTA (Thermo Fisher Scientific Inc., Waltham, MA, USA)에 넣은 후, IDEXX ProCyte DX hematology analyzer (IDEXX Laboratories Inc., Westbrook, ME, USA)를 이용하여 적혈구수 (erythrocyte count, RBC), 혈색소량 (hemoglobin, HGB), 헤마토크리트치 (hematocrit, HCT), 평균적혈구용적 (mean corpuscular volume, MCV), 평균적혈구헤모글로빈량 (mean corpuscular hemoglobin, MCH), 평균적혈구헤모글로빈농도 (mean corpuscular hemoglobin concentration, MCHC), 혈소판수 (platelet, PLT), 백혈구수 (leucocyte count, WBC), 백혈구백분 율 (WBC differential counting)과 망상적혈구 (reticulocytes, Reti)를 측정하였다.
혈액생화학적 검사는 배 대동맥에서 채취한 혈액 중 혈액학 적 검사용 혈액을 제외한 나머지 혈액을 3,000 rpm으로 10 분간 원심분리 후 혈청을 취하여 이용하였다. 또한 lactate dehydrogenase (LDH) 및 creatine kinase (CK)의 측정은 헤 파린 함유 tube에 혈액을 넣고 3,000 rpm으로 10 분간 원심 분리 후 혈장을 취하여 이용하였다.
혈액생화학분석기인 FUJI DRI-CHEM 4000i (Fujifilm, Dokyo, Japan)과 전해질분석기 EasyLyte (Medica Co., Bedford, MA, USA)를 이용하여 alanine aminotrasferase (ALT), aspartate aminotransferase (AST), alkaline phosphatase (ALP), gamma glutamyl transpeptidase (GGT), blood urea nitrogen (BUN), creatinine (Crea), total bilirubin (T-Bili), total protein (TP), chloride (Cl), sodium (Na)과 potassium (K)을 측정하였다.
부검시 군당 5 마리의 수컷에 대하여 정자검사를 실시하 였다. 부검시 가능한 신속하게 좌, 우 부고환을 적출하여 중 량을 측정한 후 우측 부고환은 조직병리학적 검사용으로 고 정하였다.
좌측 부고환은 미부를 정체하여 1% bovine serum albumin (BSA)가 포함된 Dulbecco’s phosphate buffered saline pH 7.4 (DPBS)에 넣어 약 10 분간 배양한 후, 적절한 정자농도 로 희석하여 마이크로피펫으로 취해 슬라이드에 도말한 후 Diff-Quick으로 염색하여 현미경으로 관찰하였다. 총 200 개의 정자 중 기형정자수를 계수하여 정자기형률을 산출하였다.
정자기형률 (%) = (기형정자수 / 총 정자수) × 100
사망 및 빈사동물, 모든 생존동물에 대해서 전신의 장기 조 직에 대해 상세한 육안검사를 실시하였다.
각 군당 5 마리에 대하여 다음의 장기에 대한 습중량을 측 정하고, 절식체중에 대한 상대 장기 중량비를 산출하였다. 좌 우가 있는 장기는 좌우를 합하여 무게를 측정하였다.
부검을 실시한 모든 동물에 대하여 신장과 맹장 같은 장기 조직을 적출하여 10% neutralized buffered formalin pH 7.1 (10% NBF, 중성완충포르말린용액, Thermo Fisher Scientific Inc., Waltham, MA, USA)에 고정하고, 그 중 고환은 davidson hartman’s fixative solution (Sigma-Aldrich Co., St. Louis, MO, USA)에 고정하였다.
고정한 장기 조직은 삭정, 탈수 및 파라핀 포매등의 일반적 인 조직처리과정을 거쳐 조직절편을 제작하여 박절한 후, H&E (hematoxylin & eosin) 염색을 실시하였다.
4. 통계처리
실험에서 얻어진 체중, 사료섭취량, 뇨량, 혈액학적 검사, 혈 액생화학적 검사, 장기중량 결과는 분산의 동질성을 평가하기 위해 Levene’s 검사를 실시한 후, 일원변량분석 (One-way ANOVA) 검사를 하여 유의성 (유의수준: 5%)을 조사하였다.
분산의 동질성 및 시험군간 유의성이 인정된 경우, 사후검정 으로 Scheffe 다중검정 (유의수준: 양측 5% 및 1%)을 실시하 였고 분산이 이질적이며 시험군간 유의성이 인정된 경우 사후 검정으로 Dunnett’s T3 다중검사 (유의수준: 양측 5% 및 1%)를 실시하였다.
모든 통계분석은 SPSS 통계 프로그램 (Statistical Package for Social Science Inc., Chicago, IL, USA)을 이용하여 수행 하였다.
결 과
1. 일반 증상
결명자 (Cassia tora L.)추출물 투여군 (CO 300, CO 1500 또는 CO 3000) 및 안트라퀴논 투여군은 사망동물이 발 생하지 않았다.
체중감소, 식이량 및 음수량 감소와 같은 일반증상은 나타 나지 않았지만 배설과 관련하여 연변 (soft stool)이 결명자 (CO) 1,500 및 3,000㎎/㎏/day 투여군에서 투여 16 - 26 주 에 5 - 10 례, 안트라퀴논 100㎎/㎏/day 투여군에서 투여 17 - 26 주에 1 - 4 례에서 산발적으로 관찰되었으나 결명자 300㎎/㎏/day 투여군에선 발생하지 않았다. 이러한 변화는 시 험물질의 과량적용에 의한 변화로 사료되며, 독성학적인 의미 는 없는 것으로 판단된다 (Table 1).
2. 체중 변화
결명자 추출물 경구투여 26 주 및 4 주 회복기간 동안 실 험동물들의 평균체중을 측정하였을 때, 결명자 추출물 투여군 (CO 300, CO 1500 또는 CO 3000)에서 대조군과 비교 시 유의성 있는 체중변화는 관찰되지 않았다. 하지만 안트라퀴논 100 ㎎/㎏/day 투여군에서 투여 6 주부터 회복 4 주까지 대 조군과 비교 시 유의성 (p < 0.05)있는 체중 감소가 관찰되었 다 (Fig. 1A, Table 2-1, Table 2-2).
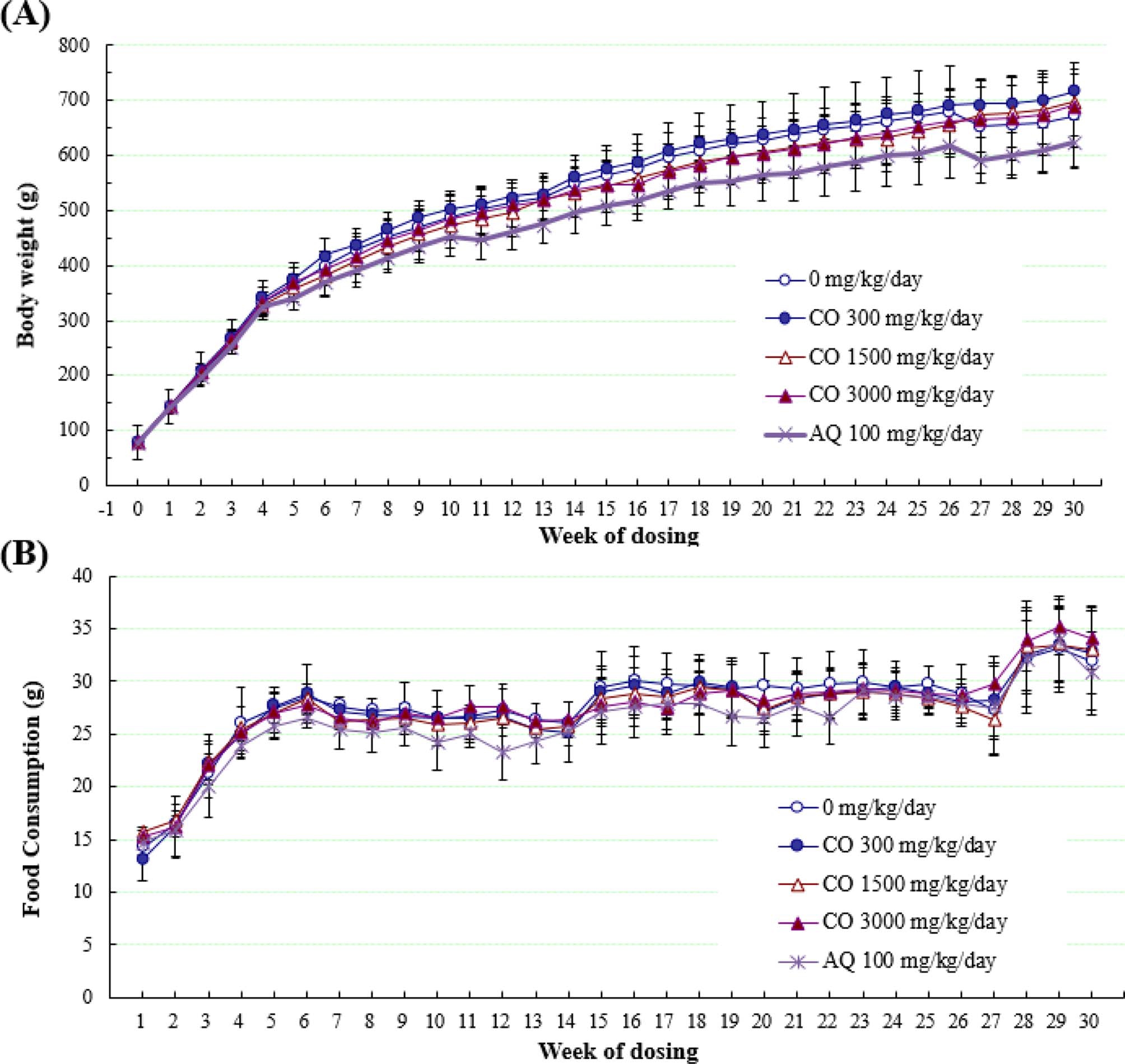
Body weights and food consumptions in male rat treated with Cassia tora L. extract and anthraquinone for 30 weeks.(A); body weights of male SD rats. (B); food consumptions of male SD rats. AQ; anthraquinone, CO 300㎎/㎏/day; aqueous extract of Cassia tora L. (300㎎/㎏/day), CO 1,500㎎/㎏/day; aqueous extract of Cassia tora L. (1,500㎎/㎏/day), CO 3,000㎎/㎏/day; aqueous extract of Cassia tora L. (3,000㎎/㎏/day).

Change in body weights of male rat treated with Cassia tora L. extract and anthraquinone for 26 weeks. Sex; Male

Change in body weights of male rat treated with Cassia tora L. extract and anthraquinone for weeks of recovery. Sex; Male (g)
안트라퀴논은 카스카라사그라다, 프랑굴라, 센나, 결명자 등 에 포함되어있는 식물 유래 화합물로 알려져 있으며 (Hardman and Limbrid, 1995), 안트라퀴논을 랫드에 938 ppm 이상의 농도로 식이 했을 때, 2 주째부터 체중을 저하시 킨다고 알려져 있다 (Dodd et al., 2013). 따라서 안트라퀴논 투여군의 체중감소는 안트라퀴논 섭취에 의한 유의적인 체중 감소로 보이며, 결명자의 투여가 체중에 대한 영향을 미치지 않는 것으로 사료된다.
3. 사료 섭취량
결명자 추출물 투여군 및 안트라퀴논 투여군의 평균사료섭 취량은 대조군과 비교시 유의성 있는 사료섭취량 변화는 관찰 되지 않았다. 모든 시험군은 연령증가에 따라 상승하는 경향 을 나타내었으며 26 주째에 주당 평균사료섭취량이 26.3 - 29.7 g의 섭취량을 보였다 (Fig. 1B, Table 3-1, Table 3-2). 이에 따라 결명자의 투여와 100㎎/㎏/day 농도의 안트라퀴논 투여가 식이섭취량에 대한 영향을 미치지 않는 것으로 사료된다.

Change in mean food consumption of male rat treated with Cassia tora L. extract and anthraquinone for 26 weeks. Sex; Male
4. 뇨 검사
결명자 추출물 투여 시 1,500 또는 3,000㎎/㎏/day 농도에 서 소변 속 포도당 (glucose)이 증가됨이 관찰되었고, 결명자 추출물 투여할수록 케톤체 (ketone body)가 증가되며 sepcific gravity (비중)가 감소되는 결과를 나타냈다. 소변의 pH는 정 상에 비해 증가하는 경향처럼 보이는데 이는 유의적인 차이가 없었을 뿐만 아니라 빌리루빈 (bilirubin), 우로빌리노겐 (urobilinogen)및 아질산염 (nitrite)수치가 대조군과 비교 시 증 가가 관찰되었다.
하지만 이와 같은 변화들은 용량의존성이 없을 뿐만 아니라 정상대조군에 비해 큰 차이가 나지 않으며 (Table 4-1), 회복 군 (Table 4-2) 및 신장 조직병학적검사에서 이상변화가 관찰 되지 않아서 (Table 11) 뇨에 존재하는 시험물질의 색소에 의 한 것으로 사료된다.
5. 혈액학적 검사
부검시 채취한 혈액에 대해 혈액학적 검사를 시행한 결과 모든 시험물질 투여군에서 호산구 (EOS, eosinophil)수치가 대 조군과 비교시 유의성 (p < 0.05)있는 감소가 관찰되었지만, 다 른 수치에 대한 변화는 나타나지 않았다 (Table 5-1).
정상대조군에서 총 백혈구중 호산구의 수치는 1.50 ± 0.42% 로 나타났다. 이에 비해 CO 1500 실험군은 0.80 ± 0.16%, CO 3000 실험군은 0.84 ± 0.29%, 안트라퀴논 투여군은 0.80 ± 0.23%로 확인되었으며, 이는 유의적인 감소가 나타났지만 경 미한 변화로 독성학적 의미는 가지지 않는 것으로 사료 된다 (Table 5-1).
4 주간 회복주기를 거친 뒤 CO 300 실험군에서 적혈구 (RBC)수치가 유의적으로 증가하고 모든 실험군에서 백혈구 (WBC)수치의 변화가 관찰되었지만 이는 유의적인 차이가 없 었다. 이들 결과를 종합하였을 때 이러한 변화는 경미한 변화 로서 독성학적 의미는 없다고 사료된다. (Table 5-2).
6. 혈액생화학적 검사
부검시 채취한 혈청을 이용해 혈액생화학적 검사를 수행한 결과 정상대조군은 ALP (alkaline phosphatase) 수치가 392.2 ± 79.9 U/ℓ로 나타났고 CO 1500 실험군이 310.4 ± 27.0 U/ℓ, 안트라퀴논 투여군이 288.8 ± 28.9 U/ℓ로 대조군에 비해 유의 적으로 감소하였지만, AST (aspartate aminotransferase), ALT (alanine aminotrasferase), BUN (blood urea nitrogen), CRE (creatinine), GGT (γ-glutamyl transferase) 및 전해질 (Na, Cl and K)은 차이가 나타나지 않았다 (Table 6).
ALP는 간이 손상되었을 때 수치가 증가한다고 흔히 알려져 있으며 감소하는 경우는 매우 드물다, 더욱이 결과에서 나타 난 감소된 ALP 수치는 정상대조군에 비례해 경미한 변화로서 독성학적 의미는 없다고 사료된다. (Table 6).
7. 정자검사
실험동물 부검시 정자를 채취하여 정자의 형태를 (bent neck, bent midpiece, tail coil, small tail, head separation, midpiece separation, tail separation) 확인해본 결과 부고환 미부 내의 정자기형률은 정상대조군이 3.1 ± 0.9%로 나타났으 며 결명자 추출물 투여군 (CO 300, CO 1500 및 CO 3000 은 각각 2.3 ± 0.6%, 2.7 ± 1.3%, 2.7 ± 0.8%로 안트라퀴논 투 여군은 2.9 ± 1.1%로 나타났다 (Table 7).
이러한 결과를 종합해볼 때, 정상대조군과 비교하여 결명자 추출물 투여에 의한 정자형태변화는 유의적인 차이가 나타나 지 않았지만 안트라퀴논 투여군에서 정상대조군과 결명자 투 여군에서 나타나지 않았던 small tail이 조금 나타난 것으로 보이지만, 총 정자 기형률에 영을 미치지 않는 정도로 관찰되 었다.
따라서 결명자 추출물은 정자의 기형률에 영향을 미치지 않 는 것으로 사료된다.
8. 부검
주시험군 및 회복군의 모든 동물에 대해 안락사를 실시한 뒤 5 분 이내에 부검을 실시하여 전신의 장기, 조직에 대한 육안 검사를 진행한 결과 이상소견은 관찰되지 않았다 (Table 8).
Rat 부검 시 흔히 발견되는 thymus의 발적과 같은 흔한 증 상도 나타나지 않은 것으로 보아 결명자 추출물의 투여가 장 기·조직에 대한 육안적인 변화에 영향을 미치지 않는 것으로 사료된다.
9. 장기중량
부검을 진행한 뒤 실험동물의 간 (liver), 심장 (heart), 비장 (spleen), 신장 (kidney), 고환 (testis) 과 정소 (epididymis)의 절대 장기중량을 측정한 결과, 주시험군 절대 장기중량에서 암 수 모두에서 시험물질 투여에 의한 변화가 관찰되지 않았지만 (Table 9), 체중에 비례한 상대 장기중량을 확인해본 결과 회 복주기에 결명자 3,000㎎/㎏/day 투여군 및 안트라퀴논 100㎎/㎏/day 투여군에서 신장의 상대 장기중량이 대조군에 비해 유의성 (p < 0.05) 있는 증가를 보였다 (Table 10).
하지만 이는 상대 장기중량 증가량이 미미하고 혈액학적, 혈 액생화학적 및 조직병리학적 검사에서 신장에 대한 이상변화 가 관찰되지 않아 독성학적인 의미는 없다고 사료된다.
10. 조직병리학적 검사
결장 점막위 대식세포 침윤 (supramucosal macrophage infiltration)이 0 (대조군), 결명자 300, 1,500 및 3,000㎎/㎏ 및 안트라퀴논 100㎎/㎏ 투여군의 주시험군에서 0, 0, 2/5, 4/5 및 4/5 례로 용량의존적으로 관찰되어 결명자 및 안트라 퀴논 투여에 따른 변화로 사료되었으며, 회복주기에도 실험군 의 대식세포 침윤 비율이 각각 0, 0, 1/5, 2/5 및 2/5 례가 용량 의존적으로 관찰되었으나, 26 주 시험군과 비교시 정상 적으로 회복되는 경향이 있을 것으로 사료 된다 (Table 11).
고 찰
일반적으로 이용되고 있는 건강기능식품의 한계용량인 1,000㎎/㎏ 농도 (Han et al., 2013) 및 organisation for economic co-operation and dvelopment (OECD)의 급성독성 시험 허용량인 2,000㎎/㎏의 농도 (OECD, 2001)를 포함하여 실험 농도를 설정하고 결명자 (Cassia tora L.)를 300, 1,500 및 3,000㎎/㎏/day의 농도로 26 주 반복경구투여 독성시험, 4 주 회복시험을 실시하였다.
이러한 시험기간은 식품의약품안전평가원의 의약품등의 독 성시험기준 해설서를 근거로 하여 26 주의 기간을 두었을 뿐 만 아니라 (OECD, 2009; NIFDSE, 2012), 여러 약용작물을 대상으로 수행된 독성평가시험과 마찬가지로 독성이 유발되었 을 때 독성의 가역성을 확인하기 위해 4 주간의 회복기간을 두었다 (Kim et al., 2014).
안트라퀴논군 실험군은, 식품의약안전처의 독성정보제공시 스템에 따르면 안트라퀴논은 랫드에게 100㎎/㎏/day 농도로 경구투여 하였을 때 독성이 나타난다고 보고되어있어 (MFDS, 2009), 본 실험에서 100㎎/㎏/day 농도의 안트라퀴논을 섭취 시키도록 하였다.
대조군 및 모든 시험물질 투여군에서 사망동물은 발생하지 않았으며, 일반증상, 체중, 사료섭취량, 뇨 검사, 장기 중량, 부 검 및 조직병리학적 검사에서 독성학적으로 의미 있는 변화가 관찰되지 않았다. 또한, 정자검사에서도 시험물질에 의한 영향 은 인정되지 않았다.
앞서 언급한대로 초결명자 (Cassia obtusifolia seed)의 경우 사료에 혼합하여 식이하였을 때 랫드의 백혈구와 혈소판이 증 가되거나 빈혈이 발생되지만 물로 추출하였을 때 5,000㎎/㎏ 의 농도에서 단회 투여 독성이 나타나지 않았다 (Voss and Brennecke, 1991; Ayodele et al., 2015). 마찬가지로 석결명 자 (Cassia occidentalis seed)는 볶아서 사용하거나 열수에 추 출하면 독성이 감소되는 경향이 나타난다고 알려져 있다 (Nadai et al., 2003; Essa’a and Medoua, 2013).
최근 연구에 따르면 결명자의 잎 추출물이 랫드와 마우스에 서 독성이 나타나지 않는 것으로 알려져 있을 뿐만 아니라 (Cholendra et al., 2014), 석결명자와 초결명자처럼 열수에 침 지하여 추출하는 과정에서 독성이 감소하는 것으로 나타난다.
흥미롭게도 석결명자 물 추출물 (1,300㎎/㎏)을 5 개월 이 상 투여한 것에 비교하여 결명자 물 추출물 (3,000㎎/㎏)을 26 주간 투여했을 때 대장에서 나타는 대식세포의 침윤이 미 미한 것으로 나타났다. 이는 결명자 (Cassia tora L.)도 마찬 가지로 물에 추출하였을 때 독성이 감소할 것으로 사료되며, 결과를 종합했을 때 수컷 랫드에 대한 무독성량 (NOAEL, no-observed-adverse-effect level)은 3,000㎎/㎏ 로 사료되고, 결명자 1,500 및 3,000㎎/㎏/day에서 경미한 변화가 관찰되어 무해용량 (NOEL, no-observed-effect level)은 300㎎/㎏으로 추정된다.
현재까지도 약용식물을 생약재로 이용할 때 부작용을 일으 키는 사례들이 증가하고 있는 추세이기 때문에, 이 결과를 바 탕으로 한의학에서 이용되는 약용식물 중 하나인 결명자의 안 전성 및 약용식물을 안전하게 이용할 수 있도록 우리나라 고 유의 질병치료제에 대한 개발에 기여할 것으로 예상 된다.
하지만 결명자 물 추출물에서 아무런 독성현상이 나타나지 않았기 때문에 추가적으로 더 높은 용량 또는 열수 추출과 유 기용매 추출물에 대한 독성평가를 파악할 필요가 있을 것으로 사료된다.
감사의 글
본 연구는 농림축산식품부(과제번호: 114150-03)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
- Ayodele, A.A.E, Abacha, F.Z, Yahaya, T, Arfo, S.B, Musa, H.I, Kevin, I.N, (2015), Acute toxicity and some elemental assessment of Senna tora Linn thylakoids in natural population of northeastern nigeria., International Journal of Research, 2, p375-381.
-
Choi, J.S, Jung, J.H, Lee, H.J, Kang, S.S, (1996), The NMR assignments of anthraquinones from Cassia tora., Arch. Pharm. Res, 19, p302-306.
[https://doi.org/10.1007/bf02976245]

-
Choi, J.S, Lee, H.J, Kang, S.S, (1994), Alatemin, cassiaside and rubrofusarin gentiobioside, radical scavenging principles from the seeds of Cassia tora on 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical., Arch. Pharm. Res, 17, p462-466.
[https://doi.org/10.1007/bf02979126]

-
Choi, J.S, Lee, H.J, Park, K.Y, Ha, J.O, Kang, S.S, (1997), In vitro antimutagenic effects of anthraquinone aglycones and naphthopyrone glycosides from Cassia tora., Planta Med, 63, p11-14.
[https://doi.org/10.1055/s-2006-957593]

- Cholendra, A, Vijayaraghavan, R, Babu, Y, Mohan, S.K, Rao, S.D, Dorababu, K, Reddy, K.K, (2014), Acute toxicity studies of Cassia tora leaf powder., Int. J. Immunopathol. Pharmacol, 4, p176-181.
-
Dodd, D.E, Layko, D.K, Cantwell, K.E, Willson, G.A, Thomas, R.S, (2013), Subchronic toxicity evaluation of anthraquinone in fischer 344 rats., Int. J. Toxicol, 32, p358-367.
[https://doi.org/10.1177/1091581813501701]

-
Essa’a, V.J, Medoua, G.N, (2013), Subchronic toxicity of the beverage made from Cassia occidentalis seeds in mice., International Journal of Nutrition and Food Sciences, 2, p237-242.
[https://doi.org/10.11648/j.ijnfs.20130205.14]

- Han, HY, Kim, SN, Yang, YS, Han, SC, Seok, JH, Roh, HS, Lee, JK, Jeong, JY, Jeong, YW, Kim, JA, Min, BS, (2015), Toxicity assessment of Polygalae radix aqueous extract orally administered to rats for 2 consecutive weeks., Korean J. Pharmacogn, 46, p44-51.
- Han, S.R, Han, H.Y, Park, H.J, Min, B.S, Chung, M.K, Moon, K.S, Jeong, J.Y, Roh, H.S, Seok, J.H, Kim, S.K, (2013), Toxicity assessment of Cyperi rhizoma aqueous extract orally administered to rats for 13 consecutive weeks., Yakhak Hoeji, 57, p258-264.
-
Han, T.W, Um, M.Y, Lim, Y.H, Kim, J.K, Kim, I.H, (2016), Single- and repeated-dose oral toxicity in rats and bacterial reverse mutation test of Morus alba L. extracts., Journal of the Korean Society of Food Science and Nutrition, 45, p1406-1413.
[https://doi.org/10.3746/jkfn.2016.45.10.1406]

- Hardman, J.G, Limbrid, L.E, (1995), Goodman and gilmans the pharmacological basis of therapeutics, 9th ed., McGrawhill, New York, NY, USA, p1546.
-
Hong, KH, Choi, WH, Ahn, J, Jung, CH, Ha, TY, (2012), Physicochemical properties of ethanol extracts and dietary fiber from Cassia tora L. seed., Korean Journal of Food and Nutrition, 25, p612-619.
[https://doi.org/10.9799/ksfan.2012.25.3.612]

-
Kim, D.H, Kim, S, Jung, W.Y, Park, S.J, Park, D.H, Kim, J.M, Cheong, J.H, Ryu, J.H, (2009), The neuroprotective effects of the seeds of Cassia obtusifolia on transient cerebral global ischemia in mice., Food Chem. Toxicol, 47, p1473-1479.
[https://doi.org/10.1016/j.fct.2009.03.028]

- Kim, D.H, Yoon, B.H, Kim, Y.W, Lee, S, Shin, B.Y, Jung, J.W, Kim, H.J, Lee, Y.S, Choi, J.S, Kim, S.Y, Lee, K.T, Ryu, J.H, (2007), The seed extract of Cassia obtusifolia ameliorates learning and memory impairments induced by scopolamine or transient cerebral hypoperfusion in mice., J. Pharmacol. Sci, 39, p241-245.
-
Kim, M.S, Lim, S.J, Lee, H.J, Nho, C.W, (2015), Cassia tora seed extract and its active compound aurantio-obtusin inhibit allergic responses in IgE-mediated mast cells and anaphylactic models., J. Agric. Food Chem, 63, p9037-9046.
[https://doi.org/10.1021/acs.jafc.5b03836]

- Kim, S.H, Choi, E.J, Kim, D.H, Lee, K.Y, Lee, M, Baek, S.W, Kwack, S.J, Kang, T.S, Kim, Y.C, Sung, S.H, (2008), Stability test of the extracts of Cimicifugae rhizoma, Achyranthis radix, Artemisia capillaris Herba, Moutan cortex Radicis and Arecae semen for toxicity study., Korean J. Pharmacogn, 39, p241-245.
- Kim, Y.H, Kim, J.Y, Han, J.M, Lee, H.Y, Jung, I.C, Jin, M.R, Kim, S.H, Park, Y.C, (2014), A thirteen week repeated oral dose toxicity test and a four week recovery test of GST in sprague dawley rats., Journal of Internal Korean Medicine, 35, p223-243.
- Liu, S.M, Sun, C, Xie, W.H, (2009), Effect of semen Cassiae extracts on expression of lipogenesis genes in hyperlipidemia model mice., Chin. Tradit. Herbal Drugs, 40, p583-587.
- Luo, X, Xu, X, Huang, C, Wu, X, Liu, J, Lan, B, Xu, J, (2011), Experiment study of total anthraquinone in Cassiae semen on lipid peroxidation and PPAR-gamma expression in liver tissues of rats with alcoholic fatty liver., China Journal of Chiness Materia Medica, 36, p1654-1659.
- MFDS ., (2009), Tox-info. anthraquinone, Ministry of Food and Drug Safety, Cheongju, Korea, p7.
- Nadai, S.R, Calore, E.E, Manzione, C.R, Puga, F.R, Perez, N.M, (2003), Effect of long-term administration of Senna occidentalis seeds in the large bowel of rats., Pathol. Res. Pract, 199, p733-737.
- NIFDSE, (2012), Manual of toxicity study standard to drugs, National Institute of Food and Drug Safety Evaluation, Cheongju, Korea, p10.
-
Nho, J.H, Jung, H.K, Lee, M.J, Jang, J.H, Sim, M.O, Jung, J.K, Lee, K.H, An, B.K, Cho, J.H, Jang, M.C, Yong, J.H, Cho, H.W, (2016), Effect of roasted water extract of fermented Cassia tora L. by Lactobacillus casei on the loperamide-induced constipation model in rats., Hanguk Yakyong Changmul Hakhoe Chi, 24, p471-478.
[https://doi.org/10.7783/kjmcs.2016.24.6.471]

- Oh, J.M, Jo, J.H, Kim, B.H, Kim, S.K, (2006), Single dose toxicity study of Buxus Microphylla var. Koreana Nakai extract in mice., Journal of Environmental Toxicology, 21, p331-335.
- OECD, (2001), OECD guidelines for the testing of chemicals, Organisation for Economic Co-operation and Development, Paris, France, p1-4.
- OECD, (2009), OECD test guideline 452, Organisation for Economic Co-operation and Development, Paris, France, p1-16.
-
Park, Y.C, Lee, J.S, Kim, D.Y, Son, H.Y, Lee, J.W, Cheoi, Y.S, Kim, K.K, Yu, C.Y, Chung, I.M, Im, M.H, Lee, K.J, Choi, R.N, Shim, H.S, Lim, J.D, (2013), A 90 day repeated dose-oral toxicity study of extracts from Astragalus membranaceus-aboverground parts in rats., Korean Journal of Medicinal Crop Science, 21, p474-485.
[https://doi.org/10.7783/kjmcs.2013.21.6.474]

- Parson, W.T, Cuthbertson, E.G, (1992), Noxious weeds of Australia. Inkarta Press. Melbourne. Victoria, Australia. Voss KA and Brennecke LH. (1991). Toxicological and hematological effects of sicklepod(Cassia obtusifolia) seeds in sprague-dawley rats: A subchronic feeding study., Toxicon, 29, p1329-1336.
- Wei, N, Lv, H, Liu, M, (2012), Study on the chemical constitutions of reducing blood lipid in semen Cassiae., Guangdong Chemical Industry, 9, p99-100.
-
Yen, G.C, Chuang, D.Y, (2000), Antioxidant properties of water extracts from Cassia tora L. in relation to the degree of roasting., J. Agric. Food Chem, 48, p2760-2765.
[https://doi.org/10.1021/jf991010q]

- Yen, G.C, Chung, D.Y, (1999), Antioxidant effects of extracts from Cassia tora L. prepared under different degrees of roasting on the oxidative damage to biomolecules., J. Agric. Food Chem, 47, p1326-1332.
-
Yi, J.H, Park, H.J, Lee, S, Jung, J.W, Kim, B.C, Lee, Y.C, Ryu, J.H, Kim, D.H, (2016), Cassia obtusifolia seed ameliorates amyloid β-induced synaptic dysfunction through anti-inflammatory and Akt/ GSK-3β pathways., J. Ethnopharmacol, 178, p50-57.
[https://doi.org/10.1016/j.jep.2015.12.007]
