
초임계 유체로 추출된 산삼 부정 배양근 오일의 효모균 처리에 의한 비사포닌 계 지방산 함량 변화 및 Collagenase 및 Elastase 저해 활성 증대
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
To obtain useful cosmetic resources, this study aimed to determine the non-saponin fatty acid and inhibitory activities of collagenase and elastase by treatment of Saccharomyces cerevisiae in supercritical fluid extracted oil of the adventitious root culture of wild mountain ginseng.
We performed supercritical fluid extraction at various conditions such as pressure, temperature, time, and use of co-solvents, unlike the n-hexane extraction for the adventitious roots culture of wild mountain ginseng. The non-saponin-fatty acid obtained from the oil of the adventitious roots culture was incresed by treatment with S. cerevisiae. The supercritical fluid extraction was conducted using gas chromatography. Non-saponin-fatty acid content, in the oil of adventitious roots culture of wild mountain ginseng treated with S. cerevisiae for 2 days were three times higher than that in the control. In addition, the oil of the adventitious roots culture treated with S. cerevisiae was investigated for the anti-wrinkle effect by using collagenase and elastase. The oil of adventitious roots culture treated with S. cerevisiae exhibited higher collagenase and elastase inhibitory activities than those in the control.
Supercritical fluid extracted oil of the adventitious roots culture of wild mountain ginseng treated with S. cerevisiae was found to have decreased ratio of saturated fatty acids and incresed ratio and content of unsaturated fatty acids increased. Furthermore, it showed anti-wrinkle effects in vitro.
Keywords:
Panax ginseng C. A. Meyer, Saccharomyces cerevisiae, Mountain Wild Ginseng Adventitious Roots Culture, Nonsaponin Fatty Acid, Supercritical Fluid Extraction서 언
산삼 (Panax ginseng C. A. Meyer)은 두릅나무과 (Araliaceae)에 속하는 다년생 초본으로서 야생에서 자연적으 로 발아하여 성장한 삼을 말한다 (Shin, 2001).
약효성분은 사포닌계 ginsenoside로 면역 활성 증강 효과, 콜레스테롤 저하효과 (Gillis, 1997; Rebolé et al., 2006), 항 산화, 피부 노화, 미백 효과 (Kim et al., 2008), 발기부전 (Kim et al., 2009), 기억력 및 인지기능 개선 등 다양한 효 과를 가지는 것으로 알려져 있다 (Kim et al., 2010).
산삼의 제한적 생산과 고가 비용 문제로 인해 생명공학기술 인 조직배양과 대용량 생물반응기 (bio-reactor)를 이용한 산삼 부정 배양근 대량 증식 기술이 발달되었고, 생물공학기술로 배 양된 개체의 유효성분 증진과 유전적 조성의 안정성이 보고되 었다 (Shin et al., 2010; Kim et al., 2016; Yoo et al., 2017).
산삼 부정 배양근은 인삼과 비교하였을 때, RH2, Rg3, Rk1, Rg5 등 사포닌계 특이 ginsenoside 성분을 더 많이 함 유하고 화장품산업 및 식품·건강기능식품 산업에서 이용되고 있다 (Park et al., 2012).
최근 비사포닌계 활용을 위한 성분, 효능규명 및 추출 연구 가 이루어지고 있는 상태이며, Lee 등 (2011a)은 백삼, 홍삼, 흑삼 추출물의 말톨 정성, 지방산 조성비, 페놀 화합물 함량을 분석하였을 때 지방산 조성에서 palmitic acid, linoleic acid 등 불포화 지방산 함량이 높은 것을 확인하였다. Lee 등 (2009)은 비사포닌 분획이 가지는 항불안 및 항우울 효과를 십 자형 높은 미로 (elevated plus-maze, EPM)와 강제수영검사 (forced swimming test, FST)로 관찰한 결과, 비사포닌 분획 50㎎/㎏를 투여했을 때 EPM상 open arm에 머무는 횟수와 시간이 대조군에 비해 유의하게 증가하여 항불안 효과를 나타 내었으나, 전체적인 총 이동거리의 감소는 없는 것으로 보아 과다한 진정작용을 나타내지 않는 것으로 보고한 바 있다.
Shon 등 (2013)은 초임계 추출기를 이용하여 홍삼에서 오일 을 추출·정제한 홍삼 오일의 in vitro 실험결과에서 농도 의존 적으로 AAPH 및 Cu2+로 유도된 산화적 스트레스 억제와 in vivo에서 보습함유량 증가 및 인삼, 홍삼 비 (非) 사포닌계 오 일의 생리활성을 보고하였다.
초임계 유체 추출법은 천연물, 식품, 환경 등으로부터 추출 할 수 있는 특징을 지니고, 임계점 근방 또는 그 이상의 온도 와 압력 하에 유체의 특이적 성질을 이용하여 유용물질을 추 출하는 방법으로 비교적 낮은 온도 (40 - 60℃)에서 수행된다. 초임계 유체 추출법은 열에 민감한 천연물질의 분리·정제에 많 이 이용되고 있으며, 유기용매 사용으로 인해 야기되는 여러 가지 환경문제를 해결하는데 적합한 추출법이다 (Lee et al., 2006). 또한 초임계 유체 추출은 soxhlet, sonication 등의 다 른 추출기술에 비해 수율, 산화도 등에서 효과적인 결과를 보 이고 있다 (Lee et al., 2011b; Hur et al., 2011).
효모 (Saccharomyces cerevisiae)는 천연물의 생산과정에 있 어 생물체가 가지는 화합물의 생물전환에 있어서 유용한 생산 플랫폼이 되고 있으며 내생의 desaturase 및 다른 재료로부터 의 기원하는 desaturase를 효모균에 기능적으로 발현시켜 지방 산 생산을 조절하고 있다.
Lee 등 (2016a)은 일반적으로 지방산은 식물의 종자와 동물 성에 높게 존재하며, 생합성 경로는 단일결합 화합물인 저분 자 포화지방산의 elongase (신장효소), desaturase (불포화효소 )반응에 의하여 고분자의 포화지방산 또는 불포화지방산으로 합성되며, 탄소수에 따라 지방산 합성경로에 반응하는 특이적 인 desaturase, elongase을 갖고 있다고 보고하였다.
예를 들면 FAD2 유전자는 omega-6 desaturase라고 명명된 효소로 암호하고 있는데 이 효소는 올레인산을 리놀렌산으로 변화시키는 반응을 촉매 하는 것으로 알려져 있고 (Miquel and Browse, 1994), 불포화지방산의 양을 증가시키기 위해서 시금치의 탈포화 (desaturase) 유전자를 이식시켜 만든 유전자 변형 돼지의 가로무늬근육에서 높은 불포화지방산 비율이 나 타남을 확인한 바 있다 (Niemann, 2004).
이에 따라 본 연구에서는 화장품 소재 및 산업적 가치를 향 상시키기 위하여 산삼 부정 배양근을 초임계 유체로 추출한 오일의 불포화지방산의 함량을 증대시키기 위하여 desaturase 를 포함한 발효 미생물인 효모균을 처리한 후 비 (非)사포닌 계 지방산 성분분석과 주름형성에 관여하는 caollagenase 및 elastase에 대한 저해활성을 평가하였다.
재료 및 방법
1. 재료
본 실험에 사용한 산삼 (Panax ginseng C. A. Meyer) 부 정 배양근은 ㈜화진바이오코스메틱 생명공학연구소에서 배양 한 재료를 사용하였다.
산삼 부정 배양근 배양은 Schenk and Hildebrandt medium (Duchefa Biochemie, Haarlem, Netherlands) 3.15 g/ℓ, sucrose (Samyang Co., Seongnam, Korea) 30 g/ℓ, pH 5.75 조건의 배지조성물을 18ℓ bio-reactor에 제조한 후, 고온·고압 (127.0℃, 45 min, 0.15 mPa) 멸균하여 냉각하였다. 이후 preculture 된 산삼 부정 배양근 세포 30 g을 접종하여, 온도 25.0 ± 0.5℃, 습도 40.0 ± 5.0%에서 8 - 9 주간 배양한 후 수확 하여, 40℃, 36 hour 열풍건조 (WiseVen, Daihan Scientific Co., Ltd., Wonju, Korea)하여 사용하였다. 발효에 사용한 균주는 빵에서 분
발효에 사용한 균주는 빵에서 분리·동정된 효모균 (Saccharomyces cerevisiae HLJG0703, KACC 83014BP, Jeonju, Korea)을 사용하였다.
2. 기기 및 시약
실험에 사용한 초임계추출기는 Ilshin Biobase (Dongducheon, Korea)의 ISA-SEFE-0500-0700-080, 감압회전 농축기는 EYELA (Tokyo, Japan)의 N-1200, pH meter기는 Mettler Toledo (Greifensee, Switzerland)의 ME204, 원심분리기는 Labogene (Lynge, Denmark)의 1580R, 초음파 추출기는 Jeiotech (Seoul, Korea)의 VCP-10, GC-FID (gas chromatography flame ionization detector)는 Agilent (Santa Clara, CA, USA)의 7890B series, 분광광도계는 Molocular Devices (San Jose, CA, USA)의 spectra max M series를 사용하였다.
지방산 표준품은 SUPELCOTM 37 Component FAME Mix는 Sigma-Aldrich (St. Louis, MO, USA) 제품, 추출 및 효모균의 효소 처리에 사용한 n-hexane, ethyl alcohol (EtOH), dimethyl sulfoxide (DMSO) 및 이외 시약은 J.T. Baker (Phillipsburg, NJ, USA)의 일급 또는 특급 제품을 구 입하여 사용하였다.
주름억제 효과 측정을 위한 trizma base, N-succinyl-Ala- Ala-Ala-p-nitroanilide, 4-Phenylazobenzyloxycarbonyl-Pro-Leu- Gly-Pro-D-Arg, elastase from porcine pancreas, collagenase from clostridium histolyticum, CaCl2, ethyl acetate 등은 Sigma-Aldrich (St. Louis, MO, USA) 제품을 사용하였다.
3. 지방산 초임계 유체 추출조건 및 수율
산삼 부정 배양근에 함유된 지방산 수율을 확인하기 위하여 건강기능식품의 기준 및 규격 (2016-163호)에 기재된 ‘EPA 및 DHA 함유 유지’ 제조방법을 변형하여 헥산추출과 초임계 유체 추출을 실시하였다.
헥산추출은 시료 100 g을 n-hexane 10 배 (v/w) 용액에 침 지한 후, 40℃, 120 min 초음파 (44 KHz) 추출하여 0.45㎛ syringe 여과하였다.
초임계 유체 추출은 시료 100 g을 초임계추출기에 충전한 후, 추출압력 (250 - 350 bar), 온도 (50 - 60℃), 시간 (120 - 180 min) 조건별로 달리 추출하여 0.45㎛ syringe로 여과하였 다 (Table 2).
각 추출 여과물에 함유된 용매 (n-hexane, EtOH) 및 수분을 제거하기 위해 농축을 실시한 후, 수율을 비교 측정하였고, 추 출수율은 다음과 같은 방법으로 산출하였다.
Production yield (%) = [ Output / Input ] × 100
4. 산삼 부정 배양근 발효미생물 처리
산삼 부정 배양근에 함유된 지방산 중 불포화 지방산 함량 을 증진시키기 위하여 발효미생물인 효모균 (S. cerevisiae HLJG0703)을 처리하였다.
효모균 처리는 초임계 유체로 추출하고 농축된 산삼 부 정 배양근 오일 시료 10 g을 30% DMSO에 희석하여 사 용하였다. 효모균을 2 일간 PDB (trypticase soy broth) medium에서 pre-culture하여 사용하였다. 배양된 효모균을 3,000 rpm, 5min으로 원심분리 하여 희석된 산삼 부정 배양근 오일에 접종하였으며, 1 - 5 일간 25℃, facultative anaerobe 조건으로 처리하였다 (treatment 1 - 5). 반응이 종료된 시료는 n-hexane과 1 : 1 (v/v)로 혼합 후, 40℃, 120 min 초음파 (44 KHz) 추출하여 0.45㎛ syringe 여과하였다.
5. 지방산 분석
지방산 분석은 식품의 기준 및 규격 (2016-72호)에 기재된 ‘지방산 제1 법’ 의 분석방법을 변형하여 실시하였다.
지방산 표준용액 SUPELCOTM 37 Component FAME Mix를 1/4, 1/8, 1/16, 1/32, 1/64로 희석하여 검량선을 확인 하였다 (Table 1).
Column은 SUPELCOTM SP-2560 (100 × 0.25㎜ × 0.02㎛) 을, 시료 주입량은 split 100 : 1 at 225℃, 1㎕, 운반기체는 helium, 0.75㎖/min으로 흘려주었다. Column 온도는 100℃에 서 4 분간 유지한 후 3℃/min의 비율로 240℃까지 온도를 상 승시키고 이후 15 분 이상 유지하였고, 검출기는 FID로 285 ℃의 조건으로 측정하였다.
6. 계층적 군집분석
Hierarchical clustering analysis (HCA)를 위해 Multi- Experiment Viewer version 4.9.0 (MeV, Boston, MA, USA)을 사용하였다.
7. Elastase 저해활성 측정
Elastase 저해활성측정은 Cannell 등 (1988)의 방법에 따라 기질로부터 생성되는 p-nitroanilide의 생성량을 410㎚에서 측 정하였다.
Elastase와 기질 N-succinyl-Ala-Ala-Ala-p-nitroanilide을 Tris-HCl buffer (50 mM, pH 8.6)에 녹여 사용하였다. 각 시 험용액은 일정 농도가 되도록 조제하였으며, 시험용액 100㎕, elastase 효소액 (0.2 U/㎖) 50㎕, 기질액 (1㎎/㎖)을 100㎕ 을 취하여 37℃에서 30 분간 반응시켜 96 well plate (SPL), 410㎚에서 흡광도를 측정하였다. Elastase 저해활성도는 다음 과 같은 계산식을 이용하여 산출하였다.
Inhibitory activity (%) = [1 -시료첨가군 (OD30 min-OD0 min)/무첨가군 OD0 min] × 100
8. Collagenase 저해활성 측정
Collagenase 저해활성 측정은 Wünsch과 Heindrich (1963) 의 방법에 따라 측정하였다.
Tris-HCl buffer (100 mM, pH 7.5)에 4 mM의 CaCl2을 녹 여 buffer를 제조하여 사용하였다. 제조된 buffer에 collagenase 와 기질 4-Phenylazobenzyloxycarbonyl-Pro-Leu-Gly-Pro-DArg을 각각 0.2㎎/㎖, 0.3㎎/㎖의 농도로 제조하여 반응하였 다. 각 시험용액은 일정 농도가 되도록 조제하였다. 시험용액 50㎕, collagenase 75㎕, 기질액 125㎕을 취하여 20℃에서 20 분간 반응시킨 후 ethyl acetate로 분획하여 상등액만 340㎚에서 흡광도를 측정하였다. Collagenase 저해활성도는 다음과 같은 계산식을 이용하여 산출하였다.
Inhibitory activity (%) = [1 -시료첨가군 (OD30 min -OD0 min)/ 무첨가군 OD0 min] × 100
9. 통계처리
모든 실험은 3 회 반복으로 진행하여 평균과 표준편차를 나 타내었다. 실험에 관련된 통계처리는 SPSS program (Statistical Package for Social Science, Version 24; IBM, Chicago, IL, USA)를 이용하여 분산분석 (ANOVA)으로 p < 0.05 수준에서 Duncan’s Multiple Range Test (DMRT)에 의 하여 시료간의 유의차를 검증하였다.
결과 및 고찰
1. 지방산 초임계 유체 추출조건 및 수율
본 연구에서는 n-hexane 추출과 초임계 유체 추출의 조건 및 수율을 비교하였고, 초임계 유체 추출 조건은 압력 (250 - 350 bar), 시간 (120 - 180 min) 및 보조용매 첨가여부에 의해 수행하였다.
본 연구에서는 n-hexane 추출에서는 0.403%의 추출수율을 나타냈었고 초임계 유체 추출에서는 조건인 온도, 압력, 보조 용매 변화에 따라 추출 수율에 차이가 나타났다.
Lee 등 (2006)은 초임계 이산화탄소에 대한 지방 추출수율 은 추출온도보다 추출압력에 의해 크게 좌우되고, 수율은 추 출시간이 증가할수록 증가되며, 불포화지방산 함량이 증가된 다고 보고하였다.
본 연구에서 보조용매 EtOH를 첨가하지 않은 추출조건에서 는 압력 250 bar에서 350 bar로 증가하였을 때, 시간이 증가 할수록 수율은 0.141 - 0.185%로 증가한 반면, 보조용매 EtOH 를 첨가한 추출조건에서는 압력 250 bar에서 350 bar로 증가 하였을 때 수율 0.214 - 0.243%로 증가하였지만, 시간 증가에 비례하여 유의적인 결과를 나타내지 않았다 (Table 2).

Production yield of fatty acid in oil of adventitious roots culture of wild mountain ginseng according to extraction condition of superciritical fluid.
Lee 등 (2011b)은 수산물의 우수한 공급원인 멸치에 초임계 이산화탄소 공정을 적용하여 다양한 압력 (15 - 25MPa) 및 온 도 (40 - 60℃) 조건에서 추출을 수행하였을 때, 높은 온도 및 압 력에서 추출 수율이 증가하였으며, 지방산 중 docosahexaenoic acid (DHA), eicosapentaenoic acid (EPA) 같은 고도불포화 지방 산 함량이 유기용매 추출 오일보다 높아 본 연구와 유의적인 결과로 확인되었다.
산삼 (Panax ginseng C. A. Meyer) 부정 배양근 오일이 추출되는 수율에 있어서 비록 이 초임계 유체 추출보다는 hexane을 사용한 추출이 더 높은 결과를 나타내었으나 초임계 유체 추출은 부정 배양근 오일을 활용한 화장품의 제조 공정 등에 유기용매를 제거하는 공정을 거치지 않아도 되는 유용성 을 가진다고 생각되어지며 이러한 초임계 유체 추출을 적용하 는 경우 추출 수율이 증가를 위하여 높은 온도 및 압력의 사 용과 함께 보조용매 EtOH의 사용하는 것이 효율적으로 판단 된다.
2. 지방산 분석
초임계 유체 추출한 산삼 부정 배양근 오일을 대상으로 효 모균을 처리하고 37 종의 지방산 함량을 비교해본 결과, 대조 군 비교하여 효모균 처리군에서 불포화지방산 중 palmitoleate, cis-9-oleic acid, linoleate, γ-linolenate, cis-11-eicosenoate, linolenate, cis-5,8,11,14-eicosatetraenoic acid, cis-11,14- eicosadienoic acid의 함량이 증가되는 것으로 확인되었다.
이 중 palmitoleate는 대조군에서는 불검출 되었으나 효모 균 처리군 (treatment 1 - 5)에서는 0.25 ± 0.03㎍/㎎에서 1.67 ± 0.23㎍/㎎까지 범위로 검출되었고, cis-9-oleic acid는 대조군이 4.05 ± 0.49㎍/㎎를 나타낸 반면 효모균 처리군에서 는 11.14 ± 1.70㎍/㎎에서 14.23 ± 0.86㎍/㎎까지 그 함량을 나타내었다.
Linoleate의 경우 대조군이 38.32 ± 3.19㎍/㎎으로 나타내 었고 효모균 처리군은 76.66 ± 4.23㎍/㎎에서 125.47 ± 8.02㎍/㎎의 함량을 나타내었으며, γ-linolenate는 대조군 함량 이 0.35 ± 0.02㎍/㎎으로 나타낸 반면 효모균 처리군에서는 0.72 ± 0.04㎍/㎎에서 1.05 ± 0.08㎍/㎎까지의 범위를 나타내 었다.
cis-11-eicosenoate는 대조군이 0.71 ± 0.24㎍/㎎로 확인되었 고 효모균 처리를 하는 경우 처리 시기별로 1.56 ± 0.09㎍/㎎ 에서 3.23 ± 0.20 ㎍/㎎까지 확인되었고, linolenate의 경우 대조군이 4.00 ± 0.23㎍/㎎, 효모균 처리군에서는 8.65 ± 1.31㎍/㎎에서 13.09 ± 0.80㎍/㎎ 범위 수준의 함량을 나타내 었다.
또한 cis-5,8,11,14-eicosatetraenoic acid는 대조군이 0.63 ± 0.06㎍/㎎의 함량을 나타낸 반면 효모균 처리군에서는 0.91 ± 0.21㎍/㎎에서 2.00 ± 0.34㎍/㎎ 범위의 함량을 나타내었고, cis-11,14-eicosadienoic acid는 대조군이 0.81 ± 0.06㎍/㎎, 효 모균 처리군이 1.55 ± 0.08㎍/㎎에서 2.57 ± 0.16㎍/㎎까지 범 위로 상대적으로 증가하는 경향을 나타내었다 (Fig. 1, 2, Table 3).
GC-FID chromatogram of fatty acid standards for quantitative analysis.Concentrations of each standards were diluted to A; 1/4, B; 1/8, C; 1/16, D; 1/32, E; 1/64.
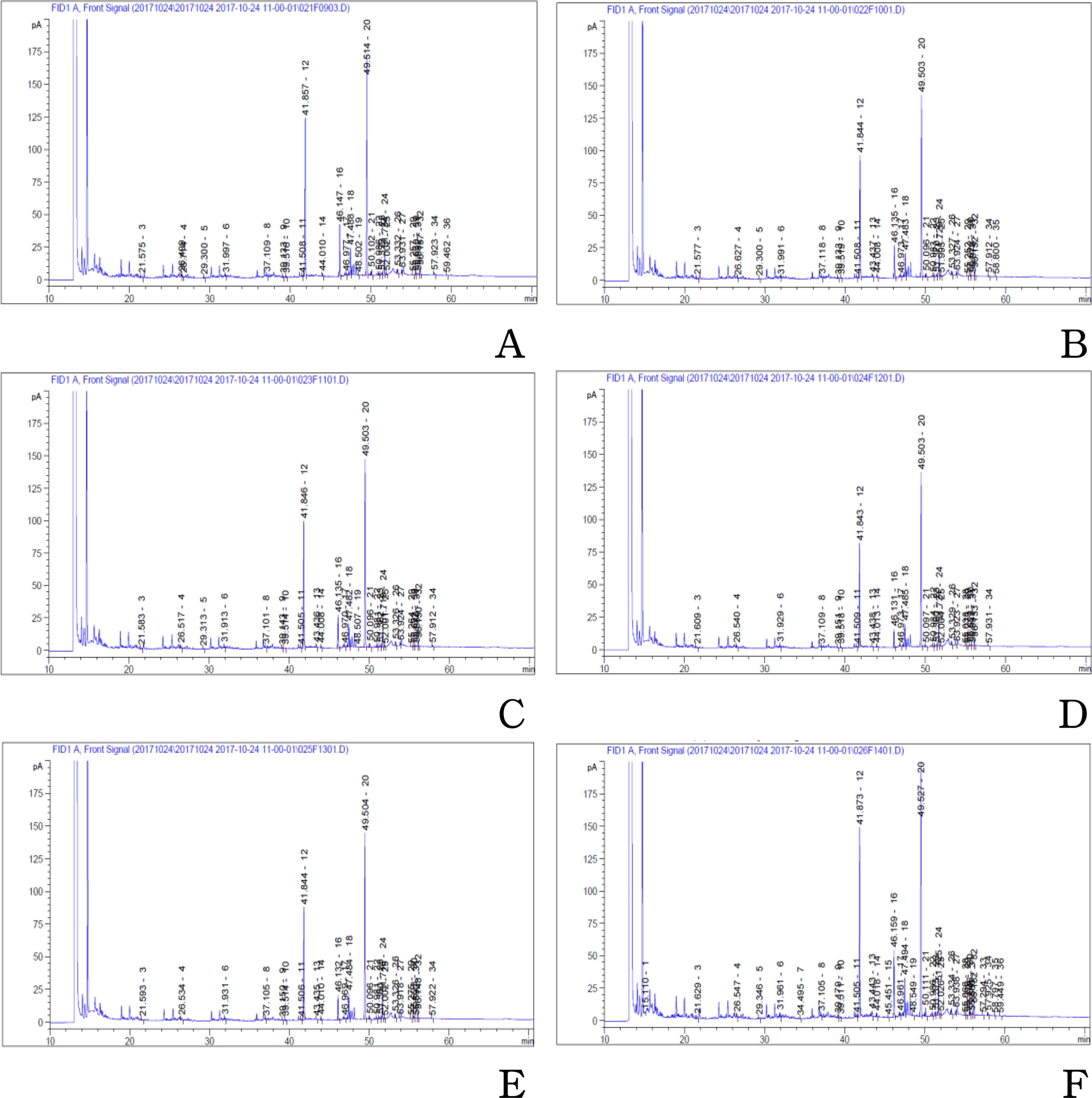
GC-FID chromatography of fatty acid in oil of adventitious roots culture of wild mountain ginseng according to fermentation condition by S. cerevisiae.Concentrate of each oil samples. A; control, 29.0㎎/㎖, B; treatment 1, 8.6㎎/㎖, C; treatment 2, 7.6㎎/㎖, D; treatment 3, 11.5㎎/㎖, E; treatment 4, 10.1㎎/㎖, E; treatment 5, 15.3㎎/㎖.

Contents of fatty acid in oil of adventitious roots culture of wild mountain ginseng according to fermentation condition by S. cerevisiae.
총 지방산 37 종을 분석한 후 포화지방산, 불포화지방산 비 율을 비교해본 결과, 대조군 대비 발효 처리군에서 불포화지 방산 비율이 증가하였다 (Table 4). S. cerevisiae의 경우 saturated (주로 16 : 0과 18 : 0)와 mono saturated (18 : 1ω9) 지방산만이 새로이 합성되기 때문에 (Daum and Vance, 1997; Martin et al., 2002) 지방산 함량 측정에서 S. cerevisiae의 포화지방산 및 불포화 지방산의 함량은 고려하지 않았다. 산삼 부정 배양근으로부터 초임계 추출한 오일에 S. cerevisiae가 포함하고 있는 desaturase가 작용하여 포화지방산 비율이 감소하고 불포화 지방산 비율 및 함량이 증가하는 것 을 확인할 수 있었다.

Ratio of saturated and unsaturated fatty acid in oil of adventitious roots culture of wild mountain ginseng according to fermentation condition by S. cerevisiae.
Petrie 등 (2009)은 야생 아마 (亞麻)로 불리는 양냉이구슬 (Camelina sativa)에 △6-desaturase pathway에서 OA (oleic acid, 18 : ω9), LA (linolenic acid) 와 ALA (α-linolenic acid)을 기질로 사용하여 ω3 LC-PUFA EPA 와 DHA로 합 성하는 효모의 관련 유전자를 통하여 생선 오일의 함유량 수 준 (12%)까지 생산 수율이 증가되었다고 보고하였다.
Qiu X 등 (2002)은 효모에 cytochrome b5-억제제 strain과 cytochrome b5-competent 야생형 strain에서 △6-desaturase를 조절하여 지방산 변화율을 비교하였을 때, 발현된 효소는 18 : 1 (9)를 18 : 2 (9, 12), 18 : 3 (9, 12, 15)로 전환된다고 보 고하였다.
본 시험에서는 산삼 부정 배양근 오일에 효모균을 처리한 결과 효모균의 대사과정 중 생성되는 desaturase에 의한 불포 화 지방산 비율을 확인한 결과, 위의 선행연구와 유의적인 결 과 값을 나타냈다.
3. 계층적 군집분석
Hierarchical clustering analysis (HCA)는 분석시료에 대해 낮은 함량은 blue, 높은 함량은 red로 표기하여 군집을 분석하 는 통계처리 방법이다.
산삼 부정 배양근 오일의 효모균 처리에 의한 총 지방산의 군집을 확인하였을 때, 효모균 처리군 (treatment 1 - 5)는 대조 군과 다른 군집을 형성하였으며, treatment 1, 2, 5와 treatment 3, 4가 유사 군집으로 형성되었다. 또한 대조군은 blue를 나타내어 낮은 함량으로 군집이 형성되는 반면, 효모균 처리군에서는 높은 함량인 red 군집의 빈도가 높아지는 것을 확인하였다 (Fig. 3).
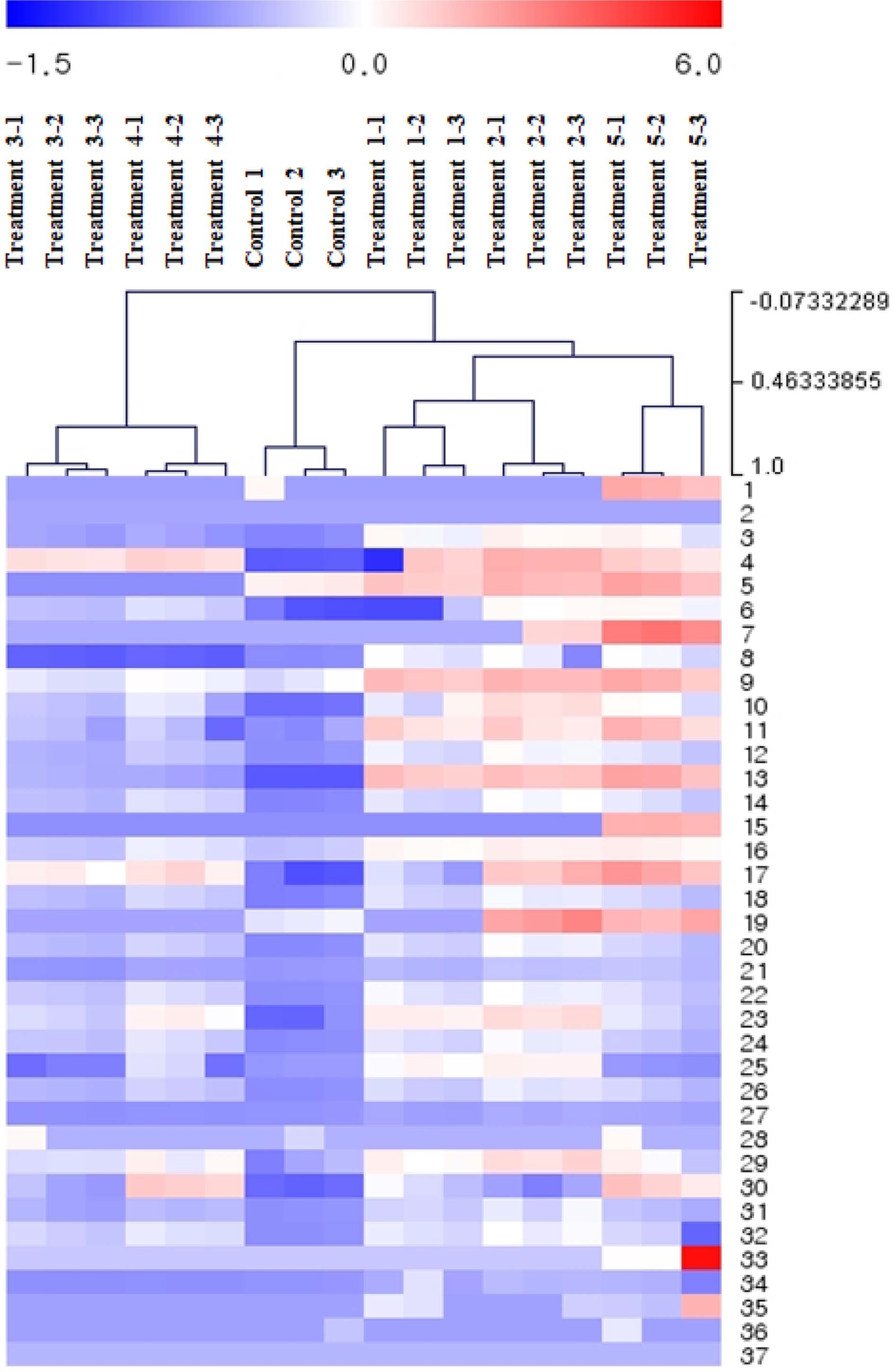
Hierarchical clustering analysis (HCA) result of fatty acid in oil of adventitious roots culture of wild mountain ginseng according to fermentation condition by S. cerevisiae.Color of each square indicates the relative amounts of compounds: red (highest contained), blue (lowest contained). Compounds 1; butyrate, 2; hexanoate, 3; octanoate, 4; decanoate, 5; undecanoate, 6; laurate, 7; tridecanoate, 8; myristate, 9; myristoleate, 10; pentadecanoate, 11; cis-10- pentadecenoate, 12; palmitate, 13; palmitoleate, 14; heptadecanoate, 15; cis-10-heptadecanoic acid, 16; stearate, 17; trans-9-elaidic acid, 18; cis-9-oleic acid, 19; linolelaidate, 20; linoleate, 21; arachidate, 22; γ- linolenate, 23; cis-11-eicosenoate, 24; linolenate, 25; heneicosanoate, 26; cis-11,14-eicosadienoic acid, 27; behenate, 28; cis-8,11,14-eicosatrienoic acid, 29; erucate, 30; cis-11,14,17-eicosatrienoic acid, 31; cis- 5,8,11,14-eicosatetraenoic acid, 32; tricosanoate, 33; cis-13,16-docosadienoic acid, 34; lignocerate, 35; cis-5,8,11,14,17-eicosapentaenoic acid, 36; nervonate, 37; cis-4,7,10,13,16,19-docosahexaenoic acid.
4. Elastase 저해활성
Elastin은 피부 내 탄력을 유지하는 중요한 역할로 알려져 있다. Elastase는 elastin을 분해하는 효소로 de Witt 등 (1981)은 이상조직에서 elastase의 활성이 높아지고 피부주름과 탄력성 손실을 유발시킨다고 보고하였다. Tsuji 등 (2001)은 피부세포의 elastase를 저해함으로 동물피부의 주름개선효과를 보였다.
본 시험에서 대조군과 효모균 처리군 (treatment 1 - 5) 각 각의 농도를 100, 500, 1,000㎍/㎖로 elastase 저해활성을 검 정한 결과, 100㎍/㎖ 농도에서 대조군 3.11 ± 1.82%, 효모균 처리군 (treatment 1 - 5) 14.50 ± 3.42%, 20.62 ± 0.74%, 1.58 ± 1.56%, 3.84 ± 3.38%, 1.20 ± 0.74%의 저해율, 500㎍/㎖ 농도 에서 대조군 22.36 ± 0.93%, 효모균 처리군 (treatment 1 - 5) 55.23 ± 2.63%, 56.47 ± 0.39%, 50.42 ± 1.08%, 47.23 ± 6.76%, 32.99 ± 2.98%의 저해율, 1,000㎍/㎖ 농도에서는 대조군 30.90 ± 0.26%, 효모균 처리군 (treatment 1 - 5) 54.88 ± 6.04%, 59.70 ± 1.45%, 52.41 ± 1.11%, 54.61 ± 0.36%, 45.32 ± 3.98%로 농도 의존적으로 저해활성이 증가하였다. Positive control은 elastase 저해활성으로 잘 알려진 ursolic acid로 300㎍/㎖의 농도일 때 30.85 ± 8.30%의 활성이 확인되었다 (Fig. 4).
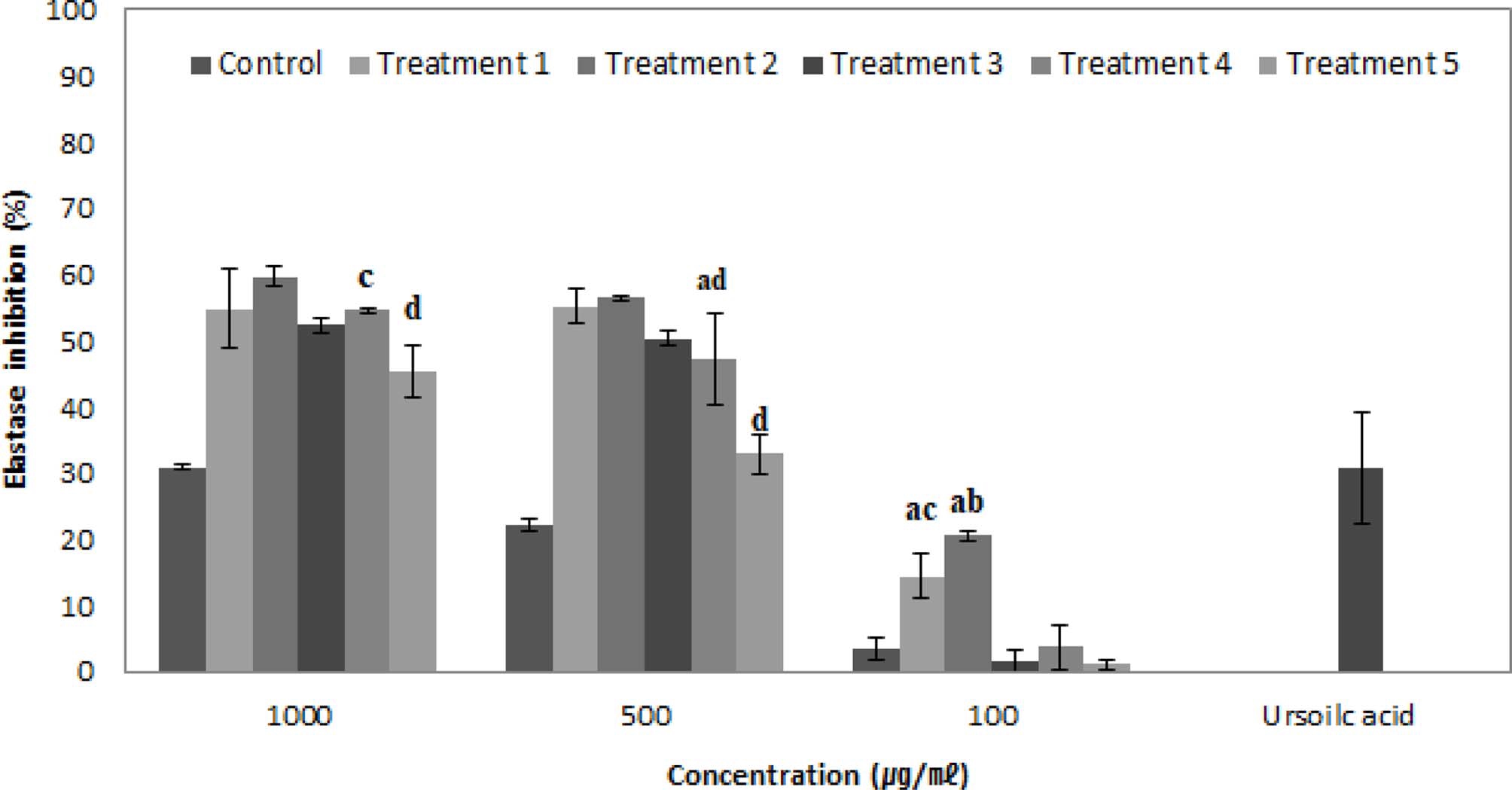
Elastase inhibitory activity in oil of adventitious roots culture of wild mountain ginseng according to fermentation condition by S. cerevisiae.*Means are significantly different by Ducans’s Multiple Range Test (p < 0.05).
산삼 부정 배양근의 초임계 유체 추출 및 효모균을 처리한 오일의 elastase 저해활성 중, treatment 2에서 가장 높은 elastase 저해활성이 확인되었다.
Rennert과 Melzig (2002)은 유리지방산 일 때, 포화지방산 보다 불포화지방산이 elastase의 저해활성에 대해 IC50값이 더 낮다고 보고하였다. IC50 값은 각각 palmitoleate는; 20 μM, cis-9-oleic acid; 5 μM, linoleate; 5 μM, γ-linolenate; 15 μM, linolenate; 15 μM이였다고 보고한 바 있다. 또한 Mori 등 (2002)은 lemon, juniper와 grapefruit의 essential oil의 농도가 약 250㎍/㎖이상에서 각각 95%, 92%, 87% 이상의 elastase 저해활성이 나타났다고 보고하였으며 Lee 등 (2016b)은 홍삼박 을 물, 에탄올 그리고 1,3-buthylene glycol으로 추출하였으며 주름개선 활성을 elastase로 저해율을 측정하였을 때, 500㎍/㎖ 에서 ursolic acid와 유사한 활성을 갖는 것을 보고하였다.
이러한 결과를 종합하여 보면 산삼 부정 배양근 초임계 유 체 추출 오일에 효모균을 처리하는 경우 효모균을 처리하지 않는 경우 보다 더 높은 elastase에 대한 저해활성이 가질 수 있음을 확인하였다.
5. Collagenase 저해활성
Collagen은 elastin과 함께 피부의 탄력과 주름 관련 핵심 지표물질이며 (Youn, 2012), 피부의 진피조직의 90%를 차지 하는 것으로 알려져 있다. Collagenase는 자외선 또는 외부 환 경 스트레스 등의 여러 가지 요인에 따라 활성이 높아지며, collagen을 분해하여 주름생성과 탄력저하를 일으켜 피부노화 의 원인이 된다고 알려져 있다 (Yu, 2014).
본 시험에서 positive control은 collagenase 저해활성으로 잘 알려진 epigallocatechin gallate (EGCG)로 500㎍/㎖의 농 도일 때 72.11 ± 1.08%의 활성을 확인하였다 (Fig. 5). 효모균 을 처리하지 않은 대조군과 효모균 처리군 (treatment 1 - 5) 각 각의 농도를 31.25, 62.5, 125, 250, 500 ㎍/㎖로 collagenase 저해활성을 검정한 결과, 32.25 ㎍/㎖ 농도에서 대조군 2.67 ± 3.77%를 나타내었고 효모균 처리군 (treatment 1 -5)은 26.66 ± 8.45%, 29.39 ± 2.79%, 29.18 ± 0.33%, 32.93 ± 3.72%, 29.83 ± 2.01%의 저해율을 각각 나타내었으며, 62.5㎍/㎖ 농도 에서는 대조군 5.73 ± 1.28%, 효모균 처리군 (treatment 1 - 5)은 각각 32.06 ± 1.86%, 39.99 ± 2.88%, 23.78 ± 2.74%, 34.65 ± 4.06%, 27.09 ± 2.82%의 저해율을 나타내었다.
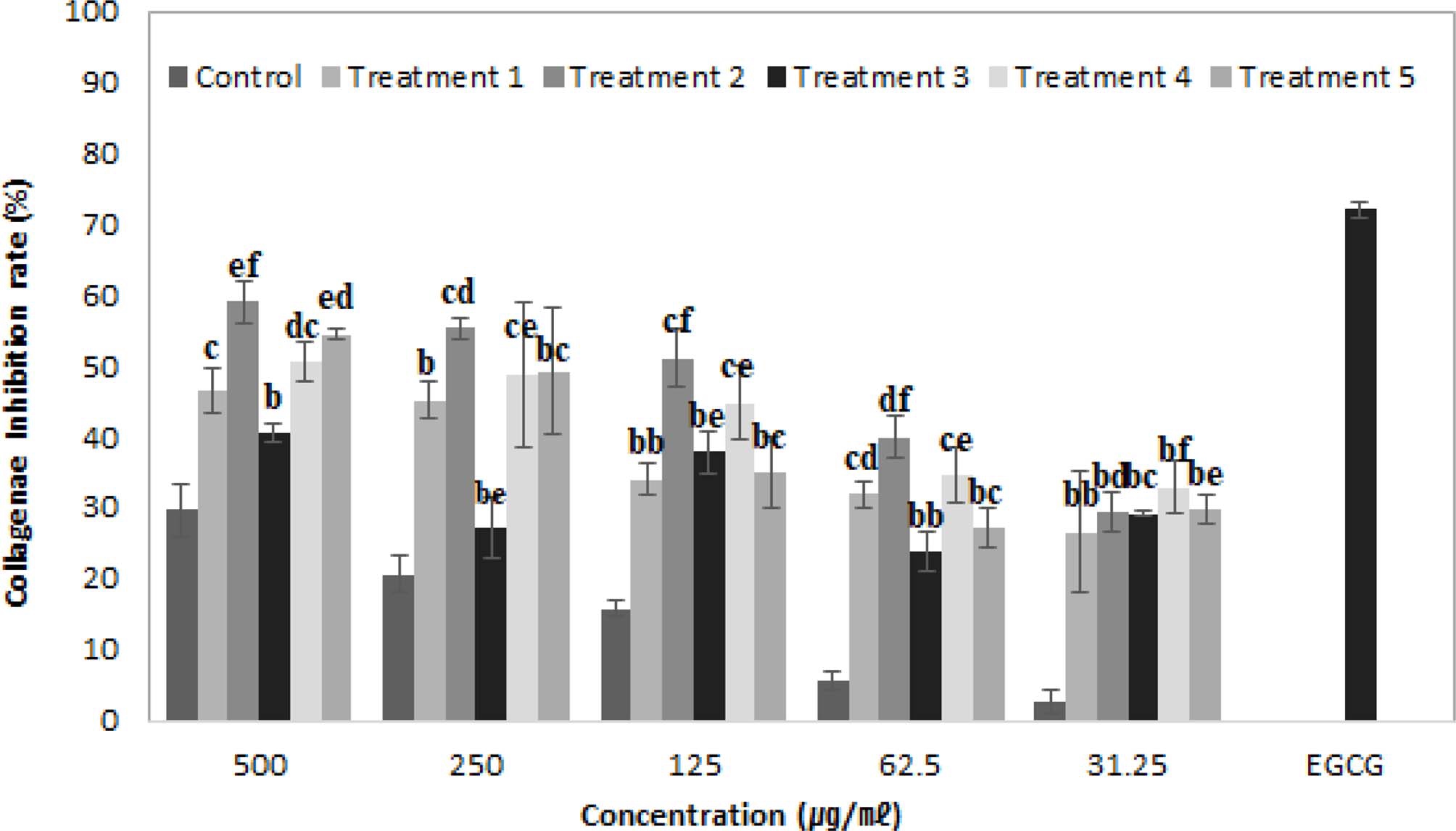
Collagenase inhibitory activity in oil of adventitious roots culture of wild mountain ginseng according to fermentation condition by S. cerevisiae.*Means are significantly different by Ducans’s Multiple Range Test (p < 0.05).
또한 125㎍/㎖ 농도에서는 대조군이 15.85 ± 1.19%를 나타낸 반면 효모균 처리군 (treatment 1 - 5)은 각각 34.01 ± 2.16%, 51.15 ± 4.12%, 37.90 ± 2.93%, 44.88 ± 5.16%, 35.09 ± 5.07%의 저해활성을 나타냄을 확인하였다.
250㎍/㎖ 농도에서는 대조군이 20.68 ± 2.63%, 효모균 처리 군 (treatment 1 - 5)이 45.17 ± 2.61%, 55.33 ± 1.63%, 27.63 ± 4.34%, 48.88 ± 10.21%, 49.32 ± 8.97%의 저해율을 각각 나타내 었고, 500㎍/㎖ 농도에서는 대조군 29.76 ± 3.77%을 나타낸 데 반하여 효모균 처리군 (treatment 1 - 5)은 46.69 ± 3.15%, 59.15 ± 2.92%, 40.49 ± 1.27%, 50.58 ± 2.82%, 54.54 ± 0.76%의 수준을 나타내어 산삼 부정 배양근 오일은 모든 처리구에서 농도 의존적으로 활성이 증가함을 확인할 수 있었으며, treatment 2에서 가장 높은 collagenase 저해활성을 확인하였다.
Choi 등 (2009)은 홍삼을 70% 에탄올 추출물의 주름개선 효능을 알아보고자 collagenase 저해활성을 측정하였고, 1,000㎍/㎖에서 29.0% 저해율을 보고하였다 (Choi et al., 2009). Park 등 (2016)은 산삼 부정 배양근 오일을 이용하여 사람 섬유아세포를 이용하여 콜라겐 생합성량을 측정하였을 때, 산삼 부정 배양근 오일을 함유하는 처리군에서 더 높은 콜라겐 양이 측정되어 주름개선에 효능을 확인하였다 (Park et al., 2016).
이상이 결과를 통하여 산삼 부정 배양근 초임계 유체 추출 오일에 효모균을 처리하는 경우 효모균의 대사과정 중에 발현 되는 desaturase에 의해 산삼 부정 배양근 초임계 유체 추출 오일에 포함되어져 있는 포화지방산의 변화를 유도하여 불포 화 지방산의 함량을 증가시킬 수 있으며 증가된 불포화 지방 산에 기인하여 elastase 및 collagenase에 대한 저해활성이 높 아졌다는 것을 확인할 수 있었고 이것을 통해 효모균 처리가 된 산삼 부정 배양근 초임계 유체 추출 오일이 주름개선에 대 하여 더 높은 주름 개선 효능을 나타낼 수 있을 것으로 생각되 며 효모균 처리의 최적 기간은 2 일이라는 것을 확인하였다.
본 연구의 결과를 통하여 산삼 부정 배양근을 주름개선을 위한 소재로 활용하고자 하는 경우 초임계 유체 추출이 발효 오일이 collagenase의 활성을 저해하여 주름개선에 대한 효능 을 가지는 것으로 판단되었으며, 선행연구와 유사한 결과가 나 타났다.
감사의 글
본 연구는 경제협력권산업육성사업(사업번호: R0004026)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Cannell, R.J.P, Kellam, S.J, Owsianka, A.M, Walker, J.M, (1988), Results of a large scale screen of microalgae for the production of protease inhibitors., Planta Med, 54, p10-14.
[https://doi.org/10.1055/s-2006-962319]

- Choi, M.E, Jeon, B.K, Kim, D.S, Mun, Y.J, Woo, W.H, (2009), A study on application for beauty food of mixture of Korean red ginseng and Fagopyrum esculentum: Anti-oxidative effect and collagenase inhibitory activity., Herbal Formula Science, 17, p153-162.
-
Daum, G, Vance, J.E, (1997), Import of lipids into mitochondria., Prog. Lipid Res, 36, p103-130.
[https://doi.org/10.1016/s0163-7827(97)00006-4]

- de Witt, D.L, Rollins, T.E, Day, J.S, Gauger, J.A, Smith, W.L, (1981), Orientation of the active site and antigenic determinants of prostaglandin endoperoxide synthase in the endoplasmic reticulum., J. Biol. Chem, 256, p10375-10382.
-
Gillis, C.N, (1997), Panax ginseng pharmacology: A nitric oxide link?, Biochem. Pharmacol, 54, p1-8.
[https://doi.org/10.1016/s0006-2952(97)00193-7]

- Hur, CG, Park, DS, Park, HN, Lee, JS, Lee, HY, (2011), Method for producing omega fatty acid-containing extract from plant using supercritical carbon dioxide extraction, USA. Patent. 13,696,060.
-
Kim, C.J, Seong, E.S, Yoo, J.H, Lee, J.G, Kim, N.J, Choi, S.K, Lim, J.D, Yu, C.Y, (2016), Biological activity of Panax ginseng C. A. Meyer culture roots fermented with microorganisms., Korean Journal of Medicinal Crop Science, 24, p191-197.
[https://doi.org/10.7783/kjmcs.2016.24.3.191]

- Kim, J.B, Kim, S.H, Park, S.Y, Chung, D.K, (2010), Effects of Korean mountain ginseng leaves and its active constituents on scopolamine-induced amnesia in mouse., Journal of Oriental Neuropsychiatry, 21, p125-144.
- Kim, SH, Jung, H, Shin, YC, Ko, SG, (2008), Research of traditional herbal medicines for anti-aging, inhibition effect of wrinkle and whitening effect in the skin.., Korean Journal of Oriental Physiology and Pathology, 22, p691-698.
-
Kim, T.H, Jeon, S.H, Hahn, E.J, Paek, K.Y, Park, J.K, Youn, N.Y, Lee, H.L, (2009), Effects of tissue-cultured mountain ginseng(Panax ginseng CA Meyer) extract on male patients with erectile dysfunction., Asian J. Androl, 11, p356-361.
[https://doi.org/10.1038/aja.2008.32]

- Lee, B.J, Kim, J.W, Ji, E.Y, Yun, S.Y, Lee, S.M, Lew, J.H, (2009), Anxiolytic and antidepressive effect of non-saponin fraction ofKorean red ginseng., Korea Journal of Herbology, 24, p143-148.
-
Lee, J.M, Lee, H.J, Kang, S.B, Park, W.J, (2016), Fatty acid desaturases, polyunsaturated fatty acid regulation, and biotechnological advances., Nutrients, a 8, p23.
[https://doi.org/10.3390/nu8010023]

- Lee, M.J, Kim, K.H, Bae, J.O, (2006), The effects of supercritical carbon dioxide on the extraction of perilla oil., Journal of the Korean Society of Food Science and Nutrition, 35, p1439-1443.
-
Lee, M.Y, Kim, B.A, Yang, J.C, (2016), Effects of extracts derived from red ginseng residue on antioxidant activity and elastase inhibition., Journal of the Korean Oil and Applied Science, b 33, p658-666.
[https://doi.org/10.12925/jkocs.2016.33.4.658]

- Lee, S.M, Yun, J.H, Chun, B.S, (2011), Fatty acid composition and oxidative properties of anchovy oil extracted by supercritical carbon dioxide., Cleanroom Technol, b 17, p266-272.
-
Lee, Y.S, Im, D.H, Yang, J.C, Noh, D.S, Kim, K.I, Oh, S.K, Choi, K.C, Cha, Y.H, (2011), Study on the qualitative discrimination of white, red, and black ginseng extract., Korean Journal of Food and Nutrition, a 24, p138-143.
[https://doi.org/10.9799/ksfan.2011.24.1.138]

-
Martin, C.E, Oh, C.S, Kandasamy, P, Chellapa, R, Vemula, M, (2002), Yeast desaturases., Biochem. Soc. Trans, 30, p1080-1082.
[https://doi.org/10.1042/bst030a103]

-
Miquel, M.F, Browse, J.A, (1994), High-oleate oilseeds fail to develop at low temperature., Plant Physiol, 106, p421-427.
[https://doi.org/10.1104/pp.106.2.421]

-
Mori, M, Ikeda, N, Kato, Y, Minamino, M, Watabe, K, (2002), Inhibition of elastase activity by essential oils in vitro., J. Cosmet. Dermatol, 1, p183-187.
[https://doi.org/10.1111/j.1473-2165.2002.00059.x]

-
Niemann, H, (2004), Transgenic pigs expressing plant genes., Proc. Natl. Acad. Sci. USA, 101, p7711-7212.
[https://doi.org/10.1073/pnas.0402011101]

- Park, JW, Jung, MS, Park, CM, (2016), Cosmetic composition comprising oil of cultured root of wild ginseng., Korea. Patent. 10-2016-0108917.
-
Park, S.J, Yoo, S.M, Kim, Y.E, (2012), Nutritional characteristics and screening of biological activity of cultured wild ginsengroots., Korean Journal of Food and Nutrition, 25, p729-736.
[https://doi.org/10.9799/ksfan.2012.25.4.729]

- Petrie, J.R, Shrestha, P, Belide, S, Kennedy, Y, Lester, G, Liu, Q, Divi, U.K, Mulder, R.J, Mansour, M.P, Nichols, P.D, Singh, S.P, (2009), Metabolic engineering Camelina sativa with fishoil-like levels of DHA., PLoS One, 9, p1-8.
-
Qiu, X, Hong, H, Datla, N, MacKenzie, S.L, Taylor, D.C, Thomas, T.L, (2002), Expression of borage -36 desaturase in Saccharomyces cerevisiae and oilseed crops., Can. J. Bot, 80, p42-49.
[https://doi.org/10.1139/b01-130]

- RebolA(c), A, RodrA-guez, M.L, Ortiz, L.T, Alzueta, C, Centeno, C, Viveros, A, Brenes, A, Arija, I, (2006), Effect of dietary higholeic acid sunflower seed, palm oil and vitamin E supplementation on broiler performance, fatty acid composition and oxidationsusceptibility of meat., Br. Poult. Sci, 47, p581-591.
-
Rennert, B, Melzig, M.F, (2002), Free fatty acids inhibit the activity of clostridium histolyticum collagenase and human neutrophil elastase., Planta Med, 68, p767-769.
[https://doi.org/10.1055/s-2002-34411]

- Shin, C.S, Lee, D.H, Kim, S.H, Shin, M.H, Jeong, C.H, Shim, K.H, (2010), Ginsenoside contents and antioxidative activities from red ginseng treated with high hydrostatic pressure., Journalof Agriculture and Life Science, 44, p133-140.
- Shin, M.H, (2001), Study of mountain ginseng adventitious culture and application., Journal of the Society of Cosmetic Scientists of Korea, 27, p45-56.
- Shon, M.S, Song, J.H, Kim, J.S, Jang, H.D, Kim, G.N, (2013), Anti-oxidant activity of oil extracted from Korean red ginseng and its moisturizing function., Korean Journal of Aesthetic Society, 11, p489-494.
-
Tsuji, N, Moriwaki, S, Suzuki, Y, Takema, Y, Imokawa, G, (2001), The role of elastases secreted by fibroblasts in wrinkle formation: Implication through selective inhibition of elastaseactivity., Photochem. Photobiol, 74, p283-290.
[https://doi.org/10.1562/0031-8655(2001)074<0283:troesb>2.0.co;2]

- WA1/4nsch, E, Heidrich, H.G, (1963), Zur quantitativen bestimmung der kollagenase., Biol. Chem, 333, p149-151.
-
Yoo, J.H, Choi, J.H, Kang, B.J, Jeon, M.R, Lee, C.O, Kim, C.H, Seong, E.S, Heo, K, Yu, C.Y, Choi, S.K, (2017), Antioxidant and tyrosinase inhibition activity promoting effects of perilla by the light emitting plasma., Korean Journal of Medicinal Crop Science, 25, p37-44.
[https://doi.org/10.7783/kjmcs.2017.25.1.37]

-
Youn, J.S, Shin, S.Y, Wu, Y, Hwang, J.Y, Cho, J.H, Ha, Y.G, Kim, J.K, Park, M.J, Lee, S.H, Kim, T.H, Kim, T.W, (2012), Antioxidant and anti-wrinkling effects of Aruncus dioicus var. kamtschaticus extract., Korean Journal of Food Preservation, 19, p393-399.
[https://doi.org/10.11002/kjfp.2012.19.3.393]

- Yu, H.S, (2014), Effect of ethanol extract of Rosa rugosa Thunb. on hypopigmentation and antioxidant activity. Ph.D. Thesis. University of Wonkwang. p.1-65.