
심재, 변재, 형성층 및 사부를 포함한 뽕나무 심부 고온추출물의 항염증 활성
†Corresponding author: (Phone) +82-61-860-2812E-mail) thej01234@gmail.com
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Inflammation plays an important role in various diseases, including ulcerative colitis, Behcet's disease, and rheumatoid arthritis. In this study, we investigated the anti-inflammatory effects of Morus alba L. extracts obtained using different extraction methods (water extraction or high temperature extraction) on RAW264.7 cells.
Extracts from the central part (including the heartwood, sapwood, cambiun, and phloem) and bark (including the periderm and cortex) of Morus alba L. were obtained using either water or high temperature extraction. The following extract were obtained: MA1, water extract from the central part of Morus alba L., MA2, high temperature extract from the central part of Morus alba L., MA3, water extract from the bark of Morus alba L., and MA4, high temperature extract from the bark of Morus alba L. None of these extracts was observed to be cytotoxic to RAW264.7 cells. The MA2 extract reduced the production of LPS-induced NO (nitric oxide), PGE2 (prostaglandin E2), TNF-α, IL-6, and IL-1β production in LPS-stimulated RAW264.7 cells.
These results indicated that the inflammatory response was moderated by MA2. Treatment with MA2 could be used as a natural medicine for treating diseases involving inflammation. However, further experiments are required to determine how the high temperature extraction method alters the active ingredients in the extract and influences the anti-inflammatory effects of Morus alba L..
Keywords:
Morus alba L., Extraction, Inflammation, RAW264.7 Cells서 언
뽕나무 (Morus alba L.)는 온대지역에서부터 열대지방까지 널리 분포하는 식물로 뽕나무과 (Moraceae)와 뽕나무속 (Morus)에 속하고 있으며, 예로부터 우리나라에서 이용되어져 왔을 뿐만 아니라 식품공전에 등록된 이후로 여러 가공식품 또는 건강식품의 재료로 많이 이용되고 있고 (Onogi et al., 1994; Shin et al., 1995; Kim et al., 2003), 이러한 뽕나무 의 주요 유효성분으로 여러 flavonoid, stilbene, coumarin 등 이 보고되어 있다 (Oh et al., 2002).
염증반응은 감염으로 인한 신체의 손상을 막는 방어기전 중 하나로, 발열과 통증 같은 증상을 나타내며, 이러한 반응을 통 해 손상된 조직을 복구하거나 재생하는 기전이다 (Zamora et al., 2000; Nathan, 2002). 하지만 염증반응이 장시간 지속될 경우 신경퇴행질환 또는 염증성 장질환 (bowel disease)과 같 은 여러 만성질환 또는 피부 괴사, 암 등으로 발전할 수 있는 요인이 되며 (Simons et al., 1996; Guslandi, 1998; Wang et al., 2007), 염증매개성 물질인 NO (nitric oxide), PGE2 (prosaglandin E2), IL-6가 분비된다.
현재까지 염증반응을 억제하기 위해 사용하는 항염증 소재 는 효과가 강력한 만큼 부작용을 동반하는 경우가 많기 때문 에 부작용이 없고 염증억제반응이 강한 천연물 소재를 탐색하 기 위한 연구가 활발히 진행되고 있다. 따라서 다양한 염증반 응으로부터 생성되는 염증매개성 물질의 분비를 억제시키는 항염증 치료 소재를 천연물로부터 찾고자 하는 연구들이 활발 하게 진행되고 있다 (Lee et al., 2011; Lee et al., 2013a).
나무는 크게 표피, 주피, 후각조직, 후막조직, 목부, 사부 및 분비조직으로 분류되는데, 이중 목부 (xylem)와 사부 (phloem) 는 여러 영양소를 운반하거나 저장하는 역할을 한다 (Lalonde et al., 2004). 사부 내부에는 conducting cell, parenchyma cell, companion cell, albuminous cell 또는 supportive cell을 포함한 여러 세포들이 구조를 이루고 있으며, 이 중 parenchyma cell로 분류되는 aerenchyma cell 과 chlorenchyma cell은 다양한 영양 분을 저장하는 기능을 한다고 알려져 있다 (Raven et al., 1992). 여러 연구결과를 비추어 볼 때 식물의 부위마다 함유 하고 있는 성분이 다를 수 있고, 효능도 차이가 난다고 알려 져 있기 때문에 나무의 부위를 세분화해서 효능을 평가하는 것이 중요하다고 생각 된다 (Yang et al., 2012; Im, 2014).
또한 천연물의 추출법은 대부분 물 증류, 수증기 증류 등과 같은 증류법, 기계적인 방법을 통한 압착법, 용매를 이용한 용 매추출법이 이용되고 있으며 (Shin et al., 2012), 추출방법에 따라 식물에서 분리되는 성분의 차이가 나타난다고 여러 연구 를 통해 알려져 있지만 (Woo et al., 2010; Lee et al., 2013b; Park and Hong, 2014), 이러한 추출 방법은 낮은 추 출효율, 추출 시간, 유효성분 파괴와 같은 단점이 나타난다 (Kwon, 2002; Park et al., 2004).
연구에 따르면 물은 250℃ 이상의 고온에서 메탄올 또는 에 탄올과 유사한 유전상수를 갖는데, 이는 메탄올 또는 에탄올 로 추출하는 화합물들을 추출할 수 있다고 알려져있다 (Bergeron et al., 2005; Katherine et al., 2008).
따라서 본 연구는 뽕나무의 심부와 수피부분의 항염증 효과 와 효과적인 추출방법을 개발하기 위한 기초 자료를 제시하기 위해 수행하였다.
재료 및 방법
1 실험 재료와 추출물의 제조
실험에 사용한 뽕나무 (Morus alba L.)는 충청북도 충주 천등산 일원에서 한경대학교 이상각박사의 동정을 받아 5 년 이상 된 뽕나무 주간을 10월경 채취한 직후 곧바로 절단하여 표피를 제거하고 절단하여 수피 (주피 및 피층을 포함하는 부 분)와 심부 (수, 심재, 변재, 형성층 및 사부를 포함한 부위)를 분리하였다.
분리된 뽕나무의 수피와 심부는 고온추출하기 위해 일정간 격 (20㎝)으로 절단하였다. 절단된 수피와 심부는 각각 원형 옹기에서 500℃로 약 48 시간 동안 가열하여 filter paper (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 통 해 바닥으로 떨어지는 뽕나무 원액을 약 12.6ℓ (54.7%)를 얻었다.
뽕나무 원액은 다시 filter paper를 이용하여 재필터 하고 그 중에서 1ℓ를 동결 건조하여 약 265 g의 파우더를 수득하여 PBS (phosphate buffered salin)에 일정 농도가 되도록 녹여 실험에 사용하였다. 물 추출물은 뽕나무를 건조시킨 뒤 무게 당 10 배의 증류수를 가하여 60℃에서 48 시간 동안 교반하 면서 유효성분을 추출한 뒤 감압농축하여 동결건조한 것을 일 정농도가 되도록 PBS (phosphate buffered saline, Sigma- Aldrich Co., St. Louis, MO, USA)에 녹여 filter paper로 필 터한 뒤 시료로 사용하였다.
시료는 각각 뽕나무 심부 물 추출물 (MA1), 뽕나무 심부 고온 추출물 (MA2), 뽕나무 수피 물 추출물 (MA3), 뽕나무 수피 고온 추출물 (MA4)로 분류하여 실험에 사용하였다.
2 세포배양
RAW264.7 세포주는 한국세포주은행 (KCLB, Seoul, Korea)에서 분양받아 실험에 사용하였다. Dulbecco’s modified Eagel’s medium (Thermo Fisher Scientific Inc., Waltham, MA, USA)에 10% fetal bovine serum (FBS, Thermo Fisher Scientific Inc., Waltham, MA, USA), 1% penicilinstreptomycin (Sigma-Aldrich Co., St. Louis, MO, USA)을 첨가하여 사용하였고. 37℃, 5% CO2 조건에서 배양하고 유지 하였다.
3 세포생존율 분석
세포생존율은 CellTiter 96® AQueous one solution cell proliferation assay kit (Promega Co., Madison, WI, USA) 를 사용하였고, 제조사에서 제공된 프로토콜에 따라 실험을 진 행하였다.
RAW264.7 세포주를 96 well plate에 2 × 105 cells/㎖ 농 도가 되도록 분주하고, 37℃, 5% CO2 배양기에서 24 시간 배양한 뒤 뽕나무 추출물을 각각 12.5, 25, 50, 100 그리고 200㎍/㎖ 농도로 24 시간 동안 처리하였다. 24 시간 뒤 20㎕ MTS solution를 넣고 2 시간 동안 배양한 후 microplate reader infinite® 200 PRO (TECAN, Mannedorf, Switzerland) 를 이용해 490㎚에서 흡광도를 측정했다. 생존율은 정상대조 군에 대한 생존율로 표시하고 이에 따라 세포보호효과가 있는 농도를 확인하였다.
4 NO (nitric oxide) 농도 측정
LPS (lipopolysaccharide)로 자극된 RAW264.7 세포에서, 각각 추출물의 NO 생성 억제효과를 측정하기 위해 뽕나무 추 출물을 여러 농도로 전처리한 뒤 LPS (500 ng/㎖)를 24 시간 동안 처리하였다. 다음으로 griess reagent system (Promega Co., Madison, WI, USA)을 이용하여 제조사에서 제공된 프 로토콜에 따라 실험을 수행하였다.
RAW264.7 세포주를 96 well plate에 2 × 105 cells/㎖ 농도 가 되도록 분주한 뒤, 37℃, 5% CO2 배양기에서 세포를 24 시간 배양한 후 뽕나무 추출물을 각각 12.5, 25, 50, 100 그 리고 200㎍/㎖ 농도로 24 시간 동안 처리하였다. 다음으로 세포배양액과 키트에서 제공된 시약을 1 : 1 비율로 혼합하여 처리하고 10 분간 반응시킨 뒤, microplate reader infinite® 200 PRO (TECAN, Mannedorf, Switzerland)를 이용하여 540㎚에서 흡광도를 측정하였다.
5 Prostaglandin E2 (PGE2) 농도 측정
뽕나무 추출물의 PGE2 분비 억제효과를 측정하기 위해 PGE2 elisa kit (Enzo Life Sciences Inc, Farmingdale, NY, USA)를 이용하여 실험을 진행하였다.
RAW264.7 세포주를 96 well plate에 2 × 105 cells/㎖ 농도 가 되도록 분주한 뒤 37℃, 5% CO2 배양기에서 세포주를 24 시간 배양한 후, 뽕나무 추출물을 각각 25, 50, 100 그리고 200㎍/㎖ 농도로 24 시간 동안 처리하였다. 그 후 세포배양 상층액을 세포와 분리하기 위해 원심분리기로 4℃, 13,000 × g 조건에서 10 분간 원심분리 하였고, 세포가 완전히 제거된 세포배양액을 이용해 제조사에서 제공된 프로토콜에 따라 PGE2 농도를 측정하였다.
6 Cytokines (TNF-α, IL-1β, IL-6) 농도 측정
LPS로 자극된 RAW264.7 세포주에 대해 뽕나무 추출물의 염증성매개인자 억제 효과를 확인하기 위해 R&D system (R&D system, Minneapolis, MN, USA)사의 mouse TNF-alpha duoset elisa (DY410), mouse IL-6 duoset elisa (DY406), mouse IL-1 beta/IL-1F2 duoset elisa (DY401)를 사용하여 실 험을 진행하였다.
RAW264.7 세포주를 96 well plate에 2 × 105 cells/㎖ 농도 가 되도록 분주한 뒤 37℃, 5% CO2 배양기에서 24 시간 배 양한 후 추출물을 각각 25, 50, 100 그리고 200㎍/㎖ 농도 로 24 시간 동안 처리하였다. 그 후 세포배양 상층액을 세포 와 분리하기 위해 원심분리기로 4℃, 13,000 × g 조건에서 10 분간 원심분리 하였고, 세포가 완전히 제거된 세포배양액을 이 용해 제조사에서 제공한 프로토콜에 따라 각각 염증인자에 대 한 농도를 측정하였다.
7 통계처리
통계처리는 평균 ±표준편차 (Means ± SD)로 나타냈으며, 유 의성을 검정하기 위해 SPSS (Statistical Package for Social Science Inc., Chicago, IL, USA) 통계 프로그램을 사용하였다. 일원변량분석 (One-way ANOVA)을 실시하였고, 유의성이 있 는 경우 p < 0.05 수준에서, Duncan’s Multiple Range Test (DMRT)를 실시하였다.
결과 및 고찰
1 추출물 처리가 RAW264.7 세포주의 세포생존율에 미치는 영향
마우스 대식세포인 RAW264.7 세포주에 대한 각각 뽕나무 (Morus alba L.) 추출물의 세포독성을 확인하기 위해 MTS 분 석을 진행하였다. 추출물들을 각각 12.5, 25, 50, 100 그리고 200㎍/㎖ 농도로 24 시간 동안 처리하였을 때, RAW264.7 세포주에 대한 독성은 나타나지 않았다 (Fig. 1A, 1B, 1C and 1D).
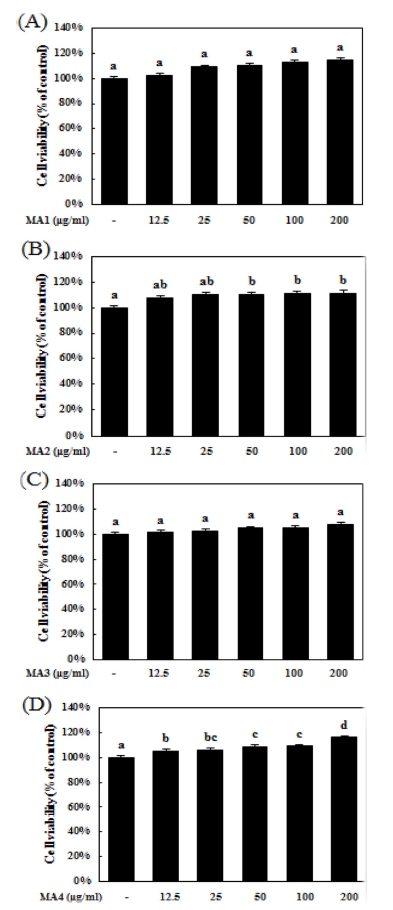
Cytotoxic evaluation of extracts from Morus alba L. in RAW264.7 cells.MA1; water extract from central part of Morus alba L., M2; high temperature extract from central part of Morus alba L., M3; water extract from bark of Morus alba L., M4; high temperature extract from bark of Morus alba L. RAW264.7 cells were treated with extracts for various concentration. (A-D) Cell viability was measured by MTS assay. Means values± SD from triplicate separated experiments are shown. *Means with difference letters are significantly different at p< 0.05 by Duncan’s Multiple Range Test (DMRT).
흥미롭게도 MA2 (뽕나무 심부 고온 추출물)와 MA4 (뽕나 무 수피 고온 추출물)는 세포증식을 각각 정상대조군 대비 11.1 ± 1.6% 그리고 11.6 ± 0.3%씩 유의적으로 증가시키는 결 과가 나타났지만 수치는 미미하였다 (Fig. 1B and 1D).
따라서 추출물들은 200㎍/㎖ 농도까지 독성이 없는 것으로 나타났고, 이러한 결과를 바탕으로 추출물이 LPS 자극에 의 해 증가된 nitric oxide 분비를 억제할 수 있는지 알아보기 위 해 실험에 사용할 농도를 12.5, 25, 50, 100 그리고 200㎍/㎖ 농도로 결정하였다.
2 추출물의 nitric oxide (NO) 생성 억제효과
대표적으로 NO는 NOS (nitric oxide synthase)에 의해 합 성되며 이는 일반적으로 체내에 침투한 박테리아나 종양을 제 거하는 면역반응 활성의 지표가 되어 흔히 이용되고 있다 (Moncada et al., 1991; Nathan, 1992).
이에 따라 각각 추출물이 LPS 자극에 의해 증가되는 nitric oxide 생성에 미치는 영향을 조사하기 위해 NO assay를 진행 하였다. 추출물들을 각각 12.5, 25, 50, 100 그리고 200㎍/㎖ 농도로 전처리한 뒤 LPS를 500 ng/㎖의 농도로 24 시간 동안 처리하였다.
LPS 단독 처리군은 비처리군에 비교하여 NO 생성량이 각 각 실험에서 유의적으로 증가하였다. MA3 (뽕나무 수피 물 추출물)와 MA4 (뽕나무 수피 고온 추출물)는 NO 생성량이 LPS 단독 처리군에 비해 유의적으로 감소하긴 하였으나 그 효 과는 미미하였다 (Fig. 2C and 2D).
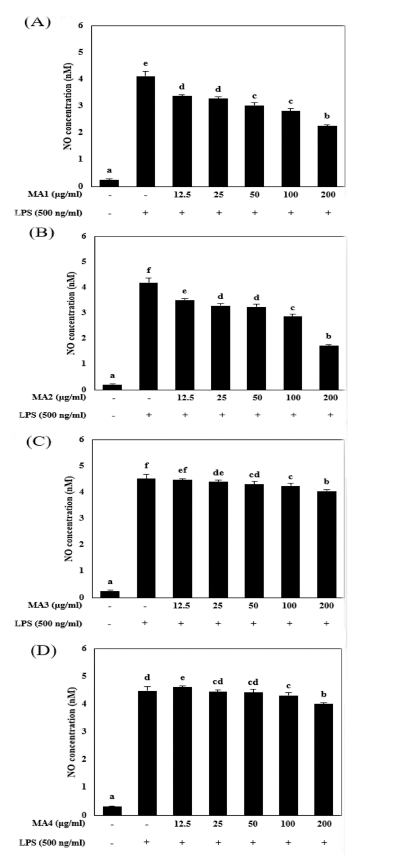
Effect of extracts from Morus alba L. on LPS-stimulated NO production in RAW264.7 cells.MA1; water extract from central part of Morus alba L., M2; high temperature extract from central part of Morus alba L., M3; water extract from bark of Morus alba L., M4; high temperature extract from bark of Morus alba L. (A-D) After pretreatment with 500 ng/㎖ LPS (lipopolysaccharide) for 30 min, RAW264.7 cells were treated with various concentration of extract for 24 h. Culture medium was subjected to NO assay. Data represent the mean±SEM of three independent experiments. *Means with difference letters are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
MA1 (뽕나무 심부 물 추출물)은 LPS 단독 처리군의 NO 생성량이 4.33 ± 0.16 nM로 증가했을 때 200㎍/㎖의 농도에 서 2.36 ± 0.04 nM로 감소시켰으며, MA2 (뽕나무 심부 고온 추출물)은 LPS 단독 처리군이 4.19 ± 0.39 nM로 증가하였을 때 1.73 ± 0.14 nM까지 감소시킨 결과를 확인하였다 (Fig. 2A and 2B).
결과를 종합하였을 때 뽕나무 수피 추출물 (MA3, MA4)에 비해 뽕나무 심부 추출물 (MA1, MA2)이 NO 생성 억제효과 가 가장 많이 나타났으며, 그 중 MA2 (뽕나무 심부 고온 추 출물)은 MA1 (뽕나무 심부 물 추출물)에 비해 NO 생성 억 제효과가 좀 더 높은 것으로 확인되었으며, M2가 200㎍/㎖ 의 이상의 농도부터 유효적인 효과를 나타내는 것으로 생각 된다 (Fig. 2B).
NO는 작은 분자량은 가지는 free radical (유리기)이며, 신경 전달과 혈압을 조절할 수 있는 등 인체에서 중요한 역할을 한다. 또한 세포독성을 가지기 때문에 염증반응이 일어날 때 숙주방어기전에서 세포독성에 관여하는 매개체로 알려져 있다 (Kim and Kim, 2002).
따라서 NO의 억제는 염증반응을 억제 할 수 있는 것으로, 뽕나무 심부 고온 추출물이 항염증 활성을 가지고 있다고 생 각된다. 하지만 이는 RAW264.7 세포주 내에 NO 생성량만을 확인한 결과로, 세포내에서 NO 생성에 관여하는 NOS (nitric oxide synthase)의 단백질 또는 mRNA 발현량을 확인하여 어 떤 과정에서 NO 생성을 억제하는지 알아보는 추가 실험이 필 요하다고 생각된다.
3 MA2의 cytokines (TNF-α, IL-6, IL-1β), PGE2 억제효과
IL-6 (interleukin-6)는 대식세포를 포함하는 여러 세포에서 분비되어 자가면역과 만성염증반응을 포함한 다양한 면역반응 을 촉진한다고 알려져 있을 뿐만 아니라, 신장의 사구체를 구 성하는 mesangial 세포의 증식이나 synovial fibroblast를 통한 혈관신생, 파골세포 분화와 같은 생체반응에 널리 관여하는 단 백질이다 (Tanaka et al., 2014).
TNF-α (tumor necrosis factor-α)는 다른 염증매개물질과 다 르게 병원성 자극에 의해 유도되는 염증성 인자로서, 후천 면 역 및 선천 면역에서 가장 중요한 역할을 담당하는 것으로 알 려져 있을 뿐만 아니라 (Song, 2007), 염증세포의 사멸, 분화 및 증식과 같은 여러 세포과정에 관여함에 따라 염증반응의 중요한 인자 중 하나로 보고되어 있다 (Bradley, 2008).
IL-1β (interleukin-1 beta)는 대표적인 pro-inflammatory cytokine 중 하나로 통증, 염증, 자가 면역과 같은 여러 염증 반응에서 주요 인자로 작용하는 단백질로 알려져 있으며, 세 포 내부의 염증조절복합체 (inflammasome)를 통해 NLRP-1 (NACHT, LRR and PYD domains-containing protein 1)과 caspase-1에 의해 활성화되는 염증매개물질로 알려져 있다 (Ren and Torres, 2009).
이에 따라 NO 생성 억제효과가 가장 높게 나타났던 MA2 (뽕나무 심부 고온 추출물)이 염증매개인자 발현에 어떤 영향 을 미치는지 알아보기 위해 TNF-α, IL-6, IL-1β에 대한 ELISA assay를 진행하였다.
추출물들을 각각 25, 50, 100 그리고 200㎍/㎖ 농도로 전 처리 한 뒤 LPS를 500 ng/㎖의 농도로 24 시간 동안 처리하 였다. TNF-α의 농도는 LPS 단독 처리군은 비처리군에 비교 하여 965.15 ± 28.2 pg/㎖의 농도로 증가하였지만 200㎍/㎖의 MA2 추출물을 처리하였을 때 441.24 ± 14.8 pg/㎖로 감소하였 다 (Fig. 3A). IL-6 ELISA assay에서 LPS 단독 처리군은 IL- 6 생성이 2,202.88 ± 120.2 pg/㎖로 증가되었지만 200㎍/㎖의 MA2 추출물을 처리하였을 때 1,473.64 ± 70.7 pg/㎖의 농도로 감소되었다 (Fig. 3B).
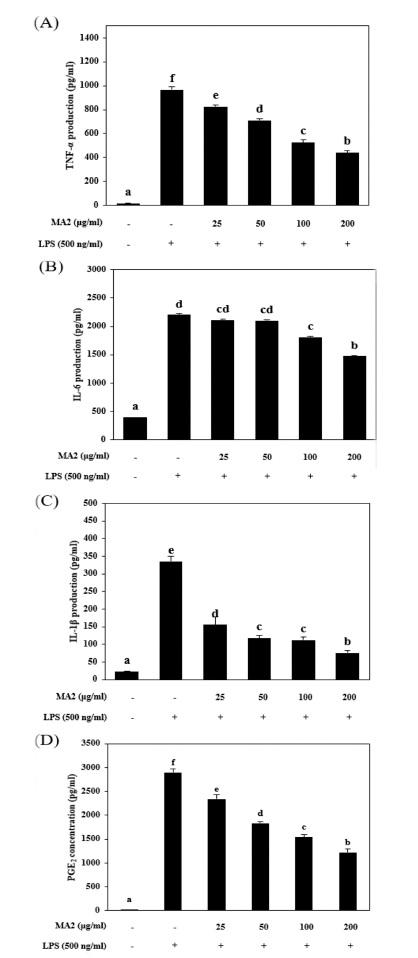
MA2 reduced LPS-stimulated cytokine and PGE2 production in RAW264.7 cells.M2; high temperature extract from central part of Morus alba L. (A-D) After pretreatment with 500 ng/㎖ LPS (lipopolysaccharide) for 30 min, RAW264.7 cells were treated with various concentration of extract for 24 h. Culture medium was subjected to ELISA assay. Data represent the mean ± SEM of three independent experiments. *Means with difference letters are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
다음으로 IL-1β 생성을 확인해본 결과, LPS 단독 처리군은 생성량이 335.14 ± 14.1 pg/㎖으로 증가되었지만 200㎍/㎖의 MA2 추출물을 처리하였을 때 46.1 ± 6.3 pg/㎖의 농도로 감소 되었다 (Fig. 3C).
PGE2 (prostaglandin E2)는 염증반응과 연관성이 매우 깊은 염증인자로써 염증을 매개할 뿐만 아니라 혈관신생과 같은 염 증반응을 유도하여 조직을 파괴하기도 한다 (Ji et al., 2004).
이에 따라 세포 내에 PGE2의 생성 농도를 확인한 결과, LPS 단독 처리군은 2,894.39 ± 73.5 pg/㎖으로 증가한 반면 200㎍/㎖ 농도의 MA2를 처리한 결과 1,221.17 ± 77.7 pg/㎖ 로 감소하였다 (Fig. 3D).
이러한 연구 결과로부터 뽕나무 심부 고온 추출물은 LPS로 유발시킨 RAW 264.7 대식세포의 cytokine과 PGE2의 발현을 억제하여 염증반응을 개선시키는 천연 소재 추출물로써 이용 될 수 있으므로, TNF-α, IL-6 그리고 IL-1β의 발현을 조절하 는 전사인자 (transcription factor)인 NF-κB (nuclear factor kappaB)와 PGE2의 생성에 관여하는 COX2 (cyclooxygenase 2)의 단백질 또는 mRNA 발현량과 NF-κB의 핵내 이동 (neclear translocation)을 확인하는 추가적인 실험이 필요 할 것으로 생각된다.
이러한 연구 결과로부터 뽕나무 심부 고온 추출물은 LPS로 유발시킨 RAW264.7 대식세포의 cytokine과 PGE2의 발현을 억제하여 염증반응을 개선시키는 천연 소재 추출물로써 이용 될 수 있으므로, in vitro 염증 억제 작용기전 및 in vivo에 대한 상세한 연구가 진행되어야 할 것으로 사료된다.
References
-
C Bergeron, S Gafner, E Clausen, DJ Carrier, Comparison of the chemical composition of extracts from Scutellaria lateriflora using accelerated solvent extraction and supercritical fluid extraction versus standard hot water or 70% ethanol extraction., J. Agric. Food Chem, (2005), 53, p3076-3080.
[https://doi.org/10.1021/jf048408t]

-
JR Bradley, TNF-mediated inflammatory disease., J. Pathol, (2008), 214, p149-160.
[https://doi.org/10.1002/path.2287]

- M Guslandi, Nitric oxide and inflammatory bowel disease., Eur. J. Clin. Invest, (1998), 28, p904-907.
- DY Im, Volatile compounds analysis of the extract form dried bark of Prunus sargentii and physiological activity of the main compound, benzaldehyde., Korean Journal of Aesthetic and Cosmetology, (2014), 12, p155-162.
- JD Ji, YH Lee, GG Song, Prostaglandin E2 (PGE2): Roles in immune responses and inflammation., Journal of the Korean Rheumatism Association, (2004), 11, p307-316.
- LS.V Katherine, CC Edgar, WK Jerry, RH Luke, CD Julie, Extraction conditions affecting supercritical fluid extraction(SFE) of lycopene from watermelon., Bioresour. Technol, (2008), 99, p7835-7841.
- MW Kim, MS Ahn, YH Lim, The antioxidative activities of mulberry leaves extracts on edible soybean oil., Korean Journal of Food Culture, (2003), 18, p1-8.
-
YK Kim, SK Kim, Nitric oxide and dental pulp., Journal of Korean Academy of Operative Dentistry, (2002), 27, p543-551.
[https://doi.org/10.5395/jkacd.2002.27.5.543]

- YJ Kwon, KH Kim, HK Kim, Changes of total polyphenol content and antioxidant activity of Ligularia fischeri extracts with different microwave-assisted extraction conditions., Korean Journal of Food Preservation, (2002), 9, p332-337.
-
S Lalonde, D Wipf, WB Frommer, Transport mechanisms for organic forms of carbon and nitrogen between source and sink., Annu. Rev. Plant Biol, (2004), 55, p341-372.
[https://doi.org/10.1146/annurev.arplant.55.031903.141758]

-
GS Lee, KY Nam, JE Choi, Ginsenoside composition and quality characteristics of red ginseng extracts prepared with different extracing methods., Korean Journal of Medicinal Crop Science, (2013), b 21, p276-281.
[https://doi.org/10.7783/kjmcs.2013.21.4.276]

-
HN Lee, DY Lim, SS Lim, JD Kim, JH Yoon, Antiinflammatory effect of ethanol extract from Eupatorium japonicum., Korean J. Food Sci. Technol, (2011), 43, p65-71.
[https://doi.org/10.9721/kjfst.2011.43.1.065]

-
SH Lee, SJ Suh, KH Lee, JB Yang, SU Choi, SS Park, Anti-inflammatory effect of peel extracts from citrus fruits., Journal of Food Hygiene and Safety, (2013), a 28, p342-348.
[https://doi.org/10.13103/jfhs.2013.28.4.342]

- S Moncade, RM.J Palmer, EA Higgs, Nitric oxide: Physiology, pathophysiology, and phamacology., Pharmacol. Rev, (1991), 43, p109-142.
-
C Nathan, Nitric oxide as a secretory product of mammalian cells., FASEB J, (1992), 6, p3051-3064.
[https://doi.org/10.1096/fasebj.6.12.1381691]

-
C Nathan, Points of control in inflammation., Nature, (2002), 420, p846-852.
[https://doi.org/10.1038/nature01320]

-
HC Oh, EK Ko, YJ Jun, MH Oh, SU Park, KH Kang, HS Lee, YC Kim, Hepatoprotective and free radical scavenging activities of prenylflavonoid, coumarin, and stilbene from Morus alba., Planta Med, (2002), 68, p932-934.
[https://doi.org/10.1055/s-2002-34930]

- A Onogi, K Osawa, H Yasuda, A Sakai, H Morita, H Tokawa, Flavonol glycoside from the leaves of Morus alba L., Shoyakugaku Zasshi, (1993), 47, p423-425.
-
HM Park, JH Hong, Effect of extraction methods on antioxidant activities of Mori ramulus., Journal of the Korean Society of Food Science and Nutrition, (2014), 43, p1709-1715.
[https://doi.org/10.3746/jkfn.2014.43.11.1709]

- JH Park, HS Lee, HC Mun, DH Kim, NS Seong, HG Jung, JK Bang, HY Lee, Improvement of anticancer activation of ultrasonificated extracts from Acanthopanax senticosus Harms, Ephedra sinica Stapf, Rubus coreanus Miq. and Artemisia capillaris Thunb., Korean Journal of Medicinal Crop Science, (2004), 12, p273-278.
- PH Raven, RF Evert, SE Eichhorn, Biology of plants, New York, NY, USA, Worth Publishers, (1992), p791.
-
K Ren, R Torres, Role of interleukin-1I during pain and inflammation., Brain Res. Brain Res. Rev, (2009), 60, p57-64.
[https://doi.org/10.1016/j.brainresrev.2008.12.020]

- KH Shin, HS Young, TW Lee, JS Choi, Studies on the chemical component and antioxidative effects of solanum lyratum., Korean J. Pharmacogn, (1995), 26, p130-138.
-
YH Shin, HJ Kim, JY Lee, YJ Cho, BJ An, Major compound analysis and assessment of natural essential oil on anti-oxidative and anti-microbial effects., J. Life Sci, (2012), 22, p1344-1351.
[https://doi.org/10.5352/jls.2012.22.10.1344]

- RK Simons, WG Junger, WH Loomis, DB Hoyt, Acyte lung injury in endotoxemic rats is associated with sustained circulating IL-6 levels and intrapulmonary CINC activity and neutrophil recruiment role of ciculating TNF-I and IL-1I ?, Shock, (1996), 6, p39-45.
-
JS Song, Review of tumor necrosis factor inhibitors on rheumatoid arthritis., Journal of Korean Rheumatic Diseases, (2007), 14, p1-14.
[https://doi.org/10.4078/jkra.2007.14.1.1]

- T Tanaka, M Narazaki, T Kishimoto, (2014), IL-6 in inflammation, immunity, and disease. Cold Spring Harbor Perspectives in Biology. 6:a016295, http://cshperspectives.cshlp.org/content/6/10/a016295.short.
- MT Wang, KV Honn, D Nie, Cyclooxygenase, prostanoid, and tumor progression., Cancer Metastasis Rev, (2007), 26, p525-534.
- JH Woo, SL Shin, YD Chang, CH Lee, Antioxidant effect according to extraction method in extracts of Dendranthema zawadskii var. yezoense and Cosmos bipinnatus., Korean Journal of Horticultural Science and Technology, (2010), 28, p462-468.
- SA Yang, JH Cho, BS Pyo, SM Kim, KI Lee, Comparison of the physiological activities of extracts from different parts of Prunus sargentii., Korean Journal of Medicinal Crop Science, (2014), 20, p159-164.
-
R Zamora, Y Vodovotz, TR Billiar, Inducible nitric oxide synthase and inflammatory diseases., Mol. Med, (2000), 6, p347-373.
[https://doi.org/10.1007/bf03401781]
