
나트륨 농도가 2년생 인삼의 생육, 생리장해 및 상토의 화학적 특성에 미치는 영향
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Saline soil has negative effects on the growth of most crops. Sodium is the main element that causes salt accumulation in soil. Organic materials such as cow and poultry manure, are frequently used during the preparation stage, which causes an increase in the rate of salt accumulation in the soil.
To investigate the influences of sodium on ginseng, NaH2PO4, Na2SO4, and NaCl were used to adjust the sodium concentrations at 0, 12.5, 25, 50, 75 and 100 mM in nutrient solution. In a 2-year-old ginseng, toxic symptoms appeared when the sodium treatment exceeded 50 mM. The sodium concentration in the leaves was 3.33%, which is more than twice as high as that of the control treated at 50 mM. As the sodium concentration increased, the root weight significantly decreased. In the 100 mM treatment, the weight decreased by 28% when compared to that of the control. The Amount of ginsenoside significantly increased with an increase in sodium concentrations.
These results suggest that the growth of 2-year-old ginseng is negatively affected when sodium exceeds 50 mM. This result can be used for a as basis in diagnosing the physiological disorders of ginseng.
Keywords:
Panax Ginseng C. A. Meyer, Physiological Disorder, Sodium, Toxicity서 언
전 세계 면적의 n약 7%, 관개하고 있는 토양 면적의 약 30%는 염류에 의해 영향을 받고 있으며 이 비율은 점차 증가 하고 있다 (Munns and Tester, 2008). 염류가 집적된 토양은 작물 생육에 해로운 영향을 미치는데 토양에 염류장해를 유발 하는 주된 원소는 나트륨으로 알려져 있다.
나트륨은 일반 식물의 생장에 필요한 원소는 아니지만 염생 식물의 생육에 필수적인 원소이다. 또한 C4 식물의 생육을 촉 진시키고 나트륨 부족 시 백화현상과 같은 결핍증상이 나타나 며 꽃을 형성하지 못하는 경우도 있다 (Marschner, 2012). 나 트륨은 온대지역의 토양 용액에는 평균 0.1 - 1 mM, 관개시설 이 있는 반건조 그리고 건조 지역의 토양 용액에는 50 - 100 mM 농도로 존재한다. 토양 용액 내의 40 mM 나트륨 농 도가 대부분 작물의 한계치 값으로서 이 이상의 농도에서는 생육 및 발달이 크게 감소한다 (Muuns and Tester, 2008; Marschner, 2012).
인삼 (Panax ginseng C. A. Meyer)은 다년생의 뿌리 작물 이고 다른 작물과 비교하여 내비성이 약하기 때문에 토양 환 경 중에서도 특히, 토양 양분에 영향을 많이 받는다. 연작장해 로 인한 초작지 부족과 최근 기상이변 등의 기후변화로 인해 인삼 생육에 부적합한 재배지가 증가하여 인삼의 안정적 생산 이 위협받고 있다. 부적합한 재배지는 생리장해 발생을 증가 시키는데 인삼에 있어 생리장해는 품질을 떨어뜨리는 것은 물 론 수량감소로 인하여 농가수입을 저하시키는 주요 원인 중 하나이다 (Park, 1991).
인삼에서 발생하는 생리장해 중 양분과 관련된 생리장해가 많지만 관련 연구는 국내외적으로 많지 않다. 논토양에서 인 삼을 재배하면 벼 재배 시 담수와 불량한 배수 조건은 토양 환원을 촉진시켜 환원철 (Fe2+)함량이 높아져 철이 과잉 흡수 되어 갈반형 황증이 발생하기 쉽고 (Lee et al., 2013), 적변 은 뿌리 표피에 철 등의 특정 무기성분이 고농도로 축적된 후 페놀 산화과정이 진행되어 나타난다고 보고하였다 (Zhou et al., 2016).
2 년생 인삼에서 철 과잉 증상이 발생하는 농도는 잎에 약 120㎎/㎏, 뿌리는 약 270㎎/㎏ 전후의 철이 함유될 때이고, 붕소의 경우 인삼 잎에 붕소 함량이 약 1,900㎎/㎏ 이상일 때 생리장해 증상이 뚜렷하며 생육이 저하된다 (Yu et al., 2017). 또한 붕소 5㎎/ℓ와 10㎎/ℓ을 양액으로 미국삼에 처리한 결과 잎의 가장 자리가 황하하고 괴사하는 등의 붕소 과잉 증상이 나타난다고 하였다 (Proctor and Shelp, 2014).
작물을 재배하는 동안 양분과 관련된 생리장해가 발생하면 축적된 자료를 토대로 문제를 진단한 후 적절한 대책을 제시 해야 하지만 (RDA, 2013), 인삼은 양분 관련 생리장해 진단 을 위한 기초자료가 충분하지 않아 현장에서 생리장해 발생 시 정확한 원인을 밝히기가 쉽지 않다.
인삼을 재배하기 전 예정지관리 단계에서 사용하는 유기물 로 우분, 계분 등 축분 퇴비를 자주 사용함에 따라 토양 염류 집적 문제가 대두되고 있고 나트륨이 다량 함유된 음식물 쓰 레기를 이용한 퇴비나 그것을 먹인 가축 분뇨의 시용으로 인 한 토양 내 나트륨 이온 집적에 의한 피해가 새로운 문제로 대두되고 있다 (Kim et al., 2015).
따라서 본 연구는 예정지관리 시 축분 퇴비 시용 증가 등에 따라 염류장해 발생이 증가하고 있는데 염류장해 유발의 주요 원소로 예상되는 나트륨을 농도별로 처리하여 2 년생 인삼에 나타나는 인삼의 생육, 생리반응 및 상토 화학성 그리고 진세 노사이드 함량을 분석하여 생리장해 진단을 위한 기초 자료를 확보하고자 수행하였다.
재료 및 방법
1 실험재료 및 처리
본 실험은 2017년 4월부터 2017년 10월까지 국립원예특작과 학원 인삼특작부 인삼 환경조절온실에서 실시하였다. 시설 내부 온도관리는 지열 냉·난방 시스템 (Turb MAX, Jeungpyeong, Korea)를 이용하여 15 - 20℃ 범위를 목표로 관리하였고 내부 온도가 30℃ 이상 되었을 때에는 상부 차광커튼과 하부 보온커 튼을 알맞게 조절하여 광량을 낮추고 일사량 유입을 줄였으며 흑색 차광망을 설치하여 광 투과율을 10 - 15%로 조절하였다.
인삼 (Panax ginseng C. A. Meyer) 공정육묘 시 인공 상 토 제조 방법 (RDA, 2014)을 참고하여 길이 120㎝, 폭 48㎝ 그리고 높이 18㎝의 스티로폼 베드에 피트모스와 펄라 이트를 5 : 5 (v/v)의 비율로 배합한 제조 상토를 넣어 배지를 조성하였다 (Table 1). 2017년 3월에 채굴한 금풍 묘삼을 0.8 - 1.0 g로 선별한 후 2017년 4월 초에 베드에 이식하였다. 실험은 나트륨 농도별로 3 반복으로 수행하였다.
나트륨 농도에 대한 인삼의 생육 및 생리적인 반응을 보기 위해 본 실험에서는 양액을 주기적으로 관주하였는데 다량원 소는 N; 6.0 mM, P; 0.5 mM, K; 4.0 mM, Ca; 1.0 mM, Mg; 0.5 mM, S; 0.25 mM, 미량원소는 FeNa-EDTA; 3㎎/ℓ, B; 3㎎/ℓ, Mn; 2㎎/ℓ, Zn; 0.2㎎/ℓ, Cu; 0.05㎎/ℓ, Mo; 0.01 ㎎/ℓ의 농도로 조제한 양액을 기본으로 사용하 였다. 나트륨 농도가 인삼에 미치는 영향을 보기위해 NaH2PO4, Na2SO4, NaCl을 이용하여 0, 12.5, 25, 50, 75, 100 mM로 조절하여 처리하였다 (Table 2).
양액은 묘삼이 정상적으로 출아와 전엽한 것을 확인한 후 상토의 수분함량에 맞추어 2017년 4월 하순부터 6월 초순까 지 약 6 주간 일주일에 1 회 처리하였다. 관주한 양액의 pH 는 pH meter (Mettler-Toledo International Inc., Columbus, OH, USA)로 측정한 후 2.5 N KOH와 HCl 용액을 이용하 여 5.5 ± 0.5로 조절하였는데 처리한 양액의 평균 pH는 5.43 ± 0.2였다. 전기전도도 (Electrical conductivity, EC)는 EC meter (Mettler-Toledo International Inc., Columbus, OH, USA)로 일주일에 한번 씩 확인하였다.
2 인삼 생육특성 조사
인삼의 생육특성은 농업과학기술 연구조사분석기준 (NIAST, 2012)의 인삼 생육특성 조사 방법에 준하여 나트륨 성분을 포 함한 양액을 처리하고 약 60 일이 경과한 후에는 처리별 15 개체씩 3 반복으로 조사하였다. 지상부 특성 중 경장은 뇌두 바로 위부터 잎자루 착생부까지의 길이를 측정하였고 엽장과 엽폭은 각 개체당 가장 큰 잎의 길이와 폭을 측정하였다.
SPAD 값은 엽색계 (KONICA MINOLTA Inc., Tokyo, Japan)를 이용하여 중앙소엽과 제 1 측엽을 측정하였고 지상 부 생체중은 잎과 줄기의 무게를 측정하였다.
지하부 특성 중 근장은 뇌두 바로 아래부터 가장 긴 뿌리 끝까지의 길이를 측정하였고 근직경은 개체당 가장 굵은 부분 을 버니어캘리퍼스 (Mitutoyo, Kawasaki, Japan)로 측정하였 으며, 근중은 주근과 지근을 모두 포함한 생체 무게를 측정하 였다.
3 식물체 분석
식물체 분석은 농업과학기술 연구조사분석기준의 식물체 분 석법 (NIAST, 2000)을 참고하여 나트륨 성분을 포함한 양액 처리 60 일 후에 수행하였다. 시료 전처리를 위해 microwave digestion system (CEM, Matthews, NC, USA)을 사용하였다. Microwave vessel에 분말시료 0.25 g을 칭량한 다음 60% 질 산 (Junsei Chemical Co., Ltd, Tokyo, Japan) 10㎖를 가한 후 용기를 밀폐하고 15 분간 180℃까지 상승시킨 후 5 분간 온도 유지, 10 분간 240℃까지 상승시킨 후 분해하였다. 분해 가 완료되면 vessel을 실온까지 방냉하고 탈기한 후 초순수를 가해 No. 6 여과지로 여과한 다음, 50㎖ 메스플라스크로 정 량한 후 무기분석 시험용액으로 사용하였다.
무기성분 함량은 ICP OES (GBC Scientific Equipment, Braeside, Australia)를 이용하여 측정하였는데 nebulizer gas (argon)의 flow는 0.5ℓ/min로 고정하고 각각의 적정파장 (Na; 589.592㎚, Fe; 259.940㎚, Mn; 257.610㎚, Cu; 324.754㎚, Zn; 213.856㎚, P; 213.618㎚, Mg; 285.213㎚, Ca; 317.933㎚, K; 769.896㎚)에서 분석하였다. 분석 후 P, K, Mg, Ca, Na은 측정값 (ppm)에 희석배수를 곱한 후 %로 환산하였고, Fe, Mn, Zn, Cu는 측정값 (ppm)에 희석배수를 곱하여 값을 얻었다. 식물체 분석은 3 반복으로 수행하였다.
4 상토 화학성 분석
상토 화학성 분석을 위해 나트륨 성분을 포함한 양액을 처 리 1 주, 2 주, 3 주, 6 주 후에 상토를 채취한 후 농업과학 기술 연구조사분석기준의 상토 분석법 (NIAST, 2000)에 준하 여, pH, EC, NO3-N, 유기물, 유효인산, 치환성양이온 K, Ca, Mg, Na 등을 분석하였다.
상토 pH와 EC는 초자전극법을 이용하여 측정하였고, NO3- N 분석은 풍건상토 20㎖ 을 100㎖ 삼각플라스크에 넣고 2 M KC1 50㎖를 가하여 30 분간 진탕한 후 No. 2 여과지로 여과한 후 auto analyzer (Bran Luebbe, Norderstedt, Germany) 로 자동비색 정량하였으며, 유기물 분석은 C/N analyzer (Vario Max CN, Elementar Analysensyteme GmbH, Langenselbold, Germany)로 Dumas법 (Dumas, 1831)을 사용해 총량 (%)을 분석하였는데 토양 0.25 g을 취해 900℃에서 태워 유기물 함 량을 측정하였다.
유효인산함량은 토양 5 g에 pH 4.25의 lancaster 침출액 20㎖을 넣은 후 10 분간 진탕 침출하여 No.2 여과지를 이용 하여 여과한 후 ammonuim molybdate를 발색시켜 비색정량하 였고, 치환성 양이온 (K, Ca, Mg, Na)은 토양 5 g에 1 NNH4OAc (pH 7.0) 완충용액 50㎖를 넣고 30 분간 진탕한 후 침출 및 여과하여 ICP OES (GBC Scientific Equipment, Braeside, Australia)로 측정하였다.
5 진세노사이드 분석
인삼의 지상부 혹은 지하부를 채취하여 10 종의 진세노사이 드를 분석하였다. 진세노사이드 표준품 10 종은 Re, Rg1, Rf, Rb1, Rg2, Rh1, Rc, Rb2, Rb3, Rd (ChromaDex, Irvine, CA, USA)를 사용하였다. 진세노사이드 분석을 위해 인삼 분 말시료 0.2 g과 70% MeOH 2㎖를 넣고 잘 혼합한 후 50℃ 에서 30 분 동안 초음파 추출한 뒤 4℃, 13,000 rpm에서 15 분 동안 원심분리 하여 얻은 상등액을 2㎖ tube에 취한 다음 1㎖를 Sep-Pak C18 cartridge를 이용하여 정제한 후 추출액 을 0.45㎛ membrane filter로 여과하여 분석시료로 사용하였 다 (Kim et al., 2010).
진세노사이드 함량은 Nexera X2 UPLC system (Shimadzu, Tokyo, Japan)을 이용하여 측정하였는데 이동상의 유속은 0.5 - 0.8㎖/min, 칼럼온도는 50℃, UV 검출기의 파장은 203㎚ 이었으며 분석을 위한 column은 Halo RP-amide column (4.6 × 150㎜, 2.7㎛, Ascentis Co., Wilmington, DE, USA) 을 사용하였다 (Jang et al., 2015).
6 통계처리
모든 분석은 SAS 프로그램 (SAS v9.4, SAS Institute inc., Cary, NC, USA)을 이용하여 분산분석 (ANOVA)을 실 시한 후 처리 간에 차이가 있을 경우 5% 유의수준에서 Duncan’s Multiple Range Test (DMRT)로 분석하였다.
결과 및 고찰
1 상토 내 나트륨 농도에 따른 인삼 생육특성 변화
나트륨 처리 농도에 따른 생육특성 변화는 Table 3과 같다. 지상부 생육 특성인 엽록소 함량, 엽장, 엽폭 및 엽중은 나트 륨 처리 후 생육 조사가 가능한 잎을 선택하여 조사하였는데 나트륨 피해 잎의 경우에는 전체 잎의 1/3 이하로 피해 받은 것을 선택하여 조사하였다. 다만 엽록소 함량은 각 반복 측정 시 중앙소엽과 제 1 측엽을 측정하여 평균 수치이기 때문에 피해 잎이 다소 포함되었다.
양액 내 나트륨 처리 농도가 증가할수록 2 년생 인삼 (Panax ginseng C. A. Meyer)의 엽록소 함량은 감소하는 경 향이 나타났는데, 나트륨 50 mM 이상의 처리구부터 대조구인 나트륨 0 mM 처리에 비해 유의하게 감소하였다. 대조구인 나 트륨 0 mM 대비 50, 75, 100 mM 처리구에서는 각 25%, 49%, 64%로 감소하였다.
높은 염류 농도 조건 하에서 자란 식물의 경우 엽록체 내의 틸라코이드 및 그라나의 수가 감소하고 (Hajibagheri and Flowers, 1985; Chung and Choi, 2003), 그라나의 미발달은 광합성을 감소시켜 잎과 식물체의 생장을 저해한다는 보고 (Keiper et al., 1998; Chung and Choi, 2003)와 같이 인삼 잎의 엽록소 감소는 생체중과 근중의 감소에 영향을 미칠 것 으로 생각된다.
지상부 생체중은 나트륨 처리 농도가 증가할수록 감소하는 경향을 나타내어 나트륨 50 mM 이상의 처리부터 대조구 대 비 34% 이상 감소한 값을 나타내었다.
나트륨은 식물체의 엽면적을 크게 감소시킨다고 알려져 있 지만 (Kwon et al., 1999) 본 실험 결과에서는 엽장과 엽폭 은 나트륨 처리 농도에 의한 유의한 차이가 나타나지 않았는 데 이는 2 년생 인삼의 전엽이 완료된 후 나트륨이 포함된 양액을 관주하여 인삼의 생육단계의 진전에 따라 나트륨에 대 한 인삼의 적응성이 증가된 것으로 추정한다. 또는 작물은 염 스트레스에 의해 단위 엽면적당 기공 수를 감소시키고 잎의 두께를 증가시키며, 잎의 표피를 두껍게 하고 표피에 납질층 을 축적시켜 증산량을 억제하는 등의 과정을 통해 나트륨 독 성에 대응하였다고 추정된다 (Winter and Gademann, 1991).
나트륨 50 mM 처리까지는 지상부 생체중이 무처리와 유사 하게 유지된 것으로 보아 견딜 수 있는 것으로 보이나 50 mM 처리부터는 지상부 생체중이 급격하게 감소하는 것으 로 과도한 염 스트레스를 받는 다는 것을 알 수 있다. 이는 대부분의 식물의 나트륨 한계 수준이 약 40 mM 라는 결과 (Muuns and Tester, 2008)와 어느 정도 일치하였다. 작물은 과도한 염분 조건하에서 줄기의 신장을 감소시킨다고 하였지 만 (Naveriyal et al., 1989) 본 결과에서는 유의한 차이를 찾 을 수 없었다.
나트륨 처리 농도가 증가할수록 처리구의 근중이 유의하게 감소하는 경향이 나타났고 50 mM 처리구부터 근중이 1.00 g 이하로 감소한 값을 나타냈으며, 나트륨 100 mM 처리구에서 는 대조구보다 약 28% 감소한 무게인 0.86 g을 나타냈다. 토 양 내 나트륨 함량이 높을 경우 지하부 생육 중에서도 근직경 과 근중이 감소한다는 결과와 일치하였다 (Kim et al., 2015).
지상부와 지하부의 결과를 종합해보았을 때 2 년생 인삼의 경우 나트륨 50 mM 이상의 농도에서 일정기간 이상 경과되 면 생육이 저해되는 것으로 판단된다.
2 상토 내 나트륨 농도에 따른 인삼의 지상부 및 지하부 생리장해 증상
나트륨 처리에 따른 과잉 증상은 Fig. 1과 같다. 처음 나트 륨 100 mM 용액을 처리하고 약 15 일이 지나자 인삼 잎의 가장자리부터 회백색으로 변한 후 흰색 또는 갈색으로 변하면 서 서서히 말라갔으며 20 일 이후 증상이 심해지면서 잎 전체 가 황화되면서 지상부 전체가 고사하기 시작했다. 나트륨이 포 함된 양액 처리 후 지상부 생리장해 증상은 전체의 약 10% 이상이 발생할 때를 기준으로 일자를 산정하였다.

Symptoms of sodium toxicity in 2-years-old ginseng.Leaves (A - D) and roots (E, F) were treated with nutrient solution containing sodium 100 mM. A; leaves treated with sodium 100 mM after 15 days, B; 20 days, C, D; 30 days, E; roots treated with basic nutrient solution without sodium, F; roots treated with soium 100 mM after 60 days.
식물체의 가장 오래된 잎은 장기간 염류 스트레스를 받게 되면 유황병이 발생하고 낙하를 한다는 결과와 유사하게 나타 났는데 (Agastian et al., 2000) 이러한 결과는 딸기에서 32 me/ℓ의 NaCl 처리 시 노엽부터 잎 가장자리가 흰색 또는 갈색으로 말라들어 갔는데 초기에 인삼에서 나타나는 과잉의 증상과 유사했다 (RDA, 2010). 나트륨에 의해 나타나는 생리 장해 증상은 다른 염류의 과잉 시에 나타났던 잎 전체가 연한 황록색으로 변하는 황화형, 잎맥 사이에 연한 황색 또는 황갈 색 반점이 생기는 황갈색 반점형 황증 증상 (RDA, 2014) 등 과 비교적 다른 양상으로 뚜렷하게 구별되었다.
인삼 뿌리의 경우, 나트륨 50 mM 이상의 처리구부터 세근 이 많이 탈락된 형태를 보이며 삼투 현상으로 인해 전체적으 로 쪼그라들거나 무르는 증상이 나타났는데 나트륨 100 mM 처리구의 경우 전체 조사개체의 약 64%가 이러한 증상이 나 타났고 무르는 증상과 함께 부분적으로 썩는 증상은 조사개체 의 약 18% 정도 관찰되었다. 그러나 나트륨 함량이 높을 경 우 적변이 동시에 발생한다는 기존의 결과 (Kim et al., 2015)와는 달리 처리구별 적변 발생률에서는 차이가 거의 없 었다.
나트륨의 과잉 농도에 의한 생리장해 증상은 처리 농도별로 발현 시기는 달랐지만 50 mM 처리부터 뚜렷하게 나타났다. 그 러나 나트륨 25 mM 용액을 첫 번째 처리하고 약 30 일이 지나자 인삼 잎이 서서히 말라갔던 것으로 보아 생리장해 발 현이 진행되고 있던 것으로 생각된다. 따라서 장기간으로 보 면 나트륨 25 mM 처리에서도 생리장해가 발생할 수 있을 것 이라고 판단된다.
3 상토 내 나트륨 농도에 따른 인삼 무기원소 함량 및 상 토 화학성 변화
나트륨 처리에 따른 인삼의 부위별 무기원소 함량은 Table 4와 같이, 나트륨 0 mM 처리구의 나트륨 함량은 잎에서 0.79%, 뿌리에서 0.13%로 잎의 나트륨 함량이 뿌리보다 약 6 배 높게 나타났다.

Concentration of mineral nutrients in the leaf and root of 2-years-old ginseng grown for 60 days at different sodium concentrations.
나트륨 12.5 mM, 25 mM, 50 mM 처리구의 경우에도 잎의 나트륨 함량은 뿌리의 나트륨 함량에 비해 각 9 배, 10 배, 12 배 이상 높은 값인 1.57%, 1.89%, 2.30% 값을 나타냈다. 대부분의 식물에서 나트륨 독성이 나타나는 주된 장소는 뿌리 가 아닌 잎인데 증산류에 의해 나트륨 이온이 침전되고 축적 되기 때문이라는 보고 (Munns, 2002)와 일치하였다. 잎의 나 트륨 함량은 나트륨 처리 농도가 증가할수록 유의하게 증가하 였다.
예비실험으로 나트륨 50 mM, 100 mM, 150 mM를 처리하 였을 때, 나트륨 처리 농도가 증가할수록 잎과 뿌리 내의 나 트륨 함량이 유의하게 증가하였고 모든 나트륨 처리구에서 뿌 리보다는 잎에서 더 많은 나트륨 함량이 분석되는 결과를 얻 어 본 실험에서는 나트륨 처리 농도를 더 세분화하여 실험하 였다.
나트륨 12.5 mM에서 50 mM 처리구들의 뿌리 내 나트륨 함량은 0.18 - 0.19%로 유지되었다. 식물은 물을 잎에 보유는 것보다 50 배 이상 증산에 사용하는데 특히 더 오랫동안 증산 작용을 하며 살아가는 다년생 식물은 일년생 식물보다 이 작 용이 더 필요하다 (Muuns and Tester, 2008). 이와 같은 증 산류에 의해 인삼 뿌리에서는 나트륨 농도가 일정 수준으로 유지되고 대부분이 잎으로 이동되었을 것으로 생각된다. 나트 륨 75 mM, 100 mM 처리구는 시료의 양이 부족하여 식물체 내 무기원소 함량 분석을 완료하지 못하였다.
Heo 등 (2007)은 Dianthus japonicus Thunb. 묘에 NaCl를 0mM에서 400 mM까지 처리했을 때 200 mM까지는 지상부의 나트륨 함량이 증가했지만 200 mM 이상 처리에서는 감소한 다고 보고하였다. 추가 분석이 필요하겠지만 100 mM 까지는 지상부의 나트륨 함량이 증가할 것으로 예상되며 그 이상의 농도에서는 오히려 감소가 일어날 것으로 판단된다.
염소 이온 역시 뿌리보다 지상부에 축적되는 양이 많았고, 나트륨 이온보다 지상부에 더 많이 축적된다는 결과와 일치하 여 하였는데 (Ashraf and Orooj, 2006) 무처리구 대비 50 mM 처리구에서 약 2 배 이상 높은 값인 3.33%를 나타내 었다. 식물 잎의 피해는 축적량이 높은 염소 이온에 의한 피 해 영향도 있을 수 있는데 (Wahome et al., 2001) 인삼 잎 에 나타난 과잉 증상 또한 나트륨뿐만 아니라 염소의 영향도 상당 부분 있을 것으로 생각된다.
나트륨과 칼륨은 모두 1가의 양이온이자 알칼리 금속이며 주기율표의 같은 열에 위치해있다. 수화된 나트륨 입자의 크 기는 0.358㎚로 0.331㎚의 칼륨과 비슷하며, 생리적인 기능 도 칼륨과 유사하다. 그러나 칼륨은 식물 생육에 가장 중요한 필수원소 중의 하나로서 삼투현상, 전하의 균형과 효소 공인 자 등으로서의 역할을 하는 반면 높은 나트륨 수준은 식물에 유해하게 작용한다. 나트륨 독성은 나트륨이 칼륨의 역할을 대 체하지 못할 때 기인하며 이들 원소는 서로의 흡수를 방해 한 다 (Cuin et al., 2003).
본 실험에서도 나트륨 처리 농도가 증가하면 잎의 나트륨 함량이 증가하였고 칼륨 농도도 유의하게 감소하는 것을 확인 하였는데, 무처리구 대비 나트륨 50 mM 처리구의 경우 칼륨 함량이 약 41% 감소하였다. 뿌리의 경우 나트륨 함량의 변화 가 적었던 것처럼 칼륨 함량 역시 급격한 변화는 찾아볼 수 없었다 (Table 4). 이러한 결과는 보리 묘에 NaCl 200 mM을 처리하여 세 번째 잎을 분석했을 때 나트륨 함량은 무처리구 보다 증가한 반면, 칼륨이 뚜렷하게 감소한 결과 (Cuin et al., 2003)와 토마토의 엽경에서 나트륨계열 용액 처리에서 무처리 구 대비 칼륨 함량이 감소한 결과 (Rhee et al., 2002)와 일 치하였다. 그러나 상추에서 나트륨 처리 20 일 후 나트륨과 양이온 간 길항흡수 작용에 의해 칼슘과 마그네슘 흡수량이 감소했다는 결과 (Yang et al., 1998)와는 일치하지 않았다.
나트륨 처리에 따른 시기별 상토의 EC 및 나트륨 농도변화 는 Fig. 2와 같다. 나트륨 12.5 mM 처리구는 다른 처리구에 비해 상토의 EC와 나트륨 농도의 변화가 적은 편이었다. 나 트륨 25 mM 처리구부터 나트륨 용액 처리 14 일 후부터 EC 와 나트륨 농도가 급격하게 증가하는 경향이 나타났다. 나트 륨 용액 처리 42 일 후, 나트륨 25 mM 처리구의 EC는 0.74 dS/m로 인삼 재배에 적합하다고 알려진 0.5 dS/m를 초과 하였고, 나트륨 75, 100 mM 처리구는 각각 1.07, 1.04 dS/m 값을 나타내었다. 이는 대조구인 나트륨 0 mM 처리구가 0.16 dS/m 값을 나타낸 것에 비해 약 7 배 증가한 값이었다.
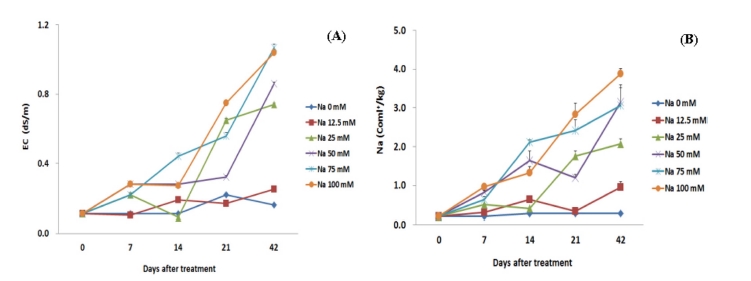
Changes in electric conductivity and sodium concentrations of bed soil treated with sodium.Bed soils were collected and analyzed for electric conductivity (A), sodium content (B) at 7, 14, 21, 42 days after sodium treatment. Data represent the means ± SD (n = 3).
Kim 등 (2015)은 토양 내 나트륨 이온 함량이 0.15 cmol+/㎏ 이하일 때 인삼을 재배하기에 적합하고, 0.15 - 0.2 cmol+/㎏는 허용, 0.2 cmol+/㎏ 이상은 과다하다고 보고하였다. 그러나 본 실험에서는 처리 7 일 후부터 나트륨 12.5 mM 처리구부터 나 트륨 이온의 농도가 0.30 cmol+/㎏로 과다 범위를 초과한 값 을 나타내었다. 나트륨 용액 처리 42 일 후, 나트륨 0, 12.5, 25, 50, 75, 100 mM 처리구에서 각 0.27, 0.95, 2.07, 3.15, 3.06, 3.88 cmol+/㎏로 상토에 상당한 농도의 나트륨 축적이 된 것을 확인할 수 있었다.
이러한 결과는 토양 내 나트륨 이온의 분산효과로 인한 토 양 물리성 악화는 토양 내 수분의 이동과 통기성을 저해함으 로써 작물의 뿌리 신장과 유식물 생장을 억제하고 근권의 삼 투압을 증가시켜 수분과 양분의 흡수를 저해하여 식물의 생장 과 발육에 영향을 미쳐 수량을 감소시킨다는 결과와 같이 (Bernstein, 1975; Munnus, 1993) 상토 내 나트륨 축적은 수 분 및 무기원소 흡수에 영향을 미쳐 결국에서 인삼의 생육에 도 부정적인 영향을 미친 것으로 판단된다.
4 상토 내 나트륨 농도에 따른 진세노사이드 함량 변화
나트륨 농도에 따른 진세노사이드 함량의 결과는 Table 5와 같다. 나트륨 처리 농도가 증가할수록 진세노사이드 함량이 유 의하게 증가하는 경향이 있었는데 특히 나트륨 100 mM 처리 시 무처리구보다 총 진세노사이드 함량이 약 1.5 배 증가한 농도인 0.7%를 나타냈다. 나트륨 처리 농도가 증가할수록 대 체로 Rb1과 Rc와 같은 panaxadiol 계열이 증가하는 것을 볼 수 있었고, panaxtriol 계열에서는 Re의 증가폭이 컸으며 Rg2 가 유의하게 증가하였다.

Amount of ginsenoside of 2 year old panax ginseng grown for 60 days at different sodium concentrations. (㎎/g, dry weight)
Terpenes, phenolics 및 alkaloids와 같은 2 차 대사산물의 생성은 환경적 및 비환경적 스트레스에 대해 내성을 유도하는 식물의 적응 전략 중 하나이다. 식물에 스트레스가 가해졌을 때 2 차 대사산물이 주로 증가하는 경향이 있는데 식물의 생 육이 억제되고 고정된 탄소가 2 차 대사산물이 생산에 우선적 으로 할당되기 때문이다 (Seigler et al., 1998).
인삼의 사포닌 즉, 진세노사이드는 뿌리, 잎, 줄기 그리고 열 매 등에서 생성되는데 이 함량은 환경적 및 비환경적 요인에 영향을 받는다 (Szakiel et al., 2010). 또한 식물체 내의 사포 닌 축적은 이러한 환경 요인에 대응하는 작용을 한다 (Lin et al., 2009).
해가림 시설을 조절하여 오전 11 시 이전까지 광투과율 17.9%로 재배하였을 때 4 년근 인삼 뿌리의 진세노사이드 함 량은 광투과율 7%로 재배하였던 관행재배보다 약 2 배 높았 고 (Jang et al., 2016), 인삼의 모상근 배양에서도 온도와 광 질에 따라 진세노사이드 함량이 조절되었다고 하였다 (Yu et al., 2005).
염 스트레스 또한 식물체의 이온 스트레스뿐만 아니라 삼투 스트레스를 유발하며 2 차 대사산물 함량을 변화시킨다고 하 였는데 (Tuteja and Mahajan, 2007) 본 결과에서도 고농도의 나트륨 농도가 스트레스로 작용하여 2 차 대사산물이 증가하 였다고 생각된다.
감사의 글
본 논문은 농촌진흥청 연구사업(과제번호: PJ01094301)의 지 원에 의해 이루어진 결과로 이에 감사드립니다.
References
- P Agastian, SJ Kingsley, M Vivekanandan, Effect of salinity on photosynthesis and biochemical characteristics in mulberry genotypes., Photosynthetica, (2000), 38, p287-290.
-
M Ashraf, A Orooj, Salt stress effects on growth, ion accumulation and seed oil concentration in an arid zone traditional medicinal plant ajwain(Trachyspermum ammi [L.] Sprague)., J. Arid Environ, (2006), 64, p209-220.
[https://doi.org/10.1016/j.jaridenv.2005.04.015]

-
L Bernstein, Effect of salinity and sodicity on plant growth., Annu. Rev. Phytopathol, (1975), 13, p295-312.
[https://doi.org/10.1146/annurev.py.13.090175.001455]

- HD Chung, YJ Choi, Ultrastructural changes in leaves of Chinese cabbage(Brassica campestris ssp. pekinensis) and radicle tissues of radish(Raphanus sativus) grown in high soil EC., Journal of the Korean Society for Horticultural Science, (2003), 44, p582-587.
-
TA Cuin, AJ Miller, SA Laurie, RA Leigh, Potassium activities in cell compartments of salt-grown barely leaves., J. Exp. Bot, (2003), 54, p657-661.
[https://doi.org/10.1093/jxb/erg072]

- JB.A Dumas, Procedes de I'analyse organique., Ann. Chim. Phys, (1831), 47, p198-205.
-
MA Hajibagheri, TJ Flowers, Salt tolerance in the halophyte Suaeda maritima(L.) Dum. the influence of the salinity of the culture solution on leaf starch and phosphate content., Plant Cell Environ, (1985), 8, p261-267.
[https://doi.org/10.1111/1365-3040.ep11604655]

- EJ Heo, HH Jung, KS Kim, Response ofDianthus japonicusThunb. to NaCl stress imposed at different growth stages., Hortic. Environ. Biotechnol, (2007), 48, p381-386.
-
IB Jang, J Yu, KB Kweon, SJ Suh, Effect of controlled light environment on the growth and ginsenoside content of Panax ginseng C. A. Meyer., Korean Journal of Medicinal Crop Science, (2016), 24, p277-283.
[https://doi.org/10.7783/kjmcs.2016.24.4.277]

-
FJ Keiper, DM Chen, LF de Filippis, Respiratory, photosynthetic and ultrastructural changes accompanying salt adaptation in culture of Eucalyptus microcorys., J. Plant Physiol, (1998), 152, p564-573.
[https://doi.org/10.1016/s0176-1617(98)80278-2]

- GS Kim, DY Hyun, YO Kim, SE Lee, H Kwon, SW Cha, CB Park, YB Kim, Investigation of ginsenosides in different parts of Panax ginseng cultured by hydroponics., Korean Journal of Horticultural Science and Technology, (2010), 28, p216-226.
-
JU Kim, DY Hyun, YC Kim, JW Lee, IC Jo, DH Kim, KH Kim, JK Shon, Effects of salt in soil condition on chlorophyll fluorescence and physiological disorder in Panax inseng C. A. Meyer., Korean Journal of Medicinal Crop Science, (2015), 23, p446-453.
[https://doi.org/10.7783/kjmcs.2015.23.6.446]

- TR Kwon, PJ.C Harris, WF Bourne, Partitioning of Na+, K+, proline, and total soluble sugar in relation to the salinity tolerance of Brassica juncea and Brassica rapa., Journal of the Korean Society for Horticultural Science, (1999), 40, p425-430.
-
SW Lee, KC Park, SH Lee, JM Park, IB Jang, KH Kim, Soil chemical property and leaf mineral nutrient of ginseng cultivated in paddy field occurring leaf discoloration., Korean Journal of Medicinal Crop Science, (2013), 21, p289-295.
[https://doi.org/10.7783/kjmcs.2013.21.4.289]

- JT Lin, Effect of harvest time on saponins in Yam(Dioscorea pseudojaponica Yamamoto)., Journal of Food and Drug Analysis, (2009), 17, p116-122.
- P Marschner, Marschner’s mineral nutrition of higher plants, 3rd ed, San Diego, CA, USA, Academic Press, (2012), p191-243.
- R Munns, M Tester, Mechanisms of salinity tolerance., Annu. Rev. Plant Biol, (2008), 59, p651-681.
-
R Munns, Physiological processes limiting plant growth in saline soil: some dogmas and hypotheses., Plant Cell Environ, (1993), 16, p15-24.
[https://doi.org/10.1111/j.1365-3040.1993.tb00840.x]

- R Munns, Comparative physiology of salt and water stress., Plant Cell Environ, (2002), 25, p239-250.
- NIAST, Methods of soil chemical analysis, Suwon, Korea, Rural Development Adminstration, (2012), p16-770.
- H Park, Physiological disorder of Panax ginseng., Journal of Korean Society of Crop Science, (1991), 36, p459-480.
-
JT.A Proctor, BJ Shelp, Effect of boron nutrition on American ginseng in field and in nutrient cultures., J. Ginseng Res, (2014), 38, p73-77.
[https://doi.org/10.1016/j.jgr.2013.11.002]

- HC Rhee, GH Kang, KB Kweon, YH Choi, HT Kim, Effect of high concentrations of sodium or chloride salts in soil on the growth of and mineral uptake by tomatoes., Journal of Bio-Environment Control, (2002), 11, p121-126.
- RDA, Causes, diagnosis and corrective fertilization of physiological disorders in strawberry, Suwon, Korea, Rural Development Adminstration, (2010), p189-191.
- RDA, Nutrient disorder of vegetable, Suwon, Korea, Rural Development Adminstration, (2013), p40-46.
- RDA, Ginseng, Eumseong, Korea, Rural Development Adminstration, (2014), p90-246.
-
DS Seigler, Plant secondary metabolism, Dordrecht, Netherlands, Kluwer Academic Publishers, (1998), p1-15.
[https://doi.org/10.1007/978-1-4615-4913-0]

- A Szakiel, C P ...czkowski, M Henry, Influence of environmental abiotic factors on the content of saponins in plants., Phytochem. Rev, (2010), 10, p471-491.
-
N Tuteja, S Mahajan, Calcium signaling network in plants., Plant Signal. Behav, (2007), 2, p79-85.
[https://doi.org/10.4161/psb.2.2.4176]

- PK Wahome, HH Jesco, I Pinker, Effect of sodium chloride on Rosa plants growing in vitro., Sci. Hortic. (Amsterdam), (2001), 90, p187-191.
-
K Winter, R Gademann, Daily changes in CO2 and water vapor exchange, chlorophyll fluorescence, and leaf water relations in the halophyte mesembryanthemum crystallinum during the induction of crassulacean acid metabolism in response to high NaCl salinity., Plant Physiol, (1991), 95, p768-776.
[https://doi.org/10.1104/pp.95.3.768]

- JS Yang, IB Lee, KD Kim, GR Cho, SE Lee, Effect of sodium chloride containing-composts on growth of lettuce (Lactuca sativa L.) and chemical properties of salt accumulated plastic film house soils., Korean Journal of Soil Science and Fertilizer, (1998), 31, p277-284.
-
J Yu, SH Kang, IB Jang, IB Jang, KC Park, UH Lee, HW Park, SJ Suh, TC Seo, KH Kim, Influence of boron and iron toxicity on the physiological status, growth, and mineral uptake of ginseng in hydroponic culture., Korean Journal of Medicinal Crop Science, (2017), 25, p175-182.
[https://doi.org/10.7783/kjmcs.2017.25.3.175]

-
KW Yu, HN Murthy, EJ Hahn, KY Paek, Ginsenoside production by hairy root cultures of Panax ginseng: Influence of temperature and light quality., Biochem. Eng. J, (2005), 23, p53-56.
[https://doi.org/10.1016/j.bej.2004.07.001]

- Y Zhou, Z Yang, L Gao, W Liu, R Liu, J Zao, J You, Changes in element accumulation, phenolic metabolism, and antioxidative enzyme activities in the red-skin roots of Panax ginseng., J. Ginseng Res, (2016), 41, p307-315.