국산 한약재로 이용되는 약용식물의 NCI-H1229 인간 폐암 세포주에 대한 성장 억제효과 분석
†Corresponding author: (Phone) +82-61-860-2841E-mail) thej0123@naver.com
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Lung cancer, the most common malignant disease worldwide, is the predominant cause of cancer deaths, particularly amongst men. Therefore, various researchers have focused on the growth inhibitory effects of medicinal plants used in traditional Korean medicine. This study aimed to investigate the growth inhibitory effects of ethanol extracts of Rubiae radix, Inulae flos, Nelumbinis receptaculum, Astilbe radix, and Lagerstroemia flos on NCI-H1229 cells.
The viability of NCI-H1229 cells was evaluated in vitro using an MTS assay. Treatment with the ethanol extracts of the selected medicinal plants at 500 μg/ml reduced NCI-H1229 cell viability and increased apoptotic cell death and caspase-3 activation. In addition, treatment with ethanol extracts of Inulae flos and Astilbe radix increases DNA fragmentation, as measured by the TUNEL assay.
These results indicated that ethanol extracts of Rubiae radix, Inulae flos, Nelumbinis receptaculum, Astilbe radix, and Lagerstroemia flos exhibited growth inhibitory effects, inducing apoptotic cell death, DNA fragmentation and caspase-3 activation in NCI-H1229 cells. Therefore, these medicinal plant extracts may be used in the development of natural medicines to inhibit the growth of lung cancers. However, further study is needed to determine the active ingredients of the ethanol extracts from medicinal plants that are reposible for the inhibitory effect on lung cancer cell grwoth.
Keywords:
Astilbe Chinensis (Maxim.) Franch. Et Savat. Var., Inula Japonica Thunb, Lagerstroemia Indica L., Nelumbo nucifera Gaertn, Rubia Akane Nakai, Lung Cancer서 언
여러 종류의 암은 우리나라에서 사망률이 높은 원인 중 하 나로, 국내 통계청 2013년 자료에 의하면 여러 암 중 5년간 상대생존율이 위암은 23.5%로 집계되어 높은 사망률을 기록 하고 있다.
대부분 암은 초기에 증상이나 통증이 수반되지 않기 때문에 초기진단이 늦는 경우가 많아 치료가 힘든 실정이기 때문에 조기진단과 예방이 무엇보다 중요하다고 알려져 있다 (Sung et al., 2016). 최근 국산 한약재로 사용되는 약용식물을 이용 한 연구가 다방면으로 진행되고 있으며, 특히 암세포 성장 억 제효과에 대한 연구가 가장 활발히 진행되고 있다 (Jo et al., 2007; Lee et al., 2012).
전 세계적으로 폐암의 사망률은 다른 암종과 비교하여 1 위 로 알려져 있고 상대생존율은 23.5%로, 전체 암종의 상대생존 율로 보고되어있는 69.4%에 비해 매우 낮은 것으로 보고되어 있다 (Oh et al., 2016).
이는 폐암이 다른 여러 암종과 비교하여 초기증상이 전혀 나타나지 않아 대부분 환자들은 암이 일정이상 진행된 후에 발견하기 때문인 것으로 알려져 있을 뿐만 아니라 (Chae and Park, 2010), 특이적인 호흡기계 증상에 의해 환자가 심리적으 로 크게 영향 받으며 장기 특성상 다른 장기에 전이가 쉽게 이루어지기 때문에 예후에 관리가 가장 중요한 문제로 대두되 고 있다 (Sarna et al., 2004; Lee and Han, 2011).
폐암에 대한 약용식물 추출물의 항암효과 연구로는 더위지 기의 생즙과 추출물이 폐암세포의 성장을 억제시킨다고 알려 져 있으며 (Ham et al., 1998), 어성초 추출물은 인체유래 폐 암세포에서 세포자멸사 (apoptosis)를 유도하는 것으로 보고되 어 있다 (Choi, 2012). 더욱이 폐암세포주인 NCI-H1229에 대 해 당근추출물의 폐암세포 성장 억제효과가 나타내었음을 보 고하였다 (Rho and Kim, 2002).
꼭두서니 뿌리 (Rubiae radix)는 꼭두서니 (Rubia akane Nakai)의 뿌리부분으로 한국, 일본, 중국, 타이완 등지의 산지 숲에서 쉽게 찾을 수 있으며, 예로부터 천초근으로 불리며 우 리나라나 중국에서 약재로 사용되어 왔고, 연구에 따르면 발 암성 연구를 위한 안전성 시험 (Kim, 2015)과 혈액암, 식중독 균에 관련된 연구가 진행되어 항암효능을 가지는 것으로 알려 져 있다 (Bae et al., 2005; Choi et al., 2008; Kim et al., 2009).
금불초 꽃 (Inulae flos)은 꼭두서니의 꽃으로 한방에선 선복 화라는 이름으로 알려져 있다. 이전 연구에서 금불초 꽃 물 추출물이 산화스트레스 및 대장암 세포 억제효과를 가진다고 보고하였으며 (Nho et al., 2018a)로 사용되는 doxorubicin의 효율을 높인다고 알려져 있을 뿐만 아니라 (Wu et al., 2016a), 혈압조절 작용에 관여한다고 보고되어 있다 (Yun et al., 2003).
꼭두서니 뿌리와 금불초 꽃은 대표적인 항암인자로 알려진 JNK (c-Jun N-terminal kinases)와 p38 (p38 mitogenactivated protein kinases)의 활성화를 유도한다고 알려져 있어, 암세포를 사멸시키는 신호전달경로 관여할 것으로 예상 된다 (Choi et al., 2008; Choi et al., 2010; Zhao et al., 2014; Chou et al., 2015).
연꽃 화탁 (Nelumbinis receptaculum)은 연꽃과 식물인 연 꽃 (Nelumbo nucifera Gaertn)의 꽃턱 (receptacle)을 건조한 것으로 예로부터 연방이라고 불렀을 뿐만 아니라, 약용식물로 사용되어져 왔다.
연꽃 화탁에서 분리된다고 알려진 hyperoside는 비소포성폐 암 세포주로 알려진 A549세포에서 apoptosis를 일으킨다고 알 려져 있어, 연꽃 화탁 추출물도 폐암세포 억제 효과를 가질 것으로 예상된다 (Kim, 2013; Fu et al., 2016).
노루오줌 뿌리 (Astilbe radix)는 노루오줌 [Astilbe Chinensis (Maxim.) Franch. Et Savat. Var.]의 뿌리로 우리나라 각처의 산에 흔히 발견할 수 있는 다년초로 알려져 있으며, 한 방에선 낙신부라는 이름으로 알려져 사용되었다 (Kang, 2008; Hong et al., 2015).
연구에 따르면 노루오줌 뿌리는 인지능을 개선시키고 항산 화 작용과 대장암 세포를 억제한다고 알려져 있고 (Kim et al., 2004; Nho et al., 2018b), 노루오줌 뿌리에서 분리된다고 알려진 daucosterol과 beta sotosterol은 폐암세포를 억제한다고 보고되어 있어 노루오줌 뿌리 에탄올 추출물 또한 폐암세포 억 제 효과를 가질 것으로 예상된다 (Sun et al., 2002; Rajavel et al., 2017).
배롱나무 꽃 (Lagerstroemia flos)는 배롱나무 (Lagerstroemia indica L.)의 꽃을 말린 것으로 한방에선 자미화로 불리며, 일반 적으로 감기와 이뇨제로 사용한다 (Woo et al., 2016).
배롱나무 꽃에서 분리된다고 알려진 C-glycosidic ellagitannin 은 다양한 형태의 암을 억제한다고 알려져 있어, 배롱나무 꽃 에탄올 추출물이 폐암세포를 억제하는 기능을 가질 것으로 예 상된다 (Xu et al., 1991; Ismail et al., 2016).
이들의 공통점은 현재까지의 연구들로 미루어볼 때 우리나 라에서 예로부터 치료에 이용된 약용식물이며 국내에서 자생 한다는 특징을 가지고 있고 최근 주요 이슈인 생물다양성협약 (convention on biological diversty, CBD)에 따른 나고야의정 서 (access to genetic resources and benefit sharing, ABS) 에 의해 우리나라의 전통지식에 대한 해외수요가 유전자원 및 관련 전통지식의 물적 범위에 해당함에 따라 전통지식에 이용 되어온 국내 자생식물의 연구가 필요한 실정이다.
또한 본 실험에서 에탄올 추출물을 하였는데, 이는 에탄을 통한 추출법이 물 추출에 비해 수율 및 에너지 소비 면에서 이점이 좋을 뿐만 아니라 높은 유전상수를 가짐으로 유효성분 의 추출이 이롭다고 알려져 있기 때문에 에탄올 추출법을 이 용하였다 (Amashukeli et al., 2007; Won et al., 2015).
이에 따라 본 연구에서는 국내에서 자생하는 토종자원으로 부터 폐암세포주에 대한 성장억제효과를 알아보기 위해 꼭두 서니 뿌리, 금불초 꽃, 연꽃 화탁, 노루오줌 뿌리, 배롱나무 꽃 으로 부터 추출된 에탄올 추출물을 이용하여 인체유래 폐암세 포주인 NCI-H1229에 대한 성장억제효과를 알아보고자 하였다.
재료 및 방법
1. 실험재료와 추출물의 제조
본 연구에 사용한 모든 약용식물 [꼭두서니 (Rubia akane Nakai) 뿌리, 금불초 꽃 (꼭두서니 꽃), 연꽃 (Nelumbo nucifera Gaertn) 화탁, 노루오줌 뿌리, 배롱나무 (Lagerstroemia indica L.) 꽃] 은 Table 1에 표기하였으며, 전남대학교 생물학 과 임형탁교수와 목포대학교 한약자원학과 김휘교수의 동정을 거쳤다. 사용된 시료의 확증표본은 한약진흥재단 한약자원본 부에 보관하고 있다. 모든 실험재료는 세척한 후 열풍건조기 에서 일주일간 50℃ 조건으로 건조하였다.
건조된 시료들은 분쇄하여 에탄올을 시료 무게의 10 배를 넣은 후, 환류 냉각추출방법을 사용하여 70℃에서 3 시간, 3 회 반복하여 추출하였다. 추출물들은 filter paper (Thermo, Waltham, MA, USA)를 사용하여 여과한 뒤, 동결건조기를 이 용해 건조하였다.
실험재료의 각각의 수율은 꼭두서니 뿌리가 7.3%, 금불초 꽃이 5.2%, 연꽃 화탁은 7.3%, 노루오줌 뿌리는 6.2%, 배롱 나무 꽃이 6.3%를 각각 나타내었으며 각각 건조된 파우더는 phosphate buffered saline (PBS, pH 7.4, Sigma-Aldrich Co., St. Louis, MO, USA)에 녹인 뒤 사용하였다.
2. 세포 배양
NCI-H1229 세포는 America Type Culture Collection (ATCC, Gaithersburg, MD, USA)에서 분양 받았으며, 10% FBS (fetal bovine serum, Gibco BRL, Grand Island, NY, USA)와 1% antibiotics (100㎎/ℓ streptomycin, 100 U/㎖ penicillin, Sigma-Aldrich Co., St. Louis, MO, USA)가 포함 된 Roswell Park Memorial Institute (RPMI) 1640 media (Gibco BRL, Grand Island, NY, USA)를 사용하여 5% CO2, 37℃ 조건하에서 배양하였다.
3. MTS Assay
96 well plate에 5 × 104 cells/well의 NCI-H1229 세포를 분 주하고 3 시간 동안 배양한 후 에탄올 추출물을 각각 첨가하 고 24 시간 동안 배양한 다음 10㎕의 MTS solution (CellTiter 96 Aqueous one solution reagent, Corporation, Madison, WI, USA)을 첨가한 후 CO2 배양기 (37℃, 5% CO2) 에서 3 시간 더 배양시킨 후, 즉시 570㎚에서 흡광도 의 변화를 측정하여 대조군에 대한 암세포 생존율을 백분율로 표시하였다.
4. Caspase-3 활성 측정
Caspase-3 활성은 caspase-3 colorimetric detection kit (Enzo Life Sciences International, Plymouth Meeting, PA, USA)를 사용하였다. 실험방법은 제품 프로토콜에 준하여 활 성의 증감 여부를 조사하였다.
농도별로 처리된 배지에서 24 시간 배양된 세포를 모은 뒤 단백질을 추출하고 정량하여 각각 20㎍의 단백질을 fluorogenic peptide 기질 100 μM이 함유된 extraction buffer [40 mM HEPES (pH 7.4), 20% glycerol (v/v), 1 mM EDTA, 0.2% NP-40 and 10 mM DL-dithiothreitol] 50㎕에 혼합하였으며, microtiter plate에 다시 extraction buffer에 희 석하여 각 sample 당 총 volume이 100㎕가 되게 하였다. 실험에 사용된 기질은 caspase-3의 경우에는 Asp-Glu-Val-Asp (DEVD)-p-nitroaniline (pNA)이며, 준비된 plate를 37℃에서 2 시간 동안 incubation 시킨 후 ELISA reader (Infinite 200 pro, TECAN GmbH, Männedorf, Switzerland)를 이용하여 405㎚의 흡광도를 이용하여 반응의 정도를 측정하였다.
5. 세포분석기 (flow cytometry)를 이용한 암세포 사멸 효과 측정
세포를 24 well plates에 1 × 106 cells/well 농도로 1㎖ 분 주한 뒤 3 시간 동안 배양한 후 시료를 처리하고 37℃에 24 시간 동안 배양하였다. 그 후에 세포를 수확하여 PBS로 wash 를 2 회 세척한 다음, Annexin V를 30 분간 염색 시킨 뒤, 다시 PBS로 wash를 2 회 세척한 다음, PI를 세포내에 형광염 색될 수 있게 30 분 처리 후 flow cytometry (CytoFLEX, Beckman Coulter, Brea, CA, USA)를 이용하여 관찰하였다.
6. 통계처리
통계처리는 SPSS (18.0, Statistical Package for Social Science, SPSS Inc., Chicago, IL, USA)을 이용하여 통계처리 하였고, 평균값과 표준편차를 구하였다. 군 간의 평균값의 차 이를 검증하기 위하여 일원배치 분산분석 (One-way ANOVA) 을 한 후, Duncan’s Multiple Range Test (DMRT)로 변인 간의 차이를 검증하였다. 모든 통계적인 유의성은 p < 0.05 수 준에서 검증하였다.
결과 및 고찰
1. 약용식물 에탄올 추출물이 NCI-H1229 세포생존율에 미치는 영향
앞에서 언급된 각각의 약용식물의 에탄올 추출물이 폐암세 포주인 NCI-H1229 세포의 생존에 미치는 영향을 측정하기 위 해 각각 500, 250, 125, 62.5, 31.25㎍/㎖의 농도로 처리하 여 MTS Assay를 통하여 암세포 생존율을 측정하였으며, 여 러 추출물에 대한 농도결정은 식물 추출물을 이용한 여러 연 구결과를 바탕으로 정하였다 (Ko et al., 2017; Park et al., 2017; Um et al., 2017).
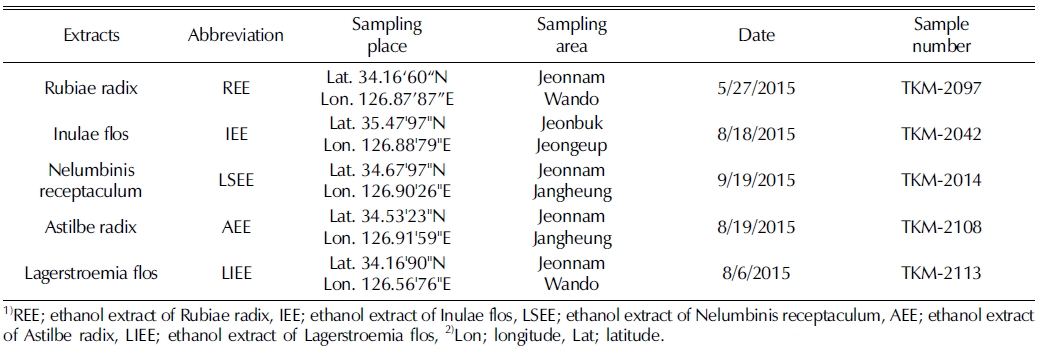
꼭두서니 (Rubia akane Nakai) 뿌리 에탄올 추출물 (REE) 을 여러 농도로 처리하였을 때 폐암세포주의 세포생존율은 최 소 농도부터 농도의존적인 효과를 나타냈으며 (31.25㎍/㎖; 78.33 ± 1.88%, 62.5㎍/㎖; 68.39 ± 3.36%, 125㎍/㎖; 62.58 ± 1.30%, 250㎍/㎖; 52.44 ± 1.12%), 최고 농도인 500㎍/㎖ 에서 30.44 ± 2.17%로 나타났다 (Fig. 1A).
Ethanol extracts of medicinal plants increase cell death on NCIH1229 cells.(A-E) NCI-H1229 cells were treated with various concentration (31.3, 62.5, 125, 250, and 500㎍/ ㎖) for 24 h. Cell viability was measured by MTS assay. A; REE (ethanol extract of Rubiae radix), B; IEE (ethanol extract of Inulae flos), C; LSEE (ethanol extract of Nelumbinis receptaculum), D; AEE (ethanol extract of Astilbe radix), E; LIEE (ethanol extract of Lagerstroemia flos). Means values ± SD from triplicate separated experiments are shown. *Means with difference letters are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
금불초 꽃 에탄올 추출물 (IEE)는 125㎍/㎖ 농도부터 사 멸효과가 나타났으며 (31.25㎍/㎖; 96.26 ± 1.17%, 62.5㎍/㎖; 94.1 ± 1.17%, 125㎍/㎖; 62.58 ± 1.30%, 250㎍/㎖에서 43.01 ± 1.29%), 최고 농도인 500㎍/㎖를 처리하였을 때 세포생존 율은 39.26 ± 1.32%로 확인되었다 (Fig. 1B).
연꽃 (Nelumbo nucifera Gaertn) 화탁 에탄올 추출물 (LSEE)은 금불초 꽃 에탄올 추출물과 마찬가지로 125㎍/㎖ 의 농도부터 사멸효과가 나타났으며 (31.25㎍/㎖; 99.76 ± 2.29%, 62.5㎍/㎖; 94.87 ± 2.33%, 125㎍/㎖; 81.66 ± 3.8%, 250㎍/㎖; 57.58 ± 2.29%), 최고 처리 농도인 500㎍/㎖에서 25.76 ± 2.29%의 세포생존율을 나타냈다 (Fig. 1C).
노루오줌 뿌리 에탄올 추출물 (AEE)은 125㎍/㎖ 농도부터 세포생존율을 감소시켰고 (31.25㎍/㎖; 96.33 ± 1.25%, 62.5㎍ /㎖; 90.67 ± 1.79%, 125㎍/㎖; 79.09 ± 1.37%, 250㎍/㎖; 68.61 ± 1.97%), 최고농도인 500㎍/㎖에서 폐암세포의 세포생 존율을 35.18 ± 1.51% 까지 낮추었다 (Fig. 1D).
배롱나무 (Lagerstroemia indica L.) 꽃 에탄올 추출물 (LIEE)도 다른 추출물과 비슷하게 125㎍/㎖의 농도에서 효과 가 나타났으며 (31.25㎍/㎖; 98.9 ± 1.88%, 62.5㎍/㎖; 88.96 ± 3.36%, 125㎍/㎖; 46.3 ± 1.92%, 250㎍/㎖; 30.16 ± 1.85%), 최고농도인 500㎍/㎖에선 25.58 ± 1.88%까지 세포생존율을 감소시켰다 (Fig. 1E).
결과를 종합하였을 때, 꼭두서니 뿌리, 금불초 꽃, 연꽃 화 탁, 노루오줌 뿌리 및 배롱나무 꽃 에탄올 추출물은 125㎍/㎖ 농도 이상에서 폐암세포주의 생존률을 감소시키는 효과가 있는 것을 확인할 수 있었으며, 이 중 NCI-H 1229 세포주에 대하여 연꽃 화탁 에탄올 추출물 (LSEE)과 배롱나 무 꽃 에탄올 추출물 (LIEE)의 세포생존율 감소비율이 가장 높게 나타났다.
최근 연구결과에 따르면, 비소세포 폐암에 대해 항암제투여 및 방사선 치료 후 옻나무 물추출물을 위주로 투여했을 때 환 자의 생존기간 증진 및 암의 재발률을 감소시킬 수 있다는 가 능성을 보고함에 따라 (Kim et al., 2012), 연꽃 화탁 및 배 롱나무 꽃 추출물이 폐암의 재발률을 감소시키거나 암세포의 성장을 억제할 수 있는지에 대한 심도있는 추가실험이 필요하 다고 생각된다.
2. 약용식물 에탄올 추출물이 caspase-3 단백질 활성화에 미 치는 영향
각각의 에탄올 추출물이 NCI-H 1229 세포주에 대하여 caspase-3 단백질 활성화를 유도하는지에 대해 알아보기 위해, NCI-H 1229 세포주에 추출물을 각각 125, 250 그리고 500㎍/㎖ 농도로 24 시간 동안 처리하고 caspase-3 단백질의 활성도를 측정하였다.
Caspase-3 단백질은 평소 세포내부에서 비활성화 (inactivation) 상태로 존재하다, 특정한 자극이 주어지게 되면 종양억제인자 로 알려져 있는 p53과 같은 단백질에 의해 활성화 (activation) 상태가 되어 apoptosis (세포자멸사)를 유발한다고 알려져 있 다 (Alnemri et al., 1996; Choi, 2007).
이에 근거하여 MTS assay에서 세포 성장억제효과를 나타내 었던 농도를 기준으로 하고 에탄올 추출물을 NCI-H1229 세 포에 각각 125, 250, 500 ㎍/㎖의 농도로 24 시간 동안 처리 하였으며, 세포내부의 caspase-3 단백질 활성정도를 ELISA assay를 통해 측정하였다.
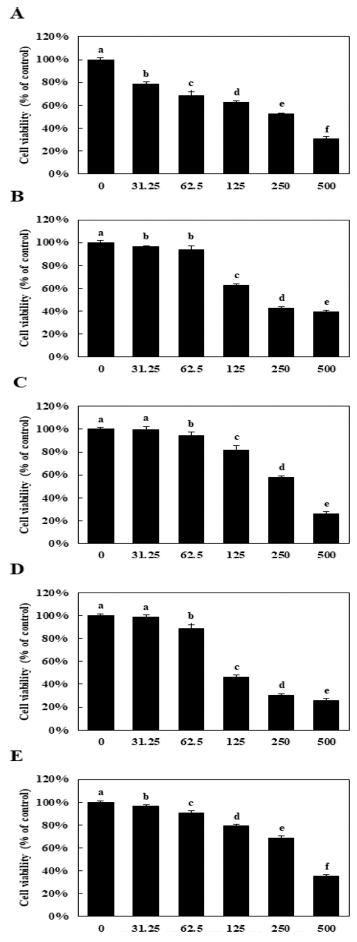
Caspase-3 단백질 활성도를 측정한 결과, 꼭두서니 뿌리 에 탄올 추출물 (REE)은 정상대조군과 비교하였을 때 유의적으 로 증가된 활성도를 나타내었으며 (125㎍/㎖; 12 ± 3.03%, 250㎍/㎖; 18.79 ± 1.88%), 최고농도인 500㎍/㎖를 처리하였 을 때 20.43 ± 2.33%로 증가하였다 (Fig. 2A).
Ethanol extracts of medicinal plants induced caspase-3 activation on NCI-H1229 cells.(A-E) NCI-H1229 cells were treated with various concentration (125, 250, and 500㎍/ ㎖). Caspase-3 activity was measured by capspase-3 activity assay. A; REE (ethanol extract of Rubiae radix), B; IEE (ethanol extract of Inulae flos), C; LSEE (ethanol extract of Nelumbinis receptaculum), D; AEE (ethanol extract of Astilbe radix), E; LIEE (ethanol extract of Lagerstroemia flos). Means values ± SD from triplicate separated experiments are shown. *Means with difference letters are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
금불초 꽃 에탄올 추출물 (IEE)은 위와 같은 농도로 처리하 였을 때 농도의존적으로 caspase-3 단백질 활성도를 증가시켰 으며 (125㎍/㎖; 18.68 ± 0.78%, 250㎍/㎖; 32.24 ± 2.67%), 최고 농도인 500㎍/㎖ 처리군은 최대 39.64 ± 3.05%까지 증 가되었다 (Fig. 2B).
연꽃 화탁 에탄올 추출물 (LSEE)을 처리하였을 때 125㎍/㎖ 처리군에서 caspase-3 단백질 활성도가 유의적으로 증가했지만 이는 미미하였으며, 250㎍/㎖ 농도부터 효과를 나타내었다 (125㎍/㎖; 7.07 ± 3.73%, 250㎍/㎖; 26.21 ± 3.12%). 최고농도인 500㎍/㎖ 처리군은 32.81 ± 2.55%로 증 가하였지만 금불초 꽃 에탄올 추출물 (IEE)에 비해 효과가 떨 어지는 것으로 나타났다 (Fig. 2C).
노루오줌 뿌리 에탄올 추출물 (AEE)도 마찬가지로 연꽃 화탁 에탄올 추출물 (AEE)과 같이 125㎍/㎖ 농도부터 caspase-3 단백질 활성도가 증가하는 것으로 나타났고 (125㎍/㎖; 13.31 ± 1.45%, 250㎍/㎖; 34.69 ± 1.37%), 최고 농도인 500㎍/㎖ 처리군은 38.47 ± 3.92%까지 증가하였다 (Fig. 2D).
배롱나무 꽃 에탄올 추출물 (LIEE)은 농도의존적으로 caspase-3 단백질 활성도를 증가시키는 것으로 나타났으며 (125㎍/㎖; 10.46 ± 0.85%, 250㎍/㎖; 21.95 ± 2.41%), 최고 농도인 500㎍/㎖ 처리군은 32.28 ± 1.16%까지 증가시켰다 (Fig. 2F).
결과를 종합하였을 때, 꼭두서니 뿌리, 금불초 꽃, 연꽃 화 탁, 노루오줌 뿌리, 배롱나무 꽃 에탄올 추출물은 250㎍/㎖ 이상의 처리농도부터 caspase-3 단백질 활성효과가 크게 증가 하는 것을 확인 할 수 있었다. 이는 에탄올 추출물들이 caspase-3 단백질 활성화를 통해 폐암세포의 성장 억제에 관여 할 수 있다는 가능성을 나타낸다고 생각되지만, 추출물과 caspase-3 inhibitor로 흔히 알려진 Z-DEVD-FMK와 같은 pharmacological inhibitor (Kim et al., 2003)를 이용해 추출 물처리가 caspasae-3 신호 전달경로를 직접적으로 경유하는지 에 대한 추가적인 실험이 필요하다고 생각된다.
3. 약용식물 에탄올 추출물의 세포사멸에 미치는 영향
Caspase-3 단백질은 세포내부에서 여러 신호전달 경로를 통 해 세포자멸사 (apoptosis)와 세포괴사 (necrosis)에 관여한다고 알려져 있다 (Yuan et al., 2016; Park et al., 2017). 이에 따라 약용식물 에탄올 추출물이 폐암세포주인 NCI-H1229에 대해 세포자멸사와 세포괴사 중 어떤 세포사멸과정을 통해 성 장억제효과를 나타내는 것인지 확인하기 위해 Annexin V & PI staining을 진행하였다.
보고에 따르면, 정상적으로 생존하는 세포에는 phosphatidyl serine (PS)이 세포질 안쪽에 존재하지만 apoptosis가 진행되면 세포막의 바깥쪽으로 이동하게 되어 Annexin V와 결합하게 된다, 또한 apoptisis에 의해 세포의 죽음이 급진적으로 진행되 거나 necrosis로 진행되었을 때 세포핵이 노출되고 PI (propidium iodide)는 핵에 염색되는 원리를 이용하여 apoptosis 와 necrosis를 구분하고 측정하게 된다 (Rieger et al., 2011; Thomas et al., 2016).
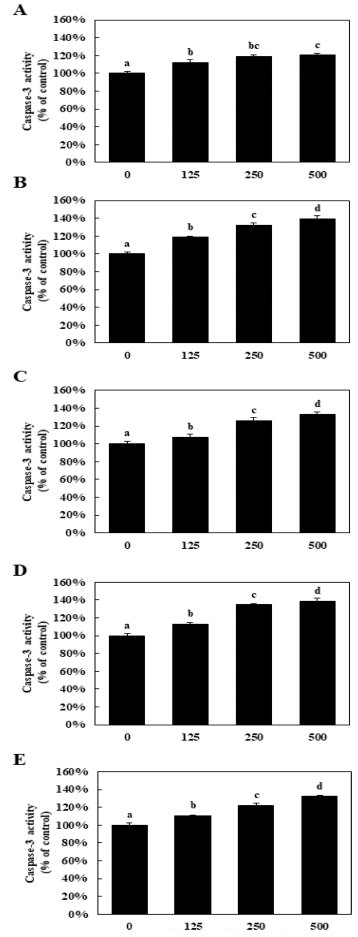
MTS assay와 caspase-3 단백질 활성도 측정실험에서 가장 효과가 좋게 나타난 500㎍/㎖ 농도를 세포에 처리해 실험을 진행하였다. 사용된 모든 에탄올 추출물에 대하여 125, 250㎍/㎖ 처리한 군에서 세포사멸효과가 나타났지만 (data not shown), 폐암세포주의 사멸률이 가장 높게 나타난 500㎍/㎖ 처리 군을 각각 비교하였을 때, 꼭두서니 뿌리 에탄 올 추출물 (REE)은 대조군과 비교하여 early apoptosis (Q2- 4) 비율이 약 44.05%로, 금불초 꽃 에탄올 추출물 (IEE)은 약 78.97%, 연꽃 화탁 에탄올 추출물 (LSEE)은 약 53.38%, 노루오줌 뿌리 에탄올 추출물 (AEE)은 약 79.4%, 마지막으로 배롱나무 꽃 에탄올 추출물 (LIEE)은 약 64.96%로 증가하였 다 (Fig. 3A). 각각 추출물에 대해 early apoptosis (Q2-4)와 late apoptosis (Q2-2)의 비율을 합하여 그래프로 나타냈을 때, 금불초 꽃 에탄올 추출물 (IEE)과 노루오줌 뿌리 에탄올 추출 물 (AEE)이 가장 효과가 좋은 것으로 나타났을 뿐만 아니라 모든 에탄올 추출물이 세포자멸사 (apoptosis)를 통해 폐암세 포의 성장을 억제시키는 것이 확인되었다 (Fig. 3B).
Flow cytometry analysis of NCI-H1229 cells treated with ethanol extracts of medicinal plants.A; NCI-H1229 cells were treated with ethanol extract of medicinal plant at 500 ㎍/㎖ for 24 h. Cells were stained with Annexin V and propidium iodide (PI), analyzed by flow cytometry. Control; non-treated, REE; ethanol extract of Rubiae radix, IEE; ethanol extract of Inulae flos, LSEE; ethanol extract of Nelumbinis receptaculum, AEE; ethanol extract of Astilbe radix, LIEE; ethanol extract of Lagerstroemia flos. B; Apoptosis ratio (early apoptosis; Q2-4 + late apoptosis; Q2-2) was summarized by graph. Means values ± SD from triplicate separated experiments are shown. *Means with difference letters are significantly different at p < 0.05 by Duncan's Multiple Range Test (DMRT).
결과를 종합했을 때, 실험에 사용된 에탄올 추출물이 인간 폐암세포주인 NCI-H1229 세포에 500㎍/㎖ 농도로 처리될 때, caspase-3 단백질 활성화와 세포자멸사를 통해 성장억제효 과를 가지는 것으로 나타났다.
4. 약용식물 에탄올 추출물의 DNA 단편화에 미치는 영향
DNA 단편화는 세포자멸사 과정에서 endonuclease가 활성화 되어 chromosomal DNA를 단편화시킴에 따라 일어나는 전형 적인 특징이다.
CAD (caspase-3 activated DNase)와 EndoG (endonuclease G)는 DNA 단편화에 직접적으로 관여하는 중요 인자로 알려 져 있으며, 세포자멸사 과정이 활성화 되었을 때 cytochrome C, procaspases, smac/DIABLO, AIF와 같은 많은 apoptotic factor들이 영향을 미친다고 알려져 있다 (Nagata, 2000).
이와 같은 근거에 따라 약용식물 에탄올 추출물을 폐암세포 주에 처리하여 DNA 단편화 정도를 측정한 결과, 금불초 꽃 에탄올 추출물 (IEE)과 노루오줌 뿌리 에탄올 추출물 (AEE) 이 가장 효과가 좋은 것으로 나타났다 (Fig. 4).
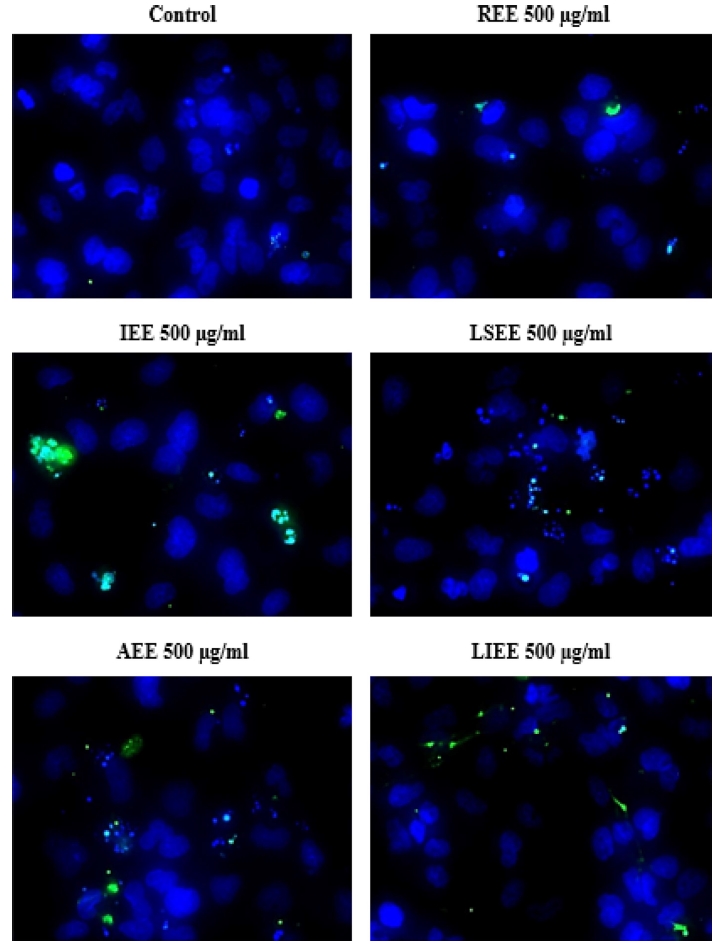
Ethanol extracts of medicinal plants induced DNA fragmentation on NCI-H1229 cells.NCI-H1229 cells were treated with ethanol extract of medicinal plant at 500 ㎍/㎖ for 24 h. Cells were analyzed by TUNEL assay. Control; non-treated, REE; ethanol extract of Rubiae radix, IEE; ethanol extract of Inulae flos, LSEE; ethanol extract of Nelumbinis receptaculum, AEE; ethanol extract of Astilbe radix, LIEE; ethanol extract of Lagerstroemia flos. Representative emages were taken from at least three independent experiments.
꼭두서니 뿌리, 금불초 꽃, 연꽃 화탁, 노루오줌 뿌리 및 배 롱나무 꽃 에탄올 추출물은 250㎍/㎖ 농도 이상에서 폐암세 포주 NCI-H1229의 성장을 억제시킬 뿐만 아니라 세포자멸사 (apoptosis)에 의해 성장억제효과가 나타나는 것으로 확인되어 여러 연구 분야에 이용될 수 있다고 생각된다.
다른 연구결과에 따르면 금불초에서 분리된다고 알려진 성 분인 bigelovin은 대장암세포에 처리하였을 때 산화스트레스에 의한 세포자멸사를 유발하는 것으로 알려져 있고 (Lee et al., 2002; Li et al., 2017), sesquiterpenoids 계열 화합물인 eupatolide 와 deacetylovatifolin은 폐암세포를 억제하는 활성을 가지고 있다고 보고되어 있다 (Wu et al., 2016b).
노루오줌 전초 및 뿌리에서 분리된다고 알려진 coumarin계 열의 화합물인 bergenin은 자궁경부암세포에 대해 사멸효과를 가진다고 보고되어있고, triterpene 계열의 daucosterol은 폐암 세포를 억제한다고 알려져 있다 (Sun et al., 2002; Rajavel et al., 2017; Kim et al., 2018).
따라서 암세포를 사멸시키는 유효성분이 포함될 수 있는 금 불초 꽃과 노루오줌 뿌리가 다른 추출물과 비교했을 때 항암 세포에 대한 세포사멸율이 높은 것으로 추측되지만, 이를 알 기 위해 금불초 꽃과 노루오줌 뿌리에 존재하는 bigelovin과 daucosterol 등의 함량을 분석하는 추가실험이 필요할 것으로 생각된다.
또한 세포내부 또는 외부에서 세부적으로 조절되는 신호전 달경로에 차이에 의한 것으로 사료되어, 이를 밝히기 위해 caspase-3 단백질 이외에 caspase-7, p53 및 MST-1과 같은 여러 단백질들이 관여한다고 밝혀져 있어 (Belloc et al., 2000), 위와 같은 주요 인자를 확인하는 실험이 필요하다고 생 각된다.
감사의 글
본 연구는 보건복지부 한국 토종자원의 한약재기반구축사업 의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Alnemri, ES, Livingston, DJ, Nicholson, DW, Salvesen, G, Thornberry, NA, Wong, WW, Yuan, J, (1996), Human ICE/CED-3 protease nomenclature, Cell, 87, p171, 8861900.
[https://doi.org/10.1016/S0092-8674(00)81334-3]

-
Amashukeli, X, Pelletier, CC, Kirby, JP, Grunthaner, FJ, (2007), Subcritical water extraction of amino acids from atacama desert soils., Journal of Geophysical Research, 112, pG04S16, (cited by 2018 may 20).
[https://doi.org/10.1029/2006JG000308]

-
Bae, JH, Jang, HJ, Jung, JI, (2005), Antimicrobial effect of Rubia akane Nakai on food-borne pathogens, Journal of the Korean Society of Food Science and Nutrition, 34, p389-394.
[https://doi.org/10.3746/jkfn.2005.34.3.389]

-
Belloc, F, Blaud-Rotureau, MA, Lavignolle, V, Bascans, E, Braz-Pereira, E, Durrieu, F, Lacombe, F, (2000), Flowcytometry detection of caspase 3 activation in preapoptoticleukemic cells, Cytometry, 40, p151-160, 10805935.
[https://doi.org/10.1002/(SICI)1097-0320(20000601)40:2<151::AID-CYTO9>3.0.CO;2-9]

- Choi, HS, Park, JM, Ju, SM, Kim, SH, Kim, DK, Kim, WS, Jeon, BH, (2008), Influence of rubiae radix extract on the mechanism of apoptosis in HL-60 cells, Korean Journal of Oriental Physiology and Pathology, 22, p548-555.
-
Choi, JH, Park, YN, Li, Y, Jin, MH, Lee, J, Lee, YJ, Son, JK, Chang, HW, Lee, EK, (2010), Flowers of Inula japonica attenuate inflammatory responses, Immune Network, 10, p145-152, 21165243.
[https://doi.org/10.4110/in.2010.10.5.145]

-
Choi, JH, (2007), Bax protein in cancer treatment, Journal of the Korean Medical Association, 50, p1016-1022.
[https://doi.org/10.5124/jkma.2007.50.11.1016]

- Choi, YH, (2012), Induction of apoptosis and telomerase activity ofNCI-H460 human lung carcinoma cells by methanol extract of Houttuynia cordata thunberg, Cancer Prevention Research, 17, p364-371.
-
Chou, SM, Lai, WJ, Hong, T, Tsai, SH, Chen, YH, Kao, CH, Chu, R, Shen, TL, Li, TK, (2015), Involvement of p38 MAPKin the anticancer activity of cultivated Cordyceps militaris, American Journal of Chinese Medicine, 43, p1043-1057, 26205966.
[https://doi.org/10.1142/S0192415X15500603]

-
Fu, T, Wang, L, Jin, XN, Sui, HJ, Liu, Z, Jin, Y, (2016), Hyperoside induces both autophagy and apoptosis in non-small cell lung cancer cells in vitro, Acta Phamacologica Sinica, 37, p505-518, 26948085.
[https://doi.org/10.1038/aps.2015.148]

- Ham, SS, Chung, CK, Lee, JH, Choi, KP, Jung, SW, Kim, EJ, (1998), Antimutagenicity and cytotoxicity of Artemisia iwayomogi kitamura extracts, Journal of Korean Food Science and Nutrition, 27, p157-162.
- Hong, JY, Park, HR, Kwon, YG, Kwon, WY, Kim, SY, Park, RD, Shin, SY, (2015), Anticancer properties of Astilbe rubraextracts on AsPC-1 human pancreatic cancer cells., Journal ofBasic Sciences, 32, p21-28.
-
Ismail, T, Calcabrini, C, Diaz, AR, Fimognari, C, Turrini, E, Catanzaro, E, Akhtar, S, Sestili, P, (2016), Ellagitannins in cancer chemoprevention and therapy., Toxins, 13, pE151, http://www.mdpi.com/2072-6651/8/5/151/pdf (cited by 2018 may 20).
[https://doi.org/10.3390/toxins8050151]

- Jo, DH, Min, KJ, Cha, CG, (2007), The antioxidant and antitumor effects of the extract of Bulnesia sarmientia, Journal of Food Hygiene and Safety, 22, p120-126.
- Kang, BH, (2008), Illustrated book of ecology in Korean herbal medicine, Geobook, Seoul, Korea, p487.
- Kim, AH, Nho, JH, Woo, KW, Gang, JE, Sim, MO, Kim, MS, Ham, SH, Cho, HW, (2018), Quantitative analysis ofbergenin in Astilbe rubra and growth inhibition effect ofethanol extract on hela cells, Korean Journal of Pharmacognosy, 49, p47-54.
- Kim, DH, Park, JH, Kim, SH, Sung, SH, (2012), Stability testand analysis of Rubia cordifolia for carcinogenicity study, Korean Journal of Pharmacognosy, 43, p147-151.
- Kim, GS, Lee, SE, Lee, HJ, Kim, YM, Jeon, SY, Park, CG, Seong, NS, Song, KS, (2004), Inhibition activity of plant extracts against prolyl endopeptidase, Korean Journal of Medicinal Crop Science, 12, p1-9.
- Kim, JH, Ajaz, M, Lokshin, A, Lee, YJ, (2003), Role of antiapoptotic proteins in tumor necrosis factor-related apoptosisinducing ligand and cisplatin-augmented apoptosis, Clinical Cancer Research, 9, p3134-3141, 12912965.
-
Kim, JH, Lee, JH, Kim, YH, Kim, KH, (2009), Apoptotic effect of Rubia cordifolia dichloromethane extracts on human acute jurkat T cells, Journal of Life Science, 19, p163-168.
[https://doi.org/10.5352/JLS.2009.19.2.163]

- Kim, KS, (2015), Case study: Regression of a residual tumor and prolongation of overall survival with allergen-removed Rhus verniciflua stokes after chemoradiotherapy in locally advancednon-small cell lung cancer, Journal of Internal Korean Medicine, 36, p200-206.
- Kim, MJ, (2013), Evaluation of antioxidative effect from Lotus seed and seedpod extracts., Master Thesis, Dongguk University, p1-63.
-
Ko, HM, Eom, TK, Song, SK, Jo, GY, Kim, JS, (2017), Tyrosinase and α-glucosidase inhibitory activities and antioxidant effects of extracts from different parts of Hypochaeris radicata, Korean Journal of Medicinal Crop Science, 25, p139-145.
[https://doi.org/10.7783/KJMCS.2017.25.3.139]

-
Lee, HT, Yang, SW, Kim, KH, Seo, EK, Mar, W, (2002), Pseudoguaianolides isolated from Inula britannica var. chinenis as inhibitory constituents against inducible nitric oxide synthase, Archives of Pharmacal Research, 25, p151-153, 12009027.
[https://doi.org/10.1007/BF02976555]

- Lee, SH, Jeong, DW, Kim, GT, Park, SY, Kim, SY, Park, OJ, Kim, YM, (2012), Quercetin of plants extracts regulates sestrin2and induces apoptosis in HT-29 colon cancer cells, CancerPrevention Research, 17, p244-250.
- Lee, YJ, Han, JY, (2011), Current trends in early diagnosis and treatment of lung cancer, Korean Journal of Medicine, 80, p529-531.
-
Li, M, Song, LH, Yue, GG, Lee, JK, Zhao, LM, Li, L, Zhou, X, Tsui, SK, Ng, SS, Fung, KP, Tna, NH, Lau, CB, (2017), Bigelovin triggered apoptosis in colorectal cancer in vitro andin vivo via upregulating death receptor 5 and reactive oxidativespecies., Scientific Reports, 7, p42176, (cited by 2018 May 1).
[https://doi.org/10.1038/srep42176]

-
Nagate, S., (2000), Apoptotic DNA fragmentation, Experimental Cell Research, 256, p12-18, 10739646.
[https://doi.org/10.1006/excr.2000.4834]

- Nho, JH, Jang, JH, Jung, HK, Lee, MJ, Sim, MO, Jeong, DE, Cho, HW, (2018b), Ethanol extracts fromAstilbe Chinensis(Maxim.) Franch. Et. Savat. exhibit inhibitory activities onoxidative stress generation and viability of human colorectal cancer cells, Korean Journal of Medicinal Crop Science, 26, p141-147.
- Nho, JH, Jung, DE, Jung, HK, Lee, MJ, Jang, JH, Sim, MO, Jung, JK, Cho, HW, (2018a), Inhibitory effect of anethanol extract of inulae flos on nitric oxide production,oxidative stress and human colorectal cancer cell line, Korean Journal of Medicinal Crop Science, 26, p19-25.
-
Oh, CM, Won, YJ, Jung, KW, Kong, HJ, Cho, H, Lee, JK, Lee, DH, Lee, KH, (2016), Cancer statistics in Korea: Incidence, mortality, survival, and prevalence in 2013, Cancer Research and Treatment, 48, p436-450, 26987395.
[https://doi.org/10.4143/crt.2016.089]

- Park, CH, Kim, JH, Choi, SH, Shin, YS, Lee, SW, Cho, EJ, (2017), Protective effects of Glycyrrhiza uralensis radix extractand its active compounds on H2O2-induced apoptosis of C6 glialcells, Korean Journal of Medicinal Crop Science, 25, p315-321.
-
Rajavel, T, Mohankumar, R, Archunan, G, Ruckmani, K, Devi, KP, (2017), Beta sitosterol and daucosterol(phytosterols identified in Grewia tiliaefolia) perturbs cell cycle and induces apoptotic cell death in A549 cells, Scientific Reports, 7, p3418, (cited by 2018 May 10).
[https://doi.org/10.1038/s41598-017-03511-4]

- Rho, SN, Kim, DH, (2002), Anti-tumor effect of carrot(Docus carota L.) extracts in the human lung cancer cell line NCIH1229, Journal of the East Asian Society of Dietary Life, 12, p289-298.
-
Rieger, AM, Nelson, KL, Konowalchuk, JD, Barreda, DR, (2011), Modified annexin V/propidium iodide apoptosis assayfor accurate assessment of cell death, Journal of VisualizedExperiments, 50, p2597, (cited by 2018 May 10).
[https://doi.org/10.3791/2597]

-
Sarna, L, Evangelista, L, Tashkin, D, Padilla, G, Holmes, C, Brecht, ML, Grannis, F, (2004), Impact of respiratory symptoms and pulmonary function on quality of life of ling-term survivors of non-small cell lung cancer, Chest, 125, p439-445, 14769722.
[https://doi.org/10.1378/chest.125.2.439]

- Sun, HX, Ye, YP, Yang, K, (2002), Studies on the chemicalconstituents in radix Astilbes chinensis., China Journal ofChinese Materia Medica, 27, p751-754.
- Sung, KE, Jeong, KH, Kim, AR, Kim, EY, (2016), An analysis on prescribing patterns of antidepressants and their associated factors in lung cancer patients, Korean Journal of Clinical Pharmacy, 26, p107-114.
-
Thomas, E, Gopalakrishnan, V, Somasagara, RR, Choudhary, B, Raghavan, SC, (2016), Extract of Vernonia condensata, inhibits tumor progression and improves survival of tumorallograft bearing mouse., Scientific Reports, 6, p23255, https://www.nature.com/articles/srep23255.pdf (cited by 2018 May 20).
[https://doi.org/10.1038/srep23255]

-
Um, JN, Min, JW, Joo, KS, Kang, HC, (2017), Nitric oxide production and elastase inhibitory activities of extract and its fraction from phellodendri Cortex, Korean Journal of Medicinal Crop Science, 25, p22-28.
[https://doi.org/10.7783/KJMCS.2017.25.1.22]

-
Won, BY, Shin, KY, Ha, HJ, Yun, YS, Kim, YR, Lee, HG, (2015), Changes in nutritional composition of dropwort (Oenanthe javanica) ethanol extracts, Journal of the Korean Society of Food Science and Nutrition, 44, p882-887.
[https://doi.org/10.3746/jkfn.2015.44.6.882]

- Woo, KW, Sim, MO, Park, EJ, Kim, MS, Suh, WS, Cho, HW, Kwon, HC, Park, JC, Lee, KR, (2016), Chemical Constituents from the stems of Lagerstroemia indica and their anti-oxidant effect, Korean Journal of Pharmacognosy, 47, p204-210.
-
Wu, M, Li, T, Chen, L, Peng, S, Liao, W, Bai, R, Zhao, X, Yang, H, Wu, C, Zeng, H, Liu, Y, (2016a), Essential oils from Inula japonica and Angelicae dahuricae enhance sensitivity of MCF-7/ADR breast cancer cells to doxorubicin via multiplemechanisms, Journal of Ethnopharmacology, 180, p18-27, 26795076.
[https://doi.org/10.1016/j.jep.2016.01.015]

-
Wu, XD, Ding, LF, Tu, WC, Yang, H, Su, J, Peng, LY, Li, Y, Zhao, QS, (2016b), Bioactive sesquiterpenoids from the flowers of Inula japonica, Phytochemistry, 129, p68-76, https://www.sciencedirect.com/science/article/abs/pii/S0031942216301352(citedby2018May20), 27452450.
[https://doi.org/10.1016/j.phytochem.2016.07.008]

-
Xu, YM, Tanaka, T, Nonaka, GI, Nishinoka, I, (1991), Tannins and related compounds. CVII. structure elucidation ofthree new monomeric and dimeric ellagitannins, flosin B andreginins C and D, isolated from Lagerstroemia flos-reginae RETZ, Chemical and Pharmaceutical Bulletin, 39, p647-650.
[https://doi.org/10.1248/cpb.39.647]

-
Yuan, J, Najafov, A, Py, BF, (2016), Roles of caspases in necrotic cell death, Cell, 167, p1693-1704, 27984721.
[https://doi.org/10.1016/j.cell.2016.11.047]

- Yun, JS, Jeong, BH, Kim, NY, Seong, NS, Lee, HY, Lee, JH, Kim, JD, (2003), Screening of 94 plant species show ACE inhibitory activity, Korean Journal of Medicinal Crop Science, 11, p246-251.
-
Zhao, L, Li, Y, He, M, Song, Z, Lin, S, Yu, Z, Bai, X, Wang, E, Wei, M., (2014), The fanconi anemia pathway sensitizes to DNAalkylating agents by inducing JNK-p53-dependent mitochondrialapoptosis in breast cancer cells, International Journal of Oncology, 45, p129-138, https://www.spandidos-publications.com/ijo/45/1/129(citedby2018May20), 24789349.
[https://doi.org/10.3892/ijo.2014.2400]