인삼 연작토양에서 관수 및 인삼뿌리 잔사물이 토양 미생물상 및 뿌리썩음병 발생에 미치는 영향
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Some phenolics detected in the soil may inhibit the seed germination and seedling growth of ginseng (Panax ginseng). This study investigated the effect of irrigation and ginseng root residue addition on the soil microbial community and root rot disease in 2-year-old ginseng.
Each 20 ℓ pot was filled with soil infected with ginseng root rot pathogens, and irrigated daily with 2 ℓ of water for one month. After the irrigation treatment, ginseng fine root powder was mixed with the irrigated soil at a rate of 20 g per pot. In descending order, NO3−, electric conductivity (EC), exchangeable Na (Ex. Na) and K (Ex. K) decreased due to irrigation. In descending order, NO3−, EC, Ex. K, and available P2O5 increased with the additon of ginseng powder to the soil. The abundance of Trichoderma crassum decreased with irrigation, but increased again with the incorporation of ginseng powder. The abundance of Haematonectria haematococca increased with irrigation, but decreased with the incorporation of ginseng powder. The abundance of Cylindrocarpon spp. and Fusarium spp., which cause ginseng root rot, increased with the incorporation of ginseng powder. The abundance of Arthrobacter oryzae and Streptomyces lavendulae increased with irrigation. The abundance of Streptomyces lavendulae decreased, and that of Arthrobacter spp. increased, with the incorporation of ginseng powder. Aerial growth of ginseng was promoted by irrigation, and ginseng root rot increased with the incorporation of ginseng powder.
Ginseng root residues in the soil affected soil nutrients and microorganisms, and promoted ginseng root rot, but did not affect the aerial growth of ginseng.
Keywords:
Panax ginseng C. A. Meyer, Ginseng Root Residue, Root Rot, Soil Microbial Community, Soil Nutrients서 언
인삼 (Panax ginseng C. A. Meyer)은 한 곳에서 다년간 재배되기 때문에 고년생으로 갈수록 토양병원균에 의한 뿌리 썩음병 발생이 많아져 6년근 인삼의 수확주수 비율은 50 - 70% 내외로 낮으며, 다시 재작할 경우 2년생부터 뿌리썩음병 발생이 급증하여 연작피해가 심한 편이다. 연작장해를 회피하 기 위해 초작지를 찾아 원거리 이동재배를 하는데, 이로 인해 임차료, 교통비, 제반 관리비용 등 경영비 증가의 원인이 되고 있다.
인삼의 연작장해는 주로 Cylindrocarpon destructans와 Fusarium solani 등과 같은 토양전염성 병원균에 의한 뿌리썩 음병 때문에 발생하는데 (Rahman and Punja, 2005; Kang et al., 2007), 이러한 병원균은 후막포자를 만들어 토양에서 10년 이상 생존하기 때문에 인삼을 수확한 후 10년 이상이 경 과되어야 비로소 재작이 가능하다 (Kang et al., 2007).
그동안 인삼의 연작장해를 극복하고자 여러 시도가 있었는 데, 벼를 4 - 5년 재배하면 토양전염성 병원균의 밀도를 낮출 수 있고 유기산 등 생육 억제물질 등을 씻어내는 효과가 있어 대부분 4년근 재배농가에서 널리 쓰이고 있으나 4년근 이상에 서는 병원균의 밀도가 크게 증가하여 병 발생이 많아지는 단 점이 있다 (Jo et al., 1996).
인삼의 재배기간이 증가할수록 토양 세균의 다양성이 감소 하여 연작장해 발생의 원인이 되는데, 이는 오래된 뿌리가 더 적은 량의 유기물을 배출하여 세균의 생육에 필요한 무기양분 이 고갈되기 때문이며, pH가 높고 유효인산과 칼슘 함량이 많 은 토양일수록 세균의 다양성이 증가된다고 하였다 (Nguyen et al., 2016). 작약의 재배년수 증가에 따라 세균과 방선균의 밀도는 1 - 3년까지 증가하다가 감소하였고 사상균 밀도는 재 배년수에 따라 크게 증가되었다 (Park et al., 2011).
미국인삼 재배토양으로부터 사포닌을 분리한 결과 토양 중 에 0.02% - 0.098% (평균 0.06%) 존재하는데, 조사포닌을 함 유한 배지에 병원균을 배양하였을 때 인삼의 뿌리썩음병을 일 으키는 Phytophthora cactorum과 Pythium irregulare의 균 총 무게가 증가되어 진세노사이드들은 근권에서 활물기생 성 곰팡이들의 생장에 대하여 타감작용을 유도하는 자극제 (allelopathic stimulators)로서 작용하였다 (Nicol et al., 2003).
타감작용 (allelopathy)은 식물의 뿌리에서 분비되는 화학물 질이 직간접적으로 다른 작물에 유해하거나 유익한 작용을 하 는 것인데, 옥수수, 밀, 사탕수수, 귀리 등이 재배된 토양에서 생육저해 물질인 ferulic acid, p-coumaric acid 등이 분리되었 으며, 이러한 타감물질을 제거를 위해 교호재배를 하거나 관 수 또는 토양배수를 양호하게 하여 이들 물질을 제거해야 한 다고 하였다 (Suh and Lee, 1993).
인삼 조사포닌의 농도가 증가될수록 F. solani의 생장은 억 제되었으나 인삼즙액의 농도가 증가할수록 F. solani의 생장은 증가되었으며, 인삼 조사포닌과 인삼즙액은 모두 세균성 뿌리 썩음병원균인 Erwinia carotovora의 생장을 촉진시켰다 (Park and Ohh, 1981).
식물뿌리 분비물과 식물체의 부패중인 조직에서 유래되는 페놀화합물 (salicylic acid, cinnamic acid, benzoic acid)은 인삼 뿌리썩음병의 원인이 되는 C. destructans의 균사 생장을 억제하였으나 식물병원균 효소 (pectinase, cellulase)의 활성을 크게 촉진하였고 이로 인해 뿌리썩음병원균의 병원성이 강해 져 연작장해 발생이 증가되었다 (Sun et al., 2013).
인삼뿌리의 추출물은 C. destructans의 생육에 필요한 영양 공급원이 되고 병원균 포자의 발아를 유도하는 신호로 작용하 는 화학적 유인 물질을 함유하고 있어 인삼의 재배과정 중에 분비되는 아미노산, 페놀화합물 등은 인삼의 생육과 병 발생 에 큰 영향을 미쳤다 (Xu et al., 2016).
따라서 본 연구에서는 인삼 연작지 토양에서 과다한 무기양 분, 유기산, 병원균 등 생육 저해요인을 제거하기 위해 관수처 리를 하고 관수 후 인삼 세근 분말을 토양에 혼화하여 토양 속에 존재하는 인삼뿌리 잔사물이 인삼의 생육 및 뿌리썩음병 발생에 미치는 영향을 구명하고자 하였다.
재료 및 방법
1. 시험토양
본시험은 충북 음성의 국립원예특작과학원 인삼특작부 유리 온실에서 수행하였다. 2015년 10월 하순에 6년근 인삼 (Panax ginseng C. A. Meyer)을 수확한 포장 (암회갈색의 식 양토, 지산통)에서 연작토양을 채취하였다. 20㎝ 깊이 이내의 작토층을 채취하여 플라스틱 원형포트 (지름 30㎝, 높이 35㎝)에 담아 유리온실 안으로 옮긴 다음 뿌리썩음병이 발생 한 묘삼을 포트당 20 주씩 이식하여 2016년 1월 30일까지 재배하면서 이병토양을 조성하였다.
2. 관수 및 인삼 세근 분말 토양혼화
인삼 연작토양을 담은 포트에 매일 1 회 2ℓ의 지하수를 2016년 2월 1일에서 2월 29일까지 1 개월 동안 관주처리 하 였다.
관수 후 인삼 세근 분말의 토양혼화 처리는 이병토양에 1 개월 동안 관수처리 후 6년근 인삼의 세근 분말을 20 포트당 g씩 토양에 골고루 혼합해 준 다음 1 개월간 보관하였다.
관수 후 세근 분말처리를 한 이유는 토양의 염류농도를 재 배 적정범위로 낮추어 주고 연작장해 발생에 영향을 미칠 수 있은 물질들을 줄여 인삼 세근 분말의 효과만을 명확히 구명 하기 위함이었다.
그리고 인삼뿌리 중 세근을 선택한 이유는, 6년근 인삼 수 확 시 주근과 지근을 제외한 세근은 대부분 탈락되고 토양에 잔류하여 토양환경에 영향을 미치며, 세근은 주근과 지근에 비 해 사포닌 함량이 높고 전분함량이 낮기 때문에 (Jang et al., 1987) 세근을 시험재료로 이용하였다.
각각의 시험구는 총 20 포트를 처리하여 5 포트씩 4 반복 으로 조사하였다.
3. 토양 이화학성 분석
묘삼을 정식하기 전인 2016년 4월 상순에 토양시료를 채취 하였다. 토양시료를 풍건하여 분쇄 후 10 mesh (2㎜)체를 통 과한 다음 유발에 미세하게 갈아 분석용으로 사용했다. 토양 화학성분 중 pH, EC, 유기물, 유효인산 및 치환성 양이온인 K, Ca, Mg은 농촌진흥청 토양화학분석법 (NIAST, 2000)에 준하였다.
시료 10 g을 100㎖ 삼각플라스크에 평량하고 침출액 (0.1N HCl) 50㎖ 첨가 후 항온 수조 30℃에서 1 시간 진탕 후 Toyo No. 5B로 여과하여 ICP-OES (Intergra XMP, GBC, Braeside, Australia)로 치환성 양이온을 측정했다. 유기물 분석 은 토양시료 0.5 g을 취해 Automatic Carbon/Nitrogen Analyzer (Vario MAX CN, Elementar, Hanau, Germany)를 이용하여 900℃로 연소하여 총탄소량을 구한 다음 유기물 함 량으로 환산하였다.
4. 토양미생물 다양성 분석
토양시료는 묘삼을 정식하기 전인 2016년 4월 상순에 채 취하여 2㎜ 체로 정선한 다음 미생물 다양성 분석에 이용하 였다.
DNA 추출은 Soil DNA Isolation Kit (Mo Bio Laboratories, Sunnyvale, CA, USA)를 사용하여 제조회사의 지침에 따라 수행하였다. 추출된 DNA는 분석까지 −20℃에서 보관하였다. 세균의 다양성을 분석하기 위해 Bacterial 16S rRNA 유전자의 V1 - V3 영역을 27F 및 518R primers를 사 용하여 각 시료로부터 증폭하였다. 곰팡이의 다양성 분석을 위 해 새롭게 만들어진 primer set, TFungi 18F (5-TYY GGR AGG, GGT, GTA, TTT-3) 및 TFungi 18R (5-CAG AWA TTT GAA TGA ASC AT-3)을 이용하여 18S rRNA 유전자 의 5 영역을 증폭하였다.
PCR 반응은 이전에 기술된 방법 (Lim et al., 2010)과 같 이 수행하였다. DNA 염기서열 분석은 Roche/454 GS FLX Titanium platform을 사용하여 ChunLab (Seoul, Korea)에서 수행하였다.
5. 묘삼 정식 및 인삼 생육특성 조사
4월 상순에 자경종 묘삼 (0.77 ± 0.04 g/주)을 각각 처리된 포트에 포트당 20 주씩 정식하여 재배하였으며, 적정 토양수 분 (18 - 20%)을 유지해 주기위해 1 주일 간격으로 포트당 1ℓ의 지하수를 관주해주었다. 6월 하순에 초장, 엽장, 엽폭 등 지상부 생육특성을 조사하였으며, 7월 상순에 수확하여 주 당근중, 근장 등 지하부 생육특성과 뿌리썩음병 발생율을 조 사하였다.
뿌리썩음병 발생정도는 0 (무발생), 1 (발병초기, 작은 반점 형성), 2 (뿌리전체에서 부패 증상 50% 이하), 3 (뿌리전체에 서 부패 증상 70% 이하), 4 (완전 부패)로 구분하여 다음과 같은 방법 (Rahman and Punja, 2005)으로 조사하였다. 즉, 뿌리썩음병 발병지수 (disease severity index, DSI) 구하는 공 식은 (X0 × 0) + (X1 × 1) + (X2 × 2) + (X3 × 3) + (X4 × 4)/ (X0 +X1 + X2+X3 + X4)이고, X0; 무병징, X1; 병반 면적 10% 이하, X2; 병반 면적 50% 이하, X3; 병반 면적 70% 이하, X4; 완전부패로 구분하였다.
6. 통계분석
통계프로그램 SAS (Version 9.2, SAS Institute Inc. Cary, NC, USA)을 이용하여 5% 유의수준에서 Duncan’s Multiple Range Test (DMRT)로 처리 간 유의성 검정을 하였다 (p < 0.05).
결과 및 고찰
1. 관수 및 인삼 세근 분말 처리에 따른 토양이화학성의 변화
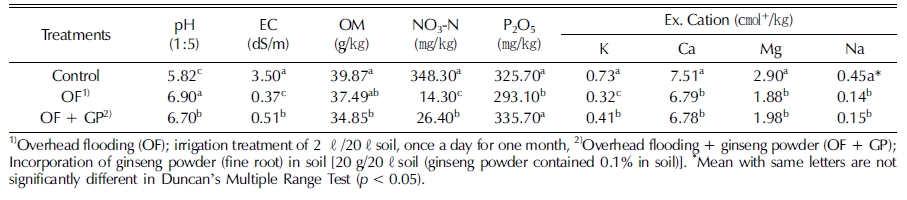
Table 1에서와 같이 6년근 인삼 (Panax ginseng C. A. Meyer)을 수확한 연작지 토양에 관수처리 및 관수처리 후 인 삼 세근 분말 토양혼화 처리가 토양이화학성에 미치는 영향을 조사하였다. 토양산도는 관수처리에 의해 뚜렷이 증가되었으 며, 관수처리 후 인삼 세근 분말을 혼화처리하면 감소되었다.

Change of soil chemical properties by irrigation treatment and incorporation of ginseng fine root powder into the soil infected with ginseng root rot pathogens.
Lee 등 (2016)에 의하면 토양산도는 인삼 이식 전에 비해 수확 후 감소되었으며, 이는 인삼뿌리에서 분비되거나 뿌리가 분해될 때 생기는 유기산 등 페놀물질의 축적 때문이라고 하 였는데, 본 시험에서도 인삼 세근 분말의 첨가에 의해 토양산 도가 낮아져 비슷한 결과를 보였다.
염류농도는 관수처리하면 염류의 용탈에 의해 뚜렷이 감소 하였으며, 인삼 세근 분말을 혼화처리하면 다시 유의적으로 증 가하였다. 유기물 함량은 관수처리에 의해 감소되었으나 처리 간 유의적인 차이를 보이지 않았으며, 인삼 세근 분말의 첨가 에 의해서도 증가되지 않았다. 질산태 질소는 관수처리에 의 해 뚜렷이 감소하였으며, 인삼 세근 분말을 혼화처리하면 다 시 유의적으로 증가하였다. 염류농도는 질산태 질소와 가장 큰 정의상관 관계를 보이기 때문에 (Lee et al., 2017) 질산태 질 소의 감소는 염류농도 감소에 가장 큰 영향을 미친 것으로 보 인다.
유효인산은 관수처리에 의해 유의적으로 감소하였는데, 인 삼 세근 분말을 혼화처리하면 유의적으로 증가하였다. 칼륨은 관수처리에 의해 뚜렷이 감소하였고 인삼 세근 분말 혼화처리 에 의해 유의적으로 증가하였다. 칼슘, 마그네슘 및 나트륨은 관수처리에 의해 유의적으로 감소하였고 인삼 세근 분말 혼화 처리에 의해 약간 증가되었으나 유의성이 없었다.
이와 같이 관수처리에 의해 질산태 질소 >염류농도 >나트 륨 >칼륨 >마그네슘 ≥ 인산 순으로 감소하였으며, 유기물 함 량은 유의적인 변화를 보이지 않았다. 인삼 세근 분말 혼화처 리에 의해 질산태 질소 >염류농도 >칼륨 >인산 순으로 증가 하였으며, 유기물, 칼슘, 마그네슘, 나트륨 함량은 유의적인 변 화를 보이지 않았다.
2. 관수 및 인삼 세근 분말 처리에 따른 토양의 미생물상 변화
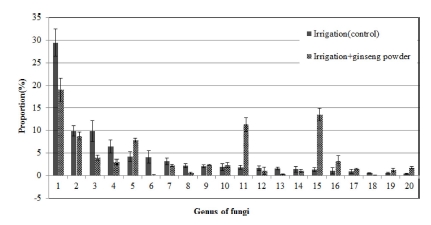
Fig. 1에서와 같이 인삼 연작지 토양에서 관수처리에 따른 곰팡이 속 단위에서의 변화를 보면, Trichoderma 속은 38.7% 에서 4.2%로 감소하였고 Fusarium 속은 11.8%에서 29.5%로, Waitea 속도 2.5%에서 9.9%로 증가하였다.
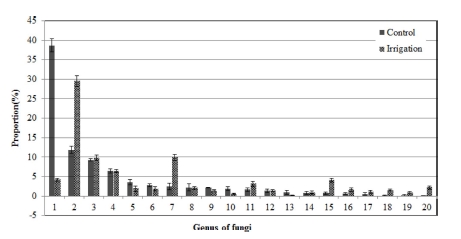
Composition ratio of soil microbial communities in fungi genus by irrigation treatment in the soil infected with ginseng root rot pathogens.1; Trichoderma, 2; Fusarium, 3; Pseudogymnoascus, 4; Pseudallescheria, 5; Chaetomidium, 6; Scytalidium, 7; Waitea, 8; Humicola, 9; Mortierella, 10; Myrothecium, 11; Fungi_uc_g, 12; Podospora, 13; Guehomyces, 14; Ascobolus, 15; Cladosporium, 16; Phialemonium, 17; Eukarya_uc_g, 18; Plectosphaerella, 19; Ascodesmidaceae_uc, 20; Onygenales_uc_g.
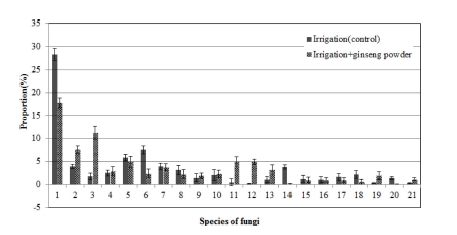
Fig. 2에서와 같이 관수처리에 따른 곰팡이 종 단위에서 변화 양상을 보면, Trichoderma 속의 Trichodermacrassum은 37.5% 에서 3.9%로 감소하였으며, Fusarium 속의 Haematonectria haematococca는 11.1%에서 28.3%로 증가하였다. 또한 Pseudogymnoascus 속의 Geomyces pannorum은 2.8%에서 7.6%로, Waitea 속의 Waitea circinata는 1.8%에서 5.9%로 증가하였다.
Composition ratio of soil microbial communities in fungi genus by incorporation of ginseng fine root powder into the soil infected with ginseng root rot pathogens.1; Fusarium, 2; Waitea, 3; Pseudogymnoascus, 4; Pseudallescheria, 5; Trichoderma, 6; Cladosporium, 7; Fungi_uc_g, 8; Onygenales_uc_g, 9; Humicola, 10; Chaetomidium, 11; Scytalidium, 12; Phialemonium, 13; Plectosphaerella, 14; Podospora, 15; Mortierella, 16; Eukarya_uc_g, 17; Ascobolus, 18; Myrothecium, 19; Chaetomium, 20; Cryptococcus.
Trichoderma 속 곰팡이들은 토양에 널리 존재하고 식물병 방제를 위한 길항미생물로도 이용되는데, T. crassum은 T. koningii에 비해 시들음병 (verticillium wilt) 방제에 효과가 적 다고 하였다 (Jamdar et al., 2013).
H. haematococca는 Fusarium solani의 완전세대형으로 인 삼에서 주로 적변을 유발하며 병원성은 낮은 것으로 보고되었 다 (Punja et al., 2007). G. pannorum은 토양에 널리 존재하 는 부생균이며, Rhizoctonia에 의한 잘록병 억제에 효과가 있 다고 하여 (Nelson et al., 1983) G. pannorum의 증가는 인 삼 연작장해 경감에 긍정적인 영향을 미친 것을 보인다.
W. circinata는 Rhizoctonia oryzae의 완전세대형으로 벼의 균핵병이나 보리, 밀의 뿌리썩음병을 일으키는 병원균으로 (Paulitz et al., 2003) 인삼의 병 발생과는 관련이 적을 것으 로 생각된다.
인삼의 뿌리썩음병과 관련되는 Cylindrocarpon species는 전 체 곰팡이에서 매우 낮은 비율로 존재하고 있는데, 관수처리 에 의해 0.04%에서 0.02%로 감소하여 인삼 연작장해 경감에 긍정적인 영향을 미쳤다.
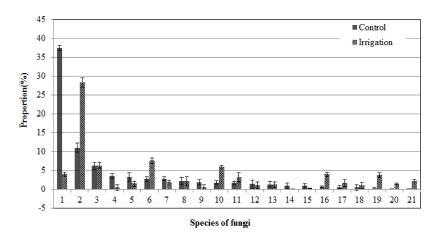
Fig. 3에서와 같이 인삼 세근 분말 토양혼화에 따른 곰팡이 속 단위에서의 변화를 보면, Fusarium 속은 29.5%에서 19.0%로 감소하였고 Mortierella 속은 1.3%에서 13.5%로, Scytalidium 속은 1.8%에서 11.3%로 증가하였다.
Composition ratio of soil microbial communities in fungi species by irrigation treatment in the soil infected with ginseng root rot pathogens.1; Trichodermacrassum_2, 2; Haematonectria haematococca_1, 3; Pseudallescheria fimeti_1, 4; Pseudogymnoascus roseus_1, 5; Chaetomidium group, 6; Geomyces pannorum_2, 7; Scytalidium thermophilum_3, 8; Humicola fuscoatra, 9; Myrothecium verrucaria_2, 10; Waitea circinata_30, 11; Fungi_uc_s, 12; Geomyces pannorum_1, 13; Podospora setosa, 14; Mortierella alpina_2, 15; Guehomyces pullulans, 16; Waitea circinata_4, 17; Taifanglania inflata, 18; Eukarya_uc_s, 19; Cladosporium sphaerospermum_1, 20; Monographella cucumerina_1, 21; Onygenales_uc_s.
Fig. 4에서와 같이 관수 후 인삼 세근 분말 토양혼화에 따 른 토양 미생물 중 곰팡이 종 단위에서의 변화양상을 보면, H. haematococca은 28.3%에서 17.7%로 감소하였고, G. pannorum도 7.6%에서 2.4%로, Pseudallescheria fimeti도 6.3%에서 2.9%로 감소하였다. 반면 T. crassum은 3.9%에서 7.6%로 증가하였고, Scytalidium thermophilum도 1.8%에서 11.3%로 증가하였으며, Mortierellaelongata도 0.2%에서 4.9%로 증가하였다.
Composition ratio of soil microbial communities in fungi species by incorporation of ginseng fine root powder into the soil infected with ginseng root rot pathogens.1; Haematonectria haematococca_1, 2; Trichodermacrassum_2, 3; Scytalidium thermophilum_3, 4; Pseudallescheria fimeti_1, 5; Waitea circinata_30, 6; Geomyces pannorum_2, 7; Waitea circinata_4, 8; Fungi_uc_s, 9; Chaetomidium group, 10; Humicola fuscoatra, 11; Mortierella_uc, 12; Mortierellaelongata_3, 13; Eukarya_uc_s, 14; Cladosporium sphaerospermum_1, 15; Podospora setosa, 16; Geomyces pannorum_1, 17; Taifanglania inflata, 18; Onygenales_uc_s, 19; Mortierellaelongata_1, 20; Monographella cucumerina_1, 21; Cryptococcus terricola.
H. haematococca의 감소는 토양에 첨가된 인삼세근 사포닌 의 항균작용에 의한 영향으로 보이며 (Park and Ohh, 1981), Rhizoctonia에 의한 잘록병 억제에 효과가 있다고 알려진 G. pannorum (Nelson et al., 1983)의 감소는 인삼의 연작장해 발생 증가에 영향을 미친 것으로 생각된다. S. thermophilum 은 glucose에 의해 생육이 촉진되는데 (Zanoela et al., 2004), S. thermophilum의 증가는 세근분말에 함유되어있는 glucose에 의해 영향을 받은 것으로 보인다.
인삼의 뿌리썩음병을 유발하는 Cylindrocarpon species는 관 수 후 인삼 세근분말 토양혼화처리에 의해 0.02%에서 0.14% 로 증가하였으며, Fusarium species는 0.21%에서 0.44%로 증 가하여 인삼의 연작장해 발생에 영향을 미쳤다. C. destructans의 밀도는 인삼 재배기간에 따라 증가되어 인삼의 뿌리썩음병 발생이 증가되었다 (Lee et al., 2014). 금산 등 3 개 지역에서 Fusarium spp.의 밀도와 Fusarium spp./total fungi의 비율은 초작지보다 재작지에서 더 높다고 하였으며 (Shin et al., 1986), 인삼즙액의 농도가 증가할수록 F. solani 의 생장이 촉진되었다고 하여 (Park and Ohh, 1981) 인삼 세근 잔사물은 이들 곰팡이의 생장 촉진에 영향을 미친 것으 로 보인다.
Han 등 (1992)에 의하면 토양 중의 유기물은 분해되어 일 부가 페놀화합물로 되며, 이 화합물들은 계속해서 미생물들의 탄소원으로 이용되는데, 토양 중에 가해진 페놀의 양이 많아 질수록 세균이나 방선균은 감소하거나 활동이 억제되는 반면 Fusarium spp.는 증가한다고 하였다.
이와 같이 T. crassum은 연작지 토양에 관수처리하면 크게 감소했다가 인삼 세근분말이 첨가되면 다시 증가되었으며, H. haematococca는 연작지 토양에 관수처리하면 크게 증가되었다 가 인삼 세근분말이 첨가되면 다시 감소되는 특징을 보였다. 또한 인삼의 뿌리썩음병을 유발하는 Cylindrocarpon species와 Fusarium species는 인삼분말 첨가에 의해 증가되었다.
따라서 토양 서식 곰팡이의 다양성 측면에서 연작장해의 발 생은 T. crassum의 증가와 H. haematococca, Geomyces pannorum의 감소, 그리고 인삼 뿌리썩음병과 직접 관련이 되 는 Cylindrocarpon species와 Fusarium species의 증가 등과 관련이 있을 것으로 생각된다.
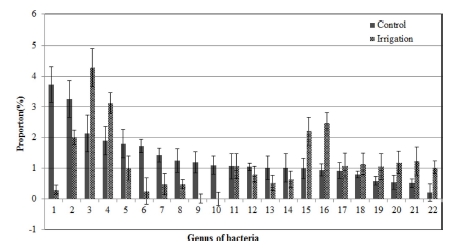
Fig. 5에서와 같이 인삼 연작지 토양에서 관수처리에 따른 세균 속 단위에서의 변화를 보면, 곰팡이처럼 뚜렷하게 우 점하는 속은 없었으나 Devosia 속은 1.9%에서 3.1%로, Arthrobacter 속은 1.0%에서 2.2%로, Bauldia 속은 0.9%에서 2.5%로 증가하였으며, Streptomyces 속은 3.2%에서 2.0%로 감소하였다.
Composition ratio of soil microbial communities in fungi genus by irrigation treatment in the soil infected with ginseng root rot pathogens.1; FR749822_g, 2; Streptomyces, 3; DQ123621_g, 4; Devosia, 5; JF421159_f_uc, 6; Nonomuraea, 7; Rhodanobacter, 8; Mycobacterium, 9; 4P002119_g, 10; Oxalicibacterium, 11; Pseudolabrys, 12; GQ396871_g, 13; EU881211_g, 14; JF266448_g, 15; Arthrobacter, 16; Bauldia, 17; Bacillus, 18; Sphingomonas, 19; Planctomycetaceae_uc, 20; Rhizomicrobium, 21; Gaiella, 22; Cytophagaceae_uc.
Fig. 6에서와 같이 관수처리에 따른 세균 종 단위에서의 변 화를 보면, Nonomuraea maritima, Streptomyces glauciniger, Oxalicibacterium solurbis 등은 뚜렷이 감소하였고 Arthrobacter oryzae, Streptomyces lavendulae 등은 뚜렷이 증가하였다.
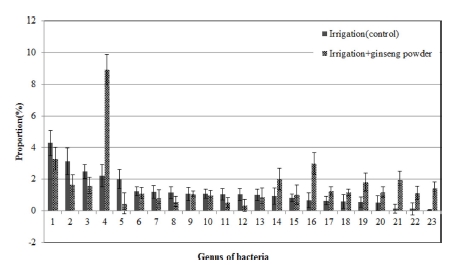
Composition ratio of soil microbial communities in fungi genus by incorporation of ginseng fine root powder into the soil infected with ginseng root rot pathogens.1; DQ123621_g, 2; Devosia, 3; Bauldia, 4; Arthrobacter, 5; Streptomyces, 6; Gaiella, 7; Rhizomicrobium, 8; Sphingomonas, 9; Pseudolabrys, 10; Bacillus, 11; Planctomycetaceae_uc, 12; Cytophagaceae_uc, 13; JF42 1159_f_uc, 14; Microbacterium, 15; GQ396871_g, 16; Rhizobium, 17; Nocardioides, 18; AB630582_g, 19; Mesorhizobium, 20; DQ404644_g, 21; Pseudomonas, 22; Sphingobium, 23; AB096215_g.
Arthrobacter oryzae는 주로 논토양에 존재하는 세균인데 (Kageyama et al., 2008) 관수처리에 의해 증가된 것으로 보 인다. Streptomyces lavendulae는 항균물질인 lavendamycin을 생산하는 곰팡이로 (Balitz et al., 1982) 인삼의 연작장해 경 감에 영향을 미친 것으로 보인다.
Fig. 7에서와 같이 인삼 세근 분말 토양혼화처리에 따른 세 균의 속 단위에서 변화양상을 보면, Devosia 속은 3.1%에서 1.6%로, Bauldia 속은 2.5%에서 1.6%로, Streptomyces 속은 2.0%에서 0.5%로 뚜렷이 감소하였고 Arthrobacter 속은 2.2% 에서 8.9%로, Rhizobium 속은 0.7%에서 3.0%로 뚜렷이 증가 하였다.
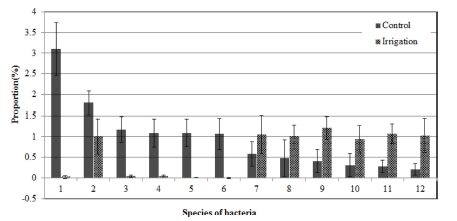
Composition ratio of soil microbial communities in fungi species by irrigation treatment in the soil infected with ginseng root rot pathogens.1; GU444078_s, 2; JF421159_f_uc_s, 3; Nonomuraea maritima, 4; Streptomyces glauciniger, 5; 4P002119_s, 6; Oxalicibacterium solurbis, 7; Planctomycetaceae_uc_s, 8; HQ119644_s, 9; EU881088_s, 10; Arthrobacter oryzae, 11; Streptomyces lavendulae group, 12; Cytophagaceae_uc_s.
Fig. 8에서와 같이 인삼 세근 분말 토양혼화처리에 따른 세 균의 종 단위에서 변화양상을 보면, Streptomyces lavendulae는 뚜렷이 감소하였고 Arthrobacter oryzae, Arthrobacterpascens, Arthrobacter humicola, Microbacterium trichothecenolyticum, Rhizobium cauense, Arthrobacter defluvii 등은 뚜렷이 증가하 였다.
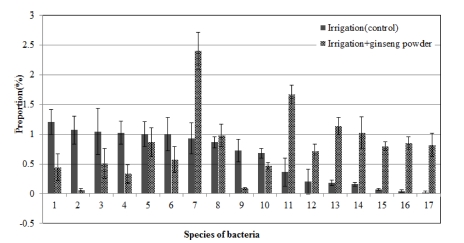
Composition ratio of soil microbial communities in fungi species by incorporation of ginseng fine root powder into the soil infected with ginseng root rot pathogens.1; EU881088_s, 2; Streptomyces lavendulae group, 3; Planctomycetaceae_uc_s, 4; Cytophagaceae_uc_s, 5; JF421159_f_uc_s, 6; HQ119644_s, 7; Arthrobacter oryzae, 8; EU801228_s, 9; AM697421_s, 10; FJ479524_s, 11; Arthrobacterpascens, 12; AB630582_g_uc, 13; Arthrobacter humicola, 14; Microbacterium trichothecenolyticum, 15; JN038769_s, 16; Rhizobium cauense, 17; Arthrobacter defluvii group.
항생물질을 생산하는 S. lavendulae (Balitz et al., 1982)의 뚜렷한 감소는 인삼의 연작장해 발생 증가에 영향을 미쳤으 며, A. humicola는 무의 발아와 생육을 억제하는 물질 (3- phenylpropionic acid)을 생산하기 때문에 (Chung et al., 2010), A. humicola의 증가도 인삼의 연작장해 발생 증가에 영향을 미친 것으로 보인다.
M. trichothecenolyticum은 인삼의 진세노사이드 Rb1을 Rd, Rh2로 전환하는 세균으로 (Kim et al., 2013) 토양에 혼화된 인삼 세근 분말에 의해 증가된 것으로 보이며, 인삼에 병을 일으키는 세균들은 진세노사이드를 전환할 수 있는 능력이 있 다고 하였다 (Nguyen et al., 2016).
Nguyen 등 (2016)에 의하면 식물병원성이 잠재된 세균 중 인삼 재배포장에서 Sphingomonas, Arthrobacter, Bacillus, Pseudomonas 속이 자주 분리되며, 이들은 인삼의 진세노사이 드를 전환하여 이용할 수 있다고 하였다. Park 과 Ohh (1981)에 의하면 인삼 사포닌과 즙액의 농도가 증가될수록 세 균성 뿌리썩음병원균인 Erwinia carotovora의 생장이 촉진되 었다고 하여 인삼 세근 잔사물은 연작장해 발생과 관련된 세 균들의 생장에 영향을 미친 것으로 보인다.
이와 같이 연작지 토양에 관수처리하면 논토양에서 주로 발 견되는 A. oryzae 및 항생물질을 생산하는 S. lavendulae 등 이 증가하여 인삼의 연작장해 경감에 영향을 미쳤으며, 인삼 세근분말을 토양에 혼화해주면 항생물질을 생산하는 S. lavendulae가 감소하고 식물생장 독소를 분비하는 A. humicola 가 증가하며 진세노사이드를 전환할 수 있는 M. trichothecenolyticum이 증가하여 인삼의 연작장해 발생 증가에 영향을 미친 것으로 보인다.
3. 관수 및 인삼 세근 분말 처리에 따른 인삼의 지상부 생 육특성
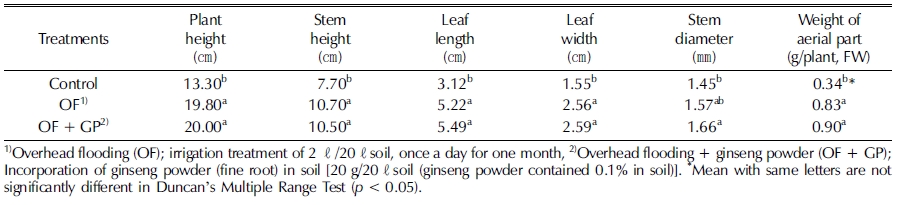
Table 2에서와 같이 인삼 연작지 토양에서 관수처리 및 관수 후 인삼 세근 분말 토양혼화 처리가 2년생 인삼의 지상부 생 육에 미치는 영향을 조사한 결과는 다음과 같다. 초장, 경장, 엽폭, 엽장, 경직경 및 지상부중은 관수처리에 의해 뚜렷한 증 가를 보였다. 관수처리 후 인삼 세근 분말 혼화처리는 경장을 제외한 초장, 엽폭, 엽장, 경직경 및 지상부중이 유의적인 변 화가 없었으나 다소 증가되었다.

Growth characteristics of 2-years-old ginseng by irrigation treatment and incorporation of ginseng fine root powder into the soil infected with ginseng root rot pathogens.
이와 같이 연작지에서 관수처리는 인삼의 지상부 생육을 촉 진하는 효과가 있었는데, 이는 염류농도 및 나트륨 농도가 크 게 감소되어 삼투압 작용 등에 영향을 미쳤기 때문으로 보인 다. Kim 등 (2015)에 의하면 인삼의 재배에 적당한 염류농도 는 0.5 - 1.0 dS/m 이며, 염류가 과다할 경우 생리장해가 발생 한다고 보고하였다. 그리고 관수 후 인삼 세근 분말 혼화처리 에 의해 인삼의 지상부 생육이 억제되지 않아 인삼 수확 후 세근 잔사물이 인삼 지상부 생육에 영향을 미치지 않을 것으 로 판단된다.
4. 관수 및 인삼 세근 분말 처리에 따른 인삼의 뿌리썩음병 발생 특성
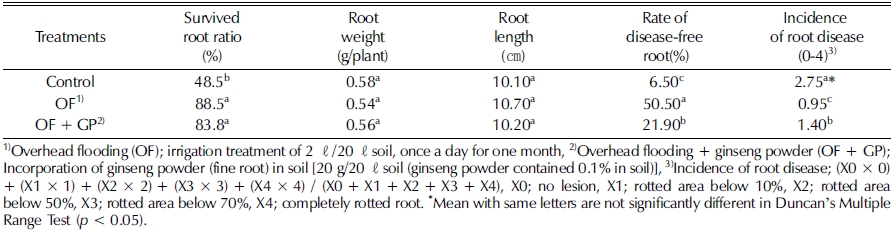
Table 3에서와 같이 인삼 연작지 토양에서 관수처리 및 관 수 후 인삼 세근 분말 토양혼화 처리가 2년생 인삼의 지하부 생육과 뿌리썩음병 발생에 미치는 영향을 조사한 결과는 다음 과 같다. 지하부 생존율은 관수처리에 의해 뚜렷이 증가되었 는데, 이는 뿌리썩음병 발생이 억제되었기 때문으로 보인다. 인삼 세근 분말 혼화처리에 의해 지하부 생존율은 약간 감소 되었는데, 이는 뿌리썩음병 발생이 증가되었기 때문으로 보인다.

Yield and root disease ratio of 2-years-old ginseng by irrigation treatment and incorporation of ginseng fine root powder into the soil infected with ginseng root rot pathogens.
인삼의 주당근중과 근장은 관수처리나 관수 후 인삼 세근 분말 혼화처리에 따라 유의적인 차이를 보이지 않아 관수처리 나 인삼 세근 분말 혼화처리는 근중 증가에 영향을 미치지 못 했는데, 4 - 6년근 인삼재배처럼 장기간 재배할 경우에는 관수 및 인삼 세근 분말 혼화처리가 인삼 근중 증가에 긍정적 또는 부정적 영향을 미칠 것으로 생각된다.
뿌리썩음병 발생정도 (disease severity index, DSI)는 관수 처리에 의해 유의적으로 감소하였으나 인삼 세근 분말 혼화처 리에 의해 유의적으로 증가하였다. 따라서 관수처리는 인삼 뿌 리썩음병 발생을 억제하는데 효과를 보였으며, 인삼 수확 시 토양에 남아있는 뿌리 잔사물은 인삼의 지상부 생육에는 유의 적인 영향을 미치지 않으나 뿌리썩음병 발생 증가에 영향을 미칠 것으로 생각된다.
토양 염류농도가 높아지면 작물의 뿌리가 갈변되고 스트레 스를 받아 병원균이 쉽게 침입하여 병 발생이 증가되며 (Yang et al., 2000), 토양염류농도는 인삼의 뿌리썩음병과 유의적인 부의 상관이 있었다는 보고처럼 (Lee et al., 2017), 본 시험 에서 관수처리에 의한 염류농도 저하는 뿌리썩음병 발생 억제 에 영향을 미친 것으로 생각된다.
그리고 인삼 세근 분말 혼화처리로 인삼 뿌리썩음병 발생이 증가되었던 것은 Sun 등 (2013)의 보고처럼 인삼뿌리에서 분 비되거나 뿌리 분해 시 발생하는 페놀화합물이 뿌리썩음병원 균의 병원성을 증가시켜 뿌리썩음병 발생이 증가되었기 때문 으로 생각된다.
본 실험결과를 종합해 보면 인삼 연작장해 발생은 관수처리 에 의해 감소되고 인삼 세근 분말 토양혼화처리에 의해 증가 되었는데, 관수처리에 의한 연작장해 경감은 토양염류농도의 감소, 토양전염성 병원균에 길항작용을 하는 곰팡이의 증가, 항생물질을 생산하는 세균의 증가, 그리고 식물생장을 억제하 는 독소를 분비하는 세균의 감소 때문으로 생각된다.
인삼 세근 분말의 토양혼화처리에 의한 인삼 연작장해 발생 증가는 뿌리썩음병과 직접 관련이 있는 Cylindrocarpon species와 Fusarium species의 증가, 토양전염성 병원균에 길항 작용을 하는 곰팡이의 감소, 항생물질을 생산하는 세균의 감 소, 진세노사이드를 전환하는 능력을 가진 세균들의 증가, 그 리고 식물생장을 억제하는 독소를 분비하는 세균의 증가 때문 으로 생각된다.
감사의 글
본 연구는 농림수산식품기술기획평가원에서 주관하는 인삼 관행 해가림 방식에서의 연작장해 경감기술 개발(과제번호: 315095-04-HD050)의 연구비 지원에 의해 이루어진 결과로 이 에 감사드립니다.
References
-
Balitz, DM, Bush, JA, Bradner, WT, Doyle, TW, O'herron, FA, Nettleton, DE, (1982), Isolation of lavendamycin a new antibiotic from Streptomyces lavendulae, Journal of Antibiotics, 35, p259-265, 7076573.
[https://doi.org/10.7164/antibiotics.35.259]

-
Chung, EJ, Park, JH, Park, TS, Ahn, JW, Chung, YR, (2010), Production of a phytotoxic compound, 3-phenylpropionic acid by a bacterial endophyte, Arthrobacter humicola YC6002 isolated from the root of Zoysia japonica, Plant Pathology Journal, 26, p245-252.
[https://doi.org/10.5423/PPJ.2010.26.3.245]

- Han, SG, Oh, DH, Ryu, J, Hwang, NY, Na, JS, Park, KH, Choi, BJ, (1992), Allelopatic effect of upland weeds on plant growth and properties in soils, Korean Journal of Soil Science and Fertilizer, 25, p263-269.
- Jamdar, Z, Mohammadi, AH, Mohammadi, S, (2013), Study of antagonistic effects of Trichoderma species on growth of Verticillium dahliae, the causal agent of verticillium wilt of pistachio under laboratory condition, Journal of Nuts and Related Sciences, 4, p53-56.
- Jang, JG, Lee, KS, Kwon, DW, Oh, HK, (1987), Chemical compositions of Korean ginseng with special reference to the part of ginseng plant, Korean Journal of Ginseng Science, 11, p84-89.
- Jo, JS, Kim, CS, Won, JY, (1996), Crop rotation of the Korean ginseng(Panax ginseng C. A. Meyer) and the rice in paddy field, Korean Journal of Medicinal Crop Science, 4, p19-26.
-
Kageyama, A, Morisaki, K, Omura, S, Takahashi, Y, (2008), Arthrobacter oryzae sp. nov. and Arthrobacter humicola sp. nov, International Journal of Systematic and Evolutionary Microbiology, 58, p53-56, 18175682.
[https://doi.org/10.1099/ijs.0.64875-0]

- Kang, SW, Yeon, BY, Hyeon, GS, Bae, YS, Lee, SW, Seong, NS, (2007), Changes of soil chemical properties and root injury ratio by progress years of post-harvest in continuous cropping soils of ginseng, Korean Journal of Medicinal Crop Science, 15, p157-161.
-
Kim, HS, Kim, JH, Lee, PY, Bae, KH, Cho, SY, Park, BC, Shin, HS, Park, SG, (2013), Ginsenoside Rb1 is transformed into Rd and Rh2 by Microbacterium trichothecenolyticum, Journal of Microbiology and Biotechnology, 23, p1802-1805, 24018971.
[https://doi.org/10.4014/jmb.1307.07049]

-
Kim, JU, Hyun, DY, Kim, YC, Lee, JW, Jo, IH, Kim, DH, Kim, KH, Shon, JK, (2015), Effects of salt in soil condition on chlorophyll fluorescence and physiological disorder in Panax ginseng C. A. Meyer, Korean Journal of Medicinal Crop Science, 23, p446-453.
[https://doi.org/10.7783/KJMCS.2015.23.6.446]

-
Lee, JS, Han, KS, Lee, SC, Soh, JW, Kim, DW, (2014), Environmental factors on the development of root rot on ginseng caused by Cylindrocarpon destructans, Research in Plant Disease, 20, p87-94.
[https://doi.org/10.5423/RPD.2014.20.2.087]

-
Lee, SW, Park, KH, Lee, SH, Jang, IB, Jin, ML, (2016), Crop rotation in paddy soil exhibiting crop failure following replanting: Effect on soil chemical properties, soil microbial community and growth characteristics of 2-year-old ginseng, Korean Journal of Medicinal Crop Science, 24, p294-302.
[https://doi.org/10.7783/KJMCS.2016.24.4.294]

-
Lee, SW, Park, KH, Lee, SH, Jang, IB, Jin, ML, (2017), Effect of green manure crop cultivation on soil chemical properties and root rot disease in continuous cropping field of ginseng, Korean Journal of Medicinal Crop Science, 25, p1-9.
[https://doi.org/10.7783/KJMCS.2017.25.1.1]

-
Lim, YW, Kim, BK, Kim, CM, Jung, HS, Kim, BS, Lee, JH, Chun, JS, (2010), Assessment of soil fungal communities using pyrosequencing, The Journal of Microbiology, 48, p284-289, 20571944.
[https://doi.org/10.1007/s12275-010-9369-5]

- National Institute of Agricultural Science and Technology (NIAST), (2000), Methods of soil chemical analysis, Rural Development Adminstration, Suwon, Korea, p89-93.
-
Nelson, EB, Kuter, GA, Hoitink, HAJ, (1983), Effects of fungal antagonists and compost age on suppression of Rhizoctonia damping-off in container media amended with composted hardwood bark, Phytopathology, 73, p1457-1462.
[https://doi.org/10.1094/Phyto-73-1457]

-
Nguyen, NL, Kim, YJ, Hoang, VA, Subramaniyam, S, Kang, JP, Kang, CH, Yang, DC, (2016), Bacterial diversity and community structure in Korean ginseng field soil are shifted by cultivation time, PLoS ONE, 11, pe0155055, (cited by 2018 Aug 1).
[https://doi.org/10.1371/journal.pone.0155055]

-
Nicol, RW, Yousef, L, Traquair, JA, Bernards, MA, (2003), Ginsenosides stimulate the growth of soilborne pathogens of American ginseng, Phytochemistry, 64, p257-264, 12946424.
[https://doi.org/10.1016/S0031-9422(03)00271-1]

- Park, CS, Ohh, SH, (1981), Effect of crude ginseng saponin and raw ginseng juice on the growth of ginseng root rot organism,Fusariumsolani and Erwinia cartovora, Korean Journal of Plant Protection, 20, p1-5.
-
Park, JH, Seo, YJ, Choi, SY, Zhang, YS, Ha, SK, Kim, JE, (2011), Soil physico-chemical properties and characteristics of microbial distribution in the continuous cropped field with Paeonia lactiflora, Korean Journal of Soil Science and Fertilizer, 44, p841-846.
[https://doi.org/10.7745/KJSSF.2011.44.5.841]

-
Paulitz, TC, Smith, JD, Kidwell, KK, (2003), Virulence of Rhizoctonia oryzae on wheat and barley cultivars from the pacific northwest, Plant Disease, 87, p51-55.
[https://doi.org/10.1094/PDIS.2003.87.1.51]

-
Punja, ZK, Wan, A, Goswami, RS, Verma, N, Rahman, M, Barasubiye, T, Seifert, KA, Levesque, CA, (2007), Diversity ofFusariumspecies associated with discolored ginseng roots in British Columbia, Canadian Journal Plant Pathology, 29, p340-353.
[https://doi.org/10.1080/07060660709507480]

-
Rahman, M, Punja, ZK, (2005), Factors influencing development of root rot on ginseng caused by Cylindrocarpon destructans, Phytopathology, 95, p1381-1390, 18943548.
[https://doi.org/10.1094/PHYTO-95-1381]

- Shin, HS, Lee, HH, Lee, MW, (1986), Studies on the distribution of fungal andFusariumspp. propagules in ginseng field soil, Korean Journal of Mycology, 14, p109-119.
- Suh, JS, Lee, SK, (1993), Competitive effects of allelochemics on the monoculture and cross-cropping culture system of plants, Korean Journal of Soil Science and Fertilizer, 26, p259-264.
-
Sun, JM, Fu, JF, Zhou, RJ, Yan, XR, (2013), Antibiotic effects of four exogenous phenolic acids on soilborne pathogen, Cylindrocarpon destructans, Applied Mechanics and Materials, 295-298, p2294-2299.
[https://doi.org/10.4028/www.scientific.net/AMM.295-298.2294]

-
Xu, YH, Chi, K, Zhang, AH, Lei, FJ, Yang, H, Zhao, Y, Li, K, Wang, EH, Li, Q, Kim, JS, Lee, SH, Kim, YC, (2016), Chemotactic response study of Cylindrocarpon destructans towards ginseng root exudates, Korean Journal of Medicinal Crop Science, 24, p360-369.
[https://doi.org/10.7783/KJMCS.2016.24.5.360]

- Yang, SS, Kim, CH, Nam, KW, (2000), Effect of soil salinity on the root growth andFusariumdisease of tomato and cucumber, Plant Disease Research, 6, p71-75.
-
Zanoelo, FF, Polizeli, MLTM, Terenzi, HF, Jorge, JA, (2004), β-Glucosidase activity from the thermophilic fungus Scytalidium thermophilum is stimulated by glucose and xylose, Federation of European Microbiological Societies Microbiology Letters, 240, p137-143, 15522500.
[https://doi.org/10.1016/j.femsle.2004.09.021]